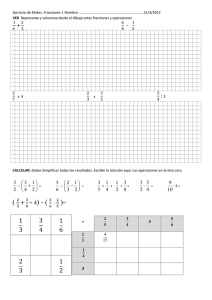
EVALUACIÓN DE LA ACTIVIDAD CITOTÓXICA DE EXTRACTOS Y
Anuncio

EVALUACIÓN DE LA ACTIVIDAD CITOTÓXICA DE EXTRACTOS Y FRACCIONES DE Isertia laevis EMPLEANDO LÍNEAS CELULARES DERIVADAS DE TUMORES HUMANOS. SANDRA LILIANA CASTRO DIAZ. TRABAJO DE GRADO Presentado como requisito parcial Para optar al título de BIÓLOGA. PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE BIOLOGÍA BOGOTÁ, D.C. 2006 NOTA DE ADVERTENCIA Artículo 23 de la resolución No 13 de Julio de 1946 “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Sólo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia”. Bogotá, 3 de octubre 2006. Señores PONTIFICIA UNIVERSIDAD JAVERIANA. Ciudad Estimados Señores: Yo (nosotros) Alba Nohemí Téllez Alfonso y Sandra Liliana Castro Diaz, identificado(s) con C.C. No. 23. 556. 606 y 52. 776. 154, autor(es) del trabajo de grado titulado Evaluación de la Actividad Citotóxica de Extractos y Fracciones de Isertia laevis Empleando Líneas Celulares Derivadas de Tumores Humanos, presentado como requisito para optar al título de Bióloga en el año de 2006; autorizo(amos) a la Universidad Javeriana a: a) Reproducir el trabajo en medio digital o electrónico con el fin de ofrecerlo para la consulta en la Biblioteca General. Si. b) Poner a disposición para la consulta con fines académicos, en la página web de la Facultad, de la Biblioteca General y en las redes de información con las cuales tenga convenio la Universidad Javeriana. Si. c) Enviar el trabajo en formato impreso o digital, en caso de que sea seleccionado para participar en concursos de trabajos de grado. Si. d) Distribuir ejemplares de la obra, para la consulta entre las entidades educativas con las que la facultad tenga convenio de intercambio de información, para que este sea consultado en las bibliotecas y centros de documentación de las respectivas entidades. No. e) Todos los usos, que tengan finalidad académica. Si. Los derechos morales sobre el trabajo son de los autores de conformidad con lo establecido en el artículo 30 de la Ley 23 de 1982 y el artículo 11 de la Decisión Andina 351 de 1993, los cuales son irrenunciables, imprescriptibles, inembargables e inalienables. Atendiendo lo anterior, siempre que se consulte la obra, mediante cita bibliográfica se debe dar crédito al trabajo y a su(s) autor(es) Este documento se firma, sin perjuicios de los acuerdos que el autor(es) pacte con la Unidad Académica referentes al uso de la obra o a los derechos de propiedad industrial que puedan surgir de la actividad académica. Alba Nohemí Téllez Alfonso. 23. 556. 606 Sandra Liliana Castro Diaz. 52.776.154 EVALUACIÓN DE LA ACTIVIDAD CITOTÓXICA DE EXTRACTOS Y FRACCIONES DE Isertia laevis EMPLEANDO LÍNEAS CELULARES DERIVADAS DE TUMORES HUMANOS. SANDRA LILIANA CASTRO DIAZ. APROBADO --------------------------------------ALBA NOHEMÍ TÉLLEZ, Ph. D. DIRECTORA --------------------------------------CLEMENCIA DE CASTRO JURADO ---------------------------------JULIO PEDROZO, Ph.D. JURADO EVALUACIÓN DE LA ACTIVIDAD CITOTÓXICA DE EXTRACTOS Y FRACCIONES DE Isertia laevis EMPLEANDO LÍNEAS CELULARES DERIVADAS DE TUMORES HUMANOS. SANDRA LILIANA CASTRO DIAZ. APROBADO --------------------------------------ÁNGELA UMAÑA, M. Phil. DECANA ACADÉMICA -------------------------------------ANDREA FORERO DIRECTORA CARRERA DE BIOLOGÍA AUTOR O AUTORES Apellidos Nombres Sandra Liliana Alba Nohemí Castro Diaz Téllez Alfonso DIRECTOR(ES) Apellidos Téllez Alfonso Nombres Alba Nohemí TRABAJO PARA OPTAR EL TÍTULO DE: Bióloga. TÍTULO COMPLETO DEL TRABAJO: Evaluación de la Actividad Citotóxica de Extractos y Fracciones de Isertia laevis Empleando Líneas Celulares Derivadas de Tumores Humanos. FACULTAD: Ciencias Básicas. PROGRAMA: Carrera: x NOMBRE DEL PROGRAMA: Biología. CIUDAD: BOGOTÁ. AÑO DE PRESENTACIÓN DEL TRABAJO: 2006. NÚMERO DE PÁGINAS: 68 TIPO DE ILUSTRACIONES: Mapas. Tablas, gráficos y diagramas. Fotografías. DESCRIPTORES O PALABRAS CLAVES: Actividad citotóxica, Isertia laevis, Extractos hojas. RESUMEN DEL CONTENIDO: Las fracciones y subfracciones de Isertia laevis del extracto Petrol y EtOH, mostraron actividad citotóxica frente a líneas celulares tumorales humanas de cáncer de seno (MCF-7 y CSC 1595) y de cólon (colo 205). Las fracciones fueron probadas a una concentración de 100 µg/ml, la fracción MeOH del extracto Petrol presentó un 7% de viabilidad sobre la línea celular 1595 y fue la fracción más activa, del extracto EtOH la fracción 3 con 27% de viabilidad para la línea MCF-7 y 23% de viabilidad en la línea 1595 fueron las fracciones que mostraron mejores resultados. Para la línea celular colo 205 las fracciones más activas fueron la 4 y 5 del extracto EtOH con un 41% de viabilidad. Las pruebas fitoquímicas cualitativas mostraron que las fracciones de petrol y las de EtOH contienen esteroles y/o triterpenos. DEDICATORIA A mis padres por la paciencia que han tenido durante estos años. A mis hermanos por su apoyo en todo momento. AGRADECIMIENTOS A la Dra. Alba Nohemí Téllez por ser una verdadera maestra y por el apoyo en la dirección del trabajo. A la Dra. Clemencia de Castro y Tulia de Murcia por proporcionarme las líneas celulares y por su preciada colaboración en todo el desarrollo del trabajo. A los profesores del Laboratorio de Fitoquímica de la Universidad Javeriana por su cooperación. Al Laboratorio de Virología e Inmunología de la Universidad Javeriana por permitir usar sus instalaciones en el desarrollo del proyecto. A Andrea y Ángela por su ayuda. TABLA DE CONTENIDO 1. INTRODUCCIÓN 2 2. MARCO TEÓRICO 4 2.1 LAS PLANTAS, FUENTE DE NUEVAS SUSTANCIAS 4 2.2 FAMILIA RUBIACEAE 6 2.3 CONCEPTOS GENERALES DEL GÉNERO ISERTIA. 7 2.3.1 ISERTIA LAEVIS 8 2.3.2 FITOQUÍMICA DEL GÉNERO ISERTIA 10 2.4 PLANTAS MEDICINALES CON TRITERPENOS, SAPONINAS TRITERPÉNICAS Y SU ACTIVIDAD CITOTÓXICA Y ANTITUMOR 13 2.4.1 ACCIÓN CITOTÓXICA DE ESPECIES DE LA FAMILIA RUBIACEAE 16 2.5 CULTIVO CELULAR 18 2.5.1 LÍNEAS CELULARES 19 2.6 ENSAYOS DE CITOTOXICIDAD IN VITRO 20 2.6.1 MÉTODO DEL MTT 22 2.7 EL CÁNCER, ENTRE LAS PRINCIPALES CAUSAS DE MORTALIDAD 23 3. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN 25 3.1 FORMULACIÓN DE PROBLEMA 25 3.2 PREGUNTA DE INVESTIGACIÓN 25 3.3 JUSTIFICACIÓN 26 4. OBJETIVOS 27 4.1 OBJETIVO GENERAL. 27 4.2 OBJETIVOS ESPECÍFICOS 27 5. MATERIALES Y MÉTODOS 28 6. RESULTADOS Y DISCUSION 34 6.1 RESULTADOS 34 6.2 DISCUSIÓN DE RESULTADOS 45 7 CONCLUSIONES 48 8 RECOMENDACIONES 50 9 BIBLIOGRAFÍA 51 10 ANEXOS 57 INDICE DE TABLAS TABLA No 1. METABOLITOS SECUNDARIOS AISLADOS DE ESPECIES DEL GÉNERO ISERTIA. 12 TABLA NO 2. PLANTAS MEDICINALES CON SAPONINAS TRITERPÉNICAS, TRITERPENOS Y SU ACTIVIDAD CITOTÓXICA Y ANTITUMOR. 15 TABLA 3. PRUEBAS FITOQUÍMICAS DE LAS FRACCIONES DEL EXTRACTO PETROL. 34 TABLA 4. PRUEBAS FITOQUÍMICAS DE LAS FRACCIONES DEL EXTRACTO ETOH. 35 TABLA 5. PORCENTAJE DE VIABILIDAD DE LAS CÉLULAS PARA LOS EXTRACTOS ETOH Y PETROL FRENTE A LAS LÍNEAS CELULARES PROBADAS. CONCENTRACIÓN 300 µg/ml. 37 TABLA 6. PORCENTAJE DE VIABILIDAD DE LAS CÉLULAS PARA LAS FRACCIONES PETROL, CH2CL2, ACOET, MEOH DEL EXTRACTO PETROL. CONCENTRACIONES APLICADAS A 100 µg/ml. 37 TABLA 7. PORCENTAJE DE VIABILIDAD DE LAS CÉLULAS PARA LAS FRACCIONES 1 – 10 DEL EXTRACTO ETOH. CONCENTRACIONES APLICADAS A 100 µg/ml. 39 TABLA 8. PRUEBAS FITOQUÍMICAS DE LAS SUBFRACCIONES DE LA FRACCIÓN MEOH DEL EXTRACTO PETROL. 41 TABLA 9. PORCENTAJE DE VIABILIDAD DE LAS CÉLULAS PARA LAS SUBFRACCIONES DE LA FRACCIÓN MEOH DEL EXTRACTO PETROL. CONCENTRACIONES 50 µg/ml, ALCALOIDE 25 µg/ml. 42 TABLA 10. PORCENTAJE DE VIABILIDAD DE LAS CÉLULAS PARA LAS MEZCLAS DE LAS SUBFRACCIONES DE LA FRACCIÓN MEOH DEL EXTRACTO PETROL CONCENTRACION 50 µg/ml. 43 TABLA 11. PRUEBAS FITOQUÍMICAS DE LA FRACCIÓN 3 DEL EXTRACTO ETOH. 43 TABLA 12. PORCENTAJE DE VIABILIDAD DE LAS CÉLULAS PARA LAS SUBFRACCIONES DE LA FRACCIÓN 3 DEL EXTRACTO ETOH. CONCENTRACIONES APLICADAS A 50 µ g/ml. 44 TABLA 13. EFECTO CITOTÓXICO DE EXTRACTO Y FRACCIONES DE PETROL SOBRE LA LÍNEA CELULAR CSC 1595. 57 TABLA 14. EFECTO CITOTÓXICO DE EXTRACTO Y FRACCIONES 1-3 DE ETOH SOBRE LA LÍNEA CELULAR CSC 1595. 57 TABLA 15. EFECTO CITOTÓXICO DE FRACCIONES 4-6 DE ETOH SOBRE LA LÍNEA CELULAR CSC 1595. 58 TABLA 16. EFECTO CITOTÓXICO DE FRACCIONES 7-10 DE ETOH SOBRE LA LÍNEA CELULAR CSC 1595. 58 TABLA 17. EFECTO CITOTÓXICO DE EXTRACTO Y FRACCIONES DE PETROL SOBRE LA LÍNEA CELULAR COLO 205. 58 TABLA 18. EFECTO CITOTÓXICO DE EXTRACTO Y FRACCIONES 1-3 DE ETOH SOBRE LA LÍNEA CELULAR COLO 205. 59 TABLA 19. EFECTO CITOTÓXICO DE FRACCIONES 4-6 DE ETOH SOBRE LA LÍNEA CELULAR COLO 205. 59 TABLA 20. EFECTO CITOTÓXICO DE FRACCIONES 7-10 DE ETOH SOBRE LA LÍNEA CELULAR COLO 205. 59 TABLA 21. EFECTO CITOTÓXICO DE EXTRACTO Y FRACCIONES PETROL SOBRE LA LÍNEA CELULAR MCF-7. 60 TABLA 22. EFECTO CITOTÓXICO DE EXTRACTO Y FRACCIONES 1-3 DE ETOH SOBRE LA LÍNEA CELULAR MCF-7. 60 TABLA 23. EFECTO CITOTÓXICO DE FRACCIONES 4-6 DE ETOH SOBRE LA LÍNEA CELULAR MCF-7. 60 TABLA 24. EFECTO CITOTÓXICO DE FRACCIONES 7-10 DE ETOH SOBRE LA LÍNEA CELULAR MCF-7. 61 TABLA 25. EFECTO CITOTÓXICO DEL ALCALOIDE SOBRE LA LÍNEA CELULAR CSC 1595. 61 TABLA 26. EFECTO CITOTÓXICO DE FRACCIÓN MEOH DEL EXTRACTO PETROL SOBRE LA LÍNEA CELULAR CSC 1595. 61 TABLA 27. EFECTO CITOTÓXICO DE LAS SUBFRACCIONES MEOH DEL EXTRACTO PETROL SOBRE 1595. 62 TABLA 28. EFECTO CITOTÓXICO DE LAS SUBFRACCIONES DE LA FRACCIÓN 3 DEL EXTRACTO ETOH SOBRE LA LÍNEA CELULAR CSC 1595. 62 TABLA 29. EFECTO CITOTÓXICO DE LAS SUBFRACCIONES DE LA FRACCIÓN 3 DEL EXTRACTO ETOH SOBRE LA LÍNEA CELULAR CSC 1595. 62 TABLA 30. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DEL EXTRACTO Y FRACCIONES PETROL SOBRE LA LÍNEA CELULAR CSC 1595. (300 µg/ml), (100 µg/ml). 63 TABLA 31. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DEL EXTRACTO Y FRACCIONES 1-3 ETOH SOBRE LA LÍNEA CELULAR CSC 1595. (300 µg/ml), (100 µg/ml). 63 TABLA 32. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DE FRACCIONES ETOH SOBRE LA LÍNEA CSC 1595. (100 µg/ml). 63 TABLA 33. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DE FRACCIONES ETOH SOBRE LA LÍNEA CSC 1595. (100 µg/ml). 64 TABLA 34. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DEL EXTRACTO Y FRACCIONES PETROL SOBRE LA LÍNEA CELULAR COLO 205. (300 µg/ml), (100 µg/ml). 64 TABLA 35. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DEL EXTRACTO Y FRACCIONES 1-3 ETOH SOBRE LA LÍNEA CELULAR COLO 205. (300 µg/ml), (100 µg/ml). 64 TABLA 36. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DE FRACCIONES ETOH 4-6 SOBRE LA LÍNEA COLO 205. (100 µg/ml). 65 TABLA 37. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DE FRACCIONES ETOH 7-10 SOBRE LA LÍNEA COLO 205. (100 µg/ml). 65 TABLA 38. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DEL EXTRACTO Y FRACCIONES PETROL SOBRE LA LÍNEA CELULAR MCF7. (300 µg/ml), (100 µg/ml). 65 TABLA 39. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DEL EXTRACTO Y FRACCIONES 1-3 ETOH SOBRE LA LÍNEA CELULAR MCF-7. (300 µg/ml), (100 µg/ml). 66 TABLA 40. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DE FRACCIONES ETOH 4-6 SOBRE LA LÍNEA MCF-7. (100 µg/ml). 66 TABLA 41. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DE FRACCIONES ETOH SOBRE LA LÍNEA CELULAR MCF-7. (100 µg/ml). 66 TABLA 42. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DE SÓLIDO ALCALOIDE SOBRE LA LÍNEA CSC 1595. (25 µg/ml). 67 TABLA 43. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DE LA FRACCIÓN MEOH SOBRE LA LÍNEA CELULAR CSC 1595. (50 µg/ml). 67 TABLA 44. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DE SUBFRACCIONES DE LA FRACCIÓN MEOH DEL EXTRACTO PETROL SOBRE LA LÍNEA CELULAR CSC 1595. (50 µg/ml). 67 TABLA 45. ANÁLISIS ESTADÍSTICO DEL EFECTO CITOTÓXICO DE SUBFRACCIONES DE LA FRACCIÓN 3 DEL EXTRACTO ETOH SOBRE LA LÍNEA CELULAR CSC 1595. (50 µg/ml). 68 ÍNDICE DE FIGURAS FIGURA 1. DISTRIBUCIÓN DE I .laevis. 9 FIGURA 2. INFLORESCENCIA DE I. laevis. 10 FIGURA 3. METABOLIZACIÓN DE MTT A SALES DE FORMAZÁN POR CÉLULAS VIABLES 23 FIGURA 4. MARCHA FITOQUÍMICA I. laevis. 30 FIGURA 5. SIEMBRA DE CÉLULAS Y EXTRACTOS EN PLACAS DE 96 POZOS. 33 FIGURA 6. CROMATOGRAFÍA EXTRACTO PETROL Y FRACCIONES. 35 FIGURA 7. CROMATOGRAFÍA EN CAPA FINA DEL EXTRACTO ETOH TOTAL Y FRACCIONES 1-8. 36 FIGURA 8. CROMATOGRAFÍA FRACCIONES 8-10 EXTRACTO ETOH 36 FIGURA 9 EFECTO CITOTÓXICO DE EXTRACTO Y FRACCIONES DE PETROL EN LÍNEA CELULAR MCF-7 38 FIGURA 10. EFECTO CITOTÓXICO DEL EXTRACTO Y FRACCIONES PETROL EN LÍNEA CELULAR 1595. 38 FIGURA 11. EFECTO CITOTÓXICO DE EXTRACTO Y FRACCIONES DE PETROL SOBRE LÍNEA CELULAR COLO 205. 38 FIGURA 12. EFECTO CITOTÓXICO DE EXTRACTO Y FRACCIONES DE ETOH EN LÍNEA CELULAR MCF7. 39 FIGURA 13. EFECTO CITOTOXICO DE EXTRACTO Y FRACCIONES DE ETOH EN LÍNEA CELULAR 1595. 40 FIGURA 14. EFECTO CITOTÓXICO DE EXTRACTO Y FRACCIONES DE ETOH EN LÍNEA CELULAR COLO 205. 40 FIGURA 15. CROMATOGRAFÍA SUBFRACCIONES MEOH DEL EXTRACTO PETROL 41 FIGURA 16. EFECTO CITOTÓXICO DEL ALCALOIDE Y SUBFRACCIONES DEL EXTRACTO PETROL SOBRE LÍNEA CELULAR 1595. FIGURA 17. CROMATOGRAFÍA SUBFRACCIONES 42 DEL EXTRACTO ETOH 43 FIGURA 18. EFECTO CITOTÓXICO DE SUBFRACCIONES DE ETOH EN LÍNEA CELULAR 1595 44 ÍNDICE DE ANEXOS EFECTO CITOTÓXICO DE EXTRACTOS Y FRACCIONES. (TABLAS). 57 ANÁLISIS ESTADÍSTICO (TABLAS). 63 INDICE DE ABREVIATURAS AcOEt: acetato de etilo. CCD: cromatografía en capa delgada. CH2Cl2: diclorometano CSC-1595: línea celular colombiana de cáncer de seno Colo 205: línea celular de cólon. DMSO: Dimetil Sulfoxido EtOH: etanol MCF-7: línea celular comercial de cáncer de seno MeOH: metanol MTT: (metil tiazol tetrazolio) ó (3-(4,5-dimetiltiazol-2-yl)-2,5 difenil tetrazolio bromuro) Pf: punto de fusión RESUMEN Colombia presenta una gran diversidad de plantas vasculares, pero un número reducido de éstas han sido estudiadas en su composición química y actividad farmacológica. Más del 50 % de las drogas de uso clínico derivan de productos naturales, por lo tanto los bosques de Colombia tienen un gran potencial medicinal. El presente trabajo evaluó la actividad citotóxica de la especie Isertia laevis de la familia Rubiaceae que es la cuarta familia de plantas vasculares con más especies. Esta planta es reportada en etnobotánica por ser anticancerígena y para curar infecciones de la piel; en Colombia presenta una buena distribución, va de los 300 a los 1700 m.s.n.m. Entre los compuestos que han sido reportados para otras especies del género se encuentran alcaloides indólicos, triterpénicas. glicósidos triterpénicos, esteres y saponinas Todos estos metabolitos han sido evaluados en otras familias botánicas y en diferentes especies de la familia rubiaceae y han presentado una buena respuesta en ensayos de citotoxicidad sobre líneas celulares derivadas de tumores. En este trabajo se evaluó la actividad citotóxica de extractos y fracciones de la especie I. laevis sobre las líneas celulares de cáncer de seno MCF-7, CSC-1595 y de cólon Colo 205 mediante el método in vitro MTT (metil tiazol tetrazolio) ó (3(4,5-dimetiltiazol-2-yl)-2,5 difenil tetrazolio bromuro), un ensayo colorimétrico rápido, cuantitativo, que se utiliza para medir la viabilidad celular Los resultados indican que la fracción MeOH del extracto Petrol presentó un efecto citotóxico moderado con 32 y 7 % de viabilidad en las líneas celulares de cáncer de seno, las fracciones 2, 3, 4, 7, 8 y 9 del extracto EtOH también presentaron porcentajes de viabilidad menores al 50% para estas dos líneas. La línea celular Colo 205 tuvo un comportamiento diferente al de las otras dos líneas, siendo las fracciones 4 y 5 las más activas con un porcentaje de viabilidad de 41% para el resto de fracciones tuvo un efecto proliferativo con porcentajes entre 79 y 162% de viabilidad. La línea celular que presentó mayor sensibilidad frente a los extractos y fracciones fue la línea 1595 seguida de la línea MCF-7. La mezcla de las subfracciones de la fracción MeOH mostró cierto grado de sinergismo al potenciar la acción citotóxica de SF-1 y SF-3. 1. INTRODUCCIÓN. El estudio de las propiedades curativas de la gran diversidad de plantas vasculares colombianas es hasta el momento incipiente, siendo el más bajo el de las especies con posible actividad antineoplásica. Las plantas superiores han sido una fuente útil de compuestos antitumorales de importancia clínica, en consecuencia, es importante rastrear los productos de origen natural mediante modelos in vivo y/o in vitro, entre los que se destacan los ensayos de citotoxicidad como uno de los indicadores de actividad antitumoral inicial. Si se tiene en cuenta que la tercera causa de muerte en Colombia es debida a las neoplasias malignas y que por ejemplo el cáncer de mama en nuestro país tiene una tasa de incidencia en las mujeres de 30 por cada 100 000, se deben enfocar los estudios en la búsqueda de nuevas sustancias con efecto citotóxico sobre diferentes líneas celulares tumorales. De acuerdo a bancos de información etnobotánica, Isertia laevis se utiliza como anticancerígena, hacen una decocción de las hojas y se dice cura el cáncer de estómago. García Barriga (1992). Isertia laevis pertenece a la familia Rubiaceae, esta familia es una de las más numerosas, se encuentra representada en todos los ecosistemas, en la región Andina se registra el mayor número de especies. El género Isertia presenta catorce especies en América, sólo siete de ellas conocidas en Colombia, es un grupo al que se le debe prestar atención ya que la actividad farmacológica de sus metabolitos secundarios no ha sido estudiada. Las especies del mismo género: Isertia pittieri, Isertia haenkeana e Isertia hypoleuca, producen alcaloides indólicos, triterpenos y saponinas triterpénicas, metabolitos secundarios que pueden contribuir al desarrollo y descubrimiento de nuevos fármacos al igual que productos de interés biológico en general. Igualmente los estudios revelan que estos metabolitos obtenidos de otras familias botánicas han mostrado tener un potencial importante de actividad citotóxica y anticancerígena. El trabajo que aquí se presenta evaluó la actividad citotóxica de extractos y fracciones de la especie Isertia laevis sobre dos líneas celulares de cáncer de seno MCF-7 y CSC-1595 y la línea celular de cólon Colo 205, mediante el método de “fraccionamiento bioguiado por bioensayo MTT” un ensayo colorimétrico, rápido, versátil y cuantitativo. Es parte del programa de investigación “La biodiversidad colombiana como fuente de nuevos fármacos en oncología” que viene desarrollando el Grupo de Investigación Fitoquímica de la Pontificia Universidad Javeriana. 2. MARCO TEÓRICO. 2.1 Las plantas, fuente de nuevas sustancias. Según Samper (2000), cuando nos referimos a la flora, se habla de la diversidad de las plantas a nivel global y se calcula que en la actualidad hay cerca de 270 000 especies de plantas vasculares. Pero esta riqueza no está distribuida uniformemente alrededor del globo y de hecho conocemos que hay ciertas regiones, entre ellas Colombia, que se caracteriza por tener una alta concentración de especies. Se estima que en Colombia existen entre 35 000 y 50 000 especies de plantas vasculares. La gran variabilidad de climas, paisajes, grandes regiones e historias evolutivas, ha permitido que podamos hablar de Colombia como un país megadiverso. Sin embargo, tenemos megadiversidad en la medida en que lo reconozcamos y lo comprobemos y para eso se requiere de estudios básicos como los inventarios biológicos. Gast, F en Mendoza et al (2004). La forma alarmante en la que progresa el exterminio de especies vegetales en ciertas áreas, incluso antes de que dichas plantas hayan sido registradas y mucho menos, estudiadas químicamente, viene también a incrementar la necesidad de realizar cada vez mayores esfuerzos, respecto a la conservación genética de las plantas medicinales utilizadas en determinadas zonas. Pese a la rápida expansión de la literatura fitoquímica, sólo un pequeño porcentaje de la totalidad de las especies se ha estudiado y queda, por tanto, un amplio campo de investigación futura. Los investigadores se enfrentan al problema de realizar una investigación sistemática entre miles de especies aún no estudiadas y de muchas de las cuales no se conoce ninguna indicación inmediata de su actividad farmacológica. Pedrozo (2004). El descubrimiento de nuevas sustancias a partir de plantas con actividad terapéutica constituye una meta de la humanidad. El reino vegetal contiene un enorme potencial de moléculas por descubrir; se estima que más del 90 % de las especies no han sido estudiadas. La naturaleza ha demostrado ser una fuente importante de compuestos anticancerígenos efectivos; por ejemplo drogas derivadas de microorganismos y de plantas. Los productos naturales representan el 50 % de las drogas de uso clínico en países desarrollados, el 25 % de los cuales derivan de plantas superiores. Téllez et al (2004), Mongelli et al (2002). En los países en desarrollo el uso de las plantas medicinales representa el 80 % del arsenal terapéutico. Sharapin (2000). Un 57% de las fórmulas médicas vendidas en Estados Unidos están basadas en productos naturales, esto es, son productos naturales en sí o son derivados sintéticos o análogos de productos naturales. De 1983 a 1995, más del 60% de las nuevas drogas aprobadas para el tratamiento del cáncer e infecciones estuvieron basadas en productos naturales. Los bosques tropicales por lo tanto representan una reserva con potencial medicinal. Setzer et al (2003). Las plantas tienen una larga historia de uso en el tratamiento del cáncer, aunque muchas de las demandas para la eficacia de tal tratamiento deben verse con algún escepticismo porque el cáncer es definido pobremente en la medicina tradicional. Los primeros agentes de uso clínico fueron los llamados alcaloides de vinca vinblastina y vincristina aislados de Catharanthus roseus la cual es usada por varias culturas para el tratamiento de diabetes. Esta droga fue descubierta durante una investigación de la planta como un recurso potencial como agente hipoglicemiante; por consiguiente, su descubrimiento puede ser atribuido indirectamente a la observación de un uso medicinal de la planta. Cragg et al (2003). Dos agentes con actividad clínica epidoside y teniposide semisintéticos del originalmente a producto natural epipodophyllotoxin, una planta usada para el son derivados que es relacionado tratamiento del cáncer. Epipodophyllotoxin es un isómero de podophyllotoxin el cual fue aislado como el agente anti-tumor activo de las raíces de varias especies del género Podophyllum. Estas plantas poseen una larga historia de uso medicinal por parte de las culturas americanas y asiáticas, incluso en el tratamiento de cáncer de piel y verrugas. Cragg et al (2003). Otros ejemplos son la homoharringtonine que ha mostrado eficacia contra las varias leucemias, aislado del árbol chino Cephalotaxus harringtonia var drupacea y el elliptinium, un derivado de ellipticine, comercializado en Francia para el tratamiento de cáncer de seno, aislado de especies de la familia de Apocynaceae, incluida Bleekeria vitensis una planta medicinal de Fiji con reputadas propiedades anticáncer; las hojas de Taxus baccata usadas en la medicina tradicional de la India (ayurveda), con un uso reportado en el tratamiento del cáncer. El flavopiridol es totalmente sintético, pero la base para su estructura es un producto natural, el rohitukine, aislado de Dysoxylum binectariferum. El combretastatins, derivado de Combrettum cajfrunn, actúa causando el cierre vascular en el tumor y produciendo la necrosis. Cragg et al (2003). 2.2 Familia Rubiaceae. A lo largo de la historia taxonómica de Rubiaceae la definición de tribus ha presentado variaciones y en la actualidad aún no se cuenta con una clasificación ampliamente aceptada. Al nivel de géneros, la mayoría son estables y sólo en pocos casos se presentan segregaciones o diferencias entre especialistas. Mendoza et al (2004). Rubiaceae es una de las familias de plantas vasculares más grandes, con 659 géneros y un número estimado de 10 700 especies alrededor del mundo, solo Asteraceae, Orchidaceae y Poaceae tienen más especies. Aproximadamente 80 % de los géneros son leñosas. Se han registrado 75 géneros y 729 especies de Rubiaceae en los Andes por encima de los 1000 m de altitud, Palicourea el género más grande con 164 especies. Andersson (1995). Es una familia cosmopolita, pero con mayor presencia en las regiones tropicales y subtropicales. En el neotrópico, Rubiaceae generalmente figura entre las primeras familias con mayor número de especies cuando se realizan inventarios locales y en Colombia no sólo es una de las más diversas sino con mayor número de individuos en las regiones Andina, Amazónica y del Chocó biogeográfico, la mayor diversidad se registra en la región Andina. Presenta una amplia cobertura de ecosistemas, que van desde las zonas costeras y de los manglares hasta las zonas de páramo Mendoza et al (2000), (2004). De los géneros de Rubiaceae presentes en Colombia, cerca del 68% tienen especies de hábito arbustivo o arbóreo. Se encuentran en bosques, rastrojos, potreros o pantanos. Para Colombia se registran 105 géneros nativos o naturalizados distribuidos en 25 tribus. Adicionalmente se documentan cuatro géneros introducidos y cultivados como ornamentales o alimenticios. Mendoza et al (2004). En Cundinamarca está representada por 46 géneros y 115 especies. García Kirkbride (1986). El mayor oficio que cumplen es alimentar la fauna silvestre Mahecha (1997); presenta especies con importancia económica ya sea en la producción de tintes, sustancias médicas, productos comestibles, maderables y ornamentales. Mendoza et al (2004). La familia tienen importancia económica principalmente por el café que es uno de sus integrantes, también son conocidas la quina, que sirvió para extracción de alcaloides y drogas para curar el paludismo y la ipecacuana que es emitizante. García Kirkbride (1986). 2.3 Conceptos generales del género Isertia. Isertia se distribuye desde Centroamérica hasta el norte de Suramérica, en el caribe solo en el extremo occidente de Cuba y Guadalupe. Es característica de bosques secundarios o sucesionales. Boom (1984). El género presenta catorce especies en América, para Colombia se conocen siete especies distribuidas en áreas bajas del Chocó biogeográfico, Caribe, Llanos orientales, Amazonas y piedemonte de los Andes en donde asciende hasta los 1.700 m de altitud. Mendoza et al (2004). Entre los nombres comunes y usos de las especies del género, en el Amazonas se conoce como “tefé-capacira” a Isertia coccinea var hypoleuca (Benth.) K. Schum, que tiene propiedades medicinales. Isertia haenkeana DC. es conocida en Bolívar como “pava”; los Karijonas la llaman “cuyarocrí”; las hojas se emplean contra el reumatismo, el paludismo y las úlceras. En Nariño se conoce a Isertia pittieri (Standl.) Standl. como “tabaquillo” y “flor de quinde”. García Barriga (1992), Mendoza et al (2004). Los indígenas miraña utilizan la corteza de Isertia sp que al secarla y pulverizarla aplican sobre la zona que presenta heridas y granos para acelerar la cicatrización. La Rotta (1988). A Isertia laevis (Triana) B.M. Boom se le llama “asaquiro” y “asaquirú” (Vaupés), “vara santa” (Tolima); las hojas se emplean como anticancerígenos y para curar infecciones de la piel. García Barriga (1992), Mendoza et al (2004). En Perú la madera de esta especie se utiliza en construcción y se conoce con el nombre de “asaquiro”, “caaynum”, “tsagnum”, y “cagnum”. Boom (1984). 2.3.1 Isertia laevis (Triana) B.M. Boom La clasificación taxonómica de Isertia laevis es: Reino: Plantae División: Magnoliophyta. Clase: Magnoliopsida. Subclase: Asteridae. Orden: Rubiales Familia: Rubiaceae. Subfamilia: Cinchonoideae Tribu: Isertieae Género: Isertia Especie: Isertia laevis En la base de datos W3 TROPICOS del Missouri Botanical Garden se encuentra que la sinonimia de esta especie es: Cassupa laevis Triana; Cassupa panamensis Standl; Creatantha peruviana Standl; Isertia alba Sprague; Isertia panamensis (Standl.) Standl.; Isertia parvifolia Standl; e Isertia weberbaueri Standl. En Colombia presenta una distribución entre los 300-1700 m de altitud. Se encuentra en los departamentos del Amazonas, Antioquia, Boyacá, Chocó, Caldas, Cauca, Caquetá, Casanare, Cundinamarca, Huila, Meta, Putumayo y Tolima. Mendoza et al (2004); en los Andes se puede encontrar en elevaciones que van desde los 100 hasta los 2000 m.s.n.m y se extiende desde el norte de Costa Rica y de oriente a occidente de la Amazonía. Boom (1984). Figura 1. Figura 1. Distribución de I. laevis. (Tomada de Boom (1984)). Son arbustos o árboles pequeños de 12 metros de alto, ramas cuadrangulares. Hojas membranáceas a subcoriáceas, elípticas, 29-43 cm de largo, 14-20 cm de ancho, ápice agudo o cuspidado de 1-2 cm de largo, base aguda a redondeada, haz glabro, envés blanco, pubescente. Pecíolo 40-120 mm de largo, 2-5 mm de ancho. 4 estípulas, interpeciolares, triangulares, 5-13 mm de largo. Inflorescencia en panícula. Cáliz en forma de copa, 5-6 mm de largo, 3-4 mm de ancho, dentro glabro o ciliado, 5-6 lóbulos. Corola blanca, tubular, 32-53 mm de largo, con pubescencia alrededor de la boca, lóbulos 5 a 6. Estambres 6 o 7, anteras oblongas, 7-9 mm de largo. Ovario 2 a 3 locular. Estilo ciliolado, 32-47 mm de largo, estigma con 2 lóbulos oblongos, 3-5 mm de largo. Fruto en baya, elipsoidal, 8-11 mm de diámetro. Semillas 0.7-1 mm de largo. Boom (1984). Figura 2. Figura 2. Inflorescencia de I. laevis. (Tomado de www.mobot.mobot.org) Las hojas se usan como anticancerígenas, hacen una decocción de dos hojas para una taza, lo cual se toma dos veces al día. Se dice que cura el cáncer de estómago; otro uso es el de los indios Cholos del Chocó que toman la decocción de las hojas para curarse las infecciones de la piel, especialmente las “úlceras malignas”; García Barriga (1992). 2.3.2 Fitoquímica del género Isertia. Algunos de las compuestos químicos que han sido reportados para otras especies de Isertia según Bohlmann et al (1969); García Barriga (1992); Bruix et al (1993) y Soto et al (2001) son alcaloides de tipo indólico y fueron encontrados por Arriaga et al (1990) y Rumbero et al (1990), triterpenos y saponinas triterpénicas por Um et al (2001). Dos especies de este género han sido estudiados previamente: Isertia hypoleuca de la cual se aislaron alcaloides del tipo quinamina, esteroles y triterpenos; en Isertia haenkeana, aislaron secoiridoides, glicósidos triterpénicos, esteres de ácido quínico. Bruix et al (1993); Rumbero- Sánchez et al (1991). Alcaloides 2,2´- Indolylquinuclidine son encontrados generalmente en tallos y hojas de especies de Cinchona y Remijia. Sin embargo recientemente, bases semejantes han sido aisladas de I. hypoleuca e I. haenkeana. Dihidroquinamina y epidihidroquinamina de I. hypoleuca; de las hojas de I. haenkeana también se ha aislado el segundo compuesto. En I. haenkeana fue encontrado un alcaloide derivado del ácido nicotínico que había sido aislado previamente de la especie Nauclea diderrichii. Bruix et al (1993). Según Bruneton (2001), la distribución de este amplísimo grupo de alcaloides indolmonoterpénicos está prácticamente limitado a tres familias: Apocynaceae, Loganiaceae y Rubiaceae. La diversidad estructural de este grupo cuenta con más de 2 000 compuestos diferentes. Menos de un 10% de los géneros que componen la familia Rubiaceae elaboran alcaloides a partir de una unidad monoterpénica, se trata de géneros pertenecientes a las tribus más primitivas de la subfamilia de las Rubioideae (Psychotrieae: Cephaelis) y de los Cinchonoideae (Naucleae: Andina, Nauclea; Cinchoneae: Remijia, Mitragyna, Uncaria, etc). La relación entre Rubiaceae, Apocynaceae y Loganiaceae, en lo concerniente a alcaloides, ha sido reconocida extensamente. Entre las especies que dieron positivo para el test de alcaloides indólicos, estuvieron I. haenkeana e I. laevis. Soto- Sobenis et al (2001). Se aisló y determinó de Isertia pittieri la estructura de dos nuevos 27-nor bidesmósidos glicosidos triterpenos junto con dos glicosidos triterpénicos conocidos, los 27-nor-triterpenos tienen un esqueleto C35 ese esqueleto deriva del esqueleto normal C30 y su distribución está restringida a unas pocas familias botánicas. Ácidos glicosidos pirocincólicos han sido aislados solo de la familia Rubiaceae, cuatro de Adena rubella y uno de I. haenkaena Um et al (2001). Además muchos glicosidos interesantes de ácido quinóvico y cincholic han sido aislados de la familia Rubiaceae. Arriaga et al (1990). Tabla 1. Tabla 1 Metabolitos secundarios aislados de especies del género Isertia. Especie Estructuras Nombres Parte planta I. hypoleuca Alcaloides * Dihydrocinchonamine Hojas * Isodihydroquinamine I. haenkeana Alcaloides * Epidihydroquinamine Hojas *Apodihydrocinchonami y ne I. haenkeana Glicósidos triterpénicos * Ácido quinóvico corteza Hojas 3β-O-6deoxy-Dglucopyranoside-28-O-βD-glucopyranoside. * Cincholic acid 3β-O-β6-deoxy-Dglucopyranoside-28-O-βD-glucopyranoside. I. haenkeana * Pyrocincholic acid 3β- Hojas O-6-deoxy-Dglucopyranoside-28-O-βD-glucopyranoside. I. pittieri Pyrocincholic acid 3β-O- Tallo Glicósidos triterpénicos β-D-quinovopyranosyl28-β-Dglucopyranosyl(1-6)-β-Dglucopyranosyl ester. I. pittieri 4,5-di-O-caffeoylquinic Esteres acid butyl ester. 1,5-di-O-caffeoylquinic acid. 3,4-di-O-caffeoylquinic acid 4,5-di-O-caffeoylquinic acid. 2.4 Plantas medicinales con triterpenos, saponinas triterpénicas y su actividad citotóxica y antitumor. Los triterpenos, 4 000 compuestos basados en más de 40 esqueletos diferentes, son compuestos en C30 procedentes de la ciclación del 3S-2,3-epóxido-2,3- dihidroescualeno más raramente del mismo escualeno. Casi siempre hidroxilados en C3. Bruneton (2001). Las saponinas son producidas principalmente por plantas pero también por animales marinos inferiores y algunas bacterias. Constan de un azúcar, usualmente contienen glucosa, galactosa, xilosa, rhamnosa o metil pentosa, glicosidicamente enlazada a una aglicona hidrofóbica (sapogenina) la cual puede ser terpenoide o esteroide. La aglicona puede contener uno o más enlaces C-C insaturados. La cadena oligosacárida está unida normalmente a la posición C3 Tallo (monodesmósido) pero muchas saponinas tienen un azúcar adicional en la posición C26 o C28 (bidesmósido). Francis et al (2002). Según Bilbao (1997), las saponinas triterpénicas se aíslan principalmente de dicotiledóneas; son un grupo de glicósidos solubles en agua, que tienen las propiedades de hemolizar la sangre y disminuir la tensión superficial del agua formando espuma abundante. Las saponinas son comunes en un gran número de plantas y productos de plantas que son importantes en la nutrición humana y animal. Muchos efectos biológicos han sido atribuidos a las saponinas. Experimentos han demostrado las propiedades fisiológicas, inmunológicas y farmacológicas de las saponinas lo que ha provocado un considerable interés clínico en estas sustancias. Francis et al (2002). Según Sparg et al (2004), muchas saponinas son usados en fitoterapia y en la industria cosmética. Ellas son los constituyentes de muchas drogas de plantas populares y farmacológicas. son consideradas responsables de numerosas propiedades Entre las propiedades biológicas y farmacológicas de las saponinas se pueden enumerar: actividad antiparasitaria, citotóxica y antitumoral, antiviral, antiinflamatorio, antifúngico. Numerosos reportes destacan las propiedades citotóxicas de muchas saponinas. Sin embargo las saponinas con gran citotoxicidad no siempre tienen propiedades antitumor. Las saponinas aisladas de diferentes plantas y animales han demostrado inhibir el crecimiento de células cáncer in vitro. La búsqueda de las sustancias naturales capaces de controlar células malignas ha conducido a la investigación considerable sobre esta característica de las saponinas. El efecto depresivo de las saponinas contra las células de cáncer puede ocurrir a través de mecanismos diversos y complejos. Más claridad en cuanto a la especificidad de las saponinas sobre diferentes tipos de cánceres podría ser conveniente preparaciones terapéuticas. Francis et al (2002). en el diseño de Tabla 2. Plantas medicinales con saponinas triterpénicas, triterpenos y su actividad citotóxica y antitumor. Nombre planta. Modelo Compuesto experimental. utilizado. Aralia dasyphylla Células KB, Saponinas Miq. triterpénicas HeLa-S3 Respuesta Referencia Actividad citotóxica Xiao et al., 1999 Actividad antitumor Lee et al., 1999 (Araliaceae) ginseng Células carcinoma Saponinas Panax C.A.Meyer de próstata LNCaP triterpénicas Inhibe el crecimiento Liu et al., 2000 (Araliaceae) y la proliferación celular. Pulsatilla Saponinas chinensis (Bunge) triterpénicas Actividad citotóxica Mimaki et al., 1999 Regel (Ranunculaceae) Trevesia palmata Líneas celulares Saponinas Inhibe la De Tommasi et al., (Roxb. Ex Lindl.) J774, HeK-293 y triterpénicas proliferación celular 2000 Vis. (Araliaceae) WEHI-164 Acanthophyllum Linfocitos Saponinas squarrosum Boiss. Actividad citotóxica Gaidi et al., 2000 Actividad antitumor Kumara & Huat., triterpénicas (Caryophyllaceae) Nigella sativa L. Saponinas (Ranunculaceae) triterpénicas Silene fortunei Células tumorales Saponinas Vis. de cólon 2001 Actividad citotóxica Gaidi et al., 2002 Actividad citotóxica Abdel-Kader et al., triterpénicas (Caryophyllaceae) Acacia (L.) tenuifolia Línea celular de Saponinas Willd. cáncer de pulmón triterpénicas (Leguminosae) Acacia M109 victoriae Células Benth (Leguminosae) 2001 humanas Saponinas de leucemia T. triterpénicas Actividad citotóxica Mujo et al., 2001 Acacia concinna Células de Saponinas Wall. fibrosarcoma (Leguminosae) humano HT-1080 Pittosporum Líneas celulares de Saponinas Actividad citotóxica Tezuka et al., 2000 Actividad citotóxica Seo et al., 2002 triterpénicas viridiflorum Sims cáncer de ovario triterpénicas (Pittosporaceae) A2780 Chysanthemum Células Raji Triterpeno Efecto inhibitorio Ukiya et al., 2002 morifolium pentacíclico sobre virus Epstein- (Composite) dioles y Barr trioles Clinopodium vulgara (Lamiaceae) Melanoma L. metastático Glucósidos, Inhibe el crecimiento Dzhambazo et al., triterpenos de células tumorales. 2002 humano,carcinoma y saponinas epidermoide triterpénicas humano 2.4.1 Acción citotóxica de especies de la familia Rubiaceae Entre las especies de rubiaceae con estudios de actividad citotóxica, se puede nombrar a Palicurea ovalis, a esta planta le evaluaron los alcaloides que presentaba en extractos y fracciones frente a células VERU-YARU, se encontró que la CL50 para el extracto EtOH fue de 112 ± 26.9 µg/ml, calicantina (alcaloide) 125.8 ± 25.6 µg/ml y uno de los alcaloides (no identificado todavía) 71 ± 37.6 µg/ml, concluyeron que la citotoxicidad del extracto fue debida en gran medida a uno de los alcaloides presentes. Arteaga et al (1997). El género Uncaria ha sido una de los más estudiados, se descubrieron dos esteres triterpenos tetracíclicos y ácidos uncarínicos de la especie U. rhynchophylla. Estos compuestos inhibieron la fosfolipasa Cγl (PLCγl) con CI50 de 35.66 y 44.55 µM respectivamente. Los compuestos también inhibieron el crecimiento de las líneas celulares de cáncer A-549, HCT-15, MCF-7 y HT-1197. Otros seis compuestos encontrados en esta especie fueron reportados porque también inhibieron tanto la PLCγl y el crecimiento de células de cáncer, con una CI50 de 9.5-4.6 µM y 0.5 – 6.5 µg/ml respectivamente. Estos compuestos incluían nuevos ácidos uncarínicos y otros tres esteres triterpenos pentacíclicos. Heitzman et al (2005). Los extractos acuosos de U. tomentosa inhibieron la proliferación de células HL60 y Raji y afectó solo de forma moderada a las células K562. Ácidos ursólicos aislados de esta misma especie han sido citotóxicos en las líneas celulares SK_MEL, KB, BT-549, SK-OV-3 y VERO con CI50 entre 30 y 40 µg/ml en todas las líneas celulares. Heitzman et al (2005). De Mitragyna inermes se han reportado alcaloides indólicos y saponinas triterpénicas que poseen una 27-nor-triterpenoide aglycona poco común la cual ha sido solo reportada aislada de Adina rubella e Isertia haenkeana. El extracto MeOH fue probado en las líneas celulares HL-60, Bel-7402, 293 y KB, presentó la fracción I como la única citotóxica para línea celular Bell-7402 inhibiendo >50% a una concentración de 102 µg/ml, esta fracción fue purificada y se aisló el componente citotóxico 3-O-(β-D-6-deoxy-glucopiranosil)-ácido quinóvico, inhibiendo 43,01% y 91,74% el crecimiento de las células Hela en un a una concentración de 102 y 103 µg/ml . Cheng et al (2002). Otras especies estudiadas han sido Chiococca alba, Hamelia patens, Posoqueria latifolia, Psychotria parvifolia, P. elata y Randia matudae, se utilizaron células Hep G2, RatH-4-II-E, MDA-MB-231, Hs 578T, 5637. Ch. alba actuó mejor en la línea celular Hs 578T con un porcentaje de células muertas de 100%, en las líneas celulares Hep G2 y MDA-MB-231 no presentó actividad citotóxica y en la línea celular 5637 tuvo un porcentaje de 6.44%; H. patens presentó un 10.56% de células muertas en la línea MDA-MB-231 y sin citotoxicidad en Hep G2; Posoqueria latifolia tuvo un 27.69% de células muertas en Hs 578T y un 0% en Hep G2 y MDA-MB-231 P. parvifolia tuvo un 70% de células muertas en la línea 5637, 44% en Hs 578T , 20% en MDA-MB-231 y 10% para Hep G2 P. elata presentó porcentajes entre el 88 y 98% en todas las líneas celulares. Setzer et al (2003). 2.5 Cultivo celular. El cultivo de células tiene su origen en el siglo XIX, cuando se comenzaron a estudiar con cierto detalle los tejidos y órganos en vasos de vidrio. Tras la incorporación de modificaciones que dieron lugar a medios más sofisticados, se hizo posible el cultivo de células tumorales procedentes de muestras de tejidos malignos tanto del hombre como animales. En un principio el objetivo principal era el estudio de las propias células, cómo crecen, qué necesitan para su crecimiento, cómo y cuándo dejan de crecer. Este tipo de estudios todavía tiene hoy un gran interés científico, por ejemplo, en relación con investigaciones sobre el ciclo celular y el control del crecimiento de células tumorales. Morgan & Darling (1995). El cultivo de células tiene el objetivo de mantener vivas, fuera de su organismo de origen, células animales para estudiar su comportamiento sin el control normal ejercido por el organismo vivo; para observarlas, bajo un ambiente experimental controlable. Freshney (2000). El cultivo de células, es la mejor manera de establecer nuevas líneas celulares en cultivo para estudiar la morfología celular y para comparar el efecto de diferentes agentes, o diferentes concentraciones de un agente sobre el crecimiento y metabolismo. 2.5.1 Líneas celulares. Las líneas celulares son células de origen animal o humano que se han adaptado a vivir en cultivo, poseen capacidad de proliferación ilimitada, debido a que han sufrido un proceso de transformación, que puede ocurrir espontáneamente, ser inducido por compuestos químicos, radiaciones o virus; que implica la alteración de las características de crecimiento. Freshney (2000). Las líneas celulares establecidas se pueden dividir en dos tipos principales: adherentes (células en monocapa) que se fijan al material plástico de un frasco o placa y por lo tanto tienen que desprenderse de esa superficie antes de utilizarlas y no adherentes (células en suspensión) que normalmente no se fijan a la superficie del recipiente de cultivo. Morgan & Darling (1995). Las células que crecen en cultivo, ya sean adherentes o en suspensión, suelen clasificarse en primarias, inmortales o transformadas. Las células primarias son aquellas recientemente aisladas a partir de tejidos u órganos y suelen tener una duración limitada de cultivo. Las células inmortales o transformadas presentan ambas la propiedad de crecer en forma ilimitada en cultivo (es decir, no mueren). Las células transformadas están integradas por células que derivan de tumores o que han sido manipuladas de algún modo. Morgan & Darling (1995). La demostración de que las células y los tumores sólidos humanos pueden dar origen a líneas celulares continuas, fomentó su empleo en investigación sobre cáncer e impulsó su implementación como método complementario de “screening” o tamizaje previo a los ensayos in vivo, en el Grupo de Desarrollo de Fármacos del Instituto Nacional de Cáncer de los Estados Unidos. Cordero (2002). La propagación de líneas celulares requiere que el número de células aumente continuamente, las condiciones de cultivo han sido seleccionadas para favorecer al máximo la proliferación celular. Estas condiciones son: baja densidad celular, baja concentración de Ca2+ y la presencia de factores de crecimiento. Dentro de los requerimientos generales de un cultivo de líneas celulares se cuentan: el medio de cultivo nutritivo, condiciones de pH, temperatura y ambiente controlado. El medio nutritivo básicamente debe ser un medio líquido, que contenga una fuente de carbono, aminoácidos esenciales, oligoelementos, un sistema regulador de pH, iones y factores de crecimiento aportados por el suero fetal bovino (FBS) con el que generalmente se suplementa el medio. Adicionalmente los medios de cultivo celular contienen rojo de fenol como indicador de pH, para permitir un constante monitoreo de esta variable. Freshney (2000). Después de preparar el medio básico deben ser añadidos otros suplementos, de modo que pueda utilizarse en el cultivo celular, como por ejemplo antibiótico para disminuir el riesgo de contaminación por microorganismos y suero que proporciona una serie de nutrientes importantes para las células. Alvarado et al (2002). Entre las ventajas de las línea celulares que citan Morgan & Darling (1995) se encuentran que suelen ser más sencillas de manejar que las células primarias, crecen continuamente y puede obtenerse un mayor número de células. Además son más fáciles de obtener y existe una información relativamente abundante sobre ellas. 2.6 Ensayos de citotoxicidad in vitro. La definición de citotoxicidad tiende a variar dependiendo de la naturaleza del estudio, si las células mueren o simplemente tienen su metabolismo alterado. Estos ensayos son empleados porque son baratos, fácilmente cuantificables y reproducibles. Muchos experimentos in vitro, tienen el propósito de determinar la potencial citotoxicidad de los compuestos estudiados, porque ellos van a ser usados como fármacos, cosméticos y deben demostrar que no son tóxicos o porque van a ser usados como agentes anticáncer y la citotoxicidad es crucial para su acción. Freshney (2000). La configuración de los modelos experimentales empleados in vitro para valorar la toxicidad de los compuestos químicos se fundamenta en dos pilares básicos, que son el sustrato biológico y los indicadores de toxicidad. El sustrato es el material generalmente orgánico, vivo o no, sobre el que se aplica in vitro el xenobiótico. Estas alteraciones se valoran mediante indicadores de toxicidad, que son los parámetros que se determinan para cuantificar las modificaciones producidas en la estructura o fisiología ensayo. Repetto (1995). de los componentes del sustrato de Según Cragg & Newman. (2003), en la década de los 90´s el descubrimiento de agentes antitumor de origen natural estuvo basado en tests de actividad citotóxica contra líneas celulares de cáncer usando modelos in vitro o in vivo. Muchos agentes anti-cáncer descubiertos usando tales ensayos han mostrado ejercer su acción citotóxica a través de la interacción con la tubulina o de la inhibición de la topoisomerasa. Con la identificación de un número creciente de blancos moleculares asociados con cánceres particulares, el descubrimiento de drogas anti-cáncer está basado ahora en el alto rendimiento de tamizar compuestos contra un rango de tales blancos. En Monks et al (1991) se muestra como por ejemplo el Instituto Nacional de Cáncer de los E.U. ha implementando nuevas investigaciones in vitro para el descubrimiento de nuevas drogas contra la enfermedad. Con el propósito de examinar esto se proporcionaría una evaluación inicial de más de 10 000 nuevas sustancias por año para la actividad citotóxica y/o la inhibición del crecimiento contra una gran diversidad de tipos de tumores y permitir la detección de la sensibilidad que un tumor puede tener a determinada droga. El objetivo es testar nuevas sustancias contra un amplio panel representativo de líneas celulares de tumores humanos. Según Fresney (2000), los ensayos de citotoxicidad se pueden clasificar en ensayos de viabilidad y ensayos de supervivencia, los primeros se emplean para determinar la proporción de células que inmediatamente después de un tratamiento potencialmente traumático, se mantienen intactas. Mediante estos ensayos se puede evaluar la citotoxicidad de un tratamiento en términos de concentraciones letales (LC). La concentración letal 50 (LC50) es la concentración de la sustancia de tratamiento que causa la muerte al 50% de las células presentes, evaluadas inmediatamente después del tratamiento. Cordero (2002). Para Freshney (1995), (2000), algunos ensayos de citotoxicidad como los de viabilidad que se basan en la capacidad que tienen las células para excluir sustancias a las que son impermeables, ofrecen una interpretación instantánea, Estos tests de viabilidad son para medir la tasa de supervivencia directamente, las células que al ser expuestas al colorante no se tiñen, se consideran viables y son de particular importancia para agentes tóxicos los cuales ejercen sus efectos primarios sobre la integridad de la membrana. 2.6.1 Método del MTT. Muchos ensayos biológicos requieren medir la supervivencia y/o proliferación de las células de mamífero, esto puede lograrse por varios métodos, para esto se desarrollo un ensayo colorimétrico rápido, versátil y cuantitativo, basado en una sal de tetrazolio MTT (metil tiazol tetrazolio) ó (3-(4,5-dimetiltiazol-2-yl)-2,5 difenil tetrazolio bromuro),mide sólo células vivientes y puede medirse espectofotométricamente leyendo la absorbancia entre 540–570 nm. Mosmann (1983). El MTT es una sal de tetrazolio color amarillo que se utiliza para medir la actividad y viabilidad celular por el rompimiento causado por la reducción (aceptación de un H+) del anillo de la sal de tetrazolio MTT por acción de las enzimas deshidrogenasas mitocondriales: succinato–deshidrogenasas, para formar unos cristales azules de formazan insolubles en agua, pero solubles en dimetil sulfóxido (DMSO). La viabilidad celular es proporcional a la absorbancia, que presentan los cristales de formazán en solución. Angel (1999). Figura 3. Figura 3. Metabolización de MTT a sales de formazan por células viables. Este método está basado en la capacidad de las enzimas mitocondriales de las células viables de transformar la sal de tetrazolio MTT en cristales de formazan. El método ha sido usado exitosamente para monitorear la sensibilidad de células de tumores humanos a agentes quimioterapéuticos. Ferrari et al (1990). 2.7 El Cáncer, entre las principales causas de mortalidad. Para Pardo et al (2003) el país no tiene aún conocimiento certero acerca del comportamiento de la enfermedad en nuestro medio, después de las enfermedades cardiovasculares y las muertes violentas, las neoplasias malignas son la tercera causa de mortalidad en Colombia, para el 2000, el cáncer de cuello uterino fue el más común en las mujeres (23,4%), seguido por el de mama (19,7%) y el de piel (11,8%). Según los datos de la International Agency for Research in Cancer (IARC), en el 2002, en el mundo, el cáncer de mama representó 22,8% de todos los cánceres en las mujeres, estimándose más de 1 millón de casos nuevos por año. En los países desarrollados, el cáncer de mama es muy superior en incidencia a los otros tipos de cáncer, mientras que, en los países menos desarrollados, la magnitud es variable. En Colombia, la tasa de incidencia estimada es de 30 por 100.000 mujeres, muy similar a la de cáncer de cuello uterino que es de 33 por 100.000 mujeres. Díaz et al (2005). En Colombia, la mortalidad por cáncer de mama muestra una clara tendencia al incremento en la última década. Para el año 2000, el cáncer de mama ocupó el tercer lugar como causa de muerte por cáncer entre mujeres (con 1.542 muertes registradas), después del cáncer de estómago y el de cuello uterino. Díaz et al (2005). Según Cordero (2002), dentro de la propuesta de programas de bioprospección nacional se ha planteado como uno de los objetivos, el seleccionar e implementar una serie de ensayos económicos, rápidos, reproducibles, sensibles e indicativos, para someter a los extractos naturales y sus fracciones a esta batería de pruebas, con el propósito de evaluar su potencialidad de aplicaciones en campos terapéuticos con alto impacto sobre la economía y la calidad de vida. 3. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN 3.1 Formulación del problema. En este trabajo de grado se planteó evaluar el posible efecto citotóxico frente a líneas celulares tumorales de extractos obtenidos de una especie vegetal perteneciente a la familia Rubiaceae. En la parte de los Andes tropicales por encima de los 1000 m.s.n.m, el registro de géneros de Rubiaceae que se tiene es de 75 y 729 especies, el género Isertia, tribu Isertieae, aunque presenta una buena distribución es un género poco conocido. Aunque Isertia es un género pequeño, se encontró entre sus metabolitos secundarios nuevas saponinas triterpénicas, triterpenos y alcaloides indólicos, dichas sustancias han sido estudiadas en otras familias botánicas y se sabe que presentan actividad citotóxica y anticancerígena, haciendo que esta planta medicinal se convierta en una alternativa para estudiar preliminarmente su citotoxicidad. El cáncer es un problema relevante dentro del perfil epidemiológico de Colombia. Datos generales muestran que, después de las enfermedades cardiovasculares y las muertes violentas, las neoplasias malignas son la tercera causa de mortalidad en Colombia (Dane) y la incidencia estimada para el 2000 fue de 60.883 casos, con 33.178 muertes. Pardo et al (2003). 3.2 Pregunta de investigación ¿Tendrán algún efecto citotóxico frente a las líneas celulares de cáncer de seno CSC-1595 y MCF-7 y la línea de cólon Colo 205 los extractos y fracciones obtenidos de Isertia laevis? 3.3 Justificación. Las plantas son una fuente de drogas medicinales que podrían ser aprovechadas en un uso clínico para atacar muchas de las enfermedades que no tienen opciones de tratamiento; en los bosques colombianos un gran número de especies vegetales no han sido estudiados, esta clase de trabajos son convenientes si se tiene en cuenta la rápida destrucción que están sufriendo estas zonas de vida. Hacia finales de la década de los ochenta, resurge el interés de la industria farmacéutica mundial, por las plantas medicinales y otros recursos naturales como fuentes de principios con actividad biológica, como alternativa a las estrategias de diseño de fármacos como la química combinatoria y la simulación por computador, que resultaron de difícil aplicación y atendiendo a las recomendaciones de la Organización Mundial de la Salud de promover el uso de plantas medicinales y sus derivados en el tratamiento de patologías de alto impacto social. Asebey (1996). A las especies de Isertia se les atribuyen propiedades diferentes enfermedades como úlceras, etnobotánicas para reumatismo, paludismo y cáncer de estómago. La valoración preliminar de la potencial actividad citotóxica de los extractos y fracciones de Isertia laevis servirá para avanzar en la búsqueda de principios que tengan actividad farmacológica y para la generación de beneficios sociales y económicos para la comunidad a través del acercamiento a nuevas alternativas terapéuticas del cáncer que pueden ser aplicadas en el país. 4. OBJETIVOS 4.1 Objetivo general. Determinar la viabilidad de líneas celulares tumorales de cáncer de seno MCF-7, CSC-1595 y cólon Colo 205, tratados con extractos y fracciones obtenidos de Isertia laevis. 4.2 Objetivos específicos. Identificar los extractos y fracciones de hojas de Isertia laevis citotóxicamente activas. Realizar la identificación y caracterización química cualitativa de la fracción o principio activo citotóxico obtenido de Isertia laevis. Demostrar la acción sinérgica o antagónica de los posibles componentes del extracto y/o fracción citotóxica más activa de la especie Isertia laevis, frente a la línea celular más sensible. 5. MATERIALES Y MÉTODOS. Material vegetal: Se colectó el material vegetal en el municipio de Medina departamento de Cundinamarca, a una altura de 550 m.s.n.m. La clasificación taxonómica de la planta fue realizada por M. Gutiérrez del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia como Isertia laevis (Triana) B. M. Boom, de la familia Rubiaceae. Un ejemplar se encuentra depositado en el Herbario Nacional Colombiano con el No. COL: 506495. La planta se limpió, se separó en sus partes, (hojas, tallo, flores y frutos), el material vegetal se secó a la sombra en un lugar con buena corriente de aire. Después se pulverizó en un molino de cuchillas para que las partículas pequeñas tuvieran una mayor superficie de contacto con el solvente, se pesó (2.6 Kg) y se guardó en un recipiente limpio y seco para utilizarlo posteriormente. Obtención de extractos: En el Laboratorio de Fitoquímica de la Universidad Javeriana se obtuvieron los extractos y fracciones de las hojas de Isertia laevis. El material vegetal seco y molido se extrajo en Soxhlet con Petrol, durante 72 horas con el fin de desengrasar el material, el extracto en Petrol se concentró en un rotaevaporador a presión reducida, posteriormente se floculó con MeOH-agua por 24 horas, se filtró y se llevó a sequedad. El marco desengrasado se extrajo por maceración en frío con EtOH, el extracto se concentró a presión reducida en rotavapor. Obtención de fracciones: A (5g) del extracto en petrol floculado, se le hizo una cromatografía en columna tipo flash con sílica gel G-60, eluída con Petrol, CH2Cl2, AcOEt, MeOH. A cada fracción se le realizó cromatografías en placas de sílica gel corridas en Petrol: AcOEt (7:3), reveladas con ácido perclórico. (2g) del extracto etanólico, se percoló en una columna cromatografía tipo flash con RP-18 y eluída con mezclas de MeOH:H2O (10:2), MeOH, MeOH:CH2Cl2 (8:2) y CH2Cl2, se obtuvieron 10 fracciones de 50 mL cada una. Las primeras fracciones se monitorearon en CCD de RP-18 corridas en MeOH:H2O (10:2), para el resto de fracciones CCD sílica gel corridas en Petrol:AcOEt (7:3), reveladas con ácido perclórico. La fracción MeOH del extracto petrol se pasó por cromatografía en columna de Sephadex, se obtuvieron 3 subfracciones se realizó cromatografía en placas de RP-18 corridas en MeOH:H2O (10:2), y revelada con ácido perclórico; a la fracción 3 del extracto EtOH se le hizo cromatografía en columna de Sephadex, se obtuvieron 2 fracciones, se realizó cromatografía en placas de RP-18 corridas en MeOH:H2O (10:2), y revelada con ácido perclórico. Figura 4. A los extractos totales de EtOH y Petrol, a las fracciones y subfracciones se les realizaron pruebas fitoquímicas cualitativas de terpenos: liebermann burchard, salkwoski; glicósidos: molish, antrona; saponinas: prueba de espuma; Flavonoides y fenoles: shinoda, cloruro férrico; alcaloides: dragendorff. Material vegetal Hojas (1.5 Kg) Extracción en Soxhlet con petrol Marco I Extracto Petrol (41.34g) Maceración en frío con EtOH Flocular Extracto EtOH (2g) Extracto (5g) Cromatografía columna flash sílica gel Cromatografía en columna tipo flash RP-18 F1............. F3…. ... F10 petrol CH2Cl2 AcOEt MeOH (580mg)(2980mg)(1112mg) (3708mg) Cromatografía columna Sephadex sephadex Sf3.1 (352mg) Sf3.2 (130mg) Sf1 (223mg) Sf2 (438mg) Sf3 (162mg) Figura 4. Marcha fitoquímica I. laevis. Para aislar alcaloides se utilizaron 20g de material vegetal y fueron extraídos en maceración en frío con MeOH, se concentró en el rotavapor. El extracto MeOH se acidificó con HCl al 10%, después de filtrado se neutralizó con NH4OH a pH 9. Se extrajo con AcOEt en embudo de separación, la fase orgánica se concentró en el rotavapor. En el balón se formó un precipitado que se sacó con EtOH, este precipitado formó un sólido con Pf: 221º C. Fraccionamiento guiado por bioensayo: La evaluación de la actividad biológica se realizó siguiendo el método: "fraccionamiento guiado por bioensayo”. El cual consiste en la aplicación de técnicas de separación y aislamiento sobre un determinado extracto, con el objeto de hacer un seguimiento de la actividad biológica de las fracciones y compuestos puros obtenidos, para finalizar con la identificación de los principios activos responsables de la actividad citotóxica demostrada por el extracto original, determinar el posible efecto sinérgico o antagónico entre las sustancias que están presentes en la fracción que contiene el posible principio activo. Bioensayos: Los ensayos citotóxicos se realizaron en el laboratorio de Virología de la Universidad Javeriana. La viabilidad celular fue determinada por la técnica del MTT, ensayo que se encuentra ampliamente referenciado en la literatura Studzinski (1999). Se tomó como control negativo del solvente empleado el DMSO 0.2%. Solubilización y preparación de muestras: Los extractos se solubilizan en Dimetil Sulfoxido (Merck) al 0.2% concentración inocua para las células, se realizaron los ensayos de los extractos a la concentración de 300 µg/ml, las fracciones a 100 µg/ml y subfracciones a 50 µg/ml. Líneas celulares: Se utilizaron las líneas celulares neoplásicas suministradas por el Instituto Nacional de Cáncer de EEUU: MCF -7 (seno) y Colo 205 (cólon) y la línea de cáncer de seno obtenida y caracterizada en el Instituto Nacional de Cáncer de Colombia CSS-1595 con las siguientes características: MCF-7. Tumor de una paciente de 69 años con adenocarcinoma de glándula mamaria, hipotetraploide, células epiteliales. CSC 1595. Línea celular colombiana obtenida en el laboratorio de biología experimental del INC del tumor de una paciente de 77 años con cáncer de seno ductal infiltrante avanzado, características: aneuploide, 70 cromosomas, hormonodependiente, sensible a antraciclinas y 5-fluoracilo. Téllez et al (2006). Colo 205. Tumor de un paciente de 70 años, caucásico, con carcinoma de cólon (adenocarcinoma), hipertriploide. Cultivo celular: Se utilizaron cajas de 96 pozos para el cultivo de las células con medio de cultivo L-15 suplementado con 10% de suero fetal bovino y 100 µl/10ml, penicilina estreptomicina y neomicina (5000U, 5mg estreptomicina y 10 mg neomicina/ml). Las líneas celulares fueron resuspendidas en medio de cultivo L-15 (±40 000 células por pozo) en 100 µl por pozo. Las cajas se incubaron a 37º C y 5% de CO2 por 24 horas, tiempo para la formación de la monocapa de células. Después de la formación de la monocapa, se colocaron 20 µl de cada una de las soluciones de extractos y fracciones a las concentraciones definidas (300 µg/ml de extractos y 100 µg/ml de fracciones), en los pozos de la caja, cada concentración de los extractos y fracciones tenían seis réplicas, se incubaron por 24 horas, tiempo para que las células puedan incorporar las sustancias. Pasado este periodo las soluciones de extractos y sus respectivas fracciones son retiradas y a cada pozo se le adicionaron 100 µl de medio L-15, por 24 horas para establecer si las células se recuperan. Posteriormente el medio es retirado y a cada pozo se le agregaron 100 µl de medio Dulbecco modificado y 50 µl de MTT, las cajas se incubaron por 4 horas a 37º C. Pasadas las 4 horas se retiraron los 150 µl de medio Dulbecco y MTT y se adicionaron en los pozos 100 µl de isopropanol para disolver los cristales de formazan producidos, a continuación se leyó la absorbancia en espectrofotómetro a una longitud de onda de 540 nm. Figura 5. Cultivo de líneas celulares MCF-7, CSC-1595, colo 205 en placas de 96 pozos 100 µl x pozo con medio L-15 suero fetal bovino antibiótico Incubar por 24h, a 37º C, con 5% de CO2 Adición de 20 µl de tratamiento por pozo Incubar por 24h, a 37º C, con 5% de CO2 300 µg/ml extractos 100 µg/ml fracciones 50 µg/ml subfracciones Retiro de tratamientos Adición de 100 µl de L15 x pozo Incubar por 24h, a 37º C, con 5% de CO2 Retiro de medio L-15 Adicionar 100 µl de medio Dulbecco modificado y 50 µl de MTT Incubar 4h Retirar medio Dulbecco modificado y MTT Adicionar 100 µl de isopropanol Lectura de placas en espectofotómetro a 540nm Figura 5. Siembra de células y extractos en placas de 96 pozos. El análisis estadístico entre los valores de controles y ensayos fueron interpretados mediante la prueba t (Student), con un nivel de significancia de (p<0.05). Tablas 30-45. 6. RESULTADOS Y DISCUSIÓN 6.1 RESULTADOS. Para las fracciones Petrol, CH2Cl2, AcOEt, MeOH del extracto en Petrol, las pruebas fitoquímicas determinaron la presencia de esteroides y/o triterpenos en las fracciones CH2Cl2, AcOEt, MeOH, tabla 3. Tabla 3. Pruebas fitoquímicas de las fracciones del extracto Petrol. Fracción Cloruro Shinoda Férrico 1 Petrol Liebermann Salkwoski Antrona Molisch Burchard - - - - - - 2 CH2Cl2 - - + + - + 3 AcOEt - - + + - + 4 MeOH - - + + + - Estas fracciones se monitorearon mediante una CCD en sílica gel G-60 corrida en Petrol: AcOEt (7:3) y revelada en ácido perclórico como se observa en la figura 6. Los Rf para el extracto Petrol fueron 0.25; 0.38; 0.52, los Rf para la fracción Petrol fueron: 0.48; 0.55; 0.63 y 0.76. Rf fracción CH2Cl2: 0.14; 0.36; 0.51 y 0.66 Rf fracción AcOEt: 0.14; 0.39. Rf fracción MeOH: 0.69 y 0.80. Figura 6. Cromatografía Extracto Petrol y fracciones 1-4. Las fracciones obtenidas del extracto EtOH mostraron en las pruebas fitoquímicas cualitativas la presencia de flavonoides, esteroides y/o triterpenos y saponinas ver tabla 4. Tabla 4. Pruebas fitoquímicas de las fracciones del extracto EtOH. Fracción Cloruro Shinoda Liebermann Salkwoski Férrico Antrona Molisch Burchard 1 + + + + + + 2 + - + + + + 3 - - + + + + 4 - - + - - - 5 - - + - - - 6 - - + - - - 7 - - + - - - 8 - - + - - - 9 - - + - - - 10 - - + - - - En la figura 7 se muestra la CCD de RP-18 del extracto EtOH total y fracciones 1 a 8, corrida en MeOH:H2O (10:2), revelada con ácido perclórico. Rf extracto EtOH total: 0.21 y 0.95. Rf fracción 1: 0.92. Rf fracción 2: 0.62; 0.675; 0.76; 0.9; 0.9625. Rf fracción 3: 0.37; 0.4. Rf para la fracción 4 fueron: 0.21. Rf fracción 5: 0.08 y 0.21. Rf fracción 6: 0.075. Figura 7. Cromatografía en capa fina del extracto EtOH total y fracciones 1-8. En la figura 8 se muestra la cromatografía de las fracciones 8-10 del extracto EtOH en placa de sílica gel, corrida con Petrol: AcOEt (7:3) y revelada con ácido perclórico. Rf subfracción 9: 0.23. Rf subfracción 10: 0.23; 0.36; 0.5. Figura 8. Cromatografía fracciones 8-10 extracto EtOH. Los resultados obtenidos en la evaluación citotóxica siguiendo el método: "fraccionamiento guiado por bioensayo (MTT)”, extractos y se consideraron activos los las fracciones que presentaron porcentajes de viabilidad igual ó inferiores a un 50 %. Los extractos totales petrol y etanólico frente a las líneas celulares CSC 1595, MCF-7 y Colo 205, demostraron la mayor actividad los dos extractos frente a línea celular colombiana CSC-1595 con porcentajes de viabilidad del 50% (50% de citotoxicidad) a la concentración de 300 µg/mL como se muestra en la tabla 5. Tabla 5. Porcentaje de viabilidad de las células para los extractos EtOH y Petrol frente a las líneas celulares probadas. Concentración 300 µg/ml. % Viabilidad Extracto Petrol total Extracto EtOH total MCF-7 82 76 Colo 205 104 101 CSC 1595 50 50 Las fracciones Petrol, CH2Cl2, AcOEt y MeOH se obtuvieron a partir del extracto total en petrol y se probaron a la concentración de 100 µg/mL, La fracción MeOH presentó la mayor actividad como se muestra en la Tabla 6 y figuras 9, 10 y 11; con porcentajes de viabilidad 32% y 7% para las líneas celulares de cáncer de seno MCF-7 y CSC 1595 respectivamente y no activo para la línea Colo 205 de colón. Tabla 6. Porcentaje de viabilidad de las células para las fracciones Petrol, CH2Cl2, AcOEt, MeOH del extracto petrol. Concentraciones aplicadas a 100 µg/ml. F. Petrol F. CH2Cl2 F. AcOEt F. MeOH MCF-7 66 81 97 32 CSC 1595 64 43 38 7 Colo 205 77 82 97 69 % VIABILIDAD EFECTO CITOTOXICO DEL EXTRACTO PETROL EN LA LÍNEA CELULAR MCF-7 100 80 60 40 20 0 Petrol 300ug/mL F. Petrol 100ug/ml F. CH2Cl2 F. AcOEt F. MeOH EXTRACTO Y FRACCIONES Figura 9. Efecto citotóxico de extracto y fracciones Petrol en línea celular MCF-7 % VIABILIDAD EFECTO CITOTOXICO DEL EXTRACTO PETROL EN LÍNEA CELULAR 1595 80 60 40 20 0 P et r ol F. P et r ol 300ug/ mL 100ug/ ml F. CH2Cl 2 F. A c OE t F. M eOH EXTRACTO Y FRACCIONES Figura 10. Efecto citotóxico del extracto y fracciones petrol en línea celular 1595. % VIABILIDAD EFECTO CITOTOXICO DEL EXTRACTO PETROL EN LA LÍNEA CELULAR COLO 205 120 100 80 60 40 20 0 Petrol 300ug/mL F. Petrol 100ug/ml F. CH2Cl2 F. AcOEt F. MeOH EXTRACTO Y FRACCIONES Figura 11. Efecto citotóxico de extracto y fracciones de Petrol sobre línea celular Colo 205. Las fracciones F.1 ....F.10 obtenidas a partir del extracto total etanólico se probaron a la concentración de 100 µg/mL, La fracción F.9 presentó la mayor actividad frente a la línea celular MCF-7 con un porcentaje de viabilidad del 20% ; La fracción F.3 presentó actividad con porcentajes de viabilidad 27% y 23% para las líneas celulares de cáncer de seno MCF-7 y CSC 1595 respectivamente y no activa para la línea de colón Colo 205 con un 162% de viabilidad , sin embargo sí mostraron actividad para esta línea las fracciones F. 4 y F. 5 con un 41% de viabilidad, como se muestra en la Tabla 7 y figuras 12,13 y 14. Tabla 7. Porcentaje de viabilidad de las células para las fracciones 1 – 10 del extracto EtOH. Concentraciones aplicadas a 100 µg/ml. F.1 F.2 F.3 MCF-7 93 43 27 CSC 1595 130 39 Colo 205 108 103 F.4 F.5 F.6 F.7 F.8 F.9 F.10 44 72 44 29 50 20 55 23 48 58 57 35 38 42 104 162 41 41 115 127 157 152 148 % VIABILIDAD EFECTO CITOTOXICO DEL EXTRACTO EtOH EN LA LÍNEA CELULAR MCF-7 100 80 60 40 20 0 ETOH F.2 total F.4 F.6 F.8 F-10 EXTRACTO Y FRACCIONES Figura 12. Efecto citotóxico de extracto y fracciones obtenidas del extracto en EtOH frente a la línea celular MCF7, a una concentración de 100 µg/ml. % VIABILIDAD EFECTO CITOTOXICO DEL EXTRACTO EtOH EN LA LÍNEA CELULAR 1595 140 120 100 80 60 40 20 0 ETOH F.2 total F.4 F.6 F.8 F-10 EXTRACTO Y FRACCIONES Figura 13. Efecto citotóxico de extracto y fracciones de EtOH en línea celular CSC1595. % VIABILIDAD EFECTO CITOTOXICO DEL EXTRACTO EtOH EN LA LÍNEA CELULAR COLO 205 200 150 100 50 0 ETOH total F.2 F.4 F.6 F.8 F-10 EXTRACTO Y FRACCIONES Figura 14. Efecto citotóxico de extracto y fracciones de EtOH en línea celular colo 205. La fracción activa en MeOH se fraccionó percolando en cromatografía en columna con Sephadex como fase estacionaria y fase móvil MeOH, se obtuvieron tres subfracciones, se realizó cromatografía en placas de RP-18 corridas en MeOH:H2O (10:2), y revelada con ácido perclórico. Los Rf para la subfracción 1 fueron: 0.4 y 0.425. Rf subfracción 2 0.25 y 0.4. Figura 15. Sf1 Sf2 Sf3 Figura 15.Cromatografía subfracciones obtenidas de la fracción MeOH del extracto en Petrol Para las subfracciones de la fracción MeOH del extracto en Petrol, las pruebas fitoquímicas determinaron la presencia de esteroides y/o triterpenos, tabla 8. Tabla 8. Pruebas fitoquímicas de las subfracciones de la fracción MeOH del extracto Petrol. Fracción Cloruro Shinoda Liebermann Salkwoski Antrona Férrico Molisch Burchard Sf1 - - + + - + Sf2 - - + + - + Sf3 - - + + - + Las subfracciones Sf1, Sf2 y Sf3 obtenidas a partir de la fracción MeOH del extracto Petrol se probaron a la concentración de 50 µg/ml. La subfracción Sf1 mostró un porcentaje de viabilidad del 100%; La subfracción Sf2 presentó un porcentaje de viabilidad de 72% y Sf3 83% de viabilidad para la línea celular de cáncer de seno CSC 1595 como se muestra en la Tabla 9 y figura 16. Tabla 9. Porcentaje de viabilidad de las células para las subfracciones de la fracción MeOH del extracto Petrol concentraciones aplicadas a 50 µg/ml, alcaloide a 25 µg/ml. % viabilidad CSC 1595 Sf1 Sf2 Sf3 Alcaloide 100 72 83 83 % VIABILIDAD EFECTO CITOTOXICO DE ALCALOIDE Y SUBFRACCIONES DE LA FRACCIÓN MeOH DEL EXTRACTO PETROL EN LA LÍNEA CELULAR 1595 100 80 60 40 20 0 Alcaloide subfr.1 subfr. 2 Subfr.3 ALCALOIDE, SUBFRACCIONES Figura 16. Efecto citotóxico del alcaloide y subfracciones de la fracción MeOH del extracto petrol sobre línea celular 1595. Para probar si las subfracciones actuaban de forma sinérgica o antagónica se hicieron mezclas de las subfracciones, se probaron a una concentración de 50 µg/ml, las subfracción 1 y 2 fueron las que presentaron un porcentaje de viabilidad más bajo 68% (32% citotoxicidad) como se muestra en la tabla 10 Tabla 10. Porcentaje de viabilidad de las células para la mezcla de las subfracciones de la fracción MeOH del extracto Petrol, concentraciones 50 µg/ml. % viabilidad Sf1+ Sf2+Sf3 Sf1+ Sf2 Sf2+Sf3 Sf1+Sf3 Concentración Concentración Concentración Concentración 16.6 µg/ml 16.6 µg/ml 25 µg/ml 25 µg/ml 71 68 92 84 CSC 1595 La fracción activa F.3 se paso por una columna con Sephadex, eluída con MeOH, obteniéndose dos subfracciones, se realizó cromatografía en placas de RP-18 corridas en MeOH:H2O (10:2), revelada con ácido perclórico. Los Rf para la fracción F.3 y sus subfracciones 1 y 2 presentaron manchas con Rf 0.30; 0.37 y 0.45, figura 17. F3 S3.1 S3.2 Figura 17. Cromatografía subfracciones de la fracción 3 del extracto EtOH Las pruebas fitoquímicas determinaron la presencia de esteroides y/o triterpenos en las subfracciones de la fracción 3 del extracto EtOH. Tabla 11. Tabla 11. Pruebas fitoquímicas de la fracción 3 del extracto EtOH. Fracción Cloruro Shinoda Férrico Liebermann Salkwoski Antrona Molisch Burchard S3.1 - - + + - + S3.2 - - + + - + Las subfracciones S3.1 y S3.2 de la fracción 3 del extracto EtOH se probaron a la concentración de 50 µg/ml. La subfracción S3.1 tuvo un porcentaje de viabilidad del 60% y la subfracción S3.2 mostró un porcentaje de viabilidad de 61% en la línea celular CSC 1595 como se muestra en la Tabla 12 y figura 18. Tabla 12. Porcentaje de viabilidad de las células para las subfracciones de la fracción 3 del extracto EtOH. Concentraciones aplicadas a 50 µg/ml subfracciones. % viabilidad CSC 1595 Sf1 Sf2 60 61 % VIABILIDAD EFECTO CITOTOXICO DE LAS SUBFRACCIONES DE LA FRACCIÓN 3 DEL EXTRACTO EtOH DEL EXTRACTO EN LA LÍNEA CELULAR 1595 61,5 61 60,5 60 subf r .1 Subf r . 2 SUBFRACCIONES Figura 18. Efecto citotóxico de subfracciones de EtOH en línea celular 1595 Los resultados de la prueba estadística t de Student (ver anexos) muestran que el efecto citotóxico de los extractos y fracciones fue producto de las concentraciones que fueron probadas y no causado por otros agentes. 6.2 DISCUSIÓN DE RESULTADOS Los extractos y fracciones obtenidos de Isertia laevis se probaron frente a un panel de células provenientes de tejido tumoral, una colombiana obtenida del Laboratorio de Biología Experimental del Instituto Nacional de Cancerología, la línea CSC-1595 y las líneas comerciales de seno MCF-7 y cólon Colo 205, con el fin de evaluar su actividad citotóxica. Los extractos se probaron a una concentración de 300 µg/ml mostrando los siguientes efectos citotóxicos, la línea tumoral CSC 1595 fue la más sensible a los extractos totales petrol y etanólico, con un efecto citotóxico del 50% (% de viabilidad 50%). En la evaluación de las fracciones petrol, CH2Cl2, AcOEt y MeOH valoradas a 100 µg/mL, se demostró que la más activa fue la fracción MeOH con porcentajes de viabilidad de 32% y 7% en las líneas tumorales de seno MCF-7 y CSC 1595 respectivamente. La línea celular obtenida de tumor de paciente colombiano CSC 1595 fue la más sensible al efecto de las fracciones CH2Cl2, AcOEt y MeOH con porcentajes de viabilidad del 43%, 38% y 7% respectivamente, este resultado es interesante si se tiene en cuenta que esta línea se considera joven, conservando un buen grado de similitud entre el tejido tumoral y la línea celular, opuesto a lo que sucede con la líneas celulares comerciales como lo menciona Téllez et al (2004). Las fracciones no fueron activas para la línea celular de colón Colo 205. Estos resultados demuestran cierta selectividad de acción frente a las líneas tumorales de diversa procedencia y origen. El comportamiento de las fracciones del extracto de EtOH también fue similar para las líneas 1595 y MCF-7. Las fracciones 2, 3, 4, 7, 8 y 9 del extracto EtOH presentaron porcentajes de viabilidad entre 23 y 50% para las líneas celulares CSC 1595 y MCF-7, la fracción 6 tuvo una viabilidad 44% solo para la línea celular MCF-7, la línea celular Colo 205 tuvo un comportamiento diferente al de las otras dos líneas, siendo las fracciones 4 y 5 las más activas con un porcentaje de viabilidad de 41% como se presenta en la tabla 7, opuesto a lo que mostró la viabilidad para el resto de fracciones y extractos de petrol y EtOH que tuvieron un efecto proliferativo con porcentajes de viabilidad entre 79 y 162% en esta línea celular. Figuras 13. Las pruebas fitoquímicas cualitativas muestran que las fracciones del extracto EtOH y del extracto petrol contienen esteroides y/o triterpenos y saponinas triterpénicas Tablas 3 y 4, concuerda con la química reportada en la literatura para las especies de Isertia, Arriaga et al (1990), Rumbero et al (1990), Bruix et al (1993); Um et al (2001). Los resultados del porcentaje de citotoxicidad para la fracción MeOH a unas concentraciones de 100 y 50 µg/ml fue de (93% y 35% de efecto citotóxico) respectivamente lo que indica que la CC50 se debe encontrar entre los 50 y 100 µg/ml; al subfraccionar la fracción MeOH que fue la que presentó el porcentaje de viabilidad inferior al 7% se quiso determinar el posible efecto sinérgico o antagónico entre las sustancias que presentaba esta fracción, se obtuvieron tres fracciones y la fracción que presentó un mayor porcentaje de citotoxicidad fue la Sf2 (28%), las subfracciones no actuaron de manera similar como la fracción MeOH, por eso se hicieron mezclas de las subfracciones para observar cual presentaba un efecto citotóxico moderado, se observó que las mezclas donde se encontraba la subfracción 2 presentaron una mejor actividad citotóxica explicando así que las subfracciones 2 y 1 se relacionan de forma sinérgica y la subfracción 3 presenta un efecto antagónico con respecto a las otras subfracciones. Según las cromatografías y las pruebas fitoquímicas cualitativas, los metabolitos secundarios esteroides y/o triterpenos posiblemente sean los que están actuando favorablemente en la actividad citotóxica de las fracciones que presentaron un porcentaje de viabilidad menor o igual al 50%. A los triterpenos y saponinas triterpénicas se les ha comprobado propiedades farmacológicas importantes, entre ellas una buena actividad citotóxica en varias líneas celulares derivadas de tumores humanos, como lo referencia Sparg et al (2004) para varias familias botánicas y Cheng et al (2002) y Setter et al (2003) para especies de la familia rubiaceae. Uno de los géneros más estudiado ha sido el género Uncaria, en la especie U. rhynchophylla se encontraron varios esteres triterpenos tetracíclicos y ácidos uncarínicos, los cuales inhibieron el crecimiento de las líneas celulares de cáncer A-549, HCT-15, MCF-7 y HT-1197. Heitzman et al (2005). En el trabajo de Cheng et al (2002) sobre Mitragyna inermes se reportó una 27nor-triterpenoide aglycona que había sido aislada solo de Isertia haenkeana y Adina rubella. El extracto MeOH fue el que mostró ser citotóxico contra un panel de líneas celulares de cáncer humanos, utilizaron como eluyentes de la columna de sílica gel CH2Cl2, AcOEt y MeOH, obteniendo tres fracciones. La fracción I presentó la inhibición del crecimiento de más del 50% en la línea celular Bel-7402, esta fracción fue sometida a purificación sobre columna de Sephadex LH-20 y se aisló el componente citotóxico (un ácido quinóvico). Tanto el género Uncaria como el género Isertia pertenecen a la subfamilia Cinchonoideae compartiendo caracteres morfológicos, pero sería preciso acudir a caracteres quimiotaxonómicos que fortalecieran aún más los aspectos filogenéticos dentro de la subfamilia. Con la prueba t se comparó el control con cada uno de los extractos y fracciones evaluadas, los valores de t calculados mostraron ser inferiores a los valores de t de la tabla. Se rechazó la Ho, es decir sí hay diferencias significativas entre los tratamientos y el control. 7. CONCLUSIONES Las líneas celulares de cáncer de seno CSC 1595 y MCF-7 fueron las líneas más sensibles al exponerlas a los diferentes extractos y fracciones de petrol y EtOH. La fracción MeOH del extracto en Petrol a la concentración de 100 µg/mL fue la que presentó mayor actividad citotóxica entre los extractos y fracciones evaluadas con un 7% de viabilidad (efecto citotóxico de 93%) frente a la línea celular de cáncer de seno CSC 1595 y con un 32% de viabilidad (68% de efecto citotóxico) en la línea celular comercial de seno MCF-7. La subfracción obtenida a partir de la fracción MeOH, (SF-1, SF-2 y SF-3) que presentó la mayor actividad citotóxica a la concentración de 50 µg/mL fue SF-2. La fracción SF-1 Presentó un 100% de viabilidad. La mezcla de las subfracciones de la fracción MeOH demostró cierto grado de sinergismo al potenciar la acción citotóxica de SF-1 y SF-3. La fracción más activa de Isertia laevis mediante las cualitativas demostró pruebas químicas la presencia glicósidos de triterpenos (Glicósidos esteroidales y/o saponinas). Posiblemente los causantes de la acción citotóxica. Las fracciones del extracto EtOH presentaron moderada actividad citotóxica para las líneas celulares CSC 1595 y MCF-7. Las fracciones y extractos que presentaron un porcentaje de viabilidad menor al 50% pueden ser evaluadas en otras líneas celulares derivadas de cáncer de seno, para estimar si existe especificidad citotóxica frente a esta clase de líneas celulares. Las fracciones y extractos que no presentaron efecto citotóxico pueden ser probadas en líneas celulares derivadas de tumores de otros órganos para evaluar que tan inocuas son. 8. RECOMENDACIONES Se recomienda que todas las fracciones y extractos se prueben en un panel amplio de líneas celulares tumorales humanas. Se sugiere hacer pruebas con otras líneas celulares de cáncer de seno. Es importante seguir evaluando la fracción MeOH del extracto Petrol que presentó una viabilidad del 7%. Es recomendable hacer ensayos sobre células normales para poder evaluar el efecto tóxico que presentan los extractos y fracciones. Se aconseja utilizar otras partes de la planta para comparar cual presenta mayor concentración de metabolitos secundarios. 9. REFERENCIAS Alvarado, A. C. & Mendoza, L. M. 2002. Posibles efectos citotóxicos de sustancias aisladas de diferentes especies vegetales colombianas. Microbióloga industrial. Pontificia Universidad Javeriana. Facultad de Ciencias. Departamento de Microbiología Industrial. Bogotá. 89 p. Andersson, L. 1995. Diversity and Origen of Andean Rubiaceae. Pags. 441-450 en: S. P. Churchill et al (eds.). Biodiversity and conservation of neotropical montane forests. New York Botanical Garden. Angel, A. C. 1999. Estudio fitoquímico preliminar, toxicidad y determinación de la actividad antitumor de extractos etanólicos de Cucumis dipsaceus. Química farmacéutica. Universidad Nacional de Colombia. Facultad de Química Farmacéutica. Bogotá. 81 p. Aquino, R., De Tomáis, N., De Simona, F & Pizza, C. 1997. Triterpenes and quinovic acid glycosides from Uncaria tomentosa. Phytochemistry 45: 10351040. Arteaga, L., Tobón, C & Mora, C. 1997. Citotoxicidad de los componentes de Palicourea ovalis. Revista colombiana de ciencias químico farmacéuticas. 26: 55-57. Arriaga, F, J., Rumbero-Sanchez, A & Vazquez, P. 1990. Two triterpene glycosides from Isertia haenkeana. Phytochemistry. 29: 209-213. Asebey. L. 1996. Biodiversidad, biotecnología y desarrollo sostenible en salud y agricultura. Conexiones emergentes. Págs. 229-242 en: Panamericana de la Salud. Publicación científica 560. Washington. Organización Bilbao, M. 1997. Análisis Fitoquímico Preliminar. Universidad del Quindío. Armenia. Bohrmann, H., Lau-Cam, C., Tashiro, J & Youngken Jr. 1969. Constituens of Isertia hypoleuca Benth. (Rubiaceae)-I. Isolation and characterization of dihydroquinamine from the leaf material. Phytochemistry. 8: 649-652. Boom, B. M. 1984. A Revision of Isertia (Isertieae: Rubiaceae). Brittonia 36: 425-454. Bruix, M., Rumbero, A & Vazquez, P. 1993. Apodihydrocinchonamine, an indole alkaloid from Isertia haenkeana. Phytochemistry. 33: 1257-1261. Bruneton, J. 2001. Farmacognosia. Fitoquímica plantas medicinales. 2ª edición. Editorial Acribia. Zaragoza, España. Cragg, G. M & D. J. Newman. 2003. Plants as a source of anti-cancer and antiHIV agents. Annals of Applied Biology 143: 127-133. Cheng, Z-H., Yu, B-Y. & Yang, X-W. 2002. 27-nor-triterpenoid glycosides from Mitragyna inermis. Phytochemistry 61: 379-382. Cordero, C. C. 2002. Implementación de un método in vitro de evaluación preliminar de actividad aticáncer de extractos vegetales empleando líneas celulares derivadas de tumores humanos. Tesis pregrado. Universidad Nacional de Colombia. Química Farmacéutica. Díaz, S., Piñeros, M & Sánchez, O. 2005. Detección temprana del cáncer de mama; aspectos críticos para un programa de tamizaje organizado en Colombia. Revista Colombiana de Cancerología 9: 93- 105. Ferrari, M., Fornasiero, M.C & Isetta, A.M. 1990. MTT colorimetric assays for testing macrophage cytotoxic activity in vitro. Journal of Immunological Methods. 131: 165-172. Francis, G., Zohar, K., Harinder, P. S., Becker, M. & Becker, K. 2002. The biological action of saponins in animal systems: a review. The British Journal of Nutrition 88: 587-605. Freshney, R. I. 2000. Culture of animal cell. A manual of basic technique. Cuarta edición. John Wiley and Sons Inc. New York. Freshney, R. I. 1995. Animal cell culture. A practical approach. Oxford University Press. García Barriga, H. 1992. Flora Medicinal de Colombia. Tomos I, II y II. Tercer Mundo Editores. Bogotá. García Kirkbride, M. C. 1987. Catálogo ilustrado de plantas de Cundinamarca. Volumen 4. Rubiaceae. Universidad Nacional. Instituto de Ciencias Naturales. Bogotá. Heitzman, M., Neto, C., Winiarz, A., Vaisberg, J. & Hammond, G. 2005. Ethnobotany, phytochemistry and pharmacology of Uncaria (rubiaceae). Phytochemistry 66: 5-29. La Rotta, C. 1988. Estudio etnobotánico sobre especies utilizadas por la comunidad Miraña (Amazonas-Colombia). FEN. WWF. Bogotá. Mahecha, G. 1997. Fundamentos y metodología para la identificación de plantas. Proyecto BIOPACÍFICO Ministerio del Medio Ambiente, Instituto Humboldt. Bogotá. Mendoza, H., Ramírez, B. & Jiménez, L. C. 2004. Rubiaceae de Colombia. Guía ilustrada de géneros. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Bogotá. Mendoza, H. 2000. Las Especies de Rubiaceae del flanco oriental de la Cordillera Oriental, Norte de los Andes, Colombia. Biota colombiana. 1: 224229. Missouri Botanical Garden´s VAST (VAScular Tropicos) Nomenclatural Data Base. http://mobot.mobot.org/W3T/search/vast.htm Monks, A., Scudiero, D., Skehan, P., Shoemaker, R., Paull, K., Vistica, D., Hose, C., Langley, J., Cronise, P., Vaigro-Wolff, A., Gray-Goodrich, M., Campbell, H., Mayo, J & Boyd, M. 1991. Feasibility of high-flux anticancer drug screen using a diverse panel of cultured human tumor cell lines. Journal of the National Cancer Institute. 83: 757-766. Morgan, S. J & Darling, D. C. 1995. Cultivo de células animales. Editorial Acribia, Zaragoza., España. Mosmann, T. 1983. Rapid colorimetric assays for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of immunological Methods. 65: 55-63. Pardo, C., Murillo, R.., Piñeros, M & Castro, M. A.. 2003. Casos nuevos de cáncer en el Instituto Nacional de Cancerología, Colombia, 2002. Revista Colombiana de Cancerología 7: 1- 24. Pedrozo, J. 2004. Productos naturales vegetales: Generalidades químicas, papel biológico e importancia industrial. Bogotá. Reppeto, G & Reppeto M. 1995. Métodos alternativos: estudios toxicológicos in vitro. Pags. 37-59 en: M. Reppeto (ed). Toxicología Avanzada. Ediciones Díaz de Santos. Madrid, España. Rumbero-Sanchez, A & Vazquez, P. 1991. Quinic acid esters from Isertia haenkeana. Phytochemistry. 30: 311-313. Rumbero-Sanchez, A & Vazquez, P. 1991. A nor-triterpene glycoside from Isertia haenkeana and a 13 CNMR study of cincholic acid. Phytochemistry. 30: 623-626. Samper, C. 2000. Explicación del fenómeno de la pérdida de diversidad, específicamente de la extinción de plantas. Pérez-Arbelaezia. 5: 11-17. Sharapin, N et al. 2000. Fundamentos de tecnología de productos fitoterapéuticos. Convenio Andrés Bello, Programa iberoamericano de ciencia y tecnología para el desarrollo, Bogotá. Setzer, M., Moriarity, D., Lawton, R., Setzer, N., Gentry, G. & Haber, W. 2003. Phytomedicinal potencial of tropical cloudforest plants from Monteverde, Costa Rica. Revista de Biología Tropical 51: 647-674. Soto-Sobenis, A., Castillo, B., Delgado, A., González, A. & Montenegro R. 2001. Alkaloid screening of herbarium samples of Rubiaceae from Panama. Pharmaceutical Biology. 39: 161-169. Sparg, S.G., Light, J & Staden J.van. 2004. Biological activities and distribution of plant saponins. Journal of Ethnopharmacology. 94: 219-243. Studzinski, G.P. 1999. Cell grown, differentiation and senescente. The paractical approach. Series editor: B. D. Hames. Téllez, N., de Castro, C., Riveros, T. & Torrenegra, R. 2006. Efectos citotóxicos in vitro de extractos y fracciones de Espeletia killipii Cuatr. Frente a líneas celulares tumorales humanos. Brazilian Journal of Pharmacognosy. 16: 12-16. Téllez, N., de Castro, C., Riveros, T., Alvarado, A., Mendoza, L., Pedroso, J. & Torrenegra, R. 2004. Citotoxicidad de metabolitos secundarios de algunas plantas colombianas. Actualidad Biológica. 26: 12–16. Um, B. H., Polat, M., Lobstein, A., Weniger, B., Aragón, R. & Declercq, L. 2002. A new dicaffeoylquinic acid butyl ester from Isertia pittieri. Fitoterapia. 73: 550-552. Um, B. H., Weniger, B., Lobstein, A., Pouplin, T., Polat, M & Aragon, R. 2001. Triterpenoid saponins from Isertia pittieri. Journal of Natural Products. 12: 15881589. 10. ANEXOS. Tabla 13. Efecto citotóxico de extracto y fracciones de petrol sobre la línea celular CSC 1595. CSC-1595 Petrol F. Petrol 300ug/mL 100ug/ml F. CH2Cl2 F. AcOEt F. MeOH CONTROL 0,108 0,12 0,077 0,065 0,06 0,147 0,117 0,101 0,076 0,069 0,006 0,193 0,108 0,094 0,064 0,058 0,005 0,191 0,111 0,091 0,081 0,073 0,004 0,194 0,094 0,113 0,085 0,062 0,005 0,188 0,011 0,176 0,086 0,092 0,005 0,172 Promedio 0,0915 0,115833333 0,078166667 0,069833333 0,014166667 0,180833333 Desv Est 0,040153456 0,031492327 0,008035339 0,01205681 0,022462561 0,018432761 Comp Control 5,7623E-04 0,00141388 1,97853E-07 2,23796E-07 6,5468E-08 Viabilidad 50,59907834 64,05529954 43,22580645 38,61751152 7,834101382 Tabla 14. Efecto citotóxico de extracto y fracciones 1-3 de EtOH sobre la línea celular CSC 1595. Promedio Desv Est Comp Control Viabilidad ETOH total 0,042 0,087 0,084 0,097 0,118 0,123 0,091833333 0,029157618 8,6832E-05 50,78341014 F.1 0,234 0,195 0,187 0,173 0,235 0,387 0,235166667 0,078552955 0,130069354 130,0460829 F.2 0,049 0,051 0,043 0,051 0,068 0,165 0,071166667 0,046717948 0,000324199 39,35483871 F.3 0,036 0,038 0,033 0,057 0,033 0,056 0,042166667 0,011267949 2,22335E-08 23,31797235 CONTROL 0,147 0,193 0,191 0,194 0,188 0,172 0,180833333 0,018432761 Tabla 15. Efecto citotóxico de fracciones 4-6de EtOH sobre la línea celular CSC 1595. F.4 F.5 F.6 CONTROL 0,08 0,086 0,086 0,175 0,072 0,094 0,102 0,19 0,08 0,092 0,101 0,146 0,09 0,093 0,097 0,188 0,076 0,104 0,099 0,159 0,081 0,106 0,088 0,133 Promedio 0,079833333 0,095833333 0,0955 0,165166667 Desv Est 0,006013873 0,007652886 0,00683374 0,023129346 Comp Control 5,34706E-06 3,84804E-05 3,39292E-05 Viabilidad 48,33501514 58,0221998 57,82038345 Tabla 16. Efecto citotóxico de fracciones 7-10 de EtOH sobre la línea celular CSC 1595. F.7 Promedio Desv Est Comp Control Viabilidad F.8 0,061 0,062 0,056 0,055 0,051 0,066 0,0585 0,005468089 6,6293E-07 35,41876892 F.9 0,066 0,075 0,058 0,072 0,068 0,044 0,063833333 0,011321072 2,22443E-06 38,64783047 0,067 0,074 0,068 0,081 0,072 0,061 0,0705 0,00683374 2,27595E-06 42,68415742 F.10 0,15 0,167 0,168 0,185 0,183 0,178 0,171833333 0,013044795 0,552315225 104,0363269 CONTROL 0,175 0,19 0,146 0,188 0,159 0,133 0,165166667 0,023129346 Tabla 17. Efecto citotóxico de extracto y fracciones petrol sobre la línea Colo 205. Colo 205 Petrol 300ug/mL 0,252 0,389 0,33 0,234 0,242 0,234 Promedio 0,280166667 Desv Est 0,06456134 Comp Control 7,0826E-01 Viabilidad 104,2157471 F. Petrol 100ug/ml F. CH2Cl2 F. AcOEt F. MeOH CONTROL 0,19 0,227 0,246 0,224 0,246 0,26 0,243 0,302 0,266 0,281 0,195 0,223 0,267 0,152 0,318 0,175 0,256 0,242 0,134 0,284 0,175 0,163 0,272 0,149 0,228 0,255 0,216 0,25 0,19 0,256 0,208333333 0,221333333 0,263166667 0,185833333 0,268833333 0,038944405 0,032054121 0,022435834 0,051164115 0,032089978 0,014868353 0,02811947 0,730327646 0,007165794 77,49535028 82,33106014 97,89212647 69,12585245 Tabla 18. Efecto citotóxico de extracto y fracciones 1-3 de EtOH sobre la línea celular colo 205. Promedio Desv Est Comp Control Viabilidad ETOH total 0,325 0,255 0,202 0,208 0,345 0,299 0,272333333 0,060251694 9,0255E-01 101,3019219 F.1 0,203 0,262 0,289 0,374 0,383 0,235 0,291 0,07359076 0,51417516 108,2455053 F.2 0,221 0,197 0,321 0,33 0,37 0,223 0,277 0,071897149 0,804586015 103,0378177 F.3 0,462 0,39 0,353 0,55 0,602 0,267 0,437333333 0,125525562 0,009725912 162,6782393 CONTROL 0,246 0,281 0,318 0,284 0,228 0,256 0,268833333 0,032089978 Tabla 19. Efecto citotóxico de fracciones 4-6 de EtOH sobre la línea celular Colo 205. F.4 F.5 F.6 CONTROL 0,258 0,241 0,553 0,401 0,197 0,208 0,548 0,455 0,212 0,198 0,535 0,406 0,179 0,147 0,46 0,429 0,155 0,172 0,481 0,579 0,142 0,186 0,599 0,482 Promedio 0,1905 0,192 0,529333333 0,458666667 Desv Est 0,041965462 0,032106074 0,050867147 0,066358622 Comp Control 7,93916E-06 4,75947E-06 0,065256485 Viabilidad 41,53343023 41,86046512 115,4069767 Tabla 20. Efecto citotóxico de fracciones 7-10 de EtOH sobre la línea celular Colo 205. F.7 Promedio Desv Est Comp Control Viabilidad 0,575 0,655 0,564 0,55 0,466 0,701 0,585166667 0,082804388 1,5298E-02 127,5799419 F.8 0,665 0,718 0,799 0,704 0,621 0,835 0,723666667 0,080587013 9,90923E-05 157,7761628 F.9 0,667 0,784 0,886 0,491 0,776 0,606 0,701666667 0,142138899 0,003517424 152,9796512 F.10 0,74 0,685 0,395 0,698 0,711 0,863 0,682 0,154660919 0,008712474 148,6918605 CONTROL 0,401 0,455 0,406 0,429 0,579 0,482 0,458666667 0,066358622 Tabla 21. Efecto citotóxico de extracto y fracciones Petrol sobre la línea celular MCF-7. MCF-7 Petrol 300ug/mL 0,388 0,348 0,49 F. Petrol 100ug/ml 0,255 0,379 0,352 F. CH2Cl2 0,421 0,421 0,372 F. AcOEt 0,42 0,492 0,535 Promedio 0,408666667 0,328666667 0,404666667 0,482333333 Desv Est 0,073221126 0,065209917 0,028290163 0,058106225 Comp Control 2,0887E-01 0,030365027 0,157508506 0,828605817 Viabilidad 82,39247312 66,26344086 81,58602151 97,24462366 F. MeOH 0,152 0,155 0,182 CONTROL 0,458 0,403 0,502 0,654 0,548 0,411 0,163 0,496 0,016522712 0,094891517 0,000639086 32,86290323 Tabla 22. Efecto citotóxico de extracto y fracciones 1-3 de EtOH sobre la línea celular MCF-7. ETOH total 0,04 0,407 0,692 Promedio Desv Est Comp Control Viabilidad 0,379666667 0,326858277 4,2043E-01 76,54569892 F.1 F.2 F.3 0,537 0,408 0,442 0,197 0,221 0,222 0,14 0,12 0,142 0,462333333 0,066860551 0,604456533 93,21236559 0,213333333 0,014153916 0,001632932 43,01075269 0,134 0,012165525 0,000380601 27,01612903 CONTROL 0,458 0,403 0,502 0,654 0,548 0,411 0,496 0,094891517 Tabla 23. Efecto citotóxico de fracciones 4-6 de EtOH sobre la línea celular MCF-7. F.4 0,224 0,192 0,251 Promedio 0,222333333 Desv Est 0,02953529 Comp Control 0,002120235 Viabilidad 44,82526882 F.5 0,462 0,326 0,292 F.6 0,182 0,211 0,265 CONTROL 0,458 0,403 0,502 0,654 0,548 0,411 0,36 0,219333333 0,496 0,089955545 0,042122836 0,094891517 0,078728504 0,002215909 72,58064516 44,22043011 Tabla 24. Efecto citotóxico de fracciones 7-10 de EtOH sobre la línea MCF-7. F.7 Promedio Desv Est Comp Control Viabilidad F.8 F.9 F.10 0,14 0,143 0,162 0,214 0,297 0,237 0,108 0,1 0,102 0,281 0,356 0,182 0,148333333 0,011930353 4,8556E-04 29,90591398 0,249333333 0,04285246 0,004124494 50,2688172 0,103333333 0,004163332 0,000226881 20,83333333 0,273 0,087275426 0,011455932 55,04032258 CONTROL 0,458 0,403 0,502 0,654 0,548 0,411 0,496 0,094891517 Tabla 25. Efecto citotóxico del sólido alcaloide sobre la línea celular CSC 1595. Alcaloide CONTROL 0,3390 0,4150 0,3930 0,4460 0,3280 0,4840 0,4650 0,3910 0,3710 0,4110 0,3010 0,4950 Promedio 0,3662 0,4403 Desv Est Comp Control 0,0582 0,0421 Viabilidad 83,1567 0,0300 Tabla 26. Efecto citotóxico de fracción MeOH en la línea CSC 1595. CSC-1595 Promedio Desv Est Comp Control Viabilidad fr. MeOH(50) CONTROL 0,166 0,244 0,183 0,249 0,156 0,237 0,152 0,272 0,16425 0,2505 0,01381726 0,01515476 0,0001539 65,5688623 Tabla 27. Efecto citotóxico de las subfracciones MeOH del extracto petrol sobre 1595. CSC-1595 Promedio Desv Est Comp Control Viabilidad A+B+C A+B(50) B+C(50) A+C CONTROL 0,215 0,229 0,289 0,165 0,282 0,15 0,171 0,177 0,164 0,249 0,163 0,148 0,174 0,187 0,237 0,166 0,161 0,162 0,181 0,272 0,178 0,169 0,25 0,223 0,244 0,1744 0,1756 0,2104 0,184 0,2568 0,02478508 0,03118974 0,05596695 0,02397916 0,01925357 0,00037389 67,9127726 0,00111581 68,3800623 0,11769359 81,9314642 0,00073416 71,6510903 Tabla 28. Efecto citotóxico de las subfracciones de la fracción 3 del extracto EtOH sobre la línea celular CSC 1595. Subfr.1 0,238 0,261 0,261 0,294 0,284 0,261 0,2665 Promedio Desv Est Comp Control Viabilidad Subfr. 2 CONTROL 0,196 0,415 0,244 0,446 0,292 0,484 0,327 0,391 0,286 0,411 0,274 0,495 0,269833333 0,440333333 0,01982675 3,5671E-06 0,045070685 4,91071E-05 60,52233157 61,27933384 0,042103048 Tabla 29. Efecto citotóxico de las subfracciones de la fracción 3 del extracto EtOH sobre la línea celular CSC 1595. CSC-1595 F-3 1+2 Promedio Desv Est Comp Control Viabilidad 0,381 0,243 0,225 0,224 0,335 0,2816 0,0720125 0,47819333 109,657321 CONTROL 0,282 0,249 0,237 0,272 0,244 0,2568 0,01925357 Tabla 30. Análisis estadístico del efecto citotóxico del extracto y fracciones Petrol sobre la línea celular CSC 1595. (300 µg/ml), (100 µg/ml). VAR. 1 VARIABLE 1 VARIABLE 1 VARIABLE 1 VARIABLE1 VARIABLE2 Ext. Petrol F. Petrol F. CH2Cl2 F. AcOEt F. MeOH 0,043597704 0,110308296 0,07741116 0,0683247 0,00580645 0,17906486 0,0016123 0,000991767 6,4567E-05 0,00014537 0,00050457 0,00033977 Media Varianza Observaciones Diferencia hipotética de las medias 6 6 6 6 6 0 0 0 0 0 Grados de libertad 10 10 10 10 10 P(T< =t) una cola P(T< =t) dos colas 0,000288113 0,000576226 0,00070694 0,00141388 9,8927E-08 1,9785E-07 1,119E-07 2,238E-07 3,2734E-08 6,5468E-08 Tabla 31. Análisis estadístico del efecto citotóxico del extracto y fracciones 1-3 EtOH sobre la línea celular CSC 1595. (300 µg/ml), (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T< =t) dos colas VARIABLE 1 VARIABLE1 VARIABLE1 Ext. EtOH F.1 F.2 0,080947109 0,21922655 0,05788927 0,000850167 0,00617057 0,00218257 6 6 6 0 10 4,3416E-05 8,68319E-05 0 10 0,06503468 0,13006935 0 10 0,0001621 0,0003242 VARIABLE1 F.3 0,039973183 0,000126967 6 VARIABLE 2 0,179064859 0,000339767 6 0 10 1,11168E-08 2,22335E-08 Tabla 32. Análisis estadístico del efecto citotóxico de fracciones EtOH sobre la línea celular CSC 1595. (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T <=t) dos colas VARIABLE1 VARIABLE1 VARIABLE1 VARIABLE 2 F.4 F.5 F.6 0,079466437 0,095332209 0,095077002 0,162363964 3,61667E-05 5,85667E-05 4,67E-05 0,000534967 6 6 6 6 0 10 2,67353E-06 5,34706E-06 0 10 1,92402E-05 3,84804E-05 0 10 1,69646E-05 3,39292E-05 0 10 0 0 6 Tabla 33. Análisis estadístico del efecto citotóxico de fracciones EtOH sobre la línea celular CSC 1595. (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T< =t) dos colas VARIABLE1 F.7 0,058071563 2,99E-05 6 VARIABLE1 F.8 0,061824903 0,000128167 6 0 10 3,31465E-07 6,6293E-07 0 10 1,11222E-06 2,22443E-06 VARIABLE1 VARIABLE1 VARIABLE 2 F.9 F.10 0,069952263 0,17096484 0,162363964 4,67E-05 0,000170167 0,000534967 6 6 6 0 10 1,13797E-06 2,27595E-06 0 10 0 0 0 10 0,276157613 0,552315225 Tabla 34. Análisis estadístico del efecto citotóxico del extracto y fracciones Petrol sobre la línea celular colo 205. (300 µg/ml), (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T <=t) dos colas VAR. 1 Ext. Petrol 0,26968121 0,00416817 6 VAR. 1 F. Petrol 0,20278726 0,00151667 6 VAR. 1 F. CH2Cl2 0,216796946 0,001027467 6 VAR. 1 F. AcOEt 0,2616623 0,00050337 6 VAR. 1 F. MeOH 0,175234231 0,002617767 6 0 10 0,35413138 0,70826276 0 10 0,00743418 0,01486835 0 10 0,014059735 0,02811947 0 10 0,36516382 0,73032765 0 10 0,003582897 0,007165794 VAR. 2 0,26570122 0,00102977 6 0 10 Tabla 35. Análisis estadístico del efecto citotóxico del extracto y fracciones 1-3 EtOH sobre la línea celular colo 205. (300 µg/ml), (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T <=t) dos colas VAR. 1 Ext. EtOH 0,26087284 0,00363027 6 0 10 0,45127341 0,90254683 VAR.2 0,26570122 0,00102977 6 0 10 VAR. 1 F.1 0,27594845 0,0054156 6 VAR. 1 F.2 0,261624814 0,0051692 6 VAR. 1 F.3 0,40578663 0,01575667 6 0 10 0,25708758 0,51417516 0 10 0,402293007 0,804586015 0 10 0,00486296 0,00972591 Tabla 36. Análisis estadístico del efecto citotóxico de fracciones 4-6 EtOH sobre la línea celular colo 205. (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T< =t) dos colas VAR.1 F.4 0,183208619 0,0017611 6 VAR.1 F.5 0,187496522 0,0010308 6 VAR.1 F.6 0,52517979 0,00258747 6 VAR. 2 0 10 3,96958E-06 7,93916E-06 0 10 2,37973E-06 4,75947E-06 0 10 0,03262824 0,06525649 0 10 0,45155463 0,00440347 6 Tabla 37. Análisis estadístico del efecto citotóxico de fracciones EtOH 7-10 sobre la línea celular colo 205. (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T< =t) dos colas VARIABLE1 F.7 0,575289271 0,006856567 6 VARIABLE1 F.8 0,716294168 0,006494267 6 VARIABLE1 F.9 0,67575836 0,02020347 6 0 10 0,007649051 0,015298102 0 10 4,95462E-05 9,90923E-05 0 10 0,00175871 0,00351742 VARIABLE1 VARIABLE 2 F.10 0,64234781 0,45155463 0,02392 0,00440347 6 6 0 10 0,00435624 0,00871247 0 10 Tabla 38. Análisis estadístico del efecto citotóxico del extracto y fracciones Petrol sobre la línea celular MCF-7. (300 µg/ml), (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T<=t) una cola P(T< =t) dos colas VAR.1 Ext. Petrol 0,4004432 0,00536133 6 VAR. 1 F. Petrol 0,31911498 0,00425233 6 VAR. 1 F. CH2Cl2 0,4032927 0,00080033 6 VAR. 1 F. AcOEt 0,477506911 0,003376333 6 VAR.1 F. MeOH 0,16194274 0,000273 6 VARIABLE2 0 10 0,10443536 0,20887071 0 10 0,01518251 0,03036503 0 10 0,07875425 0,15750851 0 10 0,414302908 0,828605817 0 10 0,00031954 0,00063909 0 10 0,482168327 0,0090044 6 Tabla 39. Análisis estadístico del efecto citotóxico del extracto y fracciones 1-3 EtOH sobre la línea celular MCF-7. . (300 µg/ml), (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T <=t) dos colas VARIABLE 1 Ext. EtOH 0,10379872 0,10683633 6 0 10 0,21021593 0,42043187 VARIABLE1 VARIABLE1 VARIABLE1 F.1 F.2 F.3 0,45623066 0,21268249 0,133224125 0,00447033 0,00020033 0,000148 6 6 6 0 10 0,30222827 0,60445653 0 10 0,00081647 0,00163293 0 10 0,000190301 0,000380601 VARIABLE 2 0,48216833 0,0090044 6 0 10 Tabla 40. Análisis estadístico del efecto citotóxico de fracciones EtOH 4-6 sobre la línea celular MCF-7. (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T <=t) una cola P(T <=t) dos colas VAR.1 F.4 0,219672672 0,000872333 3 VAR.1 F.5 0,346554609 0,008092 3 VAR.1 F.6 0,214172098 0,001774333 3 VAR. 2 0 0 0 0 7 0,001060117 7 0,039364252 7 0,001107954 7 0,002120235 0,078728504 0,002215909 0,4821683 0,0090044 3 Tabla 41. Análisis estadístico del efecto citotóxico de fracciones EtOH 7-10 sobre la línea celular MCF-7. (100 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T <=t) dos colas VARIABLE1 F.7 0,14771992 0,00014233 3 VARIABLE1 F.8 0,244711981 0,001836333 3 VARIABLE1 F.9 0,103223388 1,73333E-05 3 VARIABLE1 F.10 0,252903903 0,007617 3 0 7 0,00024278 0,00048556 0 7 0,002062247 0,004124494 0 7 0,000113441 0,000226881 0 7 0,005727966 0,011455932 VARIABLE 2 0,48216833 0,0090044 3 0 7 Tabla 42. Análisis estadístico del efecto citotóxico de sólido alcaloide sobre la línea celular CSC 1595. (25 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T< =t) dos colas VAR.1 VAR 2 Alcaloide 0,35903684 0,437039267 0,00339057 0,001772667 6 6 0 10 0,0149798 0,0299596 0 10 Tabla 43. Análisis estadístico del efecto citotóxico de la fracción MeOH sobre la línea celular CSC 1595. (50 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T <=t) dos colas 0,163413505 0,000190917 4 0 6 7,69487E-05 0,000153897 0,24983909 0,00022967 4 0 6 Tabla 44. Análisis estadístico del efecto citotóxico de subfracciones de la fracción MeOH del extracto petrol sobre la línea celular CSC 1595. (50 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T <=t) una cola P(T< =t) dos colas 0,17185159 0,0009728 5 0 8 0,0005579 0,00111581 0,17182212 0,0031323 5 0 8 0,0588468 0,11769359 0,18171954 0,000575 5 0 8 0,00036708 0,00073416 0,25567072 0,0003707 5 0 8 Tabla 45. Análisis estadístico del efecto citotóxico de subfracciones de la fracción 3 del extracto EtOH sobre la línea celular CSC 1595. (50 µg/ml). Media Varianza Observaciones Diferencia hipotética de las medias Grados de libertad P(T< =t) una cola P(T< =t) dos colas 0,268330991 0,0051858 5 0 8 0,239096666 0,478193332 0,25567072 0,0003707 5 0 8 EVALUACIÓN DE LA ACTIVIDAD CITOTÓXICO DE EXTRACTOS Y FRACCIONES DE Isertia laevis EMPLEANDO LÍNEAS CELULARES DERIVADAS DE TUMORES HUMANOS SANDRA LILIANA CASTRO DIAZ., ALBA .N. TÉLLEZ ALFONSO. slcastro@javeriana.edu.co, ntellez@javeriana.edu.co RESUMEN Las fracciones y subfracciones de Isertia laevis del extracto Petrol y EtOH, mostraron actividad citotóxica frente a líneas celulares tumorales humana de cáncer de seno (MCF-7 y CSC 1595) y de cólon (colo 205). Las fracciones fueron probadas a una concentración de 100 µg/ml, la fracción MeOH del extracto Petrol presentó un porcentaje de viabilidad de 7% sobre la línea celular 1595 y fue la fracción más activa, del extracto EtOH la fracción 3 con 27% para la línea MCF-7 y 23 % de viabilidad en la línea 1595 fue la fracción que mostró mejor resultado. Para la línea celular colo 205 las fracciones más activas fueron la 4 y 5 del extracto EtOH con un porcentaje de viabilidad de 41%. Las pruebas fitoquímicas cualitativas mostraron que las fracciones de petrol y las de EtOH contienen esteroles y/o triterpenos Palabras claves: Actividad Citotóxica, Isertia laevis, Extractos hojas. ABSTRACT The fractions of Isertia laevis showed citotoxic activity in front of human tumor cell lines of breast cancer (MCF-7 and CSC 1595) and of colon (colo 205). The fractions were proven to a concentration of 100 µg/ml, the fraction MeOH of the extract Petrol presented a percentage of viability of 7% on the cell line 1595 and it was the most active fraction, of the extract EtOH the fraction 3 with 27% for the line MCF-7 and 23% of viability in the line 1595 the fraction that showed better result were. For the cell line colo 205 the most active fractions it was the 4 and 5 of the extract EtOH with a percentage of viability of 41%. The tests qualitative showed that the fractions contain esterols and/or triterpenes. Key words: cytotoxic activity, Isertia laevis, leaves extracts. INTRODUCCIÓN. Colombia presenta una gran diversidad de plantas vasculares, la mayoría de ellas no han sido estudiadas o son poco conocidas. No se conocen trabajos fitoquímicos de Isertia laevis, se tienen reportes de los metabolitos secundarios de I.pittieri, I.haenkeana e I.hypoleuca, en las que se han encontrado alcaloides indólicos Bohrmann et al (1969); García Barriga (1992); Bruix et al (1993) y Soto et al (2001), triterpenos Arriaga et al (1990) y Rumbero et al (1990) y saponinas triterpénicas Um et al (2001); estas últimas según varios estudios en otras familias botánicas tienen propiedades citotóxicas y anticancerígenas y han presentado buenos resultados en ensayos con líneas celulares tumorales. Sparg et al (2004). En etnobotánica I. laevis se utiliza como anticancerígena García Barriga (1992). En este trabajo se evaluó la actividad citotóxica de extractos y fracciones de hojas de la especie I. laevis sobre las líneas celulares de cáncer de seno MCF-7, CSC1595 y de cólon Colo 205 mediante el método in vitro MTT, un ensayo colorimétrico rápido, versátil y cuantitativo. Mosmann (1983). MATERIALES Y MÉTODOS. Material vegetal: Se colectó en el municipio de Medina departamento de Cundinamarca. Un ejemplar se depositó en el Herbario Nacional Colombiano con No. COL: 506495. Obtención de extractos: Se realizó extracción en Soxhlet con Petrol para el desengrase del material durante 72 horas, se concentró en rotavapor a presión reducida. Al extracto floculado se le hizo una cromatografía en columna flash en sílica gel eluída con Petrol, CH2Cl2, AcOEt, MeOH de la cual se obtuvieron 4 fracciones. A cada fracción se le realizó cromatografías en placas de sílica gel corridas en Petrol:AcOEt (7:3), reveladas con ácido perclórico. El material desengrasado fue extraído por maceración en frío con EtOH, el extracto se concentró a presión reducida en rotavapor. Se realizó cromatografía en columna flash con RP-18 eluída con mezclas de MeOH:H2O (10:2), MeOH, MeOH:CH2Cl2 (8:2) y CH2Cl2, se obtuvieron 10 fracciones. A la fracción MeOH se le hizo cromatografía en columna con Sephadex eluída con MeOH, se obtuvieron tres subfracciones, se les hizo cromatografía en placas de RP-18 corridas en MeOH:H2O (10:2), revelada en ácido perclórico. A la fracción 3 del extracto EtOH también se le hizo subfraccionamiento y se obtuvieron dos subfracciones, se realizó cromatografía en placas de RP-18 corridas en MeOH:H2O (10:2), revelada con ácido perclórico. A los extractos totales de EtOH y Petrol y a las fracciones se les realizaron pruebas fitoquímicas cualitativas de terpenos: liebermann burchard, salkwoski; saponinas: molish, antrona, prueba de espuma; flavonoides: shinoda, cloruro férrico; alcaloides: dragendorff. Fraccionamiento guiado por bioensayo: consiste en la aplicación de técnicas de separación y aislamiento sobre un determinado extracto, con el objeto de hacer un seguimiento de la actividad biológica de las fracciones obtenidas, para finalizar con la identificación de los principios activos responsables de la actividad citotóxica demostrada por el extracto original, determinar el posible efecto sinérgico o antagónico entre las sustancias que están presentes en la fracción que contiene el posible principio activo. Bioensayos: La viabilidad celular fue determinada por la técnica del MTT, ensayo que se encuentra ampliamente referenciado en la literatura Studzinski (|1999). Se tomó como control negativo del solvente empleado DMSO 0.2%. Solubilización y preparación de muestras: Los extractos se solubilizan en Dimetil Sulfoxido (Merck) al 0.2% concentración inocua para las células. Líneas celulares: Se utilizaron las líneas celulares neoplásicas suministradas por el Instituto Nacional de Cáncer de EEUU: MCF -7 (seno) y Colo 205 (cólon) y la línea de cáncer de seno obtenida y caracterizada en el Instituto Nacional de Cáncer de Colombia CSS-1595 con las siguientes características: MCF-7. Tumor de una paciente de 69 años con adenocarcinoma de glándula mamaria, hipotetraploide, células epiteliales. CSC 1595. Tumor de una paciente de 77 años con cáncer de seno ductal infiltrante avanzado, características: aneuploide, 70 cromosomas, hormonodependiente, sensible a antraciclinas y 5-fluoracilo. Téllez et al (2006). Colo 205. Tumor de un paciente de 70 años, caucásico, con carcinoma de cólon (adenocarcinoma), hipertriploide. Cultivo celular: Se utilizaron cajas de 96 pozos para el cultivo de las células con medio L-15 suplementado con 10% de suero fetal bovino y 100 µl/10ml, penicilina estreptomicina y neomicina (5000U, 5mg estreptomicina y 10 mg neomicina/ml). Las líneas celulares fueron resuspendidas en medio de cultivo L15 (±40 000 células por pozo) en 100 µl por pozo. Las cajas se incubaron a 37º C y 5% de CO2 por 24 horas, tiempo para la formación de la monocapa de células. Después de la formación de la monocapa, se colocaron 20 µl de cada una de las soluciones de extractos y fracciones a las concentraciones definidas (300 µg/ml de extractos y 100 µg/ml de fracciones), en los pozos de la caja, se incubaron por 24 horas, tiempo para que las células puedan incorporar las sustancias. Pasado este periodo las soluciones de extractos y sus respectivas fracciones son retiradas y a cada pozo se le adicionaron 100 µl de medio L-15, por 24 horas para establecer si las células se recuperan. Posteriormente el medio es retirado y a cada pozo se le agregaron 100 µl de medio Dulbecco modificado y 50 µl de MTT, las cajas se incubaron por 4 horas a 37º C. Pasadas las 4 horas se retiraron los 150 µl de medio Dulbecco y MTT y se adicionaron en los pozos 100 µl de isopropanol para disolver los cristales de formazan producidos, a continuación se leyó la absorbancia en espectrofotómetro a una longitud de onda de 540 nm. RESULTADOS. Para las fracciones Petrol, CH2Cl2, AcOEt, MeOH del extracto en Petrol, las pruebas fitoquímicas determinaron la presencia de esteroides y/o triterpenos. Tabla 1. Pruebas fitoquímicas de las fracciones del extracto Petrol. Fracción Cloruro Shinoda Liebermann Férrico Salkwoski Antrona Molisch Burchard Petrol - - - - - - CH2Cl2 - - + + - + AcOEt - - + + - + MeOH - - + + + - Las fracciones obtenidas del extracto EtOH mostraron en las pruebas fitoquímicas cualitativas la presencia de flavonoides, esteroides y/o triterpenos y saponinas ver tabla 2. Tabla 2. Pruebas fitoquímicas de las fracciones del extracto EtOH. Fracción Cloruro Shinoda Férrico Liebermann Salkwoski Antrona Molisch Burchard 1 + + + + + + 2 + - + + + + 3 - - + + + + 4-10 - - + - - - A los extractos de Petrol y EtOH se hojas de I.laevis se les evaluó el efecto citotóxico a una concentración de 300 µg/ml y a las fracciones a una concentración de 100 µg/ml, frente a las líneas celulares. Las fracciones que se consideraron activas fueron las que presentaron un porcentaje de viabilidad menor a un 50%. La fracción MeOH del extracto Petrol presentó la mayor actividad como se muestra en la Tabla 3 con un porcentaje de viabilidad de 7% en la línea celular 1595. Tabla 3. Porcentaje de viabilidad de las células para las fracciones Petrol, CH2Cl2, AcOEt, MeOH del extracto petrol. Concentración a 100 µg/ml. F. Petrol F. CH2Cl2 F. AcOEt F. MeOH MCF-7 66 81 97 32 Colo 206 77 82 97 69 CSC 1595 64 43 38 7 En el estudio se encontró que las fracciones actuaron mejor sobre las líneas celulares de cáncer de seno 1595 y MCF-7 en las que se encontraron porcentajes de viabilidad de 20 a 48%. Según tabla 4. Tabla 4. Porcentaje de viabilidad de las células para las fracciones 1 – 10 del extracto EtOH. Concentraciones a 100 µg/ml. F.1 F.2 F.3 F.4 F.5 F.6 F.7 F.8 F.9 F.10 MCF-7 93 43 27 44 72 44 29 50 20 55 Colo 205 108 103 162 41 41 115 127 157 152 148 CSC 1595 130 39 23 48 58 57 35 38 42 104 Figuras 1, 2 y muestran las fracciones tanto del extracto petrol como del EtOH que tuvieron un porcentaje de viabilidad menor al 50%. Las dos líneas celulares de cáncer de seno presentaron un mayor número de fracciones con viabilidad inferior al 50%. En la línea celular colo 205 las fracciones 4 y 5 presentaron viabilidad de 41%. % VIABILIDAD FRACCIONES CON EFECTO CITOTOXICO < A 50% EN LA LÍNEA CELULAR 1595 50 40 30 20 10 0 F. MeOH F.2 F.3 F.4 F,7 F.8 F.9 FRACCIONES Figura 1. Fracciones petrol y EtOH con porcentaje de viabilidad menor al 50% en la línea celular 1595 % VIABILIDA D FRACCIONES CON EFECTO CITOTOXICO < AL 50% EN LA LÍNEA CELULAR MCF-7 60 40 20 0 F. MeOH F.2 F.3 F.4 F.6 F,7 F.9 FRACCIONES Figura 2. Fracciones petrol y EtOH con porcentaje de viabilidad menor al 50% sobre la línea celular MCF-7. Para las subfracciones de la fracción MeOH del extracto en Petrol, las pruebas fitoquímicas determinaron la presencia de esteroides y/o triterpenos. Las subfracciones Sf1, Sf2 y Sf3 obtenidas a partir de la fracción MeOH del extracto Petrol se probaron a la concentración de 50 µg/ml. La subfracción Sf1 mostró un porcentaje de viabilidad del 100%; La subfracción Sf2 presentó un porcentaje de viabilidad de 72% y Sf3 83% de viabilidad para la línea celular de cáncer de seno CSC 1595 como se muestra en la Tabla 5 y figura 3. Tabla 5. Porcentaje de viabilidad de las células para las subfracciones de la fracción MeOH del extracto Petrol concentraciones 50 µg/ml % viabilidad CSC 1595 Sf1 Sf2 Sf3 100 72 83 % VIABILIDAD EFECTO CITOTOXICO DE SUBFRACCIONES DE LA FRACCIÓN MeOH DEL EXTRACTO PETROL EN LA LÍNEA CELULAR 1595 100 50 0 Alcaloide subfr.1 subfr. 2 Subfr.3 SUBFRACCIONES Figura 3. Efecto citotóxico de subfracciones de la fracción MeOH del extracto petrol sobre línea celular 1595. Para probar si las subfracciones actuaban de forma sinérgica o antagónica se hicieron mezclas de las subfracciones, se probaron a una concentración de 50 µg/ml, las subfracciones 1 y 2 fueron las que presentaron un porcentaje de viabilidad más bajo 68% como se muestra en la tabla 6. Tabla 6. Porcentaje de viabilidad de la mezcla de las subfracciones de la fracción MeOH del extracto Petrol concentraciones 50 µg/ml. % viabilidad Sf1+ Sf2+Sf3 Sf1+ Sf2 Sf2+Sf3 Sf1+Sf3 Concentración 16.6 Concentración Concentración 25 Concentración 25 µg/ml 16.6 µg/ml µg/ml µg/ml 71 68 92 84 CSC 1595 Las pruebas fitoquímicas determinaron la presencia de esteroides y/o triterpenos en las subfracciones de la fracción 3 del extracto EtOH. Las subfracciones S3.1 y S3.2 de la fracción 3 del extracto EtOH se probaron a la concentración de 50 µg/ml. La subfracción S3.1 tuvo un porcentaje de viabilidad del 60% y la subfracción S3.2 mostró un porcentaje de viabilidad de 61% en la línea celular CSC 1595 Tabla 7. Porcentaje de viabilidad de las células para las subfracciones de la fracción 3 del extracto EtOH. Concentraciones 50 µg/ml. CSC 1595 Sf1 Sf2 60 61 % VIAB ILID AD EFECTO CITOTOXICO DE LAS SUBFRACCIONES DE LA FRACCIÓN 3 DEL EXTRACTO EtOH DEL EXTRACTO EN LA LÍNEA CELULAR 1595 62 60 s ubf r . 1 Subf r . 2 SUBFRACCIONES Figura 4. Efecto citotóxico de subfracciones de EtOH en línea celular 1595 DISCUSIÓN Los extractos se probaron a una concentración de 300 µg/ml mostrando los siguientes efectos citotóxicos, la línea tumoral CSC 1595 fue la más sensible a los extractos totales petrol y etanólico, con un efecto citotóxico del 50% (% de viabilidad 50%). En la evaluación de las fracciones petrol, CH2Cl2, AcOEt y MeOH valoradas a 100 µg/mL, se demostró que la más activa fue la fracción MeOH con porcentajes de viabilidad de 32% y 7% en las líneas tumorales de seno MCF-7 y CSC 1595 respectivamente. La línea celular obtenida de tumor de paciente colombiano CSC 1595 fue la más sensible al efecto de las fracciones CH2Cl2, AcOEt y MeOH con porcentajes de viabilidad del 43%, 38% y 7% respectivamente, este resultado es interesante si se tiene en cuenta que esta línea se considera joven, conservando un buen grado de similitud entre el tejido tumoral y la línea celular, opuesto a lo que sucede con la líneas celulares comerciales como lo menciona Téllez et al (2004). Las fracciones no fueron activas para la línea celular de colón Colo 205. Estos resultados demuestran cierta selectividad de acción frente a las líneas tumorales de diversa procedencia y origen. El comportamiento de las fracciones del extracto de EtOH también fue similar para las líneas 1595 y MCF-7. Las fracciones 2, 3, 4, 7, 8 y 9 del extracto EtOH presentaron porcentajes de viabilidad entre 23 y 50% para las líneas celulares CSC 1595 y MCF-7, la fracción 6 tuvo una viabilidad 44% solo para la línea celular MCF-7, la línea celular Colo 205 tuvo un comportamiento diferente al de las otras dos líneas, siendo las fracciones 4 y 5 las más activas con un porcentaje de viabilidad de 41%, opuesto a lo que mostró la viabilidad para el resto de fracciones y extractos de petrol y EtOH que tuvieron un efecto proliferativo con porcentajes de viabilidad entre 79 y 162% en esta línea celular. Las pruebas fitoquímicas cualitativas muestran que las fracciones del extracto EtOH y del extracto petrol contienen esteroides y/o triterpenos y saponinas triterpénicas Tablas 1 y 2, concuerda con la química reportada en la literatura para las especies de Isertia, Arriaga et al (1990), Rumbero et al (1990), Bruix et al (1993); Um et al (2001). Los resultados del porcentaje de citotoxicidad para la fracción MeOH a unas concentraciones de 100 y 50 µg/ml fue de (93% y 35% de efecto citotóxico) respectivamente lo que indica que la CC50 se debe encontrar entre los 50 y 100 µg/ml; al subfraccionar la fracción MeOH que fue la que presentó el porcentaje de viabilidad inferior al 7% se quiso determinar el posible efecto sinérgico o antagónico entre las sustancias que presentaba esta fracción, se obtuvieron tres fracciones y la fracción que presentó un mayor porcentaje de citotoxicidad fue la Sf2 (28%), las subfracciones no actuaron de manera similar como la fracción MeOH, por eso se hicieron mezclas de las subfracciones para observar cual presentaba un efecto citotóxico moderado, se observó que las mezclas donde se encontraba la subfracción 2 presentaron una mejor actividad citotóxica explicando así que las subfracciones 2 y 1 se relacionan de forma sinérgica y la subfracción 3 presenta un efecto antagónico con respecto a las otras subfracciones. Según las cromatografías y las pruebas fitoquímicas cualitativas, los metabolitos secundarios esteroides y/o triterpenos posiblemente sean los que están actuando favorablemente en la actividad citotóxica de las fracciones que presentaron un porcentaje de viabilidad menor o igual al 50%. A los triterpenos y saponinas triterpénicas se les ha comprobado propiedades farmacológicas importantes, entre ellas una buena actividad citotóxica en varias líneas celulares derivadas de tumores humanos, como lo referencia Sparg et al (2004) para varias familias botánicas y Cheng et al (2002) y Setter et al (2003) para especies de la familia rubiaceae. Uno de los géneros más estudiado ha sido el género Uncaria, en la especie U. rhynchophylla se encontraron varios esteres triterpenos tetracíclicos y ácidos uncarínicos, los cuales inhibieron el crecimiento de las líneas celulares de cáncer A-549, HCT-15, MCF-7 y HT-1197. Heitzman et al (2005). En el trabajo de Cheng et al (2002) sobre Mitragyna inermes se reportó una 27nor-triterpenoide aglycona que había sido aislada solo de Isertia haenkeana y Adina rubella. El extracto MeOH fue el que mostró ser citotóxico contra un panel de líneas celulares de cáncer humanos, utilizaron como eluyentes de la columna de sílica gel CH2Cl2, AcOEt y MeOH, obteniendo tres fracciones. La fracción I presentó la inhibición del crecimiento de más del 50% en la línea celular Bel-7402, esta fracción fue sometida a purificación sobre columna de Sephadex LH-20 y se aisló el componente citotóxico (un ácido quinóvico). Tanto el género Uncaria como el género Isertia pertenecen a la subfamilia Cinchonoideae compartiendo caracteres morfológicos, pero sería preciso acudir a caracteres quimiotaxonómicos que fortalecieran aún más los aspectos filogenéticos dentro de la subfamilia. El análisis estadístico entre los valores de controles y ensayos fueron interpretados mediante la prueba t (Student), con un nivel de significancia de (p<0.05). Los valores de t calculados mostraron ser inferiores a los valores de t de la tabla, sí hay diferencias significativas entre los tratamientos y el control, el efecto citotóxico de los extractos y fracciones fue producto de las concentraciones que fueron probadas y no causado por otros agentes. LITERATURA CITADA. -Aquino, R., De Tomáis, N., De Simona, F & Pizza, C. 1997. Triterpenes and quinovic acid glycosides from Uncaria tomentosa. Phytochemistry 45: 10351040. -Arriaga, F, J., Rumbero-Sanchez, A & Vazquez, P. 1990. Two triterpene glycosides from Isertia haenkeana. Phytochemistry. 29: 209-213. -Bohrmann, H., Lau-Cam, C., Tashiro, J & Youngken Jr. 1969. Constituens of Isertia hypoleuca Benth. (Rubiaceae)-I. Isolation and characterization of dihydroquinamine from the leaf material. Phytochemistry. 8: 649-652. -Bruix, M., Rumbero, A & Vazquez, P. 1993. Apodihydrocinchonamine, an indole alkaloid from Isertia haenkeana. Phytochemistry. 33: 1257-1261. -Cheng, Z-H., Yu, B-Y. & Yang, X-W. 2002. 27-nor-triterpenoid glycosides from Mitragyna inermis. Phytochemistry 61: 379-382. -García Barriga, H. 1992. Flora Medicinal de Colombia. Tomos I, II y II. Tercer Mundo Editores. Bogotá. -Mosmann, T. 1983. Rapid colorimetric assays for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of immunological Methods. 65: 55-63. -Rumbero-Sánchez, A & Vazquez, P. 1991. A nor-triterpene glycoside from Isertia haenkeana and a 13 CNMR study of cincholic acid. Phytochemistry. 30: 623-626. -Setzer, M., Moriarity, D., Lawton, R., Setzer, N., Gentry, G. & Haber, W. 2003. Phytomedicinal potencial of tropical cloudforest plants from Monteverde, Costa Rica. Revista de Biología Tropical 51: 647-674. -Sparg, S.G., Light, J & Staden J.van. 2004. Biological activities and distribution of plant saponins. Journal of Ethnopharmacology. 94: 219-243. -Um, B. H., Weniger, B., Lobstein, A., Pouplin, T., Polat, M & Aragon, R. 2001. Triterpenoid saponins from Isertia pittieri. Journal of Natural Products. 12: 15881589.