34 4.6. Tasa de producción La tasa de producción (TP) estipulada a
Anuncio
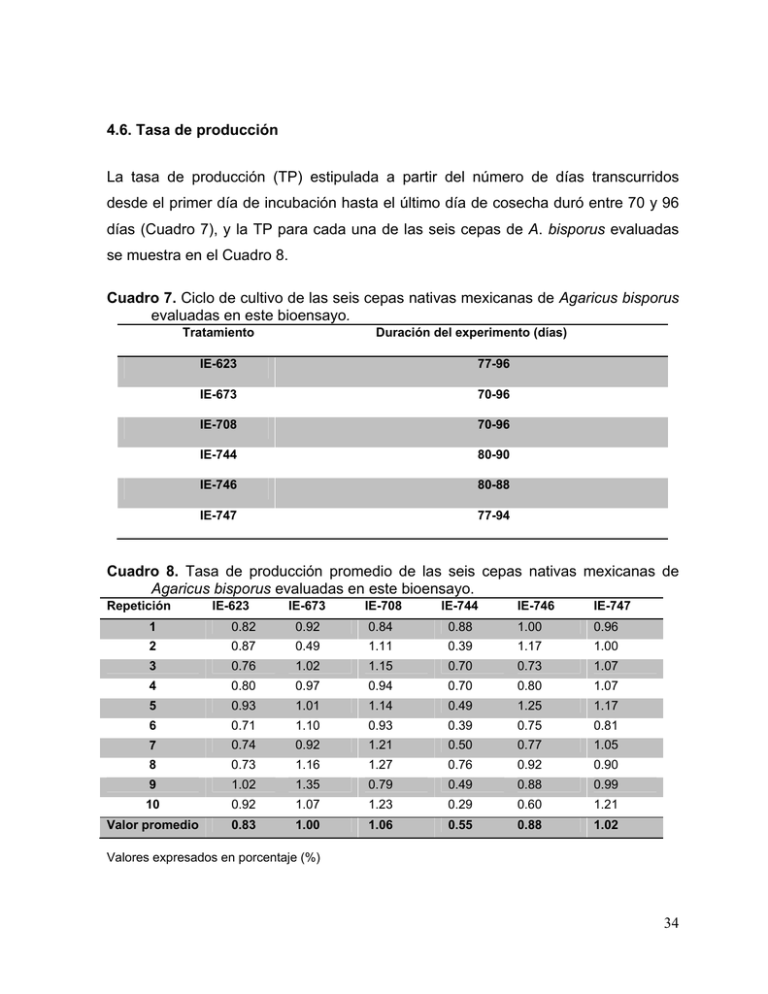
4.6. Tasa de producción La tasa de producción (TP) estipulada a partir del número de días transcurridos desde el primer día de incubación hasta el último día de cosecha duró entre 70 y 96 días (Cuadro 7), y la TP para cada una de las seis cepas de A. bisporus evaluadas se muestra en el Cuadro 8. Cuadro 7. Ciclo de cultivo de las seis cepas nativas mexicanas de Agaricus bisporus evaluadas en este bioensayo. Tratamiento Duración del experimento (días) IE-623 77-96 IE-673 70-96 IE-708 70-96 IE-744 80-90 IE-746 80-88 IE-747 77-94 Cuadro 8. Tasa de producción promedio de las seis cepas nativas mexicanas de Agaricus bisporus evaluadas en este bioensayo. Repetición IE-623 IE-673 IE-708 IE-744 IE-746 IE-747 1 0.82 0.92 0.84 0.88 1.00 0.96 2 0.87 0.49 1.11 0.39 1.17 1.00 3 0.76 1.02 1.15 0.70 0.73 1.07 4 0.80 0.97 0.94 0.70 0.80 1.07 5 0.93 1.01 1.14 0.49 1.25 1.17 6 0.71 1.10 0.93 0.39 0.75 0.81 7 0.74 0.92 1.21 0.50 0.77 1.05 8 0.73 1.16 1.27 0.76 0.92 0.90 9 1.02 1.35 0.79 0.49 0.88 0.99 10 0.92 1.07 1.23 0.29 0.60 1.21 Valor promedio 0.83 1.00 1.06 0.55 0.88 1.02 Valores expresados en porcentaje (%) 34 4.6.1. Análisis estadístico de la tasa de producción Para comprobar cuál fue la mejor tasa de producción (TP) de las seis cepas evaluadas se realizó un análisis de varianza (ANOVA, P≤0.05), y en el Cuadro 9 se muestra el resultado obtenido en la prueba de Tukey (P≤0.05) donde, tras comparar la media de los tratamientos, se apreció que las cepas IE-673, IE-708 e IE-747 tuvieron una TP similar, con valores equitativos de 1.00%, 1.06% y 1.02%, mientras que las cepas IE-623 e IE-746 desplegaron valores más bajos pero muy cercanos (0.83% y 0.88%, respectivamente), no siendo así para IE-744 cuya TP apenas alcanzó a ser de 0.55% (Figura 12). Cuadro 9. Comparación de medias de la tasa de producción de las seis cepas nativas mexicanas de Agaricus bisporus evaluadas en este bioensayo. Tukey HSD test; variable Tasa de producción (Spreadsheet11) Homogenous Groups, alpha = 0.05000 Error: Between MS = 0.03005, df = 54.000 Tratamiento Tasa de producción (Promedio) IE-744 0.55 c IE-623 0.83 b IE-673 0.88 ab IE-708 1.00 ab IE-747 1.02 ab IE-746 1.06 a Valores base expresados en porcentaje (%). Tratamientos con la misma letra son estadísticamente iguales entre sí (Tukey P≤0.05). 4.7. Producción de cuerpos fructíferos Se realizó la cuantificación de los cuerpos fructíferos cosechados en las seis cepas de A. bisporus evaluadas durante todo el ciclo productivo (bioensayo a 4 cosechas), y los resultados obtenidos mostraron que todas las cepas produjeron basidiocarpos del tipo G1, y en menor proporción del tipo G2, tal y como se advierte en el Cuadro 10. 35 Mean Plot of T.P. grouped by cepas Spreadsheet1 10v*67c 1,3 1,2 1,1 1,0 T.P. 0,9 0,8 0,7 0,6 0,5 0,4 0,3 IE-623 IE-673 IE-708 IE-744 IE-746 IE-747 Mean Mean±0,95 Conf. Interval cepas Figura 12. Tasa de producción promedio de las seis cepas de Agaricus bisporus evaluadas en este bioensayo. Valores base expresados en porcentaje (%). 4.7.1. Análisis de medias del número de hongos cosechados De acuerdo con el tamaño de los cuerpos fructíferos cosechados, se apreció que la cepa IE-746 produjo el mayor número de basidiocarpos del tipo G1 (95%) y la IE-623 los basidiomas del tipo G2 (15%) (Fig. 13). 36 Cuadro 10. Dimensiones de los cuerpos fructíferos cosechados durante todo el ciclo productivo de las seis cepas de Agaricus bisporus evaluadas en este bioensayo. IE-623 G1 G2 1 87.5 2 IE-673 IE-708 G1 G2 12.5 82.5 79.1 20.9 3 79 4 IE-744 IE-746 IE-747 G1 G2 G1 G2 G1 G2 G1 G2 17.5 88.0 12.0 84.8 15.2 94.1 5.9 85.4 14.6 50.0 50.0 86.7 13.3 97.9 2.1 98.8 1.2 93.5 6.5 21.0 89.7 10.3 91.9 8.1 87.3 12.7 97.6 2.4 97.9 2.1 95 5.0 91.3 8.7 83.6 16.4 96.7 3.3 88.7 11.3 96.4 3.6 5 84 16.0 94.8 5.2 100.0 --- 95.0 5.0 94.8 5.2 91.4 8.6 6 85.2 14.8 96.7 3.3 98.1 1.9 97.6 2.4 92.7 7.3 94.0 6.0 7 97.8 2.2 87.1 12.9 82.4 17.6 94.8 5.2 93.5 6.5 95.6 4.4 8 85 15.0 92.7 7.3 93.0 7.0 80.5 19.5 96.3 3.7 90.1 9.9 9 77.5 22.5 96.2 3.8 91.5 8.5 85.1 14.9 95.9 4.1 97.6 2.4 10 80.2 19.8 87.0 13.0 91.0 9.0 81.4 18.6 90.7 9.3 97.8 2.2 85.0 15.0 86.8 13.2 81.5 18.5 90.0 10.0 94.3 5.7 93.9 6.1 Dimensión del cuerpo fructífero Repetición Valor promedio Ciclo productivo de este bioensayo= 4 cosechas. G1= Basidiocarpos con píleos iguales o menores a 5 cm de diámetro ; G2= Basidiomas de 5.01 a 10 cm de diámetro 37 Figura 13. Tipo de basidiocarpos producidos por las seis cepas de Agaricus bisporus evaluadas en este bioensayo. Grupo G1= Basidiocarpos con píleos iguales o menores a 5 cm de diámetro, G2= Basidiomas de 5.01 a 10 cm de diámetro. 38 4.7.2. Análisis del porcentaje de cuerpos fructíferos obtenidos en cada cosecha En el Cuadro 11 se observa que las seis cepas de A. bisporus evaluadas en este bioensayo produjeron durante la primera y segunda cosecha un valor igual o superior al 80% de todos los cuerpos fructíferos obtenidos hasta el final del presente bioensayo (4 cosechas), siendo las cepas IE-708 e IE-744 las que produjeron el 90% de sus carnosos basidiocarpos en ambas cosechas. Cuadro 11. Cuerpos fructíferos cosechados durante todo el ciclo productivo de las cepas nativas mexicanas de Agaricus bisporus evaluadas en este bioensayo. Tratamiento Cosecha 1 Cosecha 2 Cosecha 3 Cosecha 4 IE-623 43.60 36.53 15.58 4.38 IE-673 53.26 27.81 17.46 1.46 IE-708 48.40 42.64 6.83 2.13 IE-744 64.07 27.87 5.65 2.41 IE-746 31.81 58.94 5.02 4.33 IE-747 57.91 25.67 13.21 2.95 Ciclo productivo de este bioensayo= 4 cosechas. Valores expresados en porcentaje (%) 4.7.3. Discusión de la dinámica porcentual de cuerpos fructíferos obtenidos en cada cosecha Tomando en consideración la caracterización morfológica de los basidiomas formados por las cepas nativas mexicanas de A. bisporus cultivadas en este bioensayo y los valores de respuesta para determinar sus índices de productividad, los resultados obtenidos concuerdan con lo señalado por Mata et al. (2002) quienes al evaluar la cepa IE-623 notaron que las características que la diferenciaban de dos cepas comerciales (registradas como IE-272 e IE-273 en el INECOL) fue el tamaño de los cuerpos fructíferos y el color, matizando además su plausible adaptabilidad a tecnologías ya establecidas para este hongo comestible con resultados favorables. 39 5. CONCLUSIONES Basándose en los resultados obtenidos en el presente estudio se llegaron a las siguientes conclusiones: La cepa nativa mexicana IE-747 de Agaricus bisporus mostró las mejores cualidades productivas (eficiencia biológica y tasa de producción) y potencial de aprovechamiento comercial por su tamaño y color (crema claro), bajo las condiciones experimentales en las que se condujo este bioensayo. Los cuerpos fructíferos de las seis cepas de Agaricus bisporus evaluadas fueron visualmente atractivos por su color, sobre todo la IE-623, con un color crema claro y escamas sobre el píleo; y los basidiocarpos carnosos de la cepa IE-744 se tornaron de color café y pudieran ser incorporados a la industria como una especie similar a los portobellos. La potencialidad genética de las seis cepas nativas mexicanas de Agaricus bisporus evaluadas permite inferir que en un futuro se les pueda aprovechar en estudios de mejoramiento genético y a nivel comercial. 40 6. LITERATURA CITADA Abad B., M., Noguera M., P., y Carrión B., C. (2004). Los sustratos en cultivos sin suelo. (3ª. ed.). En: Urrestarazu G., M. (Coord.). Tratado de cultivo sin suelo (pp. 113-152). Madrid (España): Mundi-Prensa. Abah, S.E., y Abah, G. (2010). Antimicrobial and antioxidant potentials of Agaricus bisporus. Advances in Biological Research, 4(5), 277-282. Albertó, E. (2008). Cultivo intensivo de los hongos comestibles: Como cultivar champiñones, gírgolas, shiitake y otras especies. Buenos Aires (Argentina): Hemisferio Sur. 268 p. Ardón L., C.E. (2007). La producción de hongos comestibles. Tesis maestría. Universidad de San Carlos de Guatemala, Facultad de Humanidades, Guatemala. 207 p. Beelman, R.B., Royse, D.J., y Chikthimmah, N. (2003). Bioactive components in button mushroom Agaricus bisporus (J. Lge) Imbach (Agaricomycetideae) of nutritional, medicinal, and biological importance (review). International Journal of Medicinal Mushrooms, 5(4), 321-337. Betancourt P., A. (2006). Algunas consideraciones provisionales. En: Betancourt P., A. (Coord.). De la conservación <<desde arriba>> a la conservación <<desde abajo>>; El interés supranacional en los saberes indígenas sobre ecología (pp. 237-241). México: Fundación Carolina (Proyecto CeALCI 22/05). Carrillo, L. (2003). Microbiología agrícola: Hongos. Obtenido en la Red Mundial el 10 de diciembre de 2011. http://www.unsa.edu.ar/matbib/micragri/ micagricontenido.pdf Chang, S.-T. (1999). World production of cultivated edible and medicinal mushrooms in 1997 with emphasis on Lentinus edodes (Berk.) Sing, in China. International Journal of Medicinal Mushrooms, 1(4), 291-300. Chaparro P., A.P. (2010). Aislamiento e identificación de metabolitos producidos por la cepa nativa SPG 321 de Mucor circinelloides y evaluación de su actividad microbiana. Tesis maestría en ciencias. Pontificia Universidad Javeriana, Facultad de Ciencias, Bogotá. 99 p. Cappello G., S., López-Hernández, E.S., y Sánchez L., V. (2006). Educación ambiental para conocimiento y uso de hongos en una comunidad chontal. Olcuatitán, Nacajuca. Tabasco. Horizonte Sanitario, 5(2), 44-54. 41 Estrada-Martínez, E., Guzmán, G., David Cibrián T., D., y Ortega P., R. (2009). Contribución al conocimiento etnomicológico de los hongos comestibles silvestres de mercados regionales y comunidades de la Sierra Nevada (México). Interciencia, 34(1), 25-33. Fernández M., F. (2005). Manual práctico de producción comercial de champiñón. México: Sin editorial. 122 p. Gaitán-Hernández, R., Salmones, D., Pérez M., R., y Mata, G. (2006). Manual práctico del cultivo de setas: Aislamiento, siembra y producción. México: Instituto de Ecología A.C. 53 p. Gaitán-Hernández, R., y Salmones, D. (2008). Obtaining and characterizing Pleurotus ostreatus strains for commercial cultivation under warm environmental conditions. Scientia Horticulturae, 118(2), 106-110. Galindo, E., Peña, C., y Serrano-Carreón, L. (2008). Domesticar microorganismos en un biorreactor: Los retos del bioingeniero. En: López-Munguía, A. (Ed.). Una ventana al quehacer científico. (pp. 131-143.). México: Universidad Nacional Autónoma de México. (25 aniversario, Instituto de Biotecnología de la UNAM). García M., C. (2000). Algunos aspectos estructurales y funcionales de la pared celular de Agaricus bisporus y sus aplicaciones más inmediatas. Anales de la Real Academia de Farmacia, 66, 1-19. Goltapeh, E.M., y Danesh, Y.R. (2006). Pathogenic interactions between Trichoderma species and Agaricus bisporus. Journal of Agricultural Technology, 2(1), 29-37. Guzmán, G. (2007). Variabilidad, producción e importancia de los hongos en la naturaleza. En: Zulueta R., R., Trejo A., D., y Trigos L., A. (Eds.). El maravilloso mundo de los hongos (pp. 19-29). México: Universidad Veracruzana. Guzmán, G., Salmones, D., Soto-Velazco, C., y Guzmán, D.L. (2008). El cultivo de los hongos comestibles; con especial atención a especies tropicales y subtropicales en esquilmos y residuos agro-industriales. México: Instituto Politécnico Nacional. 245 p. Hernández H., J.C. (2007). Producción de inóculo de champiñón (Agaricus bisporus [Lange] Imbach) utilizando cepas nativas mexicanas y su comparación con cepas comerciales. Tesis de licenciatura, Universidad Veracruzana, Facultad de Ciencias Agrícolas-Campus Xalapa, México. 37 p. Herrera, T., y Ulloa, M. (1998). El reino de los hongos: Micología básica y aplicada. México: Fondo de Cultura Económica/UNAM. 552 p. 42 Jagadish, L.K., Venkatakrishnan, V., Shenbhagaraman, R., y Kaviyarasan, V. (2009). Comparative study on the antioxidant, anticancer and antimicrobial property of Agaricus bisporus (J.E. Lange) Imbach before and after boiling. African Journal of Biotechnology, 8(4), 654-661. Jarquín G., R., y Cuevas G., R. (2007).Organización y mercado: La clave para el éxito. En: Sánchez V., J.E., Royse, D.J., y Leal L., H. (Eds.). Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus (pp. 151-159). México: El Colegio de la Frontera Sur. Kredics, L., García J., L., Naeimi, S., Czifra, D., Urbán, P., Manczinger, L., Vágvölgyi, C., y Hatvani, L. (2010). A challenge to mushroom growers: the green mould disease of cultivated champignons. En: Méndez-Vilas, A. (Ed.). Current Research, Technology and Education Topics in Applied Microbiology and Microbial Biotechnology: Vol. 2. Microbiology Series no. 2 (pp. 295-305). Badajoz (Spain): FORMATEX. Laborde, L.F. (2007). Inocuidad alimenticia de champiñón. En: Sánchez V., J.E., Royse, D.J., y Leal L., H. (Eds.). Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus (pp. 101-112). México: El Colegio de la Frontera Sur. Lahman, O., y Rinker, D.L. (2004). Mushroom practices and production in Latin America: 1994-2002. En: Romaine, C.P., Keil, C.B., Rinker, D.L., and Royse, D.J. (Eds.). Proceedings of the 16th International Congress on the Science and Cultivation of Edible and Medicinal Fungi (pp. 681-686). The Pennsylvania State University Press, Pennsylvania. Lahmann, O. (2007). Evolución de la industria del champiñón Agaricus bisporus en Latinoamérica. En: Sánchez V., J.E., Royse, D.J., y Leal L., H. (Eds.). Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus (pp. 161-166). México: El Colegio de la Frontera Sur. Lelley, J.I. (2007). Aspectos saludables al consumir hongos. En: Sánchez V., J.E., Royse, D.J., y Leal L., H. (Eds.). Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus (pp. 113-120). México: El Colegio de la Frontera Sur. Lomax, K.M. (2007). Control del ambiente en los cuartos de cultivo de champiñones. En: Sánchez V., J.E., Royse, D.J., y Leal L., H. (Eds.). Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus (pp. 121-133). México: El Colegio de la Frontera Sur. Manzi, P., Aguzzi, A., y Pizzoferrato, L. (2001). Nutritional value of mushrooms widely consumed in Italy. Food Chemistry, 73(3), 321-325. 43 Martínez-Carrera, D., Leben, R., Morales, P., Sobal, M., y Larqué-Saavedra, A. (1991). Historia del cultivo comercial de los hongos comestibles en México. Ciencia y Desarrollo, 96, 33-43. Martínez-Carrera, D., Larqué, A., Aliphat, M., Aguilar, A., Bonilla, M., y Martínez, W. (2000). La biotecnología de hongos comestibles en la seguridad y soberanía alimentaria de México. II Foro Nacional sobre Seguridad y Soberanía Alimentaria (pp. 193-207). México: Academia Mexicana de Ciencias/CONACyT. Martínez-Carrera, D., Bonilla, M., Martínez, W., Sobal, M., Aguilar, A., y PellicerGonzález, E. (2001). Characterisation and cultivation of wild Agaricus species from Mexico. Micología Aplicada Internacional, 13(1), 9-24. Martínez-Carrera, D., Sobal, M., Morales, P., Martínez, W., Martínez, M, y Mayett, Y. (2004). Los hongos comestibles: Propiedades nutricionales, medicinales, y su contribución a la alimentación mexicana; El shiitake. México: Colegio de Postgraduados. 46 p. Martínez-Carrera, D., Morales, P., Sobal, M., Bonilla, M., y Martínez, W. (2007a). La cadena de valor de los hongos comestibles en México. En: Zulueta R., R., Trejo A., D., y Trigos L., A. (Eds.). El maravilloso mundo de los hongos (pp. 71-89). México: Universidad Veracruzana. Martínez C., D., Morales, P., Sobal, M., Bonilla, M., y Martínez, W. (2007b). México ante la globalización en el siglo XXI: El sistema de producción-consumo de los hongos comestibles. En: Sánchez V., J.E., Martínez C., D., Mata, G., y Leal L., H. (Eds.). El cultivo de setas Pleurotus spp en México (pp. 209-224). México: El Colegio de la Frontera Sur. Mata, G., Rodríguez, A., y Callac, P. (2002). Aislamiento, cultivo y evaluación de una cepa mexicana silvestre de champiñón Agaricus bisporus, y su comparación con cepas comerciales. En: Guzmán, G. y Mata, G. (Eds.). Resúmenes del VI Congreso Latinoamericano de Botánica (p. 500). México: Xalapa, Veracruz. Mata, G., y Rodríguez-Estrada, A.E. (2005 a). Viability in spawn stocks of the white button mushroom, Agaricus bisporus, after freezing in liquid nitrogen without a cryoprotectant. Journal of Agricultural Technology, 1(1), 153-162. Mata, G., y Rodríguez-Estrada, A. (2005 b). Studies on laccase and biomass production in vitro and culture by a mexican wild strain of Agaricus bisporus (J.Lge) Imbach: A comparison with commercial strains. International Journal of Medicinal Mushrooms, 7(3), 431-432. Mata, G., y Savoie, J.M. (2007). Producción de semilla y conservación de cepas de Agaricus bisporus. En: Sánchez V., J.E., Royse, D.J., y Leal L., H. (Eds.). Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus (pp. 3748). México: El Colegio de la Frontera Sur. 44 Mata, G., Gaitán-Hernández, R., y Salmones, D. (2007). Hongos comestibles en México, una industria en crecimiento. En: Zulueta R., R., Trejo A., D., y Trigos L., A. (Eds.). El maravilloso mundo de los hongos (pp. 39-48). México: Universidad Veracruzana. Michel, L. (1982). El huerto biológico. Barcelona (España): Ediciones Marzo 80. 95 p. Ortega, P. (2002). Plagas, enfermedades y competidores en plantas productoras de hongos comestibles en la región central de México y la estrategia para su prevención y control. Tesis de maestría. Colegio de Postgraduados, Campus Puebla, Puebla. 241 pp. Pacioni, G. (1997) Cultivo moderno del champiñón. Barcelona (España): Editorial De Vecchi. 128 p. Pérez A., B., Mayett M., Y., y Martínez C., D. (2010). Propiedades nutricionales y medicinales de los hongos comestibles. Saberes Compartidos, 4(5), 5-11. Piepenbring, M. (2009). Reportes nuevos de agaricales para Panamá. Acta Biologica Panamensis,1, 22-38. Pontón, J., Moragues, M.D., Gené, J., Guarro, J., y Quindós, G. (2002). Hongos y actinomicetos alergénicos. Bilbao (España): Imprenta Berekintza. 45 p. Rinker, D.L. (2007). Manejo integrado de plagas del champiñón. En: Sánchez V., J.E., Royse, D.J., y Leal L., H. (Eds.). Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus (pp. 81-100). México: El Colegio de la Frontera Sur. Romero-Arenas, O., Huerta L., M., Damián H., M.A., Domínguez H., F., y Arellano V., D.A. (2009). Características de Trichoderma harzianum, como agente limitante en el cultivo de hongos comestibles. Revista Colombiana de Biotecnología, 11(2), 143-151. Royse, D.J. (2007). Consumo y producción de Agaricus bisporus en el mundo. En: Sánchez V., J.E., Royse, D.J., y Leal L., H. (Eds.). Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus (pp. 7-17). México: El Colegio de la Frontera Sur. Ruíz H., J., (2001). El asombroso reino de los hongos. Avance y perspectiva, 20, 275-281 Salmones, D., Gaitán-Hernández, R., Pérez, R., y Guzmán, G. (1997) Estudios sobre el género Pleurotus. Interacción entre crecimiento micelial y productividad. Revista Iberoamericana de Micología, 14, 173-176. 45 Samp, R. (2007). Desarrollo de sistemas de procesamiento de composta para el champiñón Agaricus bisporus. En: Sánchez V., J.E., Royse, D.J., y Leal L., H. (Eds.). Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus (pp. 49-56). México: El Colegio de la Frontera Sur. Sánchez, J.E. (2007). Uso de hongos termófilos para la preparación de sustratos. En: Sánchez V., J.E., Royse, D.J., y Leal L., H. (Eds.). Cultivo, mercadotecnia e inocuidad alimenticia de Agaricus bisporus (pp. 65-74). México: El Colegio de la Frontera Sur. Shnyreva, A.V., Song, W., y Van Griensven, L.J.L.D. (2010). Extracts of medicinal mushrooms Agaricus bisporus and Phellinus linteus induce proapoptotic effects in the human leukemia cell K562. International Journal of Medicinal Mushrooms, 12(2), 167-175. Smiderle, F.R, Ruthes, A.C., van Arkel, J., Chanput, W., Iacomini, M., Wichers, H.J., y Van Griensven, L.J.L.D. (2011). Polysaccharides from Agaricus bisporus and Agaricus brasiliensis show similarities in their structures and their immunomodulatory effects on human monocytic THP-1 cells. BMC Complementary and Alternative Medicine, 11: 58 (doi:10.1186/1472-6882-1158) Sobal, M., Morales, P., Bonilla, M., Huerta, G., y Martínez-Carrera, D. (2007). El Centro de Recursos Genéticos de Hongos Comestibles (CREGENHC) del Colegio de Postgraduados. En: Sánchez V., J.E., Martínez C., D., Mata, G., y Leal L., H. (Eds.). El cultivo de setas Pleurotus spp en México (pp. 27-40). México: El Colegio de la Frontera Sur. Stamets, P. (1993). Growing gourmet and medical mushroom. Berkeley, California (USA): Ten Speed Press. 552 p. Vargas-Arispuro, I., Contreras-Valenzuela, A., Hernández-Martínez, J., y MartínezTéllez, M.Á. (2006). Arilselenofosfatos con acción antifúngica selectiva contra Phymatotrichopsis omnivora. Revista Fitotecnia Mexicana, 29 (2), 171-174. Vedder, P.J.C. (1991). Cultivo moderno del champiñón. Madrid (España): MundiPrensa. 370 p. Venkatesh, Y.P., y Hegde, V.L. (2003). A hypothesis for the mechanism of immediate hypersensitivity to manitol. Allergology International, 52, 165-170. Wang, Z.-S., Chen, M.-Y., Cai, Z.-X., Liao, J.-H., Li, H.-R., Guo, Z.-J., y Lu, Z.-H. (2011). DNA fingerprinting of genetic diversity of Agaricus bisporus. Proceedings of the 7th International Conference on Mushroom Biology and Mushroom Products (pp. 1-8). Arcachon, France. (Section Posters). 46 Wannet, W.J.B., Drift, C. van der, Camp, H.J.M.O. den, y Griensven, L.J.L.D. van (2000). Trehalose and mannitol metabolism in Agaricus bisporus. En: Griensven L.J.L.D. van (Ed.). Proceedings of the 15th International Congress on the Science and Cultivation of Edible Fungi (pp. 63-70). Maastricht, The Netherlands. Wolfram|Alpha knowledgebase (2011). Wolfram Alpha LLC. Obtenido en la Red Mundial el 30 de diciembre de 2011. http://www.wolframalpha.com/ entities/species/button_mushroom/zh/z6/o0/ Zaidman, B.Z., Yassin, M., Mahajna, J., y Wasser, S.P. (2005). Medicinal mushroom modulator of molecular targets as cancer therapeutics. Applied Microbiology and Biotechnology, 67, 453-68. 47 7. ANEXOS Anexo 1 Actividades realizadas en el Laboratorio y Planta Experimental de Cultivo de Hongos Comestibles del Instituto de Ecología, A.C. (INECOL) para la evaluación de las cepas nativas mexicanas de Agaricus bisporus evaluadas en este bioensayo. Figuras del Anexo 1: 1-2. Inoculación del compost. 3-4. Muestras en área de incubación. 5. Compost colonizado. 6.aplicacion de tierra de cobertura. 48 Anexo 1 Actividades realizadas en el Laboratorio y Planta Experimental de Cultivo de Hongos Comestibles del Instituto de Ecología, A.C. (INECOL) para la evaluación de las cepas nativas mexicanas de Agaricus bisporus evaluadas en este bioensayo. Figuras del Anexo 1: 7. Micelio de Agaricus bisporus. 8. Muestras en área de producción. 9-10. Cuerpos fructíferos en desarrollo. 11-12. Hongos cosechados antes de ser evaluados. 49