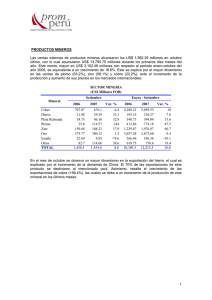
Procesamiento mineral oxidado de zinc
Anuncio

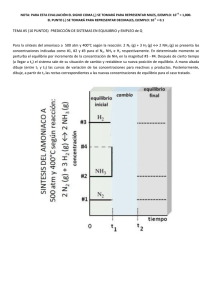
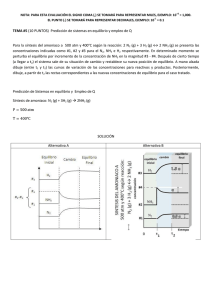
ALTERNATIVA DE LIXIVIACIÓN DE MINERALES COMPLEJOS DE COBRE Y MINERALES OXIDADOS DE ZINC Ing. Álvaro Ordoñez Nuñez Consultor alvaroordoes10@gmail.com Edmundo Alfaro Delgado; Dr. Ing. Pontificia Universidad Católica del Perú ealfaro@pucp.pe 1 OBJETIVOS: I. Establecer un proceso de lixiviación para: Minerales complejos de cobre, procedentes de las zonas de Lampa y Pucara (Puno), constituidos por: óxidos de grano fino que están íntimamente mezclados son sulfuros secundarios y con presencia de cobre nativo; ganga con alto contenido de carbonatos. , Óxidos de zinc procedentes de la zona de Accha y Yanque (Cuzco-Apurimac): smithsonita y hemimorfita con ganga muy alta en carbonatos. II. Definir el procedimiento de tratamiento de soluciones para: Obtener el metal electrodepositado Obtener un precipitado metálico. 2 Especies Minerales a Procesar Minerales de cobre: Malaquita Cu2(OH)2(CO3) Crisocola CuSiO3.H2O Calcosita Cu2S Cu nativo Cu Minerales de zinc: Smithsonita ZnCO3 Hemimorfita Zn4Si2O7(OH).H2O 3 Mecanismo de disolución 4 FUNDAMENTOS DEL PROCESO 1. Mecanismo de la Disolución de Minerales Oxidados (tipo MeCO3) en Medio Hipoclorito-Amoniaco: Etapa I: OCl- + H2O = O2(g) + 2 H+ + Cl- + 2 eEtapa II: MeCO3 + 2 H+ = Me+2 + HCO3- + H+ Me+2 + NH3(ac) + NH4+ = Me(NH3)2+2 + H+ Etapa III: Me(NH3)2+2 + NH3(ac) + NH4+ = Me(NH3)4+2 + H+ 2. La disolución y acomplejamiento del Cu nativo se efectúa según: Cu0 + OCl- + H2O = Cu+2 + 2 OH + ClCu0 + Cu(NH3)4+2 + e- = Cu(NH3)2+-+ 2 NH3(ac) 5 Termodinámica Diagrama Eh-.pH Sistema NH3-H2O pH > 9.30 NH3 => NO2 Diagrama Eh-.pH Sistema Cl-H2O pH > 7.80 OCl => Cl 6 Diagrama E-.pH Sistema Cu- CO3 – NH3 -H2O 9.40 < pH < 9.75 E°> 0 Diagrama E-.pH Sistema Zn - CO3 – NH3 -H2O 9.00 < pH < 11.0 7 Procesamiento mineral complejo de cobre 8 PROCEDIMIENTO EXPERIMENTAL Mineral Complejo de Cobre Mineralogía (SEM) Partícula grande de gangas (GGs) con inclusiones de cobre nativo (marcos grises), cavidades lixiviadas (lx), y nidos de carbonatos de cobre (C), inclusiones pequeñas de sulfuros secundarios de cobre (marcos azules). Partícula mixta: magnetita/ganga (marco verde). 9 Composición Química Muestra Cobre Granulometría CuT, % CuOx + Cu °, % 3.06 2.17 Au, g/TM Ag, g/TM 1.18 12.0 P80 = 103 micrones Condiciones de Lixiviación - Concentración [NH3(ac)] = 5.88 g/L pH = 9.23 Tiempo de lixiviacio ón/etapa = 1 hora Relación solido/liquido = 1/5 Número de etapas de lixiviacion = 4 10 Solución de lixiviación Cu2(OH)2(CO3) + 6 NH3(ac) + 2 NH4+ = 2 Cu(NH3)4+2 + CO3-2 + 2 H2O Etapa pH Oxidación y acomplejam. 8.50 NH3, g/L 1.80 OCl-, g/L 1.67 Cu, g/L 3.22 ~ 4 horas Equipo de agitación para lixiviación de mineral complejo Cu PLS con complejo amínico de cobre [Cu(NH3)4+2] = 3.22 g/L 11 Recuperación de cobre por gravimetría el ripio de la lixiviacion se envía a un concentrador centrifugo obteniéndose un concentrado constituido por cobre nativo, la recuperación del cobre nativo (de un tamaño de grano grueso que tiene una lenta cinética de disolución) constituye un 24.75 % lo que se adiciona a la recuperación por lixiviacion. Esto se efectúa debido a la presencia de cobre nativo en el mineral complejo de cobre. 12 % Cu Extraido: Lixiviación Gravimetría Total 58.15 24.75 82.90 LIXIVIACION MINERAL COMPLEJO DE COBRE 70 % Cu extraido 60 50 40 30 % Cu extraido = 19.094ln(t) + 32.789 R² = 0.9927 20 10 0 0 1 2 Tiempo, h 3 4 5 13 Opción Electrodeposición Directa Recuperación de cobre por EW directa (se obvia SX) Condiciones - [Cu+2] en electrolito: - Voltaje: - Densidad de corriente: - Área cátodos: - Volumen electrolito: - Tiempo electrodeposición: 1.865 g/L 2.38 V 9.58 A/m2 1.144 m2 105 L 30 h Cátodo con Cu electro depositado 8h 14 15 Opción Precipitación Condiciones - Tiempo: 40 min - pH: 8.70 - [Cu(NH3)4+2] inicial: 2.06 g/L Prueba N° Cu, g/L PP, % Cu Recup. Cu, % 1 2 3 4 5 1.80 1.48 1.48 2.06 2.31 62.70 56.27 53.55 64.31 56.27 85.71 78.26 82.61 90.62 95.83 [Cu], g/L, Cu en pp, y Recuperacion, % Precipitacion Cu 100 95.83 90.62 85.71 82.61 78.26 64.31 62.7 56.27 56.27 53.55 10 [Cu]in, g/L % Recup 1.80 2.31 2.06 1.48 % Cu 1.48 1 1 2 3 Prueba 4 5 16 PLS: tetra amín Cu(II) Precipitación CuS Precipitado, luego separación solido/liquido Sedimentación precipitado Precipitado seco, % Cu = 56.5 – 63.0 17 Mineral Oxidado de Zinc Composición Mineralógica (XRD) Nombre del mineral Hemimorfita Plagioclasa Smithsonita Calcita Cerusita Galena Formula general Composición aproximada, % Zn4Si2O7(OH)2.2H2O (Ca, Na) (SI, Al)4O8 Zn CO3 CaCO3 PbCO3 PbS 70 13 7 6 3 < L. D. Composición Química Muestra Zinc Granulometría ZnT, % 39.06 Cd, % 0.01 P80 = 63 micrones Au, g/TM 0.21 18 Procesamiento mineral oxidado de zinc 19 Lixiviación Condiciones o Etapa I: Oxidación con Hipoclorito - Concentración [OCl-]: 10.00 g/L - pH: 10.83 - Tiempo de lixiviacion/etapa: 1 hora - Relación solido/liquido: 10/1 - Número de etapas de lixiviacion: 1 o Etapa II: Acomplejamiento - Concentración [NH3(ac)]: 23.68 g/L - pH: 9.25 - Tiempo de lixiviacion/etapa: 2 horas - Relación solido/liquido: 10/1 - Número de etapas de lixiviacion: 6 PLS Etapa pH Oxidante (I) Acomplejamiento(II) 9.75 9.33 NH3, g/L OCl-, g/L --12.44 4.40 0.77 Zn, g/L 3.46 13.84 20 21 Opción Electrodeposición Purificación Eliminar cadmio disuelto como Cd(NH3)4+2 Cd(NH3)4+2 + Zn° = Cd° + Zn(NH3)4+2 Extracción de 99 % de cadmio Electrodeposición de Zn Celda EW de zinc Condiciones - Volumen de la solucion: 20 L - Voltaje aplicado: 2,80 V - Área cátodos: 120,40 cm2 - Densidad de corriente: 59,80 A/m2 10,70 g/L - [Zn+2] en electrolito: - Tiempo de electrodeposición: 30 a 34 horas Cátodo con zinc electrodepositado 22 23 Opción Precipitación Precipitación en dos etapas 1. Precipitación I: se recupera mayormente Zn (aprox. 80 %). 2. Precipitación II: se recupera Zn (~ 10%) y casi todo el Cd. PLS conteniendo Zn(NH3)4+2 Precipitación Zn Precipitado Zn Sedimentación precipitado Precipitado Zn y Cd 24 CONCLUSIONES Es viable el uso de NH3 - OCl- para la recuperación de metales base (Cu y Zn) contenidos en minerales de mineralogía compleja y/o con gangas de elevado contenido de carbonatos en medio básico. El empleo del hipoclorito permite tener un oxidante fuerte en el medio lixiviante. Se degrada a ion cloruro muy fácilmente. Se adecua para minerales de la Sierra sur del Perú donde predominan rocas sedimentarias con minerales complejos de cobre (mezcla de óxidos, sulfuros secundarios y cobre nativo) de difícil recuperación por flotación o por lixiviación ácida. Es una opción para procesar minerales complejos de cobre, con gangas altas en carbonatos, de la región Puno-Cusco. 25 CONCLUSIONES Ventaja importante del proceso es su facilidad de adaptarse a grandes como pequeñas unidades mineras, y se obtiene como producto final cátodos de metal o precipitados. Sirve también para minerales oxidados de zinc de la franja Accha-Yanque, los cuales están íntimamente mezclados con roca caliza, obteniendo un producto metálico comercial. Provenientes de la degradación del amoniaco los nitritos son compuestos fertilizantes que se emplean con fines agrícolas. 26