QUANTA Lite® C1q CIC ELISA
Anuncio

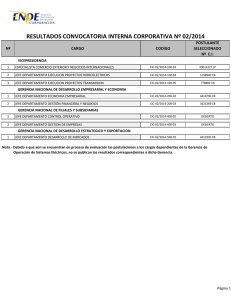
QUANTA Lite® C1q CIC ELISA 704620 Para Diagnóstico In Vitro Complejidad de CLIA: Alto Aplicación El propósito de este kit es la determinación in-vitro de los inmunocomplejos circulantes (CIC) ligantes de C1q presentes en suero humano. El kit se emplea en la determinación de CICs en el suero de pacientes con diferentes enfermedades autoinmunes u otras enfermedades asociadas a CIC. La interpretación de los resultados se realiza conjuntamente con otros resultados clínicos. El kit contiene suficiente material para realizar máximo 41 tests en duplicado u 89 en tests simples junto con una curva de calibración, un control positivo y uno negativo. Sumario y Explicación de la prueba Las reacciones antígeno-anticuerpo pueden dar lugar a la formación de inmunocomplejos. Esto en principio es una función inmunológica normal y continua. Los antígenos pueden estar fijados en tejidos o presentes en el plasma u otros fluidos corporales formando inmunocomplejos circulantes. Los CICs normalmente se eliminan sin perjuicios por el sistema reticuloendotelial. No obstante, grandes depósitos de inmunocomplejos en los vasos sanguíneos con la subsiguiente activación de procesos inflamatorios tales como la cascada de complemento, pueden dar lugar a una enfermedad mediada por inmuno-complejos acompañada de daños en los tejidos. La suerte de estos complejos depende de muchas variables, tales como las propiedades y clases del antígeno, el tamaño de los inmunocomplejos, la relación de formación y de la actividad funcional del sistema fagocítico. Debido al rol patológico de los CIC en muchas enfermedades, se han desarrollado métodos específicos para la determinación de estos para lo cual se aprovechan las ventajas de las propiedades fisicoquímicas de los CIC y/o 1, 2, 3 . su habilidad de fijarse a las superficies de la célula (celulas Raji y plaquetas o moléculas tales como el C1q) En un estudio de la OMS, se recomienda incluso emplear para la determinación de CIC como mínimo dos métodos 4 diferentes . 5 La determinación de la concentración de CIC C1q ligantes por el método de ELISA es importante en el pronostico . Este método es especialmente adecuado para el control de seguimiento de los niveles de CIC en pacientes con SLE, dado que la concentración de CIC varía con la actividad de la enfermedad y por la respuesta disminuida del 6 complemento . Procedimiento de trabajo Los micropocillos están pre-impregnados con C1q humano purificado. Los calibradores, controles y muestras de paciente diluidos son aplicados a los pocillos y los ligantes de inmunocomplejos C1q se fijan en la primera incubación. Tras el lavado de los pocillos para eliminar todas las proteínas no fijadas, se añade IgG purificada de cabra anti-humano marcada con peroxidasa. El conjugado se fija al anticuerpo humano capturado y el exceso de conjugado no fijado se elimina mediante un segundo lavado. El conjugado fijado se visualiza con tetrametilobenzidina 3,3’,5,5’ (TMB) dando un color azul. La intensidad es proporcional a la concentración de CIC en la muestra. Para parar la reacción se añade a cada pocillo ácido sulfúrico. Esto produce un color amarillo a punto final, legible a 450nm. La concentración CIC en la muestra se lee de la curva de calibración y se indica en (μg Eq/mL). Reactivos 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. Placa microperforada de poliestireno para ELISA con antígeno humana C1q (12-1 x 8 pocillos), envasada en su soporte en una bolsa de aluminio con desecante Control negativo ELISA, 1 frasco de tampón conteniendo conservante y suero humana ausente anticuerpos humanos a C1q, prediluido, 1.2 ml Control ELISA C1q CIC Calibrador A, 1 frasco de tampón conteniendo conservante y de IgG humana agregada con anticuerpos a C1q, prediluido, 1.2 ml Control ELISA C1q CIC Calibrador B, 1 frasco de tampón conteniendo conservante y de IgG humana agregada con anticuerpos a C1q, prediluido, 1.2 ml Control ELISA C1q CIC Calibrador C, 1 frasco de tampón conteniendo conservante y de IgG humana agregada con anticuerpos a C1q, prediluido, 1.2 ml Control ELISA C1q CIC Calibrador D, 1 frasco de tampón conteniendo conservante y de IgG humana agregada con anticuerpos a C1q, prediluido, 1.2 ml Control ELISA C1q CIC Calibrador E, 1 frasco de tampón conteniendo conservante y de IgG humana agregada con anticuerpos a C1q, prediluido, 1.2 ml Control ELISA C1q CIC Positivo Débil, 1 frasco de tampón conteniendo conservante y de IgG humana agregada con anticuerpos a C1q, prediluido, 1.2 ml Diluyente de Muestra Tipo III, 2 frascos color amarillo conteniendo tampón Tween 20 y conservante, 50 ml Solución de Lavado Concentrada HRP, 1 frasco de concentrado 40x color rojo conteniendo tampón con Tris y Tween 20, 25ml. Referirse a la Sección “Metodología” para instrucciones de dilución. Conjugado HRP C1q CIC IgG, humana 1 frasco - color azul conteniendo tampón, estabilizante de proteína y conservante, 10ml Cromógeno TMB, 1 frasco conteniendo estabilizantes, 10ml Solución de Parada HRP, Acido Sulfúrico 0.344 M, 1 frasco, incolora, 10 ml Advertencias 1. Aviso: Este producto contiene cloramfenicol al 0.02% en el, diluyente de Muestra, controles y conjugado considerado en el estado de California como causante de cáncer. La diluyente de Muestra también contiene Proclin 150. Puede ser dañino si es inhalado, ingerido o absorbido por la piel. Evitar la inhalación, ingestión o contacto con piel y ojos. 1 2. 3. 4. 5. 6. 7. 8. Todo material de origen humano usado en la preparación de los controles para este producto se ha examinado resultando negativo para anticuerpos contra HIV, HBsAg, y HCV por métodos aprobados por la FDA. Ningún método puede sin embargo ofrecer garantía completa que HIV, HBV, HCV o otros agentes contagiosos estén ausentes. Por lo tanto, los controles Control ELISA C1q CIC Positivo Débil, Control ELISA C1q CIC Calibradores A - E a ELISA negativo Control como si fueran material potencialmente 8 contagioso. Dado que se utiliza azida sódica como conservante, este producto puede ser tóxico por ingestión o absorción a través de piel o mucosas. La azida sódica puede reaccionar con el plomo o cobre de las tuberías para formar azidas metálicas potencialmente explosivas. Si se utilizan desagües para la eliminación de reactivos se recomienda lavarlos con abundante agua para prevenir la formación de dichas azidas metálicas. Conjugado HRP C1q CIC IgG contiene diluido un producto químico venenoso y corrosivo que puede ser tóxico si se ingiere. Para impedir quemaduras, evitar el contacto con piel o ojos. El Cromógeno TMB contiene un irritante. Puede ser dañino si es inhalado, ingerido o absorbido por la piel. Evitar la inhalación, ingestión o contacto con piel y ojos. La Solución de parada HRP consiste de una solución diluida de ácido sulfúrico. Evitar exposición a bases, metales, u otros compuestos que puedan reaccionar con ácidos. El ácido Sulfúrico es venenoso y corrosivo, puede ser tóxico si ingerido. Para impedir quemaduras, evitar contacto con piel y ojos. Se recomienda utilizar el equipo protector apropiado al trabajar con este kit. Los reactivos derramados deben limpiarse inmediatamente. Siga las normas aplicables en su laboratorio acerca de la eliminación de residuos. Precauciones 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. Este producto es para ser usado en el Diagnóstico In Vitro. Este producto sólo debe ser utilizado por personal adecuadamente preparado. Se recomienda seguir estrictamente el protocolo. Cualquier variación sobre el protocolo puede afectar a los resultados. Prestad especial atención a las Notas específicas y a todas las advertencias presentes en estas Instrucciones de Uso. No se pueden intercambiar reactivos de distintos lotes y/o kits. Si se deben realizar muchos tests, prestad atención a que todos los reactivos sean del mismo lote. Todas las tiras de pocillos deben provenir de una misma bolsa. La substitución de alguno de los componentes del kit puede dar lugar a resultados incorrectos. Para evitar que se contaminen los reactivos se debe usar siempre material plástico o de cristal nuevo o limpio. Nunca se debe retornar el reactivo no utilizado a la botella original. No se deben dejar las botellas destapadas, cualquier evaporación o contaminación puede dar lugar a resultados incorrectos. El substrato TMB no puede estar expuesto a la luz ni al agua. Los sueros con contaminaciones microbianas, hemolizados o lipémicos y las muestras que contienen partículas no deben ser utilizados. La precisión de las diluciones de las muestras no pueden ser verificadas dado que los controles están listos para usar. Se aconseja por lo tanto el uso de pipetas calibradas y de sueros de control internos. El uso de muestreadores automáticos, diluidores para muestras o cualquier otro tipo de instrumentación automática puede dar lugar a diferencias en los resultados, con respecto al procedimiento manual. Es responsabilidad del laboratorio convalidar el sistema de automatización, verificando que los resultados estén dentro de los límites definidos en la presente metódica y en el Certificado de CC adjunto. Deberá tararse toda la instrumentación utilizada y deberá realizarse el mantenimiento periódico sugerido por la casa matriz. Condiciones de Almacenaje 1. 2. 3. El kit debe conservarse a 2-8ºC y no debe congelarse. Temperaturas de conservación no adecuadas afectarán a los resultados. El tampón de lavado diluido puede conservarse a 2-8ºC para 1 semana. La fecha de caducidad de este kit se muestra en la etiqueta exterior. Recolección de Muestras 1. 2. 3. 4. Las muestras de sangre se han de obtener por venopunción, dejar que coagule de modo natural y separar el suero. 7 El suero puede conservarse a 2-8ºC hasta 7 horas antes del ensayo , o para periodos superiores, ha de alicuotarse y conservarse a -20ºC. Evitar congelaciones y descongelaciones repetidas. Las muestras de suero no deben ser inactivadas por calor ya que esto puede ocasionar resultados falsos positivos. Procedimiento Materiales Suministrados • Hoja de instrucciones: Indica todos los detalles del ensayo. • Certificado QC: Indica la funcionalidad esperada del lote. • Pocillos tapizados con C1q: 12 x 8 tiras de pocillos sensibilizados con antígeno C1q. Cada placa está envasada en una bolsa auto cierre con dos desecantes. • Control negativo ELISA: 1 botella con 1.2mL de suero humano diluido. El valor esperado se indica en el certificado QC. Listo para uso. • Calibradores de C1q CIC: 5 botellas, cada uno con 1.2 ml de suero IgG humana agregada con anticuerpos diluido,: 100, 33.3, 111., 3.7, 1.23 µg Eq/mL. Listo para uso. • Control positivo C1q CIC: 1 botella con 1,2mL de suero humano diluido. El valor esperado se indica en el certificado QC. Listo para uso. 2 • Diluyente de muestra Tipo III: 2 botellas con 50mL de tampón para dilución de la muestra. Listo para uso. Coloreado de amarillo. • Solución de lavado concentrada HRP (40X): 1 botella con 25mL de tampón concentrado 40 x para el lavado de los pocillos. • Conjugado HRP C1q CIC IgG: 1 botella con 10mL de anticuerpo purificado contra IgG humana marcado con peroxidasa Color azul. Listo para uso. • Cromógeno TMB: 1 botella con 10mL de cromógeno TMB. Listo para uso. • Solución de Parada HRP: 1 vial con 10mL 0.344 Acido Sulfúrico. Listo para uso. Material necesario no incluido • Lavador automático de microplacas: Su uso es recomendable, aunque las placas pueden lavarse manualmente. • Lector de microplacas: Capaz de medir densidades ópticas a 450nm en referencia al aire. • Agua destilada o desionizada: Ha de ser de la calidad más alta disponible. • Micropipetas calibradas: Para dispensar 1000, 100 y 10µL. • Pipeta multicanal: Recomendada para dispensar volúmenes de 100µL de conjugado, solución sustrato y solución de parada. • Tubos de vidrio/plástico: Para dilución de la muestra. Metodología Antes de empezar 1. • • 2. 3. 4. 5. Dejar el kit a temperatura ambiente Este kit está pensado para ser procesado a temperatura ambiente (20-24°C). Sacar el kit del almacenamiento y dejarlo a temperatura ambiente unos 60 minutos. Los pocillos no se deben sacar de la bolsa hasta que no se hayan atemperado. Componentes del kit Mezclar cuidadosamente cada componente del kit antes de utilizarlo. Tampón de lavado (Concentrado 40x) Diluir la solución de lavado HRP 1:40 añadiendo el contenido del envase con concentrado a 975 ml de agua destilada o desionizada. Si no va a utilizar toda la placa, puede preparar una cantidad menor de solución de lavado añadiendo 2.0 ml del concentrado a 78ml de agua destilada para cada 16 pocillos que vayan a utilizarse. El tampón diluido es estable 1 semana a 2-8°C. Dilución de la muestra Diluir 10µL de cada muestra con 1000µL de diluyente de muestras (1:101) y mezclar bien. Nota: La muestra diluida se debe usar en las 8 horas siguientes. Manipulación del marco y las tiras Disponer el número necesario de pocillos en la tira. Disponerlos desde la posición A1, rellenando columnas de izquierda a derecha a lo ancho de la placa. Al manipular la placa, apretar los extremos del marco para evitar que caigan los pocillos. Nota: Vuelva a colocar inmediatamente los pocillos no utilizados en el envoltorio de aluminio con los dos sobrecitos de desecante, cerrando firmemente para reducir al mínimo la exposición a la humedad. Verifique que el envoltorio de aluminio no esté roto ni perforado. ATENCIÓN: Si los pocillos se exponen a la humedad o a la contaminación por polvo, el antígeno puede degradarse, esto daría lugar a un ensayo con una baja precisión y resultados potencialmente erróneos. Procedimiento de Ensayo 1. 2. 3. 4. 5. Dispensación de la muestra Dispensar 100µL de cada calibrador, control y muestra diluida (1:101) en los pocillos de la placa. Nota: Las muestras deben dispensarse lo más rápido posible para reducir al mínimo el efecto deriva sobre el ensayo. Ponga en marcha el timer después de haber distribuido la última muestra. Incubar a temperatura ambiente durante 30 minutos. Lavados El procedimiento de lavados es un punto crítico y requiere una atención especial. Un mal lavado de la placa puede dar lugar a resultados poco precisos, con escasa precisión y valores de fondo elevados. Después de la incubación, lavar los pocillos 3 veces con 200-300µL cada pocillo con tampón de lavados. La placa se puede lavar de forma automática o manual. Después del lavado automático invertir la placa sobre un papel de filtro y dar unos golpecitos sobre los pocillos para permitir que se sequen. Las placas se pueden lavar manualmente de la siguiente forma: a. Eliminar el contenido de la placa en un fregadero. b. Dejar secar la placa invertida en un papel absorbente. c. Llenar cada pocillo con 200-300µL de tampón de lavados usando una pipeta multicanal. d. Agitar la placa sobre una superficie plana. e. Repetir a-d dos veces. f. Repetir a y b. Dispensación del conjugado Dispense 100µL del conjugado en cada pocillo, secar la parte superior de los pocillos con un pañuelo para eliminar cualquier posible salpicadura. Nota: Para evitar contaminaciones no devolver nunca el conjugado no utilizado a la botella de reactivo.Incubar a temperatura ambiente durante 30 minutos. Lavado Repetir el paso 2. Dispensación del sustrato (TMB) Dispensar 100µL de sustrato TMB en cada pocillo, secar la parte superior de los pocillos con un pañuelo para eliminar cualquier posible salpicadura. Nota: Para evitar contaminaciones no devolver nunca el TMB no utilizado a la botella de reactivo. Incubar a temperatura ambiente, en la oscuridad, durante 30 minutos. 3 6. 7. Parada de la reacción Dispensar 100µL de la solución de parada a cada pocillo. Esto provoca un cambio de color pasando del azul al amarillo. Determinación de la densidad óptica Leer la densidad óptica (DO) de cada pocillo a 450nm en un lector de microplacas, durante los 30 minutos siguientes a la parada de la reacción. Control de Calidad 1. 2. 3. 4. 5. 6. Control de calidad Para que un ensayo se considere válido, debe cumplir los siguientes criterios: • Cada serie debe incluir los controles positivo y negativo. • Los valores obtenidos con los controles deben estar dentro del rango descrito en el Certificado de Control de Calidad. • La forma de la curva debe ser similar a la curva que se incluye en el Certificado de Control de Calidad. Si no se cumplen estos criterios, el ensayo no se puede considerar válido y el test se debe repetir. Calcular la media de las densidades ópticas (Sólo para ensayos que se realicen por duplicado) Para cada calibrador, control y muestra, calcular la media de las DO de los duplicados de las lecturas. El porcentaje del coeficiente de variación (%C.V.) para cada duplicado de DO debe ser inferior al 15%. Dibujar la curva de calibración La curva de calibración se debe dibujar de forma automática o manual como sigue: dibujar la concentración de anticuerpos contra CIC en la escala logarítmica y la DO en la escala lineal para cada uno de los calibradores Automática - usar un Software validado y dibujar la curva que mejor represente a los datos. • Manual - usando un papel de gráfica semi-logarítmico, dibujar una curva entre los puntos (no una recta o punto a punto). Tratamiento de los puntos anómalos Si alguno de los puntos está muy alejado de la curva, éste se puede eliminar. Si la eliminación de este punto, hace variar mucho la curva y ésta no se asemeja en forma a la curva de calibración o bien hay más de un punto anómalo, se deberá repetir el ensayo. Cálculos de los niveles de autoanticuerpos y muestras diluidas Leer el nivel de los anticuerpos de CIC a partir de la curva de calibración. Los valores de los controles deben estar dentro del rango definido en el Certificado de Control de Calidad. Nota: Los valores de los calibradores se deben ajustar por un factor 100 para compensar la dilución 1:101 de la dilución de la muestra. No se necesitan más correcciones. Calibración del test El test esta calibrado en µg Eq/mL. Para la calibración se empleo un calibrador de referencia interno, contra una preparación referencia de la OMS de IgG humana agregada. Limitaciones del Procedimiento 1. 2. 3. Este kit debe ser usado tan sólo como una ayuda al diagnóstico. Un resultado positivo sugiere la presencia de determinadas enfermedades, pero debe ser confirmado por los síntomas cínicos y otros tests serológicos. Los resultados obtenidos con este ensayo no son una prueba diagnóstica de la presencia o ausencia de enfermedad. Nota: Los sueros pueden contener substancias interferentes tales como agentes quelantes, ADN, autoanticuerpos anti-C1q, factor reumatoide o inmunoglobulina monomérica. Valores Esperados El rango normal de determinó de sueros de 200 donantes de sangre normales adultos. Los valores se indican en µg Eq/mL Estos rangos deben considerarse orientativamente. Los tests ELISA son muy sensibles y capaces de detectar pequeñas diferencias en poblaciones de muestras. Se recomienda que cada laboratorio determine su propio rango normal, basado en población, técnica y equipos utilizados. Valores Esperados < 4.4µg Eq/mL 4.4 -<10.8µg Eq/mL >10.8µg Eq/mL Negativo No definido Positivo Rango Normal La concentración C1q-CIC se determinó EN sueros de 200 donantes de sangre de adultos normales. Los resultados se han resumido en el grafico siguiente. C1q-CIC se encuentran esporádicamente en la población normal como resultado de una infección y también pueden ser elevados tras comer. Con el fin de obtener un cut-off lógico para “normales reales”, las muestras de concentración elevadas han sido eliminadas por medio de tres ciclos iterativos, obteniendo así un cut-off de 4.4µg Eq/mL. Se ha fijado un rango dinámico entre 4.4 y 10.8µg Eq/mL, siendo los positivos ≥10.8µg Eq/mL. Partiendo de esto, 9/200 de las muestras normales fueron positivas con valores entre 11.6-13.5µg Eq/mL. 4 Rango normal Núm. de muestras 140 120 100 80 60 40 20 0 0-2 2.1-4 4.1-6 6.1-8 8.1-10 >10 C1q CIC ug Eq/mL Estos valores son a título orientativo. Se recomienda que cada laboratorio obtenga su propio rango normal. Características de funcionamiento Precisión La precisión intra- e inter-ensayo se determinó usando tres muestras dentro del rango de la curva de calibración. La mediana y el % C.V. para cada muestra están detallados a continuación. n=3 Muestra 1 Muestra 2 Muestra 3 PRECISIÓN INTER-ENSAYO Concentración (µg Eq/mL) 5.4 28.7 50.7 % C.V. 13.0 7.1 3.9 n=16 Muestra 4 Muestra 5 Muestra 6 PRECISIÓN INTRA-ENSAYO Concentración (µg Eq/mL) 5.3 24.0 67.4 % C.V. 7.2 5.5 7.5 Sensibildad Analítica La sensibilidad analítica se determinó de la concentración media + 2 SD de 20 determinaciones de diluyente de muestra. Esto equivale a 0.1µg Eq /mL. Especificidad, Sensibilidad y Concordancia relativas La especificidad, sensibilidad y concordancia relativas se determinaron comparando un kit EIA C1q-CIC alternativo con 48 muestras. 29 de muestras eran de donantes normales y 12 muestras de pacientes con SLE confirmado. EIA alternativo + BINDAZYME No definido C1q-CIC EIA Sensibilidad relativa Especificidad relativa Concordancia relativa + 14 1 0 No definido 4 0 1 95.0% 75.0% 83.3% 0 7 21 Para el cálculo de la sensibilidad, especificidad y concordancia relativas, los valores límite se consideraron positivos. 2 La correlación de valores de los dos kits dio un R de 0.80. Substancias Interferentes Se han añadido una serie de sustancias interferentes en algunos sueros para probar los posibles efectos interferentes. El método utilizado para verificar estas substancias se basó en el Interference Check A plus Kokusai Shiyaku, Japón. Substancia Bilirrubina F (libre) Bilirrubina C (conjugado) Hemoglobina hemolisada Quilo Factor reumatoide Concentración 18.3mg/dL 19.0mg/dL 490mg/dL 1930 unidades 500 IU/mL No se observaron interferencias con bilirrubina, hemoglobina y quilo. Por el contrario los factores reumatoides sí interferian. Por lo que se recomienda, antes de efectuar el test C1q-CIC, verificar el contenido a factores reumatoides en todas las muestras sospechosas. Rango de Detección El rango de detección del ensayo es de 1.23 - 100µg Eq/mL. 5 Esquema de la Placa 1 2 3 4 5 6 7 8 9 10 11 12 A B C D E F G H Resumen del procedimiento 1. 2. 3. 4. Añadir 100µL de cada calibrador, control y muestra diluida 1:101 a los pocillos. Incubar 30 minutos. Lavar. Añadir 100µL de conjugado a cada pocillo. Incubar 30 minutos. Lavar. Añadir 100µL de sustrato a cada pocillo. Incubar 30 minutos. Añadir 100µL de solución de parada a cada pocillo. Medir la absorbancia a 450nm. QUANTA Lite es una marca registrada de INOVA Diagnostics, Inc. Copyright 2012 Todos los derechos reservados© 6 Referencias 1. 2. 3. 4. 5. 6. 7. 8. Hay FC et al.: Routine assay for the detection of immune complexes of known immunoglobulin class using solid phase C1q. Clin. Exp. Immunol., 1976; 24: 396-400. Stanilova SA, Slavov ES: Comparative study of circulating immune complexes quantity detection by three assays - CIF-ELISA, C1q-ELISA and anti-C3 ELISA. J. Immunol. Meth, 2001; 253: 13-21. Van Hoeyveld E, Bossuyt X: Evaluation of seven commercial ELISA kits compared with the C1q solidphase binding RIA for detection of circulating immune complexes. Clin. Chem, 2000; 46:283-5. Lambert PH: WHO collaborative study for the evaluation of immune complexes in serum. Clin Lab Immunol., 1978; 1: 1-15. Espinoza LR and Osterland CK.: Circulating immune complexes. Their clinical significance. Future publishing Co., 1983. Abrass CK et al.: Correlation and Predictive Accuracy of Circulating Immune Complexes with Disease Activity in Patients with Systemic Lupus Erythematosus . Arthritis Rheum., 1980; 23: 273-282. Protein Reference Unit Handbook of Autoimmunity (3rd Edition) 2004 Ed A Milford Ward. J. Sheldon, GD Wild. Publ. PRU Publications, Sheffield. 14. Biosafety in Microbiological and Biomedical Laboratories. Center for Disease Control/National Institute of Health, 2007, Fifth Edition. Fabricante: INOVA Diagnostics, Inc. 9900 Old Grove Road San Diego, CA 92131 United States of America Technical Service (U.S. & Canada Only) : 877-829-4745 Technical Service (Outside the U.S.) : 00+ 1 858-805-7950 support@inovadx.com Representante Autorizado: Medical Technology Promedt Consulting GmbH Altenhofstrasse 80 D-66386 St. Ingbert, Germany Tel.: +49-6894-581020 Fax.: +49-6894-581021 www.mt-procons.com 624620ESP August 2012 Revision 3 7