Problemas Grupo 17
Anuncio
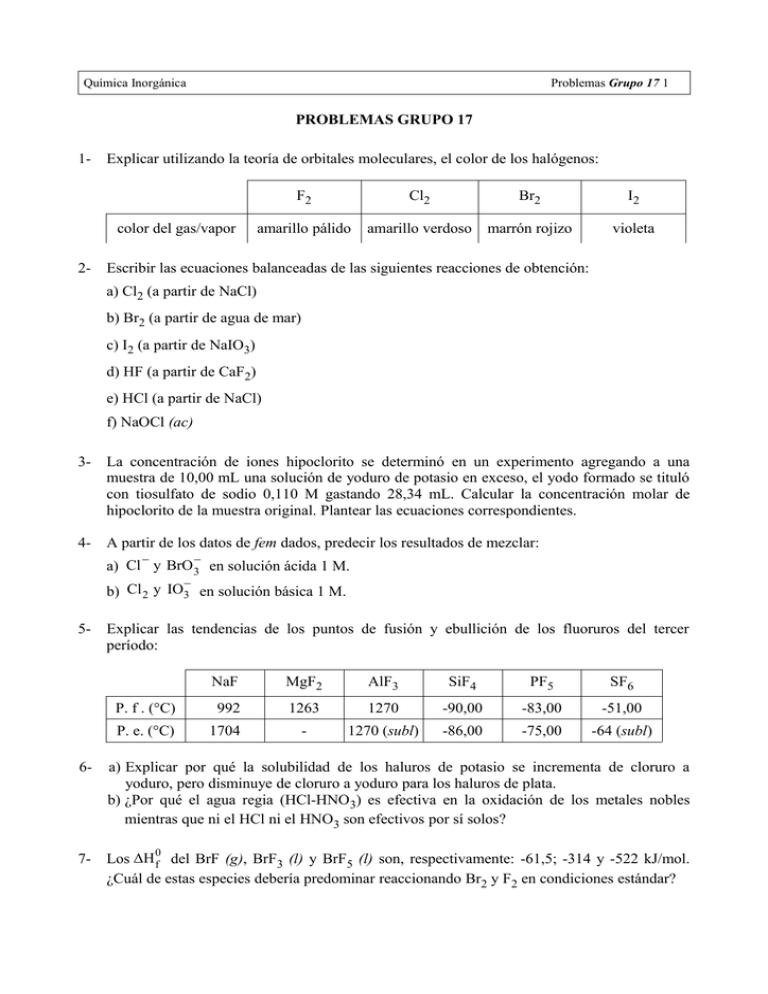
Química Inorgánica Problemas Grupo 17 1 PROBLEMAS GRUPO 17 1- Explicar utilizando la teoría de orbitales moleculares, el color de los halógenos: color del gas/vapor 2- F2 Cl2 Br2 I2 amarillo pálido amarillo verdoso marrón rojizo violeta Escribir las ecuaciones balanceadas de las siguientes reacciones de obtención: a) Cl2 (a partir de NaCl) b) Br2 (a partir de agua de mar) c) I2 (a partir de NaIO3) d) HF (a partir de CaF2) e) HCl (a partir de NaCl) f) NaOCl (ac) 3- La concentración de iones hipoclorito se determinó en un experimento agregando a una muestra de 10,00 mL una solución de yoduro de potasio en exceso, el yodo formado se tituló con tiosulfato de sodio 0,110 M gastando 28,34 mL. Calcular la concentración molar de hipoclorito de la muestra original. Plantear las ecuaciones correspondientes. 4- A partir de los datos de fem dados, predecir los resultados de mezclar: − − a) Cl y BrO 3 en solución ácida 1 M. − b) Cl 2 y IO3 en solución básica 1 M. 5- Explicar las tendencias de los puntos de fusión y ebullición de los fluoruros del tercer período: NaF MgF2 AlF3 SiF4 PF5 SF6 P. f . (°C) 992 1263 1270 -90,00 -83,00 -51,00 P. e. (°C) 1704 - 1270 (subl) -86,00 -75,00 -64 (subl) 6- a) Explicar por qué la solubilidad de los haluros de potasio se incrementa de cloruro a yoduro, pero disminuye de cloruro a yoduro para los haluros de plata. b) ¿Por qué el agua regia (HCl-HNO3) es efectiva en la oxidación de los metales nobles mientras que ni el HCl ni el HNO3 son efectivos por sí solos? 7- Los ΔH f del BrF (g), BrF3 (l) y BrF5 (l) son, respectivamente: -61,5; -314 y -522 kJ/mol. ¿Cuál de estas especies debería predominar reaccionando Br2 y F2 en condiciones estándar? 0 Química Inorgánica Problemas Grupo 17 2 8- Nombrar un compuesto interhalogenado catiónico, uno neutro y uno aniónico. En aquellos que constan de tres o más átomos ¿qué regla predice cuál es el átomo central? 9- a) ¿Por qué son violetas las disoluciones de I2 en CCl4 y pardas-rosadas las del mismo elemento en benceno? b) El I2 es casi insoluble en agua, pero se disuelve fácilmente en una solución de KI. ¿Por qué? c) ¿Por qué el flúor es más reactivo que los restantes halógenos? 10- El agua lavandina es una solución diluida de hipoclorito de sodio en agua. Explicar mediante sus potenciales redox, qué especies estarán presentes en una solución de lavandina. 11- a) Enumerar las propiedades de los óxidos de halógeno más comunes. b) ¿Cuáles son los oxácidos de halógeno más conocidos? Nombrar y escribir su fórmula general. Comentar sus fuerzas cómo ácidos. c) Escribir y nombrar los oxaniones de los halógenos. 12- a) Explicar la tendencia en los puntos de ebullición de los haluros de hidrógeno. b) Explicar el siguiente orden de energía de enlace: HF >> HCl > HBr > HI c) Ordenarlos en orden creciente de fuerza ácida. Justificar. 13- La deficiencia de yodo en la dieta puede provocar una hipertrofia de la glándula tiroides (conocida como bocio). El requerimiento de 1 mg de yodo por semana para la formación de tiroxina en el cuerpo humano suele satisfacerse por el consumo de sal de mesa yodada. Si la sal contiene 0,01 % de KI, calcular la cantidad de sal que debe ingerirse por semana. 14- El fluoruro de nitrilo es un reactivo gaseoso utilizado como propulsor de cohetes. Su composición en masa es 21,55 % de N, 49,23% de O y 29,23 % de F. La densidad del gas a 20 °C y 1 atm es 2,7 g/L. a) Determinar su masa molar y su fórmula molecular. b) Representar su estructura de Lewis y su geometría molecular. 15- ¿Qué son los clorofluorocarbonos y por qué representan un problema ambiental en relación con la capa de ozono?











