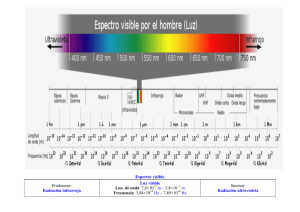
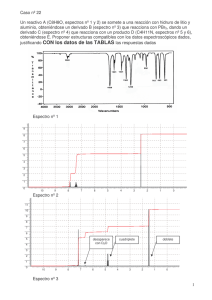
ESPECTROSCOPIA INFRARROJA
Anuncio

ESPECTROSCOPIA INFRARROJA INTERPRETACIÓN BÁSICA Y TABLAS RESONANCIA MAGNÉTICA PROTÓNICA REGLAS BÁSICAS DE INTERPRETACIÓN Y TABLAS REGLAS BÁSICAS DE INTERPRETACIÓN DE RESONANCIA MAGNÉTICA PROTÓNICA 1.- Si el espectro presenta señales de 0.5 a 4.5 ppm tu compuesto presenta grupos saturados que pueden ser metilos o metilenos. 2.- Si el compuesto presenta señales de 4.5 a 9 ppm tu compuesto puede presentar instauraciones (dobles ligaduras, anillos aromáticos o heterociclos). 3.- Grupos de protones equivalentes (en el mismo medio ambiente) presentan una sola señal en el espectro. Cuando dos grupos protonados no equivalentes se encuentran vecinos interaccionan entre si presentando cada grupo multipletes en el espectro. 4.-Si el espectro presenta señales de 1 a 4.5 ppm con multiplicidad donde la constante de acoplamiento (separación entre los picos de un multiplete medida en Hz) es un valor constante, se dice que el espectro es de primer orden y puedes conocer los grupos de que se trate aplicando la regla: el número de señales esperadas para un grupo protonado es igual al número de hidrógenos vecinos mas uno. 5.- Si el espectro presenta señales alrededor de 1.0 ppm puede que en su estructura esté presente el grupo metilo. 6.- Las señales se desplazan a bajo campo a medida que aumenta la densidad electrónica vecina al grupo por determinar. 7.- Si el espectro presenta señales múltiples arriba de 4.5 ppm y la constante de acoplamiento tiene diferentes valores el espectro es de segundo orden, en ese caso se debe proceder a medir el valor de las constantes para saber la disposición de los hidrógenos en la instauración. 8.- Si el espectro es de segundo orden y tiene señales alrededor de 7.0 ppm es probable que en su estructura presente anillos aromáticos. 9.- Si el compuesto tiene anillos aromáticos con grupos funcionales donadores de electrones las señales se desplazan a alto campo (menos de 7.3 ppm), si los grupos funcionales que sustituyen a protones del anillo son atrayentes las señales se desplazan a bajo campo (más de 7.3 ppm). 10.- Para conocer el número de hidrógenos que representa cada señal, es necesario integrar el espectro, para esto si conoces la fórmula molecular del compuesto, divide la integración total entre el número de hidrógenos que tenga, así conocerás el valor de integración por protón. Si es factible caracterizar inequívocamente una señal del espectro y por lo tanto conoces el número de hidrógenos que representa, divide el valor de integración de esa señal entre el número de hidrógenos y podrás conocer la integración por protón. MINIMA INFORMACIÓN NECESARIA PARA INTERPRETAR UN ESPECTRO DE MASAS 1.- Un espectro de masas es el registro de la masa de los iones producidos por una molécula y la abundancia con la que se presentan. 2.-El ión molecular (M+) del espectro de masas es el ión que aparece a masa más alta, representa la masa molecular del compuesto menos un electrón. 3- La primera pérdida después del ión molecular debe ser una pérdida lógica. 4.- La masa molecular de un compuesto obtenida por espectrometría de masas representa la suma de los pesos atómicos de los isótopos más abundantes. 5.- Los iones formados con los isótopos menos abundantes se registran en el espectro. 6.- El cloro tiene dos variedades isotópicas 35Cl con una abundancia aproximada del 75% y 37Cl con abundancia aproximada del 25%, por lo tanto, en el espectro de masas se evidencia la presencia de cloro cuando el ión molecular está acompañado de un ión dos unidades de masa mayor y con una abundancia de la tercera parte del ión molecular. 7.- El bromo tiene dos variedades isotópicas 79Br con una abundancia aproximada del 50% y 81Br con abundancia aproximada del 50%, por lo tanto, en el espectro de masas se evidencia la presencia de bromo cuando el ión molecular está acompañado de un ión dos unidades de masa mayor con una abundancia casi igual del ión molecular. 8.- Un compuesto que presente en su espectro de masas el ión molecular con masa non tendrá un número non de nitrógenos en su estructura. 9-El ión que se forma con mayor abundancia es el pico base del espectro