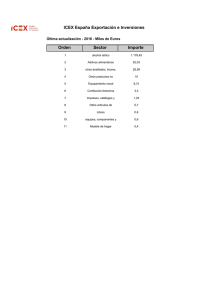
Teórica 2 (29-02 tarde) Anexo
Anuncio

01 Curso de Postgrado: Histología animal comparada: técnicas básicas para microscopía óptica y electrónica (marzo 2016). Técnicas Especiales para grupos de Invertebrados. Sexta Edición 2015 Índice de las pantallas al final Λ=Զ=Z MATERIAL DE DOCENCIA PARA CONSULTA No utilice este material didáctico fuera de contexto. Si no es capaz de desarrollar algo semejante, cite la fuente. . Histología Especial: Para cultivos especiales consultar: denaha@bg.fcen.uba.ar En este apartado vamos a describir metodologías aplicadas a grupos de organismos. 02 Protistas con afinidad animal: Ya hemos hablado de las coloraciones para frotis, las cuales se aplican perfectamente aquí. Especialmente nos hemos referido brevemente, a la coloración de bacterias, hongos y las técnicas aplicadas para los estudios parasitológicos (Pantalla 24). Muestreo: La forma de obtención esta directamente relacionada con el hábitat donde estos organismos se encuentran. Ellos aparecen en lugares comunes de muestreo como plancton o bentos, pero ciertos organismos se concentran en lugares poco habituales de la naturaleza: la película superficial de algunos cuerpos de agua, la espuma de mar, el fango; son ejemplos de lugares que deben ser considerados en el momento de hacer un muestreo para protistas. Otro planteo diferente es cuando hay que considerar a los simbiontes, comensales o parásitos. En estos casos deben ser ubicados los hospedadores respectivos, para disponer de los organismos que conviven con ellos. Para una mayor comprensión se dividirá a los protistas según la forma de locomoción. Para cada subgrupo existen distintos tratamientos, ya que se busca dejar expuestas ciertas partes celulares especiales que sirven a la taxonomía o a su descripción, como tipos y distribución de cilias, flagelos, estructuras esqueléticas, de protección tantos secretadas como agregadas, etc. Paramecium Vorticela Amebas Pseudópodos Chaos Flagelados Parásito intestinal Ciliados Giardia . Histología Especial: Protistas con afinidad animal: (continuación) 03 Propósitos Generales: Se unta un portaobjetos o mejor un cubreobjetos con albúmina glicerinada. Se agrega una gota de cultivo o de la muestra viva, se extiende y se deja reposar unos minutos, que no se seque. Se fija con el líquido de Schaudinn [bicloruro de mercurio saturado en frío 6 – 7 %, 2 partes; alcohol etílico absoluto o de 95 %, 1 parte; en el momento de usar se debe agregar ácido acético glacial al 1 %], durante unos 5 minutos. Hidratar y defijar el mercurio. Teñir con hematoxilina – eosina; se sugiere hematoxilina de Carazzi – eosina alcohólica o un carmín borásico de Grenacher. Otros fijadores: también se puede fijar con los siguientes líquidos de Bouin, Clarke (Carnoy) [alcohol etílico absoluto 30 mililitros; ácido acético glacial, 10 mililitros]; Champy [ácido crómico al 1 %, 7 partes; dicromato de potasio al 3 %, 7 partes; tetróxido de osmio al 2 %, 4 partes], Da Fano [formol, 15 mililitros; nitrato de cobalto, 1 gramo; agua destilada, 100 mililitros] (Trégouboff & Rose, 1957; Kudo, 1968). Se recomienda el ácido crómico de 0,5 a 1 %. Amebianos: Actinópodos: se puede utilizar alcohol etílico de manera general, observando las piezas esqueléticas y de protección, lóricas, caparazones y conchas. Por supuesto que el alcohol etílico debe estar libre de ácidos. Se recomienda realizar varias pruebas previas para constatar la integridad de las piezas esqueléticas y de protección. Foraminíferos: Solución Madre: bórax, 30 gramos en 1 litro de formol (o hexametilentetramina, 200 gramos por litro) (nunca glicerofosfato de sodio) (se puede utilizar la Solución Madre directamente); Solución de Trabajo: 5 ml de la Solución Madre; propilen glicol, 4,5 mililitros; propilen fenoxetol, 0,1 mililitros; 90 ml de plancton en agua de mar. pH 8,2; Relación animales, fase líquida 1:9. Se mantiene entre 5 y 15 °C. Se guarda en frascos de 10 ml bien tapados. Acantarios: Se agrega cloruro de estroncio (SrCl2.6H2O), para que no se disuelvan las espículas, pero no mucho porque puede precipitar sobre los organismos. Acantario, Acanthometron Globigerina . Histología Especial: Protistas con afinidad animal: (continuación) 04 Flagelados no calcáreos: Se fijan y se colorean con una solución yodada. Se agrega 1 mililitro de esta mezcla por 100 ml de muestra o gotas hasta color de té. Se decolora con tiosulfato de sodio al 1 %. Flagelados calcáreos: se procede como con los foraminíferos. No bajar de un pH 7. Ciliados: Como anestésico general se recomienda el sulfato de níquel al 1 % o más diluido. Se adiciona gota a gota. Es un veneno ciliar. Tintínidos: fijar con Schaudinn y colorear con Feulgen o Giemsa. Simbionte en cloaca de anfibios Parásito intestinal Amoeba, azul de toluidina Giardia, H - E Balantidium, H -E Los preparados se pueden montar en medios acuosos, aunque pueden perder color, o en medios deshidratados, donde se puede perder nitidez. Recomiendo por lo tanto hacer pruebas de coloraciones, variando tiempos y fundamentalmente montados en distintos medios. Los resultados buenos en un principio, cambian con el tiempo, y algunos preparados viejos, mejoran. . Histología Especial: Técnicas de Impregnación Argéntica Protistas con afinidad animal: (continuación) 05 Método para colorear microestructuras filamentosas e infraciliatura: La infraciliatura es el conjunto de fibras y estructuras que se encuentran por debajo de la membrana plasmática de los ciliados y como este tramado es constante sirve para clasificarlos. También este método sirve para describir el sistema basal de los flagelos y demás filamentos intracelulares. Para cortes existen otras técnicas de impregnación. Tetrahymena Método plata seco: confeccionar el frotis y secar al aire. Tratar entre 6 a 8 minutos por nitrato de plata al 2 %. Lavar y exponer a la luz solar con fondo blanco entre dos y ocho horas. Controlar reducción. Lavar, secar en estufa y montar directamente en bálsamo. Método plata húmedo: confeccionar el frotis y fijar en solución saturada de bicloruro de mercurio, 95 ml y 5 ml de formol comercial. Lavar bien (grifo y destilada) y tratar con nitrato de plata al 2 %, durante 20 minutos. Agregar agua destilada y exponer al sol entre 10 minutos y una hora, hasta reducción deseada. Lavar bien con agua destilada y durante 3 minutos cada uno, y montar. Método de Bodian modificado: hacer el frotis con albúmina glicerinada y luego fijarla con formaldehído al 10 % o Bouin - Hollande. Lavar con agua destilada y clarificar con hipoclorito de sodio al 2 % por no más de 30 segundos; sólo si es necesario porque hay mucha materia orgánica en el medio (no se aconseja). Secar los portaobjetos y luego tratar con proteinato de plata al 0,8 % (protargol en comercios). Colocar en estufa a 45 °C por 30 minutos. Enjuagar con agua destilada a la misma temperatura. Hidroquinona al 0,4 % (diluir de solución de sulfito de sodio al 5 % con hidroquinona al 1 %), no más de 30 segundos y revisar por microscopio (sacar enjuagar y observar; sí falta regresar a la solución de hidroquinona). Detener al lavar con agua destilada y tratar rápidamente Aspidisca con tiosulfato de sodio al 2,5 % por 30 segundo. Deshidratar y montar. Aclaración: haciendo los respectivos controles, se puede distinguir entre una sustancia argentafín cuando sólo reduce la plata, y una sustancia argirófila cuando la impregnación es posible con una reducción con mordientes, colocada antes o después. Si es argentafín es argirófila pero no al revés. . Histología Especial: Porifera: 06 Conservación en seco: escurrir, envolver en papel de diario y poner al sol, luego terminar de secar a la sombra en corriente de aire seco. Conservación en líquido: se escurre y se pasa al alcohol etílico 70 %. Propósitos histológicos: Debido a la presencia de espículas de sílice o de carbonato de calcio, y a la generación de una alta proporción de células con contenido de reserva (del tipo vitelo), se recomienda la siguiente técnica y luego continuar normalmente. Doble inclusión de celoidina – parafina de Peterfi: Material fijado en formaldehído deshidratación; alcohol absoluto; benzoato de metilo o acetato de butilo + celoidina (colodión) al 1 % (partes iguales) de 3 a 5 horas, 3 cambios, dejando en el último por 24 horas; 2 baños de benceno 15 minutos; benceno saturado de parafina a 30 °C en estufa por 15 a 30 minutos; parafina sola. Luego, refijar en Bouin o Zenker (no olvidar de desublimar o defijar) y descalcificar con líquido fijador de Jenkins o desilicificar. Es muy importante la elección del sentido del corte, para entender la estructura de la esponja . Histología Especial: Cnidaria y Ctenophora: 07 Anestesiar con el agregado de gotas de una solución de mentol (24 gramos en 10 ml de alcohol etílico absoluto), hasta crear una capa sobre la superficie del recipiente y tapar; se deja entre 12 y 16 horas; se fija. También se puede utilizar sales de magnesio, manganeso o anhídrido carbónico y se fija. Las actinias se anestesia con cloruro de magnesio. Para las medusas y sifonóforos se usa cloroformo gota a gota sobre el cultivo o también cloruro de magnesio. Fijar con paraformaldehído, 40 g; glicerofosfato de sodio, 5 g; agua de mar, 100 ml; probar con una dilución 1:9 de formol al 0,2 % de hidróxido de sodio, luego de unas horas pasar al formaldehído al 4 %; dejar extender el animal en muy poca agua y añadir igual volumen de Bouin caliente (70 °C), luego de unos minutos pasar a Bouin a temperatura ambiente y dejar actuar durante unas 12 horas, se lava varias veces con alcohol etílico 70 % y guardar en esta concentración. En estos animales las técnicas histológicas son muy difíciles de realizar, debido a la poca densidad celular y a la existencia de una alta proporción de agua en la sustancia intercelular. Cualquier método que endurezca el tejido, merece ser probado. Los hidrozoos se estudian mediante transparentados. Las anémonas aceptan bastante bien los procesos histológicos. Las medusas y los ctenóforos se distorsionan mucho con la deshidratación, pero mantienen su morfología. En este último caso es mejor deshidratar todo el ejemplar y luego trozarlo para la inclusión. Hidrozoo Medusa Anémona Ctenóforo . Histología Especial: Cnidaria: (continuación) 08 Para medusas y ctenóforos: al fijar sólo usar formaldehído al 4 o 5 % tamponado con bórax (no hexaminas). Para que las medusas, no se contraiga se puede sumergir previamente, en agua dulce. Se pueden conservar en glicerina, 20 partes; alcohol etílico 70 %, 40 partes; agua 40 partes; cambiar el líquido poco a poco. Platyhelminthes: (de vida libre) Anestesiado: Para propósitos generales se pueden utilizar cloruro de magnesio al 8 %, hidroxilamina al 1 % (en marinos); o gotas de alcohol etílico al 10 % o cloruro de magnesio al 2,5 % (de agua dulce). Los gusanos planos libres (microturbelarios), se pueden narcotizar con alcohol etílico 10 %, agregado muy lentamente al cultivo. Fijación: Procedimiento 1: dejar que se desplacen por el fondo del recipiente y cuando están estirados cubrirlos con sublimado ácido de Steinmann – Breslav [un volumen de ácido nítrico; un volumen de cloruro de mercurio al 5 % en solución fisiológica; un volumen de agua destilada]; se lava en alcohol etílico 30 %; desublimar con alcohol etílico yodado y conservar en alcohol etílico 70 %. Procedimiento 2: Gotas de ácido nítrico al 2 %, cuando muertos, fijar con 0,7 % de cloruro de sodio en solución saturada de sublimado corrosivo (bicloruro de mercurio) 30' => alcohol etílico 70 % yodado => alcohol etílico 70 %. En general, se puede fijar en líquidos Dalyellia viridis, un fijadores que contengan cloruro de microturbelario mercurio, desublimar y pasar a alcohol etílico 70 %. Es aconsejable también utilizar Bouin caliente. Los temnocéfalos Temnocéfalo, se los fija en líquidos fríos. simbionte de cangrejos de agua dulce . Histología Especial: Platyhelminthes: (continuación) 09 Fijación de helmintos parásitos. Método de Brumpt: se extrae el parásito del medio y se lo coloca en un portaobjetos; se pasa una o dos veces por la llama de un mechero Bunsen y se fija en una parte de formaldehído 5 % y cuatro partes de alcohol 96 % . También se aconseja usar Bouin caliente (+ o – 50 °C) entre dos portaobjetos. Cestodo Monogeneo Trematodo Planaria de tierra (Bipalium) Fijación de planarias: Colocar la planaria sobre un portaobjetos y se le agrega unas gotas de fijador para atontarlas y rápidamente colocarle un cubreobjetos y sumergir todo en fijador (Zenker o Bouin). El ácido acético a bajas concentraciones las atonta. Planaria transparentada, coloreada con carmín Planarias, difíciles de fijar, mucha práctica y paciencia. También probar con Bouin caliente. Planaria con “coloración natural” Alimento con colorante . (Nemertea, Priapulida, Sipunculida, Echiurida, 10 Enteropneusta, Pterobranchia) Gusanos no segmentados marinos: Histología Especial: Anestesiado: Este paso es muy importante ya que para la determinación de estos animales se necesita que estén bien relajados, especialmente si poseen tentáculos y se necesita que se encuentren desplegados para una buena observación. En forma general se anestesian con sulfato de manganeso, monohidratado al 2 % o solución de cloruro de magnesio hexahidratado, al 7,5 % o sulfato de magnesio heptahidratado al 20 %, en el agua de mar, o solución fisiológica isotónica. Mezclar partes iguales del cultivo o del medio donde se encuentran los organismos y esta solución. Probar porque las soluciones de sales de magnesio o manganeso dan resultado disímil. Se aconseja dejar a los animales que se distiendan en un recipiente con agua de mar; agregar gotas de una solución de mentol en alcohol Echiurida etílico, hasta crear una capa sobre la superficie del recipiente y tapar, que las corrientes de agua con alcohol etílico no lleguen a los animales; se dejan entre 12 y 16 horas. Cuando no reaccionen, se disponen como uno quiere y se los fija. Para que el introvertio de los priapúlidos y sipuncúlidos quede hacia fuera, es necesario ejercer alguna presión, especialmente luego de la anestesia y antes de la fijación. Nemertea Sipunculida Priapulida . (Nemertea, Priapulida, Sipunculida, Echiurida, 11 Enteropneusta, Pterobranchia.) Gusanos no segmentados marinos: Histología Especial: Fijación: Luego de una buena anestesia no es importante la fijación. Ésta puede ser con formaldehído 2 % tamponado o con alcohol etílico al 96 %. Para fines histológicos pueden utilizarse un gran número de líquidos fijadores, pero dan muy buenos resultados los que tienen en su composición bicloruro de mercurio. Se puede utilizar el líquido de Kleinenberg o picrosulfúrico [agua saturada con ácido pícrico, con 2 % de ácido sulfúrico], utilizar en forma directa o diluyéndolo con 3 volúmenes de agua isotónica y se puede utilizar para todos los animales. También con alcohol etílico 70 % al 0,5 % de ácido crómico, se pueden conservarlos en este líquido. El Bouin, el Bouin – Hollande y el Helly, dan buenos resultados pero las coloraciones pueden ser poco brillantes. Se conservan en alcohol 70 %, con hasta 10 % de glicerina. Enteropneusta Pterobranchia (colonia) . Histología Especial: Nematoda: 12 Anestesiado: Se narcotizan con gotas de cloroformo agregadas al medio, hidrato de cloral en solución al 10 %, sulfato de magnesio al 20 %, en la solución fisiológica o agua de grifo declorada. Siempre hacer pruebas, aislando a los animales y anestesiarlos por separado. Fijación: Probar con los siguientes procedimientos: con calor, luego se conservan en formaldehído al 5 %; con formaldehído al 5 % caliente a 40 o 50 °C; con FAAGO [formol comercial, 5 ml; alcohol etílico 50 %, 90 ml; glicerina, 1,5 ml; ácido acético, 2 ml; trazas de ácido ósmico], caliente a 50 °C; con solución saturada de cloruro de mercurio, sólo o con formaldehído al 4 % (aa), se puede usar caliente o fría; con 1 volumen de formol, 1 volumen de ácido acético, 8 volúmenes de agua destilada; con 10 ml de alcohol etílico 96 %, 30 ml de formol, 5 ml de ácido acético, 200 ml de agua destilada; con formol ácido [formol, 10 ml; ácido acético, 10 ml; agua destilada, 10 ml]. Los nematomorfos se pueden tratar de la misma manera. Los preparados se realizan dejando reposar a los animales en muy poco de agua de cultivo y adicionarle el mismo volumen de formol ácido caliente a 50 °C (no dejarlos mas de 24 horas); se pasan a glicerina y se colocan en cámara de evaporación (bajo vacío y ligeramente caliente a 25 °C); se montan a los animales directamente en glicerina nueva. Enjuagar el fijador. Otra forma es fijar en formol ácido; se pasan a una mezcla de formaldehído al 5 % y lactofenol [ácido láctico, 46 ml; fenol, 60 ml y glicerina 96 ml] al 5 %, evaporar a 40 °C; lactofenol puro y cementar. Se puede usar esmalte de uñas como cementante. Se pueden colorear con trazas de azul de algodón o fucsina ácida (0,1 %) en la mezcla de formol y lactofenol. Deshidratar mediante la solución: 20 partes de alcohol 96 %, 1 parte de glicerina y 79 partes de agua y colocar el recipiente en cápsula cerrada con alcohol 96 %. Pasar a 5 partes de glicerina y 95 de alcohol 96 %. . Histología Especial: 13 Annelida: Anestesiado: Polychaeta: con alcohol etílico 70 % gota a gota, en el agua de mar; se mezcla partes iguales de agua de mar y una solución al 7,5 % de cloruro de magnesio hexahidratado, o una solución al 20 % de sulfato de magnesio monohidratado. Para los tubícolas se puede usar hidrato de cloral al 0,2 %. Oligochaeta: primero purgarlos dejándolos en caja de Petri, con papel de filtro por 48 horas, húmedos y sin luz. Utilizar alcohol etílico 10 % agregado gota a gota en el agua de cultivo (microdrilos) o agua declorada (megadrilos), hasta que pare de moverse y adicionar hasta insensibilidad. Si el animal se excita tratar con menos concentración. Probar con hidrocloruro de hidroxilamina al 2 %. Hirudinea: Igual que con los oligoquetos. También con cloroformo o clorhidrato de cocaína, durante 1 a 5 horas hasta que no reaccionen al ser estimulados con un pincel. Poliquetos (marinos) Hirudíneos (de agua dulce y terrestres) Oligoquetos megadrilos (terrestres) Oligoquetos microdrilos (de agua dulce) . Histología Especial: Annelida: (continuación) Fijación: Polychaeta: Para todos planctónicos y bentónicos se usa formaldehído al 2 % tamponado o alcohol etílico 70 % o alcohol etílico 70 % con Chaetogaster limnaei / un 3 % de yodo, lavar con alcohol etílico 70 %, Biomphalaria tenagophila tres veces. También se puede usar, Bouin a 60 °C, Forético y depredador en pequeño volumen hasta muerte y luego Bouin normal durante 1 a 3 horas y pasar a alcohol etílico En el caso especial de los poliquetos, es mejor 70 %. Para cortes histológicos dan excelentes sacarles las acículas y la resultados los fijadores que contengas mercurio. mayoría de las quetas Las soluciones de formaldehído o alcohólicas, se luego de la fijación, pueden dejar por mucho tiempo, pero luego se debido a que al realizar deben pasar al alcohol etílico al 70 %, con un 10 los cortes histológicos % de glicerina. Los tubos o habitáculos se deben puede arrastrar tejido y dejar en alcohol etílico 70 %, los calcáreos deben perder datos importantes. En estar protegidos contra la disolución con oligoquetos con muchas soluciones tamponadas. quetas (Megascolecide) Oligochaeta: Macrodrilos: fijarlos con alcohol también puede ser útil etílico 70 %, Bouin o Zenker. realizar los cortes luego Microdrilos: se fijan directamente con Schaudinn de la zona de quetas. (desublimar) o alcohol etílico 70 %. Es muy importante Otros fijadores: Baker, Bouin o Zenker. Cortar el purgar los oligoquetos extremo posterior de los animales para que el terrestres, para que no se dañen los tejidos ni fijador penetre. la cuchilla. Hirudinea: Con Schaudinn o alcohol etílico 50 % formaldehído 2 %, mitad y mitad. Se conservan en Glossiphonia (hirudíneo con alcohol etílico 80 % o formaldehído 5 %. probóscide que pueden protruir) 14 . 15 Histología Especial: Mollusca: En general: Anestesiado: Probar con sales de cloruro de magnesio; solución al 1 % de una mezcla de acetona – cloroformo; mezcla de 1 parte de glicerina, 2 partes de alcohol etílico 70 %, 2 partes de agua de mar; solución de hidrato de cloral al 0,1 %; solución saturada de mentol en alcohol etílico 70 % o 96 %, agregar gotas sobre la superficie del cultivo (5 o 6) de acuerdo con la superficie del recipiente y tapar. Cuando los animales no reaccionan al pincharlos se retiran de la concha y se los fija. Pulpos Calamares Sepias A los cefalópodos se le coloca en el saco visceral un algodón con éter o cloroformo. Los poliplacóforos necesitan que los anestesien y los dispongan, antes de fijarlos, atados a trozos de vidrio o material plano inerte, para que queden estirado, con el pie lo más plano posible. Quitón . Histología Especial: Mollusca: (continuación) Hay que cuidar las estructuras de carbonato de calcio. 16 Fijación en general: solución al 4 % de formaldehído neutralizado y tamponado a pH 8; líquido de Bouin, ojo, deteriora las conchas; líquido de Newcomer [6 partes de alcohol etílico isobutílico, 3 partes de ácido propiónico, 1 parte de éter de petróleo, 1 parte de dioxano, 1 parte de acetona], deteriora las conchas y es peligroso; animales con conchas en alcohol etílico 70 % libre de ácido. No se usa hexaminas. Los cefalópodos necesitan de inyecciones con fijador para acelerar la fijación interna, especialmente en la cavidad paleal y en la cavidad general, en pulpos se recomienda una inyección en la “cabeza” y por la boca. Gastropoda: Anestesiado: Para los caracoles terrestres se utiliza un método poco ortodoxo, sumergir a los animales en agua, no permitiéndoles que tomen aire. Para los animales de agua dulce se puede utilizar gotas de una solución de mentol en alcohol etílico. Se puede inyectar cocaína al 2 % a nudibránquios y tectibránquios, para anestesiarlos. nudibránquios tectibránquios . 17 Histología Especial: Mollusca: (continuación) Bivalvia: Se anestesian con alcohol, hidrato de cloral, cocaína o derivado artificial. La fijación es igual a los gasterópodos. Para el estudio de las conchas, se pueden tratar con agua caliente (70 °C) hasta que se abran las conchas y conservarlos en alcohol etílico 70 %. No usar formaldehído no tamponado. No se tampona con hexaminas, porque ablandan las valvas. Bivalvo de agua dulce Bivalvo marino Moluscos planctónicos: se narcotizan con sales de cloruro de magnesio; 1 % de acetona cloroformo (Pruvot-Fol, 1924); 1 parte de glicerina, 2 de alcohol etílico 70 % y 2 de agua de mar; o hidrato de cloral, 0,1 %. Un agente como el frío es muy útil en los momentos previos a la fijación. Solamente dejar a los animales en una heladera o con hielo y agua que baja la temperatura a 4 °C o 0 °C, respectivamente. Limacina Clio . Histología Especial: Mollusca: (continuación) 18 La fijación para estudios sistemáticos basados en las conchas: dejarlos en alcohol etílico 70 % libre de ácidos y con glicerina, o formaldehído al 3 o 4 % tamponada en agua de mar y neutralizar la solución fijadora. Otra forma de preparar conchas de moluscos es fijarlos en alcohol etílico al 75 %, en el campo; en el laboratorio hervirlos y separar partes blandas de la concha y poner ambas en alcohol etílico 60 %, luego de 24 o 36 horas y cambiar al alcohol etílico 70 %. El opérculo se pega con algodón y se ubica dentro del ultimo anfracto (vuelta). Los colores de las conchas se reavivan mediante una solución de aceite para niños. Para propósitos histológicos: formaldehído al 4 % en agua de mar y neutralizado; Bouin; Newcomer [6 partes de alcohol etílico isopropílico; 3 de ácido propiónico; 1 de éter de petróleo; 1 de dioxano y 1 de acetona]; solución de Perenyi [4 partes de ácido nítrico al 10 %; 3 de alcohol etílico 70 % y 3 de ácido crómico al 0,5 %]; todos durante 5 horas. Para histología de órganos específicos se recomienda retirar el órgano y fijarlo por separado. En caso de animales grandes se deben inyectar fijador, especialmente en la cavidad general. . Histología Especial: Mollusca: (continuación) 19 Adicional: Para estudios anatómicos, sacar a los gasterópodos terrestres y de agua dulce de sus conchas, mediante agua a 70 °C, o colocarlo en congelador durante unos minutos. No servirían para histología, ya que no se protegen los tejidos. Para rescatar sólo las conchas: se matan por mentol durante 24 o hasta 3 días en invierno y hervirlo por 20 minutos a media hora; retirar con pinza las partes blandas, si queda algo dejar uno o dos días en agua hasta que se pudra y sacar con chorro de agua. Si no importa la concha, se puede fijar y descalificar con el líquido de Jenkins o se puede usar un descalcificador por intercambio aniónico como el hexametafosfato de sodio al 5, 10, 20 % durante 24 horas cada una de las soluciones. Sistema nervioso de pulmonados: se fijan con 6 parte de ácido acético en 100 ml de alcohol etílico 90 %, o 15 o 20 minutos de bicloruro de mercurio 5 % en ácido acético al 5 %; se colorean con azul de metileno al 1 % de 12 a 24 horas. Rádulas: se colocan la cabeza en hidróxido de potasio o sodio al 10 % una hora o hervirlos. Se pueden colorear: Solución A: Ácido pícrico, 1 g; carmín, 0,5 g; agua destilada, 100 ml. Hervir durante 10‘, enfriar y filtrar. Solución B: azul de anilina al 1 % en ácido acético al 1 %. Uso: Acidificar mediante ácido acético al 1 % durante 20 o 30 minutos. Solución A durante 15' o 20‘ o a 60 °C. Diluir B en el momento de usar 1:1 con agua destilada, de 30" a 1'. Deshidratar y montar. La Solución A se puede usar durante 30‘ y la B diluida 1:3, poner y sacar; diferenciar en alcohol 70 % y 96 % durante mucho tiempo para que salga el color. Rádulas de moluscos . 20 Histología Especial: Generalmente, tanto en gusanos como en moluscos, se desarrollan técnicas histológicas para estimar el grado de maduración de los animales, por lo que se realizan cortes de las gonadas, uno de los estudios más simples en histología. Para lo cual, no se necesita una metodología específica, se pueden seguir desde lo indicado para vertebrados, hasta algunas cosas dichas aquí, en la parte de Histología General. Se pueden medir los tamaños de los huevos para inferir la etapa de maduración en que se encuentran los animales. Atención: hay que estimar el grado de deshidratación para calcular el tamaño verdadero. Con el peso de la gonada se puede estimar además, Gonada madura de un crustáceo; Astacus, langostino. la cantidad muy aproximada de huevos maduros. Etapa juvenil Etapa madura Etapa prerreproductiva Distintos estados en la maduración de la gonada de un quitón . Histología Especial: Arthropoda: Insecta 21 Anestesiado: El alcohol etílico, el éter de petróleo, cloroformo, cianuro de potasio o tetracloruro de carbono, son las drogas de mayor uso para anestesiar a insectos. OJO con el cianuro de potasio y el tetracloruro de carbono. Langostas Grillos Cucarachas En muchos insectos es muy necesario el anestesiado debido a que muchos poseen apéndices (antenas, patas, alas, ovipositor, cercos, órganos sensoriales) muy delicados, que en el proceso de muerte pueden ser eliminados o rotos. Muy especialmente si se utiliza alcohol etílico 70 %. Mántidos Fijación: Para los imagos (adultos) se puede utilizar alcohol etílico a 70 % es el mejor de los fijadores. Para conservarlos es mejor agregar un 5 % de glicerina. El siguiente método sigue dando muy buenos resultados; método de Hennings (1900): acido nítrico concentrado, 16 ml; ácido crómico al 0,5 %, 16 ml; solución saturada de sublimado en alcohol etílico absoluto, 24 ml; y saturada de ácido pícrico, 12 ml. Tratamiento para que la quitina se ablande: a) agua de Javel (hipoclorito de sodio, agua lavandina); b) agua o licor de Labarraque (hipoclorito de potasio) diluir de 4 a 6 veces y tratar de 10 a 24 horas. . Histología Especial: 22 Arthropoda: Crustacea Anestesiado: Utilizar alcohol etílico al 10 %, agregado gota a gota. Fijación: En general se fijan con: 1) solución de 3 o 4 gramos de bórax en 100 ml formol (dura 1 o 2 meses) y se filtran. Se reserva. 2) solución anterior (1), 5 ml; propilen fenoxetol, 0,5 ml; propilen glicol, 4,5 ml; agua de mar, 90 ml. pH 7,6 a 8,3; se debe mantener la relación 1:9, entre animales y volumen. Se preservan en alcohol etílico 70 %, pero subir gradualmente desde el agua destilada con 30 %, 50 % y 70 %; durante 1 hora por cada solución. Los animales grandes se anestesian y se les inyecta el fijador. Siempre es mejor retirar los órganos por disección y tratar aparte. Para cladóceros, copépodos y, llevar la muestra a formaldehído al 4 % de a poco, filtrar y pasar a alcohol etílico 96 % con 40 ml de glicerina por litro, para que no se sequen completamente, sí se abren los frascos. Para contar o clasificar los animales se puede pasar a formaldehído 2 %. Sí es necesario disminuir la tensión superficial usando detergente. Los ostrácodos se pueden fijar en alcohol etílico 70 %; filtrar en gasa o criba de nylon y sumergir durante unos segundos en agua hirviendo, para que las conchas se abran y se pueda determinar o censar. cladócero copépodo ostrácodo . Histología Especial: Arthropoda: Quelicerados (arañas, ácaros, opiliones, escorpiones, etc.) 23 Anestesiado: Si hace falta utilizar éter o tetracloruro de carbono. No permitir que los animales se lastimen entre ellos cuando se los coloca en el frasco matador. No dejar a los animales capturados vivos durante mucho tiempo, anestesiarlos hasta la muerte o fijarlos inmediatamente. Fijación: alcohol etílico 70 % directo. Para ácaros acuáticos (no parásitos): se usa únicamente la mezcla de Koenike: 10 partes de glicerina; 3 partes de ácido acético; 6 partes de agua destilada. Procedimiento para el montado de piezas: las parte blandas de los animales se hidroliza con hidróxido de potasio al 2 %, durante 24 horas, lavar bien y deshidratar dejando 1 o 2 ml de agua y el ejemplar, y añadir alcohol etílico 95 %, 3 cambios de 10 o 15 minutos; se coloca un fondo de glicerina en el portaobjetos de acuerdo con el ácaro tamaño del animal y colocar el animal desde el alcohol etílico 95 %. Sin hidrolizar fijar, dejar en formol o alcohol opilión etílico y montar en glicerina en todos los casos. araña escorpión . Histología Especial: Otros artrópodos: 24 Anestesiado: El éter de petróleo da excelentes resultados cuando el material biológico se encuentra en medio seco. Si esta en un medio líquido como agua de alguna forma de extracción Paurópodo (embudo de Tullgren o luego de lavar tierra), Notostracos Tardígrados agregar alcohol etílico en gotas, si es necesario. Probar mezclando partes iguales del cultivo o donde se encuentran los organismos y alguna de estas soluciones: solución de cloruro de magnesio hexahidratado, al 7,5 o sulfato de magnesio heptahidratado al 20 %, en el agua de mar, isotónica; solución de cloruro de manganeso Bicho bolita hexahidratado al 2,5 % en agua dulce, isotónica; alcohol etílico al 10 %, agregar gota a gota hasta que se queden quietos y agregar más; solución de mentol en alcohol etílico (24 gramos en 10 ml de alcohol etílico absoluto). Ciempiés Fijación: Se usa alcohol etílico 70, 85 o 96 %, caliente o no, o formaldehído 5 %. Se aclara con creosota o hidróxido de potasio al 5 %. De las muestras completas fijadas se pueden extraer los animales, limpiarlos bien, porque generalmente están acompañado con partículas de sedimento. Se debe separar el material biológico, bajo lupa de binocular y luego separar los distintos grupos. Las larvas luego de anestesiadas puede ser fijadas en Bouin a 60 °C, adicionar de golpe al recipiente con poca agua y los ejemplares, luego de muertos, pasarlos a Bouin a temperatura ambiente, durante 1 a 3 horas y guardar en alcohol etílico 70 %. Las pupas necesitan de más tiempo de fijación, 12 horas. . Histología Especial: Un caso difícil 25 Los cirripedios son crustáceos, muy modificados, por estar adaptado a la vida sésil. Con paredes de carbonato de calcio, muy espesas. Para hacer un estudio sobre su maduración se deben cortar unos 30 animales, 5 mm de largo. Partimos del formaldehído al 5 %; se los descalcifica (Jenkins); se refijan en Bouin – Hollande; se los incluyen en parafina y se los corta sabiendo que la gonada se encuentra en la parte basal del animal. Se diferencian machos de hembras y se catalogan los distintos estados de maduración de las hembras. Notobalanus flosculus 1: tejido basal (conectivo basal). 2: corte del ovisaco en crecimiento. 3: ovisacos maduros. 4: oocitos maduros. Gonada Se detectaron 6 estados del desarrollo; tres relacionados con el tejido basal y 3 basados en los oocitos. Se observan los daños producidos por el ácido clorhídrico durante la descalcificación. . Histología Especial: 26 Echinodermata: Anestesiado: Este proceso no es necesario, pero se puede pasar por un ligero tratamiento con una solución de formaldehído al 2 % para tranquilizarlos. El agua dulce puede actuar como tranquilizante. Cuidar los apéndices en crinoideos y erizos. Fijación: estrellas, ofiuroideos, erizos y crinoideos se pueden fijar directamente en formaldehído al 4 % neutralizado y tamponado, y luego se los conservan en formaldehído al 2 %, recontraneutralizado y recontratamponado. Mejor se conservan Ofiuro en alcohol etílico neutralizado. También se recomienda fijar con Baker. Una forma general de tratamiento para animales secos (menos holoturoideos) es enjuagar muy bien con agua común de grifo, hasta que se pierda la mucosidad y luego secar rápidamente al sol, en estufa u horno, y envuelto en papel de diario. Se puede por disección vaciar a los erizos y presentar sólo la carcaza, limpia y seca. Pepinos de mar: se admite el anestesiado por pasaje por agua dulce, fijación por formaldehído al 4 % neutralizado, o alcohol etílico libre de ácido al 70 %, se puede conservar en esta última solución. Para las espículas se debe tratar al material lo menos posible. Seguir la metodología de espículas de esponjas. Estrella Erizo Pepino de mar . Histología Especial: Animales sésiles marinos: ejemplo briozoos. 27 Anestesiado: Se anestesian con sales de magnesio, manganeso o mentol. También se puede añadir formaldehído al 4 %, al agua donde están estirados de forma muy lenta (peligro de contracción). Ojo: existen Sertella beaniana membranosos y de carbonato de calcio. Fijación: Se fijan con formaldehído 2 % tamponado y cristales de mentol y tapar el recipiente, a las 24 horas, fijar con Bouin, Helly, alcohol etílico 70 % o formaldehído 10 %, conservar en los dos últimos líquidos. Estudios parasitológicos en general: Anestesiado: Se pueden utilizar cloruro de magnesio al 7,5 %, hidroxilamina al 1 %, alcohol etílico al 10 %, o hidrato de cloral al 2 %. Probar con gotas de ácido nítrico al 2 Fasciola %. Seguir los procedimientos publicados; cada grupo tiene su tratamiento. hepatica Lobatostoma manteri, un aspidogástreo parásito de intestino de peces Acantocéfalos, parásitos intestinales Nematodos (ver especial), trematodos, acantocéfalos, monogeneos y aspidogástreos, son los parásitos más comunes de encontrar. . 28 Histología Especial: Estudios parasitológicos en general: (continuación) Fijación: Para propósitos generales se puede usar el liquido de Lang (1878) [agua destilada, 100 partes; cloruro de sodio, de 6 a 10 g; ácido acético 5 a 8 ml; bicloruro de mercurio 3 a 12 g; alumbre, 0,5 g], de una a 24 horas. Se lava el mercurio con Lugol y luego pasarlo al formaldehído al 2 % o alcohol etílico al 60 %. En general, se puede utilizar fijadores que contengan cloruro de mercurio, desublimar y pasar a alcohol etílico 70 %. Los fijadores sin mercurio dan imágenes opacas luego de colorear. La metodología para la obtención de los parásitos es muy variada y algo complicada de exponer aquí. Se puede generalizar diciendo que el origen del material puede ser derivado de tegumentos, de vía intestinal, pulmonar y urogenital, y de disecciones. Para los tegumentos sirve la metodología Pulga del dada para artrópodos y las de hirudíneos. gato Generalmente estos animales se encuentran asociados a mucosidad, secreciones, heces, etc., al realizar frotis y en las muestras de heces, mediante disgregación, concentración por decantación o centrifugación. No hay que olvidarse de los estados larvales Huevos en heces Tenia . Histología Especial: Animales de agua dulce: 29 Los animales como los gastrotricos y los rotíferos se anestesian en la solución de Rouselet, modificada [eucaína o xilocaína al 2 %, 3 mililitros; alcohol etílico al 90 %, 1 mililitro; agua destilada, 6 mililitros]. Algunos productos farmacéuticos de uso externo poseen xilocaína en distintas proporciones. También con formaldehído al 4 %, añadido gota a gota a la muestra; cada 10 gotas (o menos) remover lentamente. Se fijan con ácido osmio, solución saturada de cloruro de mercurio, formaldehído 10 % o Bouin. Se conservan en alcohol etílico 70 % o formaldehído al 5 %. Luego de anestesiados, seguir añadiendo gotas de formaldehído al 4 % hasta alcanzar una concentración del 1 % aproximadamente y dejar actuar por una o dos horas. Luego de fijarlos cambiar la solución mediante filtrado a la solución conservadora. Se conservan en 2 a 5 % formaldehído y 2 % de glicerina. Gastrotrico Rotífero planctónico Rotífero bentónico De esta manera pueden ser tratados otros animales minúsculos del agua dulce, como las hydras. . Histología Especial: Animales del suelo: Muestras de tierra: Se anestesian y se fijan al mismo tiempo. red o Directamente se pasan al formaldehído al 4 % neutralizado cedazo con bórax o al alcohol etílico al 70 % libre de ácidos. Luego se separan los animales. La fauna indicadora, como artrópodos, anélidos y nematodos quedan bien preservados; muchos animales pequeños, como protozoos y rotíferos, se pierden. Metodología para separar los animales vivos: se utiliza el embudo de Tullgren. Bentos y animales bentónicos: Sedimento: Método 1: Anestesiado leve con separación, mediante corriente eléctrica continua (12 voltios). Los animales de mayor tamaño salen primero, también los de menor coberturas cuticulares. Posteriormente se fijan los animales por separados. Método 2: Los animales del sedimento se puede anestesiar en forma profunda, mediante una alta concentración del anestésico o largos tiempos de acción de ellos, y separación de los animales por diferencia de densidad del medio acuoso. Se colocan a las muestras en una solución de azúcar mayor al 30 % y se filtran los animales que flotan. Se recupera el líquido denso para otra muestra y los animales se fijan. Para la fijación se puede utilizar formaldehído al 4 % adicionado con bórax, con un pH 8 aproximadamente (tamponado). Conservar el alcohol etílico al 70 % libre de ácidos. En ambos casos se puede utilizar rosa de Bengala para visualizar los organismos que estaban vivos en el momento de la fijación. luz 30 muestra Recipiente con zona húmeda . Histología Especial: Bentos y animales bentónicos: 31 (continuación) Existen taxones que generalmente son encontrados directamente en las muestras de sedimentos marinos como los quinorrincos (Kinorhyncha). Son animales de muy pequeña talla por lo tanto muy fáciles de perder en tratamientos posteriores. Si en necesario se colorean con rosa de Bengala. Muchos de estos animales deben ser anestesiados, Quinorrínco utilizar una solución de cloruro de magnesio al 7,5 Con rosa Estado %. Fijarlos y conservarlos en alcohol etílico al 70 %. de Bengala fresco Si deben ser fijados con el sedimento marino, utilizar formaldehído al 4 % tamponado y por Loricíferos supuesto con varios cambios del fijador. Los Cephalocordata (anfioxos) se anestesian con una mezcla de partes iguales de agua de mar y solución al 7,5 % de cloruro de magnesio hexahidratado o solución al 20 % de sulfato de magnesio monohidratado, o solución de hidrato de cloral al 0,2 %. Se usa formaldehído al 2 % tamponado o alcohol etílico 70 %. Se conservan en alcohol etílico al 70 %, con un 10 % de glicerina. Anfioxo Branchiostoma . Histología Especial: Zooplancton: 32 Los poros de la red del plancton deben ser mayores a 100 micrones. Cuando se vacía el colector de las redes de plancton, se coloca en el recipiente, de forma conjunta, la muestra y el fijador. Para que se noten los animales adicionar por cada litro de formol de 0,5 a 1 gramo de rosa de Bengala. El fijador así preparado se diluye antes de usar en la proporción que corresponda. Así los animales pueden ser encontrados perfectamente entre el sedimento por su color rosado. Puede hacer falta una prueba de coloración. Plancton en fresco Plancton teñido con rosa de Bengala Posteriormente los animales son separados por taxón, determinados y cuantificados. Como suele suceder que las muestras contengan gran cantidad de animales, se debe cambiar el fijador las veces que sea necesario. Si el fijador no es el suficiente, puede haber casos de pudrición o liberación de grasas y aceites, que malogran la muestra. Por otro lado, el exceso de formaldehído, deshidrata los organismos. . Histología Especial: 33 Otras comunidades: Fitoplancton: por cada 100 ml de muestra, agregar de 2 a 3 gotas de una solución concentradas de Lugol acético (10 g de yoduro de potasio en 20 ml de agua destilada, más 5 g de yodo bisublimado, luego de disolución 50 ml de agua, más 7 ml de ácido acético o 5 g de acetato de sodio), luego adicionar formaldehído hasta un 2 %. Perifiton: se saca la vegetación litoral y sacudirla dentro de una red de plancton. Colocar la vegetación en jarros de vidrio y observar si hay animales que se desplazan sobre las paredes. También se puede colocar la vegetación dentro de una bandeja de fondo blanco y negro, sacudirla y dejar reposar durante un día y luego buscar en el fondo. Colocar portaobjetos entre la vegetación (con base de madera o telgopor) y dejar semanas o meses. Colocar trozos de la vegetación bajo la lupa, o tomar muestras para observar en microscopio. Pecton: Entre las rocas: lavar las rocas, cepillarlas, rasparlas y ver con lupa de mano. Psammon: hacer un pozo en la arena o en la tierra y esperar que se acumule el agua, luego tomar ese agua y pasarla por una red de fitoplancton. Perifiton Animales del psammon Pecton Fitoplancton Λ=Զ=Z MATERIAL DE DOCENCIA PARA CONSULTA No utilice este material didáctico fuera de contexto. Si no es capaz de desarrollar algo semejante, cite la fuente. . Técnicas Especiales para grupos de Invertebrados (Histología Especial): Protistas con afinidad animal. 02 Porifera. 06 Cnidaria y Ctenophora. 07 Platyhelminthes. 08 Gusanos no segmentados marinos. 10 Nematoda. 12 Annelida. 13 Mollusca. 15 Grado de maduración. 20 Arthropoda: Insecta. 21 Arthropoda: Crustacea. 22 Arthropoda: Quelicerados. 23 Otros artrópodos. 24 Ejemplo: cirripedios. 25 Echinodermata. 26 Animales sésiles marinos: ejemplo briozoos. 27 Estudios parasitológicos en general. 27 Animales de agua dulce. 29 Animales del suelo. 30 Bentos y animales bentónicos. 30 Zooplancton. 32 Otras comunidades. 33 34 .