Guía de Ejercicios Capítulo II
Anuncio

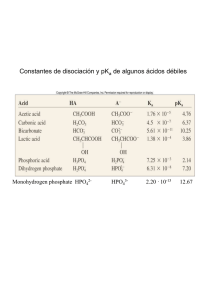
Guía de Ejercicios Capítulo II 1. De cada grupo de estructuras de resonancia mostradas abajo, designar la que más contribuirá al híbrido en cada caso, explica tu elección. (a) (b) (d) (c) (e) 2. Clasificar las estructuras contribuyentes por orden de importancia relativa, en cada uno de los híbridos siguientes: (a) (b) (c) (d) (e) (f) (g) (h) 3. Representa las estructuras de resonancia de las siguientes especies, indicando en cada caso cuál es la más estable y por qué. (a) (b) (c) (d) (e) (f) N (g) (i) (j) (k) (l) (m) 4. Compare la estabilidad de cada uno de los siguientes pares de iones orgánicos: (a) (b) (c) (d) (e) (f) 5. Explicar por qué A es menos estable que B en su contribución al híbrido de resonancia. 6. Señalar de entre las siguientes formas resonantes las tres que conjuntamente representen más fielmente la estructura de 1,3-pentadieno. I II III IV V VI 7. Algunas de las estructuras resonantes que se indican son incorrectas, otras contribuyen a la estabilización del compuesto en mayor o menor medida. Comente estos hechos. (a) (b) (c) (d) (e) (f) 8. Identifique ¿cuáles de los siguientes pares representan estructuras resonantes válidas y cuáles no? a) b) c) d) 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. Los valores de pKa para el etanol (CH3CH2OH) y el inon amonio (NH4+) son 16 y 10, respectivamente. a) Usando estos compuestos y sus bases conjugadas, escriba la ecuación que representa el equilibrio ácido-base para ambos ácidos. b) Cuál sería la reacción esperada si se mezclaran ambos compuestos, ilustre la reacción con una ecuación química. 20. Considerando que el pKa del CH3OH2+ es - 2.2, escriba: a) la reacción de disociación de este ácido, b) Escriba una expresión para su Ka en términos de la concentración de las especies químicas, c) Prediga la dirección favorecida para el siguiente equilibrio: 21. Haciendo uso de las palabras más, medio y menos, ordene los siguientes compuestos acorde con la propiedad indicada. a) Solubilidad en agua: b) Acidez: c) Estabilidad de cationes: d) Acidez: e) Punto de ebullición: f) Basicidad: OH- H2O NH3 22. Complete las ecuaciones siguientes que representan reacciones ácido-base. Indique entre paréntesis cuál es la dirección preferida por estos equilibrio (derecha o izquierda). Vale decir que en cada caso se ha escrito primero el ácido que la base. a) HCl + NH3 b) H2O + (CH3)3CO- K+ c) Fenol + H2O 23. a) Explique porqué un grupo nitro en un anillo aromático aumenta la acidez de un fenol, incluya en su respuesta estructuras para la base conjugada del fenol. b) Prediga cuál, el m-nitrofenol o el p-nitrofenol debería ser un ácido más fuerte. 24. Explique las diferencias en los valores de pKa de cada uno de los siguientes pares de ácidos a) Acido propanóico pKa= 4.9 y ácido 2-metilpropanoico pKa= 4.8 b) ácido cianoacético pKa= 2.5 y ácido nitroacético pKa= 1.7 c) o-nitrofenol pKa= 7.2 y m-nitrofenol pKa= 8.4 d) etano pKa= 42 y etino pKa= 26 e) p-hidroxibenzaldehido pKa= 7.6 y fenol pKa= 10 f) etanol pKa= 16 y agua pKa= 15.7 g) p-metilfenol pKa= 10.3 y p-metoxifenol pKa= 10.2 25. Señale el hidrógeno ácido en cada uno de los siguientes compuestos orgánicos a) 2-metil-1,3-ciclopentanodiona b) 2-oxo-ciclohexanocarboxialdehido c) 3,6-dimetilcicloheptanona d) ácido o-hidroxibenzoico e) fluoroacetato de etilo f) 2-(p-nitro)feniletanonitrilo g) 2-oxociclopentanocarboxilato de etilo h) Tetrahidrocannabinol i) Adrenalina j) 1,3-ciclopentadieno k) Tetrahidrocannabino 26. Adrenalina Explique las diferencias en los valores de Kb de cada uno de los siguientes pares de bases a) metilamina pKb= 3.4 y terc-butilamina pKb= 3.6 b) anilina pKb= 9.4 y N-metilanilina pKb= 9.2 c) anilina y p-nitroanilina pKb= 13 d) p-metilanilina pKb= 8.7 y p-trifluorometilanilina pKb= 11.5 27. Explique brevemente cada una de las siguientes observaciones: a) los alcoholes primarios son más ácidos que los correspondientes alcoholes terciarios b) las amidas son menos básicas que las aminas c) las aminas secundarias son más básicas que las terciarias 28. Ordene de mayor a menor, el grado de acidez esperado para cada una de la serie de compuestos. Justifique sus respuestas. COOH COOH COOH COOH a) F F F O b) O O OH OH OH Br OH I Cl OH O OH F OH OH c) OCH3 CO2H NO2 COCH3 29. Indique el protón más ácido presente en cada uno de los siguientes compuestos, justifique su respuesta: O O a) b) H3C O CH3 CH3 O H CH3 O O c) CH3 N d) CH3 30. Indique los protones que se remueven cuando el compuesto que se indica es tratado con un exceso de cada una de las siguientes bases: NaHCO3, NH3, NaOH, NaNH2, NaH. Represente las estructuras de las bases conjugadas que se forman. O CN O HO O HO NH2 O 31. Indique el átomo que se protona preferentemente cuando cada uno de los siguientes compuestos es tratado con HCl (ac), justifique claramente sus respuestas: H3C N H H O N a) N d) c) b) H3C CH3 NH2 N N O O H N e) f) O N NH2 N g) CH3 N H 32. Represente la estructura del ácido conjugado que se genera cuando el siguiente compuesto es tratado con un equivalente molar de HBr (ac). Justifique su respuesta. N H N N O O S H2N O NO2 33. El ácido ascórbico (vitamina C) presenta un comportamiento ácido en solución acuosa, sin embargo, en la estructura de este compuesto no existe la función orgánica “carboxílica”. Demuestre mediante una reacción ácido-base, el comportamiento ácido de este compuesto (determine cuál es el protón más ácido) H HO O O HO HO OH Ácido ascórbico 34. El compuesto A tiene comportamiento ácido, mientras que el compuesto B se comporta como una base. Al respecto indique: a) ¿Cuál es el átomo de hidrógeno que se remueve en la molécula A por acción de una base? Fundamente. b) ¿Cuál es el átomo que se protona por acción de un ácido en el compuesto B? Fundamente. COOCH3 O N CN NH2 N H A B 35. Cuando el siguiente compuesto es tratado con HCl acuoso (5%P/P), reacciona rápidamente generando una solución intensamente coloreada formada principalmente por un compuesto A en solución. CH3 N HCl 5% P/P A .. .. S .. Proponga una explicación consistente para la observación experimental (reacción rápida con HCl), como también una estructura para el compuesto A y su formación. 36. Cuando el compuesto A es tratado con NaNH2 (base muy fuerte, pKa=35) dos tipos de hidrógenos son removidos. Indique cuáles son, orden de salida y justifique su respuesta O CH3 H3C A NO2 37. El ácido “úsnico” es un metabolito secundario que se encuentra en ciertos líquenes del género Seudocyphellaria. Sin embargo, este compuesto no presenta la función orgánica carboxílica (RCOOH) en su estructura. 18 O 17 O 6 7 HO 5 8 4 9 10 1 2 13 16 OH OH 3 12 11 14 O O 15 a) Indique cuáles serían los protones acídicos en este compuesto. b) Indique además el orden creciente de acidez. c) De acuerdo a su respuesta en b) explique justificadamente la razón de la diferencia en acidez del protón que usted considera sería el más ácido. 38. Se realizó un experimento para determinar la acidez de los siguientes barbitúricos. Cuando ambos se hacen reaccionar con un exceso de KOH al 10% acuoso, se encontró que el compuesto A demostró tener un pKa menor que B. Proponga una explicación consistente en base a sus conocimientos de fuerza de ácidos, para esta observación. O O H H N N A O N H B O O N H O 39. En función de la estructura del compuesto A y de sus valores de pKa, responda: a) Asigne el valor de pKa al átomo de hidrógeno respectivo. Justifique claramente su respuesta. b) Al tratar el compuesto A con una disolución de NaHCO3 al 5% su solubilidad en agua se incrementa considerablemente. Dibuje la estructura que se obtiene como producto de esta reacción y explique este fenómeno. c) Indique que heteroátomo se encontrará protonado a pH = 5,0. Fundamente. 40. Para los siguientes compuestos: N O N H S N P A B NO2 a) Indique cuál de ellos tendrá un comportamiento ácido y el protón que puede removerse con mayor facilidad, cuando es tratado con una base. b) Indique cuál de ellos tendrá un comportamiento básico y el átomo que se protona cuando es tratado con ácido. 41. El compuesto A puede tener un comportamiento ácido o alcalino dependiendo de las características del reactivo por el cual sea tratado. Al respecto indique: a) ¿Cuál es el átomo de hidrógeno más acídico en la molécula? Fundamente. b) ¿Cuál (es) es (son) el (los) héteroátomo(s) presente en el compuesto que se protona preferentemente por acción de un ácido? Fundamente. c) Indique los grupos funcionales presentes en el compuesto. O O N N N H N O O NH2 42. Desoxitimidina es uno de las cuatro desoxiribonucleósidos que constituyen el ADN: c) Indique el protón más ácido presente en este compuesto. d) Indique el átomo más básico presente en el compuesto. 43. El sulfaetidol es utilizado como antibiótico frente a diferentes microorganismos patógenos. Determine ¿cuál sería su estructura al ser tratado en medio ácido y cuál en un medio básico? Justifique. O H2N S O N N S 44. Cuando los siguientes compuestos por separados son tratados en medio ácido solo uno de ellos experimenta protonación. Indique cual es el compuesto y justifique su respuesta. O O O 4-pirona O 3-pirona 45. La histidina es un importante dilatador de los vasos sanguíneos. Cuando este compuesto es tratado con una solución concentrada de HCl, uno de los átomos de nitrógeno se protona preferentemente, ¿cuál es este átomo? H N NH2 N 46. Para los siguientes iones, se desea establecer si se tratan de compuestos aromáticos, antiaromáticos o no aromáticos. Utilice la regla de Hückel y trace un diagrama de O.M de electrones π. H H .. a) c) b) d) .. H 47. .. H H 48. 49. 50. 51. 52. 53.