unidad II organica polix
Anuncio
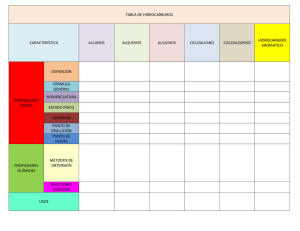
Unidad II: Estructura de alquenos, ciclo alquenos, estructura de dienos, tipos de dienos, estructura de alquinos. Sistema de nomenclatura IUPAC para alquenos ciclo alquenos dienos y alquinos. Propiedades físicas: puntos de fusión y ebullición, solubilidad, Propiedades Químicas. Hidrogenación de alquenos y alquinos Alquenos Los alquenos son compuestos insaturados que contienen en su estructura cuando menos un doble enlace carbono-carbono. Fórmula general: CnH2n .Esta formula general se cumple en los alquenos que tienen en su estructura un solo doble enlace. La terminación sistémica de los alquenos es ENO. El más sencillo de los alquenos es el eteno, conocido más ampliamente como etileno, su nombre común. Nomenclatura Común Nomenclatura IUPAQ Las reglas para nombrar a los hidrocarburos no saturados son similares a las usadas para los alcanos, solo que es necesario agregar algunas para nombrar y situar a los dobles enlaces: 1. – Los dobles enlaces carbono - carbono, se designa por medio de la terminación eno: si esta presente mas de un doble enlace, la terminación será dieno, trieno, y así sucesivamente. 2. – Se determina el nombre básico del compuesto seleccionado la cadena mas larga que contenga el o los dobles enlaces. 3. – Se numeran los carbonos de la cadena de manera que se incluyan los dos átomos del doble enlace y se comienza por el extremo mas cercano de dicho enlace. La localización del doble enlace se designa mediante el número del primer átomo del enlace a modo de prefijo. 4. – Se indica las posiciones de los grupos sustituyentes mediante el numero del átomo al que están fijados. Los siguientes ejemplos ilustran las reglas anteriores: Ejemplos1 La cadena principal incluye los carbonos que forman el doble enlace y la numeración se inicia por el extremo más cercano al doble enlace. El nombre sería entonces: 4 -metil-1-hepteno Ejemplos2 Seleccionamos la cadena más larga que contenga el doble enlace e iniciamos la numeración por el extremo más cercano al doble enlace. 6-etil-4-isopropil-7-metil-3-octeno Ejemplo 3 En los compuestos insaturados halogenados, como es el caso de este alqueno, el doble enlace tiene preferencia sobre el halógeno. El carbono del halógeno debe incluirse en la cadena, pero la numeración se inicia por el extremo más cercano al doble enlace, independientemente de la posición del halógeno o los halógenos presentes en la cadena. 6-n-butil-6-ter-butil-9-cloro-3-deceno Ejemplo 4 Seleccionamos la cadena más larga que contenga los carbonos unidos al bromo y los carbonos que forman el doble enlace. 2,6- dibromo-3-sec-butil-5-n-propil-2-hexeno Ejemplo 5 Seleccionamos la cadena más larga que contenga los carbonos del doble enlace y numeramos a partir de la derecha que es donde está el doble enlace 1- Penteno Ejemplo 6 3, 4 – dimetil -2 – Hepteno Ejemplo 7 8- Bromo - 1- Cloro - 6 etil -3- Secbutil – 4 - octeno Ejemplo 8 5-sec-butil-3-ter-butil-6-cloro-2-hexeno Ejemplo 9 2,4-dimetil-1-penteno Propiedades y usos • • • • Los primeros tres compuestos, eteno (etileno), propeno y buteno, son gaseosos a temperatura ambiente; los siguientes son líquidos hasta los que tienen más de 16 carbonos que son sólidos. Son relativamente poco solubles en agua, pero solubles en ácido sulfúrico concentrado y en solventes no polares. Su densidad, punto de fusión y de ebullición se elevan conforme aumenta el peso molecular. El uso más importante de los alquenos es como materia prima para la elaboración de plásticos. Alquenos de importancia.El etileno o eteno es un gas incoloro, insípido y de olor etéreo cuya fórmula es CH2=CH2. Se usan grandes cantidades de etileno (eteno) para la obtención del polietileno, que es un polímero. (sustancia formada por miles de moléculas más pequeñas que se conocen como monómeros). Por ejemplo del polietileno el monómero es el etileno. El polietileno es un compuesto utilizado en la fabricación de envolturas, recipiente, fibras, moldes, etc.. El etileno es utilizado en la maduración de frutos verdes como piñas y tomates. En la antigüedad se utilizó como anestésico (mezclado con oxígeno) y en la fabricación del gas mostaza (utilizado como gas de combate). El propeno (nombre común propileno), se utiliza para elaborar polipropileno y otros plásticos, alcohol isopropílico (utilizado para fricciones) y otros productos químicos. Varias feromonas u hormonas sexuales de los insectos son alquenos, los carotenos y la vitamina A constituyente de los vegetales amarillos como la zanahoria, y que son utilizados por los bastoncillos visuales de los ojos, también son alquenos.El licopeno, pigmento rojo de los tomates, la xantina colorante amarillo del maíz y la yema de huevo, también son alquenos. El teflon se elabora a partir de tetrafuoroetileno utilizando peroxido de hidrógeno comocatalizador.El teflon es muy resistente a las acciones químicas y a las altas temperaturas. Propiedades fìsicas Punto de ebullición. • Los puntos de ebullición de los alquenos no ramificados aumentan al aumentar la longitud de la cadena. • Para los isómeros, el que tenga la cadena más ramificada tendrá un punto de ebullición más bajo. • Los alquenos con dos, tres y cuatro átomos de carbono son gases, los alquenos lineales con más de 16 carbonos son sólidos. • Su densidad aumenta con el peso molecular Solubilidad. • Los alquenos son casi totalmente insolubles en agua debido a su baja polaridad y a su incapacidad para formar enlaces con el hidrógeno. Estabilidad. • Cuanto mayor es el número de grupos alquilo enlazados a los carbonos del doble enlace (más sustituido esté el doble enlace) mayor será la estabilidad del alqueno. DIENOS: Estructura , tipo de dienos. Los dienos son hidrocarburos con dos dobles enlaces, y la relacion con los dobles enlaces pueden clasificarse como aislados, conjugados o acumulados. Aislados: Son aquellos donde las dos unidades de doble enlace carbonocarbono están separados entre si por uno o más átomos de carbono con hibridación sp3 Los dienos conjugados son aquellos donde los enlaces dobles se alternan con enlaces simples Los dienos acumulados son aquellos en donde un átomo de carbono en común a dos dobles enlaces carbono – carbono.Los compuestos de este tipo en general se denominan alenos • Existen compuestos con varios dobles enlaces carbono – carbono que también pueden ser conjugados, aislados y acumulados y se denominan polienos. Muchas sustancias naturales contienen varios dobles enlaces, entre ellos, los pigmentos que dan los colores rojos y amarillos brillantes a frutas y flores en la naturaleza son polienos conjugados; por ejemplo el licopeno responsable del color rojo de los tomates. El mirceno encontrado en el laurel es un polieno aislado. Y el atrayente sexual del macho del escarabajo de las arvejas secas es un ejemplo de polienos con enlaces conjugados ALQUINOS Los alquinos son compuestos químicos formados solamente por C e H. Se caracterizan por poseer al menos un triple enlace C- C, con estos carbonos con hibridación sp. Su fórmula general corresponde a CnH2n-2 en los alquinos lineales El Butino o Etil acetileno conocido también como 1-butino se trata de un gas (hidrocarburos caracterizado por poseer un grupo funcional del tipo triple enlace carbono-carbono) y que es extremadamente inflamable y reactivo con fórmula química C4H6: (HC≡C-CH2-CH3) Este gas se emplea frecuentemente en la síntesis de otros compuestos orgánicos debido a su alta reactividad, en estado puro es incoloro y en concentraciones relativamente altas suele presentar un olor a ajos. Existen dos isómeros del butino: el 1-butino y el 2-butino. Si al referirse al butino no se menciona nada más se suele entender que nos referimos al 1butino. REGLAS DE NOMENCLATURA DE ALQUINOS. NOMENCLATURA IUPAC REGLA Nº1.- Se cuentan los átomos de carbono de aquella cadena que contiene el triple enlace (cadena principal) dándole el nombre de aquel alcano pariente con igual número de átomos de carbono y se le cambia su terminación ANO (del alcano) por INO (en el alquino) REGLA Nº2.- Al numerar ésta cadena, se empieza en el extremo más próximo al triple enlace. REGLA Nº3.-La posición del triple enlace en la cadena se indica por el número de posición del primer carbono del triple enlace. En el ejemplo de arriba el uno (1) indica la posición del triple enlace. 1 – hexino La presencia de más de un triple enlace, se expresa con tantos números como triples enlaces haya en la molécula, los que indican la posición de cada uno de ellos en la cadena principal. Además debe usarse un prefijo numérico que indique cuantas veces está repetido el triple enlace. Así, si hay dos, el prefijo será diino, tres será triino, etc. REGLA Nº4.- Cuando en un compuesto están presentes dobles y triples enlaces, hay que tener en mente los siguientes casos: 4.1.- Si el triple enlace y el doble enlace están a la misma distancia de los extremos de la cadena principal, se le dará la menor numeración al doble enlace, o sea, en igualdad de condiciones, al doble enlace le corresponderá siempre la menor numeración. 4.2.- Si el triple enlace está más cerca que el doble enlace del extremo de la cadena, se le dará al triple enlace la menor numeración. Ejemplos: Síntesis de Alquinos. El Acetileno puede producirse a partir del carbón mediante dos procesos principales: Un alquino suele tener reacciones semejantes a las de los alquenos, es por esta razón por la que el butino, tal y como los alquinos más complejos, se puede obtener, por ejemplo, a partir del alqueno correspondiente tras adición de bromo y doble eliminación de bromhídrico (HBr). Aplicaciones La mayor parte de los alquinos se fabrica en forma de acetileno. A su vez, una buena parte del acetileno se utiliza como combustible en la soldadura a gas debido a las elevadas temperaturas alcanzadas. En la industria química los alquinos son importantes productos de partida por ejemplo en la síntesis del PVC (adición de HCl) de caucho artificial etc. El grupo alquino está presente en algunos fármacos Citostático. Los polímeros generados a partir de los alquinos, los polialquinos, son semiconductores orgánicos y pueden ser dotados parecido al silicio aunque se trata de materiales flexibles. Analítica Los alquinos decolorean una solución ácida de permanganato de potasio y el agua de bromo. Si se trata de alquinos terminales (con el triple enlace a uno de los carbonos finales de la molécula) forman sales con soluciones amoniacales de plata o de cobre. (Estas sales son explosivas) Riesgos de la Manipulación Al tratarse de un gas altamente inflamable se puede decir que si se expone al fuego recipientes con butino esto puede causar su rotura o explosión. La combustión incompleta de este gas puede formar monóxido de carbono (CO). Extinción de Incendios Los medios de extinción más adecuados en el caso de que se produzca un incendio son los agentes extintores comunes. Resulta aconsejable ante un incendio con butino no actuar en su extinción a no ser que sea absolutamente necesario ya que este gas es enormemente explosivo y se debe ser consciente de la situación corriendo un peligro extra, no obstante existen medios específicos para disminuir la gravedad del incendio en el que el butino se encuentre presente, tales remedios son: • • Detención de la fuga de gas de los recipientes expuestos al fuego Sacar al exterior los recipientes o emplear técnicas de enfriamiento mediante agua pulverizada desde un lugar considerado seguro hasta que se considere que ya están fríos. Inhalación Este gas es más pesado que el aire y puede acumularse en espacios cerrados, particularmente en sótanos y a nivel del suelo. Es por esta razón por la que puede causar asfixia en altas concentraciones debido a que este gas causa desplazamiento del aire. Para detectar el gas en estos casos conviene utilizar un detector de gases específico para el butino. Los síntomas de asfixia que presentan los afectados por la inhalación pueden incluir la pérdida de consciencia o movilidad. Esta pérdida de conocimiento suele ser instantánea y se conocen casos en los que las víctimas no se dan cuenta de que han perdido la consciencia. Los afectados que inhalen este gas a bajas concentraciones pueden sentir efectos narcotizantes. Estos síntomas incluyen vértigos, cefalea, náuseas y pérdida de coordinación. Se aconseja en este caso retirar a la víctima a una zona ventilada. Usos: La combustión del acetileno libera una gran cantidad de energía y alimentada con oxígeno, supera fácilmente los 2000ºC (soplete oxiacetilénico). Su uso en el alumbrado fue importante en la antigüedad. La aplicación industrial del acetileno se basa fundamentalmente en su transformación en monómeros para su posterior polimerización: Por otra parte hay una gran cantidad de productos naturales que contienen triple enlace Debido a las capacidades reactivas que posee este hidrocarburo, es muy empleado como etapa intermedia para la elaboración de otros compuestos orgánicos sintéticos, se sabe que participa en la industria de elaboración del caucho, en la obtención del benzol, de algunos plásticos, etc. En concreto en la producción de productos polietilénicos de alta densidad (HDPE) así como los lineales de baja densidad (LLDPE), para la manufactura del polibutileno. Debido a la propiedad que tiene de arder con llama luminosa y de gran poder calorífico produciendo elevadas temperaturas (por encima de los 3000 grados centígrados) se suele emplear como elemento de cortado y soldadura de ciertos metales, tales como el acero. Sus efectos narcóticos en estado puro le han convertido en las etapas iniciales de la química orgánica (finales del siglo XIX) en un posible narcotizante de uso en medicina, pero sus capacidades explosivas a bajas concentraciones con oxígeno lo han acabado desaconsejado. REACCIONES DE ALQUENOS Y ALQUINOS La hidrogenación es la adición de hidrógeno al doble enlace para formar alcanos. Platino y paladio son los catalizadores más comunmente usados en la hidrogenación de alquenos. El paladio se emplea en forma de polvo absorbido en carbón (Pd/C). El platino se emplea como PtO2 (Catalizador de Adams). En la reacción sucede que al adicionar hidrogeno ellos se unen en los carbonos del doble enlace se rompe el doble enlace para formar el alcano correspondiente Un alquino tiene reacciones semejantes a las de los alquenos y la mayoría de ellas son reacciones de adición. Estas reacciones son facilitadas por la mayor concentración de electrones en el triple enlace. Los alquinos se hidrogenan con dos equivalentes de hidrógeno, en presencia de un catalizador metálico finamente dividido, para formar alcanos. Los catalizadores más utilizados son: platino, paladio, rodio. La hidrogenación de los alquinos a alcanos transcurre a través de un intermedio que es el alqueno. Es posible parar la hidrogenación en el alqueno empleando un catalizador de paladio envenenado, llamado catalizador de Lindlar. Los venenos disminuyen la actividad del catalizador y permiten parar la hidrogenación en el alqueno. La hidrogenación es una reacción exotérmica, y el calor desprendido se ve afectado por los sustituyentes del alquino. Así, los alquinos internos desprenden menos calor al hidrogenarse que los terminales, debido a su mayor estabilidad por el fenómeno de la hiperconjugación.