Document
Anuncio
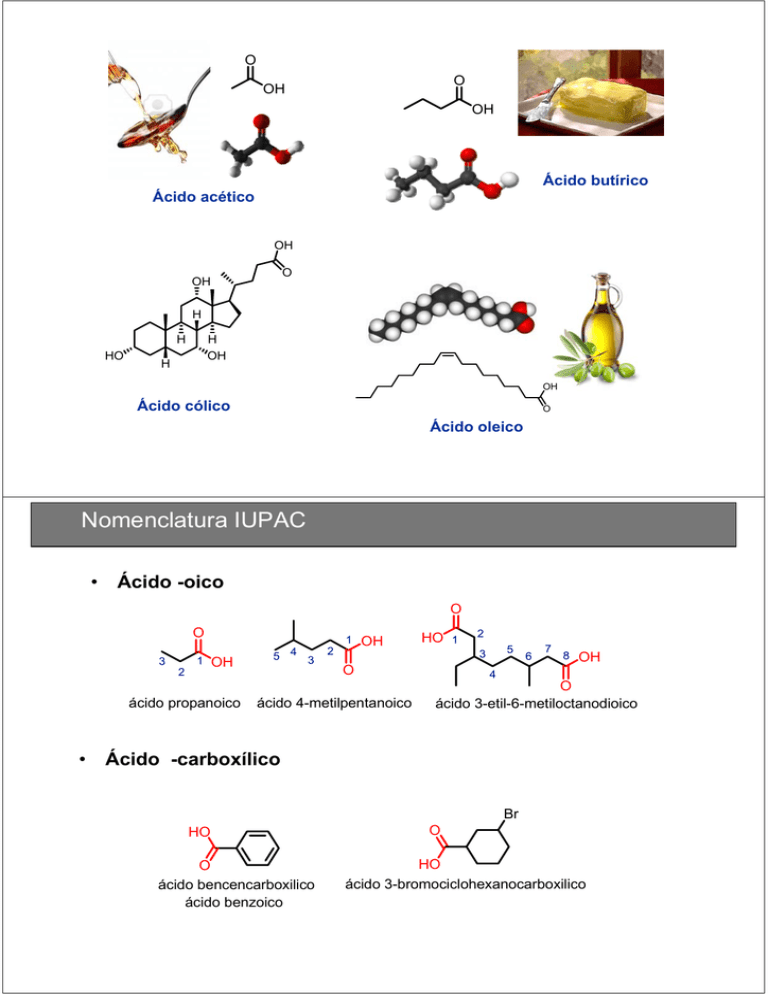
O O OH OH Ácido butírico Ácido acético OH O OH H H HO H OH H OH Ácido cólico O Ácido oleico Nomenclatura IUPAC • Ácido -oico O O 3 2 1 OH ácido propanoico • 5 4 3 2 1 OH HO 2 5 3 O ácido 4-metilpentanoico 1 6 7 8 OH 4 O ácido 3-etil-6-metiloctanodioico Ácido -carboxílico Br HO O ácido bencencarboxilico ácido benzoico O HO ácido 3-bromociclohexanocarboxilico Nombres comunes Fórmula Nombre sistemático Nombre común Ác. Metanoico Ác. Etanoico Ác. Octadecanoico Ác. 2-hidroxipropanoico Ác. fórmico Ác. acético Ác. esteárico Ác. láctico Ác. 2-hidroxi-2-feniletanoico Ác. mandélico Ác. Propenoico Ác. acrílico Ác. (Z)-9-octadecenoico Ác. oleico Ác. Bencencarboxílico Ác. benzoico Ác. o-hidroxibencencarboxílico Ác. salicílico Ác. Propandioico Ác. Butandioico Ác. malónico Ác. succínico Ác. 1,2-bencendicarboxílico Ác. ftálico Estructura O 152 pm 125 pm 119° OH ácido acético 122° Sp2 Ang. enlace ≈ 120° 119° 131 pm Deslocalización electrónica Punto de ebullición Puentes de H Dímero de ácido acético Puentes de H Punto de fusión Solubilidad ACIDEZ Disociación de los RCO2H alcohol alcóxido ácido energía carboxilato Estabilización del carboxilato Formiato de sodio Ácido fórmico Disociación de los RCO2H Grupo atrayente de electrones (GAE) – Estabiliza al carboxilato – Aumenta la acidez O X C C OH O X C C O Grupo donador de electrones (GDE) – Desestabiliza al carboxilato. – Disminuye la acidez + H Efecto de los sustituyentes sobre la acidez O OH Ka pKa O O OH OH 1,6 x 10-5 4,8 1,3 x 10-5 4,9 O OH 0,9 x 10-5 5,1 1,3 x 10-5 4,9 ACIDEZ similar O O OH F O OH Cl O Br OH O OH Cl Cl Cl Cl OH Cl Ka pKa 1,8 x 10-5 4,7 2,5 x 10-5 2,6 1,4 x 10-3 2,9 1,4 x 10-3 2,9 5,0 x 10-2 1,3 Efecto de los sustituyentes sobre la acidez O Ka pKa O O OH 1,4 x 10-3 2,9 Cl OH 1,0 x 10-4 4,0 ACIDEZ Cl OH 1,3 x 10-1 0,9 ACIDEZ Cl O OH 3,0 x 10-5 4,5 Efecto de los sustituyentes en ácidos benzoicos sustituidos Ka (pKa) para diferentes posiciones del sustituyente X Sustituyente en XC6H4CO2H Orto Meta Para *En agua a 25°C CO2H CO2H CO2H CO2H GDE Disminuye acidez CO2H NO2 NO2 OCH3 p-metoxi 4,46 GAE Aumenta la acidez NO2 Ac. Benzoico 4,19 Disociación de los diácidos m-nitro 3,47 p-nitro 3,41 o-nitro 2,16 Sales de los ácidos carboxílicos Sales de los ácidos carboxílicos Derivados orgánicos del amoniaco, un átomo de Nitrógeno con un par de electrones libres Bases y Nucleófilos N Trimetilamina NH2 Anilina Quinina N H HO O N Clasificación Alquilaminas Arilaminas NH2 N N N trimetilamina trietilamina N-etil-N-metilciclohexilamina NH2 Anilina N Heterocíclicas N N H Piridina Pirrol N H N Quinolina Imidazol N N H Indol N Pirimidina N H Pirrolidina N H Piperidina Touidina Clasificación y Nomenclatura de las aminas Origen Familia 1º 2º 3º 4º H2 O Alcoholes CH3CH2OH (CH3)2CHOH (CH3)3COH No existe NH3 Aminas CH3CH2NH2 (CH3)2NH (CH3)3N (CH3)4N Sal de amonio H2N H2N H2N OH Primarias 1° Propilamina Ciclohexilamina HN N H Secundarias 2° NH N H Pirrolidina Dietilamina Terciarias 3° 2-aminoetanol N Piperazina N N,N-dimetilpropilamina N trietilamina N-etil-N-metilciclohexilamina Estructura y enlaces en las aminas H3C N CH 3 H3C Amina con 3 sustituyentes diferentes QUIRAL W X N Y W Z Z N Y X Estructura y enlaces en las aminas Inversión piramidal W N X Y W N Z Z X Y El nitrógeno de una sal de amonio está tetrasustituído y, al igual que un carbono, mantiene su estabilidad configuracional y puede constituirse en un centro estereogénico. INVERSION IMPEDIDA POR EL BICICLO La estructura de algunas aminas impide la inversión. Algunos nitrógenos de aminas sí mantienen su integridad configuracional: Medida de la basicidad de las aminas Amina NH3 CH3NH2 (CH3)2NH (CH3)3N pKb 4.8 3.4 3.3 4.2 Amonio NH4+ CH3NH3+ (CH3)2NH2+ (CH3)3NH+ pKa 9.2 10.6 10.7 9.8 Efectos en la basicidad de las aminas Ion amonio energía amina Efectos en la basicidad de las aminas Las alquilaminas son moderadamente básicas: La estabilidad relativa de las sales de amonio resultantes permite explicar la diferente basicidad de una serie de aminas Amina NH3 CH3NH2 (CH3)2NH (CH3)3N pKb 4.8 3.4 3.3 4.2 Efectos en la basicidad de las aminas Efectos en la basicidad de las aminas Efectos en la basicidad de las aminas Efectos en la basicidad de las aminas Efectos en la basicidad de las aminas Sales de aminas Oxidación de alcoholes primarios con KMnO4 KMnO4 R CH2OH calor O R C H KMnO4 calor dos hidrógenos α O R C OH + MnO2 precipita Oxidación de alcoholes primarios con K2Cr2O7 K2Cr2O7 R CH2 OH H2SO4 O R C H K2Cr2O7 H2SO4 O R C OH + Cr3+ Oxidación de cadenas laterales O R C OH KMnO4 calor CH2CH3 OCH3 + n CO2 O C OH KMnO4 calor OCH3 Formación de nitrilos e hidrólisis R CH2 Cl _ + : C N: SN2 DMSO R CH2 C H2SO4 calor N + Cl H2 O O R CH2 C OH + + NH4 Síntesis de ácidos carboxílicos (las condiciones de reacción son abreviadas a causa del poco espacio) R C C R R R H KMnO4 H KMnO4 KMnO4 R C H CrO3 H2SO4 R CH2 OH R C OH H2O H2SO4 R C N DIBAL O H2O R C Cl Próxima clase O H2SO4 H2O R C OR ( benceno = R cadena lateral = R’ ) CrO3 o KMnO4 H2SO4 O O R' CO2 R Li or R Mg X KMnO4 NaCN acetona R X Li or Mg SOCl2 R OH R R H H OH OH