Estructuras de adhesión y locomoción
Anuncio

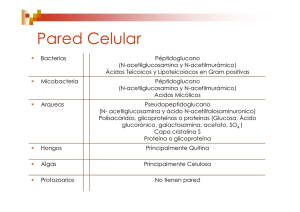
Estructuras de adhesión y locomoción Fimbrias Polisacáridos capsulares Flagelos Fimbrias Apéndices de adherencia formados de proteínas (pilina) anclado en la membrana externa Fimbrias en bacterias Gram negativas Enterobacterias y otras bacterias patógenas Tipo Genes Biogénesis I fimA-fimH Chaperoneusher pathway Características Tienen la habilidad de aglutinar eritrocitos. Algunas son inhibidas por la adición de D-manosa MSHA (hemaglutinación manosa sensible). Microorganismos E. coli, Klebsiella, Samonella, Vibrio y otras enterobacterias Otras son MRHA (hemaglutinación manosa resistente) II Chaperoneusher pathway No hemaglutinantes, variantes antigénicas de las fimbrias tipo I. Escherichia y Salmonella Chaperone-usher pathway La chaperona periplasmática FimC forma complejos con las subunidades de la fimbria recién translocadas (FimA, FimG, FimF, FimH). El complejo FimC–subunidad se dirigen a la plataforma de ensamblaje (usher) FimD, la cual reconoce específicamente al complejo. FimC es devuelta al periplasma y la subunidad es translocada por el poro de FimD. The EMBO Journal (2005) 24, 2075–2086. La fimbria está compuesta de diferentes subunidades en forma de hélice en la superficie de la célula. Mecanismo de fimbrias tipo I •E. coli patógena emplea el fimbrias tipo I para unirse a las proteínas de la superficie de las células de la vejiga. •Los pilicidas (piridona) inhiben la biogénesis de las fimbrias al destruir las interacciones de las proteínas del sistema de secreción. Nature Reviews Microbiology 6, 17-27 (January 2008) Fimbrias en bacterias Gram negativas Tipo Genes Biogénesis Características III mrkA-mrkF K. pneumoniae Chaperone– MRHA en usher pathway eritrocitos pretratados con ácido tánico. IV pil SSTII Asociadas con el movimiento no flagelar. Microorganismos Klebsiella, Salmonella, Yersinia, Proteus y Providencia Neisseria gonorrhoreae Nature Reviews Microbiology 4, 11-22 (January 2006) Sistema de secreción tipo II SSTII Fimbria Tipo IV http://www.genome.ad.jp/dbget-bin/get_pathway?org_name=bsu&mapno=03090 Twiching Una clase de fimbrias son las tipo IV que están involucradas en un tipo de movilidad llamado (Twitching), que ocurre en superficies sólidas a través de una rápida y reversible extensión y retracción de la fimbria. Modelo de motilidad para Neisseria gonorrhoeae. Esta bacteria puede seguir adelante en superficies por un ciclo de extensión, adherencia y retractación. Fimbrias en bacterias Gram negativas Tipo Genes Biogénesis P Operón Pap (papApap K) Chaperone– usher pathway Características Pili P o E. coli uropatógena (UPEC) o asociada a pielonefritis Microorganismos Escherichia coli Fimbria P y fimbria tipo I Nature Reviews Microbiology 7, 765-774, 2009 Figure 1 | P and type I pili. A schematic of P (part a) and type 1 (part b) pili, represented by the Pap and Fim systems, respectively. Numbers indicate the number of copies of each subunit in the pilus. The chaperones attached to the last subunit to be incorporated into each pilus are shown in yellow. P pili are terminated at the outer membrane (OM) by the termination subunit, PapH. No such subunit is known in the Fim system. The usher dimers are indicated in purple and blue. E, extracellular space; P, periplasm. Figure is modified, with permission, from REF. 35 © (2008) Elsevier. E. coli uropatógena (UPEC) Nature Reviews Microbiology 6, 17-27 (January 2008) Fimbrias en bacterias Gram positivas Tipo Biogénesis Características Microorganismos Fibras ND Cortas, finas y cilíndricas. Estreptococos de la cavidad oral. Fimbrias Sortasas (algunas) Alargadas y flexibles. Corynebacterium spp y Streptococcus spp. Sortasas y ensamblaje Transpeptidasa que une unidades de péptido en diferentes cadenas de peptidoglucano. Específicamente une el residuo de Treonina (T) de la secuencia LPXTG a la pared celular por una reacción de transpeptidación. Modelo de S. penumoniae. Sortasas y ensamblaje Las proteínas son secretadas por Sec. a| rompimiento entre treonina y la glicina b| formación de un intermediario entre la cisteína de la sortasa y la treonina de la proteína c| oligomerización Lisina y cisteína. Nature Reviews Microbiology 4, 509-519 (July 2006) Sortasas y ensamblaje d| la unión entre la sortasa con la subunidad de pilina es atacada por el pentapéptido del lípido II. e| unión covalente con el precursor de peptidoglucano. Nature Reviews Microbiology 4, 509-519 (July 2006) Organización Los modelos propuestos involucran la presencia (verdes) de proteínas auxiliares que participan junto con las unidades de pilina en el anclaje de la bacteria a la célula hospedera Modelo de adherencia de Streptococcus Nature Reviews Microbiology 4, 509-519 (July 2006) Polisacáridos capsulares Glucocálix: material extracelular que rodea a la célula, compuesto por polisacáridos, proteínas o ambos. Exopolisacárido (EPS): glucocálix hecho con azúcares (homopolimérico o heteropolimérico). Cápsula: sustancia organizada, grande y asociada a la pared celular. En bacterias Gram negativas anclada a una porción lipídica de la membrana externa. Capa mucoide o mucilaginosa: sustancia amorfa, esparcida o soluble que rodea a la célula. Cápsula y capa mucoide E. coli. Antígeno K de cápsula Acido colánico (antígeno M) capa mucoide Precursores de cápsula Glucosa 1-P Nucleósido 5-difosfato Nature Reviews Microbiology 8, 578-592, 2010 Biogénesis de cápsula La biosíntesis y secreción de polímeros bacterianos requieren del ensamblaje de complejos multiproteícos. Modelo de la biosíntesis del polisacárido capsular K30 de Escherichia coli. Organización genética. Nature Reviews Microbiology 8, 578-592, 2010 Biogénesis de cápsula Ruta de síntesis de poli-gglutamato (PGA) en Bacillus spp. A, B, C, y E representan cada uno a CapA, CapB, CapC y CapE de la síntesis de PGA capsular en Bacillus anthracis o PgsA (PgsAA y CapA), PgsB (CapB), PgsC (CapC) y PgsE de la síntesis de PGA extracelular en Bacillus licheniformis y Bacillus subtilis. Nature Reviews Microbiology 8, 578-592, 2010 Especificidad inmunológica Antígeno K (del alemán Kapselantigene) En Eschechichia coli se han encontrado más de 80 tipos que difieren en su antigenicidad y composición. En S. pneumoniae se han descrito más de 90 serotipos capsulares. Para Cryptococcus neoformans se han reportado al menos 6 estructuras capsulares diferentes. Evasión del sistema inmune El polisacárido capsular previene la detección por el sistema inmune del hospedero. Formación de biopelículas. Adherencia. Biofilms o biopelículas Un biofilm puede contener aproximadamente un 15% de células y un 85% de matriz extracelular, generalmente polisacáridos, que forman canales por donde circulan agua, enzimas, nutrientes, residuos; allí los individuos establecen relaciones, dependencias, viven, cooperan, y se comunican a través de señales químicas, quorum sensing, que regula la expresión de genes de manera diferente en las distintas partes de la comunidad, como un tejido en un organismo multicelular. Biofilms o biopelículas Superficies abióticas Superficies bióticas Ventajas de las biopelículas. Disponibilidad de nutrientes. Redes de alimentos. Biopelículas mixtas. -Superficie aeróbica -Base anaeróbica Biopelículas anaeróbicas. -Bacterias fermentadoras -Bacterias acetogénicas obligadas -Bacterias metanogénicas -Bacterias sulfato reductoras Biopelículas aeróbicas. -Bacterias quimiolitótrofas Sludge granules Ventajas de las biopelículas. El interés en los biofilms tiene que ver con la implicación que tienen en la resistencia antibiótica y a desinfectantes, ya que por ser una estructura más fuerte y menos accesible que una colonia son una herramienta de supervivencia importante en bacterias. Los antibióticos y desinfectantes solo alcanzan a las células más expuestas de la superficie, aunque algunas veces pueden difundir al interior del biofilm su concentración no es suficiente y/o bacterias que están la base son resistentes, lo que evita su destrucción. Comunidades en las biopelículas Microcolonias. Están formados por agrupaciones de bacterias de un mismo tipo o bien de diversos tipos. Matriz. Exopolisacárido que comprende entre el 50 y el 90% de la biopelícula. Imagen. Microcolonias bacterianas (biofilm) dentro de una cripta de amígdala extirpada a un paciente con infecciones recurrentes. Recuadro: se observan al menos dos tipos de colonias bacterianas. Comunidades en las biopelículas Canales entre las microcolonias. Permiten el paso de agua, nutrientes y productos de desecho entre las microcolonias. Modelo de una biopelícula oral Nature Reviews Microbiology 2, 552-568 (July 2004) Formación de la biopelícula Stage 1, initial attachment; stage 2, irreversible attachment; stage 3, maturation I; stage 4, maturation II; stage 5, dispersion. Formación de la biopelícula 1. Anclaje inicial (reversible). Flagelo Fimbrias Adhesinas no fimbriales 2. Formación de la monocapa (irreversible). Twitching motility Síntesis de exopolisacárido 3. Maduración fase I. Crecimiento de la matriz No hay movilidad Formación de microcolonias Formación de la biopelícula 4. Maduración fase II. Crecimiento de la matriz Formación de canales de agua Crecimiento de las microcolonias 5. Dispersión. Baja concentración de nutrientes Migración por canales de agua Formación de nuevas biopelículas Formación de la biopelícula Expresión de genes Cuando la bacteria forma una biopelícula la expresión de genes cambia como respuesta a los requerimientos de la célula. En E.coli y P. aeruginosa, se reduce la producción de flagelina e incrementa la expresión de los genes para producir ácido colánico y alginatos respectivamente. Quorum sensing. Ruta de señales que emplea la bacteria para si misma o en una población. La señales dan como resultado la expresión o regulación de genes en respuesta a un estímulo. Flagelo Filamento helicoidal o propela, que es impulsado por un motor rotatorio embebido en la superficie celular. Filamento. Componente propulsor. Codo o gancho. Estructura de acoplamiento entre el filamento y la superficie celular. Cuerpo basal. Componente multiproteíco que contiene el motor flagelar. -Ancla el flagelo a la célula. -Suministra el mecanismo del movimiento (un motor rotatorio que puede girar en ambos sentidos). -Alberga la maquinaria de exportación para el ensamblaje del flagelo. Nature Reviews Molecular Cell Biology 5, 1024-1037, 2004 Biogénesis Sistema de secreción tipo III El aparato de exportación flagelar en S. enterica es el encargado de reconocer las proteínas a ser exportadas. 6 proteínas membranales (FlhA, FlhB, FliO, FliP, FliQ y FliR). Componentes solubles (FliI, FliH, la chaperona general FliJ y las chaperonas específicas FlgN, FliS y FliT). Proteínas flagelares Nature Reviews Microbiology 4, 784-790, 2006 Proteínas flagelares Biogénesis Flil ATPasa FliH regula a FliI. Regula para acoplar la actividad a la translocación. 1. El anillo MS se inserta en la MI y forma el núcleo sobre el que se acoplarán todos los demás componentes. 2. Posteriormente se forma el anillo C que se localiza en el citoplasma y está formado por las proteínas FliG, FliM y FliN, que participan en el cambio de dirección de la rotación flagelar y generación de la torca (o fuerza de rotación). 3. Se incorpora el aparato de exportación responsable de secretar a los componentes que no presentan un péptido señal y que por lo tanto, se exportan a través de la vía específica tipo III. Biogénesis 4. Las subunidades del eje, del gancho y la flagelina (que forma el filamento), viajan por el interior de la estructura, a través de un canal central de 30 D. 5. Las subunidades que forman los anillos P y L son las únicas proteínas del sistema que presentan secuencia señal y utilizan la vía Sec. 6. Se exportan las subunidades del gancho, el cual se alarga hasta una longitud determinada. 7. Regulación: cuando el gancho adquiere su tamaño final, se exporta el factor antisigma FlgM, liberando de esta forma en el citosol al factor sigma FliA, que es el responsable de la transcripción de los genes que formarán las estructuras tardías, como el de la flagelina. Biogénesis 8. Por último, se exportan las llamadas proteínas tardías HAP1 y HAP3 (que forman una zona de amortiguamiento entre el gancho y el filamento), la proteína HAP2 (que acompaña la formación del filamento ayudando a que las subunidades se ensamblen correctamente), y la flagelina. Rotación del flagelo FliG, FliM, FliN Componentes del interruptor flagelar para la rotación y determinan la dirección (CWW y CW) Taxis (Taxias) Aerotaxia. Migración ante un gradiente de O2: - Bacterias anaerobias: aerotaxia negativa - Bacterias microaerófilas: atraídas hacia tensiones de O2 menores que la atmosférica - Bacterias aerobias y facultativas: aerotaxia positiva Fototaxia: migración en función de la luz. Quimiotaxia: migración ante un gradiente espacial de una sustancia química. El movimiento bacteriano en ausencia de gradiente químico se describe como movimiento caótico, con muchos tumbos o volteretas. El movimiento bacteriano en presencia de un gradiente químico reduce la frecuencia de los tumbos y tiene una mayor dirección. Quimiotaxia Efector: señal química externa que pone en marcha el mecanismo celular de la taxia. Receptor de membrana: recibe al efector y pone en marcha un sistema de transducción intracelular de la señal, que llegará hasta el conmutador en la base del flagelo. La bacteria siente el gradiente espacial como si fuera un gradiente temporal. Al cabo de cierto tiempo, la bacteria vuelve al patrón aleatorio de natación (adaptación al estímulo), debido a una modificación covalente de los receptores de membrana. Proteínas quimiotácticas aceptoras de metilo (MCP) Son receptoras del estímulo químico y transductoras de la señal al interior de la célula. Son agrupaciones de trímeros de los homodímeros de MCP, asociados a proteínas de la quimiotaxis (CheA y CheW). Se localizan en los polos de la célula. Nature Reviews Molecular Cell Biology 5, 1024-1037 (December 2004) Proteínas quimiotácticas aceptoras de metilo (MCP) Proteínas transmembranales, con dos dominios principales: Dominio periplásmico: contiene el sitio de unión para el quimioefector. Dominio citoplásmico con 2 zonas: -Región transductora: señal hacia el motor. -Región metilable: con 4-6 glutámicos susceptibles de ser metilados (papel en la adaptación al estímulo). La transducción de señales requiere varias proteínas CheA: proteíncinasa que se auto-fosforila en cierta His. A su vez puede fosforilar a CheY y a CheB CheW: acopla CheA a la MCP. CheY: en su forma fosforilada interacciona con el anillo C CheZ: cataliza la desfosforilación de CheY-P Trends in Microbiology Volume 12, Issue 12, December 2004, Pages 569-576 Proteínas implicadas en la adaptación CheR: metiltransferasa. Metila los glutámicos de MCP - Si hay atrayente los glutámicos de MCP son más accesibles a metilación. - Si hay repelente los glutámicos son menos accesibles a la metilación. CheB, tiene dos dominios, uno de los cuales funciona como metilesterasa y controla la adaptación de las MCPs. En su forma fosforilada (CheB-P) elimina metilos de la MCP. Nature Reviews Molecular Cell Biology 5, 1024-1037 (December 2004) Genes involucrados en la Quimiotaxis Nature Reviews Microbiology 3, 611-620 (August 2005) Ciclo excitación-adaptación (resumen) Añadimos atrayente se une a MCP cambio conformacional inhibición del nivel basal de fosforilación de CheA aumenta la probabilidad de rotación CAR mayor tiempo de corridas. Simultáneamente el MCP estimulado expone sus Glu metilación por CheR adaptación lenta al estímulo. La adaptación se facilita también por la baja actividad metilesterasa (poca CheB-P). TRENDS in Biochemical Sciences Vol.33 No.1