Carcinoma de los conductos colectores de Bellini y carcinoma
Anuncio

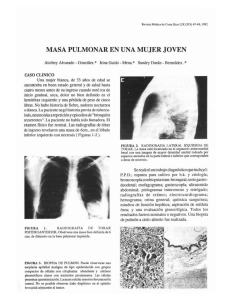
CARCINOMAS DE LOS DUCTOS COLECTORES (BELLINI) Y CARCINOMA MEDULAR DE RIÑON Dra. I. Trias Anatomia Patològica Clínica Plató Fundació Privada. En la última clasificación de la OMS, se incluyen dos tipos de carcinomas cuyo rasgo común es su origen en la médula renal. Comparten una discusión continua en la literatura médica, con muchas opiniones en las que se polemiza sobre su posible origen en la última porción de los ductos colectores o su relación con el urotelio . Todo esto, unido a la escasez de casos provoca evidentes dificultades en el diagnóstico y manejo de estos pacientes. CARCINOMA DE LOS DUCTOS COLECTORES (CARCINOMA DE LOS CONDUCTOS DE BELLINI). Se define textualmente como : “Malignant epithelial tumour thought to be derived from the principal cells of the collecting duct of Bellini” (1). Ante esta definición hay que situar la microanatomía de la nefrona y recordar que los ductos colectores son la última parte de la nefrona distal cuyo trayecto medular corresponde a los conductos de Bellini (2), que terminan desembocando en la punta de la papila. Por lo tanto el epitelio de estos conductos se continua con el urotelio que reviste la papila en su parte externa. Es evidente que la relación anatómica de estos dos epitelios es muy estrecha. (3). Contexto clínico. Tumor infrecuente (hasta 1998 se habían descrito alrededor de 100 casos) (2). Constituye menos del 1% de las neoplasias renales (1,4), es más frecuente en el varón que en la mujer con una relación de 2:1 (1). Tiene un amplio espectro de presentación con mucha variabilidad (13-83 años) y una edad media de 55 años. Los síntomas son muy inespecíficos (dolor y hematuria) y los estudios con imagen sugieren muchas veces un tumor de vías urinarias altas (5). Pronóstico. Muy malo con 1/3 de casos metastásicos en el momento del diagnóstico y 2/3 mueren a los dos años (1,2). Llama la atención la publicación de trabajos con neoplasias catalogadas de carcinomas de los ductos colectores de bajo grado cuyo pronóstico es mejor que el descrito para las variantes clásicas. (6). Macroscopía Este es un dato muy importante porque participa en los criterios diagnósticos de manera significativa. La neoplasia está constituida por un tejido grisáceo y sólido o sólido/quístico y debe ser inicialmente medular, pero su gran tendencia a la invasión hace que con frecuencia nos encontremos con tumores extrarenales con invasión de la grasa hiliar o perirenal. Es característico que no deformen excesivamente la silueta renal (a diferencia de los carcinomas renales clásicos) (3,), en cambio sí que distorsionan las papilas de tal manera que es lógico que los estudios radiológicos se interpreten como lesiones de vías urinarias altas (5). Es frecuente observar lesiones satélites. Microscopía. Las descripciones microscópicas son muy variables pero las formas clásicas (2) hablan de un patrón papilar y túbulo-papilar asociado a desmoplasia estromal y un crecimiento extraordinariamente infiltrante Las células son de alto grado, pueden ser “hobnail” y el citoplasma suele ser eosinófilo. Caracen de glucógeno pero pueden contener mucina. Si se busca suele observarse displasia en el epitelio de los conductos colectores adyacentes al tumor. Además es habitual encontrar infiltrado inflamatorio agudo estromal y con frecuencia hay invasión vascular linfática y venosa. (1). Aunque en general se considera un tumor de alto grado, hay descripciones de neoplasias de los conductos colectores con patrones más bien tubulares o quísticos y de bajo grado (6 ). A todo esto hay que añadir su semejanza con los carcinomas que se originan en el urotelio de las puntas de las papilas (3, 7, 8). Ante tanta confusión , la OMS ha decidido establecer unos criterios mayores y menores para llegar a un diagnóstico de certeza (ver tabla). Inmunohistoquimia. En general tienen un inmunofenotipo de nefrona distal con alguna peculariedad que los distingue: Positividad a queratinas de bajo peso molecular, panqueratinas y queratinas de alto peso molecular . Positividad a Ulex europaeus . Positividad variable a EMA y Vimentina . Negatividad a CD10 y Villina. Alteraciones cromosómicas. Hay pocos estudios, pero en general hay alteraciones en el cromosoma 1 y amplificación de c-erbB-2/Her2 (9). Quizá lo más significativo es que no presentan alteraciones en 3p ni en el cromosoma 17. De todo esto se deduce que estos carcinomas comparten características de las neoplasias derivadas de la nefrona distal , pero también del urotelio (3, 7, 9). Diagnóstico diferencial. El aspecto macroscópico ayuda mucho a orientar el caso. Hay que recordar que estos tumores a diferencia de la mayoría de las noeplasias renales, tienen bordes mal definidos muy infiltrantes, de color grisáceo y de localizacion medular. Al microscopio básicamente se nos plantearán 3 diagnósticos diferenciales: 1. Carcinoma papilar de alto grado. En este caso nos puede ayudar el aspecto macroscópico y la inmunohisquimia.. 2. Carcinoma urotelial con invasión del parénquima renal. Hay que buscar la evidencia de un primario urotelial muestreando ampliamente el urotelio conservado adyacente a la neoplasia. 3. Neoplasia no clasificable. 4. Ocasionalmente, metástasis de adenocarcinoma. Nos puede ayudar la historia clínica. En cualquier caso en general es un diagnóstico DE EXCLUSIÓN y por lo tanto HAY QUE PENSAR EN ÉL para llegar al diagnóstico. Comentario. Aunque esta neoplasia es muy poco frecuente conviene reconocerla por el mal pronóstico que tiene y porque aunque no hay unanimidad al respecto, existen grupos de trabajo que se plantean otros tratamientos además del quirúrgico ante un diagnóstico de este tipo (10 ). Tabla 1. (1). CRITERIOS MAYORES: 1. Localización en médula (tumores pequeños) 2. Histología típica con arquitectura irregular tubular y alto grado nuclear. 3. Estroma desmoplásico con infiltrado inflamatorio y abundantes polimorfonucleares. 4. Reactividad a queratinas de alto peso molecular. 5. Reactividad a Ulex Europaeus 6. Ausencia de carcinoma urotelial. CRITERIOS MENORES: 1. Localización central (tumores grandes). 2. Arquitectura papilar con ejes fibrosos amplios y desmoplásicos. 3. Invasión renal y extrarenal extensa con invasión linfática y venosa. 4. Atipia epitelial intratubular en ductos adyacentes al tumor CARCINOMA MEDULAR DE RIÑÓN. Este tipo de neoplasia es aún más rara y aún más agresiva que la anterior. Definición: Tumor de crecimiento muy rápido asociado casi exclusivamente a anemia falciforme (OMS). Clínica. Aparece en edades muy jóvenes (10-40 años) con un promedio de 22 años y es más frecuente en varones. Síntomas inespecíficos (dolor y hematuria) pero con cierta frecuencia debuta ya con metástasis y, a veces, con masa palpable. Los estudios radiológicos se asemejan a los del carcinoma de los ductos colectores, pero el contexto clínico ayuda mucho al radiólogo a orientar el caso. Pronóstico. Infausto. El tiempo medio de sobrevida es de 15 semanas desde el diagnóstico. Hay metástasis frecuentes a hígado, pulmón y ganglios. Macroscopía Tumor de predominio medular constituido por tejido grisáceo de bordes mal definidos y con focos de necrosis y hemorragia. Microscopía. Tumor de alto grado con células de citoplasma eosinófilo y núcleos pleomórficos que adopta un patrón reticular o, a veces, criboso. Puede haber células de aspecto rabdoide o escamoide. El infiltrado inflamatorio es frecuente (como ocurre en los carcinomas de Bellini). Es posible identificar hematies falciformes. Comentario. Es una entidad controvertuida en la que hay autores que opinan que es una variante más agresiva del carcinoma de los ductos colectores (9, 11). Algunos estudios hechos con microarrays de ADN, los coloca más cerca de los caricnomas uroteliales que del resto de carcinomas renales (12). BIBLIOGRAFÍA. 1. Srigley JR and Moch H.: Carcinoma of the collecting ducts of Bellini in Eble NJ, Sauter G, Epstein JI et al (Eds). 1: Classification of Tumours. Tumorours of the Urinary System and Male Genital Organs. Lyon IARC Press, 2004 pp: 3334. 2. Srigley JR, Eble JN. Collecting Duch carcinoma of Kidney. Seminal Diagn Pathol 15:54-67, 1998. 3. Orsola A, Trias I, Raventós CX, Español I, Cecchini L, Orsola I. Renal collecting (Bellini) duct carcinoma displays similar characteristics to upper tract urothelial carcinoma. Urology 65 (1): 49-54. 2005 4. Chao D., Zisman A., Pantuck AJ, Gitlitz BJ, Freedland SJ, Said JW, Figlin RA, Belldergrun AS. Collecting duct renal cell carcinoma: Clinical study of a rare tumor. The J. of Urol. 167:71-74, 2002 5. Fukuya T, Honda H, Grotok et al. Computed tomographic findings of Bellini duct carcinoma of the kidney. J. Comput. Assist. Tomogr. 20:399-403, 1996 6. MacLennan GT, Farrow GM, Bostwick DG. Low grade collecting duct carcinoma of the kidney: report of 13 cases of low grade mucin ous tubulocystic renal carcinoma of possible collecting duct origin. Urology 50 :679-684, 1997. 7. Kafe H., Verbatatz JM, Cocahnd-Priollet B, Castagnet J, Viellefond. Collecting duct carcinoma: an entity to be redefined?. Virchows Archiv 445 (6): 637-640, 2004. 8. Fujimoto H, Tobisu K, Sakamoto M, Kamiya M, Kakizoe T. Intraductal tumor involvement and renal parenchymal invasion of transitional cell carcinoma in the renal pelvis. The J. of Urol. 156:57-60, 1995 9. Polascik TJ, Bostwick DG, Cairns P. Molecular genetics and histopathologic features of adult distal nephron tumors. Urology 60:941-946, 2002. 10. MilowskiMI, Rosmarin A, Tickoo SK et al.: Active chemotherapy for collecting duct carcinoma of the kidney: a case report and review of the literature. Cancer 94: 111-116, 2002. 11. Eble: Renal Medullary carcinoma: a distinct entity emerging from the confusion of collecting duct carcinoma. Advances Anat. Pathol 23:233-238, 1996 12. Yang XY, Sugimura J., Tretiakova MS, et al.: Gene expresión profiling of renal medullary carcinoma: potential clinical relevance. Cancer 100(5): 976-985, 2004