Uso de las variantes del PCR en el estudio del virus del síndrome
Anuncio

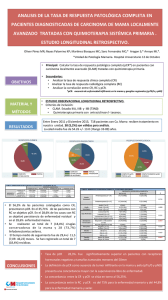
Sistema de Revisiones en Investigación Veterinaria de San Marcos USO DE LAS VARIANTES DEL PCR EN EL ESTUDIO DEL VIRUS DEL SÍNDROME RESPIRATORIO Y REPRODUCTIVO PORCINO REVISIÓN BIBLIOGRÁFICA - 2011 Autor: Mercy G. Ramírez Velásquez Universidad Nacional Mayor de San Marcos Facultad de Medicina Veterinaria TABLA DE CONTENIDO 1. 2. 2.1. 2.2. 2.3. 3. 4. 5. PRESENTACIÓN .................................................................................................... 2 CARACTERISTICAS VIRALES ............................................................................ 2 Taxonomía ................................................................................................................ 2 Genotipos .................................................................................................................. 3 Organización genómica .......................................................................................... 3 EL PCR Y SUS VARIANTES................................................................................. 3 CONCLUSIONES .................................................................................................... 5 BIBLIOGRAFÍA CITADA: ....................................................................................... 5 Postgrado – Autor: Mercy G. Ramírez Velásquez USO DE LAS VARIANTES DEL PCR EN EL ESTUDIO DEL VIRUS DEL SÍNDROME RESPIRATORIO Y REPRODUCTIVO PORCINO Mercy G. Ramírez Velásquez (mercyvet@gmail.com,) 1. PRESENTACIÓN En los últimos años, el uso de las técnicas convencionales como ensayo inmunoabsorvente ligada El presente artículo tiene por el objetivo hacer una breve revisión sobre a los estudios que se han realizado para enzimas (ELISA) y la inmunoperoxidasa identificar el VPRRS utilizando en monocapa (IPMA) han servido para principales variantes del PCR. las el diagnóstico del virus del Síndrome Respiratorio y Reproductivo Porcino Palabras clave: PCR, virus PRRS, (VPRRS) en hatos o granjas porcinas; nested PCR, multiplex PCR, tiempo real sin embargo estas pruebas serológicas PCR no permiten diferenciar a los animales vacunados infectados vacuna), de (en ni los naturalmente regiones recién donde se infectados, ni 2. CARACTERISTICAS VIRALES 2.1. Taxonomía El PRRS es causado por el virus portadores que no producen anticuerpos del detectables por estas pruebas. Las Reproductivo pruebas moleculares como la reacción VPRRS en cadena de la polimerasa (PCR) es Arteriviridae, junto al virus de la arteritis una y viral equina, al virus elevador de lactato y deshidrogenasa del ratón y al virus de la diferenciar genotipos virales por lo que fiebre hemorrágica del simio. La familia es Arteriviridae prueba permiten altamente identificar, considerada una sensible cuantificar herramienta diagnóstica más precisa y confiable. Síndrome Respiratorio Porcino pertenece junto (VPRRS). a con la la y El familia familia Coronaviridae forma el nuevo y estable Postgrado – Autor: Mercy G. Ramírez Velásquez orden Nidovirales (Snijder, 1998; Meulenberg, 2000; Morilla 2005). de 8 marcos lecturas abiertas (ORFs), 6 de los cuales son expresados para 2.2. Genotipos la formación de ARNs subgenómicos (Guarino et al., 1999). El VPRRS está dividido en dos genotipos de pero y polimerasa viral, los ORFs 2-6 codifica genéticamente distinguibles: el genotipo proteínas estructurales (GP2, GP3, Gp4, 1, el Europeo, también conocido como GP5 y M) y ORF7 la proteína de la virus Lelystad, y el genotipo 2 o nucleocápside (N) (Guarino et al., 1999; Americano (Guarino et al., 1999; OIE, Meulemberg, 2000). Hay tres principales 2008; Spilman et al., 2009). Existe una proteínas estructurales: la proteína GP5, considerable variabilidad entre ambos M y N, siendo la proteína GP5 la más genotipos, inclusive entre cepas del abundante glicoproteína de envoltura y mismo genotipo 2 (Kleiboeker et al., la principal inductora de anticuerpos 2005). Dependiendo del respectivo gen neutralizantes (Meulemberg, 2000; Yang bajo investigación, estos dos genotipos et al., 2000; Zheng et al., 2007). difieren la Mientras que la proteína N es la más secuencia de su ARN (Truyen et al., abundante proteína del virion y es 2006), teniendo solo cerca del 50-60% altamente antigénica, de utilizada para hasta identidad antigénica Los ORFs 1a y 1b codifican el ARN en un entre 50% sus en secuencias (Spilman et al., 2009). la por esto detección es de anticuerpos específicos al virus y para el diagnóstico de la enfermedad (Dea et 2.3. Organización genómica El genoma del VPRRS al., 2000). está contenido en una molécula simple de 3. EL PCR Y SUS VARIANTES ARN poliadenilado de polaridad positiva El PCR es una técnica molecular asociado a una cubierta proteica y a una altamente sensible y específica utilizada envoltura externa (Kleiboeker et al., para 2005; OIE, 2008). Su genoma consiste enfermedades Postgrado – Autor: Mercy G. Ramírez Velásquez el diagnóstico de infecciosas. muchas Hay numeroso estudios que señalan el uso VPRRS por un PCR convencional y de la PCR nested usando 6 pares de primers reacción en cadena de la polimerasa de diferentes regiones del genoma viral, (RT-PCR) para la identificación del con el objetivo de identificar primers ácido nucleico del VPRRS en muestras universales que permitan amplificar el de tejidos, suero y semen (Rovira et al., genoma de todos o de la mayoría de los 2007). Las variantes del PCR más aislados del VPRRS. Ellos demostraron utilizadas del que el ORF 7 es un blanco exitoso para VPRRS son el PCR nested, el PCR el diagnóstico del virus y que permitió la multiplex y el PCR en tiempo real. amplificación la transcriptasa para la reversa de identificación de los fragmentos En 1997 Gilbert et al. describió a correspondientes en todos los aislados la técnica del PCR multiplex y del PCR probados. Sin embargo, mencionan que nested multiplex para la diferenciación la de genotipos Europeos y Americanos disminuyó con muestras de suero, esto del VPRRS, con el fin de determinar el puede estar relacionado a pérdidas en más bajo limite de detección viral por el PCR. Ellos mostraron que la prueba del degradación del RNA por contaminación PCR nested multiplex es capaz de con detectar 10 dosis infectivas en Cultivo suero. sensibilidad de procedimiento ribonucleasas algunos de primers extracción presentes en o el de Tejido 50 (TCID50) en comparación con 103TCID50 que pudo detectar el Otra variante del PCR empleada PCR multiplex en muestras de suero de para la detección del VPRRS es el PCR animales experimentalmente infectados. en tiempo real (RRT-PCR) que tiene la La más alta sensibilidad del PCR nested ventaja, sobre el RT- PCR convencional, multiplex de consumir menos tiempo durante su tiene como ventaja la genotipificación directa del VPRRS. desarrollo y disminuir la probabilidad de contaminación de los amplificados de Guarino et al 1999, analizó 24 diferentes asilados de campo del ADN. El uso de una técnica como el RRT-PCR ofrece Postgrado – Autor: Mercy G. Ramírez Velásquez la oportunidad de detectar fácil y rápidamente ARN viral. Asimismo, puede monitorear amplicones 4. CONCLUSIONES • Las variantes del PCR más acumulados directamente, durante el utilizadas para la identificación proceso de amplificación del ADN (Yang molecular del VPRRS son el PCR et al., 2006). nested, PCR multiplex y el PCR Un estudio realizado por Yang et al., 2006 compararon los resultados obtenido de un RRT-PCR en en tiempo real. • Que el PCR en tiempo real es tiempo real utilizando SYBR green I con una un RT-PCR sensibilidad del técnica molecular convencional. La confiable RRT-PCR fue identificación del VPRRS. y segura más para la encontrada por ser de 10-100 veces más alta que el convencional RT-PCR. 5. BIBLIOGRAFÍA CITADA: Otro estudio desarrollado por Rovira et 1. Dea S, Gagnon CA, Mardassi H, al., 2007 evaluó la sensibilidad del RRT- Pirzadeh B, Rogan D. 2000. PCR en diferentes muestras biológicas, Current probadas individualmente y en mezcla structural de 3 a 5 muestras. Los resultados de reproductive and este estudio sugieren que el suero es la syndrome (PRRS) virus: mejor muestra para detectar el VPRRS comparison of North en verracos durante la infección aguda y American and European isolates. que el trabajo en mezcla de 3 a 5 Arch Virol 145: 659–688. knowledge proteins on of the porcine respiratory the muestras disminuye la sensibilidad del 2. Gilbert SA, Larochelle R, Magar RT-PCR; ya que, cerca del 6% de las R, Cho HJ, Deregt D. 1997. muestras que pudieran ser detectadas Typing of porcine reproductive por RT-PCR en muestras de suero and respiratory syndrome viruses individuales pueden ser pérdidas si ellas by a multiplex PCR assay. J. Clin. fueran corridas en una mezcla de 5 Microbiol. 35: 264-267. muestras. 3. Guarino H, Goyal SM, Murtaugh MP, Morrison RB, Kapur V. Postgrado – Autor: Mercy G. Ramírez Velásquez 1999. Detection reproductive syndrome of and virus porcine 8. Rovira Clement T, Christopher-Hennings respiratory by A, J, Thompson B, Engle M, Reicks reverse D, reaction using different regions of Evaluation of the sensibility of the viral genome. J vet Invest 11: reverse transcription polymerase 27-33. chain reacción to detect porcine 4. Kleiboeker SB, Schommer SK, Muñoz-Zanzi 2007. transcription- polymerase chain reproductive and Cl. respiratory Lee SM, Watkins S, Chittick W, syndrome virus on individual and Polson D. 2005. Simultaneous pooled samples from boars. J Vet detection of North American and Diagn Invest 19: 502-509. European porcine reproductive 9. Snijder EJ, Meulenberg JJM. and respiratory syndrome virus 1998. The molecular biology of using arteriviruses. J Gen Virol 79: 961- real-time quantitative 979. reverse transcriptase- PCR. J Vet Diagn Invest 17: 165-170. 10. Spilman MS, Welbon C, Nelson 5. Meulenberg JM. 2000. PRRSV, E, 6. Morilla A. 2005. Manual para el de las T. 2009. Cryo- electron tomography of porcine the virus. Vet Res. 31: 11-21 control Dokland reproductive and respiratory syndrome virus: organization of enfermedades infecciosas de los cerdos. 2a ed. the México. General Virology. 90: 527-535. El manual Moderno: nucleocapsid. Journal og 11. Truyen U, Wilhem S, Genzow 315p. 7. (OIE) Organización Mundial de M, Schageman G. 2006. Porcine Sanidad Animal. 2008. PRRS: Reproductive the diagnosis, Syndrome Virus (PRRSV): A ring prevention and control. Report of test performed in Germany to the OIE Ad hoc Group on PRRS/ Asess disease, its Paris, 9-11. Postgrado – Autor: Mercy G. Ramírez Velásquez and RT-PCR Respiratory dteccion methods. J. Vet. Med. B53: 1874. 12. Yang L, Frey L, Yoon KJ, Zimmerman JJ, Platt KB. 2000. Categorization of North American porcine reproductive respiratory and syndrome viruses: Epitopic profiles of the N, M, GP5 and GP3 susceptibility proteins to and neutralization. Arch Virol 145: 1599–1619. 13. Yang Z-Z, Fang WH, Habib M. 2006. First results of detection de PRRSV and CSFV RNA by SYBR green I- based quantitative PCR. J. Vet. Med. B 53, 461–467. 14. Zheng Q, Desheng Ch, Li P, Bi Z, Cao R, Zhou B, Chen P. 2007. Co-expressing GP5 and M proteins under different promoters in recombinant modified vaccinia virus ankara vaccine vector humoral and (rMVA)-based enhanced cellular the immune responses of porcine reproductive and respiratory syndrome virus (PRRSV). Virus Genes 35:585– 595. Postgrado – Autor: Mercy G. Ramírez Velásquez