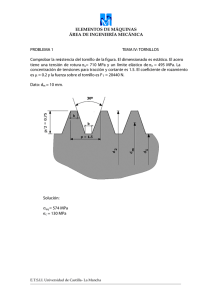
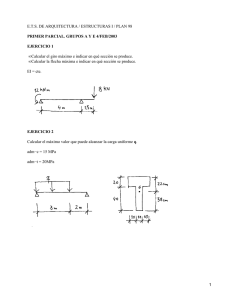
anexo i resumen de características del producto
Anuncio

The European Agency for the Evaluation of Medicinal Products Human Medicines Evaluation Unit ANEXO I RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 7 Westferry Circus, Canary Wharf, London E14 4HB, UK Tel: (+44-171) 418 84 00 Fax: (+44-171) 418 85 51 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE COMERCIAL ® CellCept 250 mg, cápsulas micofenolato mofetilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene 250 mg de micofenolato mofetilo. 3. FORMA FARMACÉUTICA CellCept cápsulas: oblongas, de color azul/marrón, con la inscripción "CellCept 250" en la mitad superior y el “logotipo de la empresa” en la mitad inferior. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas CellCept, en combinación con ciclosporina y corticosteroides, está indicado para la profilaxis del rechazo agudo de trasplante en pacientes sometidos a trasplante renal alogénico. 4.2 Posología y forma de administración La dosis inicial de CellCept debe administrarse por vía oral, dentro de las 72 horas siguientes al trasplante. La dosis recomendada en trasplantados renales es de 1,0 g administrado dos veces al día (dosis diaria de 2 g ). Aunque en los ensayos clínicos se estudiaron dosis diarias de 2 g y 3 g, no pudo establecerse ventaja alguna en cuanto a eficacia, para la dosis de 3 g. En los pacientes tratados con 2 g diarios de CellCept, el perfil toxicológico global fue mejor que en los tratados con 3 g diarios. Uso en niños: No se ha establecido la seguridad y eficacia en pacientes pediátricos. Los datos farmacocinéticos sobre trasplantes renales en pediatría son muy limitados. Uso en ancianos: La dosis recomendada en pacientes ancianos es de 1,0 g administrado dos veces al día. Los pacientes de este grupo de edad pueden presentar generalmente mayor riesgo de sufrir efectos adversos, comparando con individuos más jóvenes; esto es igualmente cierto para pacientes ancianos que hayan recibido CellCept como parte de un régimen inmunosupresor combinado, (ver 4.8 Reacciones adversas). Uso en pacientes con insuficiencia renal grave: En pacientes con insuficiencia renal 2 crónica grave (filtración gromerular < 25 ml/min/1,73 m ), deben evitarse dosis superiores a 1 g dos veces al día fuera del período inmediatamente posterior al trasplante. A estos pacientes se los debe observar cuidadosamente. No son necesarios ajustes posológicos en pacientes con retardo funcional del órgano trasplantado en el postoperatorio (v. 5.2 Propiedades Farmacocinéticas). Uso en pacientes con insuficiencia hepática grave: Los pacientes con enfermedad grave del parénquima hepático, no precisan ajuste de dosis. Otras consideraciones: 3 En caso de neutropenia (recuento absoluto de neutrófilos < 1,3 x 10 /µl), el médico debe efectuar las pruebas diagnósticas necesarias, tomar las medidas adecuadas para el tratamiento del paciente, y considerar la interrupción de la administración de CellCept. La presencia de alimentos no afecta la AUC (área bajo la curva) del MPA (ácido micofenólico), si bien ha demostrado reducir la Cmáx hasta un 40 %. Por tanto, se recomienda administrar CellCept con el estómago vacío. En caso de un cuadro de rechazo no es necesario reducir la dosis o interrumpir el tratamiento. El tratamiento debe ser iniciado por especialistas debidamente cualificados en trasplante renal y la continuación del tratamiento debe permanecer bajo la vigilancia de especialistas igualmente cualificados. 4.3 Contraindicaciones Se han descrito reacciones alérgicas a CellCept. Por consiguiente, este medicamento está contraindicado en pacientes con hipersensibilidad al micofenolato mofetilo o al ácido micofenólico. Para información sobre su uso durante el embarazo así como las medidas contraceptivas a adoptar, véase el apartado 4.6 Embarazo y lactancia. 4.4 Advertencias y precauciones especiales de empleo Al igual que en el tratamiento inmunosupresor con asociaciones de fármacos, los pacientes que reciben CellCept como parte de un régimen inmunosupresor presentan un mayor riesgo de desarrollar linfomas y otras enfermedades malignas, en especial de la piel. El riesgo parece estar relacionado con la intensidad y la duración de la inmunosupresión más que con el uso de un fármaco determinado. La supresión excesiva del sistema inmunitario puede aumentar también la vulnerabilidad a las infecciones. En ensayos clínicos se ha administrado CellCept en combinación con los siguientes productos: globulina antitimocítica, OKT3, ciclosporina y corticosteroides. En los estudios controlados sobre prevención del rechazo, en regímenes que incluían alguno o todos los agentes inmunosupresores mencionados anteriormente, se produjeron enfermedades linfoproliferativas o linfomas en el 1% de los pacientes que recibieron 3 g diarios de CellCept y en el 0,6% de los pacientes que recibieron 2 g diarios. En los tres estudios controlados de prevención del rechazo, se registraron tasas similares de infección mortal (<2%) tanto en los pacientes medicados con CellCept como en los que recibieron un tratamiento de control en regímenes que incluían alguno o todos los agentes inmunosupresores mencionados anteriormente. Hasta un 2,0% de los pacientes tratados con 3 g diarios de CellCept para la prevención del rechazo presentaron neutropenia grave (recuento absoluto de neutrófilos < 500/µl). Un total del 0,5 % de los pacientes que recibieron 2 g de CellCept y el 0,8 % de pacientes que recibieron azatioprina desarrollaron neutropenia grave. Así pues, a los pacientes medicados con CellCept se les debe vigilar, al objeto de detectar una posible neutropenia. Su aparición puede estar relacionada con el propio CellCept, otras medicaciones concomitantes, infecciones víricas o una combinación de estos factores. Controles de laboratorio: En los pacientes tratados con CellCept se deben realizar hemogramas completos un vez por semana durante el primer mes, dos veces al mes durante los meses segundo y tercero de tratamiento y, a continuación, una vez al mes durante todo el resto del primer año. Si aparece neutropenia (recuento absoluto de 3 neutrófilos <1,3 x 10 /µl), el médico debe efectuar las pruebas diagnósticas necesarias, tomar las medidas adecuadas para el tratamiento del paciente, y considerar la interrupción de la administración de CellCept. Se han observado hemorragias digestivas en aproximadamente un 3% de los pacientes tratados con 3 g diarios de CellCept y en el 1,4 % de pacientes tratados con 2 g diarios de CellCept. Se han descrito también perforaciones digestivas (de colon, vesícula biliar). En los tres ensayos controlados de prevención del rechazo, se registró perforación del colon en un 1,0% de los pacientes que recibieron 3 g diarios de CellCept, en un 0,4 % de pacientes que recibieron 2 g diarios de CellCept, en un 0,3 % de los pacientes que recibieron azatioprina y en ningún paciente de los que recibieron placebo. Dado que el tratamiento con CellCept se ha asociado a un aumento de la incidencia de reacciones adversas del aparato digestivo, incluidos algunos casos aislados de úlcera y hemorragia, la administración de CellCept debe realizarse con precaución en pacientes con enfermedad activa grave del aparato digestivo. Pacientes con insuficiencia renal crónica grave (filtración glomerular <25 2 ml/min/1,73m ) tratados con dosis únicas de CellCept presentaron valores de AUC (área bajo la curva) de ácido micofenólico (MPA) y glucurónido de ácido micofenólico (MPAG) más altos que los de sujetos con menor deterioro renal o sanos. A tales pacientes no se les deben administrar dosis superiores a 1 g dos veces al día y se les debe mantener en estrecha observación (v. 4.2 Posología y forma de administración y 5.2 Propiedades Farmacocinéticas ). En pacientes con retardo funcional del órgano trasplantado, el valor medio de AUC0-12 del MPA era comparable al observado en pacientes sin tal retardo, pero el valor de AUC0-12 del MPAG era 2-3 veces superior. No se recomiendan ajustes posológicos en estos pacientes, pero se les debe mantener en estrecha observación. (v. 4.2 Posología y forma de administración y 5.2 Propiedades Farmacocinéticas). No se recomienda administrar CellCept al mismo tiempo que azatioprina, ya que su administración concomitante no se ha estudiado. Teniendo en cuenta la reducción significativa del AUC del MPA que produce la colestiramina, la administración concomitante de CellCept y fármacos que interfieran en la recirculación enterohepática exige precaución, dada la posibilidad de que disminuya la eficacia de CellCept. 4.5 Interacción con otros medicamentos y otras formas de interacción aciclovir: Se observaron concentraciones plasmáticas de MPAG y aciclovir más altas tras la administración de micofenolato mofetilo con aciclovir que con cualquiera de estos fármacos por separado. Dado que las concentraciones plasmáticas de MPAG y aciclovir aumentan cuando está deteriorada la función renal, existe la posibilidad de que los dos fármacos compitan en la secreción tubular y, como consecuencia, se eleve aún más la concentración de ambos. antiácidos con hidróxidos de magnesio y aluminio: La absorción del micofenolato mofetilo disminuyó tras su administración con antiácidos. colestiramina: Tras la administración de una dosis única de 1,5 g de micofenolato mofetilo a sujetos sanos tratados previamente con 4 g de colestiramina tres veces al día durante 4 días, disminuyó en un 40% el AUC del MPA. ciclosporina A: La farmacocinética de la ciclosporina A no experimentó variaciones por el micofenolato mofetilo. ganciclovir: No se observó ninguna interacción farmacocinética entre el micofenolato mofetilo y el ganciclovir i.v. anticonceptivos orales: No se observó ninguna interacción farmacocinética entre el micofenolato mofetilo y la asociación de noretisterona (1 mg) y etinilestradiol (35 µg). Este estudio de dosis única pone de manifiesto la ausencia de interacciones farmacocinéticas importantes, pero no permite descartar la posibilidad de que se produzcan modificaciones farmacocinéticas de los anticonceptivos orales en un tratamiento a largo plazo con CellCept, lo que podría influir negativamente en la eficacia de los anticonceptivos. trimetoprim/sulfametoxazol: No se observó ningún efecto sobre la biodisponibilidad del MPA. otras interacciones: La administración conjunta de probenecida y micofenolato mofetilo en el mono eleva al triple el valor del AUC de MPAG. En consecuencia, otros fármacos con secreción tubular renal pueden competir con el MPAG y provocar así un aumento de las concentraciones plasmáticas de MPAG o del otro fármaco sujeto a secreción tubular. Estudios de dosis única de CellCept con ganciclovir y trimetoprim/sulfametoxazol no evidenciaron ninguna interacción farmacocinética entre CellCept y cualquiera de estos agentes; no obstante, dado que todos estos compuestos actúan mediante inhibición de la síntesis de nucleósidos, no puede excluirse una interacción clínica entre ellos. 4.6 Embarazo y lactancia Se produjeron efectos adversos en el desarrollo fetal (incluidas malformaciones) cuando se administró el fármaco a ratas y conejas preñadas durante la organogénesis (v. 5.3 Datos preclínicos sobre seguridad). Sólo debe utilizarse CellCept durante el embarazo si los beneficios esperados son mayores que el riesgo potencial para el feto, debido a que no existen estudios adecuados y bien controlados en mujeres embarazadas. Se recomienda no iniciar el tratamiento con CellCept hasta disponer de una prueba de embarazo negativa. Debe indicarse a las pacientes que consulten inmediatamente a su médico en caso de quedar embarazadas. Debe utilizarse un sistema contraceptivo eficaz antes de iniciar el tratamiento con CellCept, a lo largo del mismo y durante las seis semanas siguientes a su terminación. Aunque los resultados de un estudio de interacción farmacológica con un anticonceptivo oral, utilizando dosis únicas, indican que no se producen interacciones farmacocinéticas importantes, estos resultados no permiten descartar la posibilidad de modificaciones de la farmacocinética del anticonceptivo oral con un tratamiento prolongado con CellCept, lo que podría influir negativamente en la eficacia del anticonceptivo (v. 4.5 Interacción con otros medicamentos y otras formas de interacción). Los estudios realizados en ratas han demostrado que el micofenolato mofetilo se excreta en la leche. No se sabe si este fármaco pasa también a la leche humana. Dado que muchos fármacos se excretan en la leche humana, y teniendo en cuenta la posibilidad de reacciones adversas graves en los lactantes por la acción del micofenolato mofetilo, debe decidirse entre la suspensión de la lactancia materna o la del consumo del fármaco, considerando la importancia del medicamento para la madre. 4.7 Efectos sobre la capacidad para conducir vehículos y utilizar maquinaria No se han realizado estudios específicos al respecto. El perfil farmacodinámico y las reacciones adversas descritas indican que es improbable tal efecto. 4.8 Reacciones adversas El perfil toxicológico asociado al empleo de fármacos inmunosupresores es a menudo difícil de establecer, debido a la presencia de una enfermedad subyacente y al uso simultáneo de otros muchos medicamentos. Las principales reacciones adversas asociadas a la administración de CellCept consisten en diarrea, leucopenia, sepsis y vómitos; se han observado, además, indicios de una frecuencia más alta de ciertos tipos de infección. Se indican a continuación las reacciones adversas notificadas en ≥10% de los pacientes tratados con CellCept en los tres ensayos controlados de fase III para la prevención del rechazo. GENERALES: sepsis, infección, dolor abdominal, fiebre, dolor torácico, dolor, cefalea, dolor lumbar, astenia. HEMÁTICAS Y LINFÁTICAS: anemia, leucopenia, trombocitopenia, anemia hipocrómica, leucocitosis. UROGENITALES: infección urinaria, trastornos urinarios, necrosis tubular renal, hematuria. CARDIOVASCULARES: hipertensión. METABÓLICAS Y NUTRICIONALES: hiperpotasemia, hiperglucemia, hipofosfatemia, hipopotasemia, hipercolesterolemia, edema periférico, edema. DIGESTIVAS: diarrea, vómitos, estreñimiento, náuseas, nauseas y vómitos, dispepsia, candidiasis oral. RESPIRATORIAS: neumonía, infección, disnea, bronquitis, faringitis, aumento de la tos. PIEL Y ANEJOS: Herpes simplex, acné. NERVIOSAS: mareo, insomnio, temblor. En tres ensayos controlados para la prevención del rechazo, los pacientes tratados con 2 g diarios de CellCept presentaron un perfil de seguridad global más favorable que el de los pacientes tratados con 3 g diarios de CellCept. La sepsis, generalmente una viremia por CMV, fue ligeramente más frecuente en los pacientes tratados con CellCept que en los controles y fue ligeramente más frecuente en los pacientes que recibieron 3 g diarios que en aquellos que recibieron 2 g diarios. En el aparato digestivo, la diarrea aumentó más claramente en los pacientes tratados con CellCept que en los medicados con azatioprina o placebo. También hubo un ligero aumento de los vómitos. Estos efectos sobre el aparato digestivo fueron más frecuentes en los pacientes que recibieron 3 g diarios que en los que recibieron 2 g diarios. Las infecciones urinarias fueron frecuentes en todos los grupos de tratamiento, pero se observó un ligero incremento en los pacientes tratados con CellCept en comparación con los que recibieron azatioprina o placebo. La leucopenia fue más frecuente en pacientes tratados con CellCept que los pacientes control, y tuvo su máxima frecuencia en los que recibieron 3 g diarios de CellCept. La enfermedad hística invasiva por citomegalovirus (CMV) fue más frecuente en los pacientes medicados con 3 g diarios de CellCept que en los tratados con 2 g diarios de este fármaco o con un medicamento de control en los tres estudios controlados para la prevención del rechazo. De igual modo, la incidencia de candidemia, afectación hística invasiva por Candida y aspergilosis invasiva fue ligeramente más alta en los pacientes tratados con 3 g de CellCept al día que en los que recibieron 2 g de CellCept al día o un tratamiento de control para la prevención del rechazo. En los tres estudios controlados de prevención del rechazo, se han registrado unas tasas similares de infección mortal (<2%) en los pacientes que recibieron CellCept o un tratamiento de control en combinación con otros agentes inmunosupresores. La incidencia de afecciones malignas en los 1,483 pacientes incluidos en los tres ensayos controlados de prevención del rechazo, cuya evolución se siguió durante ≥1 año, fue similar a la incidencia descrita en la literatura médica para los pacientes receptores de un trasplante alogénico renal. Se observó un aumento de la incidencia de enfermedades linfoproliferativas en los grupos de tratamiento con CellCept (0,6% para la dosis de 2 g diarios y 1,0% para la de 3 g diarios) en comparación con los grupos placebo (0 %) y azatioprina (0,3 %). Hasta un 2,0 % de los pacientes tratados con 3 g diarios de CellCept para la prevención del rechazo presentaron neutropenia grave (recuento absoluto de neutrófilos <500/µl). Un total del 0,5 % de los pacientes que recibieron 2 g diarios de CellCept y el 0,8 % de los pacientes que recibieron azatioprina presentaron neutropenia grave. De entre los 1,483 pacientes incluidos en los tres estudios controlados sobre prevención del rechazo, hubo un número relativamente pequeño de pacientes ancianos (7 %). Estos pacientes, particularmente aquellos que recibieron CellCept como parte de un régimen inmunosupresor combinado, pueden presentar mayor riesgo de padecer ciertas infecciones (incluyendo la enfermedad hística invasiva por CMV) y posiblemente hemorragia gastrointestinal y edema pulmonar, comparado con individuos más jóvenes. Otros efectos observados en una frecuencia aparentemente más alta en ancianos incluyeron leucopenia, creatinina sérica elevada y disnea; sin embargo, estos efectos no fueron más frecuentes en pacientes que recibieron CellCept que en aquellos que recibieron azatioprina. No hubo aumento ni en las afecciones malignas ni en la mortalidad en este grupo de edad. Las siguientes reacciones adversas, no citadas anteriormente, fueron notificadas con una incidencia ≥3% y < 10% en los pacientes tratados con CellCept: GENERALES: quiste (incluyendo linfocele e hidrocele), hemorragia, hernia, malestar, distensión abdominal, escalofríos y fiebre, síndrome gripal, dolor pélvico, edema facial. HEMÁTICAS Y LINFÁTICAS: policitemia, equimosis. UROGENITALES: albuminuria, hidronefrosis, pielonefritis, disuria, dolor, impotencia, poliuria. CARDIOVASCULARES: trombosis, angina de pecho, fibrilación auricular, hipotensión, trastornos vasculares periféricos, trastorno cardiovascular, hipotensión postural, taquicardia, palpitaciones, vasodilatación. METABÓLICAS Y NUTRICIONALES: aumento de creatinina, aumento de gammaglutamil- transpeptidasa, hiperlipemia, deshidratación, hipoglucemia, aumento de SGPT, aumento de SGOT, hipervolemia, acidosis, hipocalcemia, aumento de ácido láctico deshidrogenasa, hipercalcemia, aumento de fosfatasa alcalina, hipoproteinemia, hiperuricemia, aumento de peso. DIGESTIVAS: hemorragia digestiva, íleo, gastritis, gastroenteritis, esofagitis, hepatitis, infección, pruebas de la función hepática anormales, candidiasis gastrointestinal, trastorno rectal, anorexia, flatulencia, hiperplasia gingival, gingivitis, ulceración bucal. RESPIRATORIAS: edema pulmonar, sinusitis, trastorno pulmonar, asma, derrame pleural, rinitis. PIEL Y ANEJOS: carcinoma cutáneo, úlcera cutánea, herpes zoster, neoplasia cutánea benigna, trastorno cutáneo, hipertrofia cutánea, sudoración, alopecia, erupción cutánea, hirsutismo, dermatitis fúngica, prurito. NERVIOSAS: depresión, somnolencia, parestesias, hipertonía, ansiedad. ENDOCRINAS: diabetes mellitus, trastorno paratiroideo. MUSCULOESQUELÉTICAS: artralgia, mialgia, trastorno articular, calambres en las piernas, miastenia. ÓRGANOS DE LOS SENTIDOS: cataratas (no especificado), conjuntivitis, ambliopía. 4.9 Sobredosificación No se ha descrito ningún caso de sobredosis de micofenolato mofetilo en el ser humano. A las concentraciones que se alcanzan clínicamente, el MPA y MPAG no son eliminados mediante hemodiálisis. Sin embargo, con concentraciones plasmáticas altas de MPAG (> 100 µg/ml), se eliminan pequeñas cantidades del mismo. Por interferir con la circulación enterohepática del fármaco, los secuestradores de ácidos biliares, como la colestiramina, reducen el AUC del MPA. 5. PROPIEDADES FARMACOLOGICAS 5.1 Propiedades farmacodinámicas El micofenolato mofetilo es el éster 2-morfolinoetílico del MPA. El MPA es un inhibidor potente, selectivo, no competitivo y reversible de la inosinmonofosfato-deshidrogenasa; inhibe, por tanto, la síntesis de novo del nucleótido guanosina, sin incorporación al ADN. Dado que los linfocitos T y B dependen de una manera decisiva para su proliferación de la síntesis de novo de purinas -mientras que otros tipos de células pueden utilizar mecanismos de recuperación de purinas-, el MPA tiene unos efectos citostáticos más potentes en los linfocitos que en otras células. 5.2 Propiedades farmacocinéticas El MPA, a concentraciones clínicamente relevantes, se une en un 97% a la albúmina plasmática. Tras la administración oral, el micofenolato mofetilo se absorbe rápida y ampliamente; a continuación se transforma en MPA, su metabolito activo, en un proceso de metabolización presistémica completa. El micofenolato mofetilo no es detectable sistémicamente en el plasma tras su administración oral. El MPA se metaboliza principalmente por la glucuronil-transferasa, para formar el glucurónido fenólico del MPA (MPAG), sin actividad farmacológica. Como consecuencia de la recirculación enterohepática, se suelen observar aumentos secundarios de la concentración plasmática de MPA después de aproximadamente 6-12 horas de la administración. Con la coadministración de colestiramina (4 g tres veces al día), se produce una reducción del AUC del MPA del orden del 40%, lo que es indicativo de una recirculación enterohepática importante. La cantidad del fármaco que se excreta en forma de MPA con la orina es despreciable (<1 % de la dosis). Tras la administración por vía oral de micofenolato mofetilo radiomarcado, la recuperación de la dosis administrada fue completa. Un 93% de la dosis se recuperó en la orina y un 6% en las heces. La mayor parte de la dosis administrada (alrededor del 87%) se excreta por la orina en forma de MPAG. La biodisponibilidad media del micofenolato mofetilo por vía oral, determinada mediante el AUC del MPA, fue del 94% en comparación con la del micofenolato mofetilo por vía intravenosa. Los alimentos no tuvieron ningún efecto en el grado de absorción (AUC del MPA) del micofenolato mofetilo administrado a dosis de 1,5 g dos veces al día a trasplantados renales. Sin embargo, se produjo una disminución del 40% en la Cmáx de MPA en presencia de alimentos. Los valores medios del AUC y Cmáx del MPA en el período postrasplante inmediato (< 40 días) son aproximadamente un 50 % más bajos en los trasplantados renales que en los voluntarios sanos o en los trasplantados renales que se encuentran ya en una fase estable. En un estudio de dosis única (6 individuos por grupo), se observó que para los individuos 2 con insuficiencia renal crónica grave (filtración glomerular <25 ml/min/1,73m ), el valor medio del AUC para el MPA plasmático fue de un 28 - 75 % superior que para individuos sanos normales o en pacientes con menor deterioro renal. Sin embargo, el valor medio del AUC del MPAG tras una dosis única en los sujetos con insuficiencia renal grave, fue 3-6 veces superior al presentado en los pacientes con deterioro renal leve o en los voluntarios sanos, lo que concuerda con la eliminación renal conocida del MPAG. No se ha estudiado la administración de dosis múltiples de micofenolato mofetilo en pacientes con insuficiencia renal crónica grave. En pacientes con retardo funcional del órgano trasplantado, el valor medio del AUC0-12 del MPA fue comparable al observado en los pacientes sin retardo funcional postrasplante. Asimismo, el valor medio del AUC0-12 del MPAG fue 2-3 veces superior al de los pacientes trasplantados sin retardo de la función del órgano. En voluntarios con cirrosis alcohólica se comprobó que los procesos de glucuronidación hepática del MPA estaban relativamente poco afectados por la enfermedad del parénquima hepático. Los efectos de la hepatopatía en este proceso dependen probablemente de la enfermedad concreta de que se trate. Sin embargo, una hepatopatía con predominio de la afectación biliar, como la cirrosis biliar primaria, puede tener un efecto diferente. No se ha evaluado formalmente el comportamiento farmacocinético de CellCept en pacientes ancianos. 5.3 Datos Preclínicos de Seguridad En modelos experimentales, el micofenolato mofetilo no fue tumorogénico ni tuvo actividad mutagénica. La dosis más alta ensayada en los estudios de carcinogénesis en animales resultó ser aproximadamente de 2 a 3 veces la exposición sistémica (AUC o Cmáx) observada en pacientes trasplantados renales a la dosis clínica recomendada de 2 g diarios. El micofenolato mofetilo no tuvo efecto alguno en la fertilidad de las ratas macho a dosis orales de hasta 20 mg /kg/día. La exposición sistémica a esta dosis representa de 2 a 3 veces la exposición clínica a la dosis recomendada de 2 g diarios. En un estudio de la reproducción y la fertilidad llevado a cabo en ratas hembra, dosis orales de 4,5 mg/kg/día causaron malformaciones (incluyendo anoftalmia, agnatia, e hidrocefalia) en la primera generación de crías, sin que se detectara toxicidad en las madres. La exposición sistémica a esta dosis fue aproximadamente 0,5 veces la exposición clínica a la dosis recomendada de 2 g diarios. No se evidenció ningún efecto en la fertilidad y la reproducción de las ratas madre ni en la generación siguiente. En los estudios teratológicos se produjeron resorciones fetales y malformaciones con 6 mg/kg/ día en la rata (incluyendo anoftalmia, agnatia, e hidrocefalia) y 90 mg/kg/día en el conejo (incluyendo anormalidades cardiovasculares y renales, como ectopia del corazón y riñones ectópicos, y hernia diafragmática y umbilical), sin que se registrara toxicidad materna. La exposición sistémica a estos niveles son aproximadamente equivalentes o menores a 0,5 veces la exposición clínica a la dosis recomendada de 2 g diarios. Ver sección 4.6 Embarazo y lactancia. Los sistemas hematopoyético y linfoide fueron los primeros órganos afectados en los estudios toxicológicos conducidos con micofenolato mofetilo en la rata, ratón, perro y mono. Estos efectos ocurrieron a niveles de exposición sistémica que son equivalentes o menores a la exposición clínica a la dosis recomendada de 2 g diarios. En el perro se observaron efectos gastrointestinales a niveles de exposición sistémica equivalentes o menores a la exposición clínica a la dosis recomendada. En el mono, a la dosis más alta (niveles de exposición sistémica equivalente a o mayor que la exposición clínica), también se observaron efectos gastrointestinales y renales consistentes con la deshidratación. El perfil toxicológico no-clínico de micofenolato mofetilo parece ser consistente con los efectos adversos observados en los ensayos clínicos humanos que ahora proporcionan datos de seguridad de mas relevancia para la población de pacientes. (ver 4.8 Reacciones adversas). 6. DATOS FARMACÉUTICOS 6.1 Relación de Excipientes Los excipientes de las cápsulas de CellCept son los siguientes: almidón de maíz pregelatinizado, croscarmelosa sódica, polividona K-90 y estearato magnésico. La envoltura de la cápsula contiene gelatina, índigo carmín (FP, E132), óxido de hierro amarillo (FP, E172), óxido de hierro rojo (FP, E172), dióxido de titanio (EP, E171), laurilsulfato sódico, óxido de hierro negro (FP, E172), hidróxido de potasio, goma laca y dióxido de silicio (EP). 6.2 Incompatibilidades Ninguna 6.3 Período de Validez Las cápsulas de CellCept tienen un periodo de validez de 2 años, almacenados en envases blíster opacos de cloruro de polivinilo, a una temperatura no superior a los 30°C. 6.4 Precauciones Especiales de Conservación Conservar a una temperatura de 30°C o inferior. 6.5 Naturaleza y Contenido del Envase CellCept 250 mg cápsulas: 1 caja contiene 100 cápsulas (en blisters de 10 unidades). Una unidad de venta de 300 cápsulas contiene tres cajas de 100 cápsulas cada una 6.6 Instrucciones Para su uso / Manipulación Dado que el micofenolato mofetilo ha sido teratogénico en la rata y el conejo, no deben abrirse o triturarse las cápsulas de CellCept. Evítese la inhalación del polvo contenido en las cápsulas de CellCept, así como el contacto directo con la piel o las mucosas. En caso de contacto, lávese la parte afectada con abundante agua y jabón; los ojos deben lavarse con agua corriente. 7. NOMBRE O RAZÓN SOCIAL, DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Roche Registration Limited, 40 Broadwater Road, Welwyn Garden City, Hertfordshire, AL7 3AY, U.K. 8. NUMERO DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN 9. FECHA DE LA PRIMERA AUTORIZACION/REVALIDACIÓN DE LA AUTORIZACION 10. FECHA DE LA REVISIÓN DEL TEXTO RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE COMERCIAL ® CellCept 500 mg, comprimidos micofenolato mofetilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 500 mg de micofenolato mofetilo. 3. FORMA FARMACÉUTICA CellCept comprimidos: oblongos, de color azul espliego, con la inscripción en negro de la marca "CellCept 500" en una cara y el “logotipo de la empresa” en la otra. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas CellCept, en combinación con ciclosporina y corticosteroides, está indicado para la profilaxis del rechazo agudo de trasplante en pacientes sometidos a trasplante renal alogénico. 4.2 Posología y forma de administración La dosis inicial de CellCept debe administrarse por vía oral, dentro de las 72 horas siguientes al trasplante. La dosis recomendada en trasplantados renales es de 1,0 g administrado dos veces al día (dosis diaria de 2 g ). Aunque en los ensayos clínicos se estudiaron dosis diarias de 2 g y 3 g, no pudo establecerse ventaja alguna en cuanto a eficacia, para la dosis de 3 g. En los pacientes tratados con 2 g diarios de CellCept, el perfil toxicológico global fue mejor que en los tratados con 3 g diarios. Uso en niños: No se ha establecido la seguridad y eficacia en pacientes pediátricos. Los datos farmacocinéticos sobre trasplantes renales en pediatría son muy limitados. Uso en ancianos: La dosis recomendada en pacientes ancianos es de 1,0 g administrado dos veces al día. Los pacientes de este grupo de edad pueden presentar generalmente mayor riesgo de sufrir efectos adversos, comparando con individuos más jóvenes; esto es igualmente cierto para pacientes ancianos que hayan recibido CellCept como parte de un régimen inmunosupresor combinado, (ver 4.8 Reacciones adversas). Uso en pacientes con insuficiencia renal grave: En pacientes con insuficiencia renal 2 crónica grave (filtración gromerular < 25 ml/min/1,73 m ), deben evitarse dosis superiores a 1 g dos veces al día fuera del período inmediatamente posterior al trasplante. A estos pacientes se los debe observar cuidadosamente. No son necesarios ajustes posológicos en pacientes con retardo funcional del órgano trasplantado en el postoperatorio (v. 5.2 Propiedades Farmacocinéticas). Uso en pacientes con insuficiencia hepática grave: Los pacientes con enfermedad grave del parénquima hepático, no precisan ajuste de dosis. Otras consideraciones: 3 En caso de neutropenia (recuento absoluto de neutrófilos < 1,3 x 10 /µl), el médico debe efectuar las pruebas diagnósticas necesarias, tomar las medidas adecuadas para el tratamiento del paciente, y considerar la interrupción de la administración de CellCept. La presencia de alimentos no afecta la AUC (área bajo la curva) del MPA (ácido micofenólico), si bien ha demostrado reducir la Cmáx hasta un 40 %. Por tanto, se recomienda administrar CellCept con el estómago vacío. En caso de un cuadro de rechazo no es necesario reducir la dosis o interrumpir el tratamiento. El tratamiento debe ser iniciado por especialistas debidamente cualificados en trasplante renal y la continuación del tratamiento debe permanecer bajo la vigilancia de especialistas igualmente cualificados. 4.3 Contraindicaciones Se han descrito reacciones alérgicas a CellCept. Por consiguiente, este medicamento está contraindicado en pacientes con hipersensibilidad al micofenolato mofetilo o al ácido micofenólico. Para información sobre su uso durante el embarazo así como las medidas contraceptivas a adoptar, véase el apartado 4.6 Embarazo y lactancia. 4.4 Advertencias y precauciones especiales de empleo Al igual que en el tratamiento inmunosupresor con asociaciones de fármacos, los pacientes que reciben CellCept como parte de un régimen inmunosupresor presentan un mayor riesgo de desarrollar linfomas y otras enfermedades malignas, en especial de la piel. El riesgo parece estar relacionado con la intensidad y la duración de la inmunosupresión más que con el uso de un fármaco determinado. La supresión excesiva del sistema inmunitario puede aumentar también la vulnerabilidad a las infecciones. En ensayos clínicos se ha administrado CellCept en combinación con los siguientes productos: globulina antitimocítica, OKT3, ciclosporina y corticosteroides. En los estudios controlados sobre prevención del rechazo, en regímenes que incluían alguno o todos los agentes inmunosupresores mencionados anteriormente, se produjeron enfermedades linfoproliferativas o linfomas en el 1% de los pacientes que recibieron 3 g diarios de CellCept y en el 0,6% de los pacientes que recibieron 2 g diarios. En los tres estudios controlados de prevención del rechazo, se registraron tasas similares de infección mortal (<2%) tanto en los pacientes medicados con CellCept como en los que recibieron un tratamiento de control en regímenes que incluían alguno o todos los agentes inmunosupresores mencionados anteriormente. Hasta un 2,0% de los pacientes tratados con 3 g diarios de CellCept para la prevención del rechazo presentaron neutropenia grave (recuento absoluto de neutrófilos < 500/µl). Un total del 0,5 % de los pacientes que recibieron 2 g de CellCept y el 0,8 % de pacientes que recibieron azatioprina desarrollaron neutropenia grave. Así pues, a los pacientes medicados con CellCept se les debe vigilar, al objeto de detectar una posible neutropenia. Su aparición puede estar relacionada con el propio CellCept, otras medicaciones concomitantes, infecciones víricas o una combinación de estos factores. Controles de laboratorio: En los pacientes tratados con CellCept se deben realizar hemogramas completos un vez por semana durante el primer mes, dos veces al mes durante los meses segundo y tercero de tratamiento y, a continuación, una vez al mes durante todo el resto del primer año. Si aparece neutropenia (recuento absoluto de 3 neutrófilos <1,3 x 10 /µl), el médico debe efectuar las pruebas diagnósticas necesarias, tomar las medidas adecuadas para el tratamiento del paciente, y considerar la interrupción de la administración de CellCept. Se han observado hemorragias digestivas en aproximadamente un 3% de los pacientes tratados con 3 g diarios de CellCept y en el 1,4 % de pacientes tratados con 2 g diarios de CellCept. Se han descrito también perforaciones digestivas (de colon, vesícula biliar). En los tres ensayos controlados de prevención del rechazo, se registró perforación del colon en un 1,0% de los pacientes que recibieron 3 g diarios de CellCept, en un 0,4 % de pacientes que recibieron 2 g diarios de CellCept, en un 0,3 % de los pacientes que recibieron azatioprina y en ningún paciente de los que recibieron placebo. Dado que el tratamiento con CellCept se ha asociado a un aumento de la incidencia de reacciones adversas del aparato digestivo, incluidos algunos casos aislados de úlcera y hemorragia, la administración de CellCept debe realizarse con precaución en pacientes con enfermedad activa grave del aparato digestivo. Pacientes con insuficiencia renal crónica grave (filtración glomerular <25 2 ml/min/1,73m ) tratados con dosis únicas de CellCept presentaron valores de AUC de MPA y glucurónido de ácido micofenólico (MPAG) más altos que los de sujetos con menor deterioro renal o sanos. A tales pacientes no se les deben administrar dosis superiores a 1 g dos veces al día y se les debe mantener en estrecha observación (v. 4.2 Posología y forma de administración y 5.2 Propiedades Farmacocinéticas ). En pacientes con retardo funcional del órgano trasplantado, el valor medio de AUC0-12 del MPA era comparable al observado en pacientes sin tal retardo, pero el valor de AUC0-12 del MPAG era 2-3 veces superior. No se recomiendan ajustes posológicos en estos pacientes, pero se les debe mantener en estrecha observación. (v. 4.2 Posología y forma de administración y 5.2 Propiedades Farmacocinéticas). No se recomienda administrar CellCept al mismo tiempo que azatioprina, ya que su administración concomitante no se ha estudiado. Teniendo en cuenta la reducción significativa del AUC del MPA que produce la colestiramina, la administración concomitante de CellCept y fármacos que interfieran en la recirculación enterohepática exige precaución, dada la posibilidad de que disminuya la eficacia de CellCept. 4.5 Interacción con otros medicamentos y otras formas de interacción aciclovir: Se observaron concentraciones plasmáticas de MPAG y aciclovir más altas tras la administración de micofenolato mofetilo con aciclovir que con cualquiera de estos fármacos por separado. Dado que las concentraciones plasmáticas de MPAG y aciclovir aumentan cuando está deteriorada la función renal, existe la posibilidad de que los dos fármacos compitan en la secreción tubular y, como consecuencia, se eleve aún más la concentración de ambos. antiácidos con hidróxidos de magnesio y aluminio: La absorción del micofenolato mofetilo disminuyó tras su administración con antiácidos. colestiramina: Tras la administración de una dosis única de 1,5 g de micofenolato mofetilo a sujetos sanos tratados previamente con 4 g de colestiramina tres veces al día durante 4 días, disminuyó en un 40% el AUC del MPA. ciclosporina A: La farmacocinética de la ciclosporina A no experimentó variaciones por el micofenolato mofetilo. ganciclovir: No se observó ninguna interacción farmacocinética entre el micofenolato mofetilo y el ganciclovir i.v. anticonceptivos orales: No se observó ninguna interacción farmacocinética entre el micofenolato mofetilo y la asociación de noretisterona (1 mg) y etinilestradiol (35 µg). Este estudio de dosis única pone de manifiesto la ausencia de interacciones farmacocinéticas importantes, pero no permite descartar la posibilidad de que se produzcan modificaciones farmacocinéticas de los anticonceptivos orales en un tratamiento a largo plazo con CellCept, lo que podría influir negativamente en la eficacia de los anticonceptivos. trimetoprim/sulfametoxazol: No se observó ningún efecto sobre la biodisponibilidad del MPA. otras interacciones: La administración conjunta de probenecida y micofenolato mofetilo en el mono eleva al triple el valor del AUC de MPAG. En consecuencia, otros fármacos con secreción tubular renal pueden competir con el MPAG y provocar así un aumento de las concentraciones plasmáticas de MPAG o del otro fármaco sujeto a secreción tubular. Estudios de dosis única de CellCept con ganciclovir y trimetoprim/sulfametoxazol no evidenciaron ninguna interacción farmacocinética entre CellCept y cualquiera de estos agentes; no obstante, dado que todos estos compuestos actúan mediante inhibición de la síntesis de nucleósidos, no puede excluirse una interacción clínica entre ellos. 4.6 Embarazo y lactancia Se produjeron efectos adversos en el desarrollo fetal (incluidas malformaciones) cuando se administró el fármaco a ratas y conejas preñadas durante la organogénesis (v. 5.3 Datos preclínicos sobre seguridad). Sólo debe utilizarse CellCept durante el embarazo si los beneficios esperados son mayores que el riesgo potencial para el feto, debido a que no existen estudios adecuados y bien controlados en mujeres embarazadas. Se recomienda no iniciar el tratamiento con CellCept hasta disponer de una prueba de embarazo negativa. Debe indicarse a las pacientes que consulten inmediatamente a su médico en caso de quedar embarazadas. Debe utilizarse un sistama contraceptivo eficaz antes de iniciar el tratamiento con CellCept, a lo largo del mismo y durante las seis semanas siguientes a su terminación. Aunque los resultados de un estudio de interacción farmacológica con un anticonceptivo oral, utilizando dosis únicas, indican que no se producen interacciones farmacocinéticas importantes, estos resultados no permiten descartar la posibilidad de modificaciones de la farmacocinética del anticonceptivo oral con un tratamiento prolongado con CellCept, lo que podría influir negativamente en la eficacia del anticonceptivo (v. 4.5 Interacción con otros medicamentos y otras formas de interacción). Los estudios realizados en ratas han demostrado que el micofenolato mofetilo se excreta en la leche. No se sabe si este fármaco pasa también a la leche humana. Dado que muchos fármacos se excretan en la leche humana, y teniendo en cuenta la posibilidad de reacciones adversas graves en los lactantes por la acción del micofenolato mofetilo, debe decidirse entre la suspensión de la lactancia materna o la del consumo del fármaco, considerando la importancia del medicamento para la madre. 4.7 Efectos sobre la capacidad para conducir vehículos y utilizar maquinaria No se han realizado estudios específicos al respecto. El perfil farmacodinámico y las reacciones adversas descritas indican que es improbable tal efecto. 4.8 Reacciones adversas El perfil toxicológico asociado al empleo de fármacos inmunosupresores es a menudo difícil de establecer, debido a la presencia de una enfermedad subyacente y al uso simultáneo de otros muchos medicamentos. Las principales reacciones adversas asociadas a la administración de CellCept consisten en diarrea, leucopenia, sepsis y vómitos; se han observado, además, indicios de una frecuencia más alta de ciertos tipos de infección. Se indican a continuación las reacciones adversas notificadas en ≥10% de los pacientes tratados con CellCept en los tres ensayos controlados de fase III para la prevención del rechazo. GENERALES: sepsis, infección, dolor abdominal, fiebre, dolor torácico, dolor, cefalea, dolor lumbar, astenia. HEMÁTICAS Y LINFÁTICAS: anemia, leucopenia, trombocitopenia, anemia hipocrómica, leucocitosis. UROGENITALES: infección urinaria, trastornos urinarios, necrosis tubular renal, hematuria. CARDIOVASCULARES: hipertensión. METABÓLICAS Y NUTRICIONALES: hiperpotasemia, hiperglucemia, hipofosfatemia, hipopotasemia, hipercolesterolemia, edema periférico, edema. DIGESTIVAS: diarrea, vómitos, estreñimiento, náuseas, nauseas y vómitos, dispepsia, candidiasis oral. RESPIRATORIAS: neumonía, infección, disnea, bronquitis, faringitis, aumento de la tos. PIEL Y ANEJOS: Herpes simplex, acné. NERVIOSAS: mareo, insomnio, temblor. En tres ensayos controlados para la prevención del rechazo, los pacientes tratados con 2 g diarios de CellCept presentaron un perfil de seguridad global más favorable que el de los pacientes tratados con 3 g diarios de CellCept. La sepsis, generalmente una viremia por CMV, fue ligeramente más frecuente en los pacientes tratados con CellCept que en los controles y fue ligeramente más frecuente en los pacientes que recibieron 3 g diarios que en aquellos que recibieron 2 g diarios. En el aparato digestivo, la diarrea aumentó más claramente en los pacientes tratados con CellCept que en los medicados con azatioprina o placebo. También hubo un ligero aumento de los vómitos. Estos efectos sobre el aparato digestivo fueron más frecuentes en los pacientes que recibieron 3 g diarios que en los que recibieron 2 g diarios. Las infecciones urinarias fueron frecuentes en todos los grupos de tratamiento, pero se observó un ligero incremento en los pacientes tratados con CellCept en comparación con los que recibieron azatioprina o placebo. La leucopenia fue más frecuente en pacientes tratados con CellCept que los pacientes control, y tuvo su máxima frecuencia en los que recibieron 3 g diarios de CellCept. La enfermedad hística invasiva por citomegalovirus (CMV) fue más frecuente en los pacientes medicados con 3 g diarios de CellCept que en los tratados con 2 g diarios de este fármaco o con un medicamento de control en los tres estudios controlados para la prevención del rechazo. De igual modo, la incidencia de candidemia, afectación hística invasiva por Candida y aspergilosis invasiva fue ligeramente más alta en los pacientes tratados con 3 g de CellCept al día que en los que recibieron 2 g de CellCept al día o un tratamiento de control para la prevención del rechazo. En los tres estudios controlados de prevención del rechazo, se han registrado unas tasas similares de infección mortal (<2%) en los pacientes que recibieron CellCept o un tratamiento de control en combinación con otros agentes inmunosupresores. La incidencia de afecciones malignas en los 1,483 pacientes incluidos en los tres ensayos controlados de prevención del rechazo, cuya evolución se siguió durante ≥1 año, fue similar a la incidencia descrita en la literatura médica para los pacientes receptores de un trasplante alogénico renal. Se observó un aumento de la incidencia de enfermedades linfoproliferativas en los grupos de tratamiento con CellCept (0,6% para la dosis de 2 g diarios y 1,0% para la de 3 g diarios) en comparación con los grupos placebo (0 %) y azatioprina (0,3 %). Hasta un 2,0 % de los pacientes tratados con 3 g diarios de CellCept para la prevención del rechazo presentaron neutropenia grave (recuento absoluto de neutrófilos <500/µl). Un total del 0,5 % de los pacientes que recibieron 2 g diarios de CellCept y el 0,8 % de los pacientes que recibieron azatioprina presentaron neutropenia grave. De entre los 1,483 pacientes incluidos en los tres estudios controlados sobre prevención del rechazo, hubo un número relativamente pequeño de pacientes ancianos (7 %). Estos pacientes, particularmente aquellos que recibieron CellCept como parte de un régimen inmunosupresor combinado, pueden presentar mayor riesgo de padecer ciertas infecciones (incluyendo la enfermedad hística invasiva por CMV) y posiblemente hemorragia gastrointestinal y edema pulmonar, comparado con individuos más jóvenes. Otros efectos observados en una frecuencia aparentemente más alta en ancianos incluyeron leucopenia, creatinina sérica elevada y disnea; sin embargo, estos efectos no fueron más frecuentes en pacientes que recibieron CellCept que en aquellos que recibieron azatioprina. No hubo aumento ni en las afecciones malignas ni en la mortalidad en este grupo de edad. Las siguientes reacciones adversas, no citadas anteriormente, fueron notificadas con una incidencia ≥3% y < 10% en los pacientes tratados con CellCept: GENERALES: quiste (incluyendo linfocele e hidrocele), hemorragia, hernia, malestar, distensión abdominal, escalofríos y fiebre, síndrome gripal, dolor pélvico, edema facial. HEMÁTICAS Y LINFÁTICAS: policitemia, equimosis. UROGENITALES: albuminuria, hidronefrosis, pielonefritis, disuria, dolor, impotencia, poliuria. CARDIOVASCULARES: trombosis, angina de pecho, fibrilación auricular, hipotensión, trastornos vasculares periféricos, trastorno cardiovascular, hipotensión postural, taquicardia, palpitaciones, vasodilatación. METABÓLICAS Y NUTRICIONALES: aumento de creatinina, aumento de gammaglutamil- transpeptidasa, hiperlipemia, deshidratación, hipoglucemia, aumento de SGPT, aumento de SGOT, hipervolemia, acidosis, hipocalcemia, aumento de ácido láctico deshidrogenasa, hipercalcemia, aumento de fosfatasa alcalina, hipoproteinemia, hiperuricemia, aumento de peso. DIGESTIVAS: hemorragia digestiva, íleo, gastritis, gastroenteritis, esofagitis, hepatitis, infección, pruebas de la función hepática anormales, candidiasis gastrointestinal, trastorno rectal, anorexia, flatulencia, hiperplasia gingival, gingivitis, ulceración bucal. RESPIRATORIAS: edema pulmonar, sinusitis, trastorno pulmonar, asma, derrame pleural, rinitis. PIEL Y ANEJOS: carcinoma cutáneo, úlcera cutánea, herpes zoster, neoplasia cutánea benigna, trastorno cutáneo, hipertrofia cutánea, sudoración, alopecia, erupción cutánea, hirsutismo, dermatitis fúngica, prurito. NERVIOSAS: depresión, somnolencia, parestesias, hipertonía, ansiedad. ENDOCRINAS: diabetes mellitus, trastorno paratiroideo. MUSCULOESQUELÉTICAS: artralgia, mialgia, trastorno articular, calambres en las piernas, miastenia. ÓRGANOS DE LOS SENTIDOS: cataratas (no especificado), conjuntivitis, ambliopía. 4.9 Sobredosificación No se ha descrito ningún caso de sobredosis de micofenolato mofetilo en el ser humano. A las concentraciones que se alcanzan clínicamente, el MPA y MPAG no son eliminados mediante hemodiálisis. Sin embargo, con concentraciones plasmáticas altas de MPAG (> 100 µg/ml), se eliminan pequeñas cantidades del mismo. Por interferir con la circulación enterohepática del fármaco, los secuestradores de ácidos biliares, como la colestiramina, reducen el AUC del MPA. 5. PROPIEDADES FARMACOLOGICAS 5.1 Propiedades farmacodinámicas El micofenolato mofetilo es el éster 2-morfolinoetílico del MPA. El MPA es un inhibidor potente, selectivo, no competitivo y reversible de la inosinmonofosfato-deshidrogenasa; inhibe, por tanto, la síntesis de novo del nucleótido guanosina, sin incorporación al ADN. Dado que los linfocitos T y B dependen de una manera decisiva para su proliferación de la síntesis de novo de purinas -mientras que otros tipos de células pueden utilizar mecanismos de recuperación de purinas-, el MPA tiene unos efectos citostáticos más potentes en los linfocitos que en otras células. 5.2 Propiedades farmacocinéticas El MPA, a concentraciones clínicamente relevantes, se une en un 97% a la albúmina plasmática. Tras la administración oral, el micofenolato mofetilo se absorbe rápida y ampliamente; a continuación se transforma en MPA, su metabolito activo, en un proceso de metabolización presistémica completa. El micofenolato mofetilo no es detectable sistémicamente en el plasma tras su administración oral. El MPA se metaboliza principalmente por la glucuronil-transferasa, para formar el glucurónido fenólico del MPA (MPAG), sin actividad farmacológica. Como consecuencia de la recirculación enterohepática, se suelen observar aumentos secundarios de la concentración plasmática de MPA después de aproximadamente 6-12 horas de la administración. Con la coadministración de colestiramina (4 g tres veces al día), se produce una reducción del AUC del MPA del orden del 40%, lo que es indicativo de una recirculación enterohepática importante. La cantidad del fármaco que se excreta en forma de MPA con la orina es despreciable (<1 % de la dosis). Tras la administración por vía oral de micofenolato mofetilo radiomarcado, la recuperación de la dosis administrada fue completa. Un 93% de la dosis se recuperó en la orina y un 6% en las heces. La mayor parte de la dosis administrada (alrededor del 87%) se excreta por la orina en forma de MPAG. La biodisponibilidad media del micofenolato mofetilo por vía oral, determinada mediante el AUC del MPA, fue del 94% en comparación con la del micofenolato mofetilo por vía intravenosa. Los alimentos no tuvieron ningún efecto en el grado de absorción (AUC del MPA) del micofenolato mofetilo administrado a dosis de 1,5 g dos veces al día a trasplantados renales. Sin embargo, se produjo una disminución del 40% en la Cmáx de MPA en presencia de alimentos. Los valores medios del AUC y Cmáx del MPA en el período postrasplante inmediato (< 40 días) son aproximadamente un 50 % más bajos en los trasplantados renales que en los voluntarios sanos o en los trasplantados renales que se encuentran ya en una fase estable. En un estudio de dosis única (6 individuos por grupo), se observó que para los individuos 2 con insuficiencia renal crónica grave (filtración glomerular <25 ml/min/1,73m ), el valor medio del AUC para el MPA plasmático fue de un 28 - 75 % superior que para individuos sanos normales o en pacientes con menor deterioro renal. Sin embargo, el valor medio del AUC del MPAG tras una dosis única en los sujetos con insuficiencia renal grave, fue 3-6 veces superior al presentado en los pacientes con deterioro renal leve o en los voluntarios sanos, lo que concuerda con la eliminación renal conocida del MPAG. No se ha estudiado la administración de dosis múltiples de micofenolato mofetilo en pacientes con insuficiencia renal crónica grave. En pacientes con retardo funcional del órgano trasplantado, el valor medio del AUC0-12 del MPA fue comparable al observado en los pacientes sin retardo funcional postrasplante. Asimismo, el valor medio del AUC0-12 del MPAG fue 2-3 veces superior al de los pacientes trasplantados sin retardo de la función del órgano. En voluntarios con cirrosis alcohólica se comprobó que los procesos de glucuronidación hepática del MPA estaban relativamente poco afectados por la enfermedad del parénquima hepático. Los efectos de la hepatopatía en este proceso dependen probablemente de la enfermedad concreta de que se trate. Sin embargo, una hepatopatía con predominio de la afectación biliar, como la cirrosis biliar primaria, puede tener un efecto diferente. No se ha evaluado formalmente el comportamiento farmacocinético de CellCept en pacientes ancianos. 5.3 Datos Preclínicos de Seguridad En modelos experimentales, el micofenolato mofetilo no fue tumorogénico ni tuvo actividad mutagénica. La dosis más alta ensayada en los estudios de carcinogénesis en animales resultó ser aproximadamente de 2 a 3 veces la exposición sistémica (AUC o Cmáx) observada en pacientes trasplantados renales a la dosis clínica recomendada de 2 g diarios. El micofenolato mofetilo no tuvo efecto alguno en la fertilidad de las ratas macho a dosis orales de hasta 20 mg /kg/día. La exposición sistémica a esta dosis representa de 2 a 3 veces la exposición clínica a la dosis recomendada de 2 g diarios. En un estudio de la reproducción y la fertilidad llevado a cabo en ratas hembra, dosis orales de 4,5 mg/kg/día causaron malformaciones (incluyendo anoftalmia, agnatia, e hidrocefalia) en la primera generación de crías, sin que se detectara toxicidad en las madres. La exposición sistémica a esta dosis fue aproximadamente 0,5 veces la exposición clínica a la dosis recomendada de 2 g diarios. No se evidenció ningún efecto en la fertilidad y la reproducción de las ratas madre ni en la generación siguiente. En los estudios teratológicos se produjeron resorciones fetales y malformaciones con 6 mg/kg/ día en la rata (incluyendo anoftalmia, agnatia, e hidrocefalia) y 90 mg/kg/día en el conejo (incluyendo anormalidades cardiovasculares y renales, como ectopia del corazón y riñones ectópicos, y hernia diafragmática y umbilical), sin que se registrara toxicidad materna. La exposición sistémica a estos niveles son aproximadamente equivalentes o menores a 0,5 veces la exposición clínica a la dosis recomendada de 2 g diarios. Ver sección 4.6 Embarazo y lactancia. Los sistemas hematopoyético y linfoide fueron los primeros órganos afectados en los estudios toxicológicos conducidos con micofenolato mofetilo en la rata, ratón, perro y mono. Estos efectos ocurrieron a niveles de exposición sistémica que son equivalentes o menores a la exposición clínica a la dosis recomendada de 2 g diarios. En el perro se observaron efectos gastrointestinales a niveles de exposición sistémica equivalentes o menores a la exposición clínica a la dosis recomendada. En el mono, a la dosis más alta (niveles de exposición sistémica equivalente a o mayor que la exposición clínica), también se observaron efectos gastrointestinales y renales consistentes con la deshidratación. El perfil toxicológico no-clínico de micofenolato mofetilo parece ser consistente con los efectos adversos observados en los ensayos clínicos humanos que ahora proporcionan datos de seguridad de mas relevancia para la población de pacientes. (ver 4.8 Reacciones adversas). 6. DATOS FARMACÉUTICOS 6.1 Relación de Excipientes Los excipientes utilizados en los comprimidos de CellCept son los siguientes: celulosa microcristalina, polividona (K-90), croscarmelosa sódica y estearato magnésico. El recubrimiento de los comprimidos está formado por hidroxipropilmetilcelulosa, hidroxipropilcelulosa, dióxido de titanio (EP, E171), polietilenglicol 400, índigo carmín, laca alumínica (E132), óxido de hierro rojo (FP, E172), óxido de hierro negro (FP, E172) y goma laca. 6.2 Incompatibilidades Ninguna 6.3 Período de Validez Los comprimidos de CellCept tienen un periodo de validez de 2 años, almacenados en envases blíster opacos de cloruro de polivinilo, a una temperatura no superior a los 30°C. 6.4 Precauciones Especiales de Conservación Conservar a una temperatura de 30°C o inferior. Los comprimidos de CellCept deben ser protegidos de la luz. 6.5 Naturaleza y Contenido del Envase CellCept 500 mg comprimidos: 1 caja contiene 50 comprimidos (en blisters de 10 unidades). Una unidad de venta de 150 comprimidos contiene tres cajas de 50 comprimidos. 6.6 Instrucciones Para su uso / Manipulación Dado que el micofenolato mofetilo ha sido teratogénico en la rata y el conejo, no deben triturarse los comprimidos de CellCept. 7. NOMBRE O RAZÓN SOCIAL, DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN Roche Registration Limited, 40 Broadwater Road, Welwyn Garden City, Hertfordshire, AL7 3AY, U.K. 8. NUMERO DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN 9. FECHA DE LA PRIMERA AUTORIZACION/REVALIDACIÓN DE LA AUTORIZACION 10. FECHA DE LA REVISIÓN DEL TEXTO ANEXO II AUTORIZACIÓN DE FABRICACIÓN Y CONDICIONES QUE RIGEN LA AUTORIZACIÓN DE COMERCIALIZACIÓN A. TITULAR(ES) DE LA(S) AUTORIZACIÓN(ES) DE FABRICACIÓN (apartado 1 y/o 3 del artículo 16 de la Directiva 75/319/CEE modificada) Los siguientes establecimientos de fabricación han sido seleccionados para la fabricación y el envasado y embalado de los productos terminados: - Hoffmann-La Roche AG, Emil Barrelstr. 1, Grenzach-Wyhlen, Alemania Autorización de fabricación concedida por el Regierungspraesidium, Friburgo, el 26 de abril de 1990. - Roche SpA, Piazza Durante 11, Milán, Italia Autorización de fabricación concedida por el Ministero della Sanità el 26 de enero de 1995. - Produit Roche SA, 59 rue Pasteur, Fontenay-sous-Bois, Francia Autorización de fabricación concedida por el Ministère de la Santé et de la Protection Sociale el 25 de abril de 1990 y confirmada por la Agence du Médicament el 27 de octubre de 1994. - Syntex Latino SA, C/ Severo Ochoa 13, Polígono Ind. Leganés, Madrid, España. Autorización de fabricación concedida por el Ministerio de Sanidad y Consumo el 21 de febrero de 1995. - Roche Products Ltd, 40 Broadwater Road, Welwyn Garden City, Reino Unido Autorización de fabricación concedida por el MCA el 10 de abril de 1995. Los siguientes establecimientos de fabricación han sido seleccionados para la liberación de lotes en la UE y actúan como importadores de los medicamentos fabricados fuera de la UE: - Hoffmann-La Roche AG, Emil Barrelstr. 1, Grenzach-Wyhlen, Alemania Roche Products Ltd, 40 Broadwater Road, Welwyn Garden City, Reino Unido B. CONDICIONES O RESTRICCIONES DE DISPENSACIÓN Y UTILIZACIÓN (artículos 2 y 3 de la Directiva 92/26/CEE) ® CellCept (250 mg capsulas / 500 mg comprimidos) es un medicamento sujeto a prescripción médica restringida y no renovable. C. OBLIGACIONES ESPECÍFICAS PARA EL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN (Obligaciones post-autorización) La empresa (10/10/95) proporcionará a la EMEA los siguientes datos complementarios pendientes en relación con la calidad: Resultados del ensayo de substancias depresoras, antes del 31/12/1996. Resultados del nuevo estudio de estabilidad a largo plazo de la substancia activa mediante el método M-264-1 antes del 31/12/1996. Resultados de los ensayos de estabilidad de dos años con los lotes de cápsulas de estabilidad primaria, antes del 31/12/1996. Ensayos pertinentes de identidad de los excipientes, antes del 31/12/1996. Depués de concedida la autorización, se seguirán resumiendo los datos de seguridad adicionales en el transcurso de los 3 ensayos de prevención primaria. Los pacientes que participan en los ensayos de prevención renal primaria ICM 1866 (EE.UU.), IIR 023 (Europa, Australia, Canadá) y MRE 022 (Europa) seguirán recibiendo el medicamento estudiado durante 3 años. Estos datos se resumirán anualmente por separado para cada estudio individual y se remitirán a la EMEA antes del 31 de agosto de 1996, 31 de agosto de 1997 y 31 de agosto 1998.. La empresa realizará estudios post-autorización con arreglo al modelo sometido al ponente en sus respuestas al cuestionario consolidado, y comunicarán los resultados a la EMEA antes del 31/7/2000. ANEXO III ETIQUETADO Y PROSPECTO A - ETIQUETADO Texto del estuche CellCept® Micofenolato mofetilo 250 mg 100 cápsulas Para administración oral Leer el prospecto adjunto antes de usar Cada cápsula contiene 250 mg de micofenolato mofetilo. También contiene dióxido de titanio E171 y colorantes E132 y E172. Almacenar por debajo de 30ºC Las cápsulas de CellCept deben ser manipuladas con cuidado No abrir o triturar las cápsulas, ni respirar el polvo del interior, ni permitir el contacto con la piel. MANTÉNGASE FUERA DEL ALCANCE DE LOS NIÑOS Autorización de Comercialización Nº: Roche Registration Limited, 40 Broadwater Road, Welwyn Garden City, Hertfordshire AL7 3AY, Reino Unido. Nº de lote Fecha de caducidad Especialidad farmacéutica sujeta a prescripción médica. Texto del blister CellCept® Micofenolato mofetilo 250 mg Roche Registration Ltd (-Nº de lote-) (-Fecha de caducidad-) Texto del estuche CellCept® Micofenolato mofetilo 500 mg 50 comprimidos Para administración oral Leer el prospecto adjunto antes de usar Cada comprimido contiene 500 mg de micofenolato mofetilo. También contiene dióxido de titanio E171 y colorantes E132 y E172. Almacenar por debajo de 30ºC Proteger de la luz No triturar los comprimidos MANTÉNGASE FUERA DEL ALCANCE DE LOS NIÑOS Autorización de Comercialización Nº: Roche Registration Limited, 40 Broadwater Road, Welwyn Garden City, Hertfordshire AL7 3AY, Reino Unido. Nº de lote Fecha de caducidad Especialidad farmacéutica sujeta a prescripción médica. Texto del blister CellCept® Micofenolate mofetil 500 mg Roche Registration Ltd. (-Nº de lote-) (-Fecha de caducidad-) B - PROSPECTO Información Para el Paciente ® CellCept micofenolato mofetilo Nombre de la especialidad ® CellCept (Micofenolato mofetilo) 250 mg, cápsulas. Composición Cada cápsula contiene 250 mg del principio activo micofenolato mofetilo. Las cápsulas contienen también almidón de maíz pregelatinizado, croscarmelosa sódica, polividona, estearato magnésico, gelatina, índigo carmín (E132), óxido de hierro amarillo, rojo y negro (E172), dióxido de titanio (E171), laurilsulfato sódico, hidróxido potásico, goma laca y dióxido de silicio. Forma farmacéutica Las cápsulas de color azul/marrón, llevan inscrito “CellCept 250” en una mitad. Las cápsulas para uso oral están disponibles en cajas de 100 cápsulas cada una, en envases blíster de 10 cápsulas. Una unidad de venta de 300 cápsulas contiene tres cajas de 100 cápsulas cada una. Usos El micofenolato mofetilo pertenece a un grupo de medicamentos caracterizados por ayudar a detener los mecanismos de defensa naturales del organismo, que atacan a los órganos trasplantados. Grupo terapéutico: Inmunosupresor Titular de la Autorización de Comercialización y fabricante El titular de la Autorización de Comercialización es Roche Registration Limited, 40 Broadwater Road, Welwyn Garden City, Hertfordshire AL7 3AY, U.K. El fabricante es Hoffmann-La Roche AG, Grenzach-Whylen, Alemania, o Roche Products Limited, 40 Broadwater Road, Welwyn Garden City, Hertfordshire AL7 3AY, U.K. Indicaciones Las cápsulas de CellCept se utilizan para prevenir que el organismo rechace los riñones trasplantados. CellCept se usa junto con otros medicamentos conocidos como ciclosporina y corticosteroides. Contraindicaciones No tome CellCept si usted es alérgico al micofenolato mofetilo, ácido micofenólico o cualquiera de los ingredientes relacionados anteriormente. Advertencias especiales y precauciones de uso Si la respuesta a alguna de las siguientes preguntas es afirmativa, consulte a su médico antes de empezar a tomar CellCept: Precauciones: • ¿Tiene usted en el momento actual, o ha tenido en el pasado, algún problema de aparato digestivo, por ejemplo úlcera de estómago? • ¿Tiene usted algún problema de riñón? Interacciones: • ¿Está usted tomando algún medicamento que contenga: azatioprina u otro agente inmunosupresor (que algunas veces son administrados después de una operación de trasplante), colestiramina, antiácidos, o cualquier otro medicamento (incluidos los de venta sin receta) que no sepa su médico? Embarazo y lactancia: • ¿Esta usted embarazada, en período de lactancia, o tiene pensado formar una familia en un futuro próximo?. Su médico debe aconsejarle que utilice un método anticonceptivo antes de empezar a tomar CellCept, durante el tratamiento, y hasta seis semanas después de haber dejado de tomarlo. Esto es debido a que CellCept puede causar daño al feto. Si queda embarazada, dígaselo rápidamente a su médico. Cómo se toma este medicamento Debe tomar las cápsulas exactamente como su médico le haya indicado. La manera habitual de tomar CellCept es la siguiente: Posología La primera dosis se administrará dentro de las 72 horas siguientes a la operación de trasplante. La dosis diaria recomendada es de 8 cápsulas (2g de sustancia activa), en 2 tomas separadas. Esto significa tomar 4 cápsulas por la mañana y otras 4 cápsulas por la noche. Método y vía de administración Tragar las cápsulas enteras con un vaso de agua y con el estómago vacío. No las rompa ni las triture y no tome ninguna cápsula que se haya roto o abierto. Evite el contacto con el polvo que se derrame de las cápsulas dañadas. Si se rompe o abre accidentalmente una cápsula , lávese la piel con agua y jabón. Si le entra polvo en los ojos o en la boca, enjuáguelos abundantemente con mucha agua corriente. Si se olvida alguna vez de tomar el medicamento, tómelo en cuanto se acuerde y continúe después a las horas de costumbre. No deje de tomarlo, a no ser que se lo indique su médico. Mientras esté tomando CellCept, su médico ordenará que le realicen análisis de sangre regularmente. Sobredosificación Si toma más cápsulas de las que le han dicho, o si alguien accidentalmente toma su medicina, debe acudir inmediatamente a su médico o a un hospital. Reacciones adversas Además de los efectos beneficiosos de CellCept, es posible que puedan ocurrir efectos no deseados en algunos pacientes, incluso cuando se utiliza como se ha descrito. Algunos de los más frecuentes son diarrea, disminución de la cantidad de glóbulos blancos en la sangre, infección y vómitos. El tratamiento con CellCept reduce los mecanismos de defensa del organismo, con objeto de prevenir el rechazo del riñón trasplantado. Por esta razón, el organismo tampoco puede combatir las infecciones tan eficazmente como en condiciones normales. Las personas en tratamiento con CellCept pueden contraer, por consiguiente, más infecciones de lo habitual, como por ejemplo, infecciones de la piel, boca, intestino, pulmones, tracto urinario. Al igual que ocurre en los pacientes que toman este tipo de medicamentos, un número muy reducido de pacientes tratados con CellCept han desarrollado cáncer de tejidos linfoides y piel. Su médico realizará análisis de sangre regularmente, para registrar cualquier cambio en el número de células sanguíneas o cambios en los niveles de cualquiera de las sustancias contenidas en sangre, por ejemplo azúcar, grasa, colesterol. Efectos no deseados que afectan al organismo en general fueron fiebre, cansancio general, dificultad para conciliar el sueño, dolores (abdominal, en la espalda, pecho, articulaciones, musculares, dolor al orinar). Menos frecuentes han sido también hernia, quiste, síntomas gripales, hinchazón e impotencia. Otros efectos indeseables pueden ser: Alteraciones de la piel como acné, herpes labiales. Menos frecuentes: úlcera cutánea, herpes zoster, crecimiento de la piel, sudoración , pérdida del pelo o crecimiento del vello, erupción cutánea, picor. Trastornos urinarios como problemas de riñón y sangre en la orina. Menos frecuentemente: necesidad de orinar con frecuencia. Trastornos del sistema digestivo y la boca como estreñimiento, nauseas, indigestión. Menos frecuentemente: trastornos intestinales que incluyen hemorragia, inflamación del estómago, inflamación del esófago, problemas del hígado, problemas con el recto, pérdida de apetito, flatulencia, problemas con las encías y úlceras bucales. Trastornos de los nervios y los sentidos como cefalea, temblor, vértigo. Menos frecuentemente: depresión, somnolencia, entumecimiento, espasmos musculares, ansiedad, cataratas, inflamación de los párpados, alteración de la visión. Trastornos metabólicos, sanguíneos y vasculares tales como deshidratación, aumento de peso, diabetes, problemas de corazón o tiroides, hemorragia, cardenales y magulladuras, cambios en la presión arterial, latido anormal del corazón y dilatación de los vasos sanguíneos. Trastornos de los pulmones como neumonía, bronquitis, inflamación de la garganta, dificultad respiratoria, tos. Menos frecuentemente: líquido en la cavidad pulmonar/torácica, problemas en los senos nasales, asma. Si tiene algún efecto secundario o sufre algún otro tipo de problema mientras está tomando CellCept, por favor consulte a su médico. Sin embargo, no deje de tomar el medicamento a menos que lo haya discutido previamente con su médico. Caducidad No tome las cápsulas después de la fecha de caducidad, impresa en la caja del medicamento. Condiciones de almacenamiento Las cápsulas deben conservarse a temperatura ambiente (30ºC) o inferior. Manténgase fuera del alcance de los niños. Fecha de la revisión del texto Información Para el Paciente ® CellCept micofenolato mofetilo Nombre de la especialidad CellCept ® 500 mg, comprimidos. Composición Cada comprimido contiene 500 mg del principio activo micofenolato mofetilo. Los comprimidos contienen también celulosa microcristalina, polividona, croscarmelosa sódica y estearato magnésico, hidroxipropilmetilcelulosa, hidroxipropilcelulosa, dióxido de titanio (E171), polietilenglicol 400, índigo carmín laca alumínica (E132), óxido de hierro rojo y negro (E172) y goma laca. Forma farmacéutica Los comprimidos de color azul espliego, llevan inscrito “CellCept 500” en una cara. Los comprimidos para uso oral están disponibles en cajas de 50 comprimidos cada una, en envases blíster de 10 comprimidos. Una unidad de venta de 150 comprimidos contiene tres cajas de 50 comprimidos cada una. Usos El micofenolato mofetilo pertenece a un grupo de medicamentos caracterizados por ayudar a detener los mecanismos de defensa naturales del organismo, que atacan a los órganos trasplantados. Grupo terapéutico Inmunosupresor Titular de la Autorización de Comercialización y fabricante El titular de la Autorización de Comercialización es Roche Registration Limited, 40 Broadwater Road, Welwyn Garden City, Hertfordshire AL7 3AY, U.K. El fabricante es Hoffmann-La Roche AG, Grenzach-Whylen, Alemania, o Roche Products Limited, 40 Broadwater Road, Welwyn Garden City, Hertfordshire AL7 3AY, U.K. Indicaciones Los comprimidos de CellCept se utilizan para prevenir que el organismo rechace los riñones trasplantados. CellCept se usa junto con otros medicamentos conocidos como ciclosporina y corticosteroides. Contraindicaciones No tome CellCept si usted es alérgico al micofenolato mofetilo, ácido micofenólico o cualquiera de los ingredientes relacionados anteriormente. Advertencias especiales y precauciones de uso Si la respuesta a alguna de las siguientes preguntas es afirmativa, consulte a su médico antes de empezar a tomar CellCept: Precauciones: • ¿Tiene usted en el momento actual, o ha tenido en el pasado, algún problema de aparato digestivo, por ejemplo úlcera de estómago? • ¿Tiene usted algún problema de riñón? Interacciones: • ¿Está usted tomando algún medicamento que contenga: azatioprina u otro agente inmunosupresor (que algunas veces son administrados después de una operación de trasplante), colestiramina, antiácidos, o cualquier otro medicamento (incluidos los de venta sin receta) que no sepa su médico? Embarazo y lactancia: • ¿Esta usted embarazada, en período de lactancia, o tiene pensado formar una familia en un futuro próximo?. Su médico debe aconsejarle que utilice un método anticonceptivo antes de empezar a tomar CellCept, durante el tratamiento, y hasta seis semanas después de haber dejado de tomarlo. Esto es debido a que CellCept puede causar daño al feto. Si queda embarazada, dígaselo rápidamente a su médico. Cómo se toma este medicamento Debe tomar los comprimidos exactamente como su médico le haya indicado. La manera habitual de tomar CellCept es la siguiente: Posología La primera dosis se administrará dentro de las 72 horas siguientes a la operación de trasplante. La dosis diaria recomendada es de 4 comprimidos (2g de sustancia activa), en 2 tomas separadas. Esto significa tomar 2 comprimidos por la mañana y otros 2 comprimidos por la noche. Método y vía de administración Tragar los comprimidos enteros con un vaso de agua y con el estómago vacío. No los rompa ni los triture. Si se olvida alguna vez de tomar el medicamento, tómelo en cuanto se acuerde y continúe después a las horas de costumbre. No deje de tomarlo, a no ser que se lo indique su médico. Mientras esté tomando CellCept, su médico ordenará que le realicen análisis de sangre regularmente. Sobredosificación Si toma más comprimidos de los que le han dicho, o si alguien accidentalmente toma su medicina, debe acudir inmediatamente a su médico o a un hospital. Reacciones adversas Además de los efectos beneficiosos de CellCept, es posible que puedan ocurrir efectos no deseados en algunos pacientes, incluso cuando se utiliza como se ha descrito. Algunos de los más frecuentes son diarrea, disminución de la cantidad de glóbulos blancos en la sangre, infección y vómitos. El tratamiento con CellCept reduce los mecanismos de defensa del organismo, con objeto de prevenir el rechazo del riñón trasplantado. Por esta razón, el organismo tampoco puede combatir las infecciones tan eficazmente como en condiciones normales. Las personas en tratamiento con CellCept pueden contraer, por consiguiente, más infecciones de lo habitual, como por ejemplo, infecciones de la piel, boca, intestino, pulmones, tracto urinario. Al igual que ocurre en los pacientes que toman este tipo de medicamentos, un número muy reducido de pacientes tratados con CellCept han desarrollado cáncer de tejidos linfoides y piel. Su médico realizará análisis de sangre regularmente, para registrar cualquier cambio en el número de células sanguíneas o cambios en los niveles de cualquiera de las sustancias contenidas en sangre, por ejemplo azúcar, grasa, colesterol. Efectos no deseados que afectan al organismo en general fueron fiebre, cansancio general, dificultad para conciliar el sueño, dolores (abdominal, en la espalda, pecho, articulaciones, musculares, dolor al orinar). Menos frecuentes han sido también hernia, quiste, síntomas gripales, hinchazón e impotencia. Otros efectos indeseables pueden ser: Alteraciones de la piel como acné, herpes labiales. Menos frecuentes: úlcera cutánea, herpes zoster, crecimiento de la piel, sudoración , pérdida del pelo o crecimiento del vello, erupción cutánea, picor. Trastornos urinarios como problemas de riñón y sangre en la orina. Menos frecuentemente: necesidad de orinar con frecuencia. Trastornos del sistema digestivo y la boca como estreñimiento, nauseas, indigestión. Menos frecuentemente: trastornos intestinales que incluyen hemorragia, inflamación del estómago, inflamación del esófago, problemas del hígado, problemas con el recto, pérdida de apetito, flatulencia, problemas con las encías y úlceras bucales. Trastornos de los nervios y los sentidos como cefalea, temblor, vértigo. Menos frecuentemente: depresión, somnolencia, entumecimiento, espasmos musculares, ansiedad, cataratas, inflamación de los párpados, alteración de la visión. Trastornos metabólicos, sanguíneos y vasculares tales como deshidratación, aumento de peso, diabetes, problemas de corazón o tiroides, hemorragia, cardenales y magulladuras, cambios en la presión arterial, latido anormal del corazón y dilatación de los vasos sanguíneos. Trastornos de los pulmones como neumonía, bronquitis, inflamación de la garganta, dificultad respiratoria, tos. Menos frecuentemente: líquido en la cavidad pulmonar/torácica, problemas en los senos nasales, asma. Si tiene algún efecto secundario o sufre algún otro tipo de problema mientras está tomando CellCept, por favor consulte a su médico. Sin embargo, no deje de tomar el medicamento a menos que lo haya discutido previamente con su médico. Caducidad No tome los comprimidos después de la fecha de caducidad, impresa en la caja del medicamento. Condiciones de almacenamiento Los comprimidos deben conservarse a temperatura ambiente (30ºC) o inferior. Los comprimidos deben protegerse de la luz. Manténgase fuera del alcance de los niños. Fecha de la revisión del texto