proceso aspirina 105i1
Anuncio

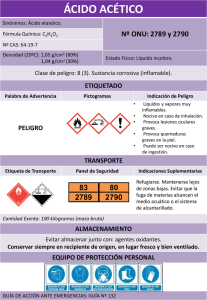
1.- Presentación con claridad del formato (3pts) 2.- Procesamiento de fundamentos teóricos legales (4pts) 3.- Análisis e interpretación de la descripción del proceso (5pts) 4.- Coherencia del diagrama de flujo de procesos (3pts) 5.- Capacidad de síntesis (resumen, introducción y conclusiones) (3pts) 6.- Desarrollo de las referencias bibliográficas (2pts) LA ASPIRINA Martínez J. 26.231.596; Barrios F. 27.097.244; Peláez O. 25.829.479; López C. 2 Faculta de Ingeniería, Escuela de Ingeniería Industrial. Asignatura (Principios y Procesos Químicos), Sección 105I1. Fecha de entrega: (17 de junio del 2016) nosoyjennifermartinez@gmail.com; fabi.barrios23@gmail.com; orianaapelaezr@gmail.com; clapalo2007@hotmail.com Resumen: Desde que se descubrió la aspirina ésta ha generado gran conmoción, pues el ser humano se ha visto en la necesidad de aliviar las dolencias que padece, hasta ahora no existe ningún otro medicamento que logre suplantarlo, ya que las propiedades de esta sustancia satisface las necesidades del hombre en distintas áreas. Es por esto que esta investigación pretende dar a conocer las virtudes, historia, composición, síntesis, efectos, usos, etc de la Aspirina. Los objetivos planteados para el desarrollo del trabajo son 1) analizar el proceso químico empleado para la obtención del ácido acetilsalicílico,2)explicar propiedades físicas y químicas de la materia prima e insumos,3) describir mediante de diagrama de flujo el proceso de acetilación. Para obtener la aspirina se realiza un proceso de acetilación , consiste en una reacción que introduce un grupo acetilo en un compuesto químico donde el anhídrido acético es usado como agente de acetilación obteniendo un éster (ácido acetilsalicílico). 1.- INTRODUCCIÓN La síntesis de la aspirina se considera una esterificación. El ácido salicílico es tratado con anhídrido acético, un compuesto derivado de un ácido, lo que hace que el grupo alcohol del salicilato se convierta en un grupo acetilo. Este proceso produce aspirina y ácido acético, el cual se considera un subproducto de la reacción. El objetivo del proceso es obtener ácido acetilsalicílico a partir de la reacción de mencionada. Abordaremos la investigación basándonos en la recolección de datos, desglosando y analizando el proceso químico 2.- FUNDAMENTOS TEÓRICOS 2.1 Origen. El descubrimiento de éste fármaco se produce el 10 de Agosto de 1897 por un joven químico llamado Félix Hoffman, que trabajaba para la farmacéutica alemana Bayer, quien purifico y mejoro la síntesis de un ácido que parte desde la salicina y ácido salicílico descubierto por el científico Francés, Charles Frederic Gerhardt. Este descubrimiento se produjo cuando el joven Hoffman se dirige a su laboratorio y toma el recipiente que recoge los componentes menos volátiles de su muestra y se observa una especie de polvo blanco que reposa en el fondo, con esto se produce la purificación y obtención del ácido acetilsalicílico. Hoffman convenció a la empresa Bayer para la fabricación del medicamento y fue patentado en 1900 con el nombre de Aspirina, la cual se empezó a distribuir en forma de polvo a todos los médicos y pronto se convirtió en la medicina número uno del mundo, puesto que actúa como antipirético, analgésico y antiinflamatorio que alivia los dolores y la fiebre. Luego, a partir de 1915 se comienza a fabricar en forma de comprimidos y podía ser comprada sin receta. 2.2 Características del proceso. Entre estas se tiene la de los componentes (materia prima) y el proceso quimico terminado (producto): Ácido Salicílico: * Sólido incoloro que suele cristalizar en forma de agujas. * Posee buena solubilidad en etanol y éter. * Industrialmente se obtiene a partir del dióxido de carbono y fenóxido de sodio. * Posee un olor muy fuerte a vinagre debido a su reacción con la humedad del aire. * Industrialmente el anhídrido acético puede ser producido por oxidación del acetaldehído con O2. * El anhídrido acético es corrosivo, irritante e inflamable, recomendación de utilizar la campana del laboratorio. Ácido Acetilsalicílico: *Es un fármaco que pertenece a la familia de los Salicilatos. * Aspirina o ácido acetilsalicílico es un derivado del ácido salicílico, con el que se ha conseguido aumento de la efectividad analgésica con menores efectos irritantes sobre el aparato digestivo. * Está formado por agujas blancas cristalinas. Hoffman consiguió sintetizarlo a partir de alquitrán de carbón. * Posee cristales alargados, de sabor ligeramente amargo, y de color blanquecino, y además se funden a 132ºC y son insolubles en agua. * El ácido salicílico es el aditivo clave en muchos productos para el cuidado de la piel diseñados para tratar acné, psoriasis, callosidades (el endurecimiento de la piel por presión persistente), la piel de gallina y las verrugas. * Es estable en aire seco, pero con la humedad se descompone lentamente en ácido salicílico y en ácido acético. Anhídrido Acético: * Sus efectos analgésicos, antipiréticos y antiinflamatorios se deben a las asociaciones de las porciones acetilo y salicilato de la molécula intacta, como también a la acción del metabolito activo salicilato. * Es uno de los anhídridos carboxílicos más simples. * Es un líquido incoloro. * Es uno de los reactivos más ampliamente usados en síntesis orgánica. * La molécula de Aspirina contiene 9 átomos de carbono, 4 de oxígeno y 8 de hidrógeno. * Soluble en 300 partes de agua destilada, en 7 partes de alcohol, en 17 partes de cloroformo, en 20 partes de éter y en soluciones concentradas de acetato de amonio. * En las soluciones concentradas de hidróxidos y de carbonatos alcalinos es soluble con descomposición. 2.3 Principales empresas productoras a nivel internacional y nacional. Producción Internacional: Las tabletas de aspirina empezaron a fabricarse en España en la década de los años 20. Se hacían casi artesanalmente: la materia prima, procedente de Alemania, se trituraba y se transformaba en pastillas, el responsable de la fabricación de la aspirina en España fue el farmacéutico Antonio Serra esto fue a partir de los años 30. Sefar distribuye anualmente unos 30 millones de unidades entre material médico-quirúrgico y medicamentos. Además tiene la capacidad de producir tres lotes por semana, cada lote equivale a 75.000 tabletas. En la actualidad, más de 200 empresas comercializan este medicamento, cuyo efecto se basa en el ácido acetilsalicílico y la producción de este se estima en 50.000 toneladas por año. 3.-Fundamentos legales (COVENIN): No existe una ley que esté relacionada directamente con el proceso químico del ácido acetilsalicílico. Cabe destacar que COVENIN establece leyes donde involucra la materia prima utilizada en este proceso, pero no desde el punto de vista químico. 4.-Materias Primas e Insumos Una de las empresas con mayor producción de este medicamento es la Bayer, que para el año 2008, el 85% de la producción mundial de ácido acetilsalicílico se realiza en Langreo España, en una planta química de la multinacional Bayer. Esta empresa suministra por término medio 12.700 millones de aspirinas al año en todo el mundo, que aseguran el suministro a los mercados regionales. En España se consumen más de 650 millones de comprimidos al año y en el mundo se superan los 216 millones al día. Producción Nacional: El Servicio Autónomo de Elaboraciones Farmacéuticas (Sefar) refuerza la elaboración ácido acetilsalicílico (aspirina) y otros medicamentos como por ejemplo los anticonvulsivos. A su vez, Ácido salicílico: Se trata de un beta-hidroxiácido donde su fuente natural es la corteza del sauce blanco (Salix alba) que contiene una sustancia llamada salicina, de la cual se obtiene el ácido salicílico, de ahí su nombre derivado del latín. Se encuentra en numerosas plantas, en especial en los frutos, en forma de metilsalicilato. El ácido salicílico, perteneciente al grupo de los agentes analgésicos, antipiréticos y antiinflamatorios, fue descrito por primera vez en el siglo XVIII por el reverendo Richard Stone que observó que las infusiones de la corteza del sauce blanco común (Salix alba vulgaris) curaba la fiebre. Su estructura química es el ácido 2hidroxibenzoico. Su fórmula molecular: C7H6O3 y su masa molecular es 138.121 g/mol, su punto de fusión se presenta a una temperatura de 432K (159°C) , su punto de ebullición a una de 484K (211°C) y su acidez es 2.972 pKa. Su forma física se encuentra en cristales blancos, generalmente como pequeñas agujas, o como polvo blanco y velloso. La forma sintética es blanca e inodora, Tiene un sabor ligeramente dulce; es poco soluble en agua y más soluble en alcohol, éter y cloroformo. Industrialmente se obtiene a partir de la conocida síntesis o reacción de KolbeSchmitt es una reacción química caracterizada por una carboxilación que ocurre cuando se calienta el fenolato sódico —la sal de sodio del fenol— junto con hidróxido de sodio y dióxido de carbono bajo 100 atmósferas de presión y 125°C, para luego tratar el producto con ácido sulfúrico. Este producto sirve como materia prima para la obtención del ácido acetilsalicílico, comercialmente conocido como Aspirina por medio de la esterificación del grupo hidroxilfenólico del ácido salicílico y del fenilsalicilato. El ácido salicílico es el aditivo clave en muchos productos para el cuidado de la piel diseñados para tratar acné, psoriasis, callosidades, la piel de gallina y las verrugas. Trata el acné causando que las células de la piel se caigan más fácilmente, evitando que los poros se tapen, esto es debido a una propiedad que le permite mezclarse con las grasas existentes en la epidermis y con el material sebáceo que se encuentre estancado en los folículos provocando la exfoliación y descamación en la piel. Este efecto en las células de la piel también hace que el ácido salicílico sea un ingrediente activo en varios champuses diseñados para tratar la caspa. El ácido salicílico de grado técnico se usa sobre todo en la producción de productos agroquímicos, tintes, colorantes, caucho, perfumes, y resinas fenólicas. Su distribución: 55% a aspirina, 18% a ésteres y sales, 10% a resinas, 10% a tintes y colorantes. El uso directo de una solución salicílica puede causar hiperpigmentación en piel sin tratamiento previo para aquellos con tipos de piel más oscuros. Anhídrido acético: El anhídrido acético, cuya fórmula es (CH3CO) 2O, es un líquido corrosivo para la mayoría de los metales en presencia de humedad, incoloro y versátil con un olor agrio, es conocido comúnmente como Ac2O. Fue sintetizado por primera vez por C. F. Gerhardt a partir de cloruro de benzoilo y acetato de potasio. Hoy en día es uno de los intermedios orgánicos más importantes en la industria petroquímica y es el anhídrido carboxílico más producido comercialmente en EEUU con una producción de un millón de toneladas al año. Su aplicación industrial más importante es para la acetilación de reacciones; es también muy usado para aplicaciones de síntesis orgánica, y tiene utilidad como solvente en el análisis químico. Es miscible con solventes polares y se disuelve en alcohol frío con lenta descomposición. La solubilidad del anhídrido acético en agua a 20 ºC es de 2,6 % (m/m), con lenta descomposición; la solubilidad del agua en anhídrido acético a 15 ºC es de 10,7 % (m/m), con descomposición gradual. Sin embargo, una solución acuosa de anhídrido acético no es estable porque éste descompone en unos pocos minutos (el tiempo exacto depende de la temperatura) en una solución de ácido acético. En sus propiedades presenta un Límite inferior de explosividad, % vol. 2,7 ,Límite superior de explosividad, % vol. 10,3 , Presión de vapor a 20 ºC, hPa (mbar) 5 ,Densidad relativa del líquido (agua=1) 1,08,Solubilidad en agua Reacciona Densidad relativa de vapor (aire=1) 3,5 ,Densidad relativa de la mezcla vapor/aire a 20ºC (aire=1) 1,01, su Peso molecular es 102,1, en términos de temperatura su Punto/intervalo de fusión, ºC -73 , el Punto/intervalo de ebullición es de ºC 139 y el de inflamación, ºC 49 (c.c.) En cuanto a su producción se puede realizar por oxidación del acetaldehído con O2, formándose ácido peracéticoCH3C(=O)OOH que reacciona catalíticamente con otra molécula de acetaldehído para dar el anhídrido acético; o por pirólisis del ácido acético a cetena CH2=C=O, la cual a continuación en una segunda etapa reacciona con una molécula de ácido acético para formar el anhídrido acético; o por carbonilación catalítica (empleando monóxido de carbono) del acetato de metilo. La sustancia se descompone al calentarla intensamente, produciendo humos tóxicos y gases incluyendo acético. Es inflamable cuando se calienta por encima de 50 ºC. En forma de vapor es muy irritante para los ojos y para las mucosas. Reacciona violentamente con agua hirviendo, vapor de agua, oxidantes fuertes, alcoholes, aminas, bases fuertes. Ataca a varios metales en presencia de agua. El líquido es muy corrosivo, especialmente en presencia de agua y humedad. El Ac2O es ampliamente empleado en química para la acetilación de alcoholes y aminas y como deshidratante. La mayor parte de la producción (aproximadamente 80%) de anhídrido acético va a parar a la fabricación de acetato de celulosa (plásticos y fibras textiles).Otras aplicaciones son la síntesis de la tetraacetiletilenodiamina (TAED) en la industria de detergentes, y la síntesis de fármacos tales como el ácido acetilsalicílico(aspirina) o el paracetamol. También encuentra aplicación en la producción de poli(metilacrilimida) (espuma dura), plastificantes acetilados, explosivos, ciertos fluidos para frenos hidráulicos, fluidos de perforación, activadores para detergentes de blanqueo al frío, tintes (principalmente junto con el ácido nítrico), intermedios orgánicos, fármacos, alimentos(acetilación de grasas animales y vegetales), herbicidas, aromas y fragancias. Insumos: Ácido sulfúrico: La utilización del ácido sulfúrico en la aspirina, es para evitar que se pierda el hidrogenión+ del ácido salicílico, y evitar que la reacción se produzca en ese punto, pues deseamos que se dé en el grupo hidroxilo. También hace que el acetato que se forma con subproducto de la reacción, del anhídrido acético, forme ácido acético, y que no intervenga en la reacción. El ácido fosfórico es usado como catalizador en el proceso a pequeña escala, además el etanol es utilizado en el proceso de purificación del proceso mencionado anteriormente. 5.-Propiedades Físicas Químicas del Proceso Químico. 5.1.- Propiedades Químicas. Hidrólisis: y El ácido es estable en aire seco, pero hidroliza gradualmente en contacto con la humedad transformándose en los ácidos acéticos y salicílicos. La aspirina se hidroliza a altas temperaturas ya que estimulan la rotura de los enlaces formados en la síntesis de la aspirina obteniéndose ácido salicílico. Esta no se hidroliza en medio ácido a temperatura corporal ni a otros valores de pH. Sin embargo, en el estómago se hidroliza por medio de la acción de las enzimas de los jugos gástricos. ligeramente dulce, pertenece a los grupos De los componentes de la aspirina el ácido salicílico es el que actúa contra los síntomas. Sin embargo, debemos ingerirlo en forma de (aspirina) ya que debido a su bajo pH produciría daños en nuestro tubo digestivo. El estómago es un órgano cuyo tejido está preparado y sometido a condiciones ácidas, donde el AAS se transforma. Punto de fusión: punto de temperatura Solubilidad: metro). La aspirina tiene muy escasa solubilidad en condiciones de pH bajo (como dentro del estómago), pero es soluble en acetona, éter, alcohol, agua hirviendo, benceno y turpentina; poco soluble en cloroformo, su Solubilidad en agua medida de la capacidad de una determinada sustancia para disolverse en agua 1g/100g agua a 37 ºC. Es importante mencionar que la aspirina tiene un ph acido, pero la aspirina pura no tiene un valor de ph como tal, ya que este depende de ciertas características como la cantidad de ácido, su masa molecular, el volumen de disolución y la constante de equilibrio Ka de cada fármaco. 5.2.-Propiedades Físicas: La aspirina, inodoro, es blanco, débilmente cristalina, acido, sabor AINES (Antiinflamatorios no esteroideos). Formula Peso molecular: Molecular: 180.16 C9H8O4. g/mol. Punto de ebullición: temperatura la cual pasa de estado líquido a gaseoso es de 140 º C. que pasa de estado sólido a liquido 136 º C. Densidad: 1.40 g /cm3, siendo esta la relación entre la masa y el volumen que ocupa. Absorción UV máxima: 229 nm (newton 6.- Descripción del Proceso Químico. El proceso químico para concebir la Aspirina es la acetilación, consiste en una reacción que introduce un grupo acetilo en un compuesto químico. Para la síntesis de la aspirina el anhídrido acético es usado como agente de acetilación. En la producción del ácido acetilsalicílico, se protona el oxígeno para obtener un electrófilo más fuerte. La reacción química de la síntesis de la aspirina se considera una esterificación. El método es una de las reacciones más usadas en los laboratorios de química en universidades de pregrado. El proceso de síntesis consiste en tratar el ácido salicílico con anhídrido acético, en presencia de ácido sulfúrico o ácido fosfórico que actúan como catalizadores. 6.2.- Reacciones Químicas Involucradas. 6.2.1.- Protonación del grupo carbonilo del Anhídrido Acético, formación del electrófilo fuerte por medio del catalizador ácido sulfúrico. 6.2.2.- El ataque del nucleófilo: El ataque al nucleófilo que tiene densidad electrónica se dirige hacia el carbono que posee carga positiva. Es seguido por la pérdida de un protón y salida de un ion de acetato. 6.2.4.-Formación del Ácido acetilsalicílico y el ácido acético: Sucede una desprotonación del Ester protonado por parte del ion acetato que desprende un hidrogeno para formar un compuesto más estable. 6.2.3.- Reordenamiento y formación del catalizador: formación del hidrato de 6.3.- Proceso de Fabricación de la Aspirina a pequeña escala. Para obtener 3.5 g de Aspirina: Ester, ion acetato y del catalizador por la protonación. a) Síntesis. Se pesan 2,5 g de ácido salicílico en un vidrio de reloj, traspasándolo posteriormente a un vaso de 100 mL. Con cuidado se adicionan 10 mL de Anhídrido acético y posteriormente 2 mL de ácido fosfórico al 85%. La mezcla se agita con una temperatura entre (70-80) °C (reacción exotérmica) durante 15 minutos esperando a que todo el ácido salicílico se disuelva. Transcurridos aproximadamente 30 minutos la disolución se habrá enfriado a temperatura ambiente, se añaden 50 mL de agua helada en varias alícuotas, se agita bien y se mantiene sobre hielo picado; el contenido será una masa sólida de cristales de aspirina y los cristales se recogen por filtración a vacío en un embudo Buchner. Pesar la cantidad de ácido acetilsalicílico obtenido después del proceso de secado. b) Purificación. El ácido acetilsalicílico puede purificarse por recristalización, para ello se coloca el ácido acetilsalicílico obtenido en un vaso de precipitados de 100 mL y se le añaden 10 mL de etanol. Se calienta en placa calefactora, hasta que los cristales se disuelvan, se añaden lentamente 15 mL de agua destilada y se continúa la calefacción hasta que la disolución entre en ebullición. Seguidamente se deja enfriar el vaso de precipitados sobre hielo picado, y cuando se inicie el enturbiamiento se rasca la pared del vaso con una varilla de vidrio hasta que recristalice la aspirina. A continuación, se filtra de nuevo a vacío, lavando los cristales con dos porciones de 3 mL de agua helada y se secan comprimiéndolos sobre papel de filtro, una vez eliminada la mayor parte del agua se lleva el producto restante en el vidrio de reloj a la estufa a secar durante 20 minutos. Pesar la cantidad de ácido acetilsalicílico obtenido después de la recristalización y el secado. c) Determinación de la pureza del ácido acetilsalicílico sintetizado mediante valoración. Para evitar errores en la determinación del contenido en ácido acetilsalicílico debidos a los reactivos y disolventes empleados es conveniente hacer un blanco para la valoración. Para ello poner en un vaso de precipitados de 100ml, 25 mL de etanol y 4 gotas de fenolftaleína. Colocar en una bureta NaOH 0,1N y adicionarla gota a gota hasta el punto de viraje. Anotar los mL del valorante gastados. A continuación, para valorar la pureza del ácido acetilsalicílico obtenido se pesan 0,3 g de la muestra (anotar exactamente el peso) y poner en un vaso de precipitados de 100 ml, añadir 25 mL de etanol para disolver el sólido y posteriormente 4 gotas de fenolftaleína. Valorar inmediatamente hasta el punto de viraje del indicador, colocar en una bureta NaOH 0,1N y adicionar de medio en medio mililitro el NaOH hasta coloración permanente de la disolución. Realizar una segunda valoración añadiendo en dos o tres veces un volumen algo menor del necesario para la neutralización, adicionando posteriormente el NaOH gota a gota hasta el punto de viraje. Anotar los mL del valorante gastados. 6.4.- Proceso de Fabricación de Aspirina a Nivel Industrial. La síntesis a nivel industrial suele obtenerse por carboxilación del fenol según Kolbe, ya que a escala industrial es muy eficaz. En esta reacción se transforma un fenol en un ácido fenólico por la acción de una base y del dióxido de carbono. Para producir 1 tonelada de ácido acetilsalicílico. Procedimiento: a) Carga (Materias primas) Se inicia la operación de carga con Ácido Salicílico y Anhídrido Acético, materias primas utilizadas en la producción de Ácido Acetilsalicílico. Para fabricar 1 tonelada de aspirina son necesarios 770 kg de ácido salicílico y 590 kg de anhídrido acético. b) Reacción: En un reactor se aplican las condiciones físicas y Químicas necesarias para asegurar que la reacción de Acetilación sea completa mediante un proceso denominado esterificación. En otras variantes del proceso, la reacción se lleva a cabo en un disolvente inerte, como CCl4, ácido acético, hidrocarburos, benceno, tolueno, etc. También pueden usarse esos disolventes para lavar los cristales, y elevar la calidad del producto. O bien, emplear un catalizador, como ácidos o aminas terciarias. Ácido Salicílico + Anhídrido Acético ►Ácido Acetilsalicílico + Ácido Acético. C6 H4 (OH) (COOH + (CH3 CO) 2O ►CH3COOC6H4COOH + CH3COOH El rendimiento de reacción es del 90%, obteniendo como subproducto 340 kg de acético. El ácido salicílico y el anhídrido acético se alimentan a un reactor de acero inoxidable en donde la temperatura debe mantenerse a menos de 90ºC, con buen control de temperatura a lo largo del ciclo. La utilización del ácido fosfórico u otro catalizador, es para evitar que se pierda el hidrogenión (H+) del ácido salicílico, y evitar que la reacción se produzca en ese punto, pues deseamos que se de en el grupo hidroxilo. Hacer que el acetato que se forma como subproducto de la reacción, del anhídrido acético, forme ácido acético y no intervenga en la reacción Por otra parte, deben recuperarse el ácido acético y el exceso empleado de anhídrido acético Tras dos o tres horas, la masa de reacción se bombea a un filtro. c) Filtración: El Ácido Acetilsalicílico líquido reaccionado pasa a través de un filtro, para retener cualquier impureza y el producto sea puro; este filtro es preparado con célite o tierra filtrante. Antes de la filtración se calentará el cristalizador designado con agua caliente y la línea de filtración con vapor. d) Cristalización: Se consigue el tamaño y la forma de los cristales mediante un enfriamiento programado. La cristalización es una técnica utilizada para la purificación de sustancias sólidas, basada en general en la mayor solubilidad que suelen presentar los sólidos en un disolvente en caliente que en frío. En este proceso, se utiliza un enfriamiento rápido, lo cual genera cristales de un menor tamaño que se deja enfriar lentamente el sistema. e) Centrifugación: Se separa el Ácido Acetilsalicílico (masa) del líquido madre (Ácido Acético y residuos de Ácido Acetilsalicílico) lavar y secar los cristales. La centrífuga se la lava con Ácido Acético, el cual debe estar libre de impurezas, transparente y con una concentración entre 99.5 – 100.5 y una temperatura de 0ºC. En esta etapa del proceso se lleva a cabo una recirculación de ácido acético, este subproducto es trasladado nuevamente al reactor porque aún puede ser utilizado, de esta forma no se generan pérdidas a la planta de producción. triturar el ácido salicílico anteriormente homogeneizado a través de la polea. f) Secado: k) Control de impurezas: Se secan los cristales extrayendo toda la humedad existente en el Ácido Acetilsalicílico. Dejando como resultado (0'5% humedad Se asegura mediante inspección física, que el producto esté libre de cualquier partícula extraña. g) Tamizado: Se deben seleccionar o clasificar el tamaño de las partículas. El Ácido Acetilsalicílico permanece temporalmente en el área de cuarentena hasta que se hayan realizado los respectivos análisis químicos y físicos que determinan su calidad. Una vez determinado el tamaño de partículas (granulometría) y comparados con los requerimientos del cliente se realiza la homogeneización del producto. h) Homogeneizado: Es entregar el producto física y químicamente igual, este instrumento de homogeneización se usa para dispersar los componentes en una partícula de tamaño uniforme. i) Molino: Se reduce el tamaño de las partículas de acuerdo a los requerimientos del cliente. El mecanismo de un molino ayuda a j) Granulador: Se compactan las partículas finas y se les da el tamaño de acuerdo a los requerimientos del cliente. Antes de iniciar la granulación de un producto, esta máquina debe estar completamente limpia y tenga la mínima posibilidad de fugas en sus diferentes partes por donde va a hacer su recorrido el producto. l) Empaque: Se procura preservar y asegurar las condiciones de calidad del producto terminado. Los materiales e insumos deben estar correctamente rotulados y situados; verificando que la marca y el número de lote tengan una impresión correcta. El producto limpio es revisado por Control de Calidad área encargada de aprobar o rechazar el cartón antes de sellar. El producto se guarda en bolsas BigBags, de este modo se preservan las condiciones físicas y químicas del producto así, como de la presentación. Las fundas big-bag han sido el medio para el manipuleo del producto Ácido Acetilsalicílico al granel. Es un envase económico y seguro para transporte de productos. Fabricados con polipropileno virgen de alta calidad. Al convertirse en instrumento de fácil transporte, reduce los costos de empaque y maximiza la utilización de espacio vertical en bodegas. m) Embarque: Es preciso verificar que el producto sea transportado de forma estrictamente segura y libre de anomalías. El transporte debe reunir las siguientes condiciones para considerarlo idóneo para transporta el producto Ácido Acetilsalicílico: 1) La plataforma debe completamente limpia y seca diversos usos, tanto farmacológicos como estéticos. A continuación se mostraran sus aplicaciones más importantes: Analgésico: Se toma para aliviar dolores de cabeza, muelas, óseos, musculares y de oídos. Antinflamatorio: Elimina la inflamación, el calor, el enrojecimiento y el dolor. Por ejemplo se aplica para tratar la artritis reumatoidea, la artrosis y la fiebre reumática. Antiagregante plaquetario: Está indicado para personas con alto riesgo de coagulación sanguínea, principalmente principalmente individuos que ya han tenido un infarto. Los especialistas indican que la aspirina es el medicamento más seguro, efectivo, barato y preventivo. Antirreumático: Reumatismo engloba un grupo de enfermedades agudas o crónicas que afectan las articulaciones. La ventaja que presenta la aspirina frente a otros fármacos es su baja toxicidad. Antipirético: Actúa bloqueando el proceso que incrementa la temperatura y descendiendo la fiebre, a través de la vasodilatación y la sudoración. Por ello, cuando la temperatura corporal es normal, su administración no provoca hipotermia. estar 2) Revisar que no exista ningún tipo de contaminante químico. 3) No debe existir olores penetrantes. 4) Revisar que no existan insectos. 5) El transporte (vehículo) debe tener cubierta protectora (lona) 6) El producto debe tener la etiqueta de: APROBADO PARA LA VENTA, colocado por el área de Control de Calidad. 7. Diagrama de flujo del proceso. Ver en los anexos: 7.1.- Diagrama de bloque para la fabricación de aspirina a pequeña escala. 7.2.- Diagrama de bloque para la fabricación de aspirina a nivel industrial. 7.3.- Diagrama de equipo para fabricación de aspirina a pequeña escala. 7.4.- Diagrama de equipo para fabricación de aspirina a nivel industrial. 8. Usos y aplicaciones del producto terminado La aspirina es un fármaco no esteroideo. A pesar de sus escasos 100 años de vida, este se ha convertido en el medicamento más consumido en el mundo, pues tiene Estudios recientes afirman que el consumo de la aspirina ayuda a combatir las siguientes enfermedades: Cáncer: Reduce el riesgo de cáncer de colon y recto, en el 40% de los casos si se toma dos veces por día. A su vez, si se ingiere una vez al día puede alejar los riesgos de cáncer mamario. Otros estudios demuestran que también podría reducir el cáncer de piel. Alzheimer: Las neuronas al inflamarse en la data avanzada provocan perdida de las capacidades cognitivas y de la memoria, que es lo característico de esta enfermedad. Estudios demuestran que al ingerir una dosis similar a la empleada como antinflamatorio, esta produciría un efecto neuroprotector evitando la muerte del 83% de las neuronas, lo que reduce el riesgo de Alzheimer. actividades del hombre. La mayoría de los problemas son provocados por las industrias, las cuales generan los siguientes contaminantes: Las aguas residuales en los procesos de las industrias farmacéuticas, en general son aguas provenientes de un proceso de filtración, que contiene restos de productos orgánicos de naturaleza muy variada, así como también agua de enfriamiento de los condensadores o bombas de vacío. El tratamiento que deberían recibir las aguas residuales o industriales para no contaminar tanto el ambiente es el siguiente: Sida: Gracias a que la aspirina estimula la producción de dos poderosos agentes activadores de la respuesta inmune, esto podría reducir los niveles de ciertos mensajeros químicos que son los que desencadenan el crecimiento del virus del VIH. La aspirina también se usa en la estética, en la eliminación de verrugas y caspa para desteñir el cabello y en mascarillas exfoliantes, para evitar el acné gracias a que el Ácido Acetilsalicílico produce la construcción y sequedad en los tejidos, facilita la cicatrización y provoca acciones antinflamatorias. Otro de los usos caseros es como quita manchas, para producir flores más verdes y para picaduras de mosquitos y abejas que debido a la propiedad antinflamatoria de la aspirina disminuirá la hinchazón. 9. Impacto ambiental Una de las principales preocupaciones en la actualidad es el acelerado deterioro del medio ambiente y la perdida de la biodiversidad como consecuencia de las Contaminación del agua: Aproximadamente el 90% de las aguas residuales, cloacales e industriales son arrojadas a los ríos, cuyas aguas son usadas para el regadío de las tierras cultivables y por lo tanto llegan a los productos agrícolas que consume el hombre. a) Pasan por un filtro de carbón vegetal, estas aguas son descargadas a una primera piscina para decantar las sustancias sólidas b) Pasan a una segunda piscina para recibir el mismo tratamiento. c) Después pasan a la tercera piscina para recibir el tratamiento químico a base de hidróxido de sodio. d) Luego recibe la aireación. e) Por ultimo pasan por un segundo filtro de carbón vegetal, para ser descargadas al pozo séptico. Emisiones de aire: Los causantes de las emisiones de aire como son gases, humos y polvos producidos por los generadores de energía. La presencia de otra clase de partículas depende del tipo de productos elaborados y los procesos aplicados. La contaminación atmosférica, generalmente se origina en las combustiones de los generadores de energía los cuales expulsan monóxido de carbono (CO), hidrocarburos (HC), óxido de nitrógeno (NOX) y humos producidos por los incineradores, utilizados frecuentemente en las industrias farmacéuticas. El ruido: Con el desarrollo de la civilización industrial y urbana el ruido ha adquirido cada vez mayor importancia, y se incluye dentro de los factores del medio que presentan efectos nocivos sobre la salud humana, es por esto que se consideran como un elemento contaminante del medio ambiente. las consecuencias del ruido, afectan cada vez más a mayor número de personas, en particular a los obreros industriales. En las industrias farmacéuticas estos ruidos y vibraciones son producidos por los procesos de granulación, centrifugación y tamización. Desechos sólidos: Se clasifican en: a) Tóxicos peligrosos: Se incluyen los acumulados en los depósitos generales, procedentes de la filtración del aire para la eliminación de partículas y polvos, los cuales son de importancias cualitativas. Estos residuos provienen de los procesos de acetilación, granulador (molino, empaques, polvos), tamización y filtración (célite) son tratados adecuadamente en incineradores donde se producen cenizas, escorias y humo. b) No tóxicos: Provienen de las fermentaciones de los procesos bioquímicos. Además se originan otro tipo de desecho constituido por un volumen apreciable de cartón y papel. Nota: Las materias primas y las formulaciones farmacéuticas tienen un tiempo limitado de actividad aceptable o de eficacia, una vez transcurrido este periodo no se debe permitir su consumo. Para esto las plantas disponen de incineradores cuya operación debe ser controlada para no causar contaminación atmosférica. 10.- Conclusiones Aspirina es un medicamento plenamente actual. Recientes investigaciones no sólo confirman sus efectos clásicos y cardiovasculares sino que han descubierto nuevos usos para la prevención y el tratamiento de varias enfermedades. Una aspirina puede salvar la vida de muchas personas, puesto que esta tiene usos antipiréticos, analgésicos y antinflamatorios La fabricación industrial de la aspirina es rentable porque es de consumo masivo a nivel mundial. Las cualidades curativas de la aspirina son básicamente proporcionadas por el ácido salicílico, puesto que anteriormente se consumía el ácido sin sintetizar , es decir, no tenía porciones del anhídrido acético. Finalmente, la razón por la que se decidió sintetizar el ácido salicílico es por sus efectos contraproducentes digestivo. a nivel Diagrama de la aspirina. Disponible: https://prezi.com/f-isjiilgddr/untitledprezi/ (consulta: 2016/mayo/27) Síntesis de la aspirina. Disponible: http://www.ugr.es/~quiored/doc/p17.pdf (consulta: 2016/mayo/30) Historia de la aspirina. Disponible: http://www.abc.es/sociedad/20130606/ab ci-aspirina-historia-investigacion-bayer201306051131.html (consulta 2016/mayo/30) 11.- Bibliografía Área de producción (investigación). Disponible: http://repositorio.ug.edu.ec/bitstream/redu g/200 C2/1/1053.pdf (consulta 2016/mayo/26) Características químicas http://aspirinaemm.blogspot.com/ (consulta: 2016/mayo/30) Anexo: 7.1 Anexo: 7.2 Anexo 7.3