Diapositiva 1
Anuncio

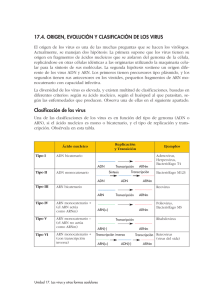
Transcripción Gen: unidad de ADN que contiene la información para especificar la síntesis de un polipéptido o de un ARN funcional (ARNt, ARNr) Transcripción es la síntesis de una cadena de ARN que representa una hebra igual en secuencia al ADN doble cadena (hebra codificante 5´- 3´). La hebra complementaria sirve de templado o molde (3´- 5´). Es catalizada por la ARN polimerasa Durante la transcripción, la polimerización de rNTPs por la ARN polimerasa se realiza en dirección 5’- 3 usando como molde la hebra complementaria (3´- 5´) Unidad de transcripción Puede incluir más de un gen (ej. en las bacterias) Etapas de la transcripción ARN polimerasa bacteriana Una sola ARN polimerasa sintetiza los 3 tipos de ARNs Holoenzima (~500 kDa)= α2 β β’(core) + σ Es inhibida por antibióticos de la familia de las rifamicinas (ej. Rifampicina) El factor σ facilita la unión de la ARN polimerasa al promotor, se libera durante la elongación de la cadena. Existen varios factores σ en E. coli (σ alternativos) que reconocen diferentes promotores (regulación de la expresión génica). Promotores Elemento reconocido por la ARN polimerasa para iniciar la transcripción. Presentan secuencias particulares cortas de localización específica. Promotores en bacterias: - Sitio de inicio de transcripción (start point), purina (CAT) - Secuencia o caja -10 ( 5´-TATAAT 3´) - Secuencia o caja -35 (5´-TTGACA 3´) - Elemento UP («upstream») (rico en AT) en algunos genes de alta expresión (rARNs). 5´- - 3´ Señales de terminación de la transcripción en bacterias Terminadores intrínsecos: Se forma una estructura de horquilla en el ARN rica en GC seguida de una región rica en U. La ARN pol se detiene en la horquilla y luego se desprende del templado, liberando el transcripto. Terminadores Rho-dependientes Necesitan la participación de la proteína Rho. Rho es miembro de la familia de helicasas hexaméricas ATP-dependientes. Rho se une al ARN naciente. Mientras la ARN pol se detiene en el terminador (ADN), la actividad helicasa de Rho desenrolla el transcripto A(RN) del híbrido ADN-ARN. ~ la mitad de los terminadores transcripcionales de E. coli son Rho-dep. Se descubrieron en los genomas de fagos. Transcripción en eucariontes ARN polimerasas Hay 3 tipos: - Pol I transcribe ARNr - Pol II transcribe ARNm - Pol III transcribe ARNt y otros ARNs pequeños ARN Pol II: - 12 subunidades, > 500 kDa. - La subunidad mayor posee un dominio CT (CTD) único de la RNA pol II que se fosforila durante el inicio de la transcripción. Pol II es sensible a α-amanitina. La ARN pol se une al promotor a través del contacto con los factores de transcripción generales (FTs). Para ARN pol II: FTIIA, FTIIB, etc Los FTs se requieren solamente para iniciar la transcripción RNA polI + FTII grales = Aparato de transcripción basal de la pol II Promotores en eucariotas: Formados por secuencias cortas ubicadas en las cercanías del sitio de inicio de la transcripción (hasta aprox. 200 pb). Localizan el sitio de inicio de la Transcripción . Existen módulos específicos en genes particulares que están involucrados con la regulación. Promotor mínimo es la secuencia mínima en la cual la ARN pol. puede iniciar la transcripción. Puede ser de dos tipos: 1. Con TATA box: InR (iniciador, -3+5 ) + TATA box (-25, equivalente a caja -10 5´bacteriana). El 80 % de los promotores. 2. Sin TATA box : InR + DPE (downstream promoter element, en +28+32). - 3´ Elementos proximales del promotor Los promotores contienen diferentes combinaciones de módulos en la región río arriba (5’) del promotor mínimo a los que se asocian diferentes factores que aumentan el nivel de la transcripción. Estos módulos son: GC box, CAAT box, Octámero Son secuencias cortas (10-20 pb) localizadas entre 100-200 pb río arriba del sitio de inicio. Estos módulos y los factores que los reconocen son comunes en una variedad de promotores. Secuencias amplificadora (Enhancers) Elementos modulares que estimulan el inicio de la transcripción, están localizados a distancia del sitio de inicio de la transcripción (hasta ~50 kpb), río arriba (5’) o río abajo (3’) del promotor. Tienen ~100 pb de largo, formados por varios módulos de 10-20 pb. Participan en la regulación temporal/espacial de genes. UAS (upstream activator sequences) de levaduras. Similar a enhancers, se localizan río arriba del promotor mínimo. Elementos de control que regulan la expresión génica en eucariotas multicelulares y levaduras Ensamblado in vitro de los FTs II en el promotor mínimo e inicio de la transcripción en eucariontes TBP: proteína de unión al TATA box. TAFs: factores asociados a TBP (in vivo). TFIID=TBP+TAFs TFIIH posee actividad helicasa (desenrolla ADN doble cadena en el promotor) y kinasa, fosforila al CTD de la ARN pol II durante el inicio de la transcripción. El CTD de la ARN Pol II coordina el procesamiento del ARNm con la transcripción. Es importante para reclutar los factores involucrados en las modificaciones postranscripcionales del pre-ARNm. ARN mensajeros Los ARNm contienen regiones codificantes (codones que especifican la proteína) y regiones no codificantes (no codifican proteínas) en ambos extremos: 5’ y 3’ UTRs (untranslated regions). Las UTRs son más cortas en los ARNm bacterianos (pocos nt) que en los ARNm eucariontes (cientos de nt). ARNm bacteriano Los ARNm bacterianos son generalmente policistrónicos (codifican varias proteínas) Los ARNms policistrónicos poseen regiones intergénicas de 1-30 pb. ARNm bacteriano Se transcriben y traducen simultáneamente (2 min para ARNm 5 kpb equivalente a una proteína de 180 kDa) en el mismo compartimento celular Son inestables (t1/2 ~2 min) y se traducen unos pocos min. ARNm eucarionte - Síntesis y maduración en el núcleo, luego son exportados al citoplasma y traducidos. - Se sintetizan como precursores (pre-ARNm) y sufren modificaciones en los extremos que identifican a los ARNms : Agregado de la cápsula/capucha (CAP) en extremo 5’ Adición de cola de poli-A en extremo 3’. - Son generalmente monocistrónicos (codifican una única proteína). - Son relativamente estables y se traducen por varias hs. T1/2 de ARNm de células animales ~1-24 hs. Procesamiento del ARNm para producir un ARNm funcional en eucariontes Los ARNm se asocian con proteínas que contienen dominios de unión al ARN Pre-ARNm: transcriptos nacientes del ARNm e intermediarios del procesamiento. ARN heterogéneo nuclear (hnRNA): pre-ARNm y otros ARNs nucleares (ej. ARN pequeňos nucleares o snRNAs). Los hnRNA se asocian con proteínas nucleares formando partículas ribonucleoproteicas heterogéneas (hnRNP). Proteínas hnRNP ~34-120 kDa Funciones: - Evitan formación de estructuras secundarias en los pre-ARNm facilitando su interacción con proteínas y ARNs involucrados en su procesamiento. - Facilitan el transporte de los ARNm maduros al citoplasma. Procesamiento en extremo 5’ del ARNm: Encapuchamiento del ARNm (capping) Modificación en extremo 5 ‘ del ARNm naciente por adición de un nt atípico, 7-metilguanilato (cap) mediante unión inusual 5’5’-trifosfato. Enzima formadora del CAP interacciona con el dominio CTD fosforilado de la ARN pol II durante la transcripción, por lo que el capping es específico de los ARNms. El capping ocurre cuando el ARNm tiene ~25 nt. Funciones del CAP: - Protege al ARNm de la degradación enzimática - Contribuye a su desplazamiento hacia el citoplasma - Se une a un factor proteico para comenzar la traducción del ARNm en el citoplasma. Procesamiento en extremo 3’ del ARNm: Poliadenilación Los ARNms de células eucariontes, excepto los de histonas, tienen poli(A). Mecanismo: Escisión del extremo 3’del ARNm por endonucleasa para generar OH- libre sobre el cual la enzima poli(A) polimerasa (PAP) agrega residuos de ácido adenílico, 100-250 b (cola poli-A). Proporciona estabilidad al ARNm Corte y empalme del ARNm (splicing) Escisión interna del pre ARNm, remoción de intrones (porciones no codificantes) y ligación de exones (porciones codificantes). Los genes de eucariontes multicelulares contienen múltiples intrones, a diferencias de los genes de bacterias y arqueas. Cómo se reconocen las secuencias que deben eliminarse? Existen secuencias consenso cortas en sitios de corte y empalme que flanquean los intrones en los pre-ARNms y que actúan como señales para su eliminación. Los snRNAs se aparean con el pre-ARNm y entre sí durante el corte y empalme snRNA: ARNs nucleares pequeños ricos en U (U1-U2-U4-U5-U6) de 100-200 nt. snRNA+ proteínas: partículas ribonucleoproteicas nucleares pequeñas (snRNP). Las snRNPs + pre-ARNm forman el empalmosoma El corte y empalme es llevado a cabo en gran medida por los snRNAs que reconocen los límites exón-intrón a través del apareamiento de bases complementarias. Participan intimamente en los procesos químicos de corte y empalme. El empalme de exones se lleva a cabo mediante dos reacciones de transesterificación. Los intrones son eliminados como una estructura con forma de lazo en la que la G 5’del intrón forma un enlace fosfodiéster inusual 2’-5’ con A (punto de ramificación) del 3’ del intrón. Un enlace fosfodiéster se intercambia por otro. Exosoma: Exonucleasas nucleares que degradan en sentido 3’-5’ los ARNs resultantes del procesamiento. Los pre-mARNs y ARNs maduros con protección en ext. 5’y 3’ no son degradados. El splicing alternativo del mRNA incrementa el número de proteínas expresadas a partir de un gen eucariótico único. Produce diferentes formas de una proteína (isoformas) en distintos tipos celulares. Eliminación específica de exones del pre-mRNA de fibronectina en fibroblastos y hepatocitos. Intrones (línea negra), exones (cajas de colores). Fibronectina proteína multidominio de la matriz extracelular de los mamíferos. Fibroblastos producen mRNA con exones (verde) que codifican dominios de unión a proteínas de membrana del fibroblasto. Esta fibronectina adhiere los fibroblastos a la matriz extracelular. Hepatocitos, mRNA carece de estos exones, esta isoforma no se adhiere al fibroblasto y circula en sangre participando en la formación de coágulos. Edición del mARN Altera las secuencias del pre-mRNA, la secuencia del ARN maduro difiere de los exones que lo codifican en el ADN genómico. Se descubrió a mediados de 1980. Muy difundida en mitocondrias de protozoos, plantas y cloroplastos. Edición del pre-mRNA de apolipoproteína B (apoB). Transportan lípidos en el suero Northern blotting RT-PCR Análisis del transcriptoma celular Conjunto de ARNm sintetizados en un momento dado. Comparación del transcriptoma celular en diferentes condiciones mediante DNA microarrays Técnicas para el estudio de la Interacción entre ADN y proteínas Geles de retardo. Permite detectar FT durante una purificación Se incuba un fragmento de ADN marcado con una secuencia de interés (ej CAAT box) en ausencia y presencia de proteína X. Se fraccionan los productos en gel nativo y se identifican por autorradiografía. 1. ADN solo; 2. ADN + proteína; 3. ADN + 2 proteínas La aparición de bandas con movilidad retrasada indican la formación de un complejo ADN-proteína Huellas de ADN (ADN footprinting) Permite identificar la secuencia de ADN específica a la cual se une un FT. Pasos: 1. Marcación del fragmento de ADN 2. Incubación del ADN marcado con/sin proteína. 3. Incubación con DNAasa I 4. Separación de los fragmentos por electroforesis en geles desnaturalizantes y autorradiografia La región protegida por la proteína se visualiza como una huella en el patrón de bandas resultante de la digestión con DNAsa I en comparación con la muestra sin digerir. NE, sin extracto. O, extracto proteico total. 1-22, diferentes fracciones proteicas eluídas de una columna Ensayos con genes reporteros Genes reporteros: Codifican proteínas fácilmente medibles (B-gal, luciferasa, GFP) Permiten Identificar/caracterizar elementos de control de la transcripción en el ADN. Fragmentos de ADN de longitudes variables en extr.5’ se clonaron en un plásmido río arriba de un gen reportero carente de su propio promotor. Se trasformaron células y se midió la actividad del gen reportero.