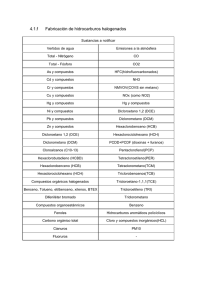
α-GLC - Universidad Tecnológica de Pereira
Anuncio

EVALUACIÓN DE LA ACTIVIDAD INHIBITORIA DE LA α- GLUCOSIDASA (α-GLC) in vitro POR EXTRACTOS VEGETALES IVONNE MELISSA AVELLANEDA ORTIZ UNIVERSIDAD TECNOLÓGICA DE PEREIRA FACULTAD DE TECNOLOGÍA ESCUELA DE TECNOLOGÍA QUÍMICA PEREIRA 2013 EVALUACIÓN DE LA ACTIVIDAD INHIBITORIA DE LA α- GLUCOSIDASA (α-GLC) in vitro POR EXTRACTOS VEGETALES IVONNE MELISSA AVELLANEDA ORTIZ CÓDIGO: 1087992796 TRABAJO DE GRADO MONOGRAFÍA Requisito parcial para optar al título de Químico Industrial DIRECTOR DEL PROYECTO OSCAR MARINO MOSQUERA MARTÍNEZ Profesor Titular Universidad Tecnológica de Pereira UNIVERSIDAD TECNOLÓGICA DE PEREIRA FACULTAD DE TECNOLOGÍA ESCUELA DE TECNOLOGÍA QUÍMICA PEREIRA 2013 NOTA DE ACEPTACIÓN DEL TRABAJO DE GRADO EVALUACIÓN DE LA ACTIVIDAD INHIBITORIA DE LA α- GLUCOSIDASA (α-GLC) in vitro POR EXTRACTOS VEGETALES MONOGRAFÍA Presentado por: IVONNE MELISSA AVELLANEDA ORTIZ El suscrito director y jurados del presente trabajo de grado, una vez revisada la versión escrita y presenciado la sustentación oral, decidimos otorgar la nota de: __________________. Con la connotación: __________________. Para la constancia firmamos en la ciudad de Pereira hoy 20 de Noviembre de 2013. Director: __________________________ Oscar Marino Mosquera Martínez Jurado: ___________________________ Juan Carlos Sepúlveda Arias AGRADECIMIENTOS A Dios, por estar siempre de mi lado. A mi madre, María Inés Ortiz Vélez por darme la vida, su infinito amor, comprensión, por la oportunidad de creer en mí y en que puedo ser alguien importante. A mi abuelo, Vicente Avellaneda eres un ejemplo a seguir, un gran orgullo para mí; gracias por tu apoyo incondicional y tu hermosa humildad. A Juan Manuel Gordillo González, Goffman, por la ayuda brindada. A todos los miembros de mi familia, por ayudarme de alguna u otra manera a resolver muchos de los obstáculos que encontré en el camino. Quiero agradecer especialmente a mi madrina, Elba Ortiz Vélez. A mis profesores, especialmente Oscar Marino Mosquera y Jaime Niño Osorio, por brindarme la oportunidad de pertenecer al Grupo Biotecnología – Productos Naturales (GB-PN), por su paciencia, concejos, apoyo y comprensión durante la ejecución del proyecto. A mis compañeras y compañeros del grupo GB-PN, por quienes tengo mucho respeto, cariño y admiración. A mi amigo de carrera, Andrés Mauricio Arias González porque siempre luchamos bajo todas las circunstancias académicas y nació una sincera amistad. A la Universidad Tecnológica de Pereira. Rubiela Vélez, Janet y Aaron TABLA DE CONTENIDO AGRADECIMIENTOS ......................................................................................................3 TABLA DE CONTENIDO ................................................................................................. I ÍNDICE DE TABLAS ....................................................................................................... V ÍNDICE DE FIGURAS ................................................................................................. VII ÍNDICE DE ANEXOS ...................................................................................................... X 1. INTRODUCCIÓN....................................................................................................... 1 2. MARCO TEÓRICO.........................................................................................................3 2.1 HIDROLASAS ..........................................................................................................3 2.1.1 Aspectos Básicos ..................................................................................................3 2.1.2 Distribución y función de las α-Glucosidasas (α-GLC) en los seres vivos ....................................................................................................................................5 2.1.3 Clasificación de las α-Glucosidasas (α-GLC) .................................................6 2.1.3.1 Clasificación de las α-Glucosidasas (α-GLC) según la Unión Internacional de Bioquímica (UIB)............................................................................7 2.1.3.1.1 Mecanismos de hidrolisis de las glicósido hidrolasas ..........................7 2.1.3.2 Clasificación de las α-Glucosidasas (α-GLC) según su especificidad por el sustrato ................................................................................................................9 2.1.3.3 Clasificación de las α-Glucosidasas (α-GLC) según la secuencia de aminoácidos en su estructura primaria ....................................................................9 2.1.4 Actividades biológicas asociadas con la inhibición de las αGlucosidasas (α-GLC) ................................................................................................... 11 2.1.5 Los inhibidores de las α-Glucosidasas (α-GLC).......................................... 12 I 2.1.5.1 Inhibidores de las α-Glucosidasas (α-GLC) con actividad farmacológica ................................................................................................................ 12 2.5.1.2 Inhibidores de las α-Glucosidasas (α-GLC) con actividad antialimentaria ...................................................................................................................... 13 2.1.5.3 Inhibidores de la α-Glucosidasa (α-GLC) de origen natural y de origen sintético reportados en ola literatura...................................................... 15 2.1.6 Los métodos para la evaluación de la actividad inhibitoria de la α- Glucosidasa (α-GLC) in vitro en extractos vegetales ........................................ 17 2.1.6.1 Fundamento del método fotométrico para la evaluación de la actividad inhibitoria de la α-Glucosidasa (α-G) in vitro .................................... 18 2.1.6.2 Sustratos utilizados en el estudio de la actividad enzimática glucósido hidrolasas (GH) ......................................................................................... 20 2.2 VARIABLES DE LA CINÉTICA DE UNA ENZIMA ................................... 21 2.3 ZONAS DE ESTUDIO ....................................................................................... 23 2.3.1 Reserva Natural Bremen-La Popa (RNB-LP) ............................................. 23 2.3.2 Parque Regional Natural Ucumarí (PRNU) ................................................ 24 2.3.3 Familias de plantas de estudio ..................................................................... 25 2.3.3.1 Familia Annonaceae ....................................................................................... 25 2.3.3.2 Familia Apocynaceae .................................................................................... 26 2.3.3.3 Familia Asclepiadaceae .............................................................................. 26 2.3.3.4 Familia Asteraceae....................................................................................... 27 2.3.3.5 Familia Clusiaceae ......................................................................................... 27 2.3.3.6 Familia Costaceae ......................................................................................... 27 2.3.3.7 Familia Euphorbiaceae ................................................................................. 28 2.3.3.8 Familia Lamiaceae ......................................................................................... 28 2.3.3.9 Familia Lauraceae ......................................................................................... 29 2.3.3.10 Familia Malvaceae ....................................................................................... 29 II 2.3.3.11 Familia Melastomataceae .......................................................................... 30 2.3.3.12 Familia Passifloraceae ............................................................................... 30 2.3.3.13 Familia Piperaceae ...................................................................................... 30 2.3.3.14 Familia Solanaceae....................................................................................... 31 2.3.3.15 Familia Urticaceae ....................................................................................... 31 3.JUSTIFICACIÓN ....................................................................................................... 32 4. OBJETIVOS ................................................................................................................ 35 4.1 OBJETIVO GENERAL ........................................................................................ 35 4.2 OBJETIVOS ESPECÍFICOS ............................................................................ 35 SECCIÓN EXPERIMENTAL......................................................................................... 36 5.1 MATERIALES ................................................................................................... 36 5.1.1 Equipos y reactivos ....................................................................................... 36 5.1.2 Material vegetal ................................................................................................ 36 5.2 MÉTODOS ......................................................................................................... 37 5.2.1 Obtención de los extractos crudos ............................................................. 37 5.2.2 Caracterización fitoquímica por cromatografía de capa delgada (CCD) 38 6. RESULTADOS Y DISCUSIÓN ............................................................................... 41 6.1 OBTENCIÓN DE LOS EXTRACTOS CRUDOS ........................................... 43 6.2 CARACTERIZACIÓN FITOQUÍMICA POR CROMATOGRAFÍA DE CAPA DELGADA (CCD) .............................................................................................. 44 6.3 FORMATO DEL MÉTODO FOTOMÉTRICO PARA LA EVALUACIÓN DE LA ACTIVIDAD INHIBITORIA α-GLUCOSIDASA (α-GLC) ................. 51 6.4 VARIABLES IMPORTANTES EN EL DISEÑO DEL MÉTODO FOTOMÉTRICO PARA LA EVALUACIÓN DE LA ACTIVIDAD INHIBITORIA DE LA Α-GLUCOSIDASA (Α-GLC) in vitro.......................... 52 6.4.1 La fuente de la α-Glucosidasa (α-GLC) ....................................................... 53 III 6.4.2 Selección del sustrato .................................................................................... 54 6.4.3 El pH y la temperatura del ensayo .............................................................. 54 6.4.4 Concentración de la solución buffer ........................................................... 55 6.4.5 La concentración de la α-Glucosidasa (α-GLC) en el ensayo ................ 56 6.4.6 La concentración final de p-Nitrofenil-α-D-glucopiranósido (p-NFGP) en el ensayo ................................................................................................................... 58 6.4.7 El tiempo de duración del ensayo ................................................................ 59 6.4.8 La solubilidad de los reactivos en el momento del ensayo ................... 60 6.4.9 El perfil de los inhibidores enzimáticos ..................................................... 61 6.5 Etapas del método fotométrico para la evaluación de la actividad inhibitoria α-glucosidasa (α-GLC) en plantas de la Ecorregión Eafetera Colombiana (ECC) ........................................................................................................ 62 6.5.1 Ecuaciones para realizar los cálculos de porcentajes de inhibición y actividad enzimática. .................................................................................................. 64 6.6 TRATAMIENTO ESTADÍSTICO DE LOS DATOS OBTENIDOS EN EL MÉTODO FOTOMÉTRICO PARA LA EVALUACIÓN DE LA ACTIVIDAD INHIBITORIA DE LA α-GLUCOSIDASA (α-GLC) EN PLANTAS DE LA ECORREGIÓN CAFETERA ..................................................... 66 7. CONCLUSIONES ....................................................................................................... 67 8. RECOMENDACIONES .............................................................................................. 68 9. BIBLIOGRAFÍA .......................................................................................................... 69 IV ÍNDICE DE TABLAS Tabla 1. Características de los tipos de α-Glucosidasa (α-GLC) según la especificidad por el sustrato (Okuyama et al., 2005). ...........................................9 Tabla 2. Actividades biológicas relacionadas con la inhibición de la αGlucosidasa (α-GLC). ........................................................................................................ 11 Tabla 3. Lista de algunos inhibidores de la α-Glucosidasa (α-GLC) de origen botánico. Las especies resaltadas en color verde presentan actividad antialimentaria. ......................................................................................................................... 15 Tabla 4. Inhibidores de las α-Glucosidasa (α-GLC) de origen bacteriano. ...... 16 Tabla 5. Lista de algunos inhibidores de la α-Glucosidasa (α-GLC) de origen sintético. ............................................................................................................................. 17 Tabla 6. Ingredientes activos de plaguicidas y bioplaguicidas aprobados por la EPA (Enviromental Protection Agency) desde 1997 al 2010 ......................... 33 Tabla 7. Nombres científicos de las especies de plantas estudiadas en el proyecto. ............................................................................................................................ 37 Tabla 8. Sistemas de elución utilizados en la caracterización fitoquímica por CCD. ..................................................................................................................................... 39 Tabla 9. Patrones, reveladores y criterios de detección de metabolitos secundarios usados en la caracterización fitoquímica por cromatografía de capa delgada (CCD). ........................................................................................................ 40 Tabla 10. Características de absorción en luz ultravioleta (360 nm) de los diferentes tipos de flavonoides (Farnsworth, 1966). ........................................... 41 Tabla 11. Masas de los extractos crudos de n-hexano, diclorometano y metanol obtenidas por maceración pasiva................................................................ 43 Tabla 12. Clases de α-Glucosidasas (α-GLC) disponibles comercialmente y sus características. ................................................................................................................ 53 Tabla 13. Condiciones experimentales de temperatura y pH óptimas para el ensayo de acuerdo a las recomendaciones establecidas por el fabricante. .. 55 Tabla 14. Concentraciones de α-Glucosidasa (α-GLC) utilizadas en ensayos actividad inhibitoria en extractos crudos de plantas. ......................................... 57 V Tabla 17. Metodología del método fotométrico para la evaluación de la actividad inhibitoria α-Glucosidasa (α-GLC) en plantas de la Ecorregión Cafetera Colombiana . .................................................................................................... 63 VI ÍNDICE DE FIGURAS Figura 1. Estructura en 3D de la α-Glucosidasa aislada de Bacillus cereus (Watanabe et al., 1997). ...................................................................................................3 Figura 2. Tipos de estructura tridimensional del sitio activo de las glicósido hidrolasas. Tipo bolsillo (1). Tipo túnel (2). Tipo hendidura (3). (Davies and Henrissat, 1995). ................................................................................................................4 Figura 3. Esquema del sitio activo de la α-Glucosidasa (α-GLC) aislada de Saccharomyces cerevisiae frente a dos disacáridos conformados por (I) glucosa y manosa. (II) glucosa y galactosa. (Yao et al., 2003). ...........................6 Figura 4. Mecanismo de Inversión. Estas enzimas utilizan dos residuos enzimáticos, normalmente residuos carboxílicos, que actúan como un ácido y una base respectivamente (Davies and Henrissat, 1995) ......................................7 Figura 5. Mecanismo de retención. Estas enzimas actúan mediante un mecanismo de dos etapas. Una vez más dos residuos se ven involucrados, uno actúa como nucleófilo y el otro como un ácido o base. En el primer paso el nucleófilo ataca en centro anómerico, dando como resultado la formación de una enzima glucosídica intermedia con un carácter ácido provisto por el carboxilato ácido. En el segundo paso el ahora desprotonado carboxilato ácido actúa como base y se une a una molécula de agua nucleofílica para hidrolizar la enzima intermedia, dando el producto hidrolizado (Davies and Henrissat, 1995). ................................................................................................................8 Figura 6. Estructura terciaria de algunas familias de glucósido hidrolasa (GH) (Davies and Henrissat, 1995). ............................................................................ 10 Figura 7. Estructuras químicas de los inhibidores de las α-Glucosidasas (αGLC) de origen bacteriano (Narender et al., 2013). Acarbosa, oligómero de pseudoazúcar (1). Voglibosa, amina poli-hidroxilada (2). Miglitol, heterocíclico N-sustituido poli-hidroxilado (3). ..................................................... 12 Figura 8. Estructura química de la Azadiractina (tri-terpenoide) componente activo de bioplagacidas (Raizada et al., 2001). ........................................................ 14 VII Figura 9. Metabolitos secundarios con actividad anti-alimentaria (Simmonds, 2006).................................................................................................................................... 14 Figura 10. Hidrólisis enzimática del p-Nitrofenil-α-D-glucopiranósido (pNFGP) por acción de la α-Glucosidasa (α-GLC) liberando unidades de pnitrofenolato y a-D-glucosa. Adaptado de (Cihan et al., 2010; Guo et al., 2010). ................................................................................................................................... 19 Figura 11. Estructuras de resonancia del ión p-nitrofenolato en medio básico (Adams and Langley, 1998). .......................................................................................... 20 Figura 12. Ecuación general de una reacción catalizada por enzimas (Segel, 1976). ................................................................................................................................... 21 Figura 13. Ecuación de una reacción catalizada por enzimas donde sólo participa un sustrato (Kargi, 2009). ........................................................................... 21 Figura 14. Relación gráfica de la constante de Michaelis-Menten y la velocidad máxima (Vm) (Fromm and Hargrove, 2012). ......................................... 22 Figura 15. Expresión gráfica de Lineweaver-Burke (Fromm and Hargrove, 2012) ................................................................................................................................... 23 Figura 16. Etapas desarrolladas durante la ejecución del proyecto. ............... 42 Figura 17. Porcentajes de abundancia relativa de metabolitos secundarios en extractos vegetales de n-hexano de plantas de la Ecorregión Cafetera Colombiana. ........................................................................................................................ 45 Figura 18. Porcentajes de abundancia relativa de metabolitos secundarios en extractos vegetales de diclorometano de plantas de la Ecorregión Cafetera Colombiana. ........................................................................................................................ 47 Figura 19. Porcentajes de abundancia relativa de metabolitos secundarios en extractos vegetales de metanol de plantas de la Ecorregión Cafetera Colombiana ......................................................................................................................... 49 Figura 20. Actividad enzimática de la polifenol oxidasa en función de la concentración de la solución buffer pH 5 (Cestari et al., 2002)...................... 56 Figura 21. Distribución de los tipos de muestras en la microplaca de 96 pozos. En la tabla se exponen los tipos de muestra estudiados en el proyecto. ............................................................................................................................ 62 VIII Figura 22. Caracterización de cumarinas en extractos de metanol. (Revelador: KOH al 5%, observar en luz ultravioleta). ....................................... 112 IX ÍNDICE DE ANEXOS Anexo 1. Metodología de la obtención de los extractos crudos de n-hexano, diclorometano y metanol (Niño et al., 2007). ......................................................... 90 Anexo 2. Procedimiento de la caracterización fitoquímica de los extractos crudos por cromatografía de capa delgada (Wagner and Bladt, 1996). .......... 91 Anexo 3. Resultados de la caracterización fitoquímica de los extractos crudos den-hexano, diclorometano y metanol por CCD. ...................................... 92 Anexo 4. Cálculo de la relación señal ruido (Skoog et al., 2008) ..................... 110 Anexo 5. Extracción de la acarbosa a partir de pastillas de Glucobay® 100 mg de Bayer (Cherkaoui et al., 1998). .......................................................................111 Anexo 6. Cálculo de los porcentajes de abundancia relativa de metabolitos secundarios en los extractos vegetales evaluados. ............................................ 112 X 1. INTRODUCCIÓN El hombre ha dependido de la naturaleza desde el inicio de la humanidad (Mukhtar et al., 2008) con el propósito de suplir sus necesidades básicas como la alimentación de él y sus animales; de seguridad y protección, como la obtención de fertilizantes, agentes para el control de plagas, medicinas, refugio, vestimenta; de confort como condimentos, cosméticos y fragancias (Gurib-Fakim, 2006; Powell, 2009). Las plantas han formado la base de sofisticados sistemas de medicina tradicional en diferentes culturas del mundo desde hace miles de años y seguirán proporcionando a la humanidad nuevos compuestos con propiedades terapéuticas. Actualmente, el conocimiento empírico de las propiedades de las plantas medicinales está siendo utilizado como guía de los químicos en la búsqueda de diferentes clases de fitocompuestos con interés farmacológico (Vitalini et al., 2009). Los metabolitos secundarios de plantas y de origen microbiano, están entre los compuestos farmacéuticos más conocidos por la sociedad científica (Carlson et al., 2008; Zhang and Tang, 2008) evidenciando actividades biológicas específicas (Feher and Schmidt, 2002) y eficaces en el tratamiento contra el cáncer, diferentes tipos de infecciones, inflamación, hipercolesterolemia, el rechazo de tejidos en el trasplante de órganos, entre otros (Ojima, 2008); además de biocompuestos que pueden ser usados como ingredientes activos en plaguicidas (Kent, 2012). Dada la importancia de las enzimas en la salud humana, el estudio de los mecanismos enzimáticos han proporcionado una interfaz entre la química orgánica, el descubrimiento de fármacos (Khosla, 2000) y aplicaciones en el campo de la biotecnología; las enzimas son consideradas como marcadores de importancia farmacológica (Carlson et al., 2008) en el desarrollo de nuevos 1 agentes terapéuticos (Komatsu et al., 2013) y métodos para el control de plagas (Nimpiboon et al., 2011). El estudio de la actividad de inhibición de la α-glucosidasa está asociada con las siguientes actividades biológicas: anti-alimentaria en animales herbívoros, anti-hiperglicemica (Raju et al., 2010), anti-infecciosa, antimetásica, anti-viral (VIH), efectos reguladores del crecimiento en las plantas (Wrodnigg et al., 2006) y desarrollo de enfermedades por almacenamiento excesivo en los lisosomas (Sawkar et al., 2006). Conociendo la riqueza de flora de la Ecorregión Cafetera Colombiana , la cual es fuente de metabolitos secundarios con actividades biológicas comprobadas (Niño et al., 2002; Niño et al., 2003) realizadas en estudios previos y a la necesidad de encontrar fito-compuestos con potencialidad para ser utilizados como inhibidores de esta glucósido hidrolasa (GH), se propone el método fotométrico para evaluar la actividad inhibitoria de la αGlucosidasa (α-GLC) en extractos vegetales pertenecientes a la Ecorregión Cafetera Colombiana. Este estudio ampliará el conocimiento de la flora de esta región y determinará los usos potenciales de la misma. 2 2. MARCO TEÓRICO 2.1 HIDROLASAS 2.1.1 Aspectos Básicos Las hidrolasas son una clase de enzimas que catalizan las reacciones de hidrólisis de diferentes sustratos como ésteres de ácidos carboxílicos y de ácidos fosfóricos, éteres, péptidos y carbohidratos utilizando agua en el proceso (Sacher et al., 2009). Las hidrolasas son importantes en la industria química, farmacéutica y de alimentos (Balogh et al., 2004). Las glicósido hidrolasas (GH) son una subclase de las hidrolasas, que actúan sobre los enlaces glicosídicos (α y β) de di, oligo y polisacáridos con el fin de obtener unidades de monosacáridos bajo dos mecanismos: inversión o retención (Davies and Henrissat, 1995). Las GH están involucradas en diferentes procesos biológicos como la degradación de la biomasa y el reconocimiento viral (Kuntz et al., 2008). Las α-Glucosidasas (α-GLC) (figura 1) pertenecen a esta subclase de enzimas (Giannesi et al., 2006). Figura 1. Estructura en 3D de la α-Glucosidasa aislada de Bacillus cereus (Watanabe et al., 1997). 3 Las glicósido hidrolasas (GH) presentan tres clases de estructura tridimensional del sitio activo: bolsillo, túnel y hendidura (Davies and Henrissat, 1995) como se presenta en la figura 2. Figura 2. Tipos de estructura tridimensional del sitio activo de las glicósido hidrolasas. Tipo bolsillo (1). Tipo túnel (2). Tipo hendidura (3). (Davies and Henrissat, 1995). 4 2.1.2 Distribución y función de las α-Glucosidasas (α-GLC) en los seres vivos Las α-Glucosidasas (α-GLC) están presentes en una amplia gama de seres vivos como microorganismos, hongos, plantas y animales (Yamamoto et al., 2004). La especificidad por el sustrato y sus propiedades dependen en gran medida de la fuente donde ella haya sido obtenida (Kim et al., 2008). En humanos, las α-Glucosidasas (α-GLC) está presente en dos isoformas: EC 3.2.1.3 y EC 3.2.1.20, ambas codificadas por el gen GAA el cual se encuentra en el cromosoma 17q25. Se sintetiza como un precursor de 110 kDa (números de aminoácidos: 2-952, 29-952 y 68-952); su carácter es ácido (Yoshimizu et al., 2008). La función de estas enzimas es hidrolizar enlaces α 1,4 y 1,6 de oligo y disacáridos liberando como producto de su acción unidades de α-Dglucosa (Moreland et al., 2012; Zeng et al., 2012). La isoforma EC 3.2.1.3 de la α-Glucosidasa (α-GLC) está presente en todas las células del organismo realizando funciones propias de catabolismo, como la biosíntesis de glicoconjugados en los lisosomas (Kakavanos et al., 2006); mientras que la isoforma EC 3.2.1.20 está presente en las vellosidades del intestino delgado realizando funciones anabólicas, como la degradación de carbohidratos en la etapa final de la digestión; es una de las cuatro enzimas encargadas de la degradación completa del almidón (Łysek et al., 2006; Ferreira et al., 2010). En plantas, las α-Glucosidasas (α-GLC) se encargan de la degradación del almidón presente en las semillas en germinación; actúa de manera sinérgica junto con la α-amilasa en este proceso (Nakai et al., 2007). En insectos, las α-Glucosidasas (α-GLC) estan presentes en el tubo digestivo, secreciones salivares y glándulas hipofaringeas de estos animales, puesto que se alimentan de celulosa para llevar a cabo la digestión y sobrevivir; 5 están presentes en una iso-forma, como α-Glucosidasa II (α-GLC II) (Ghadamyari et al., 2010; Watanabe et al., 2013). En Bacterias y hongos, la función de las α-Glucosidasas (α-GLC) es esencial en el proceso de degradación de oligo y disacáridos (Figura 3) (Murray et al., 2004; Kurakata et al., 2008) y de esta manera obtienen energía para llevar a cabo sus funciones vitales (Lee et al., 2002). Figura 3. Esquema del sitio activo de la α-Glucosidasa (α-GLC) aislada de Saccharomyces cerevisiae frente a dos disacáridos conformados por (I) glucosa y manosa. (II) glucosa y galactosa. (Yao et al., 2003). 2.1.3 Clasificación de las α-Glucosidasas (α-GLC) Las α-Glucosidasas pueden ser clasificadas según el tipo de reacción hidrolítica que catalicen de acuerdo a la Unión Internacional de Bioquímica (UIB) (Sacher et al., 2009), su especificidad por el sustrato (Okuyama et al., 2005) y la secuencia de aminoácidos en su estructura primaria (Henrissat and Bairoch, 1993). A continuación, se describirán cada uno de estos criterios de clasificación. 6 2.1.3.1 Clasificación de las α-Glucosidasas (α-GLC) según la Unión Internacional de Bioquímica (UIB) El número de la comisión de enzimas (EC) para la α-Glucosidasa (α-GLC) se presenta a continuación (Motabar et al., 2009): EC 3. Hidrolasa EC 3.2. Glucósido hidrolasa EC 3.2.1.Capaz de hidrolizar enlaces - O y -S glicosídicos EC 3.2.1.20/3 α-Glucosidasa 2.1.3.1.1 Mecanismos de hidrolisis de las glicósido hidrolasas Las glicósido hidrolasas realizan su acción enzimática bajo dos mecanismos: inversión (figura 4) y retención (figura 5). + + O H O O R O O O H 10,5 A H - O O O CH2 O - O O H O O R H O HOR OH H O O O OH Figura 4. Mecanismo de Inversión. Estas enzimas utilizan dos residuos enzimáticos, normalmente residuos carboxílicos, que actúan como un ácido y una base respectivamente (Davies and Henrissat, 1995) 7 + + O O H O O O R 5,5 A O - O O O H O CH2 R O O + + HO O O O OH O - O O O H O CH2 O - O O H O O O O H H O Figura 5. Mecanismo de retención. Estas enzimas actúan mediante un mecanismo de dos etapas. Una vez más dos residuos se ven involucrados, uno actúa como nucleófilo y el otro como un ácido o base. En el primer paso el nucleófilo ataca en centro anómerico, dando como resultado la formación de una enzima glucosídica intermedia con un carácter ácido provisto por el carboxilato ácido. En el segundo paso el ahora desprotonado carboxilato ácido actúa como base y se une a una molécula de agua nucleofílica para hidrolizar la enzima intermedia, dando el producto hidrolizado (Davies and Henrissat, 1995). 8 2.1.3.2 Clasificación de las α-Glucosidasas (α-GLC) según su especificidad por el sustrato Las α-glucosidasas (α-GLC) se pueden clasificar en tres tipos de acuerdo a su especificidad por el sustrato como se muestra en la tabla 1. Tabla 1. Características de los tipos de α-Glucosidasa (α-GLC) según la especificidad por el sustrato (Okuyama et al., 2005). TIPO DE α-GLUCOSIDASA (α-GLC) ESPECIFICIDAD α-Glucosidasa I (α-GLC I) Hidroliza rápidamente sustratos heterogéneos como aril-glucósidos y carbohidratos como la sacarosa. α-Glucosidasa II (α-GLC II) Presenta una alta actividad enzimática de sustratos homogéneos como di y oligosacáridos. α-Glucosidasa III (α-GLC III) Su mayor actividad enzimática es observada al hidrolizar sustratos homogéneos como almidón soluble y glucógeno (polisacáridos). 2.1.3.3 Clasificación de las α-Glucosidasas (α-GLC) según la secuencia de aminoácidos en su estructura primaria Las glucósido hidrolasas (GH) estan clasificadas en 130 familias (Tagami et al., 2013) según su secuencia de aminoácidos en la estructura primaria (Henrissat and Bairoch, 1993); las α-Glucosidasas (α-GLC) estan distribuidas en las siguientes familias de GH: GH4, GH13, GH31, GH63 y GH97 (Ernst et al., 2006). Las familias GH13 y GH31 comprenden el mayor número de α-Glucosidasas, las cuales se pueden distinguir por su especificidad por el sustrato; la GH31 ha sido la más estudiada en términos de su estructura tridimensional y reconocimiento de sustratos además, de ser la familia más diversa ya que 9 está conformada por enzimas de los tres dominios de vida (animales, plantas y microorganismos) las cuales presentan un amplio rango de actividades hidrolíticas (Ernst et al., 2006). En la figura 6, se puede observar algunos tipos de estructura terciaria de las familias de glucósido hidrolasas. Figura 6. Estructura terciaria de algunas familias de glucósido hidrolasa (GH) (Davies and Henrissat, 1995). 10 2.1.4 Actividades biológicas asociadas con la inhibición de las αGlucosidasas (α-GLC) El estudio del mecanismo de inhibición de la α-Glucosidasa (α-GLC) es aplicable en el tratamiento de enfermedades en seres humanos (Ryu et al., 2009) y en el diseño de nuevo métodos para el control de plagas con el propósito de proteger los cultivos de importancia agronómica (Ramzi and Hosseininaveh, 2010). Las actividades biológicas asociadas con la inhibición de la α-Glucosidasa (α-GLC) se presentan en tabla 2. Tabla 2. Actividades biológicas relacionadas con la inhibición de la αGlucosidasa (α-GLC). ACTIVIDADES BIOLÓGICAS ASOCIADAS CON LA INHIBICIÓN DE LA α-GLUCOSIDASA (α-GLC) 2.1.4.1 ANTI-ALIMENTARIA EN ANIMALES HERBÍVOROS El mecanismo de inhibición de las α-Glucosidasas (α-GLC) en animales herbívoros es el primer paso para el diseño de un método de control de plagas en plantas de importancia agronómica. (Nimpiboon et al., 2011; Vatanparast et al., 2012). 2.1.4.2 ANTI-CÁNCER La capacidad de invasión y migración de las células cancerosas es debido a que los patrones de glicosilación se encuentran alterados. Las α-Glucosidasas (α-GLC) que participan en este proceso, constituyen un tratamiento eficaz de esta enfermedad; además reduce la progresión de las células tumorales en los procesos de metástasis (Sánchez and Cantalejo, 2010) 2.1.4.3 ANTI-HIPERGLICEMICA Los inhibidores de las α-Glucosidasas (α-GLC) retrasan la absorción de carbohidratos; tienen un papel en el estado pre-diabetico reduciendo la progresión de la diabetes (Liu et al., 2011) complicaciones vasculares crónicas (Shai et al., 2010) y la obesidad (Huang et al., 2011). 2.1.4.4 ANTI-VIRAL La inhibición de la α-Glucosidasa (α-GLC) tiene un profundo efecto en la estructura del glicano (Mehta et al., 1998) alterando los procesos de reconocimiento célula-célula o célula virus (Ryu et al., 2009; Moorthy et al., 2011). 2.1.4.5 ALMACENAMIENTO EXCESIVO DE GLICOCONJUGADOS Los inhibidores de la α-Glucosidasa, pueden comportarse como “chaperonas” porque corrigen anomalías en la estructura de la α-Glucosidasa (α-GLC), recuperando su estructura tridimensional y pueda ejercer su actividad enzimática (Sawkar et al., 2006). 11 2.1.5 Los inhibidores de las α-Glucosidasas (α-GLC) 2.1.5.1 Inhibidores de las α-Glucosidasas (α-GLC) con actividad farmacológica Existen tres tipos de inhibidores de esta enzima basados en su estructura química, generalmente hidroxilados: compuestos heterocíclicos N- sustituidos poli-hidroxilados (i), ciclo-alquenos poli-hidroxilados (ii) y oligómeros de pseudoazúcares (Kim et al., 2008). A nivel farmacológico, dentro de los inhibidores naturales de esta enzima, existen compuestos de origen bacteriano como la acarbosa, el miglitol y la Voglibosa (hemi-sintético) (Naik and Kokil, 2013); son ingredientes activos en medicamentos contra la diabetes tipo II (Liu et al., 2013). Las estructuras químicas de estos inhibidores, se presenta en la figura 7. OH H3C HN HO HO OH N OH O HO HO O OH Acarbosa HO HO OH O HO OH OH OH O OH O OH OH HO OH HO Miglitol HO OH NH Voglibosa CH3 CH3 Figura 7. Estructuras químicas de los inhibidores de las α-Glucosidasas (αGLC) de origen bacteriano (Narender et al., 2013). Acarbosa, oligómero de pseudoazúcar (1). Voglibosa, amina poli-hidroxilada heterocíclico N-sustituido poli-hidroxilado (3). 12 (2). Miglitol, Actualmente, los medicamentos procedentes de plantas que actúan bajo del mecanismo de inhibición de las α-Glucosidasas (α-GLC) son muy pocos; los metabolitos secundarios medicamentos, que son ingredientes activos en dichos se les han realizado modificaciones hemi-sintéticas como tri-terpénos que han sido hibridados, la α-amirina, el lupeol y la niacina Nalílicas/ N-alquílicas (Narender et al., 2013). 2.5.1.2 Inhibidores de las α-Glucosidasas (α-GLC) con actividad antialimentaria Dentro de los métodos de control de plagas de origen botánico, el único bioplaguicida cuyo mecanismo de acción sea la inhibición de enzimas digestivas y que se usa para proteger los cultivos de importancia agronómica es la Azadiractina (Celis et al., 2008). La Azadiractina (figura 8) es un tetra-terpenoide característico de la familia Meliaceae especialmente del árbol Neem (Azadirachta indica). Este compuesto se encuentra en la corteza, hojas, frutos y, principalmente, en la semilla del árbol. Se han identificado alrededor de 18 compuestos, entre los que se destaca azadiractina, que se encuentra en mayor concentración. Muestra acción anti-alimentaria, reguladora del crecimiento, inhibidora de la oviposición y esterilizante. Actualmente, se pueden encontrar formulaciones comerciales como Neem Gold, Neemazal, Econeem, Neemark, Neemcure y Azatin, entre otros (Celis et al., 2008). Además de los tri-terpenoides, otros metabolitos secundarios tambien presentan actividad anti-alimentaria como las isoflavonoides y terpenoides (figura 9)(Simmonds, 2006). 13 furanocumarinas, H3C O MeO2C O OH O O H3C H H AcO MeO2C O O HO OH H O Azadiractina Figura 8. Estructura química de la Azadiractina (tri-terpenoide) componente activo de bioplagacidas (Raizada et al., 2001). H O H O OCH3 O HO H H O O O Faseolina O H O O O H H Xantotoxina H H OAc OCOCHMe2 H Jodrellin B H Figura 9. Metabolitos secundarios con actividad anti-alimentaria (Simmonds, 2006). 14 2.1.5.3 Inhibidores de la α-Glucosidasa (α-GLC) de origen natural y de origen sintético reportados en ola literatura A continuación se presentan en las tablas 3, 4 y 5 algunos los inhibidores de la α-Glucosidasa (α-GLC) de origen natural y de origen sintético reportados en la literatura hasta el momento. Tabla 3. Lista de algunos inhibidores de la α-Glucosidasa (α-GLC) de origen botánico. Las especies resaltadas en color verde presentan actividad antialimentaria. ESPECIE FITO-COMPUESTO O METABOLITO SECUNDARIO REFERENCIA Acer rubrum Galo-taninos (Wan et al., 2012) Aegle marmelos Fenil-etil-cinamidas (Phuwapraisirisan et al., 2008) Aesculus hippocasteneum Terpenoide Ajuga sp Terpenoide Ammi majus Furanocumarinas Azadirachta indica Terpenoide Citrus bergamia Furanocumarinas Corchorus olitorius Poli-fenoles (Oboh et al., 2012) Garcinia nobilis Xantonas (Fouotsa et al., 2012) Glinus opositifolius Saponina tri-terpénica (Kumar et al., 2013) Grateloupia elliptica 2,4-di-bromofenol 2,4,6-tri-bromofenol (Kim et al., 2008) 15 (Simmonds, 2006) Gypsophila oldhamiana Saponinas tri-terpénicas (Luo et al., 2008) Hedychium spicatum (Ham. Ex Smith) Di-terpenos (Prabhakar Reddy et al., 2009) Panax japonicus C. A. Meyer var. Major Poli-acetilénos (Chan et al., 2010) Phaseolus vulgaris Isoflavonoide (Simmonds, 2006) Ácido cafeico Ácido ferulico Catequinas Epi-catequinas Proantocianidinas, Taxifolina (Naik and Kokil, 2013) Rhus verniciflua Stokes Flavonoides (Kim et al., 2010) Salacia hainanensis Chun et How Tri-terpenos (Huang et al., 2012) Terpenoides (Simmonds, 2006) Pinus pinaster Scutellaria sp Scutellaria woronowii (Juss) Tabla 4. Inhibidores de las α-Glucosidasa (α-GLC) de origen bacteriano. ESPECIE METABOLITO SECUNDARIO Actinoplanes sp Acarbosa Streptomyces hydroscopicus Voglibosa Streptomyces sp Bacillus sp Miglitol 16 REFERENCIA (Naik and Kokil, 2013) Tabla 5. Lista de algunos inhibidores de la α-Glucosidasa (α-GLC) de origen sintético. COMPUESTO REFERENCIA Análogos N-2-sustituidos-5(p-Toluenesulfonylamino)-ftalimida (Bian et al., 2013) Compuestos derivados de β-acetamido carbonilos (Tiwari et al., 2008) Compuestos derivados de andrografólidos (Xu et al., 2007) Compuestos derivados de benzopiranos (Wang et al., 2010) Compuestos derivados de la Cromenona (Shen et al., 2010), (Raju et al., 2010) Derivados de N-fenil-carboxamida (Alves et al., 2011) Derivados de los triazoles (Ferreira et al., 2010) Derivados N-substituidos: valienamina y conduramina F-1 (Łysek et al., 2006), (Cumpstey et al., 2011) Imino-azúcares de la pirrolidina (Trapero and Llebaria, 2012) Imino-ciclitoles de cinco miembros (Guerreiro et al., 2013), (Trapero and Llebaria, 2012) Prolinas glicosidadas (Pandey et al., 2007) Sales sulfonio de tioazúcares, neosalaprinol y neoponkoranol (Xie et al., 2011) 2.1.6 Los métodos para la evaluación de la actividad inhibitoria de la α-Glucosidasa (α-GLC) in vitro en extractos vegetales Existen varios métodos para cuantificar la actividad catalítica de una enzima como los métodos fotométricos y los métodos fluorimétricos (Rahman et al., 2005); sin embargo, los métodos fotométricos son los más utilizados para este propósito (Glatz, 2006). El método fluorimétrico es mucho más sensible que el método espectrofotométrico, ya que son más específicos al tener que utilizar dos 17 longitudes de onda en lugar de una, pero pueden sufrir más interferencias por impurezas presentes en el medio o por la inestabilidad que muchos compuestos fluorescen al ser expuestos a la luz; por esta razón, no se recomienda evaluar matrices complejas como los extractos vegetales por el método fluorimétrico (Glatz, 2006). Es importante destacar que recientemente, se están desarrollando estudios para encontrar inhibidores de la α-Glucosidasa (α-GLC) en extractos vegetales por Resonancia Magnética Nuclear (RMN) comparando las señales en los espectros DOSY de la enzima, la enzima y un inhibidor con actividad biológica comprobada y de la cual se conoce el mecanismo de acción; y la enzima junto al extracto crudo (Shang et al., 2012). El cribado de inhibidores de la α-Glucosidasa (α-GLC) se ha convertido en el gran atractivo para los científicos a través de RMN debido a su capacidad única para proporcionar información sobre la aspectos estructurales, termodinámicos, y cinéticos de la interacción entre los inhibidores y los residuos de aminoácido de la enzima (Shang et al., 2012). 2.1.6.1 Fundamento del método fotométrico para la evaluación de la actividad inhibitoria de la α-Glucosidasa (α-G) in vitro El método por el cual se propone la evaluación de la actividad inhibitoria αGlucosidasa (α-GLC) en extractos vegetales, consiste en la hidrolisis enzimática del sustrato de origen sintético, p-Nitrofenil-α-D- glucopiranósido (p-NFGP) que por acción de la α-Glucosidasa (α-GLC), libera unidades de p-nitrofenolato y α-D-glucosa (Cihan et al., 2010; Damsud et al., 2013) como se presenta en la figura 10. El ión p-nitrofenolato presenta una coloración amarillo claro que evidencia que la reacción de hidrólisis enzimática se ha llevado a cabo; sin embargo, en ocasiones no se observa claramente (Oh and Kang, 2004). Varios autores 18 proponen que para intensificar el color, se debe adicionar una solución básica (Dingee and Anton, 2010) con el objetivo de generar un ambiente denso en electrones para que el anión p- nitrofenolato entre en resonancia y se estabilice (Adams and Langley, 1998) como se muestra en la figura 11, teniendo en cuenta que toda la concentración sustrato (p-NFGP) ha reaccionado con la enzima y no se presenten falsos-positivos en los resultados debido que el sustrato p-NFGP es susceptible de reaccionar frente a una hidrólisis básica. OH HO HO O O OH + N O + H O H - O p-Nitrofenil-a-D-glucopiranósido a-Glucosidasa OH HO HO O - O OH a-D-Glucosa + O N + - O OH Ión p-nitrofenolato Figura 10. Hidrólisis enzimática del p-Nitrofenil-α-D-glucopiranósido (pNFGP) por acción de la α-Glucosidasa (α-GLC) liberando unidades de pnitrofenolato y a-D-glucosa. Adaptado de (Cihan et al., 2010; Guo et al., 2010). 19 - O O O + - N + N - ++ N - O O O O O O O - O N - O Ión p-Nitrofenolato (405 nm) Figura 11. Estructuras de resonancia del ión p-nitrofenolato en medio básico (Adams and Langley, 1998). 2.1.6.2 Sustratos utilizados en el estudio de la actividad enzimática glucósido hidrolasas (GH) Los sustratos recomendados para estudiar la actividad catalítica de las glucósido hidrolasas son los glicosidos de mono y di-nitro-fenoles, debido a que los compuestos liberados como producto de la hidrólisis enzimática, presentan compuestos nitro-fenólicos fácilmente detectables por su coloración (Dingee and Anton, 2010). La estructura química de este tipo de sustratos son específicas para cada tipo de glucósido hidrolasa estudiada (Dingee and Anton, 2010); el sustrato indicado para la α-Glucosidasa (α-GLC) es el p-nitrofenil-α-D-glucopiranósido (p-NFGP). La aglicona nitro-fenólica del p-NFGP, imita a una unidad de monosacárido, la cual encaja en el sitio activo de la α-GLC y no interfiere en el mecanismo catalítico de hidrólisis enzimática (Dingee and Anton, 2010). 20 2.2 VARIABLES DE LA CINÉTICA DE UNA ENZIMA Cualquier reacción catalizada por enzimas puede ser escrita como la ecuación 1 (Figura 12): Sustrato Enzima Producto (Ecuación 1) Figura 12. Ecuación general de una reacción catalizada por enzimas (Segel, 1976). Las reacciones químicas catalizadas por enzimas donde se involucra un solo sustrato, se describen como la siguiente ecuación 2 (Figura 13); la αGlucosidasa (α-GLC) sólo requiere un solo sustrato (Guo et al., 2010). E+S Figura 13. Ecuación de → ← ES → E + P (Ecuación 2) una reacción catalizada por enzimas donde sólo participa un sustrato (Kargi, 2009). Donde E es la enzima, S es el sustrato, ES es el complejo enzima-sustrato y P es el producto. La reacción enzimática transcurre en dos etapas: en la primera etapa, la enzima se enlaza al sustrato con el propósito de formar el complejo enzima sustrato la cual es una reacción reversible; mientras que en la segunda etapa, el sustrato se ha transformado en producto y la enzima permanece sin ninguna modificación durante el ciclo catalítico (Kargi, 2009). Dentro de los parámetros cinéticos que se conocen para definir las propiedades de las enzimas son la constante de Michaelis Menten y la velocidad máxima (Vm), las cuales se relacionan gráficamente como se presenta en la figura 14 (Fromm and Hargrove, 2012). 21 Figura 14. Relación gráfica de la constante de Michaelis-Menten y la velocidad máxima (Vm) (Fromm and Hargrove, 2012). La constante de Michaelis Menten se define como la concentración de sustrato a la cual se obtiene la mitad de la velocidad máxima (Vm). El Valor de Km nos da una idea la afinidad que tiene el enzima por su sustrato, cuanto mayor es Km, menor es la afinidad (predominan las formas E y S libres); cuanto menor es Km, mayor es la afinidad (predomina la forma ES) (Fromm and Hargrove, 2012). La velocidad máxima (Vm) se define como la velocidad cuando todo el enzima se encuentra unido al sustrato, es decir, estima el número de centros activos del enzima (Fromm and Hargrove, 2012). De acuerdo a la figura 14, se puede observar que a bajas concentraciones de sustrato, la velocidad de reacción inicial (1/2 Vm) es proporcional al valor de Km, la cual es un valor específico de concentración del sustrato donde la reacción es de primer orden con respecto al sustrato (Rahman et al., 2005). Si la concentración de sustrato aumenta, la velocidad de reacción se convierte esencialmente independiente de la concentración de sustrato y se aproxima una velocidad constante; esto significa que en este rango de valores la reacción es de orden 0, dado que la enzima se encuentra saturada (Rahman et al., 2005). Para hallar los valores de Km y V máxima, se puede utilizar la expresión gráfica de Lineweaver-Burke la cual es 22 útil para proveer información importante acerca de la cinética de las enzimas (Rahman et al., 2005) como se observa en la figura 15. Figura 15. Expresión gráfica de Lineweaver-Burke (Fromm and Hargrove, 2012) 2.3 ZONAS DE ESTUDIO La variación en el relieve, los climas y los suelos de la Ecorregión Cafetera Colombiana generan una diversidad de ecosistemas o tipos de vegetación tales como: bosques secos y humedales en los valles, bosques andinos en la zona cafetera, bosques alto-andino y páramos en las partes altas de las cordilleras; la ECC es muy diversa en especies de animales y plantas incluyendo especies endémicas (Guevara et al., 2009). 2.3.1 Reserva Natural Bremen-La Popa (RNB-LP) La Reserva Natural Bremen-La Popa (RNB-LP) forma parte de la Estrella fluvial del Quindío la cual fue establecida, junto con otras fincas en un plan 23 de adquisición realizado por la Corporación Regional del Quindío (CRQ) en 1968 para la protección de cuencas hidrográficas y bosques naturales (Corporación Regional del Quindío et al., 2002; Nieto and Londoño, 2006). La RNB-LP se ubica en el Municipio de Filandia, Departamento del Quindío, tiene 747 hectáreas; 450 hectáreas están sembradas en plantaciones coníferas (pino pátula y ciprés) que están siendo aprovechadas para dejar en regeneración y de las cuales quedan 15 hectáreas, mientras que 230 hectáreas corresponden a bosque nativo (Nieto and Londoño, 2006; Echeverri et al., 2007). La RNB-LP es el atractivo natural de gran importancia para el municipio de Filandia, su gran diversidad biológica en cuanto a flora se expresa en 143 especies de árboles y 7 especies de bejucos (Echeverri et al., 2007). 2.3.2 Parque Regional Natural Ucumarí (PRNU) El Parque Regional Natural Ucumarí (PRNU) se fundó 1984 por el Concejo Municipal de Pereira y actualmente, se encuentra a cargo de la Corporación Autónoma Regional del Risaralda (Galeano and Bernal, 1993). El PRNU se ubica en el departamento de Risaralda, en la zona de amortiguación del Parque Nacional Los Nevados en un rango altitudinal entre 1850 y 2600 msnm (Galeano and Bernal, 1993); consta de 3986 hectáreas localizadas en la vertiente occidental de la Cordillera Central (Guevara, 1999). La flora del PRNU es relativamente rica, se han encontrado aproximadamente 598 especies pertenecientes a 113 familias de plantas superiores (Galeano and Bernal, 1993); El PRNU es considerado un ecosistema estratégico debido a su gran biodiversidad de especies de plantas y animales (Guevara, 1999). 24 2.3.3 Familias de plantas de estudio Este estudio se realizó con 36 especies de plantas recolectadas en la Reserva Natural Bremen-La Popa (RNB-LP) y el Parque Regional Natural Ucumarí (PRNU) las cuales se caracterizan por presentar diferentes tipos de actividades biológicas o por demostrar cierto carácter medicinal. Las plantas de estudio pertenecen a las siguientes familias botánicas: Annonaceae, Apocynaceae, Costaceae, Euphorbiaceae, Asclepiadaceae, Lamiaceae, Asteraceae, Clusiaceae, Lauraceae, Malvaceae, Melastomataceae, Passifloraceae, Piperaceae, Solanaceae y Urticaceae. A continuación, se describirá brevemente su ubicación geográfica en el mundo y en Colombia, el tipo de metabolitos secundarios presentes en ellos (Fitoquímica) y su situación en la RNB-LP y el PRNU. 2.3.3.1 Familia Annonaceae Es un conjunto de plantas muy conocido en medicina popular. Comprende alrededor de 120 géneros y 2100 especies en el mundo (Trease, 2009). En Colombia, su conocimiento es escaso y sólo existen 72 especies distribuidas en 17 géneros (Murillo, 2001); en el PRNU existen dos especies: Guatteria sp y Rollinia sp (CARDER, 2012 ). La RNB-LP se destaca por la presencia de especies del género Cynanchum sp y Guatteria sp. Los metabolitos secundarios ampliamente encontrados en esta familia son los alcaloides del tipo isoquinolina (Trease, 2009). 25 2.3.3.2 Familia Apocynaceae Las plantas de la familia Apocynaceae está estrechamente vinculada con la familia Asclepiadaceae. Comprende 250 géneros y 2000 especies alrededor del mundo, específicamente en los trópicos y sub-trópicos (Trease, 2009). En el PRNU hay una especie correspondiente al género Mandevilla sp (CARDER, 2012 ), mientras que en la RNB-LP se destaca por la presencia de especies del género Oxypetalum sp. Los metabolitos secundarios reportados en la familia Apocynaceae son: glucósidos cianogénicos, leucoantocianinas, saponinas, taninos, cumarinas, ácidos fenólicos, ciclitoles, tri-terpenoides, alcaloides esteroidales en el género Hollarhena, alcaloides del tipo harmano en los géneros Amsonia y Aspidosperma (Trease, 2009). 2.3.3.3 Familia Asclepiadaceae Las plantas de la familia Asclepiadaceae se ubican en zonas tropicales, comprende 172 géneros y 3000 especies (Jürgens et al., 2008). Estudios filogenéticos han demostrado que la familia Asclepiadaceae pertenece a la familia Apocynaceae (Heneidak et al., 2006). En el PRNU únicamente se encuentra la especie Orthosia stenophylla (CARDER, 2012 ), mientras que la RNB-LP se encuentran especies del género Blepharodon sp. Los fitocompuestos de mayor importancia en esta familia son: los alcaloides del indol, fenantrohidro-indolizidina y del tipo piridina; cardenólidos; glucósidos cianogénicos, saponinas, taninos y ciclitoles (Trease, 2009). 26 2.3.3.4 Familia Asteraceae La familia Asteraceae está conformada por 1500 géneros y 23000 especies con distribución cosmopolita agrupadas en 3 subfamilias y 17 tribus (Zavada and Lowrey, 2010) constituyendo, la mayor familia de plantas con flores incluyendo dos grupos monofiléticos de tamaño notablemente desigual (Gruenstaeudl et al., 2009). En Colombia hay 236 géneros y 1435 especies (Rangel, 2006); PRNU hay 24 especies de esta familia (CARDER, 2012 ) mientras que la RNB-LP se encuentran plantas del género Clivadium sp, Tilesia sp y Verbesina sp. Los metabolitos secundarios encontrados en la familia Asteraceae y sus subfamilias son: flavonoles, flavonas y especialmente, flavonoides (Emerenciano et al., 2001). 2.3.3.5 Familia Clusiaceae Las plantas de la familia Clusiaceae se encuentran ampliamente distribuidas en la zona tropical de Asia, África, Nueva Caledonia y Polinesia (Lavaud et al., 2012). Esta familia consta de 40 géneros y 1200 especies en el mundo (Marti et al., 2009). En Colombia existen 20 géneros (Galeano and Bernal, 1993); en el PRNU existen 5 especies (CARDER, 2012 ) mientras que en la RNB-LP hay una especie del género Clusia sp. Esta familia se caracteriza por sintetizar compuestos poli-fenólicos (Lavaud et al., 2012). 2.3.3.6 Familia Costaceae Esta familia se conoce comúnmente como “Jengibre espiral”; es originaria de África y contiene 4 géneros, de los cuales Costus tiene el mayor número de especies (Kay et al., 2005) y 130 de ellas están distribuidas en las 27 regiones tropicales . En Colombia hay 35 especies (Salinas et al., 2007).Se caracteriza por la presencia de saponinas, flavonoides, esteroides y alcaloides (Britto et al., 2011 ). 2.3.3.7 Familia Euphorbiaceae La familia Euphorbiaceae cuenta con especies de importancia económica por estar conformada por plantas productoras de aceites (Ricinus), látex (Hevea, Mabea, Sapium), almidón (Manihot), madera (Hura, Hyeronima) y especies ornamentales (Euphorbia plucherrima) . Comprende 300 géneros y 6000 especies alrededor del mundo. En Colombia existen 75 géneros y 438 especies (Rangel, 2006); en el PRNU hay 10 especies (CARDER, 2012 ) mientras que la RNB-LP se caracteriza por especies del género Hyeronima sp y Croton sp. Los metabolitos secundarios encontrados en esta familia son antraquinonas, tri-terpenos, ácidos grasos epoxidados, ácidos grasos insaturados y agentes antitumorales; alcaloides del tropano, indol, quinolina, piridina y aporfina (Trease, 2009). 2.3.3.8 Familia Lamiaceae Es una familia de plantas altamente desarrollada. Dada la variabilidad de la estructura de sus miembros, es difícil establecer un procedimiento para clasificarlas. Se le atribuyen aproximadamente 220 géneros y 4000 especies en el mundo pero se encuentra mejor representada en la región del Mediterráneo y Asia. En Colombia, hay unas 110 especies; el género Hyptis cuenta con 44 especies de hierbas y arbustos; y Salvia con 85 taxones reconocidos (Fernández, 2010); El PRNU contiene 9 especies (CARDER, 2012 ), mientras que la RNB-LP presenta especies del género Aegiphila sp. Los metabolitos secundarios encontrados normalmente en esta familia son los 28 terpenoides, especialmente los del tipo sesqui, di y tri terpénos; además de varios tipos de compuestos fenólicos, especialmente ácidos fenólicos, como el ácido rosmarínico y flavonoides (Wink, 2003). 2.3.3.9 Familia Lauraceae La familia Lauraceae está conformada por 52 géneros y 3000 especies, la mayoría se encuentran en regiones tropicales y subtropicales cálidas (Takaku et al., 2007); en el PRNU existen 6 especies (CARDER, 2012 ), mientras que en la RNB-LP hay especies del género Aniba sp, Ocotea sp y Persea sp. Los fito-compuestos que se encuentran en esta familia son alcaloides de la aporfina y bencil-isoquinolina, lignanos del tipo furofurano y di-hidro-benzo-furanos (Coy and Cuca, 2008); además de neo-lignanos biciclo [3.2.1] octánicos (Coy et al., 2009), aceites volátiles, aceites fijos y flavonoides glucosidados (Trease, 2009). 2.3.3.10 Familia Malvaceae Las plantas de la familia Malvaceae comprende 250 géneros y 4230 especies que están distribuidas en todo el mundo. Particularmente, son muy abundantes en las zonas tropicales de Sur (Oliveira da Silva et al., 2010) . En Colombia hay 140 especies (Galeano and Bernal, 1993); en el PRNU existen 2 especies: Pavonia pseudotyphalaea Linden & planchon y Sida rhombifolia L (CARDER, 2012 ). Los metabolitos secundarios encontrados en esta familia son ácidos polifenólicos, flavonoides y antocianinas (Chen et al., 2003). 29 2.3.3.11 Familia Melastomataceae Esta familia es una de las más abundantes y biodiversas en los trópicos, pero sus relaciones intrafamiliares y la evolución morfológica son poco conocidas. Comprende entre 150 - 166 géneros y 4570 especies (Clausing and Renner, 2001). En Colombia existen 68 géneros y 974 especies (Rangel, 2006); en el PRNU existen 31 especies (Galeano and Bernal, 1993). La fitoquímica de la familia Melastomataceae es poco conocida; sin embargo, los metabolitos secundarios encontrados comúnmente son los taninos hidrolizables y condensados (Yoshida et al., 2008). 2.3.3.12 Familia Passifloraceae Las plantas de la familia Passifloraceae son muy conocidas en los bosques tropicales de América del sur (Matsui et al., 2010). Comprende 12 géneros y 600 especies (Trease, 2009) alrededor del planeta. En Colombia hay 2 géneros (Galeano and Bernal, 1993) y 167 especies, siendo el género Passiflora el más importante con 162 especies (Pérez et al., 2007); en el PRNU existen 7 especies (CARDER, 2012 ) y en la RNB-LP hay especies del género Passiflora sp. Los fito-constituyentes de esta familia son: flavonoides, trazas de glucósidos cianogénicos, aceites volátiles y alcaloides del tipo harmano (Trease, 2009) 2.3.3.13 Familia Piperaceae La familia Piperaceae es fuente de muchos fito-compuestos biológicamente activos, con un gran potencial en medicina y agricultura (Scott et al., 2005); esta familia está conformada por 4000 especies (López et al., 2010). 30 Colombia posee 7 géneros y 604 especies (Rangel, 2006); el PRNU tiene 23 especies (CARDER, 2012 ). Los metabolitos secundarios encontrados en esta familia son: ésteres y éteres fenólicos, alcaloides del tipo pirrolidina, aceites volátiles y lignanos (Trease, 2009). 2.3.3.14 Familia Solanaceae Las plantas de la familia Solanaceae son de gran importancia económica en las industrias farmacéutica y de alimentos. Comprende alrededor de 96 géneros y 3000 especies. En Colombia hay 42 géneros y 402 especies (Rangel, 2006); el PRNU existen 39 especies (CARDER, 2012 ) y en la RNBLP hay especies del género Solanum sp. Las plantas de esta familia producen una amplia variedad de metabolitos segundarios como alcaloides del tropano, piridina y alcaloides esteroidales, witanolidos, ecdi-esteroides, sesquiterpénos, di-terpénos y antraquinonas (Wink, 2003). 2.3.3.15 Familia Urticaceae Comprende 45 géneros y 550 especies distribuidas en regiones tropicales y subtropicales alrededor del mundo (Vargas, 2002). En Colombia existen 100 especies (Galeano and Bernal, 1993); en el PRNU 13 especies (CARDER, 2012 ). Los metabolitos secundarios reportados en esta familia son: alcaloides fenantro-quinolizidínicos, antraquinonas, flavonoides y terpenoides (Cai et al., 2006). Son utilizadas en medicina natural en combinación con otras especies para el tratamiento de la hiperplasia benigna de la próstata (Trease, 2009). 31 3.JUSTIFICACIÓN Varios estudios ampliamente citados, han estimado que los daños económicos y ambientales causados por especies invasoras en cultivos agrícolas en Estados Unidos tienen un costo entre 97 US$ - 137 US$ millones y en el resto del mundo puede tener un estimativo de 1.5 US$ billones de dólares por año (Abhilash and Singh, 2009); además de que el uso de los pesticidas es de dos millones de toneladas anuales. En Colombia se usan aproximadamente 40.000 toneladas anuales por un valor de 23.000 millones de pesos (Jaramillo et al., 2007). Las compañías farmacéuticas y grupos de investigación enfocados en el campo de la biotecnología, están tratando de reformar el paradigma del cribado aleatorio a un diseño racional que considere el uso de los compuestos de origen natural, los cuales son un modelo probado para el descubrimiento y desarrollo de nuevos fármacos, agroquímicos, cosméticos, compuestos químicos puros, nutracéuticos (McChesney et al., 2007). Los Botánicos estiman que el número de plantas superiores en el planeta puede estar entre 300.000 y 320.000 especies; sólo un porcentaje muy pequeño de estas ha sido investigado por las propiedades de sus fitoconstituyentes; es una fuente que no ha sido explorada y aprovechada lo suficiente (Powell, 2009). Esto puede demostrarse con los porcentajes de ingredientes activos en plaguicidas aprobados por la EPA (Enviromental Protection Agency) desde el año 1997 al 2010 como se muestra en la tabla 6. 32 Tabla 6. Ingredientes activos de plaguicidas y bioplaguicidas aprobados por la EPA (Enviromental Protection Agency) desde 1997 al 2010 DESCRIPCIÓN DEL TIPO DE FUENTE PORCENTAJE Compuestos sintéticos 78% Compuestos naturales con modificaciones hemi-sintéticas 15% Compuestos de origen microbiano 1% Compuestos de origen natural 6% Como se observa en la tabla 6, es evidente que el uso de los pesticidas de origen sintético predomina como un producto de alto impacto para los agricultores. Las plantas son fuente de fito-compuestos variables estructuralmente con un amplio rango de actividades biológicas, que podrían ser útiles para el desarrollo de una terapia alternativa o adyuvante de muchas enfermedades (Zhang et al., 2013), pero también es fuente de biocompuestos con aplicación en el área de la agricultura en la búsqueda de metabolitos con posible actividad anti-alimentaria (Vatanparast et al., 2012) La inhibición de la α-Glucosidasa (α-GLC) está asociada a diferentes actividades biológicas como anti-alimentaria en animales herbívoros (Vatanparast et al., 2012), anti-cáncer y anti-metásica (Borges de Melo et al., 2006), anti-hiperglicemica (Ha et al., 2012) y anti-viral (VIH) (Moorthy et al., 2011); convirtiéndose en objeto de investigación por abarcar distintas areas a nivel farmacológico y a nivel ambiental. Teniendo en cuenta la biodiversidad de plantas de la Ecorregión Cafetera Colombiana (Guevara et al., 2009) y la abundancia de metabolitos secundarios y fito-compuestos (Niño et al., 2002; Niño et al., 2003), se propone investigar las condiciones experimentales del método fotométrico para la evaluación de la actividad inhibitoria α-Glucosidasa (α-GLC) in vitro en extractos vegetales con el objetivo de evaluar dichos extractos y 33 encontrar fito-compuestos que puedan convertirse en una posible alternativa que pueda ser utilizado en un biopreparado para el control de plagas basado en este mecanismo de inhibición. Este estudio ampliaría el conocimiento de la flora de la Ecorregión Cafetera Colombiana. 34 4. OBJETIVOS 4.1 OBJETIVO GENERAL Definir las condiciones experimentales del método fotométrico para la evaluación de la actividad inhibitoria α-glucosidasa (α-GLC) in vitro en extractos vegetales. 4.2 OBJETIVOS ESPECÍFICOS Obtener los extractos de n-hexano, diclorometano y metanol de 36 especies de plantas seleccionadas de las familias: Annonaceae, Apocynaceae, Asclepiadaceae, Asteraceae, Clusiaceae, Costaceae, Euphorbiaceae, Lamiaceae, Lauraceae, Malvaceae, Melastomataceae, Passifloraceae, Piperaceae, Solanaceae y Urticaceae de la Ecorregión Cafetera Colombiana. Caracterizar los metabolitos secundarios seleccionados presentes en los extractos crudos de n-hexano, diclorometano y metanol por Cromatografía de Capa Delgada (CCD). Proponer las condiciones experimentales del método espectrofotométrico para evaluar la actividad inhibitoria de la αGlucosidasa (α-GLC) in vitro en extractos vegetales. 35 SECCIÓN EXPERIMENTAL 5.1 MATERIALES 5.1.1 Equipos y reactivos Los solventes orgánicos empleados fueron de grado analítico: acetato de etilo, diclorometano, iso-propanol, n-hexano y metanol analítico, marca Mallinckrodt; con excepción de los solventes utilizados en la obtención de los extractos crudos, los cuales fueron de grado comercial, marca Carlo Erba. En la obtención de los extractos se utilizó un rotaevaporador Heidolph Laborata 4000 (Alemania). En la Caracterización Fitoquímica por Cromatografía de Capa Delgada (CCD), los reactivos empleados para la preparación de los reveladores y patrones utilizados fueron de las marcas Merck y Sigma-Aldrich. Las cromatoplacas utilizadas fueron de sílica gel 60 F254 20x20 cm, Merck (Alemania) y una lámpara ultravioleta Elma LC-30H (Alemania). 5.1.2 Material vegetal En la tabla 7, se presentan los nombres científicos de las plantas recolectadas en la Reserva Natural Bremen-La Popa (RNB-LP) y el Parque Regional Natural Ucumari (PRNU) y junto con su voucher de identificación (Código del Herbario de la Universidad de Antioquia, FJR). 36 5.2 MÉTODOS 5.2.1 Obtención de los extractos crudos La extracción del material vegetal se realizó mediante maceración pasiva con los solventes n-hexano, diclorometano y metanol, respectivamente, siguiendo la metodología descrita por Niño et al., (2007) como se presenta en el anexo 1. La mayoría de los extractos ya habían sido obtenidos por trabajos previos. Tabla 7. Nombres científicos de las especies de plantas estudiadas en el proyecto. Familia Especies N UTP FJR Annonaceae Guatteria petiolata 198 4052 Apocynaceae Mandevilla veraguensis 200 4054 Asclepiadaceae Blepharodon grandifolium 201 4055 Calea angosturana 95 4046 Clivadium asperum 191 4045 Clivadium funkise 89 3909 Asteraceae Clusiaceae Costaceae Euphorbiaceae Lamiaceae Lauraceae Munnzonia hastifolia 190 4044 Pentacalia americana 96 3916 Chrysoclamys floribunda 180 4035 Vismia laevis 184 4039 Costus sp 187 4029 Acalypha diversifolia 62 3726 Acalypha macrostachya 196 4050 Alchornea grandis 202 4056 Hyeronima antioquiensis 85 3905 Hyeronima Macrocarpa Müll 104 3925 Mavea montana 92 3912 Salvia scutellarioides 186 4041 Ocotea insulares 176 4031 Ocotea paulii 179 4034 Nectandra acutifolia 177 4032 Nectandra lineatifolia 178 4033 37 Malvaceae Melastomataceae Passifloraceae Piperaceae Solanaceae Urticaceae 5.2.2 Pavonea septioides 181 4036 Miconia sp 73 3739 Tibouchina lepidota 185 4040 Passiflora danielii 182 4037 Passiflora rubra 183 4038 Piper calceolarium 194 4048 Piper crassinervium 175 4030 Piper danielli-gonzalezii 197 4051 Browalia speciosa 171 4025 Deprea glabra 170 4024 Solanum brevifolium 174 4028 Solanum sp 189 4043 Solanum trachycyphum 188 4042 Phenax uliginosus 143 3990 Caracterización fitoquímica por cromatografía de capa delgada (CCD) Los extractos crudos plantas poseen una mezcla compleja de fitocompuestos que proceden de su metabolismo primario y secundario (Trease, 2009) por lo tanto, en la caracterización de los núcleos fitoquímicos, es importante encontrar un sistema de solventes que permita una buena separación de los fito-componentes ya que de esto depende su detección. Los sistemas de solventes utilizados para la elución de los tres tipos extractos estudiados, fueron encontrados siguiendo la metodología descrita previamente por Jaramillo, (1987), los cuales se muestran en la tabla 8. 38 Tabla 8. Sistemas de elución utilizados en la caracterización fitoquímica por CCD. Extracto Sistema de elución Polaridad del sistema (P’) n-Hexano n-Hexano-Acetato de etilo (77:23) 0.989 Diclorometano Cloroformo -Acetato de etilo-Isopropanol (82:17:1) 4.382 Metanol Cloroformo-Acetato de etilo- Isopropanol (90:7:3) 4.392 Con el propósito de caracterizar los metabolitos secundarios presentes en los extractos (n-hexano, diclorometano y metanol) de las 36 plantas que estudiaron en este proyecto, se realizó la marcha fitoquímica por cromatografía de capa delgada (CCD) siguiendo la metodología descrita por (Wagner and Bladt, 1996) como se muestra en el anexo 2, usando criterio de detección, la formación de manchas las cuales se compararon con patrones cuando estas fueron reveladas con un reactivo químico adecuado para cada tipo de núcleo estudiado. La presencia o ausencia del fito-compuesto analizado, se determinó mediante la observación de una coloración o fluorescencia, a la luz del día o haciendo uso de la lámpara ultravioleta (λ=240 nm y λ=360 nm). Por ejemplo, para la detección de cumarinas y quinonas se usó como revelador químico KOH al 5% en etanol absoluto, seguido de la observación en luz ultravioleta a 360 nm; la 7-hidroxicumarina como patrón de cumarinas y de antraquinona como patrón de quinonas. Los metabolitos secundarios, los reveladores, los patrones y los criterios de detección de los fito- compuestos caracterizados en este proyecto, se presentan en las tablas 9 y 10. 39 Tabla 9. Patrones, reveladores y criterios de detección de metabolitos secundarios usados en la caracterización fitoquímica por cromatografía de capa delgada (CCD). Metabolitos secundarios Patrón (300 ppm) Revelador Característica de la mancha Alcaloides Papaverina Dragendorff Naranja Cumarinas 7-Hidroxicumarina KOH al 5% en etanol absoluto (UV 254 - 360 nm) Azul o blanco fosforescente Esteroides y/o saponinas esteroidales β-Estradiol, Diosgenina, Hecogenina, Esteroles, Di, tri, terpénos y/o saponinas tri-terpénicas Colesterol, Lupeol, Esteroles Colesterol, Estigmasterol, Flavonoides: auronas, catequinas, chalconas, flavonas, flavonoles, Flavononas e isoflavonas Apigenina y Naringenina, Referencia (Harborne, 1998) Verde, amarillo o azul LiebermannBurchard Rosado o lila (Farnsworth, 1966) Amarillo pálido o gris AlCl3 al 1% en metanol analítico (UV 360 nm) (Ver tabla 10) FeCl3 Negro o azul para taninos hidrolizables y compuestos fenólicos; café o verde para taninos condensados Taninos: hidrolizables y/o compuestos fenólicos; o taninos condensados Ácido Gálico y Kaempferol Quinonas Antraquinona KOH al 5% en etanol absoluto (UV 360 nm) Naranja, amarillo, rojo, vinotinto, morado y café Sesquiterpenlactonas Digitoxina Kedde Violeta, morado o vinotinto 40 (Harborne, 1998) (Wagner and Bladt, 1996) Tabla 10. Características de absorción en luz ultravioleta (360 nm) de los diferentes tipos de flavonoides (Farnsworth, 1966). RECONOCIMIENTO DE FLAVONOIDES USANDO COMO REVELADOR CLORURO DE ALUMINIO AL 1% SEGUIDO DE LA OBSERVACIÓN EN LUZ UN A 360 nm TIPO DE FLAVONOIDE Auronas REGIÓN VISIBLE REGIÓN UV (360 nm) Café Naranja fluorescente Rosado Amarillo pálido Catequinas Incoloro Amarillo-Blanco Azul pálido Incoloro Chalconas Amarillo Naranja Amarillo-Naranja Naranja fluorescente Café Rosado Flavonas Amarillo pálido Verde fluorescente Amarillo Café Flavonoles Amarillo Flavononas Incoloro Amarillo o verde fluorescente Azul-Blanco Isoflavonas Incoloro Amarillo fluorescente Amarillo o verde fluorescente 6. RESULTADOS Y DISCUSIÓN Para el análisis de resultados obtenidos en este proyecto, se siguió el esquema que se muestra en la figura 16, en el cual se observan las etapas que se desarrollaron teniendo en cuenta los objetivos específicos planteados en este estudio. 41 Obtención de Extractos Vegetales n-Hexano Diclorometano Metanol Caracterización fitoquímica por cromatografía de capa delgada (CCD) Alcaloides Cumarinas Esteroides Esteroles Flavonoides Quinonas Taninos Saponinas Condiciones experimentales del método fotométrico para la evaluación de la actividad inhibitoria α-Glucosidasa (α-GLC) en extractos vegetales Abundancia Relativa de Metabolitos Características óptimas Variables en el de ensayos de tamizaje desarrollo del método en productos naturales Fotométrico para evaluación de la secundarios Actividad inhibitoria α-Glucosidasa (α-GLC) -Tipo de muestra -Actividad inhibitoria (% de inhibición) -Perfil de los inhibidores -Fuente de la α-Glucosidasa -Selección del sustrato (p-Nitrofenil-α-Dglucopiranósido) -pH y temperatura del ensayo -Cofactores -Concentración de la solución buffer -Concentración de la α-Glucosidasa (α-GLC) -Concetratración del sustrato -Tiempo de duración del ensayo -Solubilidad de los reactivos METODOLOGÍA -Formato del ensayo -Relación señal/ruido Figura 16. Etapas desarrolladas durante la ejecución del proyecto. 42 6.1 OBTENCIÓN DE LOS EXTRACTOS CRUDOS A continuación en la tabla 11, se encuentran los valores de las masas de los extractos crudos de n-hexano, diclorometano y metanol obtenidos a través de maceración pasiva y concentradas a 50°C siguiendo la metodología de Niño et al., (2007). Tabla 11. Masas de los extractos crudos de n-hexano, diclorometano y metanol obtenidas por maceración pasiva. MASAS DE EXTRACTOS CRUDOS OBTENIDOS POR MACERACIÓN PASIVA (g) NOMBRE CIENTÍFICO n-Hexano Diclorometano Metanol Guatteria petiolata 2,3142 17,2717 10,1374 Mandevilla veraguensis 7,5838 5,9912 17,6008 Blepharodon grandifolium 8,0466 5,1797 10,9138 Calea angosturana 3,5635 5,8709 8,2776 Clivadium asperum 1,5581 3,5513 6,6557 Clivadium funkise 7,2534 5,4337 10,6985 Munnzonia hastifolia 7,2215 5,5685 8,1138 Pentacalia americana 6,0284 6,2498 7,749 Chrysoclamys floribunda ----- 8,1444 7,2008 Vismia laevis 3,8123 2,8488 7,7866 Costus sp ---- 1,8381 19,0775 Acalypha diversifolia 4,279 5,469 22,178 Acalypha macrostachya 6,2319 5,8346 6,503 Alchornea grandis 2,227 3,159 14,058 Hyeronima antioquiensis 4,8124 4,3338 18,3213 Hyeronima Macrocarpa Müll 21,5953 ---- ---- Mavea montana 8,0815 5,4216 28,9335 Salvia scutellarioides 4,5364 6,7065 15,3539 Ocotea insulares 3,3898 4,1877 6,5223 Ocotea paulii 6,8258 6,6573 20,6937 Nectandra acutifolia 12,2728 14,8267 27,8171 Nectandra lineatifolia 8,9025 12,6264 38,0924 43 Pavonea septioides 3,3173 3,3879 7,0045 Miconia sp ---- ---- ---- Tibouchina lepidota 2,984 3,7096 12,427 Passiflora danielii 2,1085 0,9999 12,7491 Passiflora rubra 2,3365 1,7581 19,2893 Piper calceolarium 5,254 10,2006 12,2128 Piper crassinervium 14,2375 36,9265 25,9078 Piper danielli-gonzalezii 4,8979 13,1173 11,5188 Browalia speciosa 3,6596 4,409 24,7426 Deprea glabra 1,0034 ---- ---- Solanum brevifolium 4,1119 6,7074 20,6981 Solanum sp 3,1360 3,5578 13,3046 Solanum trachycyphum 12,987 6,720 11,695 Phenax uliginosus 1.8973 6,9708 35,2439 Estos extractos crudos se utilizaron en la caracterización fitoquímica por cromatografía de capa delgada (CCD). 6.2 CARACTERIZACIÓN FITOQUÍMICA POR CROMATOGRAFÍA DE CAPA DELGADA (CCD) La marcha fitoquímica por CCD determinó los núcleos fitoquímicos presentes en los extractos de n-hexano, diclorometano y metanol de las plantas evaluadas en este trabajo recolectadas en las zonas de estudio, la Reserva Natural Bremen-La Popa (RN-BLP) y el Parque Regional Natural Ucumarí (PRNU) se muestran en el anexo 3. En la figuras 17, 18 y 19 se presentan los porcentajes de abundancia relativa de metabolitos secundarios en los extractos vegetales de n-hexano, diclorometano y metanol estudiados respectivamente en este proyecto. 44 ABUNDANCIA RELATIVA DE METABOLITOS SECUNDARIOS EN EXTRACTOS VEGETALES DE n-HEXANO 97,22 88,89 91,67 100,00 97,22 80,00 52,78 60,00 40,00 20,00 47,22 30,56 22,22 2,78 11,11 33,33 27,78 2,78 0,00 0,00 Figura 17. Porcentajes de abundancia relativa de metabolitos secundarios en extractos vegetales de n-hexano de plantas de la Ecorregión Cafetera Colombiana. Con relación a los resultados presentados en la figura 17, se pueden destacar los siguientes aspectos: La única especie que presentó alcaloides en el extracto de n-hexano fue Ocotea Paulii (Lauraceae). Existen reportes en la literatura de la presencia de alcaloides del tipo bencil-iso-quinolina en especies del género Ocotea (Coy and Cuca, 2009). 45 La presencia de esteroles, esteroides; di, tri, terpénos y saponinas (esteroidales y tri-terpénicas) se evidenciaron de manera predominante en todas las especies de plantas estudiadas; esto tiene concordancia con los estudios realizados por (Zhou et al., 2008) indicando que los esteroles y compuestos relacionados constituyen el 80% de las partes vegetativas de las plantas, son insolubles en agua y se pueden extraer con solventes como nhexano y diclorometano. Esto explica la razón por la cual estos fitocompuestos presentan altos porcentajes de abundancia relativa en este trabajo. Dentro de las especies de plantas estudiadas en este tipo de extracto, Vismia laevis (Clusiaceae UTP 184, FJR 4039) se destacó por la presencia de varios tipo de flavonoides a diferencia de las especies Guatteria petiolata (UTP 198, FJR 4052), Clivadium asperum (UTP 191, FJR 4045), Pentacalia sp (UTP 96 , FJR 3916), Alchornea grandis (UTP 202, FJR 4056), Ocotea insulares (UTP 176, FJR 4031), Tibouchina lepidota (UTP 185, FJR 4040), Passiflora rubra (UTP 183, FJR 4038), Passiflora danielli-gonzalezii (UTP 197, FJR 4051), Piper calceolarium (UTP 194, FJR 4048), Piper crassinervium (UTP 175, FJR 4030) y Piper danielii-gonzalezii (UTP 197, FJR 4051) cuya presencia de flavonoides fue nula. Todas las especies de plantas estudiadas en este proyecto evidenciaron la presencia de quinonas en gran proporción en los tres tipos de extractos estudiados. El resultado anterior correlaciona los estudios de (Harborne, 1998) probando que las quinonas se distribuyen de manera cosmopolita en las plantas superiores. La única especie estudiada en este proyecto que evidenció la presencia de sesquiterpenlactonas fue Vismia laevis (Clusiaceae UTP 184, FJR 4039). Existen reportes de lactonas en plantas de la familia Clusiaceae (Guimarães et al., 2013). La presencia de taninos condensados fue predominante en la mayoría de los extractos de n-hexano más no de taninos hidrolizables. Esto puede deberse 46 a la polaridad de este tipo de metabolitos, los taninos hidrolizables son de naturaleza polar por lo tanto, no se detectaron en este tipo de extracto. A continuación, se presentan los porcentajes de abundancia relativa de metabolitos secundarios en los extractos vegetales de diclorometano. ABUNDANCIA RELATIVA DE METABOLITOS SECUNDARIOS EN EXTRACTOS VEGETALES DE DICLOROMETANO 100,00 100,00 80,00 61,11 60,00 58,33 97,22 50,00 36,11 40,00 20,00 100,00 25,11 16,67 16,67 2,78 27,78 25,00 0,00 0,00 Figura 18. Porcentajes de abundancia relativa de metabolitos secundarios en extractos vegetales de diclorometano de plantas de la Ecorregión Cafetera Colombiana. 47 De la figura 18 se destacan los siguientes aspectos: El extracto vegetal de diclorometano Phenax uliginosus (Urticaceae UTP 143, FJR 3990) no mostró la abundante presencia de los metabolitos secundarios, como cumarinas, alcaloides, flavonoides, quinonas; los únicos metabolitos que se evidenciaron en esta especie fueron di y tri-terpénos y esteroles. El contenido de quinonas y cumarinas de este tipo de extractos comparados con los extractos de n-hexano, no evidenciaron grandes diferencias en los porcentajes de estos dos tipos de metabolitos secundarios evaluados. Según la marcha fitoquímica de los extractos vegetales de diclorometano al igual que en los extractos vegetales de n-hexano hubo presencia de esteroles, esteroides y saponinas esteroidales, di-tri-terpénos y saponinas tri-terpénicas. La especie Piper danielii-gonzalezii (Piperaceae UTP 197, FJR 4051) evidenció la posible presencia de tri-terpénos y/o saponinas triterpénicas. Actualmente, existen reportes de actividad anti-secretora, antiinflamatoria y anti-Helicobacter pylori en extractos vegetales del género Piper (Quílez et al., 2010). Cerca del 97% de la plantas de los extractos de diclorometano presentaron taninos condensados y sólo un porcentaje muy pequeño evidenció la presencia de taninos hidrolizables y/o compuestos fenólicos correspondiente al 21,78 %. La especie Piper danelli-gonzalezii (Piperaceae UTP 197, FJR 4051) se destacó por presentar taninos hidrolizables y compuestos fenólicos. El extracto vegetal de la especie Ocotea Paulii (Lauraceae UTP 179, FJR 4034) fue el único que presentó alcaloides en los extractos vegetales de diclorometano caracterizados. Las especies del género Ocotea se caracterizan por presentar actividad anti-plaquetaria y anti-trombótica (Ballabeni et al., 2007). 48 A continuación se presentan los porcentajes de abundancia relativa en extractos vegetales de metanol en la figura 19. ABUNDANCIA RELATIVA DE METABOLITOS SECUNDARIOS EN EXTRACTOS VEGETALES DE METANOL 100,000 86,111 77,778 75,000 80,000 60,000 47,222 40,000 20,000 100,000 94,444 100,000 22,222 11,111 5,556 11,111 11,111 0,000 5,556 0,000 Figura 19. Porcentajes de abundancia relativa de metabolitos secundarios en extractos vegetales de metanol de plantas de la Ecorregión Cafetera Colombiana Con base a la figura 19, se destacan los siguientes aspectos: 49 Los extractos vegetales lepidota, UTP 185), de las especies (Melastomataceae Tibouchina y los miembros de la familia Solanaceae (Solanum trachycyphum, UTP 189) y (Solanum sp, UTP 188) evidenciaron la posible presencia de alcaloides en los extractos de metanol. Actualmente, no existen reportes sobre la presencia de alcaloides en plantas de la familia Melastomataceae. Las plantas de la familia Solanaceae contienen un gran variedad de alcaloides tales como: alcaloides del tropano, proto-alcaloides; alcaloides del tipo indol, iso-quinolina, purina, pirazol, piridina, pirrolidina, quinazolidina, alcaloides esteroidales y gluco-alcaloides (Trease, 2009); las especies del género Solanum se caracterizan por su alto contenido de alcaloides esteroidales y del tropano (Eltayeb et al., 1997; Trease, 2009). Los extractos que evidenciaron la mayor abundancia de Cumarinas fueron los extractos de n-hexano 25,11% y metanol 47,11%. Dentro de las familias de que manifestaron la presencia de cumarinas se encuentran la familia Annonaceae, Apocynaceae, Asclepiadaceae, Clusiaceae, Costaceae, Euphorbiaceae, Lauraceae, Melastomataceae, Piperaceae y Solanaceae. Existen reportes de extractos crudos con gran abundancia de cumarinas en las familias antes mencionadas y además han sido evaluadas contra Staphylococcus aureus (Yasunaka et al., 2005). Según la marcha fitoquímica, los extractos crudos de diclorometano (figura 18) y los extractos de metanol (figura 19) no evidencian la presencia de Sesquiterpenlactonas. Los extractos vegetales de las familias Annonaceae, Asteraceae y Euphorbiaceae presentaron un amplio contenido de taninos hidrolizables y/o compuestos fenólicos en contraste de los extractos vegetales de n-hexano. Los compuestos fenólicos de origen vegetal son conocidos por su papel en la calidad y seguridad alimentaria, puesto que contribuyen de manera significativa al gusto, sabor, color y estabilidad de los alimentos. A su vez que, se reconocen cada vez más como factores importantes en la salud a largo plazo, lo que ayuda a reducir el riesgo de enfermedades crónicas (Arapitsas, 2012). 50 Los extractos vegetales que presentaron mayor contenido de flavonoides fueron los extractos de metanol. Dentro de las familias de plantas de estudio, las flavonoides: siguientes Annonaceae, presentan una Asteraceae, abundancia significativa Euphorbiaceae, de Lauraceae y Solanaceae. La importancia de estos metabolitos radica en que ayudan a contrarrestar el efecto de los radicales libres que causan stress oxidativo (Cook and Samman, 1996). 6.3 FORMATO DEL MÉTODO FOTOMÉTRICO PARA LA EVALUACIÓN DE LA ACTIVIDAD INHIBITORIA α-GLUCOSIDASA (α-GLC) Los aspectos importantes que se tendrán en cuenta en el diseño del método fotométrico atendiendo la metodología propuesta por Rahman et al., (2005). Dentro de los aspectos que se deben tener en cuenta para el diseño del método es El formato del ensayo. Un ensayo primario es un trabajo exploratorio donde se requiere evaluar muchos y diferentes objetos de estudio, por esta razón se recomienda usar un equipo que permita analizar muchas muestras como los lectores de microplaca. Las ventajas de utilizar un espectrofotómetro con lector de microplacas (Biotek, 2012; vintessential, 2013): El volumen de la muestra oscila entre 50 - 200 µL El número de pozos en las microplacas, permite distribuir del número de muestras como lo requiera el ensayo y puede leer todos las absorbancias de dichas muestras en el mismo periodo en que transcurra la reacción. El formato más común en los centros de investigación es la microplaca de 96 pozos además de que permite al menos leer tres longitudes de onda en un sólo ensayo. Las muestras no requieren dilución . 51 Se pueden ensayos de cuantificación de ADN y ARN, ensayos de proteínas, ensayos de enzimas, ensayos de cinética, ensayos inmunológicos, ensayos de proliferación y citotoxicidad de células, ensayos de Apoptosis y ensayos de GPCR. Para los ensayos primarios de la actividad inhibitoria α-Glucosidasa in vitro, se recomienda el uso de microplacas de fondo plano fabricadas en poliestireno transparente (Liu et al., 2011). 6.4 VARIABLES IMPORTANTES EN EL DISEÑO DEL MÉTODO FOTOMÉTRICO PARA LA EVALUACIÓN DE LA ACTIVIDAD INHIBITORIA DE LA α-GLUCOSIDASA (α-GLC) in vitro Las variables que se deben tener en cuenta para desarrollo del método fotométrico se muestran a continuación siguiendo la metodología de (Rahman et al., 2005): La fuente de la α-Glucosidasa (α-GLC) y selección del sustrato. El pH y la temperatura del ensayo. La concentración final de la α-Glucosidasa (α-GLC) en el ensayo. La concentración final del p-Nitrofenil-α-D-glucopiranósido (p-NFGP) en el ensayo. El tiempo de duración del ensayo. La solubilidad de los reactivos en el momento del ensayo. Perfil de los inhibidores enzimáticos. A continuación se describirán las variables del método fotométrico para evaluar la actividad inhibitoria α-Glucosidasa (α-GLC) in vitro siguiendo la metodología descrita por Rahman et al., (2005). 52 6.4.1 La fuente de la α-Glucosidasa (α-GLC) Una de las consideraciones importantes para el desarrollo del método fotométrico para evaluar la actividad enzimática, es la selección de una fuente viable de la enzima (Rahman et al., 2005). La α-Glucosidasa puede ser aislada de diferentes organismos (Yamamoto et al., 2004); sin embargo, no siempre comparten las mismas características como su especificidad por el sustrato y condiciones de experimentación (Ota et al., 2009). En la tabla 12, se presentan las diferentes clases de α-Glucosidasas (α-GLC) disponibles comercialmente. Tabla 12. Clases de α-Glucosidasas (α-GLC) disponibles comercialmente y sus características. Organismo Número EC Especificidad por el sustrato Familia de glucósido hidrolasa pH óptimo de trabajo Temperatura (°C) Aspergillus niger 3.2.1.20/3 II 31 4.5 Bacillus stearothermophilus 3.2.1.20 I 13 6.8 Candida tsukubaensis 3.2.1.20 II 31 2.4-4.8 Fabricante Referencia 40 SigmaAldrich 37 Megazyme (Kim et al., 2005), (Tagami et al., 2013) 55 SigmaAldrich Saccharomyces cerevisiae Oryza sativa Rhizopus sp. 3.2.1.20 (Henrissat and Bairoch, 1993), (Kinsella et al., 1991) I 13 6.8 37 (Kim et al., 2005) III 31 4 37 (Nakai et al., 2007) -- 15 6 37 53 Merkmillipore (Chen et al., 2012) Maltasa de levadura (Saccharomyces cerevisiae) I 13 6.4-6.8 40 Megazyme (Frandsen et al., 2002) El objetivo principal de este proyecto al obtener las variables de esta metodología es la búsqueda de compuestos que puedan ser usados como posibles inhibidores de las enzimas hidrolíticas en los insectos y diseñar un biopreparado. Por lo general, estos organismos presentan alrededor de 5 enzimas para degradar la celulosa y el almidón de las plantas; entre ellas, la α-Glucosidasa II (α-GLC II) (Watanabe et al., 1997); por lo tanto las enzimas aisladas de Aspergillus niger y Candida tsukubaensis. Estas enzimas deben ser almacenadas entre 0-4°C. 6.4.2 Selección del sustrato Como se mencionó anteriormente, los sustratos recomendados para estudiar la actividad catalítica de las glucósido hidrolasas, son glicósidos de mono y di-nitrofenoles debido a su fácil detección por espectrofotometría UV-Visible; en el diseño del método fotométrico para la evaluación de la actividad inhibitoria de la α-Glucosidasa (α-GLC) in vitro, el sustrato recomendado es el p-Nitrofenil-α-Dglucopiranósido (p-NFGP) (Cihan et al., 2010). Es muy importante tener en cuenta que p-Nitrofenil-α-D-glucopiranósido es susceptible de hidrolisis básica, además de que debe ser conservado a una temperatura de -20°C. 6.4.3 El pH y la temperatura del ensayo El pH y la temperatura del método fotométrico para la evaluación de la actividad inhibitoria α-Glucosidasa (α-GLC) in vitro, están en función de las condiciones de 54 pH óptimo y temperatura donde sea más estable y se evidencie su máxima actividad enzimática (Rahman et al., 2005). La Glucosidasa tipo II (α-GLC II) se obtendrá comercialmente por lo tanto, el ensayo se llevará a cabo de acuerdo a las condiciones de pH y temperatura óptimas establecidas por el fabricante como se muestra en la tabla 13. Tabla 13. Condiciones experimentales de temperatura y pH óptimas para el ensayo de acuerdo a las recomendaciones establecidas por el fabricante. Fuente de la α-Glucosidasa II (α-GLC II) EC 3.2.1.20 Aspergillus niger Candida tsukubaensis pH óptimo de trabajo Temperatura 4.5 40 Fabricante Sigma Aldrich 4.8 55 6.4.4 Concentración de la solución buffer Como se expuso anteriormente, el pH óptimo de trabajo de la α-Glucosidasa tipo II (α-GLC II) es 4.8. sin embargo, la actividad enzimática es dependiente de la concentración salina de la solución buffer (Rahman et al., 2005). Para cumplir dicha condición, es importante usar la concentración adecuada de sal y del ácido débil con el objeto de que la reacción de hidrólisis catalizada por acción de la α Glucosidasa (α-GLC) se realice exitosamente. 55 Figura 20. Actividad enzimática de la polifenol oxidasa en función de la concentración de la solución buffer pH 5 (Cestari et al., 2002). De igual manera que los ensayos realizados por (Cestari et al., 2002) (figura 20), se propone evaluar la α-Glucosidasa tipo I (α-GLC) (pH óptimo=6.8) a diferentes concentraciones de la solución buffer fosfato como son 20, 40, 60, 80, 160 y 200 mM como lo sugiere (Guo et al., 2010) frente a la actividad enzimática. Se debe tener en cuenta la relación señal/ruido. 6.4.5 La concentración de la α-Glucosidasa (α-GLC) en el ensayo La concentración final de α-Glucosidasa (α-GLC) es una variable importante en el desarrollo del ensayo de evaluación de actividad inhibitoria, el cual debe ser un valor pequeño; sin embargo, debe generar un valor de la señal alto y de esta manera el cociente obtenido de la relación señal/ruido del ensayo también lo será (Rahman et al., 2005). Según reportes de la literatura, las concentraciones de α-Glucosidasa (α-GLC) del método fotométrico para la evaluación de la actividad inhibitoria de la α - 56 Glucosidasa (α-GLC) in vitro en extractos vegetales se muestran a continuación en la tabla 14. Tabla 14. Concentraciones de α-Glucosidasa (α-GLC) utilizadas en ensayos actividad inhibitoria en extractos crudos de plantas. Fuente de la α-Glucosidasa I (α-GLC I) usada en el ensayo de actividad inhibitoria Concentración inicial (U/mL) Tipo de extracto crudo evaluado Bacillus stearothermophilus 0.5 U/mL Etanol 0.1 U/mL Etanol-Agua (8:2) 0.6 U/mL Etanol-Agua (5:5) 0.6 U/mL Acetona (Shai et al., 2010) 1 U/mL Etanol (Wang et al., 2012) 0.1 U/mL Fracciones obtenidas de un extracto crudo de n-HexanoAcetato de etilo (7:3) (Damsud et al., 2013) Saccharomyces cerevisiae Referencia (Kim et al., 2011) (Lordan et al., 2013) (Rubilar et al., 2011) Dadas las concentraciones de α-Glucosidasas (α-GLC) utilizadas en las metodologías para la evaluación de la actividad inhibitoria (α-GLC) en los extractos vegetales, se propone evaluar en el rango de concentraciones desde 0,2 U/mL a 1 U/mL de αGlucosidasa tipo II (α-GLC II) a las condiciones de temperatura y pH óptimas recomendadas por el fabricante con las diferentes concentraciones de sustrato 57 con el objeto de hallar la relación existente entre la actividad enzimática de la αGlucosidasa tipo I (α-GLC I) y la concentración de sustrato en la cual se debe encontrar una relación proporcional; al aumentar la concentración de enzima, la velocidad enzimática también se incrementará (una respuesta lineal) en condiciones de saturación del sustrato. De acuerdo con los valores obtenidos se seleccionará aquella concentración de enzima que presente la mejor relación señal/ruido (Guo et al., 2010). 6.4.6 La concentración final de p-Nitrofenil-α-D-glucopiranósido (p-NFGP) en el ensayo En las reacciones enzimáticas donde se catalice un solo sustrato, este debe presentar una alta afinidad de interacción con la enzima; es decir, un valor de Km bajo lo que permitiría el uso de bajas cantidades de sustrato en el ensayo, así como proporcionar sensibilidad al ensayo para detectar los inhibidores que compiten con el sustrato por el sitio activo de la enzima. Además la reacción enzimática procederá de manera más rápida; en estudios fisiológicos tienen mayor relevancia aquellos donde el valor de Km sea bajo (Rahman et al., 2005). La constante Km de la α-Glucosidasa tipo II (α-GLC II) puede ser determinada experimentalmente usando como sustrato p-Nitrofenil-α-D-glucopiranósido (pNFGP), evaluando la relación lineal que existe entre el sustrato y la velocidad inicial de la reacción (1/2 Vm) (Rahman et al., 2005) como se muestra en las figuras 14 y 15. En el método fotométrico para la evaluación de la actividad inhibitoria de la α Glucosidasa (α-GLC) in vitro, se recomienda escoger como concentración de pNitrofenil-α-D-glucopiranósido (p-NFGP) un valor que incluya el valor de Km; al usar un valor por debajo de este, el valor de la relación señal/ruido disminuirá; aquellas concentraciones por encima del valor de Km, incrementará el valor de la relación señal/ruido, pero hará que el ensayo no sea tan sensible cuando se requiera detectar el perfil de los inhibidores enzimáticos. 58 Por consiguiente se debe encontrar el equilibrio entre la relación señal/ruido y la sensibilidad del ensayo (Rahman et al., 2005). Esto tiene correlación con los estudios realizados por (Motabar et al., 2009) donde se evaluaron diferentes concentraciones de un sustrato fluorogenico, 4-metil-umbelliferil-α-D- glucopiranósido (4-MUGP) frente a la α-Glucosidasa (α-GLC) y se encontró que el valor de Km fue de 76 µM; decidieron aumentar cuatro unidades el valor de Km para saturar la enzima por ende, la concentración escogida para el sustrato 4MUGP fue de 80µM. 6.4.7 El tiempo de duración del ensayo El tiempo de incubación es uno de los factores que habitualmente se investiga cuando se desarrolla un método para la determinación de una alguna actividad enzimática. Normalmente la reacción enzimática se incrementa de manera lineal con el tiempo de incubación hasta un determinado momento en el que se pierde la linealidad, lo que puede ocurrir debido a que la concentración de sustrato es un factor limitante o debido a la inhibición por los productos de la reacción enzimática. De acuerdo con los reportes de la literatura, el tiempo durante el que la reacción es lineal varía enormemente dependiendo de la enzima que se trate (García et al., 2003) La incubación de un ensayo enzimático debe llevarse a cabo con base a la velocidad inicial, donde la reacción es de primer orden con respecto a la concentración de sustrato y tiene un comportamiento lineal normalmente el tiempo de reacción varia de 30 a 60 minutos (Rahman et al., 2005). En estudios realizados de la actividad inhibitoria de la α-Glucosidasa (α-GLC) en extractos de plantas, normalmente se encuentran dos periodos de tiempo: un periodo de incubación en el cual la α-Glucosidasa (α-GLC) se activa y un tiempo de 59 reacción donde realiza la actividad de la hidrólisis enzimática del sustrato pNitrofenil-α-D-glucásido (p-NFGP). Experimentalmente, se ha determinado que un periodo de incubación para la αGlucosidasa (α-GLC) en un periodo de 40 minutos donde el tiempo de reacción se comporta de manera lineal frente a la actividad enzimática; se considera que 10 minutos de tiempo de incubación y 10 minutos de tiempo de reacción, generan una buena relación de señal/ruido (Motabar et al., 2009). 6.4.8 La solubilidad de los reactivos en el momento del ensayo En los ensayos de actividad inhibitoria de la α-Glucosidasa (α-GLC), la enzima, el sustrato y los extractos a evaluar la actividad se disuelven en la misma solución buffer con el pH óptimo de la enzima con el objetivo de evitar cambios abruptos que puedan afectar la estructura terciaria de la enzima (Staniszewski, 2009). La solubilidad es un factor importante dado que en la medida en que los fitocompuestos presentes en los extractos crudos se encuentren en solución aumenta la probabilidad de que la α-Glucosidasa (α-GLC) actué frente estos metabolitos y conviertan en posibles inhibidores de la enzima . Según los estudios realizados por (Nurok et al., 1999) demuestran que los disolventes hidrofílicos, como el metanol pueden distorsionar la forma en que el agua se asocia con la enzima y puede afectar negativamente la actividad enzimática, por lo tanto, no es recomendable solubilizar los extractos crudos de plantas de n-hexano, diclorometano y metanol considerados en este proyecto en sus respectivos solventes dado que puede afectar la medición de la actividad enzimática y de inhibición de la α-Glucosidasa (α-GLC). Existen reportes en la literatura de la evaluación de la actividad inhibitoria α Glucosidasa (α-GLC) en extractos de plantas In Vitro por fotometría como extractos crudos de etanol (Kim et al., 2011), acetona (Deutschländer et al., 2011), metanol y diclorometano (Ranga Rao et al., 2009); y n-hexano (Rao et al., 2007) 60 usando como solvente, una solución tampón de buffer fosfato, cuyo rango de viraje en la escala de pH es de 6.3 – 7, próximos al pH óptimo de la α-Glucosidasa (αGLC). 6.4.9 El perfil de los inhibidores enzimáticos La inhibición enzimática es de gran importancia fisiológica, ya que a veces la inhibición de una sola enzima que forma parte de una cadena de reacciones metabólicas puede inhibir por completo a todo el proceso metabólico involucrado y ejercer en esa forma un efecto profundo y a veces fatal sobre el organismo. La importancia que este fenómeno tiene lugar en farmacología y toxicología así como también, en el desarrollo de herbicidas e insecticidas. De ahí que el estudio del mecanismo de acción de los inhibidores se haya constituido en una de las más exploradas de la enzimología práctica. Es importante comprender el mecanismo por el cual los extractos vegetales inhiben la enzima; la α-Glucosidasa (α-GLC) exhibe cinética de Michaelis-Menten y por lo tanto, la descripción de su mecanismo de inhibición puede ser estudiado por gráficas de dobles recíprocos (Kumar et al., 2013). Como se mencionó anteriormente, la acarbosa es un inhibidor de la α-Glucosidasa (α-GLC) cuyo mecanismo de inhibición es competitivo y se recomienda ser utilizado para hallar el valor del IC50 con el objetivo de discriminar los extractos crudos con actividad inhibitoria α-Glucosidasa (α-GLC) (Hasegawa et al., 2008), además de ser el control positivo para el ensayo del método fotométrico; la acarbosa se comercializa con el nombre de Glucobay® (Bayer, 100 mg) y puede ser extraída de las tabletas como se describe en anexo 5 siguiendo la metodología descrita por (Cherkaoui et al., 1998). 61 6.5 Etapas del método fotométrico para la evaluación de la actividad inhibitoria α-glucosidasa (α-GLC) en plantas de la Ecorregión Eafetera Colombiana (ECC) La primera etapa del método inicia con la distribución de los diferentes tipos de muestras en la microplaca de 96 pozos como se muestra en la figura 21. . Control negativo Patrones del extracto II Control positivo Control del extracto II Blanco fotométrico Patrones del extracto III Pozos vacíos Patrones del extracto I Control del extracto III Patrones del extracto IV Control del extracto I Control del extracto IV Control del sustrato Figura 21. Distribución de los tipos de muestras en la microplaca de 96 pozos. En la tabla se exponen los tipos de muestra estudiados en el proyecto 62 La metodología del método se presenta en la tabla 17. Tabla 17. Metodología del método fotométrico para la evaluación de la actividad inhibitoria α-Glucosidasa (α-GLC) en plantas de la Ecorregión Cafetera Colombiana . METODOLOGÍA PARA LA EVALUACIÓN DE LA ACTIVIDAD INHIBITORIA α-GLUCOSIDASA (α-GLC) EN PLANTAS DE LA ECORREGIÓN CAFETERA COLOMBIANA TIPOS DE MUESTRAS Control negativo Control positivo Mezcla reaccionante α-Glucosidasa (α-GLC) Blanco fotométrico Blanco del extracto Control del sustrato α-GLC + + + - - - Solución de extracto a evaluar la actividad inhibitoria - - + - - - Acarbosa - + - - - - Buffer Fosfato (pH=6.8) + + - + + + REACTIVOS Periodo de activación de la α-Glucosidasa (α-GLC) a las condiciones de pH y temperatura óptimas por 10 minutos. Monitorear la reacción cada minuto + p-NFGP - Periodo de reacción enzimática de la α-Glucosidasa (α-GLC) a las condiciones de pH y temperatura óptimas por 10 minutos. Monitorear la reacción cada minuto Solución básica (Detiene la reacción enzimática) + Medir espectrofotométricamente a 405nm (-) No requieren del reactivo (+) Requieren del reactivo. 63 Se debe tener en cuenta en el momento de calcular los volúmenes de las muestras que serán adicionadas a los pozos: Las concentraciones iniciales y finales de las soluciones en la microplaca en el momento de realizar los cálculos. La concentración final no tiene en cuenta el volumen de la solución que detiene la reacción enzimática. La capacidad máxima de los pozos (300 µL). Aquellas muestras que no requieran de la adición de algún volumen de los reactivos, se reemplazará por un volumen de solución buffer fosfato (pH=6.8). Por ejemplo, el control negativo contiene la enzima y el sustrato en contraste del control positivo que contiene adicionalmente la acarbosa; en ese caso, el volumen de acarbosa en el control negativo debe ser reemplazado por volumen equivalente de solución buffer fosfato (pH=6.8). 6.5.1 Ecuaciones para realizar los cálculos de porcentajes de inhibición y actividad enzimática. Porcentajes de inhibición de acuerdo a los trabajos realizados por (Shai et al., 2010). 64 Velocidad enzimática en función de la actividad enzimática de acuerdos a los estudios realizados por (Watanabe et al., 2013) i i a nzim i a ( ) i a m n am z a a i nan Dónde: Coeficiente de extinción molar (ε) del p-Nitrofenol= 18200 mol. L-1. cm-1 Distancia recorrida por la luz (d). 65 6.6 TRATAMIENTO ESTADÍSTICO DE LOS DATOS OBTENIDOS EN EL MÉTODO FOTOMÉTRICO PARA LA EVALUACIÓN DE LA ACTIVIDAD INHIBITORIA DE LA α-GLUCOSIDASA (α-GLC) EN PLANTAS DE LA ECORREGIÓN CAFETERA Evaluar la actividad inhibitoria α-Glucosidasa (α-GLC) in vitro de los extractos vegetales de cinco concentraciones iniciales: 30 ppm, 100 ppm, 300 ppm, 1000 ppm y 3000 ppm como se sugiere en la metodología de (Orhan et al., 2013). Determinar el IC 50 como criterio de inhibición frente a la α-Glucosidasa (Alexander et al., 1999), como base el IC50 de la acarbosa (30 ppm, 100 ppm, 300 ppm, 1000 ppm y 3000 ppm), la cual es un inhibidor de las α Glucosidasas (α- GLC) y de las α-amilasas (α-AML) usando el programa Graphpad Prism. Realizar el ensayo por triplicado en dos días diferentes. Los valores de los datos se expresaran como media ± desviación estándar 66 7. CONCLUSIONES El análisis de la actividad inhibitoria α-Glucosidasa (α-GLC) en muestras multi-componente como los extractos vegetales, requiere del diseño de un método altamente sensible debido a la complejidad de la matriz. Este proyecto plantea las variables requeridas para desarrollar el método fotométrico para la evaluación de la actividad inhibitoria α Glucosidasa (α-GLC) y que este pueda ser adaptado a diversas investigaciones. 67 8. RECOMENDACIONES Continuar con la aplicación y ejecución del método fotométrico para la evaluación de la actividad inhibitoria de la α-Glucosidasa (α-GLC) in vitro en extractos vegetales, puesto que contribuye al conocimiento de flora de nuestra región, además de que las actividades biológicas asociadas con la inhibición de la α-Glucosidasa (α-GLC) como la actividad antialimentaria en animales herbívoros, anti-hiperglicemica y anti-viral están relacionadas con problemáticas farmacológicas y ambientales a nivel mundial y nacional como son el control de plagas, la búsqueda de nuevos compuestos para combatir el VIH y la diabetes. 68 9. BIBLIOGRAFÍA Abhilash P. C. and Singh, N. (2009). Pesticide use and application: An indian scenario. Journal of Hazardous Materials. 165: 1-12. Adams J. B. and Langley, F. M. (1998). Nitrophenyl glucoside hydrolysis as a potential time-temperature integrator reaction. Food Chemistry. 62: 65-68. Alexander B., Browse, D. J., Reading, S. J. and Benjamin, I. S. (1999). A simple and accurate mathematical method for calculation of the EC50. Journal of Pharmacological and Toxicological Methods. 41: 55-58. Alves M. J., Costa, F. T., Duarte, V. C. M., Fortes, A. G., Martins, J. A. and Micaelo, N. M. (2011). Advances in the synthesis of homochiral (−)-1Azafagomine and (+)-5-Epi-1-Azafagomine. 1-N-phenyl Carboxamide derivatives of both enantiomers of 1-Azafagomine: Leads for the synthesis of active α-glycosidase inhibitors. The Journal of Organic Chemistry. 76: 95849592. Arapitsas P. (2012). Hydrolyzable tannin analysis in food. Food Chemistry. 135: 1708-1717. Balogh T., Boross, L. and Kosáry, J. (2004). Novel reaction systems for the synthesis of O-glucosides by enzymatic reverse hydrolysis. Tetrahedron. 60: 679-682. Ballabeni V., Tognolini, M., Bertoni, S., Bruni, R., Guerrini, A., Rueda, G. M. and Barocelli, E. (2007). Antiplatelet and antithrombotic activities of essential oil from wild Ocotea quixos (Lam.) kosterm. (Lauraceae) calices from Amazonian Ecuador. Pharmacological Research. 55: 23-30. Bian X., Wang, Q., Ke, C., Zhao, G. and Li, Y. (2013). A new series of N2substituted-5-(p-Toluenesulfonylamino)phthalimide analogues as α-glucosidase inhibitors. Bioorganic & Medicinal Chemistry Letters. 23: 2022-2026. Biotek. (2012). Spectrophotometric nucleic acid quantification in microplates and micro-volumes [22 de octubre de 2013]. 69 http://www.biotek.com/resources/articles/Nucleic-Acid-Quant-ApplicationGuide.html. Borges de Melo E., da Silveira Gomes, A. and Carvalho, I. (2006). Alpha and beta Glucosidase inhibitors: Chemical structure and biological activity. Tetrahedron. 62: 10277-10302. Britto R. M., Santos, A. L., Cruz, J. S., Gondim, A. N. S., Lauton-Santos, S., Lara, A., Guatimosim, S., Vasconcelos, C. M. L., Estevam, C. d. S., Dias, A. S., Oliveira, E. D., Lima, A. K., Souza, R. and Conde-Garcia, E. A. (2011 ). Aqueous fraction from Costus spiralis (Jacq) roscoe leaf reduces contractility by impairing the calcium inward current in the mammalian myocardium. Journal of Ethnopharmacology. 138: 382-389. Cai X. F., Jin, X., Lee, D., Yang, Y. T., Lee, K., Hong, Y.-S., Lee, J.-H. and Lee, J. J. (2006). Phenanthroquinolizidine alkaloids from the roots of Boehmeria pannosa potently inhibit hypoxia-inducible factor-1 in AGS human gastric cancer cells. Journal of Natural Products. 69: 1095-1097. CARDER C. A. R. d. R. (2012 ). Plantas del Parque Regional Natural Ucumarí. [documento mimeo]. CARDER. Pereira-Risaralda. 23. [Fecha de consulta: 11 de abril de 2012] Carlson H. A., Smith, R. D., Khazanov, N. A., Kirchhoff, P. D., Dunbar, J. B. and Benson, M. L. (2008). Differences between high- and low-affinity complexes of enzymes and nonenzymes. Journal of Medicinal Chemistry. 51: 6432-6441. Celis Á., Mendoza, C., Pachón, M., Cardona, J., Celgado, W. and Cuca, L. (2008). Extractos vegetales utilizados como biocontroladores con énfasis en la familia Piperaceae. Una revisión. Agronomía Colombiana 26: 97-106. Cestari A. R., Vieiraa, E. F. S., Nascimentoa, A. J. P., Filhaa, M. M. S. and Airoldib, C. (2002). Factorial design evaluation of some experimental factors for phenols oxidation using crude extracts from jackfruit (artocarpus integrifolia). The Journal of the Brazilian Chemical Society. 13: 260-265. Cihan A. C., Ozcan, B., Tekin, N. and Cokmus, C. (2010). Characterization of a thermostable α-glucosidase from Geobacillus thermodenitrificans F84A. 70 Current Research, Technology and Education Topics in Applied Microbiology and Microbial Biotechnology. 1: 945-955. Clausing G. and Renner, S. (2001). Molecular phylogenetic of Melastomataceae and Memecylaceae: Implications for character evolution. American Journal of Botany. 88: 486-498. Cook N. C. and Samman, S. (1996). Flavonoids—chemistry, metabolism, cardioprotective effects, and dietary sources. The Journal of Nutritional Biochemistry. 7: 66-76. Corporación Regional del Quindío, Corporación Autónoma Regional de Risaralda, Corporación Autónoma Regional del Valle del Cauca, Corporación Autónoma Regional del Tolima and Corporación Autónoma Regional del Caldas. (2002). Ecorregión: Eje cafetero. Un territorio de oportunidades. Editorial Alma Mater Pereira. 33-40. Coy E. D. and Cuca, L. E. (2008). Chemical constituents from Pleurothyrium cinereum (van der weff) (Lauraceae) from Colombia. Biochemical Systematics and Ecology. 36: Coy E. D. and Cuca, L. E. (2009). Aporphine alkaloids from leaves of Ocotea macrophylla (Kunth) (Lauraceae) from Colombia. Biochemical Systematics and Ecology. 37: 522-524. Coy E. D., Cuca, L. E. and Sefkow, M. (2009). PAF-antagonistic bicyclo[3.2.1] octanoid neolignans from leaves of Ocotea macrophylla Kunth (Lauraceae). Phytochemistry. 70: 1309-1314. Cumpstey I., Ramstadius, C., Eszter Borbas, K., Alonzi, D. S. and Butters, T. D. (2011). Synthesis and α-Glucosidase II inhibitory activity of valienamine pseudodisaccharides relevant to N-glycan biosynthesis. Bioorganic & Medicinal Chemistry Letters. 21: 5219-5223. Chan H.-H., Sun, H.-D., Reddy, M. V. B. and Wu, T.-S. (2010). Potent αglucosidase inhibitors from the roots of Panax japonicus c. A. Meyer var. Major. Phytochemistry. 71: 1360-1364. 71 Chen C.-C., Hsu, J.-D., Wang, S.-F., Chiang, H.-C., Yang, M.-Y., Kao, E.-S., Ho, Y.-C. and Wang, C.-J. (2003). Hibiscus sabdariffa extract inhibits the Development of atherosclerosis in cholesterol-fed rabbits. Journal of Agricultural and Food Chemistry. 51: 5472-5477. Chen W., Xie, T., Shao, Y. and Chen, F. (2012). Phylogenomic relationships between amylolytic enzymes from 85 strains of fungi. PLOS ONE. 7: e49679. Cherkaoui S., Daali, Y., Christen, P. and Veuthey, J.-L. (1998). Development and validation of liquid chromatography and capillary electrophoresis methods for acarbose determination in pharmaceutical tablets. Journal of Pharmaceutical and Biomedical Analysis. 18: 729-735. Damsud T., Adisakwattana, S. and Phuwapraisirisan, P. (2013). Three new phenylpropanoyl amides from the leaves of Piper sarmentosum and their αglucosidase inhibitory activities. Phytochemistry Letters. 6: 350-354. Davies G. and Henrissat, B. (1995). Structures and mechanisms of glycosyl hydrolases. Structure 3: 853-859. Deutschländer M. S., Lall, N., Van de Venter, M. and Hussein, A. A. (2011). Hypoglycemic evaluation of a new triterpene and other compounds isolated from Euclea undulata thunb. Var. Myrtina (ebenaceae) root bark. Journal of Ethnopharmacology. 133: 1091-1095. Dingee J. W. and Anton, A. B. (2010). The kinetics of p-nitrophenyl-β-Dcellobioside hydrolysis and transglycosylation by Thermobifida fusca CEL5ACD. Carbohydrate Research. 345: 2507-2515. Echeverri P. A., Nieto, M. and Hernández, L. H. (2007). Formulación plan de manejo del “parque natural regional barbas-bremen”. Convenio CARDERInstituto Alexander Von Humboldt. Quindío. 111. Eltayeb E. A., Al-Ansari, A. S. and Roddick, J. G. (1997). Changes in the steroidal alkaloid solasodine during development of Solanum nigrum and Solanum incanum. Phytochemistry. 46: 489-494. 72 Emerenciano V. P., Militão, J. S. L. T., Campos, C. C., Romoff, P., Kaplan, M. A. C., Zambon, M. and Brant, A. J. C. (2001). Flavonoids as chemotaxonomic markers for Asteraceae. Biochemical Systematics and Ecology. . 29: 947-957. Ernst H. A., Lo Leggio, L., Willemoës, M., Leonard, G., Blum, P. and Larsen, S. (2006). Structure of the Sulfolobus solfataricus α-Glucosidase: Implications for domain conservation and substrate recognition in gh31. Journal of Molecular Biology. 358: 1106-1124. Farnsworth N. R. (1966). Biological and phytochemical screening of plants. Journal of Pharmaceutical Science. 55: 225-277. Feher M. and Schmidt, J. M. (2002). Property distributions: Differences between drugs, natural products, and molecules from combinatorial chemistry. Journal of Chemical Information and Computer Sciences. 43: 218-227. Fernández J. (2010). Una nueva especie de Hyptis (Labiatae) de Colombia. Anales del Jardín Botánico de Madrid. 67: 127-135. Ferreira S. B., Sodero, A. C. R., Cardoso, M. F. C., Lima, E. S., Kaiser, C. R., Silva, F. P. and Ferreira, V. F. (2010). Synthesis, biological activity, and molecular modeling studies of 1H-1,2,3-Triazole derivatives of carbohydrates as α-Glucosidases inhibitors. Journal of Medicinal Chemistry. 53: 2364-2375. Fouotsa H., Lannang, A. M., Mbazoa, C. D., Rasheed, S., Marasini, B. P., Ali, Z., Devkota, K. P., Kengfack, A. E., Shaheen, F., Choudhary, M. I. and Sewald, N. (2012). Xanthones inhibitors of α-glucosidase and glycation from Garcinia nobilis. Phytochemistry Letters. 5: 236-239. Frandsen T. P., Palcic, M. M. and Svensson, B. (2002). Substrate recognition by three family 13 yeast α-glucosidases. European Journal of Biochemistry. 269: 728-734. Fromm H. J. and Hargrove, M. S. (2012). Essentials of biochemistry. Springer. Verlag, Berlin. 53-123. Galeano M. and Bernal, R. (1993). Guía de las plantas del Parque Regional Natural Ucumarí (PRNU). Corporación Autonoma Regional de Risaralda (CARDER). Pereira. 11,14,16,39,58,90,102,116,117. 73 García C., Gil, F., Hernández, T. and Trasar, C. (2003). Técnicas de análisis de paramétros bioquímicos en suelos: Medida de actividades enzimáticas y biomasa microbiana. Primera edición. Mundi-Prensa Libros S.A. 35. Ghadamyari M., Hosseininaveh, V. and Sharifi, M. (2010). Partial biochemical characterization of α- and β-glucosidases of lesser mulberry pyralid, Glyphodes pyloalis walker (Lep.: Pyralidae). Comptes Rendus Biologies. 333: 197-204. Giannesi G. C., de Lourdes Teixeira de Moraes Polizeli, M., Terenzi, H. F. and Jorge, J. A. (2006). A novel α-glucosidase from Chaetomium thermophilum var. Coprophilum that converts maltose into trehalose: Purification and partial characterisation of the enzyme. Process Biochemistry. 41: 1729-1735. Glatz Z. (2006). Determination of enzymatic activity electrophoresis. Journal of Chromatography B. 841: 23-37. by capillary Gruenstaeudl M., Urtubey, E., Jansen, R. K., Samuel, R., Barfuss, M. H. J. and Stuessy, T. F. (2009). Phylogeny of Barnadesioideae (Asteraceae) inferred from DNA sequence data and morphology. Molecular Phylogenetics and Evolution. 51: 572-587. Guerreiro L. R., Carreiro, E. P., Fernandes, L., Cardote, T. A. F., Moreira, R., Caldeira, A. T., Guedes, R. C. and Burke, A. J. (2013). Five-membered iminocyclitol α-glucosidase inhibitors: Synthetic, biological screening and in silico studies. Bioorganic & Medicinal Chemistry. 21: 1911-1917. Guevara M. (1999). Plan de manejo Parque Regional Natural Ucumarí. Primera edición. Corporación Autonoma Regional de Risaralda (CARDER). Pereira. 1-3. Guevara M., Rey, C. and Valencia, M. (2009). El sistema regional de áreas protegidas del eje cafetero SIRAP-EC, un espacio de articulación regional para la orientación de acciones de conservación de biodiversidad y servicios ambientales. Planificando el edén Segunda edición. SIRAP Eje cafetero. Pereira. 7-14. Guimarães A. L. d. A., Bizarri, C. H. B., Barbosa, L. S., Nakamura, M. J., de Souza Ramos, M. F. and de Macêdo Vieira, A. C. (2013). Characterisation of the effects of leaf galls of Clusiamyia nitida (Cecidomyiidae) on Clusia lanceolata 74 cambess. (Clusiaceae): Anatomical aspects and chemical analysis of essential oil. Flora - Morphology, Distribution, Functional Ecology of Plants. 208: 165173. Guo L.-P., Jiang, T.-F., Lv, Z.-H. and Wang, Y.-H. (2010). Screening αglucosidase inhibitors from traditional chinese drugs by capillary electrophoresis with electrophoretically mediated microanalysis. Journal of Pharmaceutical and Biomedical Analysis. 53: 1250-1253. Gurib-Fakim A. (2006). Medicinal plants: Traditions of yesterday and drugs of tomorrow. Molecular Aspects of Medicine. 27: 1-93. Ha T. J., Lee, J. H., Lee, M.-H., Lee, B. W., Kwon, H. S., Park, C.-H., Shim, K.-B., Kim, H.-T., Baek, I.-Y. and Jang, D. S. (2012). Isolation and identification of phenolic compounds from the seeds of Perilla frutescens (L.) and their inhibitory activities against α-glucosidase and aldose reductase. Food Chemistry. 135: 1397-1403. Harborne J. B. (1998). Phytochemical methods. A guide to moder techniques of plant analysis. Third editon. Springer. India. 2-263. Hasegawa G., Kajiyama, S., Tanaka, T., Imai, S., Kozai, H., Fujinami, A., Ohta, M., Obayashi, H., Park, H., Nakano, K., Tanaka, M., Shiraishi, E., Fukui, M., Yoshikawa, T. and Nakamura, N. (2008). The α-glucosidase inhibitor acarbose reduces the net electronegative charge of low-density lipoprotein in patients with newly diagnosed type 2 diabetes. Clinica Chimica Acta. 390: 110-114. Heneidak S., Grayer, R. J., Kite, G. C. and Simmonds, M. S. J. (2006). Flavonoid glycosides from Egyptian species of the tribe Asclepiadeae (Apocynaceae, subfamily Asclepiadoideae). Biochemical Systematics and Ecology. 34: 575584. Henrissat B. and Bairoch, A. (1993). New families in the classification of glycosyl hydrolases based on amino acid sequence similarities. The biochemical journal. 293 781-788. Huang G.-J., Hsieh, W.-T., Chang, H.-Y., Huang, S.-S., Lin, Y.-C. and Kuo, Y.-H. (2011). Alpha Glucosidase and aldose reductase inhibitory activities from the 75 fruiting body of Phellinus merrillii. Journal of Agricultural and Food Chemistry. 59: 5702-5706. Huang J., Guo, Z.-h., Cheng, P., Sun, B.-h. and Gao, H.-Y. (2012). Three new triterpenoids from Salacia hainanensis Chun et how showed effective anti-αglucosidase activity. Phytochemistry Letters. 5: 432-437. Jaramillo J., Rodriguez, V., Guzman, M., Zapata, M. and Rengifo, T. (2007). Manual técnico buenas prácticas agrícolas –bpa- en la producción de tomate bajo condiciones protegidas. Primera edición. FAO (Organización de las Naciones Unidas para la Alimentación y la Agricultura). Colombia, Medellín. 7190. Jaramillo L. M. (1987). Fundamentos de la separación y purificación de comuestos orgánicos por métodos de distribución entre fases. Primera edición. Universidad del Valle. Cali, Valle. 61-79. Jürgens A., Dötterl, S., Liede-Schumann, S. and Meve, U. (2008). Chemical diversity of floral volatiles in Asclepiadoideae-Asclepiadeae (Apocynaceae). Biochemical and Systematics and Ecology. 36: 842-852. Kakavanos R., Hopwood, J. J., Lang, D., Meikle, P. J. and Brooks, D. A. (2006). Stabilising normal and mis-sense variant α-glucosidase. FEBS Letters. 580: 4365-4370. Kargi F. (2009). Generalized rate equation for single-substrate enzyme catalyzed reactions. Biochemical and Biophysical Research Communications. 382: 157-159. Kay K., Reeves, P., Olmstead, R. and Schemeske, D. (2005). Rapid speciation and the evolution of humminngbird pollination in neotropical Costus sungenus Costus (Costaceae): Evidence from NR-DNA ITS and ETS sequiences. American Journal of Botany. 92: 1899-1910. Kent J. A. (2012). Handbook of industrial chemistry and biotechnology. twelfth edition. Springer. United States, New york. 1180-1183. Khosla C. (2000). Natural product biosynthesis: A new interface between enzymology and medicine. The Journal of Organic Chemistry. 65: 8127-8133. 76 Kim J.-S., Hyun, T. K. and Kim, M.-J. (2011). The inhibitory effects of ethanol extracts from sorghum, foxtail millet and proso millet on α-glucosidase and αamylase activities. Food Chemistry. 124: 1647-1651. Kim J.-S., Kwon, Y.-S., Chun, W.-J., Kim, T.-Y., Sun, J., Yu, C.-Y. and Kim, M.-J. (2010). Rhus verniciflua Stokes flavonoid extracts have anti-oxidant, antimicrobial and α-glucosidase inhibitory effect. Food Chemistry. 120: 539-543. Kim K. Y., Nam, K. A., Kurihara, H. and Kim, S. M. (2008). Potent α-glucosidase inhibitors purified from the red alga Grateloupia elliptica. Phytochemistry. 69: 2820-2825. Kim Y.-M., Okuyama, M., Mori, H., Nakai, H., Saburi, W., Chiba, S. and Kimura, A. (2005). Enzymatic synthesis of alkyl α-2-deoxyglucosides by alkyl alcohol resistant α-glucosidase from Aspergillus niger. Tetrahedron: Asymmetry. 16: 403-409. Kinsella B. T., Stephane Hogan, Larkin, A. and Cantwell, B. A. (1991). Primary structure and processing of the candida tsukubaensis alpha glucosidase: Homology with the rabbit intestinal sucrase-isomaltase complex and human lysosomal alpha glucosidase. European Journal of biochemistry. 202: 657-664. Komatsu T., Hanaoka, K., Adibekian, A., Yoshioka, K., Terai, T., Ueno, T., Kawaguchi, M., Cravatt, B. F. and Nagano, T. (2013). Diced electrophoresis gel assay for screening enzymes with specified activities. Journal of the American Chemical Society. 135: 6002-6005. Kumar D., Shah, V., Ghosh, R. and Pal, B. C. (2013). A new triterpenoind saponin from Glinus oppositifolius with alpha glucosidase inhibitory activity. Natural Product Research. 27: 624-630. Kuntz D. A., Tarling, C. A., Withers, S. G. and Rose, D. R. (2008). Structural analysis of golgi α-mannosidase II inhibitors identified from a focused glycosidase inhibitor screen. Biochemistry. 47: 10058-10068. Kurakata Y., Uechi, A., Yoshida, H., Kamitori, S., Sakano, Y., Nishikawa, A. and Tonozuka, T. (2008). Structural insights into the substrate specificity and function of Escherichia coli K12 YGJK, a Glucosidase belonging to the glycoside hydrolase family 63. Journal of Molecular Biology. 381: 116-128. 77 Lavaud A., Soleti, R., Hay, A.-E., Richomme, P., Guilet, D. and Andriantsitohaina, R. (2012). Paradoxical effects of polyphenolic compounds from Clusiaceae on angiogenesis. Biochemical Pharmacology. 83: 514-523. Lee M.-H., Kim, Y.-W., Kim, T.-J., Park, C.-S., Kim, J.-W., Moon, T.-W. and Park, K.-H. (2002). A novel amylolytic enzyme from Thermotoga maritima, resembling cyclodextrinase and α-glucosidase, that liberates glucose from the reducing end of the substrates. Biochemical and Biophysical Research Communications. 295: 818-825. Liu L., Deseo, M. A., Morris, C., Winter, K. M. and Leach, D. N. (2011). Investigation of α-glucosidase inhibitory activity of wheat bran and germ. Food Chemistry. 126: 553-561. Liu T., Yip, Y. M., Song, L., Feng, S., Liu, Y., Lai, F., Zhang, D. and Huang, D. (2013). Inhibiting enzymatic starch digestion by the phenolic compound diboside a: A mechanistic and in silico study. Food Research International. 54: 595-600. López S. N., Lopes, A. A., Batista Jr, J. M., Flausino Jr, O., Bolzani, V. d. S., Kato, M. J. and Furlan, M. (2010). Geranylation of benzoic acid derivatives by enzymatic extracts from Piper crassinervium (Piperaceae). Bioresource Techology. 101: 4251-4260. Lordan S., Smyth, T. J., Soler-Vila, A., Stanton, C. and Ross, R. P. (2013). The α-amylase and α-glucosidase inhibitory effects of irish seaweed extracts. Food Chemistry. 141: 2170-2176. Luo J.-G., Ma, L. and Kong, L.-Y. (2008). New triterpenoid saponins with strong α-glucosidase inhibitory activity from the roots of Gypsophila oldhamiana. Bioorganic & Medicinal Chemistry. 16: 2912-2920. Łysek R., Schütz, C., Favre, S., O’Sullivan, A. C., Pillonel, C., Krülle, T., Jung, P. M. J., Clotet-Codina, I., Esté, J. A. and Vogel, P. (2006). Search for αglucosidase inhibitors: New N-substituted valienamine and conduramine F-1 derivatives. Bioorganic & Medicinal Chemistry. 14: 6255-6282. Marti G., Eparvier, V., Moretti, C., Susplugas, S., Prado, S., Grellier, P., Retailleau, P., Guéritte, F. and Litaudon, M. (2009). Antiplasmodial 78 benzophenones from the trunk latex of Moronobea coccinea (Clusiaceae). Phytochemistry. 70: 75-85. Matsui Y., Sugiyama, K., Kamei, M., Takahashi, T., Suzuki, T., Katagata, Y. and Ito, T. (2010). Extract of passion fruit (Passiflora edulis) seed containing high amounts of piceatannol inhibits melanogenesis and promotes collagen synthesis. Journal of Agricultural and Food Chemistry. 58: 11112-11118. McChesney J. D., Venkataraman, S. K. and Henri, J. T. (2007). Plant natural products: Back to the future or into extinction? Phytochemistry. 68: 20152022. Mehta A., Zitzmann, N., Rudd, P. M., Block, T. M. and Dwek, R. A. (1998). Alpha Glucosidase inhibitors as potential broad based anti-viral agents. FEBS Letters. 430: 17-22. Moorthy N. S. H. N., Ramos, M. J. and Fernandes, P. A. (2011). Structural analysis of α-glucosidase inhibitors by validated QSAR models using topological and hydrophobicity based descriptors. Chemometrics and Intelligent Laboratory Systems. 109: 101-112. Moreland R. J., Higgins, S., Zhou, A., VanStraten, P., Cauthron, R. D., Brem, M., McLarty, B. J., Kudo, M. and Canfield, W. M. (2012). Species-specific differences in the processing of acid α-glucosidase are due to the amino acid identity at position 201. Gene. 491: 25-30. Motabar O., Shi, Z.-D., Goldin, E., Liu, K., Southall, N., Sidransky, E., Austin, C. P., Griffiths, G. L. and Zheng, W. (2009). A new resorufin-based α-glucosidase assay for high-throughput screening. Analytical Biochemistry. 390: 79-84. Mukhtar M., Arshad, M., Ahmad, M., Pomerantz, R. J., Wigdahl, B. and Parveen, Z. (2008). Antiviral potentials of medicinal plants. Virus Research. 131: 111120. Murillo J. (2001). Las Annonaceae de Colombia. Biota Colombiana. 2: 49-58. Murray P., Aro, N., Collins, C., Grassick, A., Penttilä, M., Saloheimo, M. and Tuohy, M. (2004). Expression in trichoderma reesei and characterisation of a 79 thermostable family 3 β-glucosidase from the moderately thermophilic fungus talaromyces emersonii. Protein Expression and Purification. 38: 248-257. Naik S. R. and Kokil, G. R. (2013). Chapter 12 - Development and discovery avenues in bioactive natural products for glycemic novel therapeutics. Book. Chapter 12 - Development and discovery avenues in bioactive natural products for glycemic novel therapeutics. Elsevier. Volume 39. 431-466. Nakai H., Ito, T., Hayashi, M., Kamiya, K., Yamamoto, T., Matsubara, K., Kim, Y.M., Jintanart, W., Okuyama, M., Mori, H., Chiba, S., Yoshio Sano and Kimura, A. (2007). Multiple forms of a-glucosidase in rice seeds (Oryza sativa L., var nipponbare). Biochimie 89: 49-62. Narender T., Madhur, G., Jaiswal, N., Agrawal, M., Maurya, C. K., Rahuja, N., Srivastava, A. K. and Tamrakar, A. K. (2013). Synthesis of novel triterpene and N-allylated/N-alkylated niacin hybrids as α-glucosidase inhibitors. European Journal of Medicinal Chemistry. 63: 162-169. Nieto M. and Londoño, E. (2006). Área protegida de carácter regional BarbaBremen. Corpración Autónoma Regional de Risaralda (CARDER). Pereira. 6-19. Nimpiboon P., Nakapong, S., Pichyangkura, R., Ito, K. and Pongsawasdi, P. (2011). Synthesis of a novel prebiotic trisaccharide by a type I α-glucosidase from B. licheniformis strain TH4-2. Process Biochemistry. 46: 448-457. Niño J., Espinal, C. M., Mosquera, O. M. and Correa, Y. M. (2003). Antymycotic activity of 20 plants from Colombian flora. Pharmaceutical Biology. 41: 491496. Niño J., Mosquera, O. M., Correa, Y. M., Victoria, P. A. and Espinal, C. M. (2002). Evaluación preliminar de la actividad biológica y tamizados fitoquímicos de cincuenta plantas del Parque Regional Natural Ucumarí. Scientia et Technica. 19: 151-157. Niño J. O., Bustamante, A. M., Correa, Y. M. and Mosquera, O. M. (2007). Evaluación de extractos vegetales para el control de la broca del café (Hypothenemus hampei, FERRARI). Scientia et Technica. 13: 838-385. 80 Nurok D., Kleyl, R. M., Muhoberac, B. B., Frost, M. C., Hajdu, P., Robertson, D. H., Kamat, S. V. and Russell, A. J. (1999). Study of enzyme-catalyzed reactions in organic solvents using multiple linear regression. Journal of Molecular Catalysis B: Enzymatic 7: 273-282. Oboh G., Ademiluyi, A. O., Akinyemi, A. J., Henle, T., Saliu, J. A. and Schwarzenbolz, U. (2012). Inhibitory effect of polyphenol-rich extracts of jute leaf (Corchorus olitorius) on key enzyme linked to type 2 diabetes (αamylase and α-glucosidase) and hypertension (angiotensin i converting) In vitro. Journal of Functional Foods. 4: 450-458. Oh S.-W. and Kang, D.-H. (2004). Fluorogenic selective and differential medium for isolation of Enterobacter sakazakii. Applied and Environmental Microbiology. 70: 5692-5694. Ojima I. (2008). Modern natural products chemistry and drug discovery. Journal of Medicinal Chemistry. 51: 2587-2588. Okuyama M., Tanimoto, Y., Ito, T., Anzai, A., Mori, H., Kimura, A., Matsui, H. and Chiba, S. (2005). Purification and characterization of the hyperglycosylated extracellular α-glucosidase from Schizosaccharomyces pombe. Enzyme and Microbial Technology. 37: 472-480. Oliveira da Silva A. C., Morais de Oliveira, A. F., Alves Cursino dos Santos, D. Y. and Izídio da Silva, S. (2010). An approach to chemotaxonomy to the fatty acid content of some Malvaceae species. Biochemical Systematics and Ecology. 38: 1035-1038. Orhan N., MustafaAslan, Süküroglu, M. and Orhan, D. D. (2013). In vivo and In vitro anti-diabetic effect of Cistus laurifolius L. And detection of major phenolic compounds by uplc–tof-ms analysis. Journal of Ethnopharmacology. 146: 859-865. Ota M., Okamoto, T., Hoshino, W. and Wakabayashi, H. (2009). Action of α -dglucosidase from Aspergillus niger towards dextrin and starch. Carbohydrate Polymers. 78: 287-291. Pandey J., Dwivedi, N., Singh, N., Srivastava, A. K., Tamarkar, A. and Tripathi, R. P. (2007). Diastereoselective synthesis of glycosylated prolines as α 81 glucosidase inhibitors and organocatalyst in asymmetric aldol reaction. Bioorganic & Medicinal Chemistry Letters. 17: 1321-1325. Pérez J., Eeckenbrugge, G., Restrepo, M., Jarvis, A., Salazar, M. and Cayetano, C. (2007). Diversity of Colombian Passifloraceae: Biogeography and an updated list for conservation. Biota Colombiana. 8: 1-45. Phuwapraisirisan P., Puksasook, T., Jong-aramruang, J. and Kokpol, U. (2008). Phenylethyl cinnamides: A new series of α-glucosidase inhibitors from the leaves of Aegle marmelos. Bioorganic & Medicinal Chemistry Letters. 18: 49564958. Powell R. G. (2009). Plant seeds as sources of potential industrial chemicals, pharmaceuticals, and pest control agents. Journal of Natural Products. 72: 516-523. Prabhakar Reddy P., Tiwari, A. K., Ranga Rao, R., Madhusudhana, K., Rama Subba Rao, V., Ali, A. Z., Suresh Babu, K. and Madhusudana Rao, J. (2009). New labdane diterpenes as intestinal α-glucosidase inhibitor from antihyperglycemic extract of Hedychium spicatum (Ham. Ex Smith) rhizomes. Bioorganic & Medicinal Chemistry Letters. 19: 2562-2565. Quílez A., Berenguer, B., Gilardoni, G., Souccar, C., de Mendonça, S., Oliveira, L. F. S., Martín-Calero, M. J. and Vidari, G. (2010). Anti-secretory, antiinflammatory and anti-Helicobacter pylori activities of several fractions isolated from Piper carpunya ruiz & pav. Journal of Ethnopharmacology. 128: 583-589. Rahman A. U., Choudhary, M. I. and Thomson, W. J. (2005). Bioassay techniques for drug development. First edition. Taylor and Francis, e-Library. United Kingdom. 103-196. Raizada R. B., Srivastava, M. K., Kaushal, R. A. and Singh, R. P. (2001). Azadirachtin, a Neem biopesticide: Subchronic toxicity assessment in rats. Food and Chemical Toxicology. 39: 477-483. Raju B. C., Tiwari, A. K., Kumar, J. A., Ali, A. Z., Agawane, S. B., Saidachary, G. and Madhusudana, K. (2010). Alpha glucosidase inhibitory antihyperglycemic 82 activity of substituted chromenone derivatives. Bioorganic & Medicinal Chemistry. 18: 358-365. Ramzi S. and Hosseininaveh, V. (2010). Biochemical characterization of digestive α-amylase, α-glucosidase and β-glucosidase in pistachio green stink bug, Brachynema germari kolenati (Hemiptera: Pentatomidae). Journal of AsiaPacific Entomology. 13: 215-219. Ranga Rao R., Tiwari, A. K., Prabhakar Reddy, P., Suresh Babu, K., Ali, A. Z., Madhusudana, K. and Madhusudana Rao, J. (2009). New furanoflavanoids, intestinal α-glucosidase inhibitory and free-radical (DPPH) scavenging, activity from antihyperglycemic root extract of derris indica (lam.). Bioorganic & Medicinal Chemistry. 17: 5170-5175. Rangel J. (2006). La biodiversidad de Colombia. Palinpesto. 5: 292-394. Rao S. A., Srinivas, P. V., Tiwari, A. K., Vanka, U. M. S., Rao, R. V. S., Dasari, K. R. and Rao, M. J. (2007). Isolation, characterization and chemobiological quantification of α-glucosidase enzyme inhibitory and free radical scavenging constituents from derris scandens benth. Journal of Chromatography B. 855: 166-172. Rubilar M. n., Jara, C., Poo, Y., Acevedo, F., Gutierrez, C., Sineiro, J. and Shene, C. (2011). Extracts of maqui (Aristotelia chilensis) and murta (Ugni molinae turcz.): Sources of antioxidant compounds and α-Glucosidase/αamylase inhibitors. Journal of Agricultural and Food Chemistry. 59: 1630-1637. Ryu H. W., Lee, B. W., Curtis-Long, M. J., Jung, S., Ryu, Y. B., Lee, W. S. and Park, K. H. (2009). Polyphenols from Broussonetia papyrifera displaying potent α-Glucosidase inhibition. Journal of Agricultural and Food Chemistry. 58: 202208. Sacher O., Reitz, M. and Gasteiger, J. (2009). Investigations of enzymecatalyzed reactions based on physicochemical descriptors applied to hydrolases. Journal of Chemical Information and Modeling. 49: 1525-1534. Salinas N., Clavijo, L. and Betancour, J. (2007). Una nueva especie de Costus (Costaceae) de la amazonia colombiana. Caldasia. 29: 195-201. 83 Sánchez F. and Cantalejo, J. (2010). Síntesis esteroselectiva de hiacitacinas naturales y análogas no naturales. Tesis doctoral. Universidad de Granada. Departamento de Química Farmacéutica y Orgánica. Granada, España. 1-151. Sawkar A. R., Schmitz, M., Zimmer, K.-P., Reczek, D., Edmunds, T., Balch, W. E. and Kelly, J. W. (2006). Chemical chaperones and permissive temperatures alter the cellular localization of gaucher disease associated glucocerebrosidase variants. ACS Chemical Biology. 1: 235-251. Scott I. M., Puniani, E., Jensen, H., Livesey, J. F., Poveda, L., Sanchez-Vindas, P., Durst, T. and Arnason, J. T. (2005). Analysis of Piperaceae germplasm by HPLC and LCMS: A method for isolating and identifying unsaturated amides from Piper spp extracts. Journal of Agricultural and Food Chemistry. 53: 1907-1913. Segel I. H. (1976). Biochemical calculatios. How to solve mathematical problems in general biochemistry. Second edition. John Wiley & Sons. Ney york. 208-320. Shai L. J., Masoko, P., Mokgotho, M. P., Magano, S. R., Mogale, A. M., Boaduo, N. and Eloff, J. N. (2010). Yeast alpha glucosidase inhibitory and antioxidant activities of six medicinal plants collected in phalaborwa, South Africa. South African Journal of Botany. 76: 465-470. Shang Q., Jun-FengXiang and Ya-LinTang. (2012). Screening alpha glucosidase inhibitors from mulberry extracts via DOSY and relaxation-edited NNR. Talanta 97: 362-367. Shen Q., Shao, J., Peng, Q., Zhang, W., Ma, L., Chan, A. S. C. and Gu, L. (2010). Hydroxycoumarin derivatives: Novel and potent α-Glucosidase inhibitors. Journal of Medicinal Chemistry. 53: 8252-8259. Simmonds M. S. J. (2006). Chapter 13 the search for plant-derived compounds with antifeedant activity. Book. Chapter 13 the search for plant-derived compounds with antifeedant activity. Elsevier. Volume 3. 291-324. Skoog D. A., Holler, F. J., Crouch, S. R. and Anzures, M. B. (2008). Principios de análisis instrumental. Sexta edición. Cengage Learning. Madrid, España. 118. 84 Staniszewski M. (2009). Theoretical analysis of inhibition effect on steady states of enzymatic membrane reactor with substrate and product retention for reaction producing weak acid. Desalination. 249: 1190-1198. Tagami T., Okuyama, M., Nakai, H., Kim, Y.-M., Mori, H., Taguchi, K., Svensson, B. and Kimura, A. (2013). Key aromatic residues at subsites +2 and +3 of glycoside hydrolase family 31 α-glucosidase contribute to recognition of longchain substrates. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1834: 329-335. Takaku S., Haber, W. A. and Setzer, W. N. (2007). Leaf essential oil composition of 10 species of Ocotea (Lauraceae) from Monteverde, Costa Rica. Biochemical Systematics and Ecology. 35: 525-532. Tiwari A. K., Kumbhare, R. M., Agawane, S. B., Ali, A. Z. and Kumar, K. V. (2008). Reduction in post-prandial hyperglycemic excursion through αglucosidase inhibition by β-acetamido carbonyl compounds. Bioorganic & Medicinal Chemistry Letters. 18: 4130-4132. Trapero A. and Llebaria, A. (2012). A prospect for pyrrolidine iminosugars as antidiabetic α-Glucosidase inhibitors. Journal of Medicinal Chemistry. 55: 10345-10346. Trease G. (2009). Trease and evans pharmacognosy. Sixteenth edition. El Servier. London. 23-39. Vatanparast M., Hosseininaveh, V., Ghadamyari, M. and Sajjadian, S. M. (2012). Pectinase and cellulase activity in the digestive system of the elm leaf beetle, Xanthogaleruca luteola Muller (Coleoptera: Chrysomelidae). Journal of AsiaPacific Entomology. 15: 555-561. vintessential. (2013). Automation in the wine laboratory. [22 de octubre de 2013]. http://www.vintessential.com.au/resources/articles/automation-in-thewine-laboratory.html. Vitalini S., Tomè, F. and Fico, G. (2009). Traditional uses of medicinal plants in valvestino (Italy). Journal of Ethnopharmacology. 121: 106-116. 85 Wagner H. and Bladt, S. (1996). Plant drug analysis: A thin layer chromatography atlas. Book. Plant drug analysis: A thin layer chromatography atlas. Springer. Wan C., Yuan, T., Li, L., Kandhi, V., Cech, N. B., Xie, M. and Seeram, N. P. (2012). Maplexins, new α-glucosidase inhibitors from red maple (Acer rubrum) stems. Bioorganic & Medicinal Chemistry Letters. 22: 597-600. Wang S., Yan, J., Wang, X., Yang, Z., Lin, F. and Zhang, T. (2010). Synthesis and evaluation of the α-glucosidase inhibitory activity of 3-[4(phenylsulfonamido)benzoyl]-2H-1-benzopyran-2-one derivatives. European Journal of Medicinal Chemistry. 45: 1250-1255. Wang Y., Huang, S., Shao, S., Qian, L. and Xu, P. (2012). Studies on bioactivities of tea (Camellia sinensis L.) fruit peel extracts: Antioxidant activity and inhibitory potential against α-glucosidase and α-amylase in vitro. Industrial Crops and Products. 37: 520-526. Watanabe K., Hata, Y., Kizaki, H., Katsube, Y. and Suzuki, Y. (1997). The refined crystal structure of Bacillus cereus oligo-1,6-glucosidase at 2.0 å resolution: Structural characterization of proline-substitution sites for protein thermostabilization. Journal of Molecular Biology. 269: 142-153. Watanabe S., Kakudo, A., Ohta, M., Mita, K., Fujiyama, K. and Inumaru, S. (2013). Molecular cloning and characterization of the α-glucosidase II from Bombyx mori and Spodoptera frugiperda. Insect Biochemistry and Molecular Biology. 43: 319-327. Wink M. (2003). Evolution of secondary metabolites from an ecological and molecular phylogenetic perspective. Phytochemistry. 64: 3-19. Wrodnigg T. M., Stütz, A. E., Tarling, C. A. and Withers, S. G. (2006). Fine tuning of β-glucosidase inhibitory activity in the 2,5-dideoxy-2,5-imino-Dmannitol (DMDP) system. Carbohydrate Research. 341: 1717-1722. Xie W., Tanabe, G., Akaki, J., Morikawa, T., Ninomiya, K., Minematsu, T., Yoshikawa, M., Wu, X. and Muraoka, O. (2011). Isolation, structure identification and sar studies on thiosugar sulfonium salts, neosalaprinol and 86 neoponkoranol, as potent α-glucosidase inhibitors. Bioorganic & Medicinal Chemistry. 19: 2015-2022. Xu H.-W., Dai, G.-F., Liu, G.-Z., Wang, J.-F. and Liu, H.-M. (2007). Synthesis of andrographolide derivatives: A new family of α-glucosidase inhibitors. Bioorganic & Medicinal Chemistry. 15: 4247-4255. Yamamoto T., Unno, T., Watanabe, Y., Yamamoto, M., Okuyama, M., Mori, H., Chiba, S. and Kimura, A. (2004). Purification and characterization of Acremonium implicatum α-glucosidase having regioselectivity for α-1,3glucosidic linkage. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1700: 189-198. Yao X., Mauldin, R. and Byers, L. (2003). Multiple sugar binding sites in α glucosidase. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1645: 22-29. Yasunaka K., Abe, F., Nagayama, A., Okabe, H., Lozada-Pérez, L., LópezVillafranco, E., Muñiz, E. E., Aguilar, A. and Reyes-Chilpa, R. (2005). Antibacterial activity of crude extracts from mexican medicinal plants and purified coumarins and xanthones. Journal of Ethnopharmacology. 97: 293299. Yoshida T., Ito, H., Yoshimura, M., Miyashita, K. and Hatano, T. (2008). Cglucosidic ellagitannin oligomers from Melaleuca squarrosa donn ex sm., Myrtaceae. Phytochemistry. 69: 3070-3079. Yoshimizu M., Tajima, Y., Matsuzawa, F., Aikawa, S.-i., Iwamoto, K., Kobayashi, T., Edmunds, T., Fujishima, K., Tsuji, D., Itoh, K., Ikekita, M., Kawashima, I., Sugawara, K., Ohyanagi, N., Suzuki, T., Togawa, T., Ohno, K. and Sakuraba, H. (2008). Binding parameters and thermodynamics of the interaction of imino sugars with a recombinant human acid α-glucosidase (glucosidase alfa): Insight into the complex formation mechanism. Clinica Chimica Acta. 391: 68-73. Zavada M. S. and Lowrey, T. K. (2010). Comparative pollen morphology of Brachylena, Tarchananthus and two species of Tubulifloridites (Asteraceae) from the Eocene, Knysna Lignite of South Africa. Review of Palaeobotany and Palynology. 162: 183-192. 87 Zeng Y.-F., Lü, Z.-R., Yan, L., Oh, S., Yang, J.-M., Lee, J. and Ye, Z. M. (2012). Towards alpha-glucosidase folding induced by trifluoroethanol: Kinetics and computational prediction. Process Biochemistry. 47: 2284-2290. Zhang A., Sun, H. and Wang, X. (2013). Recent advances in natural products from plants for treatment of liver diseases. European Journal of Medicinal Chemistry. 63: 570-577. Zhang W. and Tang, Y. (2008). Combinatorial biosynthesis of natural products. Journal of Medicinal Chemistry. 51: 2629-2633. Zhou W., Nguyen, H. T. and Nes, W. D. (2008). Plant sterol methyltransferases: Phytosterolomic analysis, enzymology, and bioengineering strategies. Book. Plant sterol methyltransferases: Phytosterolomic analysis, enzymology, and bioengineering strategies. Pergamon. Volume 1. 241-281. 88 ANEXOS 89 Anexo 1. Metodología de la obtención de los extractos crudos de n-hexano, diclorometano y metanol (Niño et al., 2007). Material vegetal Secar el material vegetal en estufa a 50 °C por 48 horas Moler Pesar 300g de material vegetal seco y molido (Someter a extracción por lixiviación durante 48 horas con n-hexano) x3 Filtrar Extracto de n-hexano Marco vegetal (Extraer con diclorometano por lixiviación durante 48 horas) x3 Filtrar Marco vegetal Extracto de diclorometano (Extraer con metanol por lixiviación durante 48 horas) x3 Filtrar Eliminar marco vegetal Extracto de metanol Concentrar cada extracto en rotaevaporador a 50 °C hasta sequedad Almacenar los extractos crudos a -10°C 90 Anexo 2. Procedimiento de la caracterización fitoquímica de los extractos crudos por cromatografía de capa delgada (Wagner and Bladt, 1996). Seleccione 5 plantas de estudio aleatoriamente y buscar las mismas en cada tipo de extracto: n-hexano, diclorometano y metanol y preparar una soluciones madre de 10000 ppm a partir de sus extractos crudos Encontrar el sistema de adecuado para cada tipo de extracto Mantener el ambiente libre de humedad usando un secador Sembrar los extractos en cromatoplacas de sílica gel 60 F254 (5 cm X 10 cm) junto con el patrón del núcleo fitoquímico que se requiera caracterizar Eluir las respectivas cromatoplacas con el sistema de solventes que se encontró para cada tipo de extracto Revelar las placas (inmersión o spray) usando el reactivo que permita la detección del núcleo fitoquímico objeto de investigación Observar en luz ultravioleta (λ=254 nm y λ=365 nm) en caso de ser necesario 91 Anexo 3. Resultados de la caracterización fitoquímica de los extractos crudos den-hexano, diclorometano y metanol por CCD. METABOLITOS SECUNDARIOS FAMILIA Annonaceae ESPECIE Guatteria petiolata Apocynaceae Mandevila veraguensis Asclepiadaceae Blepharodon grandifolium Calea angosturana Asteraceae Clivadium asperum UTP Nº EXTRACTO (10000 ppm) ALCALOIDES CUMARINAS ESTEROIDES Y/O SAPONINAS ESTEROIDALES n-Hexano - +++ 198 Diclorometano - - Metanol - n-Hexano 200 201 95 191 Clivadium sp 89 (-) Ausente DI-TRI-TERPÉNOS Y/O SAPONINAS TRI-TERPÉNICAS ESTEROLES ++ - +++ - ++ ++ - ++ + + - - - ++ +++ Diclorometano - - - ++ - Metanol - +++ ++ + ++ n-Hexano - - - ++ - Diclorometano - - - ++ - Metanol - - ++ + ++ ++ n-Hexano - ++ ++ - Diclorometano - - - ++ - Metanol - - ++ ++ + ++ n-Hexano - +++ ++ ++ Diclorometano - - +++ ++ - Metanol - - +++ ++ + n-Hexano - - - ++ ++ Diclorometano - - ++ ++ - Metanol - ++ ++ + + Reveladores Dragendorff Patrones (300 ppm) Papaverina KOH al 5% en etanol absoluto 7-Hidroxi cumarina (+)Presente Liebermann- Burchard β-estradiol, Colesterol, Diosgenina, Estigmasterol, Hecogenina, Lanosterol, Lupeol (++)Moderado 92 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA Asteraceae ESPECIE Munnzonia hastifolia Pentacalia sp Clusiaceae Chrysoclamys floribunda Vismia laevis Costaceae Euphorbiaceae (-) Ausente Costus sp Acalypha diversifolia UTP Nº 190 96 180 184 187 62 EXTRACTO (10000 ppm) ALCALOIDES CUMARINAS ESTEROIDES Y/O SAPONINAS ESTEROIDALES DI-TRI-TERPÉNOS Y/O SAPONINAS TRI-TERPÉNICAS ESTEROLES n-Hexano - - - ++ Diclorometano - - - +++ - Metanol - - +++ ++ + n-Hexano - - - ++ ++ Diclorometano - - - ++ - Metanol - - ++ + ++ ++ n-Hexano - + +++ - +++ Diclorometano - - - ++ ++ Metanol - + + ++ ++ n-Hexano - ++ ++ ++ ++ Diclorometano - - +++ ++ ++ Metanol - - ++ ++ ++ n-Hexano - ++ - ++ ++ Diclorometano - - - ++ - Metanol - - + + + ++ n-Hexano - - ++ - Diclorometano - + - ++ - Metanol - - + ++ + Reveladores Dragendorff Patrones (300 ppm) Papaverina KOH al 5% en Liebermann- Burchard etanol absoluto 7-Hidroxi cumarina (+)Presente β-estradiol, Colesterol, Diosgenina, Estigmasterol, Hecogenina, Lanosterol, Lupeol (++)Moderado 93 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIO FAMILIA ESPECIE Acalypha macrostachya Alchornea grandis UTP Nº 196 202 Euphorbiaceae Hyeronima sp Hyeronima sp Mavea sp Lamiaceae (-) Ausente Salvia Scutellarioides 85 104 92 186 EXTRACTO (10000 ppm) ALCALOIDES CUMARINAS ESTEROIDES Y/O SAPONINAS ESTEROIDALES DI-TRI-TERPÉNOS Y/O SAPONINAS TRI-TERPÉNICAS ESTEROLES n-Hexano - - ++ ++ Diclorometano - - ++ + - Metanol - - ++ ++ ++ n-Hexano - - ++ ++ +++ Diclorometano - - +++ ++ - Metanol - + + + + ++ +++ n-Hexano - - ++ + Diclorometano - - - ++ - Metanol - + + + + n-Hexano - ++ - ++ ++ Diclorometano - - - ++ ++ Metanol - + ++ + + n-Hexano - - ++ + ++ Diclorometano - - ++ ++ - Metanol - + + + ++ n-Hexano - - - ++ +++ Diclorometano - - + + - Metanol - - + + + Reveladores Dragendorff Patrones (300 ppm) Papaverina KOH al 5% en etanol absoluto 7-Hidroxi cumarina (+)Presente Liebermann- Burchard β-estradiol, Colesterol, Diosgenina, Estigmasterol, Hecogenina, Lanosterol, Lupeol (++)Moderado 94 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA ESPECIE Ocotea insulares Lauraceae Ocotea paulii Nectandra acutifolia Nectandra lineatifolia Malvaceae Melastomataceae (-) Ausente Pavonea septioides Miconia sp UTP Nº 176 179 177 178 181 73 ESTEROIDES Y/O SAPONINAS ESTEROIDALES DI-TRI-TERPÉNOS Y/O SAPONINAS TRI-TERPÉNICAS - - ++ ++ - ++ ++ ++ EXTRACTO (10000 ppm) ALCALOIDES CUMARINAS n-Hexano - Diclorometano - ESTEROLES Metanol - + - + + n-Hexano +++ - - ++ ++ Diclorometano +++ - ++ ++ + Metanol +++ - ++ ++ + n-Hexano - - ++ ++ ++ Diclorometano - - - ++ ++ Metanol - + - ++ + n-Hexano - - - ++ ++ Diclorometano - - - ++ ++ Metanol - + - ++ + n-Hexano - - ++ ++ ++ Diclorometano - - ++ ++ ++ + Metanol - - ++ ++ n-Hexano - - ++ ++ + Diclorometano - - ++ ++ ++ Metanol - - - + + Reveladores Dragendorff Patrones (300 ppm) Papaverina KOH al 5% en etanol absoluto 7-Hidroxi cumarina (+)Presente Liebermann- Burchard β-estradiol, Colesterol, Diosgenina, Estigmasterol, Hecogenina, Lanosterol, Lupeol (++)Moderado 95 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA Melastomataceae ESPECIE Tibouchina lepidota Passiflora danielii Passifloraceae Passiflora rubra Piper calceolarium Piperaceae Piper crassinervium Piper danieliigonzalezii (-) Ausente UTP Nº 185 182 183 194 175 197 EXTRACTO (10000 ppm) ALCALOIDES CUMARINAS ESTEROIDES Y/O SAPONINAS ESTEROIDALES DI-TRI-TERPÉNOS Y/O SAPONINAS TRI-TERPÉNICAS ESTEROLES n-Hexano - - ++ + ++ Diclorometano - - ++ + ++ + Metanol +++ + ++ ++ n-Hexano - - - ++ + Diclorometano - - ++ Metanol - - - ++ + n-Hexano - - - ++ + Diclorometano - - ++ ++ ++ Metanol - - - ++ + n-Hexano - - - ++ +++ Diclorometano - - - ++ ++ Metanol - + - + ++ n-Hexano - - - +++ +++ Diclorometano - - +++ ++ + Metanol - + ++ + + n-Hexano - + - ++ + Diclorometano - + + ++ + Metanol - + ++ + + Reveladores Dragendorff Patrones (300 ppm) Papaverina KOH al 5% en etanol absoluto 7-Hidroxi cumarina (+)Presente Liebermann- Burchard β-estradiol, Colesterol, Diosgenina, Estigmasterol, Hecogenina, Lanosterol, Lupeol (++)Moderado 96 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA ESPECIE Browalia speciosa Deprea glabra Solanaceae Solanum brevifolium Solanum sp Solanum trachycyphum Urticaceae (-) Ausente Phenax Uliginosus UTP Nº 171 170 174 189 188 143 EXTRACTO (10000 ppm) ALCALOIDES CUMARINAS ESTEROIDES Y/O SAPONINAS ESTEROIDALES DI-TRI-TERPÉNOS Y/O SAPONINAS TRI-TERPÉNICAS ESTEROLES n-Hexano - - +++ ++ + Diclorometano - - ++ ++ + + Metanol - - - + n-Hexano - - + +++ - Diclorometano - - ++ +++ + Metanol - + - + + n-Hexano - - ++ ++ - Diclorometano - - ++ +++ + Metanol - + - + ++ n-Hexano - - ++ +++ ++ Diclorometano - - ++ +++ + Metanol ++ - - + + n-Hexano - - +++ +++ - Diclorometano - - ++ +++ + Metanol ++ - - + ++ n-Hexano - - - ++ + Diclorometano - - ++ ++ + Metanol - - - + + Reveladores Dragendorff Patrones (300 ppm) Papaverina KOH al 5% en etanol absoluto 7-Hidroxi cumarina (+)Presente Liebermann- Burchard β-estradiol, Colesterol, Diosgenina, Estigmasterol, Hecogenina, Lanosterol, Lupeol (++)Moderado 97 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA ESPECIE UTP Nº EXTRACTO (10000 ppm) FLAVONOIDES AURONAS Y/O CHALCONAS Annonaceae Apocynaceae Asclepiadaceae Guatteria petiolata Mandevila veraguensis Blepharodon grandifolium Calea angosturana Asteraceae Clivadium asperum Clivadium sp (-) Ausente 198 200 201 95 191 89 CATEQUINAS FLAVONAS Y/O FLAVONOLES FLAVONONAS ISOFLAVONAS - + - n-Hexano - + Diclorometano - - + - Metanol - - ++ + - n-Hexano - - + - + Diclorometano - - - - - + Metanol - - +++ ++ ++ n-Hexano - - + - + Diclorometano - - - - - Metanol - ++ ++ - - n-Hexano - - + - + Diclorometano - - - - - Metanol - - ++ + - n-Hexano - +++ - ++ - Diclorometano - - - - - Metanol - - ++ + + n-Hexano - - - + - Diclorometano - - - - - Metanol ++ - ++ - - Reveladores AlCl3 al 1% en etanol absoluto Patrones (300 ppm) Apigenina, Narigenina (+)Presente (++)Moderado 98 (+++)Abundante Continuación anexo 3: T FAMILIA ESPECIE UTP Nº EXTRACTO (10000 ppm) FLAVONOIDES AURONAS Y/O CHALCONAS Asteraceae Munnzonia hastifolia Pentacalia sp Clusiaceae Chrysoclamys floribunda Vismia laevis Costaceae Euphorbiaceae (-) Ausente Costus sp Acalypha diversifolia 190 96 180 184 187 62 CATEQUINAS FLAVONAS Y/O FLAVONOLES FLAVONONAS ISOFLAVONAS n-Hexano - - - + - Diclorometano - - ++ + - Metanol ++ - ++ + + n-Hexano - - - - - Diclorometano - - - - - + + Metanol + - + n-Hexano - - - - - Diclorometano - - ++ + + Metanol - - ++ ++ ++ n-Hexano +++ +++ +++ +++ - Diclorometano - - - - - Metanol ++ - + + - n-Hexano - ++ - ++ - Diclorometano - - - - - Metanol - - ++ - - n-Hexano - - - - - Diclorometano - - ++ + - Metanol - - ++ - - Reveladores AlCl3 al 1% en etanol absoluto Patrones (300 ppm) Apigenina, Narigenina (+)Presente (++)Moderado 99 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA ESPECIE UTP Nº EXTRACTO (10000 ppm) FLAVONOIDES AURONAS Y/O CHALCONAS Acalypha macrostachya Euphorbiaceae Alchornea grandis Hyeronima sp Hyeronima sp Mavea sp Lamiaceae (-) Ausente Salvia scutellarioides 196 202 85 104 92 186 CATEQUINAS FLAVONAS Y/O FLAVONOLES FLAVONONAS ISOFLAVONAS n-Hexano - - - - - Diclorometano - - - - + Metanol - - ++ + n-Hexano - - - - - Diclorometano - - + ++ + Metanol - - ++ + + - n-Hexano - - - - Diclorometano - - + - - Metanol - - + + + n-Hexano - - - - - Diclorometano - - +++ ++ + Metanol - - + + + n-Hexano - - - - - Diclorometano - - ++ ++ ++ Metanol - - + + + n-Hexano - - - - - Diclorometano - - - - - Metanol - - + + + Reveladores AlCl3 al 1% en etanol absoluto Patrones (300 ppm) Apigenina, Narigenina (+)Presente (++)Moderado 100 (+++)Abundante Continuación anexo 3: METABOLITOS SECUDARIOS FAMILIA ESPECIE UTP Nº EXTRACTO (10000 ppm) FLAVONOIDES AURONAS Y/O CHALCONAS Ocotea insulares Ocotea paulii Lauraceae Nectandra acutifolia Nectandra lineatifolia Malvaceae Melastomataceae (-) Ausente Pavonea septioides Miconia sp 176 179 177 178 181 73 CATEQUINAS FLAVONAS Y/O FLAVONOLES FLAVONONAS ISOFLAVONAS n-Hexano - + + - - Diclorometano - - ++ + + Metanol - - ++ + n-Hexano - + + - - Diclorometano ++ ++ ++ ++ + Metanol - - ++ - + n-Hexano Diclorometano ++ + + + ++ - + Metanol - - ++ + + n-Hexano ++ + + ++ + - - Diclorometano Metanol - - ++ + + n-Hexano - - - - Diclorometano - Metanol - - + - + n-Hexano - + - - - Diclorometano - Metanol ++ ++ ++ + + Reveladores AlCl3 al 1% en etanol absoluto Patrones (300 ppm) Apigenina, Narigenina (+)Presente (++)Moderado 101 - - - - (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA ESPECIE UTP Nº EXTRACTO (10000 ppm) FLAVONOIDES AURONAS Y/O CHALCONAS Melastomataceae Tibouchina lepidota Passiflora danielii 185 182 Passifloraceae Passiflora rubra Piper calceolarium Piperaceae Piper crassinervium Piper danieliigonzalezii (-)Ausente 183 194 175 197 CATEQUINAS FLAVONAS Y/O FLAVONOLES FLAVONONAS ISOFLAVONAS n-Hexano - +++ ++ - - Diclorometano +++ - ++ + ++ Metanol - - + + + n-Hexano - - ++ + + Diclorometano - - - - - Metanol - - + + + n-Hexano - - ++ + + Diclorometano - - + - - Metanol - - + + + n-Hexano +++ - + ++ + Diclorometano - - + + - Metanol + + - - - n-Hexano ++ ++ +++ ++ +++ Diclorometano - ++ +++ ++ +++ Metanol + + + +++ + n-Hexano ++ ++ +++ ++ +++ Diclorometano ++ + ++ + + Metanol + - + + + Reveladores AlCl3 al 1% en etanol absoluto Patrones (300 ppm) Apigenina, Narigenina (+)Presente (++)Moderado 102 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA ESPECIE UTP Nº EXTRACTO (10000 ppm) FLAVONOIDES AURONAS Y/O CHALCONAS Browalia speciosa 171 CATEQUINAS Solanaceae Solanum brevifolium Solanum sp Solanum trachycyphum Urticaceae (-) Ausente Phenax uliginosus 170 174 189 188 143 FLAVONOLES FLAVONONAS ISOFLAVONAS n-Hexano - - + ++ - Diclorometano - - - - - - ++ + + n-Hexano - - - - - Diclorometano - - - - - Metanol Deprea glabra FLAVONAS Y/O Metanol - - ++ + + n-Hexano - - - - - Diclorometano - - - - - Metanol - - ++ + + - n-Hexano - - + - Diclorometano ++ ++ +++ - - Metanol - - + + + n-Hexano - - - ++ + Diclorometano - - - - - Metanol - - +++ + + n-Hexano - - - - - Diclorometano - - - - - Metanol - - - - - Reveladores AlCl3 al 1% en etanol absoluto Patrones (300 ppm) Apigenina, Narigenina (+)Presente (++)Moderado 103 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA Annonaceae Apocynaceae Asclepiadaceae ESPECIE Guatteria petiolata Mandevila veraguensis Blepharodon grandifolium Calea angosturana Asteraceae Clivadium asperum Clivadium sp (-) Ausente UTP Nº 198 200 201 95 191 89 EXTRACTO (10000 ppm) QUINONAS SESQUITERPENLACTONAS TANINOS CONDENSADOS HIDROLIZABLES - n-Hexano +++ - + Diclorometano +++ - ++ - Metanol +++ - - ++ n-Hexano +++ - - - Diclorometano +++ - + + Metanol +++ - - ++ n-Hexano +++ - + - Diclorometano +++ - ++ - Metanol +++ - - ++ n-Hexano ++ - + - Diclorometano + - ++ - Metanol ++ - - ++ n-Hexano +++ - + - Diclorometano +++ - ++ - Metanol +++ - - ++ n-Hexano ++ - + - Diclorometano ++ - + - Metanol ++ - - ++ Reveladores KOH al 5% en etanol absoluto Kedde FeCl3 al 5% en HCl 0.5 N Patrones (300 ppm) Antraquinona Digitoxina Ácido gálico, Kaempferol (+)Presente (++)Moderado 104 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA Asteraceae ESPECIE Munnzonia hastifolia Pentacalia sp Clusiaceae Chrysoclamys floribunda Vismia laevis Costaceae Costus sp Euphorbiaceae Acalypha diversifolia (-) Ausente UTP Nº 190 96 180 184 187 62 EXTRACTO (10000 ppm) QUINONAS n-Hexano +++ Diclorometano +++ SESQUITERPENLACTONAS TANINOS CONDENSADOS HIDROLIZABLES - + - - + - - ++ - Metanol +++ - n-Hexano ++ - ++ Diclorometano ++ - ++ - Metanol ++ - - ++ n-Hexano +++ - ++ - Diclorometano +++ - ++ - Metanol +++ - - - n-Hexano +++ +++ ++ - Diclorometano +++ - ++ ++ Metanol +++ - - - n-Hexano +++ - + - Diclorometano +++ - + + - Metanol +++ - - n-Hexano +++ - ++ - Diclorometano +++ - ++ + Metanol +++ - - +++ Reveladores KOH al 5% en etanol absoluto Kedde FeCl3 al 5% en HCl 0.5 N Patrones (300 ppm) Antraquinona Digitoxina Ácido gálico, Kaempferol (+)Presente (++)Moderado 105 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA ESPECIE Acalypha macrostachya Alchornea grandis Euphorbiaceae Hyeronima sp Hyeronima sp Mavea sp Lamiaceae (-) Ausente Salvia scutellarioides UTP Nº 196 202 85 104 92 186 EXTRACTO (10000 ppm) QUINONAS SESQUITERPENLACTONAS TANINOS CONDENSADOS HIDROLIZABLES n-Hexano +++ - ++ - Diclorometano +++ - ++ ++ Metanol +++ - - ++ n-Hexano +++ - ++ - Diclorometano +++ - ++ +++ Metanol +++ - - ++ ++ - n-Hexano ++ - Diclorometano ++ - ++ - Metanol ++ - - ++ n-Hexano +++ - ++ - Diclorometano +++ - ++ - - +++ Metanol +++ - n-Hexano +++ - ++ - Diclorometano +++ - ++ + Metanol +++ - - +++ n-Hexano +++ - + - Diclorometano +++ - + - Metanol +++ - - + Reveladores KOH al 5% en etanol absoluto Kedde FeCl3 al 5% en HCl 0.5 N Patrones (300 ppm) Antraquinona Digitoxina Ácido gálico, Kaempferol (+)Presente (++)Moderado 106 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA ESPECIE Ocotea insulares Ocotea paulii Lauraceae Nectandra acutifolia Nectandra lineatifolia Malvaceae Melastomataceae Pavonea septioides Miconia sp UTP Nº 176 179 177 178 181 73 EXTRACTO (10000 ppm) QUINONAS TANINOS CONDENSADOS HIDROLIZABLES n-Hexano +++ - ++ - Diclorometano +++ - ++ - Metanol +++ - + - n-Hexano - - ++ - Diclorometano +++ - ++ - Metanol +++ - + - ++ - n-Hexano ++ - Diclorometano ++ - ++ - Metanol ++ - - +++ n-Hexano ++ - ++ - Diclorometano ++ - ++ - Metanol ++ - - +++ n-Hexano ++ - +++ - Diclorometano ++ - +++ - Metanol ++ - - + n-Hexano ++ - ++ - Diclorometano ++ - ++ + ++ - - + Metanol (-) Ausente SESQUITERPENLACTONAS Reveladores KOH al 5% en etanol absoluto Kedde FeCl3 al 5% en HCl 0.5 N Patrones (300 ppm) Antraquinona Digitoxina Ácido gálico, Kaempferol (+)Presente (++)Moderado 107 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA Melastomataceae ESPECIE Tibouchina lepidota Passiflora danielii Passifloraceae Passiflora rubra Piper calceolarium Piperaceae Piper crassinervium Piper danieliigonzalezii (-) Ausente UTP Nº 185 182 183 194 175 197 EXTRACTO (10000 ppm) QUINONAS SESQUITERPENLACTONAS TANINOS CONDENSADOS HIDROLIZABLES - n-Hexano +++ - +++ Diclorometano ++ - +++ ++ Metanol +++ - - n-Hexano +++ - ++ - Diclorometano +++ - ++ - Metanol +++ - - - n-Hexano ++ - ++ Diclorometano ++ - ++ - Metanol ++ - - ++ n-Hexano +++ - ++ - Diclorometano ++ - ++ - Metanol +++ - - ++ - n-Hexano +++ - ++ Diclorometano +++ - ++ - Metanol +++ - - ++ n-Hexano +++ - +++ - Diclorometano +++ - +++ +++ Metanol ++ - - ++ Reveladores KOH al 5% en etanol absoluto Kedde FeCl3 al 5% en HCl 0.5 N Patrones (300 ppm) Antraquinona Digitoxina Ácido gálico, Kaempferol (+)Presente (++)Moderado 108 (+++)Abundante Continuación anexo 3: METABOLITOS SECUNDARIOS FAMILIA ESPECIE Browalia speciosa Deprea glabra Solanaceae Solanum brevifolium Solanum sp Solanum trachycyphum Urticaceae (-) Ausente Phenax uliginosus UTP Nº 171 170 174 189 188 143 EXTRACTO (10000 ppm) QUINONAS n-Hexano +++ Diclorometano Metanol SESQUITERPENLACTONAS TANINOS CONDENSADOS HIDROLIZABLES - ++ - +++ - ++ + +++ - - + n-Hexano +++ - ++ - Diclorometano ++ - ++ - Metanol +++ - - + n-Hexano ++ - ++ - Diclorometano ++ - ++ - Metanol ++ - - + n-Hexano + - ++ - Diclorometano + - ++ - Metanol + - - + n-Hexano ++ - +++ - Diclorometano ++ - +++ - Metanol ++ - - + n-Hexano + - + - Diclorometano + - + + Metanol + - - + Reveladores KOH al 5% en etanol absoluto Kedde FeCl3 al 5% en HCl 0.5 N Patrones (300 ppm) Antraquinona Digitoxina Ácido gálico, Kaempferol (+)Presente (++)Moderado 109 (+++)Abundante Anexo 4. Cálculo de la relación señal ruido (Skoog et al., 2008) ( ) √ ( ) Donde: n es el número de repeticiones del ensayo. es la media de las absorbancias a 400 nm. S es la desviación estándar de las absorbancias a 400 nm. 110 Anexo 5. Extracción de la acarbosa a partir de pastillas de Glucobay® 100 mg de Bayer (Cherkaoui et al., 1998). Pulverizar finamente cinco tabletas de Glucobay® Disolver en 25 mL de agua desionizada Sonicar por 15 minutos Realizar tres veces este Homogenizar en un vortex en intervalos de 5 minutos Centrifugar Almidón Sobrenadante Aforar a 100 mL con agua desionizada Filtrar usando una membrana de 0.2 µm Concentrar a 40 °C Almacenar a -10 °C 111 procedimiento Anexo 6. Cálculo de los porcentajes de abundancia relativa de metabolitos secundarios en los extractos vegetales evaluados. Ejemplo: A continuación se presentan los cromatoplacas donde fueron sembrados 36 extractos vegetales de metanol, el metabolito que se va a caracterizar son las cumarinas usando como revelador hidróxido de sodio al 5% en etanol, seguido de la observación en luz ultravioleta a 360 nm. La presencia de este tipo de compuestos se caracteriza con la aparición de fluorescencias blancas y azules como se muestra en la figura 22. Figura 22. Caracterización de cumarinas en extractos de metanol. (Revelador: KOH al 5%, observar en luz ultravioleta). El cálculo del porcentaje de abundancia relativa (%AR) se calcula de siguiente manera: 112