nomenclatura de los compuestos inorgánicos
Anuncio

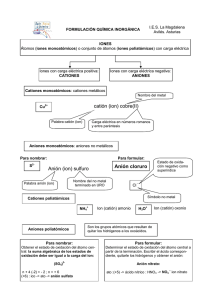
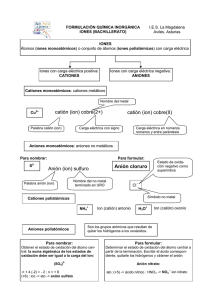
UNIVERSIDAD NACIONAL DE GENERAL SAN MARTÍN ESCUELA DE CIENCIA Y TECNOLOGÍA CURSO DE PREPARACIÓN UNIVERSITARIA NOMENCLATURA DE LOS COMPUESTOS INORGÁNICOS IONES MONOATÓMICOS ANIONES MONOATÓMICOS El nombre de los aniones monoatómicos se obtiene agregando el sufijo -uro al nombre del elemento (si éste termina en vocal, se la elimina) o, en algunos casos, a su raíz latina (ejemplo sulfuro) fluoruro F− cloruro Cl− bromuro Br− − ioduro I sulfuro (se emplea la raíz latina sulfurum) S2− La única excepción es el anión O2− , llamado óxido. CATIONES MONOATÓMICOS Los cationes monoatómicos se nombran simplemente de acuerdo al nombre del elemento, si dicho elemento sólo forma un tipo de catión. ion litio ion calcio Li+ Ca2+ + 2+ ion sodio ion estroncio Na Sr ion potasio ion bario K+ Ba2+ ion rubidio ion aluminio Rb+ Al3+ ion cesio ion plata Cs+ Ag+ ion berilio ion cinc Be2+ Zn2+ 2+ 2+ ion magnesio ion cadmio Mg Cd Cuando el mismo elemento puede formar más de un catión monoatómico, entonces la nomenclatura moderna los diferencia agregando, entre parentesis y en números romanos, la carga del ion. La nomenclatura antigua les da nombres distintos, y agregua el sufijo -oso o ico al de menor o mayor carga, respectivamente Fe2+ Fe3+ Co2+ Co3+ Cu+ Cu2+ Pb2+ Pb4+ hierro (II) hierro (III) cobalto (II) cobalto (III) cobre (I) cobre (II) plomo (II) plomo (IV) o o o o o o o o ferroso férrico cobaltoso cobáltico cuproso cúprico plumboso plúmbico IONES POLIATÓMICOS ANIONES POLIATÓMICOS Los aniones poliatómicos más comunes son los oxoaniones, formados por un elemento central y oxígeno. La nomenclatura moderna nombra a todos los oxoácidos agregando el sufijo -ato al nombre del elemento central y, entre paréntesis y en números romanos, el número de oxidación del elemento central. Ejemplo: SO42- sulfato (VI) SO32- sulfato (IV) Algunos oxoaniones forman aniones parcialmente protonados. En este caso, el nombre del anión agrega al principio la palabra hidrógeno con un prefijo indicando la cantidad de átomos de hidrógeno por fórmula. Como ejemplo: • oxoanión fosfato (V) PO43• oxoanión hidrógeno fosfato (V) HPO42• oxoanión dihidrógeno fosfato (V) H2PO4La nomenclatura anterior es un poco más complicada. Sin embargo debemos conocerla porque es la de uso corriente. carbonato nitrito CO32− NO2− − carbonato ácido (bicarbonato) nitrato HCO3 NO3− 3− − cianuro fosfato CN PO4 hipoclorito fosfato monoácido ClO− HPO42− clorato fosfato diácido ClO3− H2PO4− − − perclorato permanganato ClO4 MnO4 sulfito cromato SO32− CrO42− sulfato dicromato SO42− Cr2O72− − hidróxido u oxhidrilo OH CATIONES POLIATÓMICOS El único catión poliatómico que mencionaremos es: amonio NH4+ COMPUESTOS IONICOS El nombre del compuesto iónico se obtiene simplemente a partir del nombre del anión seguido del nombre del catión. Ejemplos: NaNO2 nitrato (III) de sodio o nitrito de sodio NaNO3 nitrato (V) de sodio o nitrato de sodio FeCl2 FeCl3 cloruro de hierro (II) cloruro de hierro (III) o o cloruro ferroso cloruro férrico K2MnO4 KMnO4 manganato (VI) de potasio manganato (VII) de potasio o o manganato de potasio permanganato de potasio Na2CO3 NaHCO3 carbonato de sodio hidrógeno carbonato de sodio o bicarbonato de sodio (carbonato ácido de sodio) ÁCIDOS Por ahora diremos que un ácido es un compuesto molecular que se disocia en un catión H+ y un anion (por ejemplo: HCl es un ácido que se disocia en H+ y Cl−; otro ácido es el HNO3, que se disocia en .... y ...). El nombre de los ácidos se obtiene cambiando el sufijo. Cuando el sufijo es cambia a Ejemplo ácido clorhídrico HCl -uro -hídrico cambia a Ejemplo ácido sulfuroso H2SO3 -ito -oso cambia a Ejemplo ácido nítrico HNO3 -ato -ico COMPUESTOS MOLECULARES BINARIOS 1. El nombre del compuesto se escribe con los elementos en el orden contrario al dado en la fórmula. 2. Al nombre del segundo elemento se le agrega el sufijo -uro (salvo que sea oxígeno en cuyo caso se llama óxido) y al del primer elemento se lo deja intacto. 3. Si agrega un prefijo (derivado del griego) para indicar la atomicidad de cada elemento en la molécula. Atomicidad 1 2 3 4 5 6 Ejemplos: SF6 CO2 CCl4 CS2 hexafluoruro de azufre dióxido de carbono tetracloruro de carbono disulfuro de carbono Prefijo monoditritetrapentahexa-