REACCIONES QUÍMICAS
Anuncio

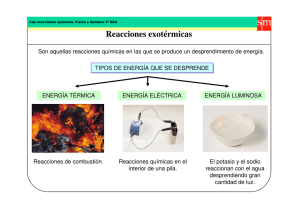
QUÍMICA 3: tema 2 REACCIONES QUÍMICAS resumen teórico Reacciones químicas Cambios físicos y químicos Los compuestos o elementos pueden sufrir dos tipos de cambios: físicos y químicos. Cambios físicos: la sustancia implicada es la misma al principio y al final del cambio. Un ejemplo son los cambios de estado. Cambios químicos: las sustancias del inicio son diferentes de las del final. Comenzamos, por ejemplo, con dos compuestos y acabamos con otros dos que son diferentes. Ley de la conservación de la masa La masa de las sustancias del inicio de una reacción es la misma que la de las sustancias que quedan al final de ésta. Esta ley siempre se cumple: es una ley universal. La masa en una reacción química se conserva. La materia en una reacción no se crea ni se destruye porque no aparecen nuevos átomos de la nada ni tampoco desaparecen. Lo que cambia es la relación entre ellos. Reactivos y productos • Las sustancias que hay antes de la reacción son los reactivos, son las que reaccionan. • Las sustancias que quedan después de la reacción son los productos, que es lo que se ha producido. Lenguaje químico • Los elementos se representan por su símbolo oficial (derivado de su nombre en latín o griego). • Los números que encontramos a tamaño normal a la izquierda de los símbolos indican cuántos átomos de este elemento o compuesto participan en la reacción. QUÍMICA 3: tema 2 REACCIONES QUÍMICAS resumen teórico • Los números pequeños (subíndices) situados a la derecha de los símbolos nos indican cuántos átomos forman parte de la molécula en cuestión. • En las ecuaciones químicas se puede indicar el estado en el que se encuentra cada sustancia. ◦◦ (s) Para los sólidos ◦◦ (l) Para los líquidos ◦◦ (g) Para los gases ◦◦ (ac) Para las sustancias que se encuentran disueltas en agua. Tipos de reacciones químicas Reacciones de formación o síntesis Dos o más reactivos a la izquierda que dan un único producto. Se han juntado diferentes sustancias para formar una nueva. A+BgC Reacciones de descomposición Otro tipo de reacción es aquella en la que tenemos un reactivo a la izquierda y dos o más productos a la derecha. Una sustancia se ha descompuesto en dos o más sustancias diferentes. AgB+C Reacciones de substitución o de desplazamiento Podemos encontrarnos con dos sustancias a un lado y dos al otro que hayan intercambiado alguno de sus átomos. Se desplaza un átomo de una sustancia a otra. AB + C g A + BC Reacciones de doble substitución o doble desplazamiento Las sustancias que reaccionan intercambian dos átomos. AB + CD g AC + BD QUÍMICA 3: tema 2 REACCIONES QUÍMICAS resumen teórico Reversibilidad Las reacciones irreversibles son reacciones químicas que se dan en una “dirección” determinada. Los reactivos reaccionan y dan lugar a los productos. En las reacciones irreversibles cuando se están formando los productos, éstos reaccionan y se producen de nuevo los reactivos, que reaccionan y dan lugar a los productos, y así sin sucesivamente. Estas situaciones se indican en las ecuaciones químicas con una doble flecha. Muchas de las reacciones que se dan en los seres vivos son reversibles. Los seres vivos tienen unas moléculas, las proteínas enzimáticas, que ayudan a que estas reacciones se den en una dirección o en la otra. Reacciones y energía Las reacciones que desprenden energía son las reacciones exotérmicas (exo- significa “fuera”, como en éxodo). Las reacciones que absorben energía son reacciones endotérmicas (endo- significa “dentro”, como en endoscopia). Espontaneidad Hay reacciones que se dan de manera espontánea cuando se encuentran sus reactivos. Hablamos de reacciones espontáneas. Las reacciones no espontáneas requieren un aporte de energía para que se inicien. Velocidad de las reacciones No todas las reacciones se dan a la misma velocidad. Las reacciones químicas se dan por las colisiones de las partículas de un reactivo con las del otro hasta que estos choques generan los productos de la reacción. Se necesita lo que se llama una colisión eficaz. Las partículas adecuadas han de chocar entre sí de la manera concreta que permita su unión y a la velocidad necesaria para romper el antiguo enlace (si existía) y formar el nuevo. QUÍMICA 3: tema 2 REACCIONES QUÍMICAS resumen teórico Reacciones ácido-base Tanto ácidos como bases actúan prácticamente siempre en disolución acuosa. • Los ácidos son aquellas sustancias que, en agua, dejan ir protones. • Las bases son aquellas sustancias que, en agua, cogen protones. No todos los ácidos son igual de ácidos, ni todas las bases igual de básicas. • Los ácidos fuertes dejan ir H+ muy rápidamente y no se quedan ninguno. A los débiles les cuesta mas. • Las bases fuertes cogen rápidamente todos los protones que pueden. Las débiles se lo piensan más. El pH El indicador de la fuerza de un ácido y de una base es el pH. • Una dilución se considera ácida si su pH es inferior a 7. • Si el pH de una solución es de 7, se habla de pH neutro. • Una dilución se considera básica si su pH es superior a 7. Neutralitzación Ácidos y bases pueden reaccionar entre sí en reacciones que se llaman de neutralización por dos razones: • Porque se neutralizan los ácidos y las bases. Pierden toda o parte de su fuerza. • Porque se obtiene una dilución neutra. Concretamente se obtiene agua + sales. Reacciones redox Otra reacción química a la que estamos acostumbrados es la oxidación, que se presenta con un antagonista natural: la reducción. QUÍMICA 3: tema 2 REACCIONES QUÍMICAS resumen teórico De la conjunción de los dos procesos surge el nombre genérico de redox. En las reacciones redox hay un tráfico de electrones, partículas con carga negativa. • El hecho de ceder electrones representa una oxidación: la sustancia que da electrones se oxida. • El hecho de captar electrones representa una reducción: la sustancia que recibe electrones se reduce. • La sustancia que lanza electrones produce una reducción a la que los coge. Por lo tanto, la que cede electrones es un reductor. • La sustancia que lanza electrones se ha oxidado porque hay una sustancia que se los coge; la que capta electrones está oxidando a la otra y la que adquiere electrones es un oxidante. Así, aunque parezca un contrasentido: el oxidante se reduce y oxida al reductor. Si somos capaces de dirigir los electrones de un oxidante a un reductor, podremos generar electricidad. Las pilas y baterias se basan en reacciones redox. Combustión Un caso especial de las reacciones redox son las reacciones de combustión. En estas reacciones el oxígeno actúa como oxidante, en que oxida una sustancia que, en este caso, se llama combustible. Es una reacción exotérmica. Respiración Los seres vivos obtenemos la energía que necesitamos para seguir vivos gracias a una reacción de combustión que tiene lugar dentro de nuestras células: la respiración celular. En la respiración reaccionan la glucosa (el combustible) con el oxígeno y se obtiene energía, dióxido de carbono y agua. QUÍMICA 3: tema 2 REACCIONES QUÍMICAS resumen teórico Fotosíntesis La fotosíntesis es una reacción de reducción. En ella se genera glucosa y oxígeno a partir de dióxido de carbono mediante energía obtenida de la radiación solar.