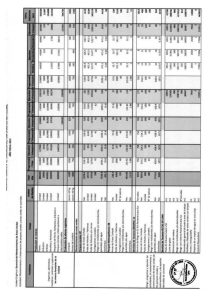
INTRODUCCION
Anuncio

EVALUACIÓN REGIONAL DE LA VULNERABILIDAD ACTUAL Y FUTURA DE LA ZONA COSTERA MEXICANA Y LOS DELTAS MÁS IMPACTADOS ANTE EL INCREMENTO DEL NIVEL DEL MAR DEBIDO AL CAMBIO CLIMÁTICO Y FENÓMENOS HIDROMETEOROLÓGICOS EXTREMOS. INFORME FINAL Número de registro: INE/A1-051/2008 COORDINADOR: DR. ALFONSO VÁZQUEZ BOTELLO 24 de octubre de 2008. Participantes: Coordinador. Alfonso Vázquez Botello Responsable de la Unidad Académica: Sistemas Oceánicos y Costeros Instituto de Ciencias del Mar y Limnología, UNAM. Tendencias del nivel del mar en México Jorge Zavala-Hidalgo, R. De Buen Kalman, R. Romero-Centeno y F. Hernández Maguey Instituto de Geografía, UNAM. Proyecciones del incremento del nivel del mar. José Adrián Carbajal Domínguez División Académica de Ciencias Básicas, Universidad Juárez Autónoma de Tabasco. Proyección de incremento del nivel del mar de 1 metro (mayor resolución). Ernesto Caetano Víctor Magaña Centro de Ciencias de la Atmósfera, Universidad Nacional Autónoma de México. Tasa de erosión y proyecciones del incremento del nivel del mar para la costa de Campeche. Vicente Torres Rodríguez 1 Antonio Márquez García 1,3 Andrea Bolongaro Crevenna 1 Jerónimo Chavarría Hernández 2 Gilberto Exposito Díaz 1 1 Unidad de Oceanografía, Academia Nacional de Investigación y Desarrollo. 2 Unidad de Geoinformación, Academia Nacional de Investigación y Desarrollo 3 Dpto. de Hidrobiología, Universidad Autónoma Metropolitana-Iztapalapa. Cambio de línea de costa en la Riviera Maya debido a fenómenos hidrometeorológicos extremos, consecuencias del cambio climático global. Antonio Z. Márquez García1. Andrea Bolongaro Crevenna R2. Vicente Torres Rodríguez2. 1 Depto. de Hidrobiología, DCBS Universidad Autónoma Metropolitana Iztapalapa. 2 Unidad de Oceanografía, Academia Nacional de Investigadores. A. C. Proyecciones en los deltas del Golfo de México. Hermilo Ramírez León Franklin Torres Bejarano Enrique Herrera Díaz Programa de Investigación en Matemáticas Aplicadas y Computación SAIIA-Dirección de Seguridad y Medio Ambiente. Instituto Mexicano del Petróleo. Humedales costeros Francisco J. Flores Verdugo1 P. Cassasola2 C. Agraz Hernández3 G. De La Lanza-Espino4. 2 1 Instituto de Ciencias del Mar y Limnología. Unidad Académica Mazatlán. UNAM. Instituto de Ecología, A. C. 3 EPOMEX. Universidad Autónoma de Campeche. 4 Instituto de Biología. UNAM. 2 Efecto de los huracanes y cambio climático sobre el Caribe Mexicano: Adaptabilidad de los pastos marinos. M. A. Liceaga-Correa L. U. Arellano-Méndez Héctor Hernández-Núñez Centro de Investigación y de Estudios Avanzados del IPN, Unidad Mérida. Arrecifes de coral y cambio climático global: Vulnerabilidad de la zona costera del estado de Quintana Roo. Paul Blanchon Roberto Iglesias-Prieto Eric Jordán Dahlgren Simon Richards Unidad Académica Puerto Morelos ICML-UNAM. El posible efecto del cambio climático en las tortugas marinas. René Márquez-M. 1 Ma. del Carmen Jiménez-Q.2 1 CIACTM-Comité Científico. 2 Instituto Nacional de Pesca, SAGARPA. Vulnerabilidad de las zonas costeras: ecosistemas costeros. Susana Villanueva Fragoso Guadalupe Ponce Vélez Claudia García Ruelas Joaquín Presa de la Vega Lab. Contaminación Marina, Instituto de Ciencias del Mar y Limnología, UNAM. Vulnerabilidad de sitios de anidación de tortugas marinas por efectos de erosión costera en el estado de Campeche. Andrea Bolongaro Crevenna Recaséns1 Vicente Torres Rodríguez1 Antonio Márquez García Vicente Guzmán Hernández1 Aidee García Vicario1 1 Unidad de Oceanografía, Academia Nacional de Investigación y Desarrollo. 2 Depto. de Hidrobiología, DCBS Universidad Autónoma Metropolitana Iztapalapa. Retos para el sector pesquero y acuícola ante el cambio climático. Patricia Guzmán Amaya Patricia Rojas Carrillo Gabriela Morales García Elaine Espino Barr Instituto Nacional de Pesca, SAGARPA. Vulnerabilidad de las costas ante el aumento del nivel del mar: Caso las costas de barrera del Golfo de México en el litoral de México. 3 Mario Arturo Ortiz-Pérez Instituto de Geografía, Universidad Nacional Autónoma de México. Tasas de avance transgresivo en el frente deltaico tabasqueño: en el período comprendido de 1995-2008. Mario Arturo Ortiz- Pérez José Ramón Hernández Santana Instituto de Geografía, Universidad Nacional Autónoma de México. Vulnerabilidad de las zonas costeras: Físico-química. Guadalupe de la Lanza Espino Juan Carlos Gómez Rojas Salvador Hernández Pulido Departamento de Zoología, Instituto de Biología, UNAM. Un modelo de análisis social para el cambio climático en zonas costeras de México. Estudio de Caso. Pedro Hipólito Rodríguez Herrero1 Lorenzo Manuel Bozada Robles 2 1 Centro de Investigaciones y Estudios Superiores en Antropología Sociales – Golfo (CIESAS). 2 Universidad Veracruzana Intercultural- sede Selvas. Propuesta del uso del estabilizador de suelo o base seal como recurso para mejorar las características de los suelos para la construcción y rehabilitación de caminos. Sergio Eduardo Barrios Santa Cruz Representante de BASE SEAL Inc. Mitigación, Adaptación y Costos. Manglar, Turismo, Impactos por aumento del nivel del mar Carreteras. Agricultura. Alfonso Vázquez Botello Responsable de la Unidad Académica: Sistemas Oceánicos y Costeros Instituto de Ciencias del Mar y Limnología, UNAM. 4 I. INTRODUCCIÓN Las actividades humanas, principalmente la quema de combustibles fósiles y el cambio en la cubierta vegetal y la utilización de tierras, han aumentado la concentración de Gases de Efecto Invernadero (GEI) en la atmósfera. En su conjunto, en aumento en las emisiones de GEI, conducirán según las proyecciones, a cambios globales y regionales de temperatura, precipitación y otras variables climáticas, dando así origen a cambios en la humedad del suelo a escala mundial, a un aumento del nivel del mar, valores más extremos de temperatura, crecidas de ríos y sequías prolongadas en algunos lugares del planeta. Basándose en las distintas sensibilidades del clima, al cambio de las concentraciones de GEI en la atmósfera (IPCC, 1996), las proyecciones de los modelos climáticos predicen un aumento de la temperatura media anual en la superficie del planeta de 1.1 a 6.4º C a finales del siglo XXI (IPCC, 2007). El cambio climático global es un fenómeno que afecta al planeta entero, por ello se está abordando desde la perspectiva política como un problema ambiental internacional. En 1988, el Programa de las Naciones Unidas para el Medio Ambiente y la Organización Meteorológica Mundial, establecieron en conjunto el Panel Intergubernamental sobre Cambio Climático (IPCC, por sus siglas en inglés) (Hughes, 2000). Los propósitos con los que se creó dicho Panel, fueron evaluar el estado del conocimiento científico sobre diversos aspectos del cambio climático, valorar los impactos ambientales y socioeconómicos y analizar estrategias de mitigación 1. El cambio climático supone un importante factor adicional de desgaste de los sistemas ya afectados por una creciente demanda de recursos, por unas prácticas de gestión insostenibles y por la contaminación, que en muchos casos pueden ser de magnitud igual o mayor que con el cambio climático (IPCC, 1997). La elevación del nivel del mar es probablemente el impacto antropogénico más importante del cambio climático en este siglo (Grinsted, et al., 2009). El enfoque utilizado por el IPCC (Meehl, et. al, 2007), para estimar la elevación futura del nivel del mar, ha sido la de modelar sus dos principales componentes: la expansión térmica y la fusión del hielo. El nivel del mar es una importante variable oceanográfica afectada por el cambio climático. De acuerdo con el Cuarto Informe de Evaluación del IPCC (2007), datos globales indican que en el periodo comprendido entre 1961 y 2003 el nivel del mar ha aumentado a una tasa promedio de 1.8 ± 0.5 mm año-1. Estos datos muestran también que en el período 1993-2003 la tasa de incremento fue de 3.1 ± 0.7 mm año-1, aunque no se sabe si el aumento en este último período es debido a oscilaciones naturales de escala decadal o si puede ser atribuido al cambio climático. Las estimaciones del siglo XX muestran que el nivel medio mundial del mar se elevó a una tasa de unos 1.7 mm año–1. Según el IPCC (2007) se esperan incrementos de nivel del mar de 18 cm a 59 cm a finales del siglo XXI. Lara (2008), menciona que un calentamiento de entre 1.5 y 5 °C significaría una posible subida del nivel del mar de entre 20 y 165 cm, lo que inundaría por completo zonas densamente pobladas del mundo y muchas ciudades de nuestro país (Gallegos, et al., 2004). Otros autores han realizado estimación aun más críticas, en 1987, Titus cita a varios autores, los cuales mencionan que el nivel del mar puede subir 70 cm para el año 2080 y Hoffman, et al. (1983), estiman un ascenso del nivel del mar de 26 a 39 cm para 2025 y de 91 a 136 cm para 2075. El aumento en el nivel del mar como resultado del calentamiento global, tendrá diferentes efectos ambientales sobre los sistemas costeros como tormentas, inundaciones, pérdida de humedales, 1 http://www.grida.no/climate 5 erosión, intrusión de agua salada y aumento en los niveles freáticos. El Cuadro I.1 resume algunos de los efectos biogeofísicos y sus interacciones. Dichos efectos, tendrán además impactos socioeconómicos directos e indirectos sobre el turismo, los asentamientos humanos, la agricultura, el suministro, la cantidad y calidad de agua dulce, las pesquerías, así como los servicios financieros y de salud (McLean, et al., 2001; Nicholls, 2002), afectando a la población residente. Habría también cambios en los bienes y servicios comercializados tales como las tierras, infraestructura urbana y la productividad agrícola e industrial. Cuadro I.1. Efectos biogeofísicos relevantes en las costas, relacionados con el cambio climático. Factor climático Dirección del cambio Efectos biogeofísicos Temperatura superficial del mar Aumento Blanqueamiento de corales; migración de especies costeras, disminución de la incidencia de hielo en altas latitudes. Intensidad de la precipitación/ escurrimiento superficial Ciclo hidrológico intensificado, con amplias variaciones regionales Cambios en el suministro de sedimentos fluviales; cambios en el riesgo de inundación en zonas costeras bajas. Oleaje Intensidad de Ciclones Tropicales Poco conocido, pero significativa variabilidad temporal y espacial esperada Poco conocidos, pero significativa variabilidad temporal y espacial esperada CO2 atmosférico Aumento Efectos biogeofísicos Inundación y daños Oleaje Efecto de arrastre Pérdida de humedales (y cambios) Erosión Cambios e incrementos en los patrones de erosión costera; cambios en los impactos por oleaje de tormentas. Cambios en la ocurrencia de inundaciones y daños por Ciclones Tropicales. Aumento de la productividad en ecosistemas costeros; disminución de los impactos de la saturación de CaCO3 en arrecifes coralinos. Climáticos Oleaje de tormentas, cambios morfológicos, suministro de sedimentos Escurrimiento superficial Fertilización con CO2 Suministro de sedimentos Suministro de sedimentos, Marea y Ciclones Tropicales Aguas Escurrimiento superficial superficiales Aguas Precipitación subterráneas Aumento de capa freática Precipitación /drenaje impedido Fuente: Modificado de Nicholls, 2002. Intrusión de agua salada No Climáticos Suministro de sedimentos, manejo de inundaciones, adjudicación de tierras. Manejo de cuencas y uso de la tierra. Suministro de sedimentos, espacio de migración, destrucción directa. Suministro de sedimentos Manejo de cuencas y uso de la tierra Uso de la tierra, uso de acuíferos Uso de la tierra, uso de acuíferos Los efectos del cambio climático se verán reflejados en que tan vulnerables pueden ser los ecosistemas y a su poder de adaptación. Las zonas costeras se caracterizan por una rica diversidad de estos entornos, así como a un gran número de actividades socioeconómicas. Sin embargo en 6 muchos países, la población ha crecido dos veces más rápido en las costas que en su conjunto; se estima que actualmente más de la mitad de la población mundial habita en estos lugares, aunque hay grandes variaciones de un país a otro. El Panel de Observación de las Costas y los Océanos (COOP, por sus siglas en inglés) establece que los bienes y servicios de los ecosistemas se concentran, en mayor medida, en la zona costera, comparado con cualquier otro lugar del planeta. Los cuerpos de agua costeros, humedales, lagunas, bahías y mar costero, son hábitats de una gran riqueza de especies y diversidad genética (Christensen, et al., 1996). Además, por su belleza escénica, las zonas costeras del mundo han sido atractivas para el establecimiento y desarrollo de asentamientos humanos; alrededor del 80 % de la contaminación marina proviene de las actividades antropogénicas que se desarrollan en este espacio (CNPA, 2000; Sanger, 1987). Se ha calculado que aproximadamente el 60 % de la población mundial vive en las zonas costeras (UNESCO, 2003), haciéndolas vulnerables a disturbios naturales y humanos así como al calentamiento global. Los cambios del clima afectarán a los sistemas costeros debido al aumento del nivel del mar, a un mayor riesgo de mareas de tempestad y a un posible cambio en la frecuencia y/o intensidad de los fenómenos meteorológicos. Las playas, dunas, estuarios y humedales costeros, se adaptarán de manera natural a la dinámica y a los cambios del viento y el mar (IPCC, 1997). De antemano lo que se debe tener en cuenta, es el hecho de que cualquiera de las predicciones, sea cual sea el método y sus escenarios, la tendencia es una elevación del nivel del mar en gran parte causada por el Cambio Climático Global; cuyas consecuencias, se ven reflejadas en inundaciones, intrusión de la cuña salina y erosión de las costas (Wayne, et al.,1993). Esto provoca una pérdida de humedales y por lo tanto, la destrucción de una barrera contra las mareas y oleaje de tormentas, como consecuencia, éste impacta en forma erosiva, sobre todo a la zona de supraplaya. Un incremento del nivel del mar aumenta la profundidad de la columna de agua, disminuyendo la fricción del fondo, induciendo un oleaje con mayor energía que se presenta en la línea de costa. Por ejemplo: sí se elevara 1 m el nivel del mar sobre una plataforma de 10 m de ancho y 10 m de profundidad, al presentarse una ola su altura se incrementaría un 3 % y se generarían olas locales con un incremento de altura de 7.5 %. Al subir el nivel del mar 1 m sería catastrófico para bahías someras, estuarios y lagunas, donde se generarían olas de más de 0.75 m de altura en sitos donde no existían (Wells, 1995) los cambios hidrológicos alteran también la distribución de nutrientes y de sedimento (Voice, et al., 2006). En el futuro se espera que las anomalías del clima, experimentadas en el último siglo o las que ocurrirán en las próximas décadas, podrían incluir alteraciones en la variación interanual e interdecadal del clima, propiciando eventos del El NIÑO y La NIÑA más frecuentes e intensos, huracanes de mayor magnitud, así como la modificación de los patrones de lluvia (Lara, 2008). Estos cambios globales pueden afectar el funcionamiento de los ambientes costeros, como resultado de una interacción entre factores geológicos, físicos, químicos, climáticos y biológicos, traduciéndose localmente que cada ambiente sea único, por lo que los cambios antropogénicos y climáticos, afectarán directa o indirectamente a variables como la temperatura, niveles de oxígeno, nutrientes y salinidad, entre otros; que en conjunto alteraran el hábitat, modificaran los ciclos biogeoquímicos, la calidad del agua, la composición y distribución de especies animales y vegetales. La circulación superficial de los océanos, es una condición de frontera para los sistemas de corrientes marinas sobre la plataforma continental, que influyen en el equilibrio del agua dulce y agua de mar de los ecosistemas y modifican la ubicación y magnitud de los procesos costeros de sedimentación y erosión (Hendry, 1993). La circulación superficial del océano, es también determinante en la distribución de huevos y larvas y en los patrones de migración de especies marinas de importancia comercial; por lo tanto es un factor importante en la localización y 7 comportamiento de las áreas de pesca. Es por ello urgente e indispensable conocer, describir y entender la variabilidad de las condiciones oceanográficas y costeras de los mares mexicanos, e investigar sobre sus tendencias a escala climática. La caracterización de la estructura espaciotemporal del clima oceánico, es crucial para la oportuna detección de cambios significativos en la circulación del estrato superficial de los mares mexicanos. En México el litoral costero se extiende aproximadamente a lo largo de 11,122 km, y abarca una gran variedad de ambientes que incluyen: ríos, deltas, estuarios, lagunas, bahías, humedales, manglares y arrecifes, además proporcionan una infinidad de hábitats que propician una gran diversidad biológica. En estas zonas se ubican importantes centros urbanos y se desarrollan actividades vitales para la economía como la extracción de petróleo, turismo, agricultura, pesca y acuacultura, entre otras. Existen 447 municipios costeros (224 en el litoral del Pacífico y 223 en el litoral del Golfo de México). Ortiz y Méndez (1999), mencionan que al aumentar el nivel del mar de 1 a 2 m, en el Golfo de México y Mar Caribe, las zonas más vulnerables son: la llanura deltaica del río Bravo, laguna de Alvarado y curso bajo del río Papaloapan en Veracruz; complejo deltaico Grijalva-Mezcalapa-Usumacinta en Tabasco; los Petenes en Campeche y bahías de Sian Kaa´n en Chetumal Quintana Roo. Estos ecosistemas por su localización en la zona intermareal, se estima que serán los más afectados frente al cambio climático global, en particular frente a los efectos del incremento del nivel del mar, fuerza de vientos, oleaje, corrientes y patrón de tormentas (Yáñez-Arancibia, et al., 1998). Uno de los ecosistemas más susceptibles ricos en biodiversidad y que han sufrido una mayor pérdida, son los humedales costeros mexicanos, al actuar como amortiguadores de zonas contaminadas, cuyos servicios ambientales no han sido estimados en todo su potencial. Estos sistemas se encuentran amenazados en principio por la alteración del sistema hidrológico, debido al crecimiento de redes carreteras e infraestructura petrolera, urbana, turística y agropecuaria, alterando su dinámica y funciones ecológicas. Sin embargo, las modificaciones que el cambio climático podría ocasionar a dichos sistemas, aunado a las problemáticas que ya actualmente presentan, pueden ocasionar la desaparición de un inmenso número de especies, la mayoría probablemente no se conocen, por lo que se hace necesario inventariar, establecer indicadores de monitoreo (parámetros fisicoquímicos o de calidad del agua) (Gama, et al., 2009), así como cambios en el grado de trofismo (nutrientes, materia orgánica, especies no deseables, entre otros). Dado que los sistemas costeros están estrechamente vinculados con las cuencas hidrológicas, es importante determinar la fragilidad de éstas ante el cambio climático, pueden tener un efecto dramático en el régimen y magnitud de la escorrentía, en la humedad del suelo y en la evaporación (Lara, 2008), afectando de manera directa o indirecta los ecosistemas costeros, en los que se realizan los principales ciclos biogeoquímicos. Se define la vulnerabilidad como el grado en que un ecosistema natural o social podría resultar afectado por el cambio climático. Ésta, se encuentra en función de la sensibilidad de un sistema a los cambios del clima y de su capacidad para adaptarse a dichos cambios. En este contexto, un sistema muy vulnerable sería aquel que fuera muy sensible a pequeños cambios en el clima, incluyéndose en el concepto de sensibilidad la posibilidad de sufrir efectos muy perjudiciales, o aquel cuya capacidad de adaptación se hallara seriamente limitada. Las evaluaciones de la vulnerabilidad de recursos costeros a los impactos del cambio climático deben poder distinguir entre vulnerabilidad natural del sistema y vulnerabilidad socioeconómica del sistema, aunque claramente ambos están relacionados y son interdependientes. Ambos son dependientes en sensibilidad, exposición y capacidad de adaptación (Smith, et al., 2001). Un análisis apropiado de vulnerabilidad socioeconómica a la elevación del nivel del mar, requiere de una comprensión previa de cómo el sistema natural será afectado. Partiendo de esta base, el análisis de vulnerabilidad costera comienza con la respuesta del sistema natural. Además, otras 8 presiones climáticas y no climáticas deben ser reconocidas en un análisis de vulnerabilidad, porque el aumento del nivel del mar no ocurre aisladamente y los sistemas costeros evolucionarán a causa de otros factores distintos al aumento del nivel del mar. Este aumento a escala global es controlado por el clima, los movimientos en la superficie de la Tierra, la rotación de la misma y el efecto de la gravedad. Es probable que el promedio global de la elevación del nivel del mar, se acelere considerablemente en las siguientes décadas a causa del calentamiento global antropogénico, presentando consecuencias adversas considerables para los ecosistemas y las sociedades costeras. Aún con reducciones drásticas en las emisiones de GEI, el nivel del mar continuará subiendo por siglos, más allá del 2100, a causa del largo tiempo necesario para la respuesta térmica del sistema global del océano, conocido generalmente como “el compromiso al aumento del nivel del mar”. 1.1 Efectos del aumento en el nivel del mar El aumento relativo del nivel del mar, tiene una gran variedad de efectos sobre los procesos costeros que operan en torno al nivel promedio del mar (mareas, oleajes). Los efectos inmediatos incluyen como ya se mencionó, el aumento en la frecuencia de las inundaciones en tierras costeras. Los efectos a más largo plazo incluyen cambios morfológicos, particularmente erosión de las playas y disminución de las dunas, a medida que la costa se ajusta a las nuevas condiciones ambientales. Para la cantidad de aumento relativo del nivel del mar esperado durante el siglo XXI (≤ 1 m), estos incrementos son principalmente efectivos a través de cambios en dos direcciones: Cambios en oleajes, mareas y oleadas Cambios en la morfología costera Un aumento relativo del nivel del mar permite que las olas rompan más cerca de la costa, lo que a su vez aumenta la carga y el estrés sobre las estructuras costeras de defensa. Las profundidades crecientes del agua también pueden afectar el progreso de mareas y oleadas. Más directamente, levantará todos los niveles de las aguas asociadas, incluyendo las alturas extremas de oleadas. Por lo tanto, aunque se mantengan constantes la trayectoria, la frecuencia y la intensidad de las tormentas, el aumento relativo del nivel del mar podría reducir el período del retorno de los niveles de agua extremos. El IPCC concluyó que la intensidad de los ciclones tropicales podría aumentar; si esto ocurre, haría que el poder combinado entre el aumento del nivel del mar y los ciclones sea potencialmente aún más destructivo que los ciclones de hoy. En cuanto al alcance de las mareas a los ríos, subirá los niveles de éstos al aumentar el caudal, provocando aumento en el riesgo por inundación. Una de las manifestaciones más visibles del aumento en la temperatura del mar, debido al cambio climático, es el desplazamiento y sustitución de especies, pero la incertidumbre aumenta por efecto de otros parámetros como la acidificación del mar, cuyas consecuencias son aún poco conocidas (Comisión Europea, 2007). Algunos de los impactos clave del cambio climático son: la inundación de tierras bajas y desplazamiento de humedales, erosión de la línea de costa, intrusión salina en estuarios y acuíferos, cambios en la composición y productividad de los ecosistemas, pérdida de biodiversidad, alteración del régimen de mareas, cambios en patrones de sedimentación, disminución de la penetración de la luz para organismos bentónicos, y los impactos socioeconómicos como el daño a la infraestructura costera entre muchos otros (Hernández, 2007; Estrada, 2001). 9 Los efectos socioeconómicos potenciales del aumento del nivel del mar son: • Pérdida directa de valores económicos, ecológicos, culturales y de subsistencia a causa de la pérdida de tierras, infraestructura y hábitats costeros • Aumento del riesgo de inundación para personas, tierras e infraestructura • Otros efectos relacionados con cambios en el manejo del agua, la salinidad y la actividad biológica, tales como la pérdida de turismo, la pérdida de hábitats costeros y los efectos en la agricultura y acuacultura. Hasta hoy en día, en México se han realizado muy pocas evaluaciones sobre los impactos que tendrá el incremento del nivel del mar en las zonas costeras debido al cambio climático, por ello resulta necesario el realizar este tipo de evaluaciones para identificar cuales serán los impactos potenciales y la vulnerabilidad de las zonas costeras y de los deltas que se identifiquen como los más vulnerables, ante el incremento del nivel del mar, considerando las evaluaciones más recientes del Cuarto Informe de Evaluación del IPCC. Así, la información generada; apoyará la toma de decisiones y el diseño de políticas públicas de adaptación de zonas costeras ante cambio climático. Se debe tener en cuenta que la información climática, adquiere un alto valor socioeconómico cuando se le considera en la toma de decisiones La gestión de las zonas costeras está interrelacionada con diferentes sectores socioeconómicos, como el hídrico, turismo, de construcción, transportes, de energía y ecosistemas costeros, entre otros, por lo cual los resultados del presente estudio permiten identificar los impactos potenciales que podrían enfrentar dichos sectores ante los diferentes escenarios de incremento del nivel del mar bajo condiciones de cambio climático. De igual manera, los resultados del estudio permiten caracterizar el grado de vulnerabilidad de las zonas costeras y de los deltas, ante los efectos del incremento del nivel del mar, bajo los efectos del cambio climático y su relación con diversos sectores socioeconómicos y ambientales. Con la información generada, se estima el riesgo climático para formular, y adecuar, planes y estrategias de desarrollo que contemplen adaptación al cambio climático, buscando reducir la vulnerabilidad de las poblaciones costeras y de sus actividades económicas y sociales. En el presente estudio se generan escenarios regionales de incremento del nivel del mar ante condiciones de cambio climático y de fenómenos hidrometeorológicos extremos, tomando en cuenta las variaciones topográficas y la subsidencia de la zona costera por fenómenos geomorfológicos. Se estiman y analizan los impactos de los fenómenos hidrometeorológicos extremos, en los asentamientos humanos, agua, pesca y ecosistemas costeros de las zonas costeras y los deltas más vulnerables ante el incremento del nivel del mar. 10 II. OBJETIVOS 1. Evaluar la vulnerabilidad de la zona costera mexicana y de los deltas más impactados ante el incremento del nivel del mar (2, 1 y 0.6 metros), debido al cambio climático y a los fenómenos hidrometeorológicos extremos. 2. Identificar los impactos del aumento del nivel del mar sobre ecosistemas críticos (manglares, arrecifes de coral, pastos marinos), y recursos naturales (agua, pesca y tortugas marinas). 3. Identificar opciones de adaptación en los deltas más impactados para enfrentar el incremento del nivel del mar, debido al cambio climático y a fenómenos hidrometeorológicos extremos. 11 12 III. OBSERVACIONES Y PROYECCIONES POR INCREMENTO DEL NIVEL DEL MAR. 3.1 Observaciones del incremento del nivel del mar Los cambios en la morfología de las zonas costeras son el resultado de la influencia de muchos procesos, siendo uno de ellos el aumento en el nivel del mar. Entre estos procesos, los más importantes son el balance entre el aporte y la remoción de sedimentos, el transporte litoral de sedimentos, la incidencia de eventos extremos y los movimientos verticales de la corteza terrestre. Es importante señalar que los cambios en el nivel del mar medidos en una localidad son la respuesta a una gran variedad de fenómenos, entre los que se pueden mencionar la marea; los seiches 2; las corrientes costeras; los fenómenos meteorológicos de escala sinóptica como nortes y huracanes; los fenómenos oceanográficos de gran escala como el fenómeno de El Niño; variaciones interdecadales como la oscilación decadal del Pacífico; condiciones oceanográficas que son la respuesta a fenómenos que se originan lejos de la zona de influencia, como las ondas atrapadas a la costa; los tsunamis; los movimientos verticales de la corteza terrestre; los cambios en la presión atmosférica y, por supuesto, la señal del cambio del nivel del mar debida al calentamiento del planeta. En este estudio se presentan estimaciones de las tendencias de largo plazo en el nivel del mar para 17 sitios de las costas mexicanas, considerando los promedios mensuales de las series de nivel del mar más largas del país a partir de los datos obtenidos por el Servicio Mareográfico Nacional (SMN) 3 de la UNAM, dichas observaciones se ven limitadas por la longitud y la continuidad de las series de tiempo. El análisis de las tendencias en el nivel del mar 4 para los 17 sitios se muestra en las gráficas de las Figuras III.1 a la III.17. En éstas los promedios mensuales se indican con líneas azules, los promedios corridos de doce meses (o menos si no existen los datos de algunos meses) se muestran con una línea roja y los promedios de los años en que existen datos completos se indican con puntos negros. Se observó que los datos de nivel del mar en México muestran tendencias similares a las globales. Además se realizaron estimaciones de los ciclos anuales en 50 años de los sitios analizados, las gráficas se pueden observar en el Anexo A.1. En los Cuadros III.1 y III.2 se resumen las tendencias del nivel del mar para los sitios analizados en el Golfo de México y el Pacífico mexicano, respectivamente, se incluye el período de muestreo y el número de años considerado en el cálculo. Información complementaria sobre comparaciones entre las series del nivel del mar se encuentran en el Anexo A.1. 2 Es una onda estacionaria en un cuerpo de agua encerrado o parcialmente encerrado. Los seiches y los fenómenos relacionados a seiche se han observado en lagos, embalses, piletas, bahías, mares. La clave de requerimiento para formar un seiche es que tal cuerpo de agua esté al menos parcialmente delimitadas, lo que permite la formación de la onda estacionaria. 3 El SMN inició el monitoreo del nivel del mar en la década de los 40’s (con series que datan de 1946), entre otras variables, es pionero en México, cuenta con mareógrafos, y bancos de nivel que han sido fundamentales para la georeferenciación, muchos de ellos utilizados por el INEGI para sus labores de cartografía del territorio nacional. Actualmente la UNAM mantiene, en colaboración con otras instituciones, 15 sitios de medición del nivel del mar, los cuales se encuentran en un proceso de modernización utilizando técnicas de telemetría y cómputo que permitirán conocer el estado de esta variable en tiempo real. 4 La metodología se muestra en el anexo A.1. 13 Tendencias del nivel del mar en el Golfo de México. Figura III.1. Tendencia del nivel del mar en Alvarado, Ver. Figura III.2. Tendencia del nivel del mar en Cd. del Carmen, Camp. 14 Figura III.3. Tendencia del nivel del mar en Cd. Madero, Tamps. Figura III.4. Tendencia del nivel del mar en Coatzacoalcos, Ver. 15 Figura III.5. Tendencia del nivel del mar en Progreso, Yuc. Figura III.6. Tendencia del nivel del mar en Tuxpan, Ver. 16 Figura III.7. Tendencia del nivel del mar en Veracruz, Ver. Los datos del Cuadro III.1 muestran tendencias bastantes disímiles para el Golfo de México ya que van de 1.79 mm/año en Alvarado, Ver., hasta 9.16 mm/año en Cd. Madero, Tamps., aunque debe tenerse en cuenta que las series de datos con las que se realizaron estas estimaciones no corresponden a los mismos períodos. Cuadro III.1. Tendencias del nivel del mar para los sitios analizados en el Golfo de México. Tendencia Período (mm/año) Alvarado, Ver. 1.79 1955-1981 Cd. del Carmen, Camp. 3.38 1956-1990 Cd. Madero, Tamps. 9.16 1962-1979 Coatzacoalcos, Ver 2.90 1952-1988 Progreso, Yuc. 2.45 1952-1984 Veracruz, Ver. 1.89 1952-2003 Tuxpan, Ver. 2.82 1958-1989 Nota: Se indica el período en el cual hay datos disponibles. Sitio No. de años en el cálculo 19 26 15 22 27 16 43 En los siete sitios analizados en el Golfo de México se encontró una tendencia de aumento en el nivel del mar. Las series de tiempo muestran claramente variaciones interanuales y de escala decadal que, para ser separadas del cambio producido por el calentamiento global del planeta, es deseable tener series más largas, de varias décadas. Aunque estas series tienen longitudes variables, se buscó tener más información al comparar las tendencias de cada sitio con relación a las variaciones del nivel del mar en Veracruz (Ver Anexo A.1), que se encuentra en la parte central de las costas mexicanas del Golfo de México y tiene la serie de tiempo más larga. 17 Es importante notar que la tendencia de aumento en el nivel del mar en Veracruz, de 1.89 mm año-1, es muy similar a la reportada por el IPCC para el océano mundial lo que sugiere que, en principio, no ha habido movimientos verticales de la corteza terrestre importantes en la región lo que hace que el sitio sea una buena referencia para comparar con la variación en otros sitios. Los valores que se obtienen muestran tendencias positivas en los siete sitios analizados, tanto en el análisis de cada una de las series como en la comparación con Veracruz. Los resultados muestran una menor tendencia en Veracruz y Alvarado con 1.89 mm año-1 y 1.79 mm año-1, respectivamente, y de 2.76 mm año-1 en Alvarado cuando se considera la tendencia relativa a Veracruz (ver Cuadro A.1 en Anexo A, apartado 1.2). Progreso muestra una tendencia de 2.45 mm año-1 o de 2.60 mm año-1 con respecto a Veracruz. Le siguen Cd. del Carmen, Camp., Coatzacoalcos, Ver., y Tuxpan, Ver., con tendencias entre 3 y 4 mm año-1, mientras que en Cd. Madero, Tamps., la tendencia es mucho mayor con un valor de 9.16 mm año-1 y de 7.93 mm año-1 con respecto a la variación del nivel del mar en Veracruz. Tendencias del nivel del mar en el Océano Pacífico. Figura III.8. Tendencia del nivel del mar en Acapulco, Gro. 18 Figura III.9. Tendencia del nivel del mar en Ensenada, B.C. Figura III.10. Tendencia del nivel del mar en Guaymas, Son. 19 Figura III.11. Tendencia del nivel del mar en La Paz, B.C.S. Figura III.12. Tendencia del nivel del mar en Manzanillo, Col. 20 Figura III.13. Tendencia del nivel del mar en Mazatlán, Sin. Figura III.14. Tendencia del nivel del mar en Puerto Ángel, Oax. 21 Figura III.15. Tendencia del nivel del mar en Salina Cruz, Oax. Figura III.16. Tendencia del nivel del mar en San Carlos, B.C.S. 22 Figura III.17. Tendencia del nivel del mar en Topolobampo, Sin. Cuadro III.2. Tendencias del nivel del mar para los sitios analizados en el Pacífico. Tendencia Período (mm/año) Acapulco, Gro. -2.44 1952-1999 Ensenada, B.C. 2.73 1956-1992 La Paz, B.C.S. 1.04 1952-1991 Manzanillo, Col. 3.28 1954-1988 Mazatlán, Sin. 1.85 1953-1992 Puerto Ángel, Oax. 1.70 1967-1990 Salina Cruz, Oax. 1.13 1952-1992 San Carlos, B.C.S. 16.08 1968-1987 Topolobampo, Sin. 2.95 1952-1992 Guaymas, Son. 4.23 1951-1991 Nota: Se indica el período en el cual hay datos disponibles. Sitio No. de años en el cálculo 36 30 20 25 19 7 26 8 19 25 En las estaciones del Pacífico mexicano sobresale la tendencia negativa en Acapulco (ver Figura III.8), la cual es observada tanto en la pendiente de la serie como con respecto a las variaciones observadas en Mazatlán, Ensenada y Salina Cruz (ver Anexo A.1 y Cuadro A.5). En las gráficas de las series de las diferencias entre Acapulco y los otros sitios es notable el descenso en el año de 1962 debido a un movimiento de la corteza terrestre provocado por un doble sismo, el cual fue documentado por Ortiz, et. al (2000). Este evento provocó una elevación de la corteza terrestre de 22 cm, con una disminución relativa del nivel medio del mar. En las tendencias, previas y posteriores a este evento, se observa un aumento en el nivel medio del mar que se interrumpe con el evento sísmico. 23 En todas las demás estaciones se observan tendencias positivas en el nivel medio del mar. En el sur de México, en Puerto Ángel y en Salina Cruz, se observan tendencias de 1.70 mm año-1 y 1.13 mm año-1 respectivamente, y al compararlas con otros sitios Puerto Ángel mantiene valores similares y Salina Cruz disminuye su tendencia (ver Anexo A.1 y Cuadro A.5). Nótese que al comparar Puerto Ángel con Salina Cruz, la tendencia aumenta ligeramente a 2.08 mm año-1. En Mazatlán hay un período de muestreo entre 1953 y 1975 que se interrumpe y vuelve a haber registros hasta 1989 y 1990. Es notable que entre un período y otro hay un aparente incremento en el nivel del mar que no parece corresponder con la tendencia observada en el primer período. Por lo tanto, los valores de las tendencias relativas a Mazatlán deben tomarse con cautela 5. En Manzanillo se observó una tendencia de 2.38 mm año-1 y al compararla con Ensenada el valor aumenta ligeramente a 3.62 mm año-1 (ver Anexo A.1 y Cuadro A.5). En Topolobampo, Sin., se obtuvo una tendencia de 2.95 mm año-1, que se eleva a 3.53 mm año-1 al calcular la tendencia relativa a Salina Cruz y disminuye a 0.59 mm año-1 al compararla con Ensenada. En Guaymas, Son., se encontró una tendencia más alta, de 4.23 mm año-1, la cual aumenta a 6.13 mm año-1 y a 7.41 mm año-1 al evaluarla con respecto a Ensenada y a Salina Cruz, respectivamente. La serie de tiempo de San Carlos, B.C.S., es muy corta y por lo tanto las tendencias encontradas no son significativas. En Ensenada, que es una de las series más largas, se encontró una tendencia de 2.73 mm año-1, la cual aumenta a 5.21 mm año-1 al compararla con Salina Cruz. En conclusión las series de datos del Servicio Mareográfico de la UNAM muestran tendencias de aumento en el nivel del mar en todos los sitios analizados excepto en Acapulco, Gro., en donde se observa una tendencia negativa. Las series ajustadas con base en la tendencia relativa a las series más largas también muestran que el nivel del mar ha aumentado. Las tendencias observadas en el nivel del mar muestran que es muy importante continuar con las mediciones de esta variable en los sitios en que se tienen las series de tiempo más largas para poder actualizar estas estimaciones. Algunos de los sitios considerados se han mantenido y otros se están rehabilitando, por lo que habrá que dar seguimiento a los datos que se vayan generando para actualizar estas tendencias las cuales fueron calculadas con datos que se interrumpieron, en la mayoría de los casos, en las décadas de los ochentas o noventas. 3.2 Proyecciones de incremento en el nivel del mar En este apartado se presentan las proyecciones de incremento en el nivel del mar a nivel global, nacional y regional. Las proyecciones globales son las citadas en el Cuarto Informe de Evaluación (2007) del IPCC; en cuanto a las proyecciones nacionales son las estimadas por el Laboratorio de Estudios Ambientales del Departamento de Geociencias de la Universidad de Arizona disponibles en http://geongrid.geo.arizona.edu/arcims/website/slrworld/viewer.htm, algunas estimaciones fueron adecuadas según la metodología del Anexo A.1; y las proyecciones regionales fueron estimadas con diversas metodologías dependiendo de la disponibilidad de información en cada sitio, la mayoría de ellas son cálculos realizados a partir de imágenes de satélite, dichas metodologías pueden encontrarse en el Anexo A.1. 5 Se sabe que el sitio de muestreo se modificó, pero habrá que revisar la fecha en que se realizó el cambio y si éste puede ser la causa de dicho incremento. 24 Proyecciones globales de incremento en el nivel del mar. Las dos causas fundamentales de la elevación del nivel del mar son la expansión térmica de los océanos (el agua se expande en la medida en que se calienta) y la pérdida de hielo terrestre debido al derretimiento incrementado. Se estima que la contribución total del derretimiento de los glaciares, los casquetes polares y los mantos de hielo al incremento del nivel del mar para el período de 1993 a 2003 fue de 1,2 a ± 0,4 mm/año. Para el Ártico, la extensión promedio anual del hielo marino ha disminuido 2.7 ± 0.6% por decenio, mientras que la extensión del hielo marino de verano ha disminuido 7.4 ± 2.4% por decenio. La extensión del hielo marino antártico no muestra tendencias significativas. El derretimiento de los glaciares y de los casquetes polares adicionó 0,77 ± 0,22 mm año–1 a la elevación del nivel del mar entre 1991 y 2004 (IPCC, 2007). La Figura III.18 muestra la evolución del nivel del mar medio mundial en el pasado y cómo se proyecta para el siglo XXI de acuerdo con la propuesta del escenario A1B 6. Figura III.18. Serie cronológica7 del nivel del mar medio mundial (desviación de la media de 1980 a 1999) en el pasado y su proyección. Fuente: IPCC, 2007. Nota: El sombreado gris muestra la incertidumbre en cuanto a las tasas de variaciones del nivel del mar calculadas a largo plazo. La línea roja es una reconstrucción del nivel del mar medio mundial a partir de mediciones de mareas y el sombreado rojo denota el rango de variaciones a partir de la curva. La línea verde muestra el nivel del mar medio mundial observado con altimetría satelital. El sombreado azul representa el rango de las proyecciones de los modelos para el escenario A1B en el siglo XXI, en comparación con la media de 1980-1999, y se ha calculado independientemente de las observaciones. 6 7 Consultar: IPCC, 2001. Special Report on Emissions Scenarios (SRES). No hay mediciones mundiales del nivel del mar antes de 1870. 25 El calentamiento medio mundial de superficie proyectado para finales del siglo XXI (2090–2099) depende del escenario, y el calentamiento real se verá afectado significativamente por las emisiones reales que ocurran (ver Cuadro III.3). Cuadro III.3. Calentamiento medio mundial proyectado para la superficie e incremento del nivel del mar a finales del siglo XXI. Cambio de temperatura (°C a 2090–2099 relativo a a 1980–1999) El aumento del nivel del mar (m a 2090–2099 relativo a 1980–1999) Caso Mejor cálculo Margen probable Margen basado en modelos Se excluyen los cambios rápidos, dinámicos futuros en el flujo de hielo 0,6 0,3 – 0,9 NA 1,8 1,1 – 2,9 0,18 – 0,38 Escenario A1T 2,4 1,4 – 3,8 0,20 – 0,45 Escenario B2 2,4 1,4 – 3,8 0,20 – 0,43 Concentraciones durante b el Año constante 2000 Escenario B1 Escenario A1B 2,8 1,7 – 4,4 0,21 – 0,48 Escenario A2 3,4 2,0 – 5,4 0,23 – 0,51 Escenario A1FI 4,0 2,4 – 6,4 0,26 – 0,59 Fuente: IPCC (2007). Notas: a Estos cálculos se evalúan a partir de una jerarquía de modelos que abarca un modelo sencillo de clima, varios Modelos de Sistemas Terrestres de Complejidad Intermedia (EMIC), y una gran cantidad de Modelos de Circulación General Atmósfera-Océano (MCMAO). b La composición constante para el año 2000 se deriva solamente de MCMAO. La dilatación térmica contribuye entre un 70 a un 75% al cálculo óptimo para cada escenario. En todos los escenarios de emisiones, excepto en el B1, la tasa promedio de aumento del nivel del mar durante el siglo XXI excede muy probablemente la tasa media entre 1961–2003 (1,8 ± 0,5 mm año1). Se prevén pérdidas en la masa de los glaciares, en los casquetes de hielo y en el Manto de Hielo de Groenlandia durante el siglo XXI porque será mayor el derretimiento que la cantidad de nieve caída. Los modelos actuales indican que el Manto de Hielo de la Antártida permanecerá demasiado frío, no se derretirá, y puede que gane masa en el futuro a raíz de un incremento en las nevadas, lo que reducirá el aumento del nivel del mar. Sin embargo, los cambios en la dinámica del hielo podrían aumentar las contribuciones de Groenlandia y la Antártida al aumento del nivel del mar en el siglo XXI. Proyecciones nacionales de incremento en el nivel del mar. Escenario con incremento del nivel del mar de 2 m. En la Figura III.19 se muestra el escenario de 2 m para México. En términos absolutos Campeche, Sinaloa y Quintana Roo podrían ser los estados más afectados. Se estima una superficie afectada total de 29,622.6 km2 en México (Cuadro III.4). En términos relativos, Tabasco es el estado más afectado con el 14 % de su superficie; le siguen Quintana Roo, Campeche y Sinaloa con 11.94, 9.50 y 8.90 % respectivamente. 26 Figura III.19. Escenario de incremento del nivel del mar de 2 m para México. Fuente: Laboratorio de Estudios Ambientales del Departamento de Geociencias de la Universidad de Arizona Nota: El mar en azul, las zonas susceptibles en rojo y el territorio en verde con las poblaciones en blanco. Cuadro III. 4. Estados costeros más impactados, por el incremento en el nivel del mar de 2 m. Superficie afectada Superficie relativa 2 (km ) (%) Campeche 5,503.0 9.50 Sinaloa 5,106.6 8.90 Quintana Roo 5,058.0 11.94 Veracruz 3,806.0 5.30 Tabasco 3,463.0 14.00 Tamaulipas 2,886.0 3.60 Yucatán 2,484.0 6.27 Nayarit 1,316.0 4.73 Total 29,622.60 Nota: La superficie relativa esta en función de la superficie total del estado. Estado 27 Escenario con incremento del nivel del mar de 1 m. De las Figuras III.20 a la III.24 se muestran los escenarios de 1 m de incremento, se encontró que en términos absolutos, que el orden de afectación se mantiene similar al incremento de 2 m. En total la superficie afectada se estima en 22,078.4 km2 para México (Cuadro III.5). En términos relativos, Quintana Roo, Tabasco, Campeche y Sinaloa podrían ser los más afectados con un porcentaje entre el 6.58 y 9.47 % de su superficie. Figura III.20. Escenario de incremento del nivel del mar de 1 m para México. Fuente: Laboratorio de Estudios Ambientales del Departamento de Geociencias de la Universidad de Arizona Nota: El mar en azul, las zonas susceptibles en rojo y el territorio en verde con las poblaciones en blanco. 28 Cuadro III. 5. Estados costeros más impactados, por el incremento en el nivel del mar de 1 m. Superficie afectada Superficie relativa 2 (km ) (%) Campeche 4,321.0 7.46 Quintana Roo 4,011.0 9.47 Sinaloa 3,775.4 6.58 Veracruz 3,591.0 5.00 Tabasco 2,024.0 8.18 Yucatán 1,862.0 4.70 Tamaulipas 1,604.0 2.00 Nayarit 890.0 3.20 Total 22,078.4 Nota: La superficie relativa esta en función de la superficie total del estado. Estados Figura III.21. Escenario de incremento del nivel del mar de 1 m (Región Noroeste). Fuente: Laboratorio de Estudios Ambientales del Departamento de Geociencias de la Universidad de Arizona Nota: El mar en azul, las zonas susceptibles en rojo y el territorio en verde con las poblaciones en blanco. 29 Figura III.22. Escenario de incremento del nivel del mar de 1 m (Región Golfo Norte). Figura III.23. Escenario de incremento del nivel del mar de 1 m (Región Golfo Sur). Fuente: Laboratorio de Estudios Ambientales del Departamento de Geociencias de la Universidad de Arizona Nota: El mar en azul, las zonas susceptibles en rojo y el territorio en verde con las poblaciones en blanco. 30 Figura III.24. Escenario de incremento del nivel del mar de 1 m (Región Pacífico Sur). Fuente: Laboratorio de Estudios Ambientales del Departamento de Geociencias de la Universidad de Arizona Nota: El mar en azul, las zonas susceptibles en rojo y el territorio en verde con las poblaciones en blanco. Utilizando otra metodología descrita en el Anexo A.2, apartado 2.2, se obtuvo un mapa de áreas inundadas con el incremento del nivel del mar de 1 metro con mayor definición 8 (Figura III.25), así como otra estimación de la superficie afectada para los estados de Campeche, Tabasco, Quintana Roo, Tamaulipas y Veracruz (Cuadro III.6). La mayor extensión de área inundada, relativa por estado, será en Campeche, resultados similares fueron encontrados por Ortíz y Méndez (1999) pero en su análisis tomaron en cuenta los procesos costeros de erosión, hundimiento costero, entre otros. Cuadro III. 6. Estados costeros más impactados, por el incremento en el nivel del mar de 1 m. Superficie afectada Superficie relativa 2 (km ) (%) Campeche 3,643.9 6.5 Tabasco 3,065.7 12.6 Quintana Roo 2,447.9 2.4 Tamaulipas 964.5 1.2 Veracruz 762.2 1.1 Nota: La superficie relativa esta en función de la superficie total del estado. Estados 8 Con resolución de 90 m en la horizontal y de 1 metro en la vertical. 31 Figura III.25. Escenario de incremento del nivel del mar de 1 m para México. Nota: el área roja muestra las zonas de posible afectación por aumento de 1 m del nivel del mar. Escenario con incremento del nivel del mar de 0.6 m. En el Sureste Mexicano, se observa que la costa de Quintana Roo y Campeche podrían ser las más afectadas (Figura III.26, ver Anexo A.2, apartado 2.3). Sin embargo, en estos estados se observa la influencia de los errores introducidos por la vegetación y que sólo es posible corregir con mediciones más precisas. En Veracruz se observa la posible afectación en los municipios de Alvarado, Tuxpan y Pánuco (Figura III.27). El estado de Tamaulipas podría tener afectaciones en la zona del río Pánuco y del río Bravo así como en su sistema lagunar adyacente (Figura III.28). Para las costas de Sinaloa y Nayarit, se observan posibles penetraciones del mar de aproximadamente 35 km en la región norte entre Ahome y Guasave, mientras que en Nayarit se observa alrededor de la zona de Tuxpan. Sin embargo es posible que los resultados estén influenciados por errores debido a la cobertura vegetal, principalmente manglares, que son muy abundantes en esta región (Figura III.29). Para el escenario de 0.6 m de incremento, se encontró que Tabasco, Campeche y Sinaloa podrían ser los estados más afectados del País (Cuadro III.7). 32 Cuadro III. 7. Estados costeros más impactados, por el incremento en el nivel del mar de 0.6 m. Superficie (%) Campeche 7,698 13.29% Sinaloa 5,445 9.49% Tabasco 5,240 21.18% Quintana Roo 2,177 5.14% Nayarit 1,967 7.07% Veracruz 1,939 2.70% Tamaulipas 1,764 2.20% Yucatán 1,018 2.57% Nota: La superficie relativa esta en función de la superficie total del estado. Estados Superficie 2 (km ) Figura III. 26. Escenario de incremento del nivel del mar de 0.6 m para las costas de los estados de Campeche, Quintana Roo y Yucatán. 33 Figura III. 27. Escenario de incremento del nivel del mar de 0.6 m para las costas de los estados de Veracruz y Tabasco. Figura III. 28. Escenario de incremento del nivel del mar de 0.6 m para las costas del estado de Tamaulipas. 34 Figura III.29. Escenario de incremento del nivel del mar de 0.6 m para las costas de los estados de Sinaloa y Nayarit. Proyecciones regionales de incremento en el nivel del mar. Veamos ahora la proyección regional de algunos puntos críticos a nivel nacional. Laguna de Términos en Campeche Para los escenarios de emisiones de GEI A1 y B2 se estimaron los incrementos posibles del nivel del mar para la costa de Campeche de los años 2030, 2050 y 2100 9. En el Cuadro III.8 se muestran los resultados con los valores de las proyecciones del modelo Magicc, de 8 cm para el año 2030, 13.5 cm para 2050, y 33 cm en el 2100, tratándose de un escenario optimista. Cuadro III.8. Elevación del nivel medio del mar bajo escenarios de emisiones de GEI A1 y B2. Año 2030 2050 2100 9 Escenario A1 (cm) 8.0 13.5 33.0 Escenario B2 (cm) 8.5 15.7 39.2 Metodología en anexo A.2 apartado 2.4 35 Las zonas de la costa de Campeche que podrían ser afectadas se identificaron a partir del modelo de elevación del nivel del mar generado mediante un interpolador, obteniendo las cotas que corresponden a las elevaciones 8, 13 y 33 cm (Figura III.30, ver metodología en Anexo A.2 ). Ante un escenario de aumento de 8 cm, se presentarían afectaciones en la Península de Atasta y Punta Disciplina, así como en parte de la Isla del Carmen; en tanto que con 33 cm, la región comprendida por la Laguna de Términos, se conformaría como una bahía para el año 2100; Igualmente la mayor parte del litoral de Campeche quedaría cubierto por el mar, lo que conlleva a la potencial desaparición de la Isla del Carmen. Las costas de Campeche para los años 2030, 2050 y 2100, se erosionarán e inundarán, empezando por la península de Atasta, siguiendo con el interior de la laguna de Términos y culminando con la Isla del Carmen. Figura III.30. Escenarios de incremento del nivel del mar para el litoral del estado de Campeche. Planicie del estado de Tabasco Para la planicie Tabasqueña se muestran los resultados en la Figura III.31, la ciudad de Villahermosa está en el centro de la imagen claramente rodeada por zonas bajas. Más de la mitad del estado tendrá problemas de inundación recurrente, durante las próximas décadas esta proyección se mostrará esporádicamente debido a los impactos por fenómenos hidrometeorológicos extremos, aunque para alcanzar el nivel de 6 metros se requieren más condiciones que únicamente la del incremento del nivel del mar, cuando ocurran en conjunto éstas condiciones como lluvia 36 intensa continua, suelo saturado, aumento de marea y oleaje; el incremento del nivel del mar exacerbará las condiciones para alcanzar un desastre por inundación hacia finales de siglo. Figura III.31. Escenario de incremento del nivel del mar de 6 m para el estado de Tabasco bajo condiciones de fenómenos extremos. Nota: En rojo zonas cuya elevación es menor o igual a 6 m; En café con elevación mayor a 6 m y menor a 40 m; mientras que en gris mayores a 40 m. Riviera Maya en Quintana Roo La costa oriental de Quintana Roo consiste de una baja pendiente en la llanura costera compuesta de los humedales, playas de duna-retrocedidas, lagunas costeras y arrecifes bordeantes (Jordan y Rodríguez, 2003), la estructura y forma de ésta, es controlada casi completamente por la dinámica sedimentaria de estos ecosistemas. Cualquier predicción del futuro impacto del incremento del nivel del mar, en estos sistemas requiere un análisis detallado de su elevación y respuesta sedimentaria. La elevación puede usarse para dar una simple estimación del máximo potencial de inundación y la respuesta sedimentaria es necesaria para proporcionar la reacción costera más realista de tal incremento. En la Figura III.32. se muestra el escenario posible para el norte Quintana Roo, bajo varios escenarios de incremento del nivel del mar para el año 2100, mediante un modelo de elevación digital basado en datos de altimetría ajustados a la vegetación. 37 Figura III.32. Escenarios de incremento del nivel del mar en el litoral del norte de Quintana Roo para el año 2100. a b c d Nota: a) Escenario en ausencia de la inestabilidad de las capas de hielo. b) Escenario con incremento de 0.5 m, c) escenario con incremento de 1.5 m, c) Escenario de 6 m como el resultado del colapso de las capas de hielo. 38 Las diversas proyecciones de las inundaciones, causan cada vez más una significativa alteración de las costas y terrenos bajos. La inundación de + 0.5 m causará serios retrocesos de la playa y parcial inundación del humedal parálico. La inundación de +1.5 m aumentará el retroceso de la playa y completa pérdida de la playa en algunas áreas. También inundará totalmente los humedales y parcialmente las áreas bajas. Finalmente, la inundación de + 6 m, causará la completa pérdida de la playa y del humedal en todas las áreas y restablecerá la costa, la cual será significativamente inundada. Proyecciones locales de incremento en el nivel del mar. Se realizaron simulaciones experimentales bajo escenarios de incremento del nivel del mar para tres deltas del Golfo de México, el río Grijalva, Coatzacoalcos y Pánuco (la metodología se describe en el Anexo A.2, apartado 2.7). Los resultados se presentan a manera de resumen pero puede encontrarse, en el mismo anexo, información detallada. Dichas simulaciones se realizaron para tres temporadas, la de secas, de lluvia y de nortes con la finalidad de observar el comportamiento de la penetración de la marea y la elevación de la superficie libre del río por incrementos en el nivel del mar de 40, 60 y 100 cm. Rio Grijalva En la temporada de secas, bajo condiciones normales de marea, se observa la influencia de la misma hasta la localidad de Frontera y la isla del Buey; con un incremento del nivel del mar de 40 cm, se aprecia una mayor penetración de la marea pasando la isla del Buey, presentando elevación de la superficie libre de 20 cm, a una distancia de 4000 m sobre el río y no representa posibilidades de inundaciones salvo en la desembocadura donde los registros de elevaciones obtenidas por el modelo son de 45 a 60 cm en promedio; para incrementos del nivel del mar de 60 cm y 100 cm, se observa un mayor aumento entre 8 y 10 cm pasando los 4500 m respectivamente, cabe mencionar que las elevaciones de la superficie libre en los perfiles presentaron mayor magnitud en la desembocadura (ver Figura III.33 y Anexo A.2, apartado 2.7). Con un gasto en la temporada de lluvias de 3,435.99 m3/s bajo condiciones normales de marea, se aprecia que la influencia de la marea no se presenta, es decir, el gasto del río es mayor a la penetración del mar; para incrementos del nivel del mar de 40 cm, se observa una ligera penetración de la marea siendo más notorio en la desembocadura del propio río. Para los incrementos del nivel del mar de 60 cm se presenta una mayor penetración pasando los 2500 m con una elevación en la superficie de 10 cm, lo que no presenta una posible inundación en zonas aledañas al río y principalmente al puerto de Frontera, el cual es la población más cercana ante un evento de inundación; y para 100 cm un aumento en la elevación de 10 cm pasando los 4000 m medidos desde la desembocadura. Con un gasto menor al de la temporada de lluvias, de 2053.48 m3/s, en la temporada de nortes, bajo condiciones normales de marea, se puede observar que existe una ligera influencia de la marea en el río Grijalva, aunque el gasto del río es considerable, la elevación de la superficie libre registró a una distancia de 1800 m aproximadamente, con un aumento en la elevación de la superficie libre de 5 cm en promedio; Para un incremento del nivel del mar de 40 cm, donde se aprecia una influencia a 3000 m sobre el río, con un aumento de 30 cm. Para los escenarios de 60 cm, se tienen registros de elevación aproximadamente de 10 cm a 4000 m, mostrando una penetración de la marea más extensa sobre el río para la elevación de 100 cm después de los 4200 m con una elevación de 8 cm. Se concluye que en el río Grijalva, la condición que podría agravar la magnitud de las inundaciones sería durante la temporada de nortes con un incremento del nivel de mar de 40 cm al potenciar el 39 efecto de la marea, pasando de condiciones actuales a futuras en la penetración de 1,800 a 3,000 m y en la elevación de 5 a 30 cm. Figura III.33. Proyecciones en la elevación de la superficie libre del río Grijalva bajo incrementos del nivel del mar. Río Coatzacoalcos Para la temporada de secas, bajo condiciones normales de marea, no existe un incremento apreciable en la elevación de la superficie libre, aunque el gasto de 355.22 m3/s del río para esta 40 temporada sea relativamente pequeño. Con un incremento del nivel del mar de 40 cm a las condiciones normales de marea, se observa un leve aumento en el nivel de superficie libre del río hasta aproximadamente 4000 m, aguas arriba y con un valor máximo de 30 cm en la desembocadura. Al aumentar el nivel del mar a 60 cm, consecuentemente el nivel de la superficie libre del río también aumenta, hasta alcanzar un nivel máximo de 50 cm, pero decayendo paulatinamente hacia aguas arriba, siendo visible solo hasta los 4000 m. Lo mismo sucede al realizar las simulaciones con incremento del nivel del mar de 100 cm, la superficie del río se incrementa los primeros 4 km, apreciándose un máximo de 85 cm en la zona de interacción con el mar, ésta elevación disminuye rápidamente hasta aproximadamente 25 cm a unos 1500 m aguas arriba de la desembocadura y desde ahí manteniéndose constante aprox. a 10 cm, hasta una distancia alrededor de 5000 m (ver Figura III.34 y Anexo A.2, apartado 2.7). Para la temporada de lluvias, de manera similar que para la temporada de secas, las simulaciones bajo condiciones normales de marea, mostraron que no existe un aumento en la superficie libre del río, es evidentemente que el flujo del río sea dominante debido al gasto de aproximadamente 1,704.7 m3/s. Con incremento del nivel del mar de 40 cm se presenta un aumento máximo de 20 cm, siendo 10 cm menor que el incremento máximo presentado en la temporada de secas, lo cual se explica por el aumento en el gasto del río. Asimismo ocurre en el escenario con 60 cm adicionales a las condiciones de marea para agosto, el nivel del río se incrementa hasta 35 cm, aproximadamente 3000 m aguas arriba, 55 cm fue el incremento máximo en la elevación bajo el incremento del nivel del mar de 100 cm, siendo perceptible hasta los 5000 m con 10 cm de elevación. Para la temporada de nortes con condiciones normales de marea; no se aprecia influencia de ésta, aguas arriba del río. Sin embargo, en los otros escenarios, con 40, 60 y 100 cm, si existe tal influencia, incrementándose el nivel de superficie libre del río con valores máximos de 45, 75 y 115 cm, respectivamente. El incremento de la superficie libre del río se disipa aproximadamente a los 5000 m aguas arriba. También se puede apreciar que aunque el gasto del río para esta temporada (2056.5 m3/s) es mayor que el gasto en la temporada de lluvias, los niveles máximos de superficie libre son también mayores. Se concluye para el río Coatzacoalcos, la condición que podría agravar la magnitud de las inundaciones sería durante la temporada de nortes con un incremento del nivel de mar de 40 cm al potenciar el efecto de la marea, pasando de condiciones actuales a futuras en la elevación de 0 cm a 45 cm; para 60 cm de incremento del nivel del mar con elevaciones de 0 a 75 cm; y para incrementos del nivel del mar de 100 cm con elevaciones de 0 a 115 cm. Figura III.34. Proyecciones en la elevación de la superficie libre del río Coatzacoalcos bajo incrementos del nivel del mar. 41 Río Pánuco Para condiciones normales de marea en la temporada de secas, se observa que la penetración de la marea es de 2000 m con una elevación aproximada de 5 cm; con incremento del nivel del mar de 40 cm, se observan elevaciones de la superficie libre de 10 a 15 cm promedio, a una distancia de 4000 m aguas arriba. Para incremento del nivel del mar de 60 cm, se aprecia que la influencia de la marea se presenta a una distancia de 5000 m con elevaciones promedio de 10 cm, para el incremento del nivel del mar de 100 cm y podrían presentar 8 cm de elevación a una distancia aproximada de 6000 m de la desembocadura (ver Figura III.35 y Anexo A.2, apartado 2.7). Analizando la temporada de lluvias en condiciones normales de marea, se presenta en la desembocadura una elevación en promedio de 15 cm. Para incrementos de nivel del mar de 40 cm, la penetración de la marea alcanza una distancia de 2000 m con una elevación de la superficie libre de 10 cm aproximadamente. Para las condiciones de 60 cm, la influencia de la marea sobre el río se presenta a una distancia de 5000 m desde la desembocadura con una elevación de 12 cm; siendo el caso más notorio para estos escenarios cuando se sobre eleva 100 cm se podría presentar aumentos en la superficie libre en promedio de 8 cm a una distancia de 7000 m. Por último, para el escenario en temporada de nortes bajo condiciones normales de marea, la influencia de ésta, es ligera y alcanza a notarse a los 1000 m aproximadamente con una elevación de 10 cm en promedio, así mismo cuando se presenta un incremento del nivel del mar de 40 cm, la penetración de la marea se nota a una distancia de 4000 m, con un registro de 12 cm de elevación de la superficie libre. Para el incremento del nivel del mar de 60 cm, se observa notoriamente que la elevación de 10 cm en promedio, se presenta alrededor de los 6000 m aguas arriba, donde en la desembocadura alcanza elevaciones cercanas a los 75 cm. Cuando se presenta la elevación de 100 cm, el perfil de elevación presenta a una distancia de 6000 m, un aumento de 12 cm. 42 Debido a todo lo anterior, se puede decir que en ningún caso, la marea por si sola podría provocar un desbordamiento de alguno de estos tres ríos. Este tipo de situaciones podrían presentarse con incremento en las precipitaciones y consecuentemente de los escurrimientos en las cuencas propias de cada río. Figura III.35. Proyecciones en la elevación de la superficie libre del río Pánuco bajo incrementos del nivel del mar. 43 Tortugas marinas Los Modelos de Circulación General Océano-Atmósfera (AOGCM, por sus siglas en inglés) sugieren que el calentamiento en la región de México y Centroamérica, entre los años 2000 y 2100, será mayor que en el resto del globo, mientras que la precipitación decrecerá significativamente (Cuadro III.9). En ese periodo las anomalías térmicas se incrementarán de 1.5 a 3ºC en el escenario más frío y de 3 a poco más de 5ºC, en el más cálido (Christensen et al., 2007), lo cual contrasta con las condiciones del siglo XX, cuando fue de alrededor 0.5ºC. Según estos autores, el impacto será más acusado durante la primavera en la masa continental (Cuadro III.9) y en la costa. Cuadro III.9. Proyecciones estacionales para la Región México y Centroamérica (10º a 30ºN, 116 a 83ºO). Respuesta térmica Respuesta pluvial (%) (°C) Estaciones (meses) Min 25 50 75 Max T yrs Min 25 50 75 Max T yrs Estaciones extremas (%) Cálida Húmeda Seca DEF 1.4 2.2 2.6 3.5 4.6 15 -57 -18 -14 -9 0 >100 96 2 25 MAM 1.9 2.7 3.6 3.8 5.2 10 -46 -25 -16 -10 15 75 100 2 18 JJA 1.8 2.7 3.4 3.6 5.5 10 -44 -25 -9 -4 12 90 100 * 24 10 -45 -10 -4 7 24 100 * 15 10 -48 -16 -9 -5 9 100 2 33 SON Anual 2 2.7 3.2 3.7 4.6 1.8 2.6 3.2 3.6 5 65 Fuente: Christensen et al., 2007. Aunado a este proceso, las costas y mares mexicanos presentan cambios derivados de otros eventos naturales, cuyos ciclos duran unos cuantos años, pero cuya extensión es global, tales como El Niño-La Oscilación del Sur (ENOS)10 y la Oscilación Decadal del Pacífico Norte (OPN) en el Pacífico mexicano y la Oscilación del Atlántico Norte (OAN) y la Oscilación Multidecadal del Atlántico (OMA), en el Golfo de México y Caribe. Cabe mencionar que existen teleconexiones entre regiones, por lo cual El Niño influye en la costa nororiental y oriental mexicana, a través de la intensificación de los vientos del norte (Nortes). Por otro lado, en los años posteriores a este evento disminuye la frecuencia de los huracanes y tormentas tropicales en el Atlántico. Las tortugas marinas son especies muy antiguas cuya capacidad de adaptación está determinada por la rapidez y escala geográfica a la que ocurren los cambios en el ambiente; si bien sobrevivieron a las cuatro grandes glaciaciones del Pleistoceno y otra multitud de eventos de menor magnitud, que llevó a la extinción de los grandes mamíferos y han mantenido mecanismos fisiológicos que les han permitido amortiguar el efecto de los eventos cuyos ciclos son de corto y mediano plazo, se desconoce el impacto del incremento acelerado de la temperatura y los procesos asociados con éste. Se realizaron proyecciones de pérdida de hábitat de anidación por el aumento del nivel del mar de 1 m, en las playas Isla Aguada y Chenkan en el estado de Campeche. 10 El ENOS es un proceso de interacción océano-atmosfera, a cuya fase marina se le conoce como “Niño” de manera genérica; en este documento a la fase cálida del evento, durante la cual se intensifica el transporte de aguas del Centro del Pacífico hacia la costa mexicana, se le denominará “Niño” y Niña a la fase fría, durante la cual se incrementa el aporte de la corriente de California y el desplazamiento de las masas de aire de Norteamérica hacia territorio mexicano. 44 En la Figura III.36, se muestra el perfil de playa de Isla Aguada con incrementos del nivel del mar de 40, 60 y 100 cm. Considerando un incremento de 40 cm se puede observar como toda la zona de mesoplaya pasará a ser infraplaya, perdiéndose así la zona donde anidan alrededor del 40 % de las tortugas, esto es, perdiéndose los sitios aptos para la anidación. Figura III.36. Representación gráfica de la pérdida de hábitat de anidación en la playa Isla Aguada bajo incrementos del nivel medio del mar. Supraplaya Mesoplaya Infraplaya Posiblemente la supraplaya no se verá afectada en esta playa, siendo ésta una situación benéfica para las tortugas, ya que la mayoría anida en la supraplaya. En la Figura III.37 se muestra el resultado de la modelación de los escenarios de incremento en el nivel del mar para varias cotas en el área del campamento tortuguero de Chenkan. En la Figura se puede observar la superficie de costa a perder en los distintos escenarios, siendo que con solo un aumento de 40 cm, se estima perder prácticamente toda la playa, situación muy grave para el estado de Campeche y en particular para la tortugas que perderían su hábitat de anidación viéndose obligadas a desplazarse a nuevas zonas para poder cumplir con su ciclo biológico. Se perderían aproximadamente 14 m de amplitud de playa, desplazándose la zona de infraplaya a donde actualmente comienza la mesoplaya (Figura III.37), destruyéndose ésta última y perdiéndose a su vez la zona donde anidan el alrededor del 70 % de las tortugas, esto es, perdiéndose los sitios aptos para la anidación. En este sentido, la playa de Chenkan es un sitio muy crítico, altamente vulnerable por la erosión y la pérdida de hábitat de anidación. 45 Figura III.37. Representación grafica de la pérdida de hábitat de anidación en la playa de Chenkan con el aumento del nivel medio del mar. Supraplaya Mesoplaya Infraplaya Humedales Algunos autores sugieren que un ascenso en el nivel del mar mayor a los 12 cm en 100 años pueden llevar a que el ecosistema se colapse (Ellison y Stoddart 1991). Snedaker et al (1994) sugiere que los manglares han sobrevivido en Florida con ascensos en el nivel del mar de 23 a 37 cm en 100 años. En el Cuadro III.10 se puede observar la extensión de las áreas inundadas con un ascenso en el nivel del mar de un metro. Las nuevas zonas disponibles para los humedales, asumiendo la planicie costera a un metro por arriba del futuro ascenso del nivel del mar, en general presentan menores extensiones que las áreas afectadas por lo que se presentarán más perdidas que ganancias netas oscilando entre pérdidas del 20 al 94% de los humedales costeros dominantes en cada estado. Cuadro III.10. Pérdida neta en extensión de humedales (Km2) por algunos estados costeros de México asumiendo un ascenso en el nivel del mar de 1 metro para fines del siglo XXI. REGIÓN Sinaloa Quintana Roo Campeche Veracruz Tabasco Tamaulipas Yucatán Nayarit TOTALES Pérdida de Humedales (sumergencia) 3, 775.4 4, 011.0 4, 321.0 3, 591.0 2, 024.0 1, 604.0 1, 862.0 890.0 22, 078.0 Ganancia de hábitats espacios nuevos disponibles (2 m) 1, 331.2 1, 047.0 1, 182.0 215.0 1, 439.0 1, 282.0 622.0 426.0 7, 545.0 Ganancia neta (+) ó pérdida neta (-) - 2, 444.2 - 2, 954.0 -3, 139.0 -3, 376.0 - 585.0 - 322.0 -1, 243.0 464.0 -14, 533.0 % pérdida 64.7 73.9 72.6 94.0 28.9 20.1 66.8 52.1 65.8 46 IV. IMPACTOS Y VULNERABILIDAD ANTE EL INCREMENTO DEL NIVEL DEL MAR 4.1 Impactos por incremento del nivel del mar A nivel mundial se espera que el aumento del nivel del mar agrave las inundaciones, los oleajes de tormentas, la erosión, entre otros, poniendo en peligro los ecosistemas costeros y la infraestructura vital que sostiene el bienestar socioeconómico en las comunidades insulares, en deltas y en zonas costeras bajas (IPCC, 2007). Se prevé que el incremento del nivel del mar afecte negativamente a los humedales costeros, incluidos marismas de agua salada y manglares, con pronósticos de pérdidas mundiales del 33% si el nivel del mar aumenta 36 cm de 2000 a 2080, principalmente donde existe contención del lado que da a la tierra o privación de sedimentos. El incremento del nivel del mar y el desarrollo del ser humano están contribuyendo conjuntamente a las pérdidas de los humedales y manglares costeros y al aumento de daños ocasionados por inundaciones costeras en muchas zonas (IPCC, 2007). El aumento del nivel del mar ampliará las zonas de salinización de las aguas subterráneas y los estuarios. Se prevé que los manglares y arrecifes de coral se degraden aún más en el futuro, con consecuencias adicionales para las pesquerías y el turismo. Esto traerá como resultado una disminución de la disponibilidad de agua dulce para los seres humanos y los ecosistemas en las zonas costeras. La intrusión de agua de mar puede aumentar el hábitat de la pesquería en aguas salobres pero puede dañar considerablemente la industria de la acuicultura (IPCC, 2007). En México se ha identificado al delta de río Grijalba como una zona de media vulnerabilidad ante el incremento del nivel del mar (Figura IV.1). Figura IV.1. Vulnerabilidad relativa de los deltas costeros tal como indican las estimaciones de la población potencialmente desplazada por las tendencias actuales del nivel del mar hacia 2050. Fuente: IPCC, 2007. Nota: Vulnerabilidad extrema = >1 millón; alta = de 1 millón a 50.000; media = de 50.000 a 5.000. 47 El presente estudio identifica otras zonas del país como se puede observar el la Figuras III.25 a la III.28, casi todo el litoral costero del Golfo de México con afectaciones en las zonas costeras de los estados de Tamaulipas, Veracruz, Tabasco, Campeche, Yucatán, Quintana Roo, Sinaloa, Nayarit y Chiapas, hacia finales del presente siglo. Las zonas críticas serán la Laguna de Términos en Campeche; el Complejo Deltaico GrijalvaUsumacinta y el Sistema Lagunar Carmen-Pajonal Machona en Tabasco; La Reserva de la Biosfera Sian Kaa’n en Quintana Roo; y Marismas Nacionales en Nayarit y Sinaloa. Además del aumento del nivel del mar, mareas de tormenta asociado a ciclones tropicales y probablemente con mayor intensidad de precipitaciones, podría aumentar el potencial de inundación. En el futuro los efectos de los eventos hidrometeorológicos junto con el aumento del nivel del mar podrían ser más extensos, debido a los cambios de carácter temporal, intensidad, frecuencia y trayectoria de los eventos extremos. Caetano y Magaña (en proceso), hacen referencia a que los eventos extremos ocurren episódicamente, sin embargo pueden tener repercusiones a largo plazo en el ambiente y las poblaciones humanas. Estudios recientes (Emanuel, et al., 2004, 2008, Emanuel, 2005, Komar y Allen, 2008; Elsner, et al., 2008), muestran que hay indicios que la intensidad de los huracanes ha aumentado durante los últimos 30 años sobre el Océano Atlántico. Sin embargo, no hay consenso científico sobre los cambios en la frecuencia de éstos. Emanuel, et al. (2008) y Gutowski, et al. (2008), sugieren que el aumento de la cizalla del viento reduce el calentamiento global, lo cual debilita los huracanes, y puede reducir la frecuencia de los mismos. Los huracanes que tocan la costa atlántica, pueden producir mareas de tormenta de hasta de 5 m o más (Karl, et al., 2008). La potencia y la frecuencia de huracanes del Atlántico, se han incrementado sustancialmente en los últimos decenios. El IPCC (2007) y Karl, et al. (2008) indican que, basados en modelos numéricos, es probable que estos fenómenos serán más intensos, con aumentos en la temperatura de la superficie del mar tropical. Los efectos sobre la frecuencia de huracanes bajo el cambio climático en el Atlántico, aún no están determinados y son tema actual de estudios científicos (Elsner, et al., 2008, Emanuel, et al., 2008; Karl, et al., 2008). Los ciclones extratropicales (nortes), pueden también producir mareas de tormenta. Dichas tormentas han experimentado un desplazamiento hacia el norte en los últimos 50 años (Karl, et al., 2008), lo que conlleva a una reducción de frecuencia e intensidad de tormenta en las latitudes medias y el aumento de frecuencia e intensidad de tormentas en altas latitudes (Gutowski, et al., 2008; Karl, et al., 2008). Por lo tanto en el futuro los ciclones extratropicales intensos serán más frecuentes con vientos más fuertes y altura de las olas extremas aunque el número total de ciclones disminuirán. Para los eventos hidrometeorológicos extremos, que se han presentado en el Atlántico (Blake, et al., 2007), se hizo un análisis de la frecuencia de los huracanes extremos de 1988 al 2005, donde se pudo observar una tendencia de aumento de la frecuencia hacia el 2005, que culminó con 4 huracanes de categoría 5 resultado del cambio global climático, como se muestra en la siguiente Figura IV.2. 48 Figura IV.2. Huracanes extremos en el océano Atlántico. Número de Huracanes Extremos en el Atlántico (Período de 1988 al 2005) Número de huracanes 5 4 3 2 1 0 1985 1990 1995 2000 2005 2010 Año Quintana Roo Sin duda los impactos y efectos del cambio climático para las costas mexicanas, serán diferentes en magnitud y características para los estados costeros. En Quintana Roo, los impactos serán desastrosos para el turismo y por ende para la economía, ya que la gran mayoría de los complejos hoteleros y centros turísticos están asentados en áreas de posible inundación permanente por el ascenso del nivel del mar, aún cuando este se de en bajos niveles como 60 cm. Sin embargo, a pesar de tener un incremento en el número de fenómenos hidrometeorológicos extremos, la erosión costera en las playas de la riviera maya no ha sido considerable, como lo demuestra la presencia de playas erosivas-acumulativas con una tasa de erosión de menos de 1 m. Es importante, considerar que la existencia de una playa depende de 4 factores: 1) Fuente de sedimentos 2) Transporte litoral 3) Condiciones de energía de oleaje, corrientes y mareas no extremas. 4) Nivel del mar estable Para el caso de la riviera, la fuente de sedimentos es principalmente de origen biogénico, es decir, proviene de la erosión de la zona arrecifal y del material calcáreo de los litorales rocosos presentes en el área. El transporte litoral en la riviera, presenta interrupción de manera natural por puntas y litorales rocosos, además de la construcción de espigones, rompeolas, y obras civiles asociadas a la protección hotelera, lo cual produce áreas acumulativas y áreas erosivas. Los efectos causados por oleaje, marea y corrientes presentes en Nortes y huracanes, en cierta forma son disminuidos por la presencia de la zona arrecifal y de la Isla de Cozumel, sin embargo donde no se tiene esta protección la vulnerabilidad aumenta, sobre todo si se considera que la frecuencia e intensidad de huracanes se presenten más continuamente. Finalmente, el incremento 49 del nivel del mar es un proceso a largo plazo pero que ya esta presente y debe ser considerado dentro de los problemas de erosión de costas. La dinámica de las playas es muy compleja, donde intervienen diferentes factores desde los geológicos, oceanográficos y antropogénicos que para cada playa intervienen de diferente manera, por lo que cada playa debe ser estudiada de manera local sin dejar de tomar en cuenta el contexto regional. El aumento en frecuencia e intensidad de los huracanes en la región, es sin duda la amenaza crítica más importante ya que afectará no sólo a los ecosistemas costeros, sino que además impactará las construcciones hoteleras, centros turísticos, viviendas y sobre todo a la población, propiciando fuertes pérdidas en la economía regional (Huracán Wilma 2005, más de $10,000,000,000 millones de US dólares), en infraestructura y en ocasiones pérdidas de vidas humanas. Finalmente, se debe considerar que debido a la naturaleza cárstica de la Península de Yucatán el paulatino ascenso del nivel del mar y el aumento de la capilaridad, propiciarán la salinización de las fuentes de agua potable provocando la disminución de la calidad del agua para un gran número de poblaciones costeras, haciéndola inservible para uso humano, agricultura y procesos industriales. Sinaloa Así, en Sinaloa los mayores efectos serán sobre la agricultura (con ingresos cercanos a los $ 2,000,000,000 de pesos), la pesca y sobre todo para la acuicultura, debido a que la mayoría de las más de 480 granjas camaronícolas que existen, están localizadas en áreas que serán inundadas por el ascenso del nivel del mar. Los costos económicos serán cuantiosos y de igual manera propiciarán la cancelación de numerosas fuentes de trabajo para las sociedades locales. Aunque el desarrollo turístico no es tan grande como en otras regiones, también contribuye con importante porcentaje a la economía regional y a la creación de fuentes de empleo. Tabasco Para la región del estado de Tabasco, los efectos serán muy drásticos para la elevación del nivel del mar, ya que la mayoría del estado se asienta en planicies bajas y zonas de fácil inundación, lo cual origina problemas a nivel de catástrofe como la inundación de la ciudad de Villahermosa en octubre del 2007 (costo aproximado de $31,000 millones de pesos, CEPAL, 2007). Gran parte de sus litorales presentan también una tasa de erosión muy alta, lo cual eleva la vulnerabilidad de la región y pone en riesgo a las poblaciones costeras, su infraestructura carretera, las instalaciones petroleras como el Puerto de “Dos Bocas” de donde se movilizan diariamente 1.8 mmb de petróleo crudo. Por la elevación del nivel del mar, también se verían amenazadas muchas lagunas costeras que son el sustento económico de un gran núcleo de pescadores dedicados a la captura del ostión principalmente. Otra región que se vería muy afectada sería la de Pantanos de Centla, ya que la penetración de la cuña salina pondría en peligro a muchas especies dulceacuícolas que habitan esta región. Asentamientos Se estimo la población ubicada en las zonas que podrían resultar afectadas ante el incremento del nivel del mar para los municipios costeros de los estados del Golfo de México y para los estados de Sinaloa y Nayarit, con base en el censo nacional 2005 del Instituto Nacional de Estadística y Geografía (INEGI). 50 Los estados con la mayor población afectada son Veracruz, Quintana Roo y Tamaulipas. En tanto que en términos relativos, el orden es Quintana Roo, Campeche y Tamaulipas (Cuadro IV.1). En los estados considerados, se encontraron 3,288,511 habitantes que podrían resultar afectados. Sin embargo, es necesario realizar un estudio más detallado y minucioso que permita determinar con un mayor grado de confiabilidad el número de habitantes afectados así como de su ubicación exacta, además de extrapolar el número de habitantes que habrá hacia finales de siglo. Cuadro IV.1. Población afectada ubicada en zonas impactadas por el incremento del nivel del mar de 1 m. Veracruz Quintana Roo Tamaulipas Campeche Tabasco Yucatán Total Población Población total afectada 7,110,214 1,008,928 1,135,309 920,772 3,024,238 651,647 754,730 440,910 1,989,969 199,491 1,818,948 66,763 3,288,511 Población afectada (%) 14.18 81.10 21.54 58.41 10.02 3.67 Sector pesquero y acuícola El aumento de nivel del mar afectará a las actividades e infraestructuras pesqueras y acuícolas instaladas en las costas; con el aumento de temperatura, los fenómenos de El NIÑO y La NIÑA intensificarán sus efectos sobre los ecosistemas y consecuentemente sobre los recursos pesqueros y acuícolas. Los impactos sobre aquellas poblaciones pesqueras cuya distribución exceda los límites nacionales, son difíciles de prever a escalas locales. Humedales costeros Entre las predicciones del cambio climático global se espera que se afecten los patrones de temperatura y precipitación, la circulación oceánica y atmosférica, la tasa de elevación del nivel del mar, y la frecuencia, intensidad, así como la estacionalidad y distribución de los huracanes y las tormentas tropicales. La magnitud de estos cambios físicos y sus impactos subsecuentes en los humedales costeros y en las playas y dunas variará regionalmente. Hoy en día se conocen ya algunos de los efectos ecológicos que las tormentas tropicales y huracanes tienen; esta revisión indica que la estacionalidad de las tormentas, su frecuencia e intensidad pueden alterar la hidrología, la geomorfología, la estructura biótica, la selección natural, las tasas de extinción, la biodiversidad los patrones de energía, la productividad y los ciclos de nutrientes en los humedales costeros (Michener, et al., 1997). La ubicación de los humedales de agua dulce en zonas costeras y su dependencia del hidroperiodo e intrusión salina, los hacen particularmente vulnerables a los efectos del cambio climático. El cambio climático traerá modificaciones sustanciales de las superficies cubiertas por humedales de agua dulce, ya que éstos dependen de la presencia de zonas bajas donde se acumule el agua, y éstas se reducirán con el avance de la intrusión salina. La distribución y tamaño de las superficies de los humedales costeros se verán sustancialmente modificados. Algunas áreas de la tierra se volverán más húmedas y otras más secas, produciéndose un cambio en la distribución de los ríos, lagos y humedales (Carpenter, et al., 1992). Una de las 51 proyecciones del cambio climático en el centro del Golfo de México es mayor cantidad de lluvia y por tanto escurrimiento; estará llegando mayor cantidad de agua a las zonas bajas. Sin embargo hay un límite de distribución dado por la topografía, ya que el agua corre por superficies (por ejemplo planicies de inundación) o se acumula en depresiones. Por otro lado se incrementará la intrusión salina, por tanto el espacio entre estos dos límites se verá reducido en aquellas costas donde la planicie costera tiene una topografía que rápidamente se va elevando, i.e. muchas zonas del Pacífico, o bien se extenderá donde la geomorfología es muy plana como en los deltas del Papaloapan, Grijalva y Usumacinta. En estos casos se puede decir que los humedales van a migrar, sobre las tierras bajas donde ahora se desarrollan actividades productivas. La acumulación de agua modificará el hidroperiodo (ver Anexo B.2, apartado humedales) de los humedales alterando el tiempo que permanecen inundados y el nivel de la inundación. Esta última es crítica para los popales, ya que algunos como los de Sagittaria lancifolia, solamente alcanzan alturas de 80-150 cm. Si quedan totalmente sumergidos morirán. Popales más altos como los de Thalia geniculata, Pontederia sagitatta, Cyperus giganteus, pueden tolerar niveles un poco más altos, pero solamente durante tiempos cortos. Sin embargo todos ellos necesitan de un periodo con el suelo seco, para que las semillas germinen y las plántulas se establezcan. Los árboles de selva (el apompo -Pachira aquatica y la anona -Annona glabra) dispersan sus semillas por agua y mejora la germinación después de un tiempo flotando, pero se obtienen mayores porcentajes de germinación y plántulas con un sistema radicular mejor desarrollado cuando hay periodos con humedad, no solamente inundación (Infante, 2004; Infante y Moreno, 2005). Se ha visto que cuando se modifica el hidroperiodo y un humedal se convierte en un cuerpo de agua, su recuperación es casi imposible (Carpenter, et al., 1992). Por otro lado, una de las características de los popales, las selvas inundables y muchos tulares, es la presencia de suelos orgánicos. Estos son producto de la acumulación de materia orgánica a lo largo de cientos de años, y de las bajas tasas de descomposición en suelos anóxicos. La migración de humedales, que tendrá velocidades mayores que las que se han presentado en el pasado, les permitirá colonizar nuevos sitios que se vuelven inundables, pero la acumulación de materia orgánica tardará mucho tiempo. Las características de los suelos orgánicos (gran porosidad y por tanto capacidad de retención de agua) permiten su funcionamiento como control de inundaciones. Este servicio ambiental fundamental en escenarios de desarrollo de la zona costera, se perderá con la migración de los humedales. Además de la modificación del hidroperiodo, la intrusión salina también afectará de manera importante la distribución de humedales. Typha domingensis, especie dominante del tular, tolera aguas ligeramente salinas, mientras que las especies de popal son totalmente de agua dulce (Flores, et al., 2007). Pachira aquatica tolera salinidades altas y en diversos manglares del país aparece como especie acompañante (D. infante, comunicación personal), no así Annona glabra o Ficus spp. El cambio climático alterará la biomasa, productividad, y composición de especies de muchos humedales y por tanto el aporte que hacen de materia orgánica y nutrientes a los cuerpos de agua (Carpenter, et al., 1992). Los cambios en la temperatura y en la concentración de CO2 generalmente resultan en un incremento en la productividad, aunque la respuesta varía considerablemente entre especies (Field, et al., 2000). Las plantas dependen del bióxido de carbono para llevar a cabo la fotosíntesis, el aumento de éste gas se ha demostrado en algunas especies de manglar estimula la fotosíntesis y el crecimiento. Aunque la asimilación del bióxido de carbono por los estomas provoca la pérdida de agua por transpiración se ha observado que los manglares a elevadas concentraciones de bióxido de carbono disminuye la conductividad de los estomas incrementando la fotosíntesis pero siendo más eficiente en el uso de agua, sin embargo en periodos largos a elevadas concentraciones de bióxido de 52 carbono el incremento en la fotosíntesis no se mantiene por largo tiempo regresando a su tasa de asimilación original. Sin embargo en general se considera que el efecto directo del aumento del bióxido de carbono es el de menor impacto en los manglares que otros factores asociados al cambio climático (Hoghart, 2007). Las especies invasoras se verán favorecidas por el cambio climático. Los componentes del cambio global, como es el incremento en la depositación de nitrógeno y la concentración de CO2 atmosférica, favorecerá grupos de especies que comparten ciertos rasgos de historia de vida o comportamientos fisiológicos. Las especies invasoras comparten rasgos que les permitirán capitalizar los cambios, alterando aún más las propiedades básicas y el funcionamiento de los ecosistemas (Dukes y Mooney, 1999). En diversos países hay ejemplos de ocupación de humedales por especies exóticas sumamente agresivas (Lythrum salicaria en Estados Unidos, Tamarix spp. en la cuenca y el delta del río Colorado). En el trópico de México también hay ejemplos como el del pasto africano Echinochloa pyramidalis, introducido como pasto ganadero en los humedales potrerizados. Es una gramínea C4, debido a su gran productividad que le permite acumular gruesas capas de biomasa seca, con lo cual “va formando suelo” y desecando el humedal (López, 2007). Los manglares poseen reacciones diferentes, según la especie, al aumento en la temperatura. En general las condiciones óptimas se encuentran por arriba de los 22 oC. El principal efecto del aumento de la temperatura en los manglares sería en su distribución geográfica a expensas de los pantanos salobres de Spartina spp. (Luisiana y Misissippi), aumentando hacia el norte y sur de su distribución original. Esto es de esperarse debido que los límites de distribución latitudinal del manglar están asociados con la temperatura (Hogarth, 2007). En México sería de esperarse una mayor colonización dentro del Golfo de California por arriba del Estero de El Soldado e Isla Tiburón en Sonora y Bahía de Los Ángeles en Baja California. Sin embargo en el Pacífico, la corriente de California seguiría siendo una barrera infranqueable para que los manglares dieran el salto de Abreojos en San Ignacio, B. C. S., al otro lado de la península del Vizcaíno a la playa del Malarrimo en Guerrero Negro, B. C. Por otro lado, aunque existen reportes de colonización por manglares en la costa Atlántica de Estados Unidos de America (EUA), se especula que con el derretimiento de los glaciares de Groenlandia y costa Este de Canadá se puede interrumpir por completo la celda de circulación marina asociada a la Corriente del Golfo de México provocando descenso de la temperatura en el Reino Unido y en la costa Este de Norteamérica incluyendo la Florida. Los cálculos del impacto por el incremento del nivel del mar en un metro, en la Laguna de Alvarado y en el curso bajo del Río Papaloapan, indican una afectación de 47.5 km tierra adentro, en el Río Usumacinta de 55 km, en el Río Grijalva de 25 y en Laguna de Términos de 20, siendo éstos de los sitios más vulnerables (Estrategia Nacional del Cambio Climático, 2007). Ello nos da una indicación del nivel de impacto y los cambios que se sucederán en la planicie costera. El efecto del aumento en el nivel del mar en los manglares va a depender de las condiciones hidrológicas locales, en especial de los aportes de sedimentos de la planicie costera y cuenca, la microtopografía, así como del transporte litoral asociado a las condiciones oceanográficas locales y a mayor escala y a las mareas. La zonación de las diferentes especies de manglar obedece en gran medida a hidroperiodos selectivos por determinada frecuencia de inundación para cada especie. El hidroperiodo a su vez va a estar determinada por las mareas y/ó los aportes de agua dulce y el gradiente topográfico. En general un aumento en el nivel del mar provocaría un desplazamiento tierra adentro de los manglares de disponer de los espacios correspondientes. La expansión o compresión de la zonación ó la distribución preferencial por una especie de manglar va a depender de las características topográficas tierra adentro. En un simulador de mareas con plántulas de manglar del Pacífico de México, Hernández et al. 2009, demostraron que el manglar rojo (R. mangle) tiene 53 preferencia por permanecer inundada por periodos de 10 horas por cada 12 horas, el manglar blanco (L. racemosa) 6 horas cada 12 horas y el manglar negro (A. germinans) entre 3 y 5 horas cada 12 horas. Es de esperarse que el cambio en el nivel del mar ocasione la transformación de amplias zonas de humedales regulados por hidroperiodos selectivos (ej., zonas de “intermareas”) a cuerpos de agua permanente (humedales submareales) y se desplacen, los primeros, tierra adentro. Sin embargo las nuevas zonas disponibles para los humedales (de mareas) en general presentan menores extensiones que las áreas afectadas por lo que se presentarán en general más pérdidas que ganancias netas oscilando entre pérdidas del 20 al 94% de los humedales costeros en función de las pendientes topográficas dominantes de cada región. El comportamiento de los manglares en México con respecto al ascenso del nivel del mar en gran medida va a depender del tipo de costa en función de su origen morfotectónico (Carranza, et al. 1975) así como su combinación con las características climáticas regionales (Flores, et al. 1992). Las costas del Golfo de México corresponden a una costa de arrastre con una extensa plataforma continental y por lo tanto una extensa planicie costera y elevada precipitación que ha permitido el desarrollo de extensas zonas de manglar con buen desarrollo estructural como bosque como son los manglares asociados a Laguna de Términos (Campeche), Alvarado (Veracruz) y Altamira (Tamaulipas). Las costas del caribe por su origen cárstico con aportes subterráneos de agua dulce aunque con pocos nutrientes (oligotróficos) y escasas mareas (< 50 cm) permiten un desarrollo de bajo a intermedio de los manglares como en Los Petenes (Campeche), Ría Lagartos (Yucatán), Chacmuchuk, Nichupté, humedales de Puerto Morelos, Sian Kan (Quintana Roo). En la zona de los Petenes (Campeche), la baja energía de oleaje ha permitido la colonización por el manglar hacia el mar abierto. Las costas del Pacífico sur (sur de Nayarit a Chiapas) se caracterizan por ser una costa de colisión entre la placa de Cocos y la placa Americana lo que determina una plataforma continental corta con un litoral montañoso de pronunciada pendiente que limita el desarrollo de los manglares a estrechas franjas y de manera discontinúa bordeando pequeños cuerpos lagunares y a sotavento de las islas y penínsulas de barrera con excepción de las costas de Chiapas (ChantutoTeculapa-Panzacola) donde existen extensas zonas de manglar con alturas superiores a los 20 m. Como ejemplos de éstos pequeños ecosistemas tenemos los manglares asociados a los cuerpos lagunares de Chacahua, Mazunte, La Ventana(Oaxaca), Mitla, Chautengo (Guerrero), Playa Azul (Michoacán), Cuyutlán, Las Garzas (Colima), Chalacatepec, Paramán-Xola, El Salado (Jalisco), El Quelele, Platanitos (Nayarit). La costa continental del Golfo de California y Pacífico norte clasificadas como una costa de neoarrastre presenta una relativamente extensa planicie costera con climas que van de árido a subhúmedo los que han permitido el desarrollo de extensas zonas de manglar a sotavento de las islas de barrera y alrededor de las lagunas costeras con un desarrollo como bosque desde matorral (< 2 m de altura) hacia las zonas áridas y de matorral y borde (> 8 m) hacia las regiones subhúmedas como son La Bahía de Lobos (Sonora), San Ignacio-Navachiste, Santa María-La Reforma, Ensenada del Pabellón (Sinaloa) y Marismas Nacionales (Nayarit). Las costas de Baja California corresponden a una costa de colisión la costa del Pacífico y de Neoarrastre la costa este, ambas se caracterizan por una escasa o nula planicie costera, una elevada aridez y bajas temperaturas hacia el norte lo que limita de forma notable la extensión de los manglares predominando los matorrales. Asumiendo a un ascenso en el nivel del mar de menos de 1 metro para finales de éste siglo es de esperarse una respuesta selectiva de los manglares en función del tipo de costa. Es de esperarse una pérdida significativa en extensión del manglar para las costas del Pacífico sur, las costas de la península de Baja California y el caribe, este último en particular por su escaso nivel de mareas (< 50 cm), el efecto de los huracanes y el deterioro de su barrera natural (el arrecife de coral). Un probable aumento neto en la extensión de los manglares del Golfo de México a costa de los pantanos dulceacuícolas en particular en Tabasco y Laguna de Términos pero con el riesgo de ser erosionadas las penínsulas de barrera de ser sobrepasadas con el aumento del nivel del mar 54 exponiendo al oleaje los manglares en Veracruz y Tamaulipas. También es probable un aumento neto en la extensión del manglar en Sinaloa y Sonora desplazando a las marismas y salitrales así como su desplazamiento más al norte en el interior del Golfo de California y del Pacífico de Baja California de desplazarse más al norte la corriente de California. Las regiones donde el nivel de lluvias se incremente es de esperarse un aumento en extensión y estructura de los manglares de tipo borde (6-10 m de altura) a ribereño (12 a 25 m) y de tipo matorral (< 2 m) a tipo cuenca (4-10 m) ó su desplazamiento por pantanos de agua dulce de tulares (Typha spp), popales u otra macrófita acuática. En regiones donde se incrementen las sequías tendría consecuencias negativas para los manglares con una pérdida de estructura (de ribereño a borde ó matorral) ó incluso llegar a desaparecer de incrementarse la salinidad del suelo a salinidades superiores a las 70 ups (la salinidad del mar es de 35 ups). Se asume que asociado al calentamiento global será de esperarse un incremento en algunas regiones de las lluvias como en la frecuencia de huracanes nivel 5. Los manglares están adaptados a ser afectados por los huracanes. En regiones tropicales fuera de la influencia de los manglares es posible encontrar una mayor heterogeneidad en la distribución de estructura forestal (tamaños y frecuencias diametrales), edades y tipos fisonómicos. En el cinturón de huracanes los manglares tienden a ser más homogéneos en su estructura forestal y edad. Se estima un impacto directo por huracanes cada 25 años por lo que los manglares tienden a recolonizar el sitio perteneciendo a la misma generación lo que determina un crecimiento similar en altura y frecuencia diametral. El lado positivo de los huracanes es la de favorecer una mejor distribución de las semillas del manglar y revitalizar los sistemas lagunares en calidad del agua y biodiversidad acuática al reabrir bocas de sistemas lagunares con comunicación estacional ó efímera con el mar y reducir el tiempo de residencia del agua en los cuerpos de agua semicerrados. El aumento en la frecuencia de huracanes nivel 5 con el cambio climático, es de esperarse una disminución en las tallas promedio de los diámetros del bosque de manglar del cinturón de huracanes por estar ahora sujetos a ser afectados con mayor frecuencia a impactos directos por los huracanes a periodos menores a los 25 años y un cambio en la distribución de las estructuras forestales del manglar hacia tallas menores y de la misma edad a los bosques que ahora van a estar influenciados por huracanes. Esto se ha observado en San Blas y Marismas Nacionales, en el estado de Nayarit, donde recientemente por el efecto de los huracanes de los últimos 15 años los manglares de mayor altura prácticamente han desaparecido (Kovacs, et al. 2004). Sin embargo consideramos que el efecto más importante del aumento en la frecuencia de los huracanes que ha repercutido de manera negativa en los manglares ha sido la erosión de la playa y duna. Este proceso ha sido particularmente crítico en la Riviera Maya en Quintana Roo donde en algunos puntos ha desaparecido la playa y duna quedando expuestos a la erosión directa los manglares por el oleaje con una pérdida superior a los 100 metros de manglar a lo largo de la costa (Tres ríos, Punta Brava, etc.). La misma situación, aunque en menor intensidad se ha detectado en el Pacífico de México y Golfo de California donde diversas islas de barrera presentan lugares donde el oleaje del mar llega a atravesar la barra con potencial de abrir una nueva boca como se ha observado en la península de Lucenilla, Ensenada del Pabellón en el estado de Sinaloa, el manglar parece adaptarse a salinidades altas y es posible una migración de estos ecosistemas tierra adentro. 55 Para los ecosistemas de manglar, es posible que exista una adaptación de las especies hacia tierra adentro, originando nuevos bosques de manglar y una nueva fisiografía de la región. Su mayor amenaza en la actualidad lo representa su incesante destrucción por la construcción de complejos hoteleros, y la modificación de su hidrología por la construcción de caminos, puentes y marinas. Playas y dunas Los paisajes costeros formados por playas suaves, dunas de arena y marismas representan sistemas geomorfológicos móviles de respuesta rápida, altamente sensibles a los cambios ambientales (Hansom, 2001). Las costas arenosas son ambientes estresantes, dinámicos, en los que la acción de las olas y mareas determinan de manera importante la diversidad de especies, la biomasa y la estructura de las comunidades. Hay un intercambio de arena, materia biológica y otros materiales entre las dunas, las playas intermareales y la zona de rompiente del oleaje. Las tormentas y la erosión asociada representan el mayor riesgo para la fauna y la flora de las playas, dunas embrionarias y primer cordón de dunas. Las perturbaciones relacionadas con la actividad humana varían de una playa a otra; sin embargo, las estructuras o actividades que impiden el transporte natural de arena o alteran el presupuesto de arena, normalmente dan lugar a una erosión severa, a menudo de naturaleza permanente. El incremento en la frecuencia e intensidad de tormentas tendrá como consecuencia un escalamiento de la erosión y pérdida de hábitats de playa para las plantas, las aves, tortugas y numerosos invertebrados (Brown y McLachlan, 2002). Ciertos procesos básicos (como la construcción de dunas o su migración, la formación de bocas, el transporte litoral, y las zonas de erosión por entrada del oleaje) se dan a lo largo de toda la costa, aunque no con la misma importancia o frecuencia. La importancia relativa de estos procesos depende de las condiciones climáticas y oceánicas generales de cualquier área dada. Los vientos prevalecientes, la orientación de la línea de la costa, la energía del oleaje, el cambio del nivel del mar, la frecuencia de las tormentas, los perfiles de la playa sumergida y de la plataforma continental, la configuración de la costa y el rango de las mareas son factores medioambientales importantes que determinan la relativa importancia de la construcción de las dunas, de la erosión producida por el oleaje (overwash), o de las diversas combinaciones de los dos. Aunado a los factores climáticos están las respuestas de las especies pioneras a los factores medioambientales y la distribución de las especies adaptadas a estos factores a lo largo de la costa. El comportamiento de las plantas adaptadas para construir y estabilizar las dunas, soportar la erosión producida por el oleaje, o ambos, puede ser un factor significativo en el desarrollo de la morfología de la línea de costa (Godfrey, 1977). Un fuerte problema a que se enfrentan las playas es que su espacio físico está cada vez más reducido. Están atrapadas entre el crecimiento de las poblaciones humanas con sus desarrollos costeros y actividades productivas y los efectos del cambio del clima global. Las intervenciones de la sociedad, por ejemplo la línea de la costa acorazada con ingeniería dura, como el caso de Nueva York, (Gornitz, et al., 2001, Bird, 1996) y la alimentación artificial de playas, para combatir los cambios en los ambientes playeros, como la erosión y retirada de la línea de la costa, pueden resultar en impactos ecológicos severos y pérdida de biodiversidad en escalas locales, pero también se predice que tendrán consecuencias cumulativas de gran escala a nivel mundial (Schlacher, et al., 2007). Las playas y dunas constituyen otro de los ecosistemas que proporcionan importantes servicios ambientales, sobre todo de protección de la zona costera (Hesp, 2000). Son acumulaciones de arena, móviles, que se reacomodan constantemente ante la energía de la marea, de las olas, y del viento. Los sedimentos, proceden de cuenca arriba y son acarreados por escurrimientos y ríos y 56 después redistribuidos y arrojados a la playa por mareas y oleaje. Hoy en día, debido a la escasez de sedimentos, cerca del 70% de las playas del mundo se están erosionando, es decir están perdiendo sedimentos (Bird, 1996). En México no se cuenta con monitoreos de las playas que permitan dimensionar la problemática, pero hay numerosos casos aislados, bien conocidos. Han resultado tanto de causas naturales (huracanes) como de actividades humanas (obras de ingeniería costera como espigones, escolleras) y presas. Ejemplos de ellos son Ensenada, el Puerto de Veracruz, Antón Lizardo, Cancún, entre muchos otros. La elevación del nivel del mar y el incremento en la frecuencia e intensidad de huracanes afectarán aún más a las playas. Las dunas son la fuente de arena que retorna a la playa y al mar y se vuelve a redistribuir. Hoy en día están siendo transformadas drásticamente por la construcción de zonas hoteleras y la expansión de ciudades y casas de verano. La definición de zona federal marítimo terrestre es totalmente obsoleta y resulta perjudicial bajo escenarios de cambio climático. Las dunas embrionarias y el primer cordón de dunas constituyen la principal protección para la vida humana, sus actividades económicas y sus posesiones La ley no protege estas unidades geomorfológicos, permitiendo su ocupación por infraestructura de ingeniería dura. Hay varios casos en Veracruz, de reciente construcción, donde el muro de la propiedad recibe el embate de las olas durante los nortes. El desarrollo costero en México constituye uno de los ejemplos más claros donde el ambiente debe ajustarse al proyecto y no viceversa, y esto es un ambiente frágil, cambiante, de gran dinamismo y valor por sus servicios ambientales, tiene y tendrá un alto costo para la población y la sociedad en general. Se ha prestado muy poca atención al impacto del calentamiento global, sobre todo la elevación del nivel del mar, en el paisaje de dunas costeras, a pesar del hecho que éstas proporcionan protección natural a lo largo de muchas de las líneas de la costa del mundo. En énfasis de los trabajos ha sido en las playas. Las dunas costeras reaccionarán de diversas maneras en función de los factores regionales y locales. Los niveles del mar crecientes aumentarán la susceptibilidad a la erosión, pero el destino del sedimento liberado puede permitir la construcción de dunas costeras, al punto de lograr el crecimiento de playas en algunas zonas. La respuesta de la vegetación de la duna a un clima más caluroso y más húmedo es incierta. La mayoría de las especies de las dunas de zonas templadas son principalmente C3; estas plantas, bajo condiciones favorables, responderían positivamente a la mejora de CO2 (Carter, 1991. Las plantas de dunas tropicales incluyen tanto especies C3 como C4, éstas últimas mejor adaptadas a las altas temperaturas. Poco se sabe de las respuestas de las comunidades de dunas dependientes del espacio a la pérdida o restricción de dicho espacio (hábitat). Se desarrolló un modelo para analizar la sucesión en las dunas de la Isla de Galveston, Texas. Este modelo consideró que la elevación del nivel del mar era el principal mecanismo que produce erosión local y se demostró que esa erosión de la playa constriñó a las plantas a un área más restringida, resultando en un desajuste del proceso sucesional (Feagin, et al., 2005). La elevación del nivel del mar y el incremento en la frecuencia e intensidad de huracanes afectarán aún más a las playas. La pendiente de la playa está en función de diversos factores, entre ellos la geomorfología de la zona, el oleaje y el tamaño de grano de arena (Bird, 1996). Las playas con pendientes mayores son más erosionables que aquellas con pendientes más suaves. La elevación del nivel del mar hará que el oleaje pegue más arriba que lo que hace actualmente, quedando una mayor superficie de la playa sujeta al impacto del oleaje. El incremento en la frecuencia e intensidad de huracanes hará que estas mismas playas se vean golpeadas por un oleaje de mayor energía, propiciando una erosión aun mayor. 57 El viento mueve la arena que el mar arroja en la playa y la deposita formando dunas embrionarias. Estas son estructuras geomorfológicas terrestres formadas por pequeñas acumulaciones de arena. Se originan cuando las corrientes de viento que acarrean los granos de arena se topan con un obstáculo, como son las plantas, y dejan caer la arena formando un montículo. Existen especies fijadoras o estabilizadoras de dunas que no solamente toleran el enterramiento por arena, sino que crecen mejor y más vigorosas cuando se deposita arena alrededor de ellas (Martínez y Moreno, 1986). En el Golfo de México las especies que juegan este papel son Chamaecrista chamaecristoides, Palafoxia lindenii, Croton punctatus, Uniola paniculata y en el Pacífico Scaevola plumierii, Pectis postrata, Abronia maritima, Uniola pittieri. Otras especies tienen una distribución más extensa. Ipomoea pes caprae, Canavalia rosea, Ipomoea imperatii, Sesuvium portulacastrum son pantropicales. Todas ellas acumulan la arena y forman dunas embrionarias y cordones de dunas que reducen la energía del oleaje y regresan arena al mar para ser depositada en otras playas. Las playas desprotegidas ya están experimentando retirada y esta tendencia será exacerbada bajo todos los futuros panoramas del incremento en el nivel del mar. Pastos marinos A continuación, algunos factores medioambientales, temperatura, nivel medio del mar y reducción de la luz, asociados al cambio climático, relacionados con la estructura y función de los pastos marinos. La vegetación acuática sumergida está compuesta por pastos marinos y diversas especies de algas unidas a sus hojas, así como macroalgas que crecen intermitentemente entre las plantas, y el fitoplancton que crece en la columna de agua (Sand y Borum, 1991). La eutrofización de la zona costera, mediante el deterioro de la calidad del agua y del sedimento, propicia que las plantas de pastos marinos sean a menudo excluidas por varias formas algales (Cambridge, et al., 1986; Neckles, et al., 1993; den Hartog, 1994; Short, et al., 1995). La magnitud y extensión de estas algas competitivas pueden depender enormemente de la temperatura del agua (Neckles, et al., 1993), lo que sugiere que el declive de praderas de pastos marinos podría acelerarse con el calentamiento del agua de mar. Las algas epifitas afectan la productividad de los pastos marinos, pues limitan la disponibilidad de luz y carbono en la superficie de las hojas (Sand-Jensen, 1977; Sand-Jensen y Revsbech, 1987). También la distribución y abundancia de los pastos marinos se ve alterada por el incremento en la temperatura, a través de efectos directos en su florecimiento (de Cock, 1981; McMillan, 1982; Durako y Moffler, 1987) y durante la germinación de las semillas (Harrison, 1982; Phillips, et al., 1983). Así, un efecto de largo plazo del cambio global puede acelerar una pérdida de hábitat de los pastos marinos en ambientes estuarinos someros, caso de la bahía de la Ascensión. Cambios en la magnitud del rango mareal dependen de la geomorfología costera, no obstante, incrementos en el nivel del mar aumentaran las corrientes maréales, particularmente en áreas de flujo de marea restringido. Este incremento puede restringir la profundidad a la cual las plantas pueden crecer debido a estrés por la limitación de la luz (Dring y Lüning, 19954; Koch y Beer, 1996). El efecto total de mayores rangos de marea provocará un desarraigo del borde profundo y por tanto una pérdida de área total de pastos marinos. Por otra parte, el aumento del nivel del mar puede incrementar el movimiento del agua en la costa y en las áreas estuarinas, modificando la velocidad de la corriente y los patrones de flujo de circulación (Fonseca, et al., 1983; Worcester, 1995). El aumento de las corrientes intermareales podrían, en algún momento, aumentar el flujo de agua a las praderas de pastos marinos que están siendo alcanzadas por el crecimiento de las algas marinas en un sistema eutrófico. Este incremento 58 podría dar lugar a la reducción de la biomasa macroalgal dentro de estas praderas, teniendo un impacto positivo en la salud de las praderas mismas de pastos marinos. El impacto directo más grande de un aumento del nivel del mar es el aumento de la profundidad del agua y la reducción consiguiente de la disponibilidad de la luz en el fondo. El hábitat de los pastos marinos de cualquier sitio, experimentará una reducción en su distribución y su productividad, la estructura de las praderas será alterada, y sus valores funcionales se verán reducidos (Zimmerman y Livingston, 1976; Bay, 1984; Averza y Almodovar, 1986; Dennison y Alberte, 1986; Dawes y Tomasko, 1988; Orth y Moore, 1988; Duarte, 1991). Cualquier reducción en la cantidad de luz que alcanza las comunidades de pastos marinos, como un resultado de la elevación del nivel del mar, disminuirá la productividad total y alterará la estructura de la pradera de pastos marinos (Short, et al., 1995), resultando en una pérdida de la función de ese hábitat. Una reducción en el alcance de la luz al sustrato puede provocar una variación en la composición de especies por un aumento en el crecimiento de especies que poseen un menor requerimiento de luz (Pulich, 1985). El impacto global del incremento de la profundidad del agua puede variar entre localidades, dependiendo de la topografía local donde crecen los pastos marinos. Sin embargo, la proyección del incremento de 50 cm en la profundidad del agua puede reducir la disponibilidad de la luz en un 50 % (Short, 1980), lo que podría causar una reducción del 30 al 40 % en el crecimiento de los pastos marinos (Short y Neckles, 1999). El desplazamiento de los pastos marinos del margen costero puede ser impedido en muchas zonas costeras desarrolladas, debido a las construcciones consolidadas en la línea de costa o en sitios a ser ampliados para proteger inversiones de propiedades inmobiliarias. Tortugas marinas La supervivencia de las tortugas marinas, como todos los organismos vivientes, está siendo afectada en mayor o menor grado por el calentamiento global. Uno de los puntos más vulnerables es que durante la incubación, la determinación del sexo varía con la temperatura, es decir que cuando la incubación se desarrolla cercana a los 30 ºC, la producción de machos y hembras está equilibrada al 50 por ciento, pero si se incrementa uno o dos grados se produce mayor cantidad de hembras y si disminuye, la mayoría serán machos. Es decir que la incidencia directa en las tortugas del calentamiento climático, se expresaría en ese sentido, feminizándose la población y consecuentemente iría disminuyendo la fertilidad de los huevos al reducirse el número de machos. De manera natural esto se está presentado alternativamente durante periodos cálidos y frescos, por influencia de fenómeno de El Niño, y La Niña; sin embargo el impacto es temporal, por lo que se restablece el equilibrio de sexos. Otro efecto del calentamiento global puede ser a través de la reducción del hábitat de alimentación, como ocurre con los arrecifes coralinos, las zonas de pastizales o de algas marinas, las áreas abundantes en crustáceos y moluscos, etc. La energía del oleaje, la periodicidad de las corrientes y el ciclo de mareas, modelan las características de las playas además de propiciar el ascenso de las hembras al lugar de desove y contribuir a la dispersión de las crías. Se prevé que una de las consecuencias del cambio climático será la elevación del nivel del mar y el incremento de las tormentas y huracanes, lo que contribuiría a modificar sustancialmente las características de las playas. En las áreas de reproducción, el impacto de fenómenos naturales serán más frecuentes, como los ciclones, degradando más rápidamente las playas de anidación, causando alta mortalidad en huevos y crías y obstaculizando el arribo de las hembras, al formarse paredones en las playas, debido a la erosión causada por el oleaje extremo. Es difícil proponer medidas de mitigación contra este tipo de fenómenos naturales, no obstante, el esfuerzo se podría aplicar hacia la protección de las nidadas en las playas, pero debido al carácter altamente migratorio de estas especies, las acciones deben ser emprendidas coordinadamente entre los diferentes países donde se distribuyen estas especies, ya que como 59 serán impactadas también las áreas de alimentación, la protección parcial que se logre en las áreas de reproducción no tendrá ningún efecto positivo. En México, todas las especies de tortugas marinas están consideradas en peligro de extinción, y a partir de 1990 está prohibido totalmente su uso comercial (DOF, 1990). Por lo anterior, el efecto del cambio climático, no se puede considerar que tenga una consecuencia económica directa al no existir ninguna pesquería, sin embargo, la reducción de las poblaciones de tortugas marinas, sí podrían tener una influencia negativa sobre el complejo equilibrio de los ecosistemas donde éstas se desarrollan. El efecto del cambio climático está afectando a un cúmulo de especies, que si bien consideradas por separado, la pérdida de alguna de ellas podría no tener mucho valor, al considerarlas dentro del entramado biológico del ecosistema, la pérdida de una especie o incluso alguna población, o el aumento desmesurado de alguna otra, favorecida por estos cambios, puede tener efectos catastróficos en el conjunto del ecosistema. La pérdida del hábitat de anidación, afecta la sobrevivencia y abundancia de las tortugas marinas y en un escenario de cambio climático, se acelera el proceso de erosión por el aumento de los fenómenos hidrometeorológicos extremos, por lo que es importante implementar medidas de adaptación ante la erosión costera, para proteger el hábitat de anidación de las tortugas marinas. En el Anexo B.2 apartado tortugas, donde se describen las consecuencias de las fases cálidas de los eventos oceánico-atmosféricos, se puede suponer que el calentamiento global afectará la reproducción de las tortugas marinas principalmente a través de cambios en la fecundidad relacionados con la disponibilidad de alimento y la feminización de la progenie y en menor medida cambiando la fisiografía de las playas de anidación; sin embargo, la magnitud del impacto estará en relación con el grado de intervención humana en el ecosistema y el grado de estrés a que estén sometidas las poblaciones. Es posible que especies con mayor área de distribución se adapten con más facilidad, que las especies cuya distribución es más restringida (vg. tortuga lora). Otro factor que podría incrementar el efecto del cambio climático es la posible feminización de las colonias como resultado del manejo inadecuado de los nidos. Actualmente, en gran parte de los campamentos de México, los huevos se trasplantan a corrales, para reducir la depredación y el robo, sin embargo en los corrales las condiciones térmicas son homogéneas y frecuentemente más altas que en la playa, mientras que a lo largo de ésta hay mayor diversidad de microclimas. Previo al conocimiento de las causas y efectos del cambio climático sobre los ecosistemas, una de las actividades que se han desarrollado para favorecer la conservación y recuperación de las tortugas marinas ha sido el establecimiento de los “campamentos tortugueros” a lo largo de ambos litorales del país, cuyo objetivo principal ha sido la protección de la anidación, en las playas más importantes, de todas las especies que se reproducen en México (Márquez, 1976), así mismo se decretaron en la década de los años ochenta del siglo pasado, las “zonas de reserva y sitios de refugio para la protección, conservación, repoblación, desarrollo y control de las diversas especies de tortuga marina”, ubicadas en los estados de Chiapas, Guerrero, Jalisco, Michoacán, Oaxaca, Sinaloa, Tamaulipas y Yucatán” (DOF, 1986), a las cuales mediante otro acuerdo se elevaron de nivel, dándoles el rango de “áreas naturales protegidas, con la categoría de santuarios” (DOF, 2002). Corales Durante más de 200 millones de años los corales pétreos han dominado las aguas someras de los océanos tropicales, formando enormes estructuras carbonatadas conocidas como arrecifes de coral. Estas estructuras geológicas se originan a partir de la acumulación milenaria de esqueletos de coral 60 y de otros organismos calcáreos. El éxito de los corales como formadores de arrecifes es el resultado de la relación simbiótica que mantienen con algas unicelulares del grupo de los dinoflagelados (Stanley, 2002). Las algas proporcionan al animal alimento obtenido a partir de la fotosíntesis, mientras que los productos de deshecho del metabolismo del animal son utilizados por las algas como nutrimentos (Muscatine y Weis, 1992). Este eficiente mecanismo de reciclamiento confiere a los corales formadores de arrecifes una ventaja metabólica que les permite crecer a lo largo de toda la zona eufótica (Iglesias, et al., 2004) y depositar carbonato de calcio a una tasa superior a la tasa de erosión y por lo tanto formar arrecifes. Durante los últimos 20 años se ha presentado en todos los mares tropicales del planeta un fenómeno conocido como blanqueamiento de coral. Este fenómeno se caracteriza por una pérdida de coloración de los corales principalmente debida a una reducción en el número de algas simbiontes presentes en sus tejidos (Smith, et al., 2005). En condiciones normales las algas simbiontes tienen densidades cercanas al millón de células por centímetro cuadrado de coral. El blanqueamiento se presenta cuando debido a las reducciones en el número de algas simbiontes es posible observar el esqueleto blanco de los corales a través de sus tejidos transparentes. Desde un punto de vista biológico, el blanqueamiento de coral es la ruptura de la relación simbiótica entre los dinoflagelados y sus hospederos (Iglesias, et al., 1992). Aunque el blanqueamiento de coral puede ser iniciado cuando los corales son expuestos a condiciones ambientales extremas de temperatura, salinidad y radiación solar. Los eventos de blanqueamiento de coral que se han presentado a escala global durante los últimos años están relacionados con la presencia de temperaturas superficiales del agua anómalamente altas. Pese a que blanqueamientos de coral esporádicos y restringidos geográficamente han sido observados desde la década de los años 50, a partir de 1982 se ha detectado un incremento en la severidad, frecuencia y alcance geográfico de dichos eventos (Hoegh, 1999, Hoegh, et al., 2007). Durante 1998, el año más caliente en el registro climatológico, se reportaron eventos masivos de blanqueamiento de coral en prácticamente todas las zonas coralinas del planeta. Dependiendo de la intensidad y duración de las condiciones de alta temperatura, el blanqueamiento de coral puede ser un fenómeno reversible con limitadas consecuencias negativas en la fecundidad y en la tasa de calcificación de los corales (Hoegh, 1999), o bien resultar en eventos de mortalidad masiva de corales. En este sentido, durante el evento de 1998 se considera que se perdieron aproximadamente el 16 % de los corales a escala planetaria. La relación entre los eventos de blanqueamiento de coral y la presencia de temperaturas del agua elevadas es preocupante si tomamos en consideración que como resultado del Cambio Climático Global (CCG), las temperaturas del océano continuarán incrementándose y que solamente se requiere de una elevación de 1.5 ºC durante un período de 3 a 4 semanas por arriba de la media de verano para iniciar el blanqueamiento de coral (Hoegh, 1999). Pese a que en la actualidad existe un debate sobre los mecanismos moleculares responsables del blanqueamiento de coral, también existe un consenso indicando que uno de los primeros blancos del estrés térmico es la función fotosintética de las algas simbiontes de coral (cf Smith, et al., 2005). Una vez que se inactiva la fotosíntesis de las algas, el esparcimiento múltiple de la radiación solar en las superficies altamente reflectantes del esqueleto de coral produce un incremento exponencial en la cantidad de radiación absorbida y a la formación de especies reactivas de oxigeno capaces de producir mortalidades masivas (Enríquez, et al., 2005). Las mortalidades masivas de coral pueden tener consecuencias catastróficas ya que producen una transición de fase de una comunidad dominada por corales a una comunidad dominada por macroalgas (Huges, et al., 2003: Hoegh, et al., 2007). Dicho cambio de fase se puede traducir desde el punto de vista de la estructura del arrecife en un cambio de un sistema con acreción neta (crecimiento arrecifal) a un estado de disolución neta con la concomitante pérdida de servicios arrecífales. 61 Como resultado de las actividades humanas, la concentración atmosférica de CO2 en la actualidad excede los 380 ppm, esto es 80 ppm por arriba de todos los registros históricos en un período de por lo menos 740,000 años (Petit, et al., 1999). Aproximadamente el 25 % de las emisiones de CO2 son capturadas por el océano en donde reacciona con el agua produciendo acido carbónico el cual termina por limitar la disponibilidad de carbonato a los sistemas biológicos. Existen numerosos experimentos que indican que incrementos en la concentración de CO2 a niveles que duplican las concentraciones preindustriales resultan en disminuciones en las tasas de calcificación de los corales formadores de arrecifes de hasta 40 % (Kleypas y Langdon, 2006). Bajo estas condiciones es posibles predecir que como efecto neto de la acidificación del océano la mayoría de los arrecifes de coral pasarán de un estado de calcificación neta a un estado de disolución. Estas predicciones son consistentes con las observaciones de que los arrecifes modernos solo se presentan en zonas del océano en donde el estado de saturación de la aragonita es superior a 3.3 (Kleypas, et al., 1999). Cuando los valores saturación de aragonita se encuentran por debajo de este valor crítico, es posible observar un desacoplamiento entre la calcificación de los corales y las tasas de acreción del arrecife. Este tipo de condiciones se pueden observar en la parte sur de la Península de Baja California en donde los corales son capaces de calcificar con tasas similares a las medidas en otras partes del Pacifico pero no se mantiene un balance positivo de acreción a nivel comunitario y por lo tanto no se presentan verdaderas plataformas calcáreas. Análisis recientes de las tendencias temporales en las tasas de calcificación de los corales a lo largo de la Gran Barrera Australiana indican disminuciones de hasta 20% en las tasas de calcificación durante los últimos 20 años (Cooper, et al., 2008; De’ath, et al., 2009). Aunque estas reducciones son mayores que las esperadas por un efecto de la temperatura es aun temprano para asignarlas de manera inequívoca a cambios en el pH del océano. En la costa de Quintana Roo no se han observado variaciones en la tasa de clasificación de los principales constructores arrecífales asociados a la acidificación del océano (Carricart, et al., en revisión). Los efectos sinérgicos de la exposición a temperaturas elevadas y reducciones en el pH del mar aún no están claramente descritos y son en la actualidad un tema de investigación muy activo. Antonny, et al., 2008, reportaron que la exposición a altas temperaturas en ambientes ácidos exacerba el blanqueamiento de coral lo que probablemente indique que en el futuro cercano estos efectos combinados comprometan la capacidad de los corales de construir arrecifes con consecuencias catastróficas para estos ecosistemas. En esta sección se entiende por Enfermedades Emergentes (EE), a aquellas enfermedades que independientemente del agente causal y de que sean novedosas o no, son capaces de tener un importante efecto poblacional. En este sentido se utiliza el término enfermedad en su sentido más genérico: la aparición de signos de disfunción fisiológica que pueda o no causar mortalidad, independientemente de la causa que provoca la afección. En particular se analiza la relación potencial entre los efectos del incremento de la temperatura a través de la relación entre anomalías térmicas y las EE. En las últimas décadas la incidencia de EE se ha multiplicado en los ecosistemas arrecífales coralinos y su efecto directo e indirecto ha sido severo como demuestran los siguientes ejemplos: En la década de los ochenta del pasado siglo, la enfermedad conocida como “banda blanca” (Gladfelter, 1982) causó mortalidades masivas en los enormes campos de Acropora palmata y A. cervicornis que caracterizaban a los arrecifes de toda la región biogeográfica del Caribe. Hoy en día, quedan pocos ejemplos de esos exuberantes campos, a la vez que diversas EE siguen afectando a los reclutas de estas especies. Ecológicamente el efecto ha sido catastrófico porque estas especies de rápido crecimiento y eficiente distribución clonal son las que mantienen una elevada heterogeneidad espacial en las zonas someras del arrecife; con todos los beneficios ecológicos que esto implica. Pero además, son constructores arrecífales primarios (Blanchon y Shaw, 1995) y por ende, uno de los principales agentes de recuperación de áreas arrecifales impactadas por huracanes. 62 Otro tipo de catástrofe ecológica para la comunidad coralina fue causado por una enfermedad novedosas que causó mortalidades masivas del erizo Diadema antillarum, en la gran mayoría de los arrecifes coralinos de la región biogeográfica del Caribe; fenómeno que inició también a principios de los ochenta (Lessios, 1984). La consecuencia inmediata de esta mortalidad masiva fue la pérdida del herbívoro más importante en las zonas someras de los arrecifes caribeños; lo que a su vez ocasiono un crecimiento algal descontrolado capaz de cubrir corales e impedir eventos de reclutamiento. El resultado para muchos arrecifes, aunque no para todos, fue una sustitución temporal de corales por algas como elementos dominantes de la estructura comunitaria (Hughes, 1984). Las consecuencias ecológicas a mediano y largo plazo de estos dos eventos causados por EE aún se están ponderando en términos de su capacidad de provocar cambios de fase semi-estables (Hughes, at al., 2007). Este tipo de epizootias pan-caribeñas, extensas y letales, son un fenómeno reciente, probablemente determinado en mucho por el estrés térmico acumulado y puntualmente por anomalías térmicas. El registro fósil de los últimos cientos de miles de años, señala claramente que Acropora palmata y A. cervicornis han sido corales dominantes y principales formadores de los arrecifes caribeños (Greenstein, et al., 1998). La evidencia fósil indica también hiatos en los registros, que podrían indicar efectos de antiguas epizootias; pero si acaso lo fueron, esa misma evidencia indica que se trata de fenómenos locales y no pan-caribeños como ha sucedido en la actualidad (Aronson, et al., 1998). Si bien los ejemplos anteriores muestran el potencial catastrófico que pueden tener las EE, en su momento, no se relacionó su emergencia con el calentamiento del mar. Más aún, estos ejemplos parecerían mostrar efectos directos cuando en realidad los impactos observados resultan de complejas interrelaciones sinérgicas, que a su vez son inducidas por múltiples efectos del CCG y del desarrollo humano en la zona costera. Por ejemplo, el caso del enorme impacto de la mortalidad masiva de Diadema antillarum, se da porque los otros herbívoros naturales, principalmente peces han sido diezmados por sobrepesca. En el caso particular de Jamaica, particularmente afectado por este evento, se sumó el efecto del impacto generado por el huracán Allen que destruyó en mucho la elevada heterogeneidad espacial de las zonas arrecifales someras (Hughes, at al., 2007). Hoy en día, se postula que la relación primaria entre el incremento de temperatura del mar y la creciente incidencia de EE en corales (y biota coralina en general) resulta de diversos efectos fisiológicos y ecológicos, que afecta tanto a hospederos como a patógenos potenciales. El efecto principal del estrés térmico en los hospederos es complejo y se postula que reduce su capacidad de enfrentar con éxito interacciones ecológicas y los efectos de otros factores de forzamiento ambiental e incluso haciéndolos más susceptibles de ser infectados y de disminuir su capacidad de combatir exitosamente infecciones (Harvell, et al., 2007; Lesser, et al., 2007). Situación más problemática aún, porque aguas con temperaturas más cálidas favorecen: a) el desarrollo poblacional de patógenos bacterianos y quizás de virus también (Daszak, et al., 2001, Harvell, et al., 1999); b) la expansión en la distribución de patógenos potenciales y la invasión de nuevos ambientes (Banin, et al., 2000); c) el potencial cambio en el tipo de interacción mutualista entre las bacterias y el hospedero a una de patogénesis (Lesser, et al., 2007); y d) la producción de toxinas en algunos Vibrios cuando la temperatura rebasa determinados umbrales (Ben Haim, et al., 2001). Se ha propuesto que existe una relación entre la cobertura de los corales, el aumento en la temperatura del agua y el nivel de prevalencia de enfermedades. (Bruno, et al., 2003), implicando que la transmisión es denso-dependiente y apuntando hacia un agente infeccioso. Tal puede haber sido el caso de la enfermedad de la banda blanca en Acropóridos y de la mortalidad de Diadema antillarum, en el Gran Caribe, pero en ambos casos no fue posible aislar a un patógeno responsable. Sin embargo, a finales de los setentas y principios de los ochentas, además de mortalidades masivas por supuestos agentes infecciosos, se dan también severos eventos de 63 blanqueamiento térmico. Y a partir de entonces se ha ido registrando un constante incremento de signos y síndromes que corresponden al criterio de EE. De hecho, estas inferencias históricas sólo se refieren al género Acropora pero en las últimas décadas se ha observado un variado conjunto de EE, la mayoría letales, que afectan a los corales escleractinios de arrecies en todos los mares tropicales del mundo y desafortunadamente en mayor medida a los que son constructores clave. Weil, et al. (2006) y Harvell, et al. (2007) enlistan estos síndromes y enfermedades, así como sus hospederos y posibles agentes causantes. Entre las EE enfermedades que han satisfecho el postulado de Koch, en laboratorio, se encuentran patógenos primarios como bacterias, algunas cosmopolitas, pero también hongos de origen terrestre como Aspergillus sydowii, que ataca a gorgonáceos. Entre las bacterias, las del género Vibrio son particularmente agresivas, pero también se han encontrado bacterias comunes en tiburones e incluso humanos y otras recientemente descritas que a la fecha solamente se han aislado de corales enfermos. Dado que el postulado de Koch se comprueba condiciones de laboratorio, queda la duda de en algunos casos se trate de patógenos oportunistas en lugar de primarios. Más aún, porque prácticamente en todos estos casos de enfermedades infecciosas el origen de los patógenos, los mecanismos de infección y los vectores potenciales, son aún desconocidos. Kushmaro y Kramarsky (2005), postulan que en la capa mucosa que produce el coral sobre su epitelio externo, se encuentra una compleja comunidad bacteriana que aprovecha los mucopolisacáridos del mucus como fuente de energía. Pero también postulan que esas comunidades bacterianas son diferentes de la que existe en las aguas que circundan al coral y que funcionan como una barrera a la invasión por otras bacterias no comensales; algunas incluso producen antibióticos específicos. En corales que han sufrido un evento de blanqueamiento térmico, se ha observado un cambio significativo en la composición de la comunidad bacteriana asociada al mucus del coral, siendo particularmente evidente la incorporación de especies de Vibrio que existen en las aguas adyacentes al coral, pero que no eran parte de la comunidad bacteriana comensal original (Ritchie y Smith, 2005; D. Bourne, comunicación personal). Por lo que se considera que el incremento en la temperatura del mar puede provocar un desequilibrio funcional entre el coral y su comunidad bacteriana, cambiando la relación de comensal a patógeno, si los efectos del estrés térmico alteran la señalización entre los diferentes componentes del holobionte. Por otro lado, en Australia se han registrado casos de muertes masivas de Acropóridos por un síndrome blanco, para el cual no ha sido posible identificar un patógeno probable (Ainsworth, et al., 2007). Utilizando técnicas histológicas y técnicas moleculares estos autores muestran que no hay indicio de bacterias alóctonas en las áreas de tejidos sanas o enfermas de estos corales, en cambio, encuentran signos de apoptosis en las células del coral, pero no se puede explicar el origen de esta respuesta radical. Si efectivamente la mortandad observada es causada por este fenómeno, debe existir un disparador del fenómeno, algo que lo mantenga hasta destruir todo el tejido del coral y algo que permita la comunicación del fenómeno entre colonias. Pero algo así también puede ser explicado por un estrés ambiental severo, como incremento de la temperatura del mar; aunque no excluye la posibilidad de ataques virales y sus secuelas. En contraste con lo anterior, Sussman, et al., (2008) postulan que un síndrome blanco similar que también causa una extensa mortalidad de acropóridos en las Islas Marshall, es causada por un patógeno infeccioso, que tiene una elevada afinidad genética con Vibrio corallyticus. Este es un planteamiento interesante pues anteriormente Ben-Haim, et al., (2001), postulan que cuando en arrecifes del Mar Rojo la temperatura del mar aumenta por encima de los 30° centígrados, Vibrio corallyticus produce una toxina que destruye la pared celular de las zooxantelas, en el coral Oculina patagónica y con ello causa la muerte del coral por lo que se ha denominado blanqueamiento bacteriano, sin embargo, observaciones posteriores cuestionan esta hipótesis, por lo que su validez requiere de confirmación. 64 Lo anterior muestra que existe evidencia a la fecha de que tanto el animal como las zooxantelas pueden ser el blanco de patógenos, en mucho por el incremento de temperatura. El síndrome de la banda amarilla, otro síndrome letal cuya virulencia ha sido asociada con temperaturas elevadas (Cervino, et al., 2004) está causando severos impactos en comunidades coralinas del Caribe e IndoPacífico, es aparentemente causada por un consorcio de especies de Vibrio (Cervino, et al., 2008) que atacan a las zooxantelas. Dado que el síndrome se caracteriza por una banda de decoloración, blanqueamiento y eventualmente muerte del tejido; quizás exista un mecanismo de ataque similar a lo propuesto por Ben-Haim, et al., (2001). En particular es interesante el efecto directo sobre las zooxantelas dado lo que se conoce de la relación positiva entre anomalías térmicas y blanqueamiento masivos (Hoegh-Guldberg, 1999). El Gran Caribe se ha denominado como “hot spot” de enfermedades de coral por la elevada prevalencia y diversidad de EE. Se ha observado que, al menos en términos de la apariencia de los signos, algunas EE son capaces de afectar corales de diferentes especies, géneros e incluso familias (ver Cuadro C.4 en Anexo C). Por otro lado, algunas especies son afectadas por muchos síndromes. Desafortunadamente, entre estas especies se incluyen aquellas que en el presente son las más importantes en conformar y mantener la estructura del arrecife, como son especies del género Montastraea, Diploria y Colpophyllia, además del caso antes mencionado de las especies del género Acropora (ver Cuadro C.4 en Anexo C). En términos generales, de las aproximadamente 60 especies de corales que colonizan los arrecifes del Gran Caribe, más del 70% son afectadas por alguna enfermedad o síndrome, entre ellas las especies clave (aproximadamente 15). El efecto del calentamiento posiblemente se relacione con el blanqueamiento de corales, ya que este es uno de los ecosistemas más vulnerables. Por ejemplo, en la Gran Barrera Arrecifal de Australia, entre un 42 al 60% de los arrecifes experimentaron un masivo “blanqueamiento”, el cual fue también reportado en 31 diferentes naciones entre 1997 y 1998, se estima que 16% de los arrecifes coralinos del mundo fueron severamente dañados. El suceso coincidió con el registro de uno de los eventos más intensos de El Niño. Otra vez en 2002 se presentó otro blanqueamiento masivo, más fuerte que el de 1998, pero ahora conectado con un ENOS más débil, pero con el registro de altas temperaturas (Fabricius et al., 2007). Estos eventos alertan sobre la gran vulnerabilidad de los corales al calentamiento global y las consecuencias negativas, además de la pérdida del hábitat, sobre todas las especies asociadas a estos ecosistemas, entre ellas, las tortugas marinas, en particular la tortuga carey. En los arrecifes del Caribe Mexicano y del Golfo de México el panorama anteriormente descrito es el mismo que para el Gran Caribe, con grandes mortalidades de Acropora palmata y A. cervicornis (Jordán, 1992, Rodríguez, et al., 2001). Y hoy en día la proliferación del síndrome letal de la banda amarilla está causando estragos en las poblaciones de Montastraea annularis y M. faveolata (Jordán et al. 2005) tanto en el Golfo de México como en el Caribe mexicano. Una estimación, entre censos separados por más de 20 años, muestra una pérdida de más del 60% en la abundancia de constructores arrecífales clave, a lo largo de todo el sistema arrecifal del Caribe mexicano, atribuible tanto a la banda blanca como al síndrome de la banda amarilla (Jordán, 1984; Harvell, et al., 2007). Aparentemente aún no han sido detectados signos que pudieran relacionarse con enfermedades de coral en las comunidades coralinas del Pacífico mexicano (H. Reyes, comunicación personal). Sin embargo, de ser ese el caso, es probable que está situación no perdure, pues como se ha explicado anteriormente existen numerosos casos de EE en los arrecifes del Indo-Pacífico. Más aún, se han observado áreas de mortalidad masiva en campos de corales uniespecíficos, sin haber presenciado el evento que lo causó, pero el patrón espacial resultante no excluye la posibilidad de que haya sido causado por enfermedades. Sin embargo, los ecosistemas de coral, estarán fuertemente amenazados y tendrán efectos muy negativos los aumentos de la temperatura, ya que propicia el fenómeno del blanqueamiento y el 65 desarrollo de enfermedades emergentes que resultan en su destrucción en grandes áreas del Sistema Arrecifal Mesoamericano. Las amenazas del cambio climático global sobre el calentamiento del océano, la acidificación oceánica y el incremento en la intensidad de las tormentas tropicales son ahora consideradas como las mas grandes amenazas para todos los arrecifes del mundo, y a menos que acciones urgentes sean tomadas para reversar la tasa de emisiones de los gases de efecto invernadero, estaremos enfrentados a pérdidas mundiales masivas de los arrecifes coralinos. Esto significará extinción de especies, disminución de suplementos alimenticios, perdida de potenciales turísticos y reducción de la protección costera por la erosión de los arrecifes coralinos cercanos. Desde el último reporte de la Red Global de Arrecifes Coralinos (GCRMN, por sus siglas en ingles) en 2004, sobre todos los arrecifes coralinos del mundo, existe un “tiempo marcado” debido al balance tan cercano entre la recuperación y la degradación. Los arrecifes del Caribe han sido menos afortunados, debido a los efectos del blanqueamiento del año 2005. Quintana Roo La conservación de los sistemas arrecífales en la costa de Quintana Roo debe ser considerada como una medida prioritaria de adaptación ante los efectos del CCG, ya que los servicios naturales que estos ecosistemas proveen para la economía local es enorme. Solamente la protección de la zona litoral que los arrecifes, proveen es fundamental para la preservación de la infraestructura hotelera y por lo tanto para la viabilidad de esta industria. Los incrementos de temperatura y las reducciones en el pH del océano, limitan las tasas de calcificación de los corales de manera directa, y en el caso de las Enfermedades Emergentes y de la mortalidad masiva asociada al blanqueamiento de coral, las reducciones en la cobertura coralina comprometen seriamente la capacidad de estos ecosistemas, para mantener un balance positivo de carbonato y por lo tanto, de mantener sus servicios ambientales. En este sentido la mejor manera de planear un programa de adaptación a los efectos del CCG en la zona, debe contemplar reducciones en las amenazas locales que sufren estos ecosistemas, como son la contaminación y degradación de la calidad del agua por el desmedido e incontrolado desarrollo de la zona costera y la sobrepesca. Los sistemas arrecífales lagunares son vulnerables al futuro incremento en el nivel del mar, debido a la pobre salud de sus comunidades coralinas. Bajo los tres futuros escenarios del incremento del nivel del mar (ver capítulo III, sección 3.2), los arrecifes a lo largo de la costa de Quintana Roo, podrían potencialmente tolerar un incremento de ~5 mm/año con pequeños efectos adversos. Pero incrementos superiores producirían sumersión progresiva de la cresta y retirada de la línea de costa debido al incremento de la energía de la ola. 4.2 Vulnerabilidad ante el incremento del nivel del mar. En esta sección se estimando el grado de vulnerabilidad según los criterios de diversidad ecosistémica y ecológicos generales, y aplicando la metodología propuesta por Bojórquez, et al., (1998) para cada uno de los estados analizados (Tabasco, Quintana Roo y Sinaloa; Cuadro IV.2). Para calcular el grado vulnerabilidad del manglar por estado, se consideró tanto el número de especies como la cobertura del manglar en hectáreas de las tres zonas y el tipo de manglar que domina; por ejemplo, en Tabasco domina el de tipo ribereño/borde con una influencia muy grande de las condiciones estuarinas lo que permite longitudes arbóreas mayores respecto al manglar de Quintana Roo, que es predominantemente de borde con una zona de playa o dunas hacia el mar, 66 con alturas de los árboles menores y una mayor exposición a la dinámica costera imperante. El manglar del sur de Sinaloa y norte de Nayarit es de los más extensos del mundo, con un grado de alteración bajo, por lo que su resiliencia es mayor así como su cobertura lo que le brinda un menor grado de vulnerabilidad ante eventos naturales extremos. Cuadro IV.2. Grado de Vulnerabilidad para los estados de Tabasco, Quintana Roo y Sinaloa. Ecosistema/ Grado de Vulnerabilidad Manglar Grado de Vulnerabilidad Parámetros Tabasco Quintana Roo Sinaloa No. Especies Extensión (Ha) 4 35191 4 64755 4 71225 3 2 1 Se consideró que la región que cuenta con la mayor extensión (cobertura) de manglar, es la de mayor resiliencia y por lo tanto de menor vulnerabilidad, tal es el caso de Sinaloa. El estado de Tabasco, es un claro ejemplo de cómo las actividades humanas pueden provocar alteraciones ambientales de gran envergadura; las actividades petroleras en bosques de manglar ocasionaron una serie de impactos ambientales negativos, incluyendo la interrupción del flujo de agua dulce hacia estos ecosistemas, la alteración del flujo del agua de las mareas hacia los manglares y dentro de ellos, lo que modifica el patrón del drenaje, la vegetación, el suelo y la inestabilidad general del área. En las distintas etapas de la actividad petrolera, se registra deforestación para la construcción de instalaciones, incluyendo las plataformas de perforación, campamentos, pozos, apertura de carreteras de acceso, entre otras. La perforación se hace por dragado, lo que ocasiona una destrucción total del área. El dragado implica hacer más profundo y más ancho los canales existentes, o abrir nuevos canales; el tamaño y la profundidad del canal estarán determinados por el tamaño de la gabarra de perforación utilizada y del nivel del agua durante la perforación, entre más ancho y profundo sea el canal, mayor será el daño que se haga al ecosistema. La construcción de estos canales altera la hidrología natural del manglar y lo hace más vulnerable a la erosión ya que la pendiente natural del manglar puede colapsar. La compactación de los residuos a causa de otras excavaciones puede causar perjuicios posteriores a la zona; se elimina las cepas de los árboles mediante una draga hasta una profundidad de 1 - 2 m, y los residuos se depositan en la orilla para formar muros de contención o se depositan en el mar, lo que obstruye el flujo natural de las corrientes, destruir los arrecifes aledaños y otros ecosistemas vulnerables. Los bancos de residuos pueden extenderse hasta 30 metros más allá del borde del canal, lo que puede producir la propagación del líquido de los residuos y una migración vertical de los residuos de dragado a las tierras cercanas. Los depósitos de residuos pueden destruir los manglares mediante relleno directo (por asfixia de los pneumatóforos) o por formación de una barrera al flujo y reflujo de las aguas. La alteración del suelo puede producir cambios en el pH del mismo y del agua que podrían causar un deterioro crítico de la calidad de los manglares. El acceso a las zonas de perforación con los equipos respectivos, puede provocar los siguientes impactos: tala para las vías de vuelo, clareo del bosque para la construcción de plataformas de aterrizaje, de zonas de andamiaje y para el almacenamiento y transferencia de combustible. (Oilwatch, 2005). En función del posible impacto ambiental que pueda provocarse debido a la presión ambiental, ejercida por uno de los parámetros ambientales de mayor relación con estas especies vegetales como es la salinidad, se estimó el valor del MEDij para cada estado del litoral evaluado. En el Cuadro IV.3, se presentan los valores estimados para el Caribe mexicano para cada una de las especies principales que conforman el manglar, así como el promedio resultante de estos datos. 67 Cuadro IV.3. Estimación del índice básico de impacto ambiental (MED ij ) para las especies dominantes de mangle en el Caribe mexicano. Factor ambiental limitante: salinidad. Rhizophora mangle (rojo) Laguncularia racemosa (blanco) Avicennia germinans (negro) Condición adecuada (salinidad en ups) Salinidad UPS M E’ D’ MED’ 10 – 100 43.86 1 3 2 0.78 15 – 20 43.86 2 3 3 0.89 40 43.86 1 3 3 0.78 Promedio Desviación estándar 0.82 0.06 La salinidad reportada es un valor promedio estimado de diversos ambientes costeros de esta región incluyendo lagunas costeras, zonas arrecífales y mar abierto (De la Lanza, et al., 2006). El MEDij promedio para el manglar de la región del caribe mexicano fue de 0.82 ± 0.06 y el criterio básico de magnitud es el que está determinando la magnitud de este índice de impacto ambiental. La categorización de este parámetro se establece derivada del intervalo de salinidad, en el cual cada una de las especies de mangle se desarrolla adecuadamente, para el mangle rojo y el negro, que poseen una mayor tolerancia a la variabilidad de sales, los valores de este índice básico fue de 0.78, mientras que para el mangle blanco (Laguncularia racemosa) aumentó a 0.89. Significa que esta especie puede ser más susceptible de ser afectada por una intrusión salina severa ya que se ha reportado que vive bajo una condición de salinidad más restringida, entre 15 y 20 ups, de tal forma que cuando se presentan fenómenos meteorológicos como los huracanes y la progresión del agua marina sobre el manglar de Quintana Roo ocurre, este hecho ejerce una presión ambiental mayor sobre esta especie que se ubica regularmente en la porción o franja intermedia del manglar. Para Tabasco, donde existe una cobertura de manglar de aproximadamente 35,000 ha, el cálculo del MEDij mostró el comportamiento que se observa en el Cuadro IV.4; debido a la gran cantidad de caudales de agua dulce en esta entidad, el valor promedio reportado de la salinidad es de 13 ups, lo que permite que se tenga el mismo valor de este índice para las tres especies de mangle, y por tanto el promedio para el manglar tabasqueño sea igual de 0.78. Cuadro IV.4. Estimación del índice básico de impacto ambiental (MED ij ) para las especies dominantes de mangle en el estado de Tabasco. Factor ambiental limitante: salinidad. Rhizophora mangle (rojo) Laguncularia racemosa (blanco) Avicennia germinans (negro) Condición adecuada (salinidad en ups) Salinidad UPS M E’ D’ MED’ 10 – 100 13 1 3 3 0.78 15 – 20 13 1 3 3 0.78 40 13 1 3 3 0.78 Promedio Desviación estándar 0.78 0 En términos generales, en este estado del Golfo de México la dinámica costera muestra una influencia de la descarga de aguas continentales sobre el océano, aportando principalmente materia orgánica a la región marina, por lo que el efecto inverso del agua salada sobre los humedales es menor o nulo en la mayoría de los casos y el impacto que puede generarse por este patrón hidrodinámico y la salinidad incrementada subsiguiente también es bajo. 68 En el Pacífico subtropical mexicano, el manglar más importante es el que abarca el sur de Sinaloa y la región norte de Nayarit con una extensión de alrededor de 70,000 ha (Marismas Nacionales); en el Cuadro IV.5, se presenta el comportamiento del MEDij para las especies de mangle que conforman una de las regiones de manglar del pacífico mexicano más importantes a nivel mundial. Cuadro IV.5. Estimación del índice básico de impacto ambiental (MED ij ) para las especies dominantes de mangle en Sinaloa-Nayarit. Rhizophora mangle (rojo) Laguncularia racemosa (blanco) Avicennia germinans (negro) Condición adecuada (salinidad en ups) Salinidad UPS M E’ D’ MED’ 10 – 100 25.6 1 3 3 0.78 15 – 20 25.6 2 3 3 0.89 40 25.6 1 3 3 0.78 Promedio Desviación estándar 0.82 0.06 Nota: Factor ambiental limitante: salinidad. El patrón mostrado fue similar al de Quintana Roo, debido básicamente al efecto de la salinidad sobre L. racemosa, ya que la salinidad promedio reportado fue de 25.6 ups y esta especie se desarrolla mejor hasta 20 ups; el MEDij promedio para este ecosistema costero del pacífico subtropical mexicano fue de 0.82 ± 0.06 denotando una fragilidad similar a la presentada para el caribe mexicano. Existe un gran número de trabajos que versan sobre el manglar en nuestro país, desde revisiones documentales hasta investigaciones específicas sobre aspectos puntuales de este ecosistema. Derivado de este gran acervo científico, puede decirse que debido a que la costa del Golfo de México es más húmeda que la del Pacífico, los manglares del Golfo pueden encontrarse en zonas protegidas como los estuarios y las lagunas costeras que tienen una mayor influencia de agua dulce y la mayor riqueza específica en este litoral se encuentra en el sur de Veracruz, Tabasco y Campeche, zonas con alta precipitación y con temperaturas nunca menores a 14 °C (López y Ezcurra, 2002). La fisonomía del manglar de Quintana Roo es distinta a la del Golfo y del Pacífico, debido posiblemente a la menor tasa de recambio del sistema hídrico como una consecuencia de las características cársticas de la Península de Yucatán y por tanto a la gran influencia del agua saturada en calcio y baja en nutrientes de estas costas caribeñas (López y Ezcurra, 2002). El sustrato es un rasgo ambiental importante en el asentamiento, mantenimiento y sobrevivencia del manglar; Thom (1967 y 1982) reportó una fuerte dependencia entre las características del sustrato y la geomorfología del sitio estudiado en las planicies costeras de Tabasco y concluyó que la variabilidad en dicha morfología contribuye a explicar las condiciones locales del sustrato y por ende la composición y estructura del manglar. También se ha reportado el posible efecto de diversas interacciones abióticas como los parámetros ambientales y las geoformas sobre este ecosistema, donde la diversidad de los manglares disminuyó significativamente con el incremento en la salinidad y en los sitios menos salinos se presentaron bosques mixtos, los lugares más salinos están habitados por manglares monoespecíficos de Avicennia, mientras que Rhizophora y Laguncularia aumentan su cobertura, la cual es una medida de éxito ecológico, conforme la salinidad disminuye lo que manifiesta la cercanía entre el óptimo ecológico y el fisiológico; la variabilidad en composición y 69 zonación de los manglares puede estar relacionada con la salinidad y el ambiente geomorfológico (López y Ezcurra, 2002). Los cambios en la línea de costa pueden tener efectos de orden espacial en extensión global, regional y local (Duke, et al., 1998) y el manglar se ha tomado como indicador de estos cambios (Pannier, 1992); por lo que, los efectos del cambio climático serán de diferente magnitud y escala, propiciando condiciones físicas y químicas distintas a las cuales los manglares tendrán que responder diferencialmente a lo largo de la zona costera (Ortiz y Méndez, 2004). Las presiones humanas sobre este tipo de ecosistema han provocado una disminución de la cobertura natural; las mediciones realizadas a través de la herramienta satelital han permitido estimar que de 1970 a 1993 se perdió aproximadamente un 23% del manglar de Nayarit (Ramírez, et al., 1998) y un valor similar fue estimado para Sinaloa (Ruiz y Berlanga, 1999); además, la variabilidad en los datos reportados sobre deforestación de manglar es tal que no permite uniformizar los criterios para atender en orden de prioridad aquellas localidades que realmente estén siendo afectadas por las actividades antropogénicas, principalmente la tala de este recurso forestal, a pesar de existir en la actualidad normatividad nacional vinculada con este rubro ambiental. Todo este panorama hace que este ecosistema sea particularmente vulnerable. La creación de infraestructura de comunicaciones terrestres, petrolera, turística, urbana, eléctrica, así como insumos domésticos de carbón y leña, artefactos para pesquerías como tapos, galeras para secado de tabaco, aprovechamiento de taninos, son ejemplos de la amplia diversidad en la que el manglar se ha utilizado desde hace muchas décadas, creando hábitos y mitos difíciles de modificar con la subsecuente alteración del manglar que aunado a los fenómenos naturales, se magnifica el grado de impacto recibido. Conjuntando los resultados obtenidos del grado de vulnerabilidad ecosistémica de los criterios ecológicos generales y del índice básico de impacto ambiental MED, en la Cuadro IV.6, se presenta la integración del comportamiento mostrado de forma individual, por los estados litorales evaluados en función de los diversos criterios y parámetros considerados. Tabasco, es la entidad litoral mexicana en esta aproximación que resulta con el mayor grado de vulnerabilidad y de impacto ambiental, seguido por Sinaloa y por Quintana Roo. Cuadro IV.6. Grado de vulnerabilidad ecológica de los estados litorales evaluados. Criterios ecológicos e índice de impacto ambiental. RAMSAR RECURSOS PESQUEROS MedIJ (manglar) MedIJ (arrecife) Grado de Vulnerabilidad e impacto ambiental 2 3 2 0.78 NR ALTO 3 1 1 1 0.82 0.9 BAJO NR 3 2 3 0.82 NR MEDIO Entidad Cobertura Manglar Arrecife de coral ANP Tabasco 3 NR Quintana Roo 2 Sinaloa 1 El grado de conservación o deterioro del manglar, la presencia de áreas protegidas y la abundancia y diversidad de recursos pesqueros, determinan el grado de la vulnerabilidad en una región y con ello las consecuencias que puedan derivarse de eventos naturales o antropogénicos extraordinarios; una evaluación previa de los posibles escenarios, debe redituar en contar con medidas de prevención, o en su caso de restauración de ecosistemas alterados para aumentar su resiliencia y con ello su permanencia ante las amenazas que puedan presentarse. 70 Si se considera individualmente, para el criterio ecosistémico de manglar, el comportamiento decreciente del grado de vulnerabilidad fue el siguiente: Tabasco > Quintana Roo > Sinaloa Para el arrecife de coral localizado solamente en la región de Quintana Roo se estimó un grado de vulnerabilidad y de impacto ambiental altos (categoría 3). Al evaluar la vulnerabilidad costera derivada de los recursos pesqueros considerados, el patrón descendiente fue: Sinaloa > Tabasco > Quintana Roo En función de las áreas protegidas nacionales, el comportamiento de la vulnerabilidad costera fue el siguiente: Sinaloa > Tabasco > Quintana Roo Mientras que al tomar en cuenta los sitios de la Convención relativa a los Humedales de Importancia Internacional especialmente como Hábitats de Aves Acuáticas (RAMSAR, por sus siglas en íngles), se invirtió el patrón entre Sinaloa y Tabasco ya que para el Caribe Mexicano fue similar: Tabasco > Sinaloa > Quintana Roo Por lo que, el manglar y los sitios RAMSAR del estado de Tabasco, los arrecifes de coral de Quintana Roo, las pesquerías y las Áreas Naturales Protegidas (ANP) de Sinaloa, son las más vulnerables a los cambios climáticos y a los fenómenos hidrometeorológicos extremos; estos fenómenos podrían aumentar el índice de pérdida de la diversidad biológica. Campeche El ambiente erosivo regional de Campeche pone en situación de vulnerabilidad a todo el sistema lagunar-isla barrera, ya que éstas últimas ya no están recibiendo los sedimentos fluvio-deltaicos que recibían en décadas anteriores, dependiendo actualmente en su mayor parte por los detritos biogénicos locales. La pérdida de una fracción importante de sedimentos de origen continental, ocasiona cambios en la condición sedimentaria (espesor de capas, compactación, contenido arcilloso, etc.) y en las condiciones biológicas por la disponibilidad y tipo de nutrientes contenidos diferencialmente en los detritos oceánicos y continentales; esto ocasionará el desplazamiento o la adaptación de especies a la nueva condición del tipo de sedimentos. Por ejemplo, la presencia de pastos marinos. Quintana Roo En este Estado, existen cuatro especies de mangle, Rhizophora mangle mangle rojo, Avicennia germinans mangle negro, Laguncularia racemosa mangle blanco y Conocarpus erectus conocido como botoncillo. La superficie de cobertura de manglar reportada para este estado es de 64,755 hectáreas. Tabasco Al igual que para el estado anterior, en este litoral del Golfo de México, se presentan las cuatro especies de mangle ya mencionadas, con una superficie de manglar de 35,191 hectáreas. 71 Sinaloa En esta región del Pacífico subtropical mexicano coexisten las cuatro especies de mangle encontradas en los otros litorales; tiene una superficie de manglar estimada de 71,225 hectáreas. Del total de la superficie de manglar existente en México, el 43 % es superficie que se encuentra decretada como ANP y el 64 % de la superficie total de cobertura de manglar en nuestro país, está inscrito en la Convención Internacional Ramsar, para la protección de los humedales del mundo. Erosión costera La vulnerabilidad de cualquier sistema es una función de la sensibilidad de ese sistema para cambiar, es decir, su grado de respuesta, y el grado al cual él puede adaptar o absorber ese cambio. Claramente, los sistemas costeros naturales a lo largo de la costa de Quintana Roo tienen la capacidad de absorber o de adaptarse con el incremento en el nivel del mar, como han hecho durante los últimos miles de años en respuesta al incremento gradual del nivel del mar durante el Holoceno tardío. Consecuentemente, su respuesta al futuro incremento en el nivel del mar no será simplemente inundación, como se proyectó anteriormente, sino una reorganización de la dinámica física de los materiales sedimentarios (Pilkey y Cooper, 1994). La relación entre el incremento en el nivel del mar y el retiro de la línea de costa, sin embargo, es poco conocida. El retiro a largo plazo en sistemas abiertos de playas de duna, por ejemplo, es controlado por el suministro de arena, el gradiente costero y el incremento del nivel del mar. Y en el caso más simple, el retiro de playas desprotegidas y no consolidadas se puede predecir usando la regla de Bruun (Figura IV.3). Figura IV.3. Retiro de la Playa predicho usando la Regla de Bruun. Nota: Proporción del retiro, R = (L/B + el h) S = (1/tan Ø)S, donde S es valor del incremento del nivel del mar, L es longitud de perfil a profundidad del cierre h (base de perfil en el cual el intercambio del sedimento es despreciable), Ø es el ángulo de la pendiente del perfil, y B es altura de la duna (Bruun, 1962). No obstante la regla de Bruun asume un simple incremento bajo condiciones fairweather y no incluye los procesos como las tormenta, que cambian la profundidad de encierro (h adentro de la ecuación). Tampoco considera la estabilización de dunas y áreas posteriores a la playa por la vegetación o el interior de dunas por cementación meteórica (McLaren y Gardner, 2000). Consecuentemente, la regla de Bruun es generalmente inadecuada para predecir el retiro de la playa a lo largo de la costa de Q. Roo donde las playas son extensivamente estabilizadas por la vegetación y cementos. Un gran porcentaje de las playas a lo largo de la costa también son protegidas por los sistemas franja lagunar arrecifal. La respuesta de estos sistemas al incremento del nivel del mar es más difícil de predecir. Por ejemplo los ciclones tropicales los cuales en algunas partes a lo largo de la zona 72 costa causan erosión severa y retiro, pueden causar avance de la línea de costa a lo largo de las playas protegidas por arrecifes dependiendo de la pista de tormenta específica y de las condiciones meteorológicas. En un caso reciente, un gran huracán de categoría 5 (Wilma en 2005) causó avance a escala decimétrica de la línea de costa a lo largo de las playas protegidas por arrecifes como resultado de la movilización del sedimento lagunar. La erosión de las playas protegidas con arrecifes debida al incremento del nivel del mar es también posible de ser compensada por la tasa acreción vertical del arrecife. En efecto, el estudio de IPCC establece que el incremento del nivel del mar es poco probable en afectar a su capacidad de actuar como rompeolas (Meehl, et al 2007) porque se ha demostrado tener capacidad de nivelarse con subidas en el nivel del mar de hasta 12-14 mm/año, como fue registrado durante la última glaciación hace 14000 años (Blanchon, y Shaw 1995). La capacidad de los arrecifes del Caribe para solventar altas tasas de acreción, es sin embargo en la actualidad dudosa considerando la declinación drástica (del 80%) de la cubierta coralina debido a enfermedades y al blanqueamiento (Gardner, et al 2003). Si la capacidad de los arrecifes de acrecentar también es reducida en un 80% (ej., a ~3 mm/año), todos los panoramas de incremento del nivel del mar modelados arriba sumergirán progresivamente la cresta y llevarán a un incremento en la altura de onda, causando así la erosión de playa. Además, la exacerbación de esta erosión será la entrada reducida del sedimento del arrecife en la playa y el sistema lagunar, que contribuyen normalmente hasta aproximadamente el 30% por volumen del sedimento (Medina, 2008). Asentamientos Rodríguez y Bozada (en proceso) reconocen 16 municipios de muy baja vulnerabilidad (zonas metropolitanas), 81 municipios de baja vulnerabilidad (periferias urbanas y pequeñas ciudades), 168 municipios de vulnerabilidad media (rurales), 66 municipios con alta vulnerabilidad (pequeños municipios) y 23 municipios con muy alta vulnerabilidad (pobreza extrema y aislamiento). La mayor parte de las áreas que registran muy alta vulnerabilidad, se ubican en las zonas de la sierra Madre Oriental y cuenca del Usumacinta, es decir, en aquellas áreas que por su difícil topografía poseen significativos problemas de aislamiento. Al contrastar las zonas de vulnerabilidad social con las zonas de riesgo, puede apreciarse que las zonas de baja vulnerabilidad, se hallan asociadas con las zonas de desarrollo urbano, debido a que éstas, concentran gran parte de los procesos de modernización (infraestructuras y servicios de salud, educación, comunicación) y desarrollo económico (Producto Interno Bruto per capita). Sin embargo, aún cuando esas áreas de desarrollo urbano concentran los beneficios del desarrollo, ello no impide que también se encuentren amenazadas por situaciones de riesgo. Algunas de las zonas urbanas cuentan con muy buenos indicadores de desarrollo humano, pero eso no impide que enfrenten dinámicas de vulnerabilidad ambiental y particularmente de vulnerabilidad a fenómenos de cambio climático. La razón estriba en que se trata de ciudades que han crecido a un lado de las líneas costeras, y su expansión ha ocurrido en las inmediaciones de los ríos que desembocan al Golfo. Las zonas metropolitanas de Tampico-Ciudad Madero, Coatzacoalcos-Minatitlán, Villahermosa y Cárdenas, Tecolutla y Martínez de la Torre, Ciudad del Carmen y Campeche, son áreas de crecimiento urbano que se encuentran expuestas a dos situaciones de riesgo: por un lado, el incremento del nivel del mar y el impacto de los huracanes, y del otro, inundaciones y desbordamientos de los ríos que desembocan en su entorno. Los asentamientos populares, donde se concentra la pobreza urbana, suelen ubicarse en áreas contiguas a los cuerpos de agua (pantanos, ríos, lagunas), y sus habitantes son particularmente vulnerables. 73 V. ADAPTACIÓN ANTE EL INCREMENTO DEL NIVEL DEL MAR. La adaptación al cambio climático es la capacidad de los sistemas humanos y naturales para ajustarse, espontánea y ordenadamente, a los impactos de climáticos adversos. Así, para hacer efectivas las estrategias de adaptación se requieren modificaciones de gran alcance en los procesos de desarrollo, en los patrones dominantes de apropiación de los recursos naturales, en las prácticas de producción, los hábitos de consumo y en las formas de organización social, mientras que las acciones de mitigación de emisiones de GEI, requieren de una respuesta coordinada a nivel internacional, la adaptación requiere de una respuesta nacional a local y vicerversa. Las acciones e iniciativas de adaptación deben ser diseñadas e instrumentadas también a nivel nacional, estatal, municipal y sectorial y por lo tanto es necesaria la participación de todos los sectores y actores implicados en la planificación y la gestión del riesgo del sistema en cuestión. La adaptación incluye numerosas opciones de adecuación que dependen fuertemente de las características biogeofísicas y socioeconómicas locales, donde la opción óptima para una región específica puede ser una mezcla de ellas. Las medidas de adaptación son agrupadas en dos categorías generales: la adaptación autónoma y la adaptación planeada. La adaptación autónoma hace referencia a la utilización de la capacidad de respuesta libre de los sistemas costeros al cambio marino, en tanto que la adaptación planeada utiliza estrategias de prevención y respuesta antrópica al fenómeno marino adverso. En las estrategias correspondientes a las dos categorías mencionadas, el planeamiento requiere de la consideración de largos períodos de tiempo para garantizar su efectividad, que en este caso debe ser de al menos 100 años. La adaptación autónoma utiliza la capacidad que tienen los sistemas costeros para responder libremente a las presiones externas, como son las producidas por el cambio climático. La capacidad de respuesta depende ampliamente de la resiliencia y la resistencia de los sistemas costeros, las que a su vez están controladas por los procesos morfodinámicos litorales y fluviales. Los sistemas costeros con resiliencia y resistencia alta pueden llegar a tener la suficiente autorregulación para compensar el ascenso acelerado del nivel de mar, bien sea migrando hacia el continente o compensando el ascenso marino acelerado mediante la acreción de sedimentos. No obstante, las actividades humanas y la contaminación han reducido notoriamente la resiliencia de los sistemas costeros debido a la alteración de los ecosistemas. Esta interferencia incluye principalmente el desarrollo urbano, de infraestructura turística y la contaminación, actividades que evitan que tomen lugar procesos naturales como el crecimiento de los corales, la acreción de los manglares y los aportes de sedimentos por la deriva litoral. La opción de permitir la libre adaptación natural puede ser considerada en dos formas: no hacer nada y prevenir y/o revertir malas adaptaciones. La primera medida implica no tomar ninguna acción, dejando en libertad a los sistemas costeros para que se ajusten al nivel más elevado del mar. En la segunda opción son adoptadas medidas para reducir la interferencia de los sistemas y de la dinámica natural, así como para restablecerlas cuando sea posible. La adaptación autónoma puede ser facilitada mediante la adopción de las siguientes opciones de adaptación: no-intervención de áreas naturales de amortiguación de inundaciones, no-alteración y/o interrupción de la dinámica natural costera y fluvial y reversión de malas adaptaciones. Los dos primeros lineamientos hacen referencia a la prevención de nuevos desarrollos en áreas de amortiguación de eventos súbitos y extraordinarios tanto marinos como fluviales y la no-interrupción de los procesos de transporte y acumulación de sedimentos en el litoral y el delta, con el propósito de fortalecer los mecanismos de resiliencia de los sistemas costeros y aumentar su capacidad de respuesta. 74 La tercera opción considera la reversión de malas adaptaciones, como la eliminación de estructuras y la corrección de usos inadecuados de la tierra que interfieren con la dinámica litoral y deltaica. La reversión puede incluir el desmonte de estructuras que interfieren o su adecuación para reducir los impactos de su interferencia, así como el cambio de uso de la tierra hacia opciones de conservación del medio natural y la restricción de la ocupación (para prevenir potenciales amenazas y recuperar zonas de amortiguación). Estas opciones de adaptación pueden considerar acciones específicas para algunos sitios del litoral como: Restablecer la alimentación natural de las playas actualmente amenazadas en las zonas del Golfo de México y Caribe principalmente. Control de la contaminación y los daños sobre los corales y manglares e implementación de programas para recuperación con el propósito de aumentar la resiliencia de la línea de costa. Eliminación y/o reducción de la intervención de los deltas para permitir la adaptación autónoma del complejo deltaico al ascenso del nivel del mar. Creación y ampliación de áreas naturales protegidas para asegurar la no-interferencia en los procesos autónomos de adaptación. Las medidas más indicadas podrían incluir la ampliación de parques naturales para incluir mayores zonas de manglares e islas coralinas, y la creación de nuevas zonas de reserva natural en los humedales y pantanos costeros. Establecimiento de refugios, parques y reservas con corredores biológicos para permitir la migración de especies (caso tortugas en Capítulo III, sección 3.2). La adaptación planeada hace referencia a las medidas futuras para prevenir, reducir y resistir los impactos del cambio climático y en especial del ascenso del nivel del mar. Para el IPCC, la adaptación planeada puede darse mediante tres categorías de respuesta: el retiro manejado, la acomodación y la protección. Las estrategias de retiro manejado y acomodación incluyen principalmente medidas preventivas para áreas donde se permitirá la pérdida de terreno por erosión e inundación, facilitando la adaptación autónoma y la estabilidad de la dinámica de los sistemas costeros. La protección involucra tanto medidas de respuestas como de prevención para tratar de mantener la línea de costa en el sitio actual. El retiro manejado considera el abandono estratégico progresivo de las tierras y de las estructuras que pueden ser afectadas por el ascenso del nivel del mar. El abandono puede ser motivado en algunos sectores del litoral por el alto impacto ambiental y económico de las medidas de protección, considerándose como posible alternativa óptima permitir el avance de los ecosistemas hacia el continente. En el retiro manejado se consideran opciones de adaptación como: reubicación de la población amenazada, desarrollo condicionado a las fases de abandono, adopción de medidas de acomodación y prevención de futuros desarrollos importantes en áreas amenazadas. En las zonas costeras mexicanas, estas opciones de adaptación pueden ejemplificarse con acciones en sitios específicos como: No intervención de áreas altamente susceptibles como los manglares, los humedales salobres y las llanuras de inundación de los principales ríos para permitir que cumplan su función de amortiguación de inundaciones y expansión de los cuerpos de agua. Este es el caso de la mayoría de los humedales de Tabasco, Marismas Nacionales en Sinaloa-Nayarit, los manglares de la costa de Chiapas, Campeche y Quintana Roo. Retiro de la población actualmente amenazada y asentada sobre marismas de mangle y pantanos costeros; retiro gradual de la población asentada en las llanuras de inundación de los principales ríos. Este es el caso de las poblaciones que habitan las márgenes del Ríos Coatzacoalcos, Pánuco y el Grijalva –Usumacinta. 75 La estrategia de acomodación comprende el continuo pero modificado uso de la tierra y la inclusión de respuestas adaptativas de la población. Para el IPCC (1990), la acomodación implica que los habitantes continúen el uso de la tierra bajo su riesgo pero sin intentar prevenir que la tierra sea inundada o erosionada. Las respuestas adaptativas incluyen medidas como la elevación de las construcciones sobre los niveles de inundación, la modificación de los sistemas de drenaje y el cambio de uso de la tierra. La estrategia de acomodación considera opciones de adaptación como la conservación de los ecosistemas en armonía con la ocupación, la modificación del uso de la tierra, la protección de los ecosistemas amenazados y la regulación estricta de las zonas inundables. La ocupación continua considera el uso de áreas altamente susceptibles a la inundación mediante la adopción de respuestas de adaptación y la modificación de los códigos de construcción. Las opciones de adaptación relacionadas con la acomodación para los litorales mexicanos pueden incluir acciones como: Modificar el uso de la tierra en los deltas y establecer usos de acuerdo con la oferta natural y bajo prácticas conservacionistas. El IPCC recomienda la introducción de agricultura de crecimiento anegado y/o resistente a la sal. Promover el cambio de uso de la tierra en las llanuras de inundación de los principales ríos y deltas. Creación de nuevas y/o ampliación de áreas protegidas como parques nacionales para la protección de los humedales y pantanos costeros. Deben evitar los excesos de fertilizantes o emplear orgánicos de fácil degradación, para hacer eficientes los cultivos incluso utilizar la técnica de rotación o cambiar el tipo de cultivo; evitar la desecación de los suelos para no ser trasportados como sedimentos a los ambientes acuáticos costeros y no azolvarlos, lo cual permitiría una mayor transgresión marina como sucede en los Pantanos de Centla, aunque puede suceder lo contrario, que al no haber sedimentos la erosión sea mayor y por lo tanto también transgredir el mar. No incrementar áreas de cultivo y en su caso desaparecer tierras de éstas ociosas o abandonadas, que también han provocado azolvamientos en los ambientes costeros por transporte eólico e incluso han desaparecido humedales, en cuyo caso se sugeriría reforestar para evitar la erosión hídrica, que incrementaría el transporte de sedimentos. 5.1 Medidas de adaptación. El cambio climático es una realidad para la cuál es necesario tomar en cuenta como un factor significativo dentro de los planes de desarrollo económico de muchos países y en particular en México por su alta vulnerabilidad. La indiferencia ante este hecho repercutirá de manera negativa en todos los aspectos tanto ambientales como sociales y económicos. Deberán definirse estrategias de adaptación para la reducción de los impactos debidos al incremento del nivel del mar mediante medidas y acciones por los siguientes 50 años como: Ampliar la extensión de las zonas de amortiguamiento en los desarrollos urbanos y turísticos de zonas costeras más vulnerables, para reducir los daños potenciales ocasionados por huracanes e inundaciones. Desarrollar e instrumentar una estrategia de reubicación de la población actualmente amenazada y asentada sobre marismas de mangle y pantanos costeros; propiciar un retiro gradual de la población asentada en las llanuras de inundación de los principales ríos. Fortalecer la regulación del uso de la tierra en los deltas y fomentar prácticas sustentables de manejo de suelo y uso de agua en actividades agropecuarias en la parte media y alta de las cuencas y en su caso recuperar tierras de cultivo abandonadas e integrarlas a los ecosistemas. Ampliar áreas para la protección de los humedales y pantanos costeros, sobre todo en los estados identificados con impactos por el posible aumento del nivel del mar. 76 Propiciar espacios para el desplazamiento de ecosistemas costeros mediante regulación, para que el desarrollo de infraestructura y asentamientos humanos sea hacia el interior del continente, a partir de los límites de áreas que serían potencialmente afectadas con incrementos en el nivel del mar. Continuar con la atención de la fragmentación de los humedales en las cuencas bajas que son afectados por infraestructura costera (carreteras, puentes, bordos, escolleras, muros, entre otros). Reforzar la implementación de programas de reforestación con especies resistentes al aumento de la temperatura y salinidad, para construir y estabilizar las dunas, con el fin de disminuir la erosión costera y estabilizar la línea de costa. Mantener un flujo de caudal óptimo para el desarrollo de los ecosistemas costeros, mediante una planificación de presas que asegure dicho caudal. Reforzar el control de la contaminación y los daños sobre los corales y manglares e implementar programas para su recuperación con el propósito de aumentar la resiliencia de la línea de costa. Llevar a cabo un programa de vulnerabilidad de la zona costera por fenómenos hidrometeorológicos extremos y cambios del nivel del mar, que contemple un monitoreo nacional permanente, que permitan identificar los cambios en la zona litoral, para proponer las medidas de adaptación pertinentes. Planes de desarrollos urbanos y turísticos en zonas costeras que contemplen amplias zonas de amortiguamiento ante daños potenciales ocasionados por huracanes e inundaciones como la prohibición de la urbanización de zonas inundables, playas y dunas. Estrategia de adaptación específica del impacto en los manglares y otros humedales por el ascenso en el nivel del mar para evitar el aprovechamiento o transformación de los hábitats terrestres por actividades humanas por arriba de 1 metro del nivel medio del mar, lo que permitiría el desplazamiento del manglar y otros humedales tierra adentro. Creación de norma de agua dulce por servicios ambientales (“gasto ecológico”) hacia los ecosistemas costeros (ríos, humedales dulceacuícolas, manglares y lagunas costeras) y la conservación y restauración de los cauces naturales de los aportes de agua marina (esteros y venas) ya que los humedales requieren en ocasiones pulsos de inundación y sobretodo de sedimentos. Evitar la construcción de presas que secuestren significativamente los aporte fluviales y con planteamientos hidráulicos que garanticen además de una cuota de agua dulce y sedimentos que permita la sustentabilidad ambiental de los humedales costeros, pulsos de agua que propicien inundaciones controladas hacia el complejo de humedales en su totalidad. Evitar la fragmentación de los humedales con construcción de carreteras o cualquier tipo de bordo en los humedales o de ser necesarios dejar el suficiente número de pasos de agua ó de preferencia sobre pilotes para mantener la integralidad hidrológica. Mantener el aporte de sedimentos de los ríos hacia las costas como una medida para enfrentar el incremento del nivel del mar, lo cual resalta el interés de estudiar y atender la influencia de las presas en la reducción de aporte de sedimentos. Ecosistemas costeros El efecto del cambio climático está afectando a un cúmulo de especies que si bien consideradas por separado, la pérdida de alguna de ellas, podría no tener mucho valor, al considerarlas dentro del entramado biológico del ecosistema, la pérdida de una especie o incluso alguna población, o el aumento desmesurado de alguna otra, favorecida por estos cambios, puede tener efectos catastróficos en el conjunto del ecosistema. Los arrecifes coralinos, los manglares y en menor grado los pastos marinos, sirven de barrera y protegen en gran medida a la zona costera. No obstante, muchos de ellos también son sensibles al acelerado ascenso del nivel del mar. Por ejemplo, los manglares protegen contra los ciclones, las tormentas y las mareas. Desgraciadamente, muchos manglares ya sufren la presión de la 77 explotación excesiva, lo que reduce la resistencia al ascenso previsto del nivel del mar. Por lo tanto, las estrategias de adaptación deben centrarse en la reducción de estas presiones externas. Las tortugas marinas y las poblaciones de muchas especies ya están amenazadas y correrán un mayor riesgo a causa de la sinergia entre las coerciones del cambio climático, que hacen inhabitable su hábitat actual, y de los cambios en el uso de la tierra que fragmentan los hábitats 11. Sin adaptación, algunas especies actualmente calificadas de “críticamente en peligro de extinción” se extinguirán y la mayoría de las consideradas “en peligro de extinción o vulnerables” serán mucho más raras en el Siglo XXI. Esto puede tener su mayor impacto en las sociedades humanas de ingresos más bajos, que dependen de la vida silvestre para su subsistencia. Además, es muy probable que la pérdida o reducción de especies tendrá efectos sobre los servicios que presta la vida silvestre mediante la función que cumple dentro de un ecosistema (por ejemplo, polinización, eliminación natural de las plagas), la recreación (por ejemplo, la caza deportiva, la observación de la vida silvestre). Los posibles métodos de adaptación para reducir los riesgos para las especies podrían incluir el establecimiento de refugios, parques y reservas con corredores biológicos para permitir la migración de especies, así como el empleo de la reproducción en cautiverio y la reubicación. No obstante, estas opciones pueden tener limitaciones de costo. Manglar Sin duda y como se detalla en muchos informes y publicaciones recientes, los humedales y entre ellos los ecosistemas de manglar, serán sin duda uno de los primeros afectados por el cambio climático. Algunos estudios demuestran que más que el aumento de la temperatura, serán los cambios del nivel del mar lo que más los afectará y debido a su importancia ya diversas Universidades y centros de estudios han iniciado medidas de adaptación como la restauración, la repoblación y la reforestación de los mismos. Las estrategias de adaptación de los manglares deben centrarse en la reducción de estas presiones externas. Para las áreas donde existan actividades relacionadas con la industria petrolera, se recomienda: Utilización mínima del bosque de manglar en todas las fases. Interrupción mínima del flujo de agua dulce hacia los manglares. Alteración mínima del flujo del agua de las mareas hacia los manglares y dentro de ellos. Alteración mínima de la vegetación. Alteración mínima del suelo. Mantenimiento (cuando sea posible) de franjas amortiguadoras a lo largo de la costa, los ríos, los arroyos y las corrientes. Control de la contaminación del ambiente. Implementar programas de restauración. Las principales razones para efectuar un programa de restauración son: la recuperación del hábitat para restablecer en la medida de lo posible, sus condiciones originales, y con ello, restablecer también los servicios ambientales que originalmente se derivaban de él. Pero además, estos programas generan beneficios directos a través de la contratación de lugareños para los trabajos que implican estos programas, sin contar la capacitación y especialización que esa gente que vive allí, alcanza en las técnicas y procedimientos para llevar a cabo trabajos serios y eficientes de 11 http://www.ipcc.ch/pdf/climate-changes-2001/impact-adaptation-vulnerability/impact-spm-ts-sp.pdf 78 restauración. Por tal motivo, estos programas pueden ser considerados sustentables toda vez que tocan los tres aspectos fundamentales de este concepto generando beneficios económico, ecológicos y sociales. Este, es el fin último que se persigue en un programa de restauración a través del concepto de desarrollo de comunidades rurales especializadas denominadas para efectos prácticos: “mangleros”. De esta forma, los beneficios directos que se generan consiguiendo por una parte regenerar los ecosistemas a sus condiciones originales (o lo más cercano posible a éstas, Figura V.1, a y b) y al mismo tiempo, generando un círculo virtuoso de fuente de trabajo en un recurso que eventualmente puede manejarse de formas sustentable para la propia comunidad que lo regeneró, aunque para ello debe revisarse el marco normativo actual. Ya desde 1959, algunos países asiáticos han realizado estudios sobre la regeneración y el crecimiento de manglar (Teas, 1977; Kinch, 1975; Lewis III, 1979; Wadsworht, 1959). Al respecto, existen algunos trabajos que se enfocan en el trasplante y sobrevivencia de las plántulas de tres de las especies presentes en México (Bojórquez y Prada, 1988; Pulver, 1976; Cintrón, 1982). Estos estudios se enfocan a trasplantes directos. Por su parte, algunos países como los árabes tienen programas de forestación con manglares para uso forrajero de cabras y camellos (Agraz, 1999), mientras que los ingenieros en Texas, Estados Unidos, recomiendan la conservación de los humedales, porque los consideran como uno de los sistemas más eficientes de protección contra las inundaciones. En Bangladesh, se reforestaron 25,000 ha de manglares para utilizarse como barrera contra los tifones que causaron la muerte de más de 70,000 personas cuando estos ecosistemas fueron remplazados por arrozales (Fosberg, 1917). Otro ejemplo más dramático de esto se reveló durante el tsunami que atacó estas áreas y a Indonesia en 2004. Además. En países como Adamán, Tailandia, Malasia, Puerto Rico e Indonesia, se han aplicado técnicas silvícolas en sus bosques de manglar de manera cotidiana, tales como cosecha y reforestación llegando incluso a desarrollar tiempos de rotación de entre 20 a 100 años dependiendo de la especie (Lewis, 1982). En lo que se refiere a sobrevivencia, es ampliamente conocido que cuando parámetros como el crecimiento, área foliar y salud de las plántulas, es cuidado desde la etapa de vivero, normalmente se obtienen mejores índices de adaptación-sobrevivencia y desarrollo de las plántulas por encontrarse libres de predadores y por tener mayores atributos fisiológicos para enfrentar aquellos tensores ambientales a los que se verán sometidos, garantizando de esa forma un mayor éxito en la reforestación. Algunos de los países que han trabajado bajo esta premisa son Bangladesh, Tailandia, India, Australia, Vietnam, Indonesia, Arabia Saudita, Cuba, Colombia, Panamá y México (Agraz, 1999). Estudios realizados bajo condiciones controladas en viveros experimentales en nuestro país, han reportado índices de sobrevivencia que van desde el 80% hasta el 100% incluso para Rhizophora mangle, Avicennia germinans y Laguncularia racemosa (Figura V.2, a y b, Agraz, 1999; Benítez, 2003; Agraz, et al., 2004). Algunos programas de reforestación reportados para manglar, basan su éxito en estudios experimentales (viveros de halófitas) utilizando diferentes variedades genéticas de manglar (Figura V.3), y como punto importante la consideración de plántulas más apropiadas para la región e incluso la calidad del sitio a reforestar, sin descuidar la capacitación previa de la mano de la obra local antes de realizar una reforestación extensiva. En caso de que se trate de un sitio cuyo patrón hidrológico fue alterado, estos programas consideran como un paso indispensable hacer trabajos de restauración antes de pensar en esquemas de reforestación, dando para ello puntual seguimiento a los patrones fisicoquímicos del agua intersticial para seleccionar el momento y la especie más propicios para reforestar. Asimismo, en aquellos casos en los cuales el programa de reforestación requiera de gran cantidad de plántulas (programas extensivos con varios ciclos anuales) se deberá contemplar obligatoriamente un vivero exclusivamente para producción de mangle. Esto con la finalidad de garantizar la disponibilidad de plántula en condiciones óptimas de crecimiento. 79 Figura V.1 a. Programa de restauración a través del desarrollo de comunidades rurales. Figura V.1 b. Viveros de plántulas de manglar de la Universidad del Carmen, Ciudad del Carmen, Campeche. Fuente: Flores, F., Rojas-Galaviz, J. L. y Zárate-Lomelí, D. (2009). Importancia ecológica y económica de los ecosistemas de manglar y otros humedales costeros. Elementos de juicio para unificar criterios de comprensión y análisis. pp. 54. http://www.senado.gob.mx/comisiones/LX/cyt/content/presentaciones/docs/Rojas_Galaviz.pdf 80 Figura V.2 a. Estudios realizados en viveros bajo condiciones controladas. Fuente: Flores, F., Rojas-Galaviz, J. L. y Zárate-Lomelí, D. (2009). Importancia ecológica y económica de los ecosistemas de manglar y otros humedales costeros. Elementos de juicio para unificar criterios de comprensión y análisis. pp. 43. http://www.senado.gob.mx/comisiones/LX/cyt/content/presentaciones/docs/Rojas_Galaviz.pdf Figura V.2 b. Estudios realizados en viveros bajo condiciones controladas. Fuente: Agraz, C.M., Flores-Verdugo, F. J. (2004). Creación y restauración de ecosistemas de manglar. Principios básicos. en: Moreno-Cassasola, P. (Ed.). Manejo Integral de la Zona Costera: Un Enfoque Municipal. Consejo Estatal de Protección al Ambiente del Gobierno de Estado de Veracruz y el Instituto de Ecología, A. C. 81 Figura V.3. Viveros de plántulas de manglar de la Universidad del Carmen, Ciudad del Carmen, Campeche. Arrecifes de coral Expertos de todo el mundo han elaborado las siguientes recomendaciones de alta prioridad para conservar los arrecifes (Wilkinson y Souter, 2008): Combatir urgentemente el cambio climático global - a menos de que se produzcan dramáticas reducciones en las tasas de emisión de gases efecto invernadero, se verán amenazados a 82 largo término los arrecifes de coral. Los científicos estiman que el mundo tiene de 8 a 10 años antes de que el cambio climático comience a devastar los arrecifes coralinos. Minimice las presiones humanas sobre los arrecifes - daños por sobrepesca y pesca destructiva, aumento de la sedimentación, drenaje de nutrientes y otros contaminantes y pérdida de hábitat por desarrollo insostenible. Controlando estas amenazas se mejorará la capacidad de los arrecifes para resistir mejor las pérdidas por cambio climático. Países en desarrollo, requieren de asistencia para mejorar los métodos de captura pesquera, manejo costero basado en la comunidad y desarrollo de nuevas alternativas de trabajo que disminuyan la presión sobre los arrecifes de coral. Incluir más áreas de arrecifes coralinos dentro de ANP, las cuales deberán contener amplias zonas de pesquerías y estar conectadas a la red de ANP regionales con manejo efectivo y apoyo gubernamental. Proteja los arrecifes remotos - en el futuro, las más grandes reservas de biodiversidad estarán en los arrecifes alejados de las grandes masas continentales y de poblaciones humanas. Si éstos están protegidos, podrán servir como semilleros de larvas y juveniles de organismos para arrecifes que se encuentren deteriorados. Los países desarrollados tienen la mejor gobernabilidad y capacidad para proteger los arrecifes en sus aguas jurisdiccionales. Mejore la capacidad de aplicabilidad de las regulaciones de las ANP. Sistemas efectivos y garantizables de gobernabilidad son esenciales para regular el acceso y explotación en ecosistemas bajo manejo. Países en desarrollo necesitan asistencia para establecer sistemas efectivos de aplicabilidad que sean compatibles con los valores culturales y prácticas locales. Ayude a mejorar la toma de decisiones con un adecuado monitoreo ecológico y socioeconómico - El incremento en el monitoreo es necesario para proveer de la mejor información a los manejadores de recursos naturales y tomadores de decisiones, sobre los impactos inminentes de los efectos del cambio climático para reducir las amenazas a los arrecifes coralinos y comunidades costeras. Tortugas Previo al conocimiento de las causas y efectos del cambio climático sobre los ecosistemas, una de las actividades que se han desarrollado para favorecer la conservación y recuperación de las tortugas marinas, ha sido el establecimiento de los “campamentos tortugueros” a lo largo de ambos litorales del país, cuyo objetivo principal ha sido la protección de la anidación, en las playas más importantes, de todas las especies que se reproducen en México (Márquez, 1976), así mismo se decretaron en la década de los años ochenta del siglo pasado, las “zonas de reserva y sitios de refugio para la protección, conservación, repoblación, desarrollo y control de las diversas especies de tortuga marina”, ubicadas en los estados de Chiapas, Guerrero, Jalisco, Michoacán, Oaxaca, Sinaloa, Tamaulipas y Yucatán” (DOF, 1986), a las cuales mediante otro acuerdo se elevaron de nivel, dándoles el rango de “áreas naturales protegidas, con la categoría de santuarios” (DOF, 2002). Por otra parte, existen playas de anidación que aún no están en la categoría de “santuarios” pero que se consideran importantes por el volumen de la población que anida y por las importancias de las especies, de acuerdo a su vulnerabilidad, como es el caso de las tortugas de carey, lora, prieta y laúd, las cuales valdría la pena incluirlas en esa categoría y poder darle mejor seguimiento a las poblaciones. Cuando se realicen proyectos para recuperación de playas en zonas de anidación de tortugas marinas, deberá utilizarse siempre arena que cumpla con las características sedimentológicas de la arena original, esto es, con la misma textura de sedimento de los sitios de anidación originales. 83 Así mismo evitar poner obstáculos de origen antropogénico (rompeolas, espigones, tetrápodos, geotubos, etc.) que impidan la arribazón de las tortugas marinas, sin un estudio previo de la dinámica costera y el impacto que pueden causar. Del mismo modo, es importante realizar un análisis del impacto antropogénico por el manejo de las especies de tortugas marinas y considerar los escenarios de erosión y cambio climático para diseñar medidas de adaptación en los programas de conservación de la tortuga marina. Pesquerías y acuacultura Las fluctuaciones en la abundancia de peces se consideran cada vez más como una respuesta biológica a las fluctuaciones climáticas a mediano plazo, además de una consecuencia de la pesca excesiva y otros factores antropogénicos. La adaptación por expansión de la acuacultura marina puede compensar en parte las posibles reducciones en la captura de peces oceánicos. La producción por acuacultura marina se ha duplicado desde 1990, y en 1997 representó aproximadamente el 30% de la producción comercial total de pescados y mariscos para consumo humano. Sin embargo, la productividad futura de la acuacultura puede verse limitada por las poblaciones de arenques, anchoas y otras especies que se utilizan para proporcionar harina y aceites de pescados para alimentar a especies cultivadas, que pueden sufrir efectos adversos del cambio climático 12. 12 La actividad pesquera y acuícola debe contribuir eliminando flotas y prácticas pesqueras ineficientes, para restringir el consumo de combustibles, y aumentar la eficiencia en los cultivos, reduciendo el uso de agua y energía, disminuir las pérdidas postcosecha y aumentar el reciclado de desechos. Los actores de la actividad, deben participar en la planificación y operación de sus pesquerías en comanejo, al involucrarse en la planeación y administración son a su vez corresponsales, en este punto se requiere educación y capacitación. Crear reservas marinas, que convenientemente administradas en comanejo por las comunidades, puedan proveer de resguardo y protección de larvas, servicios de ecoturismo y recreación (Kaufman y Dayton, 1997) Se deben rescatar los centros acuícolas productores y el trabajo de siembra de crías, para mantener el nivel de producción de los embalses continentales que aportan alimento y generan riqueza a las poblaciones rurales. En México una estrategia de manejo debe ser la diversificación de la pesca, para cubrir de manera prioritaria las necesidades alimentarias de la población (Pikitch, et al., 2004 en Castelló, et al., 2007). Diseñar políticas públicas dirigidas a reducir la vulnerabilidad de los ecosistemas y recursos, en cumplimiento al Artículo 2 de la Convención Marco de las Naciones Unidas sobre el Cambio Climático, que señala: “…permitir el desarrollo económico de manera sostenible, lo cual no podrá ser, si los ecosistemas se encuentran en un camino de degradación, pérdida de funciones y de especies por efecto de las actividades humanas”. http://www.ipcc.ch/pdf/climate-changes-2001/impact-adaptation-vulnerability/impact-spm-ts-sp.pdf 84 Industria Petrolera Para las áreas donde existan actividades relacionadas con la industria petrolera, se recomienda: Dada la frágil naturaleza de los ecosistemas de manglar, se deberá reducir el posible efecto de operaciones de petróleo y gas sobre el manglar, a través de: Una planificación minuciosa de los levantamientos sísmicos, de las perforaciones exploratorias y de la provisión de servicios contingentes Una selección de aquellas técnicas y equipo que minimice la necesidad de una infraestructura de apoyo dentro del manglar Un cuidadoso control de las actividades para identificar los efectos inesperados en una primera fase. La industria petrolera debe considerar que, en cada etapa del desarrollo de petróleo y gas procedimientos que deben ser puestos en práctica, para prevenir posibles daños al manglar y minimizar efectos. Levantamientos exploratorios Los vuelos a baja altura deberán ser programados de tal manera que minimice las alteraciones de las crías, migraciones o patrón de crecimiento de las especies sensibles. Deberá minimizarse la extensión de las actividades sísmicas en los manglares. Se debe prestar atención a no alterar el patrón de drenaje. La introducción de vehículos pesados es inadecuada porque requieren una vía de acceso de 4 metros de ancho y una base sólida para que sostenga los vehículos. Las técnicas de agua, como cañones de aire y de agua, requieren profundidades de más de 23 metros y una gran cantidad de equipos auxiliares y requieren el uso de gabarras de rastreo poco profundas. Estas técnicas no son una opción viable en sistemas costeros y poco profundos como son los manglares. Cuando se utiliza técnica de explosivos, los agujeros deben ser tapados para evitar la erosión, mantener la hidrología de la superficie y disminuir el peligro para el hombre y para animales Las líneas sísmicas deben ser máximo de 1.5 a 2 metros de ancho, debe evitarse la destrucción de grandes manglares, reducir los impactos hidrológicos. 5.2 Opciones de reducción de la vulnerabilidad La estrategia de protección busca mantener la línea de costa en su posición actual mediante medidas de defensa, las que pueden consistir en la construcción y/o ampliación de estructuras y en la alimentación artificial y mantenimiento de playas. Sin embargo, las opciones de protección pueden involucrar la pérdida de funciones naturales de los sistemas costeros, del valor de los recursos naturales y el debilitamiento de los mecanismos de resiliencia si no son cuidadosamente diseñadas y basadas en estudios de impacto ambiental. Por tanto, la selección de una opción de defensa debe involucrar importantes consideraciones ambientales, sociales y económicas, que necesitan ser previamente evaluadas en forma cuidadosa. En la protección se hace énfasis en la defensa de áreas altamente vulnerables como centros de población, actividades económicas y ecosistemas estratégicos. Las medidas de protección pueden ser adoptadas para la línea de costa completa, para las áreas de marcada importancia o no ser protegido ningún sector litoral, en una elección que dependerá de razones ambientales y económicas fundamentalmente. La estabilización de la línea de costa puede intentarse mediante 85 opciones como la alimentación de playas, la restauración de humedales y la reforestación de las zonas aledañas a ésta. Por lo tanto, las acciones preventivas de adaptación evitarán costos de reparaciones y ajustes posteriores y tendrán importantes beneficios. Sin embargo, para países como México, las principales restricciones para adoptar y aplicar medidas de adaptación, son los altos costos que representan. Por lo tanto, es necesario asegurar que la implementación de medidas aporte beneficios a corto plazo y a bajos costos o que incluso pueda generar ahorros económicos (INE, 2006). Debido a que la zona litoral de todo el país está expuesta a fenómenos meteorológicos extremos y de la elevación del nivel del mar, como resultado del cambio global climático; es necesario tomar varias medidas, por lo que se recomienda: Para conservar una playa, se tome en cuenta la existencia de una fuente continua de sedimentos, un transporte litoral sin interrupciones y la protección de las playas a los fenómenos hidrometeorológicos extremos. Es necesario que los asentamientos humanos y sus diversas actividades (industriales y recreativas) asentadas tanto en las márgenes de los cuerpos costeros como en vías fluviales asociadas o parte altas de las cuencas, no descarguen a la zona costera sus aguas de desecho; lo que requiere de la construcción de plantas de tratamiento de alta eficiencia y proyectadas a largo plazo, antes de ser descargadas, incluso utilizar el agua tratada para servicios secundarios. Especialmente las áreas agrícolas adyacentes a los sistemas costeros, en afluentes fluviales o aguas cuencas arriba, deben evitar los excesos de fertilizantes o emplear orgánicos de fácil degradación; se deben hacer eficientes los cultivos incluso utilizar la técnica de rotación o cambiar el tipo de cultivo; evitar la desecación de los suelos para no ser trasportados como sedimentos a los ambientes acuáticos costeros y no azolvarlos, lo cual permitiría una mayor transgresión marina como sucede en los Pantanos de Centla, aunque puede suceder lo contrario que al no haber sedimentos la erosión sea mayor y por lo tanto también transgredir el mar. No incrementar áreas de cultivo y en su caso desaparecer tierras de cultivo ociosas o abandonadas que también han provocado azolvamientos en los ambientes costeros por transporte eólico e incluso han desaparecido humedales, en cuyo caso se sugeriría reforestar para evitar la erosión hídrica que incrementaría el transporte de sedimentos. Ordenamiento territorial costero, falta del seguimiento y organización. Aplicación de la legislación ambiental costera correspondiente. Reglamentación de distancias mínimas para el levantamiento de construcciones cerca de la línea de costa no resistentes, las cuales deberán estar apoyadas en detalladas mediciones de tasas locales de retroceso de la línea de costa. 5.3 Costos por la no adaptación. La adaptación al cambio climático es la capacidad de los sistemas humanos y naturales para ajustarse, espontánea y ordenadamente, a los impactos de climáticos adversos. Así, para hacer efectivas las estrategias de adaptación se requieren modificaciones de gran alcance en los procesos de desarrollo, en los patrones dominantes de apropiación de los recursos naturales, en las prácticas de producción, los hábitos de consumo y en las formas de organización social. Dentro de las zonas costeras son particularmente vulnerables a los cambios de clima, los humedales, las lagunas costeras, los estuarios, los arrecifes, los pastos marinos, y de cuyo correcto 86 funcionamiento dependen muchas especies de peces, crustáceos y moluscos; que son base de la economía de muchas poblaciones ribereñas en el país. Debido a que las zonas costeras son altamente complejas desde el punto de vista funcional, es necesario describir por ecosistemas los costos y las principales medidas de adaptación al cambio climático. Resulta difícil el cálculo de los beneficios económicos que acarrean los trabajos dirigidos a la preservación ambiental o a la facilitación del uso sostenible de los recursos naturales. La Economía Clásica no aborda estos temas en términos comunes de costo-beneficio 13. Ahora bien, los costos de los programas de restauración son altamente variables dependiendo sobre todo de diversos factores locales tales como: costo de la mano de obra, características del sitio (su accesibilidad, tamaño y calidad), la cercanía de las áreas para colecta de propágulos, producción en viveros, tipo de material biológico a utilizar, costo de los materiales para la construcción y operación del vivero y colecta de propágulos y plántulas, la densidad de siembra, así como el grado de mortalidad (sustitución de plántulas muertas). A nivel internacional, los costos de reforestación varían desde $1,140 hasta $6,545 dólares/ha, dependiendo del tipo de material que se utilice: propágulos o plántulas. Los costos se incrementan sustancialmente si en lugar de usar propágulos se utilizan árboles (Pulver, 1976). El reducir el espacio entre plántula y plántula en 1/3 de la distancia original de 0.9 m a 0.61 m) duplica el número de trasplantes (de 12,100 a 26,896 plantas/ha) y con una mayor reducción (0.3 m) lo incrementa hasta 110,889 plántulas/ha. Asimismo, un programa de reforestación efectuado en el aeropuerto internacional de Brisbane en 1980, presentó un costo por recaudación y plantado de <$0.5 dólares/propágulo, con una sobrevivencia entre 30 y 90%. Cuando se usaron plantas de un año de edad el costo fue de $0.74 -$1.33 dólares con índices de sobrevivencia de entre 40 a 60% y por concepto de transplante $4.50 dólares y sobrevivencia de 80% (Saenger, 1996). Por su parte, Snedaker y Biber (1996) mencionan costos similares, traduciéndose los costos en aproximadamente $20,000 dólares/ha, mientras que Untawale (1996) ha reportado intervalos de costos por transplante de $70 a 122 dólares/ha en la India. Para Tailandia el costo calculado fue de $140 dólares/ha (Alsornkoae et al., 1995), y en Malasia de $314 dólares/ha (Chan, 1996). Sin embargo, en ese país los costos de mano de obra son muy bajos. Es relevante mencionar que en estos programas (Sánchez Paéz et al., 2000), los costos de reforestación con base a una densidad de siembra, desde 3 x 3 m (1111 plántulas) hasta 1 x 1 (10,000 plántulas), el costo de una hectárea se encontró entre $150 y $1,350 dólares. Igualmente este autor menciona que el precio por todas las actividades y gastos de un ciclo de vivero (abono, semilla, llenado de semilleros, siembra para producción y siembra incluyendo preparación del terreno 14) de 24,000 plántulas, tuvo un costo $3,225 dólares. Lewis (1979) realizó un programa de restauración en St. Croix, U.S. Virgin Islands con un costo total de $12.500/dólares/ha, reforestado con una distancia entre plántulas de 0.7 a 0.8 m, con una sobrevivencia después de 6 semanas del 75%. Datos mundiales indican que los manglares dañados, pera su restauración, requieren un gasto entre 10,000 y 100,000 US por hectárea, en dependencia de las características físicas del lugar, disponibilidad de propágulos, tecnología disponible, etc. Los pastos marinos resultan más caros, y se calcula entre 50,000 y 200,000 US por hectárea. En nuestro país existen pocos programas de restauración y por tanto es realmente escasa la información disponible al respecto. Sin embargo, los costos para México se estiman desde los 0.58 a 0.74 dólares para producción de plántula. Así, un programa de restauración (acciones hidrológicas + vivero de mangle + reforestación) se ha calculado con un costo de 12,840 a 68,469 dólares ha-1 13 14 http://www.forum.villaclara.cu/ponencias/trabajo/90 No indica qué tipo de preparación y si se refiere a restauración hidrológica. 87 (Benítez, 2003; Agraz, et al., 2004). Es relevante mencionar que la variación del costo en la producción de plántulas se debe sustancialmente a las variaciones en el tipo de sustrato, tipo de sistema de producción (sistema de riego y productos para fortalecimiento/vigor foliar y radicular), tiempo de permanencia en el vivero y porcentajes de sobrevivencia (sustitución de material). Con respecto a la restauración hidrológica, el costo variará dependiendo de la calidad del sitio y la zona económica, así como de las necesidades del número de canales y tipo, depende también del número de ejecuciones (normalmente en periodos bianuales para corregir o prevenir contingencias derivadas de eventos naturales Figura V.4). Por su parte, los costos en la reforestación se ven influenciados por el tipo de contratación que se realice con los “mangleros”: esto es, por tiempo o por tarea, densidad de la reforestación (tipo fisonómico que se requería como meta), tipo de material que se utilice, cantidad y calidad de los propágalos, plántula o árbol (si es que son de vivero o silvestres), acceso y tipo de área, mantenimiento y seguimiento (3 años) y finalmente contingencias derivadas del ataque de plagas o enfermedades (tipo y tiempo de producto por aplicar). Acciones generales para los programas de restauración en bosques de manglar degradados. Detección de las áreas potenciales para la restauración. Detección de factores de impacto y adaptación. Evaluación de los principales parámetros físicos (hidroperÍodo, microtopografía, textura del sedimento) y químicos del agua intersticial y del sedimento (salinidad, pH, potencial redox, pH, nutrientes, sulfuros) en las áreas potenciales para la restauración. Definición de las medidas de adaptación congruentes con el tipo de impacto o efecto que originó la mortalidad o degradación del bosque. Clausura del patrón hidrológico: restauración hidrológica con/sin reforestación. Deforestación: reforestación o en el caso de que no exista posibilidad de mitigar el área impactada. Incremento de la cobertura vegetal: prestación como una medida compensatoria. Definición del origen de la plántula (natural o de vivero) Definición del tiempo de seguimiento y mantenimiento del programa (mínimo 3 años). Figura V.4. Restauración hidrológica. 88 Fuente: Flores, F., Rojas-Galaviz, J. L. y Zárate-Lomelí, D. (2009). Importancia ecológica y económica de los ecosistemas de manglar y otros humedales costeros. Elementos de juicio para unificar criterios de comprensión y análisis. pp. 38, 42http://www.senado.gob.mx/comisiones/LX/cyt/content/presentaciones/docs/Rojas_Galaviz.pdf Carreteras costeras Con respecto a las carreteras costeras, la creciente generada por el paso del huracán Wilma, dejó sumergidos muchos puntos de éstas, en los cuales la base polímero de alta resistencia para el recubrimiento de las carreteras permaneció intacto y sin daño. Otras bases que no fueron tratadas con Base-Seal y Top-Shield, fueron severamente dañadas por la lluvia. Estos productos se han utilizado en India, China, España, Italia, Filipinas, Alemania, Guatemala, Panamá y otros países con resultados similares. Reducción del coeficiente de permeabilidad: 10-7 a 10-9 cm / seg. * En términos de intervalo de gradiente unitario*. Los estudios científicos independientes revelan que cuando la Base-Seal alcanza su máxima viscosidad, el resultado es un gel que se polimeriza. Éste genera un enlace fuerte a la base, tiene una acción impermeable, nula acción capilar bloqueando la filtración, sin embargo, no es biodegradable. Ahorros: Reducción en el consumo de agua Eliminación de la necesidad de importar agregados Reducción de la mano de obra para instalación y del tiempo de maquinaria Costos 89 Se calcula que su aplicación por kilómetro lineal requiere de al menos 25 tambores del producto, cuyo costo es de: Tambores de 208 litros (55 galones) al 100% de Concentración $ 3500.00 US. Presentación del producto Top-Shield : Tambores de 208 litros (55 Galones)………………………………. $ 1750.00 US. Industria turística Respecto a la industria turística, ésta representa una de las fuentes más importantes de divisas y es receptora de una fracción primordial de la inversión extranjera directa que se realiza en nuestro país, por lo que tiene un valor estratégico para la economía nacional (Cuadro V.1). Cuadro V.1. Datos comparativos de la capacidad hotelera y de los ingresos por actividades turísticas de los cuatro principales destinos de Quintana Roo. Destino No. de hoteles No. de habitaciones Ingresos Enero-Marzo Ingresos Anualizados Cancún Riviera Maya Cozumel Isla Mujeres 146 354 52 52 27,750 24,010 3,800 1,070 572.23 417.6 154.96 15.65 2288.92 1670.4 619.84 62.6 Total* 772 60,459 1,160 4,642 Fuente: Secretaria de Turismo del estado de Quintana Roo (2005). Nota: Los ingresos se presentan como millones de dólares americanos. Es importante señalar que la gran mayoría de la infraestructura hotelera que se localiza directamente sobre la franja costera (Figuras V.5, a y b), presenta una alta vulnerabilidad durante la temporada de tormentas y huracanes. 90 Figura V.5, a. Industria hotelera en Cancún. Fuente: http://topofertas.com/externo/mapas/rivieramaya/cancun_hotelzone.jpg 91 Figura V.5, b. Corredor turístico Riviera Maya en Quintana Roo Fuente: http://www.cancunhoteles-mx.com/MapasMexicoCancun/ 92 VI. NECESIDADES Y RECOMENDACIONES Una de las principales tareas en el desarrollo de capacidades de adaptación de cambio climático es la generación de conocimiento para la correcta toma de decisiones. En el caso de las Zonas Costeras Mexicanas, resalta la urgencia de la información climática y en particular los pronósticos de clima para diseñar adecuadamente las políticas enfocadas a la adaptación al cambio climático. En este sentido, es necesario contar con: Series de información de tiempo largo, sobre todo en cuanto al comportamiento de las mareas. La medición de los flujos de agua de los ríos y su capacidad hidrodinámica. Mediciones de calidad del agua en lagunas, estuarios y ríos. Mediciones continuas y a largo plazo, de la presencia y niveles de contaminantes que alteren y disminuyan la capacidad de resiliencia de los ecosistemas costeros. Observación continua de los hidroperíodos en las zonas costeras bajas, ya que algunos ecosistemas como los humedales y el manglar dependen directamente de él. Identificación de la infraestructura hidráulica existente (represas, bordos, canales de derivación, obras de contención, etc). Financiamiento para la promoción de estudios de vulnerabilidad costera en toda la zona marítima mexicana. Promover la colaboración de equipos y proyectos multidisciplinarios e interinstitucionales para el desarrollo de estudios integrales. Identificación de asentamientos humanos irregulares y los requerimientos para su posible desalojo y reubicación. Adaptación y/o desarrollo de software especifico para estudios de eventos hidrometeorológicos extremos. Elaboración de planes de contingencia por eventos hidrometeorológicos extraordinarios a corto, mediano y largo plazo. Implementación de políticas, públicas y privadas, para la adaptación ante los efectos del cambio climático. Se debe efectuar un trabajo detallado de las causas locales de erosión como es la actividad turística, obras civiles como espigones, muelles, hoteles, factores biológicos, como el papel que juegan los arrecifes y la presencia de manglar, entre otros factores. Es necesario generar información básica actualizada: topografía, batimetría, cartografía refinada donde se aprecien curvas de nivel, actividades y uso de las cuencas hidrográficas por sector (agrícola, industrial, turístico, etc). Incremento de puntos de medición y control de la información. Generación de bases de datos disponibles en red o bien manejadas por los sectores correspondientes (CONAGUA, INE, SEMARNAT, INEGI, etc); existen infinidad de estudios que se han realizado por diferentes instituciones públicas, privadas, universidades, centros de investigación y organizaciones no gubernamentales, la información no siempre es accesible y se encuentra dispersa. Se sugiere contar también con registros o base de datos hidrológicos (gastos mensuales o por temporada) de las cuencas fluviales costeras para calcular cuando se presentarían los mayores aportes de nutrientes, mezcla y alcance de la cuña salina (balance de materiales), así como para determinar el tiempo de residencia. Dado el escaso número de registros sobre la fisicoquímica del agua (salinidad, oxígeno disuelto, nitrógeno total, fósforo total, clorofila, coliformes o específicamente enterococos) así como de la falta de un programa continuo de monitoreo en las lagunas costeras y estuarios de las costas de México, se requiere que las instancias gubernamentales realicen muestreos por lo menos en las diferentes temporadas del año (secas, lluvias y la de Nortes, huracanes o tormentas tropicales); y se propone como parámetro adicional sólidos suspendidos o sedimentos. En virtud de que se eligieron aquellas regiones del Pacífico y del Golfo de México93 Mar Caribe como las más vulnerables por los cambios hidrológicos, geomorfológicos y sociales que han experimentado, se recomienda se aboquen a efectuar los monitoreos necesarios para alimentar una base de datos suficiente y corroborar los índices de vulnerabilidad. Los resultados aquí obtenidos podrían ser la base metodológica para aplicarse a otras áreas costeras de México, también vulnerables, siempre y cuando se tenga una base de datos fisicoquímicos del agua. Llevar a cabo un programa de vulnerabilidad de la zona costera por fenómenos hidrometeorológicos extremos y cambios del nivel del mar, que contemple un monitoreo nacional permanente, que permita identificar los cambios en la zona litoral, para proponer las medidas de adaptación pertinentes. Conocer la dinámica de los sitios de erosión-depósito y evaluar el efecto de los huracanes, nivel del mar (cambio climático global) y de los efectos antropogénicos que permitan evaluar las causas principales de erosión y tomar las medidas de adaptación necesarias. Dado el escaso número de registros sobre la fisicoquímica del agua (salinidad, oxígeno disuelto, nitrógeno total, fósforo total, clorofila, coliformes o específicamente enterococos ) así como de la falta de un programa continuo de monitoreo en las lagunas costeras y estuarios de las costas de México, se requiere que las instancias gubernamentales realicen muestreos por lo menos en las diferentes temporadas del año (secas, lluvias y Nortes, huracanes o tormentas tropicales); y se propone como parámetro adicional sólidos suspendidos o sedimentos. En virtud de que en la presente sección se eligieron aquellas regiones del Pacífico y del Golfo de México-Mar Caribe como las más vulnerables por los cambios hidrológicos, geomorfológicos y sociales que han experimentado, se recomienda se aboquen a efectuar los monitoreos necesarios para alimentar una base de datos suficiente y corroborar los índices de vulnerabilidad. Los resultados aquí obtenidos podrían ser la base metodológica para aplicarse a otras áreas costeras de México, también vulnerables, siempre y cuando se tenga una base de datos fisicoquímicos del agua aquí empleados. Se sugiere contar también con registros o base de datos hidrológicos (gastos mensuales o por temporada) de las cuencas fluviales costeras para calcular cuando se presentarían los mayores aportes de nutrientes, mezcla y alcance de la cuña salina (balance de materiales), así como para determinar el tiempo de residencia, especialmente las áreas agrícolas adyacentes a los sistemas costeros, en afluentes fluviales o aguas cuencas arriba. Se recomienda incluir en las investigaciones sobre pastos marinos, estudios de otras variables como la turbidez, corrientes, ciclos de reproducción y reclutamiento de las especies, análisis de contaminantes en el sedimento y en la planta misma, entre otros, con el fin de obtener mayor información del estado fisiológico y ambiental de los pastos marinos. La información obtenida constituye la base fundamental del reconocimiento de indicadores de estado ambiental para este ecosistema, siendo posible a futuro identificar áreas específicas para implementación de planes de monitoreo, con fines de conservación y sustentabilidad. Se recomienda ampliar estudios de conservación de tortugas marinas en sitios prioritarios y continuar investigando sobre el papel que juegan los procesos erosivos costeros en el éxito de la anidación de éstas, así como monitorear permanentemente la dinámica de las playas de anidación, para evaluar si se encuentran en erosión y poder definir medidas de adaptación. Realizar perfiles geomorfológicos de dos o más Km. de longitud, donde se ubiquen estos rasgos así como los litológicos. Lo anterior para conocer si la nueva condición de erosión afectará al nuevo sitio de la línea de costa y la capacidad para el nuevo desarrollo de playas en la zona erosionada. Realizar durante los estudios de caracterización de sitios de anidación, trincheras de exploración de dos a tres metros de profundidad (o hasta la cota cero del nivel medio del mar), con la finalidad de conocer la condición sedimentaria tierra adentro y constatar si existe capacidad de generación de nuevas playas en los sitios erosionados. El desarrollo de centros urbanos así como el turístico en la zona litoral, hacen necesario realizar este tipo de investigaciones, a fin de contar con la información actualizada sobre los procesos de erosión-depósito presentes en la línea de costa, los cuales permitan la correcta 94 toma de decisiones sobre el uso y manejo adecuado de la zona costera y determinar la vulnerabilidad de ésta por el cambio global climático, que comprende elevación del mar, frecuencia e intensidad de huracanes y nortes. Evaluación del grado de aplicación del Código de Conducta para la Pesca Responsable y el enfoque precautorio, e implementar medidas y prácticas para orientar la pesca y acuicultura hacia la sustentabilidad. Realizar un seguimiento permanente sobre el estado de los ecosistemas de interés pesquero y acuícola, para su evaluación y toma de decisiones. La investigación debe ser el eje rector para la planeación y elaboración de estrategias, con el fin de luchar contra el cambio climático y sus efectos, por lo que se debe asignar mayor presupuesto para investigación y desarrollo tecnológico. La investigación se debe orientar hacia un enfoque ecosistémico para el manejo de las diversas pesquerías multiespecíficas de pequeña escala, ya que en la captura monoespecífica no se considera al ecosistema, por lo que este tipo de pesca daña al ecosistema y a los recursos objetivo. Se debe abordar el estudio de las pesquerías de forma integral, y enfocarse al manejo de sistemas complejos y su resiliencia: “La conservación de las pesquerías sólo es posible a través de una comprensión integrada entre los stocks pesqueros y las sociedades que los explotan” (Castelló, et al., 2007). El diseño e implementación de las medidas de protección requerirá la utilización de series de información básica detallada, como la caracterización geológica, geomorfológico, morfodinámica, geotécnica y sobretodo oceanográfica (nivel de mareas, corrientes superficiales, oleaje, batimetría). Para obtener esta información es necesario que se implementen programas científicos para la caracterización detallada de los litorales nacionales y el seguimiento de la evolución de los sistemas costeros. Se debe incluir instancias para el seguimiento y medición de la intrusión de la cuña salina, comportamiento de los niveles freáticos, salinización de suelos y de acuíferos, cambios ecológicos, estabilidad de cauces y modificación de los niveles de inundación, entre otros aspectos. Desarrollo de Centros Regionales que diseñen y ejecuten programas de investigación y sobre el seguimiento de la dinámica litoral y la medición de las tasas locales de retroceso de la línea de costa a nivel nacional. Incentivar programas de investigación científica de los humedales costeros, manglares, pantanos y ecosistemas críticos, para conocer mejor el funcionamiento y la dinámica con el propósito de lograr su recuperación y aumentar su productividad. Creación de programas científicos y de investigación para realizar el seguimiento y monitoreo de los efectos que se presentarán en los deltas y los litorales por el ascenso del nivel del mar. Realizar el modelamiento hidráulico y dinámico de los deltas de los principales ríos a nivel nacional, para evaluar los impactos que se presentarán por el aumento de las inundaciones y los nuevos patrones de sedimentación debidos al ascenso del nivel del mar. Necesidades de información Topográfica y batimétrica. Cartografía refinada donde se aprecien curvas de nivel a 30 cm. Actividades y uso de las cuencas hidrográficas por sector (agrícola, industrial, turístico, etc) Instrumentación de las zonas, falta de mediciones regulares permanentes. Incremento de puntos de medición y control de la información Generación de bases de datos disponibles en red o bien manejadas por los sectores correspondientes (CONAGUA, INE, SEMARNAT, INEGI, etc); existen infinidad de estudios que se han realizado por diferentes instituciones públicas, privadas, universidades, centros de 95 investigación y organizaciones no gubernamentales, la información no siempre es accesible y se encuentra dispersa Ordenamiento territorial costero, falta del seguimiento y organización; de igual forma que en el punto anterior existen infinidad de estudios que se han realizado por diferentes instituciones públicas, privadas, universidades, centros de investigación y organizaciones no gubernamentales, la información no siempre es accesible y se encuentra dispersa Aplicación de la legislación ambiental costera correspondiente Identificación de la infraestructura hidráulica existente (represas, bordos, canales de derivación, obras de contención, etc). Estudios por realizar Financiamiento para la promoción de estudios de vulnerabilidad costera en toda la zona marítima mexicana. Promover la colaboración de equipos y proyectos multidisciplinarios e interinstitucionales para el desarrollo de estudios integrales. Identificación de asentamientos humanos irregulares y los requerimientos para su posible desalojo y reubicación Adaptación y/o desarrollo de software especifico para estudios de eventos hidrometeorológicos extremos Elaboración de planes de contingencia por eventos hidrometeorológicos extraordinarios a corto, mediano y largo plazo Implementación de políticas, públicas y privadas, para la adaptación ante los efectos del cambio climáticos. En la riviera maya es necesario llevar un monitoreo permanente a detalle de la dinámica de los sitios de erosión-deposito y evaluar el efecto de los huracanes, nivel del mar (cambio global climático) y de los efectos antropogénicos, que permitan evaluar las causas principales de erosión y tomar las medidas de adaptación necesarias. Se recomienda que para conservar una playa, se tome en cuenta la existencia de una fuente continua de sedimentos, un transporte litoral sin interrupciones y la protección de las playas a los fenómenos hidrometeorológicos extremos. No se ha realizado un levantamiento a detalle de la línea de costa ni de la topografía con resolución altimétrica de centímetros. Se propone un levantamiento regional mediante LIDAR, técnica muy adecuada para la fisiografía de la región, con abundantes humedales y baja topografía. Actualizar el modelo de elevación del nivel del mar en el estado de Campeche acorde al levantamiento altimétrico anterior. Realizar estudios de dinámica costera específicos en cada localidad vulnerable de importancia social, económica y de infraestructura, tales como: Ciudad del Carmen, Champotón, Isla Aguada, Nitrogenoducto y planta Atasta. Sólo a partir del estudio de cada caso se podrán emitir las recomendaciones de prevención y/o protección o abandono de sitios. Realizar un levantamiento con radar de apertura sintética en la modalidad de interferometría (InSar) para conocer si existen hundimientos, levantamientos o basculamiento del terreno, y de esta manera conocer el efecto de la subsidencia en el balance neto de elevación del nivel del mar. Fortalecimiento Incrementar sustancialmente los apoyos financieros a la investigación social relacionada con el cambio climático y eventos hidrometeorológicos extremos en el Golfo de México, Mar Caribe y Océano Pacífico. 96 Analizar la problemática social que enfrentan los pueblos indios en las sierras donde nacen las cuencas hidrológicas del Golfo de México. Considerar a las cuencas fluviales altas en la realización de planes de manejo costero o marinos. Realizar una investigación sobre el Capital Social del estado de Tabasco. Fortalecer y dar seguimiento del más alto nivel académico a las comunidades animales y vegetales de la Reserva de la Biosfera Pantanos de Centla, sometida a una intensa presión por la industria petrolera y la ganadería, con la finalidad de proponer y aplicar las medidas adecuadas de adaptación ante los eventos de cambio climático. Efectuar en los sistemas lagunares costeros (Carmen-Pajonal-Machona-Redonda, Mecoacán, Julivá-Santa Anita) investigaciones encaminadas a la realización de una acuacultura sostenible. Planificación de las nuevas instalaciones petroleras en la zona costera de Tabasco considerando escenarios de cambio climático. Realizar los estudios hidrometeorológicos de los ríos Usumacinta, Tonalá, Seco y Mezcalapa ante los escenarios del cambio climático. Promover la participación multidisciplinaría para la construcción y aprobación del Plan hidráulico del estado de Tabasco. Fortalecer la implementación de proyectos productivos. Actualizar los Programas de Ordenamiento Territorial en las localidades urbanas de la entidad, a fin de que incorporen los resultados de la investigación científica en la planificación de las áreas de crecimiento urbano y relocalicen a las poblaciones que se encuentran amenazadas por los probables impactos del cambio climático. 97 VII. BIBLIOGRAFÍA Aguilar, A. G. 2003. Los asentamientos humanos y el cambio climático en México un escenario futuro de vulnerabilidad regional. Gay, C. (Ed). México: una visión hacia el Siglo XXI. El cambio climático en México. UNAM. Disponible en http://www.atmosfera.unam.mx/ cambio/libro.html Aguilar, G. R. 1995. México ante cambio climático. Segundo Taller de Estudio de País, México. In SEMARNAP-UNAMUS Country Studies. México ante cambio climático. Segundo Taller de Estudio de País, México. Aguirre, G. R. 2004. La observación de impactos en el Golfo de México mediante imágenes de satélite. pp. 833-898. Caso-Chávez, M., Pisanty I. y E. Ezcurra., (Eds). Diagnostico Ambiental del Golfo de México. México: INE – SEMARNAT, Instituto de Ecologia, A. C., Hearteresearch Institute for Gulf of Mexico Studies. Ainsworth, TD, E.C. Kvennefors, L. Blackall, M. Fine y O. Hoegh-Guldberg. 2007. Disease and cell death in White Syndrome of Acroporid corals on the Great Barrier Reef. Mar Biol 151:19–29. Aldana, A.D. 2004. Diagnostico de los bancos ostrícolas del estado de Tabasco para su uso racional y sustentable. Disponible en http://www.alfinal.com/Mexico/ostintabasco.shtml Alley, R.B., J. Marotzke, W.D. Nordhaus, J.T. Overpeck, D.M. Peteet, R.A. Pielke Jr., R.T. Pierrehumbert, P.B. Rhines, T.F. Stocker, L.D. Talley, y J.M. Wallace. 2003. Abrupt climate change. Science. 299 (5615), 2005-2010. Alonso, D. A., M. P. Vides y M. Londoño. 2001. Amenazas y riesgos ambientales en las zonas costeras colombianas. En: Informe del Estado de los Ambientes Marinos y Costeros en Colombia. Instituto de Investigaciones Marinas y Costeras–INVEMAR. Colombia. Álvarez M. Jr. 1961. Provincias Fisiográficas de la República Mexicana. Bol. Soc. Geol. Mexicana. 24 (2): 1-21. Amthor, J.S. 1995. Terrestrial higher-plant response to increasing atmospheric (CO2) in relation to the global carbon cycle. Global Change Biol. 1, 243-274. ANIDE .2005. Metodología para la determinación de erosión costera. Informe UO-IT-01, 120 pp. Cuernavaca, Morelos (Citado con autorización del propietario de la tecnología). Anthony, K.R.N., D.I. Kline, G. Diaz-Pulido, S. Dove y O. Hoegh-Guldberg. 2008. Ocean acidification causes bleaching and productivity loss in coral reef builders. Proceedings of the National Academy of Sciences [USA] 105(45): 1744217446. Arcos, D.F., L.A. Cubillos y S.P. Núñez. 2001. The jack mackerel fishery and El Niño 1997–98 effects of Chile. Progress in Oceanography. 49(1-4), pp. 597-617. Arellano, L.U. 2004. Análisis Espacio-Temporal de las variables Hidrológicas: Detección de Heterogeneidad a Gran Escala Temporal. Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional (CINVESTAVIPN). Tesis de Maestría, Unidad Mérida, Yucatán, México. Arntz, W. E. y J. Tarrazona. 1990. Effects of El Niño 1982-83 on benthos, fish and fisheries off the South American Pacific Coast. Elsevier Oceanography Series. 52, pp. 323-360. Aronson, R. B., W. F. Precht y I. G. MacIntyre. 1998. Extrinsic control of species replacement on a Holocene reef in Belize: the role of coral disease. Coral Reefs. 17:223-230. Arreguín, F., M. Ramírez-Rodríguez, M.J. Zetina-Rejón y V.H. Cruz-Escalona. 2008. Natural hazards, stock depletion and management in the southern Gulf of Mexico pink shrimp fishery. Am. Fish. So. Symp. 64: pp. 419-428. Arzola, F. y J. Armenta. 1994. Análisis comparativo de los factores ambientales en nidos naturales y nidos trasladados y su efecto en crías de tortuga golfina, Lepidochelys olivacea en la playa El Verde, Mazatlán, Sinaloa, durante la temporada 1992-1993. Tesis de Biología, Instituto Tecnológico de Los Mochis, México, 72 pp. Averza, A.A. y L.R. Almodovar, 1986. Halodule wrightii Aschers (marine phanerogamous, potamogetonaceae), in the Cueva Island, Puerto Rico part 3. Science. 13, 21-32. Avilés, Q.A. y F.O. Castelló. 2004. Manual para el cultivo de Seriola lalandi (Pisces: Carangidae) en Baja California Sur, México. Instituto Nacional de Pesca. SAGARPA. México, D.F. Ayala-Castañares, A. 1963. Sistemática y distribución de los foraminíferos recientes de la Laguna de Términos, Campeche, México. Bol. Inst. Geol. Univ. Nal. Auton. México. 67(3):1-130. Balvanera, P. y H. Cotler. 2007. Acercamiento al estudio de los servicios ecosistémicos. INE-SEMARNAT. Gaceta Ecológica. 84-85: pp. 8-15. Banin, E.I.T., A. Kushmaro, Y. Loya, E. Orr y E. Rosenberg. 2000. Penetration of the Coral-Bleaching Bacterium Vibrio shiloi into Oculina patagonica. Applied and Environmental Microbiology. 66(7): 3031-3036. Barba-Macías, E., J. Rangel-Mendoza y R. Ramos-Reyes. 2006. Clasificación de los humedales de Tabasco mediante sistemas de información geográfica. Universidad y Ciencias. 22 (2):101-110. Bates, B.C., Z.W. Kundzewicz, S. Wu y J.P. Palutikof, Eds., 2008: El Cambio Climático y el Agua. Documento técnico del Grupo Intergubernamental de Expertos sobre el Cambio Climático, Secretaría del IPCC, Ginebra, 224 págs. Bay, D. 1984. A field study of the growth dynamics and productivity of Posidonia oceanica in Calvi Bay, Corsica, France. Aquat. Bot. 20, 43-64. 98 Bayo García, N., E. Chicharro-Fernández y A. Gálvez-Martín. 1995. Aspectos teóricos en la medición de los impactos en el medio social de los residuos tóxicos y peligrosos, Serie Geografía. 5, pp. 69-96. Bechtel, T.J. y B.J. Copeland. 1970. Fish species diversity indices as indicators of pollution in Galveston Bay, Texas. Contributions in Marine Science. 15: pp. 103-132. Bello, J., M. A. Liceaga-Correa, H. Hernández-Núñez y R. Ponce-Hernández. 2005. Using aerial video to train the supervised classification of landsat TM imagery for coral reef habitats mapping. Environmental Monitoring and Assessment. 105:145-164. Bello, J. 1998, Sistema de clasificación para los tipos de fondo del arrecife Alacranes compatible con una imagen Landsat TM, CINVESTAV-IPN, Mérida, México. Ben-Haim, Y, E. Banim, A. Kushmaro, Y. Loya y E. Rosenberg. 1999. Inhibition of Photosynthesis and Bleaching of Zooxanthellae by the Coral Pathogen Vibrio Shiloi. Environ. Microbiol. 1 (3): 223-229 Ben-Haim, Y., E.Banin, A.Kushmaro, Y. Loya y E. Rosenberg. 1999. Inhibition of photosynthesis and bleaching of zooxanthellae by the coral Vibrio shiloi. Environ. Microbiol. 1:223-229. Bindoff, N.L., J. Willebrand, V. Artale, A. Cazenave, J. Gregory, S. Gulev, K. Hanawa, Le Quéré, S. Levitus, Y. Nojiri, C.K. Shum, L.D. Talley, y A. Unnikrishnan, 2007. Observations: oceanic climate change and sea level. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate [Solomon, S., D. Qin, M. Manning, Z. Chen, M. Marquis, K.B. Avery, M. Tignor, and H.L. Miller eds.)]. Cambridge University Press, Cambridge, UK and New York, pp. 385-432. Binet, D., B. Gobert y L. Maloueki. 2001. El Niño-like warm events in the Eastern Atlantic (6°N, 20°S) and fish availability from Congo to Angola (1964-1999). Aquatic Living Resources. 14(2), March-April, pp. 99-113. Birch, W.R., M. Birch. 1984. Succession and pattern of tropical intertidal seagrasses in Cockle Bay, Queensland Australia: A decade of observations. Aquat. Bot. 19, 343-367. Blake, E.S., E. N. Rappaport y C.W. Landsea. 2007. The deadliest, costliest and most intense United States tropical cyclones from 1851 to 2006 (and other frequently requested hurricane facts), NOAA Technical Memorandum NWS TPC-5, 43p. Blanchon, P. y J. Shaw. 1995. Reef drowning during the last deglaciation: Evidence for catastrophic sea-level rise and icesheet collapse. Geology. 23: 4-8. Blanco, J.A., J.C. Narváez-Barandica y E.A. Viloria. 2007. ENSO and the rise and fall of a tilapia fishery in northern Colombia. Fisheries Research. 88(1-3) pp. 100-108. Bograd, S. J. y R. J. Lynn. 2003. Long-term variability in the Southern California Current System. Deep Sea Research Part II: Tropical Studies in Oceanography. 50(14-16). pp. 2355-2370 Bojorquez, F. 2007. Manifestacion De Impacto Ambiental Modalidad Particular. Proyecto: “Departamentos Habitacionales Mar Y Viento” Lote 06, MZA 01, SM 02, Región 02, Calle Gral. Lázaro Cárdenas, Localidad de Puerto Morelos, Municipio de Benito Juárez, Estado de Quintana Roo. Bojórquez, L. A., E. Escurra y O. García. 1998. Appraisal of environmental impacts and mitigation measures through mathematical matrices. Journal of Environmental Management. 53: 91-99. Bojórquez, L.A. 1989. Methodology for prediction of ecological impacts under real conditions in Mexico. Environmental Management. 13(5):545–551. Botello, A. V., G. Díaz, F. S. Villanueva y S. L. Salazar. 1993. Presence of PAH’s in coastal enviroments of the south-east Gulf of México. Polycyclic Aromatic Compounds. 3 Suppl. 397-404. Botello, A.V., C. González y G. Díaz. 1991. Pollution by petroleum hydrocarbons in sediments from continental shelf of Tabasco, State, Mexico. Bulletin of Environmental, Contamination and Toxicology. 47:565-571. Bozada, L. M. 2001. Diagnostico socioambiental y pesquero en la zona de Cinco Presidentes y los Sistemas Lagunares Interiores: Estancia Vieja, el Pueblo, Del Padre (Tabasco); Santuario y Limón (Chiapas). Informe final al Instituto de Ciencias del Mar y Limnología, UNAM, México. Bozada, L. M. 1998. El Desarrollo pesquero y acuícola del estado de Tabasco. Informe final a la Asociación Ecológica Santo Tomas, A.C., Villahermosa, Tabasco, México. Bozada y Páez, 1986. La fauna acuática del río Coatzacoalcos. Serie medio ambiente en Coatzacoalcos. México. Universidad Veracruzana.131 pp. Broecker, W.S. y R. Kunzig. 2008. Fixing Climate: What Past Climate Changes Reveal about the Current Threat and How to Counter It. Hill and Wang, New York, 253 pp. Bruke, L. y J. Maidens. 2004. Reefs at risk in the Caribbean World Resources Institute. Washington D.C., USA: 80p. Bruno, J.F., L. Petes, C.D. Harvell y A. Hettinger. 2003. Nutrient enrichment can increase the severity of two Caribbean coral diseases. Ecology Letters 6:1,056–1,061. Bruun, P. 1962. Sea-level rise as a cause of shore erosion. ASCE J. Waterways and Harb. Div. 88. 117-130. Bulthuis, D.A. 1987. Effects of temperature on photosynthesis and growth of seagrasses. Aquat. Bot. 27, 27-40. Butler, D.R., G. P. Malanson, y J. G. Oelfke. 1991. Potential catastrophic flooding from landslide dammed lakes, Glacier National Park, Montana, USA. Z. Geomorphol. 83(suppl.):195-209. 99 Bythell J. y C. Sheppard. 1993. Mass Mortality of Caribbean Shallow Corals. Mar Pollut Bull. 26:296–297. Calderón, L.E., H. Reyes-Bonilla y J.D. Carriquiry. 2007, El papel de los arrecifes coralinos en el flujo de carbono en el océano: estudio en el Pacífico mexicano. En: Carbono en ecosistemas acuáticos de México. Hernández-de la Torre, B. y G. Gaxiola-Castro Ed. INE/SEMARNAT. 508 p. Cambio Climático 1992 — Informe suplementario a la evaluación científica del IPCC. Informe de 1992 del Grupo de trabajo sobre Evaluación Científica del IPCC. Cambio Climático 1992 — Informe suplementario a la evaluación de los impactos del IPCC. Informe de 1990 del Grupo de trabajo sobre Evaluación de los impactos del IPCC. Cambio Climático: evaluaciones de 1990 y 1992 del IPCC— Primer informe de evaluación del IPCC – Resumen general y resúmenes para responsables de políticas y suplemento del IPCC de 1992. Cambridge, M.L.,A.W. Chiffings, C. Brittan, L. Moore y A. J. McComb. 1986. The loss of seagrass in Cockburn Sound, Western Australia. II. Possible causes of seagrass decline. Aquat. Bot. 24, 269-285. Canada's National Programme of Action (CNPA) (2000). http://www.cc.gc.ca/marine/npa-pan/sum_e.htm Canziani O. y S. Díaz. 2000. Impactos regionales del cambio climático: evaluación de la vulnerabilidad. Capitulo 6: América latina. Grupo Intergubernamental de Expertos sobre el Cambio Climático. Carbajal, D.J.A. 2008. Efectos del calentamiento global en el estado de Tabasco: el incremento del nivel del mar. Disponible en: adriancarbajal.no-ip.org/inundacion/reporte.pdf Carbajal, D.J.A. 2007. Efectos del calentamiento global en el Golfo de México: incremento del nivel del mar. Disponible en: adriancarbajal.no-ip.org/inundacion/reportegolfo.pdf Carranza, A., L. Rosales-Hoz, M. Caso Chávez y E. Morales de la Garza. 2004. La geología ambiental de la zona litoral. pp 1043-1082. Caso-Chávez, M., I. Pisanty, y E. Ezcurra (Eds). Diagnostico Ambiental del Golfo de México. Mexico: INE –SEMARNAT, Instituto de Ecología, A. C., Hearteresearch Institute for Gulf of Mexico Studies. Carranza, A. 2001. Grain Size Sorting in Modern Beach Sands. Journal of Coastal Research. 17 (1): 38-52. Carranza, A., M. Gutierrez-Estrada y R. Rodríguez-Torres. 1973. Unidades morfotectónicas continentales de las costas mexicanas. An. Centro Cienc. del Mar y Limnol. Univ. Nal. Autón. México. 2 (1):81-88. Casco, R. 2004. La Zona Costera de México: Definición. Pp 1-4 .Rivera Arriaga, E., G. J. Villalobos, I. Azuz Adeath, y F. Rosado May (Eds.). El Manejo Costero en México. Universidad Autónoma de Campeche, SEMARNAT, CETYSUniversidad, Universidad de Quintana Roo. Castro, J.L., H.S. Espinosa Pérez y J. J. Schmitter-Soto. 1999. Ictiofauna estuarino-lagunar y vicaria de México. Serie Biotecnologías. IPN y Ed. Noriega-Limusa, 711 p. Centro GEO, QuercuS, Natura y Ecosistemas Mexicanos, A.C., Conservación Internacional México, A.C., USAID/ United States Embassy, Conservación Internacional México, A.C., COFOSECH, CONANP, CNA (2008). Programa para el Manejo de la Cuenca del Río Usumacinta para el Desarrollo Económico con Sustentabilidad Ambiental. Versión [CD-ROOM]. México. Cepal, Secretaria de Gobernación, Gobierno del Estado de Tabasco, Cenapred (2008). Tabasco: Características e Impacto Socioeconómico de las Inundaciones Provocadas a finales de Octubre y a comienzos de Noviembre de 2007 Por El Frente Frío Número 4. Versión [CD-ROOM]. México. Cervantes, D. 1984. Improvements of coastal Lagoons: some examples of Mexico. pp 695-708.In: Kapetsky, J.M. and/ et G. Lasserre (Eds). Managament of Coastal Lagoon Fisheries. Stud. Rev. GFCM 61 (2):439-776. Cervino, J.M, R.L. Hayes, S.W. Polson, S.C. Polson, T.J. Goreau, R.J. Martinez y G. W. Smith. 2004. Relationship of Vibrio Species Infection and Elevated Temperatures to Yellow Blotch/Band Disease in Caribbean Corals. Applied and Environmental Microbiology. 70(11): 6855-6864. Cervino, J.M., F.L.Thompson, B. Gomez-Gil, E.A. Lorence, T.J. Goreau, R.L Hayes, K.B. Winiarski-Cervino, G.W. Smith, K. Hughen, K. y E. Bartels. 1998. The Vibrio core group induces yellow band disease in Caribbean and IndoPacific reef-building corals. Journal of Applied Microbiology. 105 (5):1658-1671. Chang, I. 2005. Indicadores de Vulnerabilidad y Desastres para América Latina Producto 3: Resumen Ejecutivo e Informe Final. Disponible en: http://www.disasterinfo.net/lideres/spanish/panama2005/presentaciones/facilitadores/isaias_chang_urriola/informefin alconsindvd/informe_final_y_resumen_ejecutivo.doc Chardon, A.C. y J.L. González- Manizalez. 2002. Indicadores para la Gestión de Riesgos. Programa de Información e Indicadores de Gestión de Riesgo. BID, Univ. Nac. de Colombia-sede Manizales, CEPAL, IDEA. Chávez, J.U. 2007. Potonchán y Santa María de La Victoria: Una Propuesta Geomorfológico/Arqueológica. A Un Problema Histórico. Estudios de Cultura Maya. 29:103-139. Christensen, N., A.M. Bartuska, J.H. Brown, S. Carpenter, C. D'Antonio, R. Francis, J. F. Franklin, J.A. MacMahon, R.F. Noss, D.J. Parsons, C.H. Peterson, M.G. Turner, y R.G. Woodmansee. 1996. The report of the Ecological Society of America committee on the scientific basis for ecosystem management. Ecological Applications. 6:665-691. Church, J.A. y N.J. White. 2006. A 20th century acceleration in global sea-level rise, Geophys. Res. Lett., 33, L01602, doi:10.1029/2005GL024826. 100 Church, J.A., J.M. Gregory, P. Huybrechts, M. Kuhn, K. Lambeck, M.T. Nhuan, D. Qin y P.L. Woodworth. 2001. Changes in sea level. pp.639-693. In: Climate Change 2001: The Scientific Basis, J. T. Houghton, Y. Ding, D. J. Griggs, M. Noguer, P. J. van der Linden, X. Dai, K. Maskell and C. A. Johnson (eds.), Contribution of Working Group I to the Third Assessment Report of the Intergovernmental Panel on Climate Change, Cambridge University Press, Cambridge, UK. Clarke, S.M. y H. Kirkman. 1989. Seagrass dynamics. In: Larkum, A.W.D., McComb, A.J., Shepherd, S.A. (Eds.), Biology of Seagrasses. Elsevier, Amsterdam, pp. 304-345. Comisión Europea. 2007. Pesca y acuicultura en Europa. Cambio climático: ¿qué impacto tiene en la pesca? Dirección General de Pesca y Asuntos Marinos. No. 35. Agosto. 12 p. Comisión Nacional del Agua, 2003. Programa Hidráulico Regional 2002-2006. Región X Golfo Centro. México Comisión Nacional del Agua, 2003. Programa Hidráulico Regional 2002-2006. Región VI Río Bravo. México CONANP. Comisión Nacional de Áreas Naturales Protegidas. Disponible en: www.conap.gob.mx CONANP, 2009. Disponible en: http://www.conap.gob.mx/q_anp.html CONAPESCA/SAGARPA. 2005. Anuario estadístico de acuacultura y pesca. Disponible en: http://www.conapesca.sagarpa.gob.mx/wb/cona/cona_produccion_pesquera_y_acuicola_2005 CONAPESCA/SAGARPA. 2005. Anuario estadístico de acuacultura y pesca. CONAPO. 2005. Índice de marginación 2005. Disponible en: http:www.conapo.gob.mx/publicaciones/margina2005/AnexoC.pdf Conde, A.C.(sin año). Vulnerabilidad y adaptación al cambio climático: descripción de un estudio de caso y los retos en las investigaciones actuales. Centro de Ciencias de la Atmósfera, UNAM. pp 157 – 171. CONEVAL (2007a). Los mapas de Pobreza en México. Anexo técnico metodológico. Disponible en: http://www.coneval.gob.mx CONEVAL (2007b). Los mapas de Pobreza en México. Disponible en: http://www.coneval.gob.mx CONEVAL (2007c). Validación estadística de las estimaciones de la incidencia de pobreza estatal y municipal por niveles de ingreso. Disponible en: http://www.coneval.gob.mx CONEVAL (2007d). Mapas de Pobreza por Ingresos y Rezago Social 2005. Disponible en: http://www.coneval.gob.mx/coneval2/htmls/publicaciones/HomePublicaciones.jsp?id=mapas_de_pobreza_2007 CONEVAL (2008e). Informe de Evaluación de la Política de Desarrollo Social en México 2008. Disponible en: http://www.coneval.gob.mx/coneval2/htmls/publicaciones/HomePublicaciones.jsp?id=mapas_de_pobreza_2007 http://www.conservation.org/Event%20Documents/Economic%20values%20of%20coral%20reefs%20mangroves%2 0seagrass_a%20global%20compilation.pdf Conover, J.T., 1968. The importance of natural diffusion gradients and transport of substrate to benthic marine metabolism. Bot. Mar. 11, 1-19. Conservation International/The Ocean Foundation/ICRI/NOAA/World Resources Institute. Economic Values of Coral Reefs, Mangroves, and Seagrasses. A Global Compilation 2008. Contreras, F. 1985. Las Lagunas Costeras Mexicanas. México: CECODES-SEPESCA. Contribution of Working Group 1 to the Fourth Assessment Report of the Intergovernmental Panel on Climate [Solomon, S., D. Qin, M. Manning, Z. Chen, M. Marquis, K.B. Avery, M. Tignor, and H.L. Miller eds.)]. Cambridge University Press, Cambridge, UK and New York, pp. 385-432. Cooper, T.F., G. De'Ath , K.E. Fabricius y J.M. Lough J.M. 2008. Declining coral calcification in massive Porites in two nearshore regions of the northern Great Barrier Reef. Global Change Biology. 14(3): 529-538. Crowe, V. 2000. Governance of the oceans, Short report in the Wilton Park Conference 586, December 3-5, 1999. Cruz, M.L. y R.E. Morán-Angulo. 2007. Pesca, medio ambiente y sustentabilidad en Sinaloa. Editorial UAS, FACIMAR, 240 p. Cuevas, E., M.A. Liceaga-Correa y M. Garduño-Andrade. 2007. Spatial Characterization of a Foraging Area for Inmature Hawksbill Turtles (Eretmochelys imbricata) in Yucatan, Mexico. Amphibia-Reptilia. 28 (3): 337-346pp. Cuevas, E.A. 2004. “Caracterización espacial y detección de cambio, por el paso del huracán Isidoro, de los hábitats submarinos en el oriente del Estado de Yucatán, México”. Maestría en Biología Marina. CINVESTAV. Cubillos, L. A. y D. F. Arcos. 2002. Recruitment of common sardine (Strangomera bentincki) and anchovy (Engraulis ringens) off central-south Chile in the 1990s and the impact of the 1997-1998 El Niño. Acuatic Living Resources. 15(2), April, pp. 87-94. Cutter, S.L., J. B.Boruff y W. Lynn. 2003. Social vulnerability to Environmental Hazards. Social Science Quarterly. 84(2):242-261. Daily, G.C. 1999. Developing a scientific basis for managing earth’s life support systems conservation ecology. 3(2):14. Disponible en: http://www.consecol.org/vol3/iss2/art14 Daily, G.C. 1997. Nature’s Services. Societal Dependence on Natural Ecosystems. Island Press. Washington, D. C. 392 p. Daszak, P., A.A. Cunningham, y A.D. Hyatt. 2001. Anthropogenic environmental change and the emergence of infectious diseases in wildlife. Acta Tropica 78:103-116. 101 Dawes, C.J.y D.A. Tomasko. 1988. Depth distribution of Thalassia testudinum in two meadows on the west coast of Florida; a difference in effect of light availability. Mar. Ecol. 9, 123-130. Day, J., J. Jacob, Yañez-Arancibia, A., Martínez, A., S. Miranda, Tejeda-Martines, A., C. A. Ochoa y C.M. Welsh. 2008. 2ª Panel Internacional sobre Cambio Climático: La Zona Costera y su Impacto Ecológico, Económico y Social. Disponible en: http://www.inecol.edu.mx/inecol/imagenesvolatiles/cambioclimatico/Conclusiones%202do%20Panel%20Cambio%20Clim%E1tico.pdf Day, J. W., Jr., D.F. Biesch, E.J. Clairain, G.P. Kemp, S.B. Laska, W.J. Mitsch, K. Orth, H. Mashriqui, D.J. Reed, L. Shabman, C.A. Simenstad, B.J. Streever, R.R. Twilley, C.C. Watson, J.T.Wells y D.F. Whigham. 2007. Restoration of the Mississippi Delta: lessons from hurricanes Katrina and Rita. Science. 315(5819), 1679-1684. De’ath, G., J.M. Lough, J. M. y K.E. Fabricius. 2009. Declining Coral Calcification on the Great Barrier Reef. Science 2 323 (5910), 116-119 DOI: 10.1126/science.1165283. De Cock, A.W.A.M. 1981. Influence of temperature and variations in temperature on flowering in Zostera marina under laboratory conditions. Aquat. Bot. 10, 125-132. Den Hartog, C., 1994. Suffocation of a littoral Zostera bed by Enteromorpha radiata. Aquat. Bot. 47, 21-28. De Fontaubert, A.C.; D. R. Downes y R. S. Agardy. 1996. Biodiversity in the Seas. Implementing the Convention on Biological Diversity in Marine and Coastal Habitats. IUCN Environmental Policy and Law Paper No. 32. A marine conservation and development report. 84 p. De la Cruz, J. 1997. Catálogo de los peces marinos de Baja California Sur. IPN, CICIMAR, CONABIO, 346 p. De la Lanza, G., P.S. Hernández, R.I. Penie y R.J.C. Gómez. 2006. Calidad del agua de las playas del municipio de solidaridad. Revista de Medio Ambiente, Turismo y Sustentabilidad: 2(1): 25-43. De la Lanza, G. y S. Gómez Aguirre. 1999. Fisicoquímica del agua y cosecha de fitoplancton en una laguna costera tropical. Ciencia ERGOSUM 6 (2): 147-153. De La Lanza, G., J.J. Salaya-Avila y E. Varsi. 1994. Manejo y aprovechamiento acuícola de lagunas costeras en América Latina y el Caribe. II Taller Regional sobre Lagunas Costeras. México, D.F., 9–12 de febrero 1993. GCP/RLA/102/ITA. FAO/Aquila II. De La Lanza, G. y J. L. García-Calderón. 1991. Sistema lagunar Huizache y Caimanero, Sin. Un estudio socio ambiental, pesquero y acuícola. Hidrobiológica 1(1): 1-35. De la Lanza, G., M. Rodríguez Medina y L. Soto. 1991. Análisis ecológico de los productores primarios en la Laguna de Términos, Campeche, México. Universidad y Ciencia 8 (15): 15-25. Denzer, R. 2005. Generic integration of environmental decision support systems – state-of-the-art. Environmental Modelling & Software 20 (2005) 1217–1223. Dennison, W.C. y R.S. Alberte. 1986. Photoadaptation and growth of Zostera marina (eelgrass) transplants along a depth gradient. J. Exp. Mar. Biol. Ecol. 98, 265-282. Díaz, G., A. Vázquez-Botello y G. Ponce-Vélez (1994). Contaminación por hidrocarburos aromáticos y policíclicos (HAP'S) disueltos en la laguna Mecoacán, Tabasco, México. Hidrobiologica 1y2 (4): 21-27. Díaz, J. 2006. Diagnóstico ecológico de los arrecifes coralinos del Municipio Solidaridad, Quintana Too, México basados en las microalgas arrecifales. Revista de Medio Ambiente, Turismo y Sustentabilidad: 2(1): 89-105. Díaz, M. M. y C.C. Díaz. 2001. El análisis de la vulnerabilidad en la cartografía de riesgos tecnológicos. Algunas cuestiones conceptuales y metodológicas. Departamento de Geografía Universidad de Alcalá. Serie Geográfica 10(2002): 27 – 41. Díaz, S. C., A. Aragón, A. Arreola, Brito L., S. Burrola, Carreón S., A. Cruz, González, P., M. Manzano, Martínez G., G. Padilla y D. Urias. 2008. Análisis de vulnerabilidad del Golfo de California asociado al incremento del nivel medio del Mar. Primera Bienal de la Agenda de Investigaciones del Programa de Ordenamiento ecológico marino del Golfo de California. INE/Semarnat, pp. DOF. Diario Oficial de la Federación. Secretaria de Medio Ambiente y Recursos Naturales. 22 septiembre 2008. Decreto por el que se declara área natural protegida con la categoría de área de protección de flora y fauna, la región conocida como Cañón del Usumacinta, localizada en el Municipio de Tenosique, en el estado de Tabasco. p.17. Domínguez, C.A., L.E. Eguiarte; J. Núñez y R. Dirzo. 1998. Flower morphometry of Rhizophora mangle (Rizophoraceae): geographical variation in Mexican populations. American Journal of Botany. 85(5):637-643. Douglas, B.C., 1997. Global sea rise, a redetermination: Surveys in Geophysics. 18, p. 279-292. Douglas, M. 1986. Risk acceptability according to the social sciences. New York: Russell Sage Foundation. Douglas, M., A. Wildavsky. 1982. Risk and culture: An essay on the selection of technological and environmental dangers. Berkeley: University of California Press. Dring, M.J. y K. Lüning, 1994. Influence of spring-neap tide cycles on the light available for photosynthesis by benthic marine plants. Mar. Ecol. Prog. Ser. 104, 131-137. Duarte, C.M. y J. Kalff. 1990. Patterns in the submerged macrophyte biomass of lakes and the importance of the scale of analysis in the interpretation. Can. J. Fish. Aquat. Sci. 47: 357-363. Duarte, C.M. 1991. Seagrass depth limits. Aquatic Botany, 40: 363-377. 102 Dubravko J., T. N. Rabalais y R. Turner. 2005. Coupling between climate variability and coastal eutrophication: Evidence and outlook for the northern Gulf of Mexico. Journal of Sea Research. 54. 25-35. Duke, N.C., M.C. Ball, y J.C. Ellison. 1998. Factors influencing biodiversity and distributional gradients in mangrove. Global Ecology and Biogeography Letters 7: 27:47. Dukes, J.S. y H.A. Mooney. 1999. Does global change increase the success of biological invaders? TREE 14 (4): 135-139. Durako, M.J. y M. D. Moffler. 1987. Factors affecting the reproductive ecology of Thalassia testudinum hydrocharitaceae. Aquat. Bot. 27, 79-96. Dyer, K.R., 1995. Response of estuaries to climate change. In: Eisma, D. (Ed.), Climate Change: Impact on Coastal Habitation. CRC Press, Boca Raton, pp. 85-110. EEA Briefing 2005. Vulnerabilidad y adaptación al cambio climático en Europa. Agencia Europea de Medio Ambiente. Elbers, C., J.O. Lanjouw y P. Lanjouw. 2003. Micro level estimation of poverty and inequality. Econometrica. 73(1):355364. El cambio climático global y el creciente desafío del mar. Subgrupo de trabajo sobre gestión de las zonas costeras del Grupo de trabajo sobre Estrategias de Respuesta del IPCC, 1992. Ellison, J.C. y D.R. Stoddart. 1991. Mangrove ecosystem collapse during predicted sea level rise: Holocene analogues and implications. J. Coastal Res. 7: 151-165 Elsner, J.B., J.P. Kossin y T.H. Jagger. 2008. The increasing intensity of the strongest tropical cyclones. Nature. 455(7209), 92-95. Emanuel, K., 2008: The hurricane--climate connection. Bulletin of the American Meteorological Society, 89(5), ES10ES20. Emanuel, K., R. Sundararajan y J. Williams. 2008. Hurricanes and global warming: results from downscaling IPCC AR4 simulations. Bulletin of the American Meteorological Society. 89(3), 347-367. Emanuel, K.A. 2005. Increasing destructiveness of tropical cyclones over the past 30 years. Nature. 436(7051), 686-688. Emanuel, K., C. DesAutels, C. Holloway y R. Korty. 2004. Environmental control of tropical cyclone intensity. Journal of the Atmospheric Sciences. 61(7), 843-858. Enríquez, S., E.R. Méndez y R. Iglesias-Prieto. 2005. Multiple scattering on coral skeletons enhances Light absorption by simbiotic algae. Limnology and Oceanography 50(4):1025-1032. Escanero, F. G., H.V. Guzmán y R. Gómez. 1988. Informe anual del programa de protección y estudio de las tortugas marinas en Campeche. Temporada 1987. (Mecan) INP-CRIP-Carmen, 39pp. Estrategia Nacional de Cambio Climático México 2007. http://www.semarnat.gob.mx/queessemarnat/politica_ambiental/cambioclimatico/Documents/enac/sintesis/sintesisejecutiva/Estrat_nal_Sintesis%2 0espa%C3%B1ol.pdf Espino, E., E.G. Cabral-Solís, A. García-Boa y M. Puente-Gómez. 2004. Especies marinas con valor comercial de la costa de Jalisco, México. SAGARPA–INP, ISBN–968-800-570-3, México, 145 p. Espino, E., A E. García-Boa, E.G. Cabral-Solís y M. Puente-Gómez. 2008. Pesca artesanal multiespecífica en la costa de Colima, criterios biológicos para su administración. Serie Linderos de la costa 5, IPN, 102 p. Esquivel, H. G., L. López-Calva y R. Vélez. 2003. Crecimiento económico, desarrollo humano y desigualdad regional. Estudios sobre Desarrollo Humano PNUD México 2003-3. Estadísticas de producción de camarón de acuacultura y pesca. Disponible en: http://www.industriaacuicola.com/PDFs/4.1estadisticas_produccioncamaron_pescayacuacultura.pdf Evans, A.S., K.L. Webb. y P.A. Penhale. 1986. Photosynthetic temperature acclimation in two coexisting seagrasses Zostera marina and Ruppia maritima. Aquat. Bot. 24, 185-198. Fabricius, K.E., O. Hoegh-Guldberg, J. Johnson, L. McCook and J. Lough (2007). Chapter 17. Vulnerability of coral reefs of the Great Barrier Reef to climate change. In: Climate Change and the Great Barrier Reef. A vulnerability Assessment, eds: J.E. Johnson and Marshall, P.A. Australia, Queensland. 515-554. FAO/ONU. Mitigación del cambio climático y adaptación en la agricultura, la silvicultura y la pesca. Disponible en: http://www.fao.org/docrep/fao/010/i0142s/i0142s.pdf FAO/ONU. 2008. El cambio climático tendrá un fuerte impacto en la pesca. Comunicado de prensa. 08/75 esp. 10 de julio. Farr, T.G., E. Caro, R. Crippen, R. Duren, S. Hensley, M. Kobrick, M. Paller, E. Rodriguez, P. Rosen, L. Roth, D. Seal, S. Shaffer, J. Shimada, J. Umland, M. Werner, D. burbank, M. Skin, y D. Alsdorf. 2007. The shuttle radar topography mission, Reviews of Geophysics. 45(2). RG2004 doi: 10.1029/2005RG000183, 2007. Feagin, R.A., D.J. Sherman y W.E. Grant. 2005. Coastal erosion, global sea-level rise, and the loss of sand dune plant habitats. Frontiers in Ecology and the Environment 3 (7): 359-364. Fernández, I. 2007. Indicadores del desempeño de la pesca en México y propuestas alternativas de políticas de administración. En: Estudios e investigaciones. La situación del sector pesquero en México. Coord. J. B. Santinelli. CEDRSSA/Cámara de Diputados. pp. 95-283. 103 Fernández, M.S. 2001. Las Nuevas Tecnologías en la educación. Análisis de modelos de aplicación. Madrid: Universidad Autónoma de Madrid. Field, J.C., D.F. Boesch, D. Scavia, R. Buddemeier, V.R. Burkett, D. Cayan, M. Fogarty, M. Harwell, R. Howarth, C. Mason, L.J. Pietrafesa, D. Reed, T. Royer, A. Sallenger, M. Spranger y J.G.Titus. 2000. Potential consequences of climate. Variability and change on coastal Areas and marine resources. National Assessment Synthesis Team (Ed) Climate Change Impacts on the United States. The Potential Consequences of Climate Variability and Change: overview. Foundation Report. Cambridge University Press, Cambridge, 154 pp. Fischer, W., F. Krupp, W. Schneides, C. Sommer, K.E. Carpenter y U.H. Niem (ed.). 1995. Guía FAO para la identificación de especies para los fines de la pesca. Pacífico Centro Oriental. Vols. II y III, pp. 644-1813. FitzGerald, D.M., M.S. Fenster, B.A. Argow y I.V. Buynevich, 2008. Coastal impacts due to sea-level rise. Annual Review of Earth and Planetary Sciences. 36, 601-647. Flores, F., F. González-Farías, D.S. Zamorano y P. Ramirez-García. 1992. Mangrove ecosystems of the Pacific coast of Mexico: Distribution, structure, litterfall and detritus dynamics. In: Seeliger, U. (Editor). Coastal Plants Communities of Latin America. Academic Press. 269-288 Flores-Verdugo, F. 2001. Procesos ecológicos en los humedales. En: Abarca, F. y J. Herzig (Eds.). Manual para el manejo y conservación de los humedales de México. Producción especial bajo colaboración de la SEMARNAP, US Fish & Wildlife Serv. Arizona Game & fish Dep. Flores, F., P. Moreno-Casasola, C. M. Agraz- Hernández, H. López Rosas, D. Benítez Pardo y A.C. Travieso-Bello. 2007. La topografía y el hidroperiodo: dos factores que condicionan la restauración de los humedales costeros. Boletín Sociedad Botánica de México 80 (Suplemento): 33-47. Folk, R.L. 1966. A review of grain size parameters, Sedimentology 6: 73-93. Fonseca, M.S. y W.J. Kenworthy. 1987. Effects of current on photosynthesis and distribution of seagrass. Aquat. Bot. 27, 59-78. Fonseca, M.S., J.C. Zieman, G.W. Thayer y J.S. Fisher. 1983. The role of current velocity in structuring eelgrass Zostera marina meadows. East. Coast. Shelf Sci. 17, 367-380. Frattini, R. A. 2002. Vulnerabilidad de las zonas costeras próximas a grandes centros urbanos. AA - AGOSBA – ILPLA – SIHN. Galaviz, A., Gutierrez Estrada, M. y A. Castro del Rio. 1987. Morfología, sedimentos e hidrodinámica de las lagunas de Dos Bocas y Mecoacán, Tabasco, México. An. Inst. Cien. del Mar y Limmnol. Univ. Nal. Autón. México. 14:2:109124. Gallegos, A., Rodríguez, R., Márquez, E. y Lecuanda, R., 2003: Temperatura de la Superficie de los Mares de México. El Faro, sección Asómate a la Ciencia. Boletín informativo de la CIC-UNAM, Año III, No. 30, septiembre, 2003. Gallegos, G A. 2004. Clima oceánico: los mares mexicanos ante el cambio climático. En: Martínez J. y Fernández A (Coord.) 2004. Cambio climático una visión desde México. INE y SEMARNAT. México D.F. Galloway, D., D.R. Jones y S.E. Ingebritsen. 1999. Land Subsidence in the United States. USGS circular 1182. U.S. Geological Survey, Reston, VA, 177 pp. Gehrels, W.R., B.W. Hayward, R.M. Newnham, and K.E. Southall, 2008: A 20th century acceleration in sea-level rise in New Zealand. Geophysical Research Letters, 35, L02717, doi: 10.1029/2007GL032632. Gama, L., A. Galindo-Alcántara, E. Cortés, C. Zequeira, A. Morales, C. Rullán, E. Moguel y Ma. E. Macías. 2009. El cambio climático global y su monitoreo sobre los posibles cambios en los servicios ambientales de cuencas de Tabasco. CA Ordenamiento Ecológico y Desarrollo Sostenible Universidad Juárez Autónoma de Tabasco Av. Universidad S/N, Zona de la Cultura 86000, Villahermosa Tabasco, México. García, A.V. 2004. La perspectiva histórica en la antropología del riesgo y del desastre. Acercamiento metodológico. Relaciones 97 (XXV), 124-142. García, R. 2000. Sistemas Complejos. Editorial Gedisa, España. Gardner, T.A., I .M. Côté, J. A. Gill, A. Grant y A.R. Watkinson. 2003. Long-Term Region-Wide Declines in Caribbean Corals Science 301(5635): 958 – 960. DOI: 10.1126/science.1086050. Gervacio, H. y B. Castillo-Elías. Aprovechamiento de bosques de mangle a través de unidades de manejo sustentable como recurso para el desarrollo económico local y su importancia en la educación ambiental. Disponible en: http://www.sicbasa.com/tuto/AMECIDER2006/PARTE%208/142%20Herlinda%20Gervacio%20Jimenez%20et%20a l.pdf Giesen, W.B.J.T., M.M. den Van Katwijk y C. Hartog. 1990. Eelgrass condition and turbidity in the Dutch Wadden Sea. Aquatic Botany 37, 71-85. Gladfelter, W.B.J.T. 1982. White-Band Disease in Acropora palmata: implications for the structure and growth of shallow reefs. Bull. Mar. Sci. 32: 639-643. Godfrey, P.J. 1977. Climate, plant response and development of dunes on barrier beaches along the U.S. east coast. International Journal of Biometeorology 21 (3): 203-316. 104 Godínez, E., J. Rojo-Vázquez, V. Galván-Piña y B. Aguilar-Palomino. 2000. Changes in the structure of a coastal fish assemblage exploited by a small scale gillnet fishery during an El Niño-La Niña event. Estuarine, Coastal and Shelf Science, 51(6), December, pp. 773-787. Gómez, M.L. 2008. Proyecto Piloto de Adaptación Nacional Integrado para Fortalecer la Capacidad de Recuperación de los Humedales Costeros del Golfo de México al Cambio Climático. Sección: Impactos Antropogénicos, cambio de uso de suelo. [Versión CD], informe final al Banco Mundial, INE-Semarnat. Gómez, J.J. 2001. Vulnerabilidad y medio ambiente. Seminario Internacional. Las diferentes expresiones de la vulnerabilidad social en América Latina y el Caribe. Santiago de Chile, 20 y 21 de junio. CEPAL/CELADE/ONU. 36 p. Gómez, M. Disponible en: http://www.eumed.net/cursecon/ecolat/mx/2007/mgr-ciclones.htm González. M., E. Jurado, S. González, O. Aguirre, J. Jiménez y J. Navar. 2003. Cambio climático mundial: origen y consecuencias. Ciencia UANL. VI.(3), julio-septiembre: 377-385. Gornitz, V.M., R.C. Daniels, T.W. White y K.R. Birdwell. 1994, The development of a coastal vulnerability assessment database, Vulnerability to sea-level rise in the U.S. southeast. Journal of Coastal Research. Special Issue 12: 327-338. Gornitz, V. y T.W. White. 1992, A coastal hazards database for the U.S. West Coast: ORNL/CDIAC-81, NDP-043C, Oak Ridge National Laboratory, Oak Ridge, Tenn. Gornitz, V. y S. Lebedeff.1987. Global sea-level changes during the past century. In: Sea-Level Fluctuation and Coastal Evolution [Nummedal, D., O.H. Pilkey, and .D. Howard, (eds.)]. Special publication 41. Society of Economic Paleontologists and Mineralogists, Tulsa, OK, pp. 3-16. Gornitz, V., S. Couch y E. K. Hartig. 2001. Impacts of sea level rise in the New York City metropolitan area. Global and Planetary Change 32 (1): 61-88. Gray, W. H. 1984. Atlantic seasonal hurricane frequency. Part I: El Niño and 30 mb Quasi-Biennial oscillation influences. Monthly Weather Review. 112:1649-1668 Greenstein, B.J., H.A. Curran y J. M. Pandolfi. 1998. Shifting ecological baselines and the demise of Acropora cervicornis in the western North Atlantic and Caribbean Province: A Pleistocene perspective. Coral Reefs 17(3):249-261. Grinsted, A., J.C. Moore y S. Jevrejeva. 2009. Reconstructing sea level from paleo and projected temperatures 200 to 2100AD. Clim. Dyn. In press. Disponible en: http://dx.doi.org/10.1007/s00382-008-0507-2 Grupo de Trabajo SUPRE. 1970. Diagnostico preliminar de los factores que determinan el comportamiento de la Laguna Santa Anita, Municipio de Centra, Tabasco. Informe Técnico. Villahermosa, Tabasco. Grupo Intergubernamental de Expertos Sobre el Cambio Climático, 1997. Informe especial del IPCC impactos regionales del cambio climático: Evaluación de la vulnerabilidad. Guaymas, CECARENA. 1993. Taller para el manejo de manglares de humedales costeros en el noroeste de México, Memorias, 7,11 de diciembre, p.8. Guerra, V. y S. Ochoa-Gaona. 2008. Evaluación Del Programa De Manejo De La Reserva de La Biosfera Pantanos De Centla En Tabasco, México. Universidad y Ciencia 24(2):135-146. Gutiérrez, M.A., M.A. De la Fuente-Betancourt y A. Cervantes-Martìnez. 2000. Biomasa y densidad de dos especies de pastos marinos en el sur de Quintana Roo, México. Revista de Biología Tropical.Junio 2000, 3p. Gutiérrez, M. y Y. Montaño-Ley. 1987. Control de perfiles de playa en el área de Mazatlán, Sinaloa, México. An.Inst.Cienc. del Mar, UNAM. Gutierrez, M. y A. Galaviz-Solis. 1983. Morfología y sedimentos recientes de las lagunas El Carmen, Pajonal y la Machona, Tabasco. México. An. Inst. Cienc. del Mar y Limmol. Univ. Nal. Autón. México. 10(1):249-268. Gutowski, W.J., G.C. Hegerl, G.J. Holland, T.R. Knutson, L.O. Mearns, R.J. Stouffer, P.J. Webster, M.F. Wehner y F.W. Zwiers, 2008. Causes of observed changes in extremes and projections of future changes. In: Weather and Climate Extremes in a Changing Climate: Regions of Focus: North America, Hawaii, Caribbean, and U.S. Pacific Islands. [Karl, T.R., G.A. Meehl, C.D. Miller, S.J. Hassol, A.M. Waple, and W.L. Murray (eds.)]. Synthesis and Assessment Product 3.3. U.S. Climate Change Science Program, Washington, DC, pp. 81-116. Guzmán, V. 2005. Informe técnico final del programa de conservación de tortugas marinas de Campeche, México en 2005. 10-12 pp. Guzmán, V. 1996. Reseña de la temporada de anidación en Campeche, México, durante 1996. Doc. Téc. del Centro Reg. de Invest. Pesquera de Cd. del Carmen. Nº 3. Programa Nacional de Tortugas Marinas, INP. 9 pp. Inédito. Guzmán, V., Cuevas, F.E., F.A Abreu-G. González-G. B., García A.P., y Huerta, R.P. (Compiladores) 2008. Resultados de la reunión del grupo de trabajo de la tortuga de carey en el Atlántico mexicano. Memorias. CONANP/EPC/APFFLT/PNCTM. ix+ 244pp. Hammar, E.S. y E.R. Thieler. 2001. Coastal Vulnerability to Sea-Level Rise, A Preliminary Database for the U.S. Atlantic, Pacific, and Gulf of Mexico Coasts: U.S. Geological Survey, Digital Data Series, DDS-68, 1 CD, Online. Hansom, J.D. 2001. Coastal sensitivity to environmental change: a view from the beach. CATENA 42 (2-4): 291-305. Harrison, P.G. 1982. Seasonal and year-to-year variations in mixed intertidal populations of Zostera japonica and Ruppia maritima. Aquat. Bot. 14, 357-372. 105 Harvell, C. D., E. Jordan, S. Merkel, L. Raymundo, E. Rosenberg, G. Smith, Weil, E. y B.L. Willis. 2007. Coral disease: environmental change and the balance between coral and microbes. Oceanography 20, 58–81. Harvell, C.D., C.E. Mitchell, J.R. Ward, S. Altizer, A.P. Dobson, R.S. Ostfeld y M.D. Samuel. 2002. Climate warming and disease risks for terrestrial and marine biota. Science 296:2,158–2,162. Harvell, C.D., et al. 1999. Emerging marine diseases climate links and anthropogenic factors. Science 285:1,505–1,510. Hendry, M. 1993. Sea-level movement and shoreline change. En: G.A. Maul (ed.). Climate change in the Intra-America Sea, London: Reward Arnold Publishers. Hernández, A.H. 2007. Calentamiento global y zonas costeras: peligrosa combinación. Ecofronteras, 31 agosto. Hernández, J.R., M.A. Ortiz-Pérez, A.P. Méndez-Linares y L. Gama. 2008. Morfodinámica de la línea de costa del estado de Tabasco, México: tendencias desde la segunda mitad del siglo XX hasta el presente. Investigaciones Geográficas. Boletín del Instituto de Geografía, UNAM. 65:7-21. Heron, S., et al. 2008. In: Status of Caribbean coral reefs after bleaching and hurricanes in 2005. Wilkinson C. Souter D. (Eds.). Global Coral Reef Monitoring Network, and Reef and Rainforest Research Centre, Townsville, 152 p. Herrera, J.A. 2006. Lagunas Costeras de Yucatán (SE, MÉXICO): Investigación, Diagnostico y Manejo. Ecotropicos 19(2):94-108. Hesp, P. 2000. Coastal sand dunes. Form and function. CDVN Technical Bulletin no. 4. Massey University. Nueva Zelanda. 29 pp. Hicks, S.D. 1978. An Average Geopotential Sea Level Sries for the United States, Journal of Geophysical Research. 83(C3): pp 1377-1379. Hidore, J. 1996. Global Environmental Change. Its nature and impact. Prentice Hall, USA. 263pp. Hillman, K., W, D.I. Larkum, A.W.D. y A.J. McComb. 1989. Productivity and nutrient limitation. In: A.W.D. Larkum, A.J. McComb and S.A. Shepherd (Editors), Biology of Seagrasses. A treatise on the Biology of Seagrasses with Special Reference to the Australian Region. Elsevier, Amsterdam, pp. 635-685. Hoegh, O. 1999. Climate change, coral bleaching and the future of the worlds coral reefs, Mar. Freshwater Res. 50, 839866. Hoegh-Guldberg O., P.J. Mumby, A.J. Hooten, R. Steneck, S. Greenfield, E. Gomez, C.D. Harvell, P.F. Sale, A.J Edwards, K. Knowlton, C.M. Eakin, R. Iglesias-Prieto, N. Muthiga, R.H Bradbury, A. Dubi y M.E. Hatziolos. 2007. Coral Reefs Under Rapid Climate Change and Ocean Acidification. Science. 318 (5857): 1737-1742. Hoffman, J.S., D. Keyes y J.G. Titus. 1983. Projecting Future Sea Level Rise; Methodology, Estimates to the Year 2100, and Research Needs; Report 230-09-007, U.S. Environmental Protection Agency, Washigton, DC. Hoghart, P.J. 2007. The Biology of Mangroves and Seagrasses. Second Edition. Oxford University Press.273 pp. Holgate, S.J. 2007. On the decadal rates of sea level change during the twentieth century, Geophysical Research Letters 34, L01602, doi:10.1029/2006GL028492. Holgate, S.J.y P.L. Woodworth. 2004. Evidence for enhanced coastal sea level rise during the 1990s, Geophysical. Research. Letters. 31, L07305, doi:10.1029/2004GL019626. Holman, J. Alan. 1967. The age of the turtle. Turtle and Tortoise Soc. Journ. , May-June: 15-21 Honty, G. 2007. América Latina ante el cambio climático. Observatorio de la globalización informa y analiza sobre nuevas perspectivas globales y sus impactos en América Latina. Houghton, J. T., Houghton, Y. Ding, D. J. Griggs, N. Noguer, P. J. van der Linden, D. Xiaosu, K. Maskell and C. A. Johnson. 2001. Climate change. The scientific basis. Edited by Contribution of Working Group I to the Third Assessment Report of the Intergovernmental Panel on Climate Change, Cambridge University Press, Cambridge. 2001. 881 pp. Hubertz, J.M., E.F. Thompson y H.V. Wang. 1996. Wave Information Studies of U.S. coastlines, Annotated bibliography on coastal and ocean data assimilation: WIS Report 36, U.S. Army Engineer Waterways Experiment Station, Vicksburg, 31 p. Hughes, T.P., M.J. Rodrigues, D.R. Bellwood, D. Ceccarelli, O. Hoegh-Guldberg, L. McCook, N. Moltschaniwskyj, M.S. Pratchett, R.S. Steneck y B. Willis. 2007. Phase Shifts Herbivory, and the Resilience of Coral Reefs to Climate Change.Current Biology. 17(4):360-365. Hughes, L. 2000. Biological consequences of global warming: is the signal already apparent ?. Trends Ecol. Evol. 15(2):56-61. Hughes, T. 1994. Catastrophes, phase shifts, and large scale degradation of a Caribbean coral reef. Science. 265:1,547– 1,551. IDEAM (Instituto de Hidrología, Meteorología y Estudios Ambientales). 2001. Vulnerabilidad y adaptación de la zona costera colombiana al ascenso acelerado del nivel del mar. Instituto de Hidrología, Meteorología y Estudios Ambientales. Iglesias, R. V.H. Beltra, T.C. LaJeunesse, H. Reyes-Bonilla, y P.E. Thome. 2004. Different algal symbionts explain the vertical distribution of dominant reef corals in the eastern Pacific. Proceedings of the Royal Society of London. Series B, Biological Sciences, 271, 1757–1763. 106 Iglesias, RJL, W.A. Matta, W.A. Robins y R.K. Trench. 1992. Photosynthetic response to elevated temperature in the symbiotic dinoflagellate Symbiodinium microadriaticum in culture. Proceedings of the National Academy of Sciences, USA (1992) 89:10302–10305. INE, 1997. Programa de Manejo del Área de Protección de Flora y Fauna Laguna de Términos, México. México, D.F. 201 pp. INEGI, 2007. Perspectiva Estadistica.Tabasco. México: INEGI. INEGI, 2006. II Conteo de Población y vivienda 2005 Disponible en: http://www.inegi.gob.mx/est/contenidos/espanol/sistemas/conteo2005/localidad/iter/default.asp?s=est&c=10395 INEGI, INE, Semarnap. 2000. Indicadores de desarrollo sustentable. Disponible en: http://maestros.its.mx/loyola/EducA/indic.pdf Infante, M. D. 2004. Germinación y establecimiento de Annona glabra (Annonaceae) y Pachira aquatica (Bombacaceae) en humedales, La Mancha, Actopan, Ver. Tesis de Maestría. Maestría en Ecología y Manejo de Recursos. Instituto de Ecología A.C., Xalapa. Ver. Infante, M., D. y P. Moreno-Casasola. 2005. Effect of in situ storage, light, and moisture on the germination behavior of two wetland trees: Annona glabra (Annonaceae) and Pachira aquatica (Bombacaceae). Aquatic Botany (83) 3: 206218. Informe del Curso de Estudios Nacionales del IPCC, 1992. Directrices preliminares para evaluar los impactos del cambio climático, 1992. Informe especial del IPCC, 1997. Impactos regionales del cambio climático: evaluación de la vulnerabilidad. (Incluido en resumen para responsables de políticas). Informe especial del Grupo de trabajo II del IPCC, 1997. Datos sobre el Nivel del Mar. INP/SAGARPA, 2006. Carta Nacional Pesquera. D. O. F. 25 agosto. INP/SAGARPA, 2006. Sustentabilidad, y pesca responsable en México: Evaluación y manejo. 543 p. INP/SAGARPA, 2004. Carta Nacional Pesquera. D. O. F. 15 marzo. INP/SAGARPA, 2000. Estado de salud de la acuacultura. DGIA. Noviembre. INP/SAGARPA, 2001. Sustentabilidad, y pesca responsable en México: Evaluación y manejo 1999-2000. 1111 p. INP/SEMARNAT, 1999. Sustentabilidad, y pesca responsable en México: Evaluación y manejo 1997-1998. INP/SEMARNAT, 2000. Sustentabilidad, y pesca responsable en México: Evaluación y manejo 1999-2000. Instituto Nacional de Ecología-Sistema arrecifal Mesoamericano (INE-SAM). 1997. Sistema arrecifal del Caribe Mesoamericano. Secretaría del Medio Ambiente, Recursos Naturales y de Pesca. México: 10 p. IPCC, 2007. Climate Change 2007. The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change [Solomon, S., D. Qin, M. Manning, Z. Chen, M. Marquis, K.B. Averyt, M. Tignor, and H.L. Miller (eds.)]. Cambridge University Press, Cambridge, UK, and New York, 996 pp. IPCC, 2007. Cambio climático 2007. Informe de síntesis. Contribución de los Grupos de trabajo I, II y III al Cuarto Informe de evaluación del Grupo Intergubernamental de Expertos sobre el Cambio Climático. IPCC, Ginebra, Suiza. http://www.ine.gob.mx/download/ipcc/ipcc_grupo1_informe.pdf IPCC. 2002. Climate Change 2001. The Scientific Basis; Contribution of Working Group I to the Third Assessment Report of the Intergovernmental Panel on Climate Change: IPCC: Geneva, Switzerland, 563 p. Disponible en: www.ipcc.ch IPCC, 2001: Climate Change 2001: The Scientific Basis. Contribution of Working Group I to the Third Assessment Report of the Intergovernmental Panel on Climate Change [Houghton, J.T., Y. Ding, D.J. Griggs, M. Noguer, P.J. van der Linden, X. Dai, K. Maskell, and C.A. Johnson (eds.)]. Cambridge University Press, Cambridge, UK, and New York, 881 pp. IPCC, 2001. Special Report on Emissions Scenarios (SRES). IPCC, 1994. Technical Guidelines for Assessing Climate Change Impacts and Adaptations with a Summary for Policy Makers and a Technical Summary. T.R. Carter, M.L. Parry, H. Harasawa, S. Nishioka. Eds. Department of Geography, University College London, U.K. and the Center for Global Environmental Research, National Institute for Environmental Studies, Japan. 59 pp. IPCC, 1992. Climate Change, the Supplementary Report to the IPCC Scientific Assessment. J. T. Houghton, B. A. Callendar y S. K. Varney, eds. Cambridge University Press, Cambridge, U.K. 200 pp. Jevrejeva, S., J.C. Moore, A. Grinsted y P.L. Woodworth. 2008. Recent global sea level acceleration started over 200 years ago? Geophysical Research Letters. 35, L08715, doi: 10.1029/2008GL033611. Jevrejeva, S., A. Grinsted, J.C. Moore y S. Holgate. 2006: Nonlinear trends and multiyear cycles in sea level records. Journal of Geophysical Research. 111, C09012, doi: 10.1029/2005JC003229. Jiménez, MC. 2003. Relación entre las variables ambientales y la reproducción de la tortuga lora (Lepidochelys kempi, Garman 1880) en la playa de Rancho Nuevo, Tamps. Tesis de Grado. Fac. de Ciencias. UNAM, México. 320pp. 107 Jiménez, S., W. Salinas y J. Campos. 2004. Impacto de la urbanización en zonas costeras. Caso de Estudio: zona conurbada Altamira-Madero-Tampico, Tamaulipas, México. pp 361-372. Caso-Chávez, M., I. Pisanty, y Ezcurra, E. (Eds). Diagnostico Ambiental del Golfo de México. Mexico: INE –SEMARNAT, Instituto de Ecología, A. C., Hearteresearch Institute for Gulf of Mexico Studies. Justic, D, N. Rabalais y E. Turner. 1997. Impacts of climate change on the net productivity of coastal waters: implications for carbon budgets and hypoxia. Climate Research 8:225-237. Jordan, E. 1992. Recolonization of Acropora palmata in a marginal environment. Bulletin of Marine Science. 51(1):104117. Jordán, E. y R.E. Rodríguez-Martínez, “The Atlantic Coral Reefs of Mexico”. En Latin American Coral Reefs. J. Cortés, ed. (Amsterdam: Elsevier Press, 2003), p. 150. Jordán, E., M.A. Maldonado y R.E. Rodríguez-Martínez. 2005. Diseases and partial mortality in Montastraeaannularis species complex in reefs with differing environmental conditions (NW Caribbean and Gulf of México). Dis. Aquat. Org. 63(1): 3-12. Kennedy V S., R. Twilley, J. A. Kleypas, J. H. Cowan, Jr y S. R. Hare. 2002. Coastal and marine ecosystems potential effects on U.S. Resources & Global climate change. Prepared for the Pew Center on Global Climate Change. Kenworthy, W.J. y D. Haunert. 1991. Results and recommendations of a workshop convened to examine the capability of water quality criteria, standards and monitoring programs to protect seagrasses from deteriorating water transparency. NOAA's Coastal Ocean Program, Estuarine Habitat Studies, NOAA Workshop Report, p. 151. Kleypas, J.A. y C. Langdon. 2006. Coral reefs and changing seawater carbonate chemistry. In: Phinney J.T., O. HoeghGuldberg, J.A. Kleypas, W. Skirving, A. Strong (eds). Coral reefs and climate change: science and management. Coast Estuar Stud. 61:73–110. Kleypas, J.A., J.W. McManus y L.A.B. Menez. 1999. Environmental limits to coral reef development: where do we draw the line? Am. Zool. 39,146 -159. Klima, E. F., G. A. Matthews y F. J. Patella. 1986. Synopsis of the Tortugas pink shrimp fishery, 1960-1983, and the impact of the Tortuga sanctuary. N. Am. J. Fish. Manage. 6: 301-310. Koch, E.W. 1996. Hydrodynamics of shallow Thalassia testudinum beds in Florida, USA. In: Kuo, J., Phillips, R.C., Walker, D.I., Kirkman, H. (Eds.), Seagrass Biology: Proceedings of an International Workshop, Rottnest Island, Western Australia, 25±29 January 1996. Sciences UW, Nedlands, Western Australia, pp. 105-110. Koch, E.W. y S.Beer. 1996. Tides, light and the distribution of Zostera marina in Long Island Sound, USA. Aquat. Bot. 53, 97-107. Komatsu, T., 1996. Influence of a Zostera bed on the spatial distribution of water flow over a broad geographic area. In: Kuo, J., Phillips, R.C., Walker, D.I., Kirkman, H. (Eds.), Seagrass Biology: Proceedings of an International Workshop, Rottnest Island, Western Australia, 25-29 January 1996. Sciences UWA, Nedlands, Western Australia, pp. 111-116. Kovacs, J.M., C.M. Blanco y V.F. Flores. 2001. A logistic regression model of hurricane impact in a mangrove forest of the Mexican Pacific. Journal of Coastal Research. 17(1):30-37. Kovacs, J. M., J. Melczwski anf F. Flores-Verdugo. 2004. Examing local ecological knowledge of hurricane impacts in a mangrove forest using an analytical hierarchy process (AHP) approach. J. Coastal Research 20 (3): 792-800 Krumbein, W.C. y L.C. Sloss. 1963. Stratigraphy and Sedimentation, W.H. Freeman company, San Francisco. 660p. Kushmaro, A. y E. Kramarsky-Winter In E. Rosenberg y Y. Loya (Eds.) Coral Health and Disease. pp. 231-242. ISBN 3540-20772-4. Springer-Verlag (2005). La Amenaza del Cambio Climático para la pesca y la acuicultura. Domingo, 24 de junio de 2007. World Fish Center. Policy Brief. Disponible en: http://agricultura.vicar.es/cdigital/html/portal/com/bin/contenidos/agriculturaMA/actualidad/documentos/cambio_cli matico_aquahoy/1201602936993_cambio_climatico_aquahoy.pdf Land Processes Distributed Active Archive Centre (National Aeronautics and Space Administration). Disponible en: http://edcdaac.usgs.gov/main.asp Lara, L R. 2008. Los cambios ambientales globales y la vulnerabilidad de los sectores de México. En: Infra estructura y Desarrollo Sustentable. I. A. Azuz Adeath (Editor). 2008. Gobierno del Estado de B.C. CETYS Universidad. Larkum, A.W.D., G. Roberts, J. Kuo y S. Strother. 1989. In: Larkum, A.W.D., McComb, A.J., Shepherd, S.A. (Eds.), Biology of Seagrasses: A Treatise on the Biology of Seagrasses with Special Reference to the Australian region. Elsevier, Amsterdam, pp. 686-722. Lefebvre, L.W. y J.A. Powell. 1990. Manatee grazing impacts on seagrasses in Hobe Sound and Jupiter Sound in southeast Florida during the winter of 1988-1989. National Technical Information Service, #PB90-271883, Springfield, VA. 36 pp. Leigh, E.G. 1990. Community diversity and environmental stability: A re-examination. Tree 5(10): pp. 340-344. León, C. 2008. Instrumentación de Medidas de Adaptación al Cambio Climático en Humedales Costeros del Golfo de México. [Versión CD]. Informe final al Banco Mundial, INE-Semarnat. 108 León, C. J. G. y M. Muciño. 1995. Nota informativa sobre la pesquería de abulón en Baja California. CRIP-La Paz. Informe Técnico del Instituto Nacional de la Pesca (documento interno). León, C. y Rodríguez, H. 2004. Ambivalencia y asimetrías en el proceso de urbanización en el Golfo de México: Presión ambiental y concentración demográfica. Pp.1043-1082. Caso-Chávez, M., I. Pisanty, y Ezcurra, E. (Eds). Diagnostico Ambiental del Golfo de México. Mexico: INE –SEMARNAT, Instituto de Ecologia, A. C., Hearteresearch Institute for Gulf of Mexico Studies. Lesser, M.P., J.C. Bythell, R.D. Gates, R.W. Johnstone y O. Hoegh-Guldberg.2007. Are infectious diseases really killing corals? Alternative interpretations of the experimental and ecological data. J. Exp. Mar. Biol. Ecol. 346:36–44. Lessios, H.A., D Robertson et al. 1984. Spread of Diadema mass mortality through the Caribbean. Science. 226: 335-37. Ley de Bienes Nacionales. Diario Oficial Federal (DOF) 20 05 2004 Lewis, D. W., 1984. “Practical Sedimentology”, Van Nostrand Reinhold Company Inc., New York, 229 pp. Liceaga-Correa, M. A. 2003. Reporte Final. Caracterización Ecologica, Actual y Retrospectiva, de los Hábitats Bénticos y su Relación con la Pesquería de la Langosta Panulirus argus. Bahía de la Ascensión, Reserva de la Biosfera de Sian Ka’an. Proyecto SISIERRA 20000706005. Lim, B., I. Burton y S. Huq 2004. Adaptation policy frameworks for climate change. Developing strategies, policies and measures. Cambridge University Press. Limpus, C.J., 2006. Impacts of climate change on marine turtles. A case study. En: UNEP/CMS Secretariat. Migratory species and climate change: Impacts of a changing environment on wild animals. 34-39. Limpus, C. J. y N. Nicholls. 1988. The southern Oscillation regulates the annual numbers of green turtles (Chelonia mydas) breeding around Northern Australia. Aust. J. Wildl. Res.15:157-161. Limpus, C. J. y N. Nicholls. 1990. Progress report on the study of the interaction of the El Niño Southern Oscillatin on annual Chelonia mydas numbers at the southern Great Barrier Reef Rookeries. In: J. Rusell (Ed.). Proc. of the Australian Marine Turtle Conservation Workshop. Queensland Department of Environment and Heritage and Australian Nature Conservation Agency. 73-78. Linton, D. M. y G. F. Warner. 2003. Biological indicators in the Caribbean coastal zone and their role in integrated coastal management. Ocean & Coastal Management, 46(3-4), pp. 261-276. Littler, M.M. y D.S. Littler, 1984. Relationships between macroalgal functional form groups and substrata stability in a subtropical rocky-intertidal system. J. Exp. Mar. Biol. Ecol. 74:13-34. Littler, M.M. 1980. Morphological form and photosynthetic performances of marine macroalgae: test of a functional/form hypothesis. Bot. Mar. 22:161-165. Littler, M.M. y D.S. Littler, 1980. The evolution of thallus form and survival strategies in benthic marine macroalgae: field and laboratory test of a functional form model. Am. Nat. 116:25-44. Livezey, R., M. Masutani, A. Leetma, H. Rui, M. Ji y A. Kumar. 1997. Teleconnections responses of the PNA atmosphere to large central equatorial Pacific SST anomalies. Journal of Climate 10:1787-1820. Lloret J, A. Marin y L. Marin-Guirao. 2008. Is coastal lagoon eutrophication likely to be aggravated by global climate change?. Estuarine Coastal and Shelf Science. 78: 403-412. Lluch, D., D. Lluch-Belda, S. Lluch-Cota, J. López-Martínez, M. Nervárez-Martínez, G. Ponce-Díaz, G. Salinas-Zavala, A. Vega-Velázquez, J. R. Lara-Lara, G. Hammann y J. Morales. 1999. Las pesquerías y El Niño. En: Los impactos de El Niño en México. Ed. Magaña, R. V. O. CCA/UNAM y DGPC/SEGOB. México. 229 p. Lluch, D. 2005. El sector pesquero. En: Cambio climático: una visión desde México. Comp. Martínez, J., A. FernándezBremaunts, y P. Osnaya. SEMARNAT/INE. pp. 327-335. Longhurst, A.R. y D. Pauly. 1987. Ecology of tropical oceans. Academic Press, Inc., San Diego, Ca., U.S.A., 407 p. López, P.y R.de la Torre. 2004. Capital Social y Desarrollo Humano en México. Estudios sobre desarrollo Humano PNUD-México No 2004-14. López, A. E. 2003. Aplicación de un índice de calidad para cuerpos de agua del estado de Tabasco. Tesis Lic. Universidad Autónoma de Tabasco. López, J. y E. Ezcurra. 2002. Los Manglares de México: una revisión. Madera y Bosques. Instituto de Ecología A.C. Xalapa, México. Número Especial 8 (1): 27-51. López, H. 2007. Respuesta de un humedal transformado por la invasión de la gramínea exótica Echinochloa pyramidalis (Lam.) Hitch y Chase a los disturbios inducidos (cambios en el hidroperiodo, apertura de espacios y modificación de la intensidad lumínica). Doctorado en Ecología y Manejo de Recursos. Tesis Doctoral. Instituto de Ecología A.C., Xalapa. Ver. Lot, H.A., Y.C. Vázquez y F.L. Menéndez. 1975. Physiognomic and floristic changes near the northern limit of mangroves in the Gulf Coast of Mexico. In: Walsh, G.E., Snedaker, S:C., Teas, H.T. eds. Proceedings of the International Symposium on Biology and Management of Mangroves Vol. 1 Universidad de Florida, Gainesville, 5261. Loya, Y., K. Sakai, K. Yamazato, Y. Nakano, H.Sambali y R.R. van Woesik. 2001. Coral bleaching: the winners and the losers. Ecol Lett. 4, 122–131. 109 Lugo, A.E., C.S. Rogers y S.W. Nixon. 2000. Hurricanes, coral reefs and rainforest: resistance, ruin and recovery in the Caribbean. Ambio, 29:106-114. MacNae, W. 1968. A general account of the fauna and flora of mangrove swamps and forests in the Indo-West-Pacific region. Advances in Marine Biology 6: 73-270. Magaña, V. y C. Gay, 2002. Vulnerabilidad y Adaptación Regional Ante El Cambio Climático y sus Impactos Ambiental, Social y Económicos. Gaceta Ecológica, Instituto Nacional de Ecología 65: 7-23. MAGICC, 2009. Model for the Assessment of Greenhouse-gas induced Climate Change (MAGICC, 5.3). NCAR, Boulder, Colorado. Mallela, J. y C.T. Perry. 2007. Calcium carbonate budgets for two coral reefs effected by different terrestrial runoff regimes, Rio Bueno, Jamaica. Coral Reefs. 26: 129-145. Margalef, R. 1977. Ecología. Ediciones Omega, S.A., España, 951 p. Márquez, E., S. Flores-Erazo, A., Márquez-García y V. Pérez-Aguilar. 2006. Cambios por erosión y acreción de las playas del Municipio de Solidaridad, In: Bello M.J., De la Lanza-Espino, G y Pérez de la Fuente, G. Eds. Comunidad arrecifal de las playas en la Riviera Maya. Revista del Medio Ambiente, Turismo y Sustentabilidad, Vol. 2, núm. 1, Universidad del Caribe ISSN 1870-1515, pp. 45-57. Márquez, G. A. Z., V. Pérez, E. Márquez y Z. Flores. 2007. Cambios en el tamaño de los sedimentos de las playas del Litoral del Municipio de Solidaridad por efectos climáticos estacionales. Revista de la Universidad del Caribe, Quintana Roo. 59-68 pp. Márquez, E. 2003. Cartografía y análisis climatológico de la temperatura de la superficie del mar en el Golfo de California (1996-2001). Tesis de Licenciatura. Facultad de Ingeniería, UNAM. Ingeniero Topógrafo y Geodesta. Monografía c/CD anexo, 75 pp. Márquez-M., R. 1976. Reservas Naturales para la conservación de las tortugas marinas de México. Inst. Nal. de Pesca, INP/SI:i83. Márquez., R. 1990. FAO Species Catalogue. Vol. 11. Sea turtles of the world. An Annotated and Illustrated Catalogue of Sea Turtle Species Known to Date. FAO Fisheries Synopsis 125(11):1-81. Márquez, R. 1996. Las tortugas marinas y nuestro tiempo. La ciencia para todos No. 144. Fondo de cultura económica. México D. F. 200 pp. Márquez., R. 2002. Las tortugas marinas y nuestro tiempo. 3ª Ed., México, FCE. EP. CONACYT. Colec. La Ciencia para Todos/144. 200pp. Márquez., R., C. Peñaflores y Ma. C. Jiménez-Q. 2007. Protección de la tortuga marina en la costa de Oaxaca por el Instituto Nacional de la Pesca. XXV Aniversario de conservación e investigación en tortuga Marina. UABJ de Oaxaca. Tomo II:4-26. Marsh, Jr., J.A., W.C. Dennison, R.S. Alberte. 1986. Effects of temperature on photosynthesis and respiration in eelgrass (Zostera marina L.). Journal of Experimental Marine Biology and Ecology 101: 257-267. Marshall, P. H. Schuttenberg. 2006. The Impacts of Climate Change on the Coral Reefs of the Caribbean. In: Reef Managers guide to coral bleaching. Martínez, M.L. y P. Moreno-Casasola. 1996. Effects of burial by sand on seedling growth and survival in six tropical sand dune species. J. Coastal Research 12 (2): 406-419. Martínez, M.L., Gallego-Fernández, J. B., García-Franco, J., Moctezuma, C. y D. Jiménez. 2006. Assessment of coastal dune vulnerability to natural and anthropogenic disturbances along the Gulf of Mexico. Environmental Conservation 33 (2): 109–117 Martínez, M.L., A. Intralawan, G. Vázquez, O. Pérez-Maqueo, P. Sutton y R. Landgrave. 2007. The coasts of our world: Ecological, economic and social importance. Ecological Economics 63: 254-272 Maul, G. A. 1985. Introduction to Satellite Oceanography. Martinus Nijhoff Publishers, Boston, 606 pp. Maul, G.A. 1993. Climatic change in the Intra-Americas Sea. Edward Arnold, London, 389 p. Mckenna, J. E. y S.B. Saila. 1991. Application of an objective method for detecting changes in fish communities: Samar Sea, Philippines. Asian fisheries Science 4: pp. 201-210. McGehee, M. 1979. Effects of moisure on eggs and hatchlings of loggerhead sea turtles (Caretta caretta). Thesis. B. S., Presbyterian College, U.S.A. 252 pp. McLaren, S. y R. Gardner 2000. New radiocarbon dates from a Holocene aeolianite, Isla Cancun, Quintana Roo, Mexico. The Holocene 10: 757. McMillan, C. 1982. Reproductive physiology of tropical seagrasses. Aquatic. Botany 14: 245-258. Medina. 2008, Unpublished M.Sc. Thesis, University of Fribourg, Switzerland. Medina, I. y J.A Herrera-Silveira. 2003. Spatial characterization of water quality in a karstic coastal lagoon without anthropogenic disturbance: a multivariate approach. Estuarine, Coastal and Shelf Science 58: 455–465. Meehl, G.A. et al., 2007. Global Climate Projections. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change [Solomon, 110 S., D. Qin, M. Manning, Z. Chen, M. Marquis, K.B. Averyt, M.Tignor and H.L. Miller (eds.)]. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA. Mendoza, M., A., M. Herrera-Rodríguez y G. Olguín-Pascualli. 2004. Monitoreo ambiental de la actividad petrolera en el sur del Golfo de México, p 589-609. En: Rivera-Arriaga, E., G. J. Villalobos, I. Azuz-Adetath y F. Rosado (eds.) El Manejo Costero en México. Universidad Autónoma de Campeche, SEMARNAT, CETYS-Universidad de Quintana Roo, 654 p. Mendoza, M.V., Villanueva E. E. y Maderey, E.L. 2008. Vulnerabilidad en el recurso agua de las zonas hidrológicas de México ante el Cambio Climático Global. En: Cambio Climático: una visión desde México. Julia Martínez y Adrián Fernández (Compiladores) SEMARNAT, Instituto de Ecología, septiembre2008.Cuarta reimpresión. Mexicano, G., M.A. Liceaga-Cintora, L.U. Arellano-Méndez y H. Hernández. 2003. Space and Systematic Characterization of the Superficial Silts of Bay of the Ascension, Quintana Roo. National Congress of Science and Technology of the Sea. 16 at 18 October, Boca del Rio, Veracruz. Mileti, D. 1999. Disasters by Design: A Reassessment of Natural Hazards in the United States. Washington, D.C.: Joseph Henry Press. Mitchell, J.M. 1991. Carbon Dioxide and Future Climate. Weatherwise, August September, pp. 17-23. Michener, W.K, E.R. Blood, K.L. Bildstein, M.M. Brinson y L.R. Gardner. 1997. Climate change, hurricanes and tropical storms, and rising sea level in coastal wetlands. Ecological Applications 7 (3): 770-801. Millenium Ecosystem Assessment. 2005. Organización de las Naciones Unidas. www.MAweb.org Mitigación del cambio climático y adaptación en la agricultura, la silvicultura y la pesca” y el comunicado de prensa de 2008. Mitsch, W.J. y J.G. Gosselink. 2000. Wetlands. John Wiley & Sons. N. York. 3. Edición. 920 pp. Molina, A. 2006. Caracterización de las comunidades de corales escleractineos del municipio de solidaridad, Quintana Roo, México. Revista de Medio Ambiente, Turismo y Sustentabilidad: 2(1): 115-124. Monte, P., V. Guzmán. E. Cuevas, F. Arreguín-Sánchez, M.C. Jiménez-Quiroz y D. Lluch-Belda. 2008. Rise and decline of the hawksbill turtle in the southern Gulf of Mexico as response to short and long term environmental variation. Coping with global change in marine social-ecological systems. 8-11 julio, FAO Roma, Italia. Disponible en: http://web.pml.ac.uk/globec/structure/fwg/focus4/symposium/posters.htm Morales, E.M., A. Cisneros-Mata, M.O. Nevárez-Martínez y A. Hernández-Herrera. 2001. Review of stock assessment and fishery biology of Dosidiscus gigas in the Gulf of California, México. Fisheries Research, 54(1), December, pp. 83-94. Moreno, P., Espejel I, Castillo S, Castillo-Campos G, Durán R, Pérez-Navarro JJ, León JL, Olmsted I, Trejo-Torres J. 1998. Flora de los ambientes arenosos y rocosos de las costas de México. En: Halffter, G. (Ed.). Biodiversidad en Iberoamérica. Vol. II. CYTED- Instituto de Ecología A.C.: 177-258. Moreno, P. 2004. Playas y dunas del Golfo de México. Una visión de su situación actual. En: M. Caso, I. Pisanty y E. Escurra (comp.). Diagnóstico ambiental del Golfo de México. SEMARNAT (INE)-INECOL-Harte Research Institute for Gulf of México Studies. 491-520. Moreno, P., E, Peresbarbosa y A.C. Travieso-Bello. (Eds). 2006. Estrategias para el manejo integral de la zona costera: un enfoque municipal. Instituto de Ecología A.C.-Comisión Nacional de Areas Naturales Protegidas, SEMARNATGobierno del Estado de Veracruz. Xalapa, Ver., México. Volumen I, II y III. 1251 pp Morreale, S.J., G.J. Ruiz, J.R. Spotila y E.A Standora. 1982. Temperature dependent sex determination: Current practices threaten conservation of sea turtles. Science, 216:1245-1247. Morreale, S.J. y E. A. Standora. 2005. Western North Atlantic Waters: Crucial Developmental Habitat for Kemp's Ridley and Loggerhead Sea Turtles Chelonian Conservation and Biology, 4(4):872-882. Morrison, J., M. Seele, R. Andersen. 1998. Hydrography of the upper Arctic Ocean measured from the nuclear submarine U.S.S Pargo. Deep-Sea Research 45, 15–38. Mrosovsky, N. y C. Yntema. 1995. Temperature dependence of sexual differentiation in sea turtles: Implications for conservation practices. World Conference on Sea Turtle Conservation, Wash., D. C., 59-65. Muscatine, L., V. M. Weis. 1992. Primary Productivity and Biogeochemical Cycles in the Sea P. G. Falkowski, A. D. Woodhead, Eds. (Plenum Press, New York, 1992) pp. 257-271. Nuevo Altas Nacional de México. 2007. Universidad Nacional Autónoma de México, Instituto de Geografía. EXIV, EXIV 1 - EXIV 17. Natal y Sandoval. 2004. Capital Social: una revisión crítica para el estudio de la acción colectiva en OBC. Colegio Mexiquense. Documento de discusión sobre el Nuevo Institucionalismo, 8:14. Neckles, H.A., R.L. Wetzel, R.J. Orth, 1993. Relative effects of nutrient enrichment and grazing on epiphyte-macrophyte (Zostera marina L) dynamics. Oecologia 93: 285-295. Nesa, B. M. Hidaka. 2009. High zooxanthella density shortens the survival time of coral cell aggregates under thermal stress. Journal of Experimental Marine Biology and Ecology 368:81-87. 111 Ng’ang’a, S.M., A. Campos, M. Sutherland y S.E. Nichols. 2001. Supporting Coastal and Marine Monitoring by Remotely Accessing Data Using Spatial Fusion and WAP. In: Proceeding of the 4th International Symposium on Computer Mapping and GIS for Coastal Zone Management: CoastGIS Conference, Halifax, Nova Scotia, June 2001. Níkel, J. y R. Klein. 2003. DINAS-COAST: Developing a Method and a Tool for Dynamic and Interactive Vulnerability Assessment. Loicz Newsletter 27:1-4. NOAA, 2009. The Saffir-Simpson Hurricane Scale (en línea). National Weather Service. National Hurricane Center. NOAA, 2005. “NOAA reviews record-setting 2005 Atlantic hurricane season”, National Oceanic and Atmospheric Administration. NOM-059-SEMARNAT-2001. Norma oficial mexicana. Protección ambiental – especies nativas de México de flora y fauna silvestres-categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-lista de especies en riesgo. Diario Oficial de la Federación, miércoles 6 de marzo de 2002, segunda sección: 1-153pp. Nugent, R.S., E.Jordan, R.de la Torre.1978. Investigaciones preliminares de la biomasa de Thalassia testudinum Koning, en la costa del Caribe Mexicano: Nota Científica. Anales del Centro de Ciencias del Mar y Limnolgía. Volumen 5, 1978 Número 1, 1-306 Ñiquen, M. y M. Bouchon. 2004. Impact of El Niño events on pelagic fisheries in Peruvian waters. Deep Sea Research Part II: Topical Studies in Oceanography, 51(6-9), March-May, pp. 563-574. Odum, E.P. 1982. Ecología. Ed. Interamericana 3ª ed. México, 639 p. Oilwatch, 2005. Disponible en: http://www.oilwatch.org/index.php?option=com_content&task=view&id=112&Itemid=43&lang Olmsted, I. 1993. Wetlands of Mexico. En: D. F. Whigham, D. Dykyjová y S.Hejnÿ, (eds.) Wetlands of the world I: inventory, ecology and management. Handbook of Vegetation Science. Kluwer Academic Publishers, Dordrcht: 637678. OMM/PNUMA/IPCC. 1997. Resumen para responsables de políticas. Impactos regionales del cambio climático: Evaluación de la vulnerabilidad. 16 p. Orth, R.J., K.A,. Moore. 1988. Distribution of Zostera marina L. and Ruppia maritima L. sensulato along depth gradients in the lower Chesapeake Bay, USA. Aquatic Botany 32: 291-305. Ortiz, M., S. K. Singh, V. Kostoglodov and J. Pacheco, Source areas of the Acapulco-San Marcos, Mexico earthquakes of 1962 (M 7.1; 7.0) and 1957 (M 7.7), as constrained by tsunami and uplift records, Geofís. Int., 39, 4, pp. 337-348, 2000. Ortiz, M. A. 1992. Retroceso reciente de la línea de costa del frente deltaico del río San Pedro, Campeche-Tabasco. Investigaciones Geográficas. Boletín del Instituto de Geografía. 25:7-23. Ortiz, M.A. 1994. Repercusiones del ascenso del nivel del mar en el litoral del Golfo de México: un enfoque geográfico de los problemas del cambio global. En: C. Gay, L.G. Ruiz, M. Imaz, C. Conde y O. Sánchez (Eds.) Memorias del 1er Taller de estudio del país: México. México ante el cambio global. Memorias. Cuernavaca 18-22 abril, 1994. Instituto Nacional de Ecología, UNAM. 191-196. Ortiz, M.A. y R.L.M. Espinosa. 1991. Clasificación geomorfológica de las costas de México. Geografía y Desarrollo 2 (6): 2-9. Ortiz, M.A., C. Valverde y N.P Psuty. 1996. The impacts of sea level rise and economic development on the low-lands of the Mexican Gulf coast. En: A.V. Botello, J.L. Rojas-Galaviz, J.A. Benítez y D. Zárate (Eds.) Golfo de México. Contaminación e impacto ambiental: diagnóstico y tendencias. Universidad Autónoma de Campeche. EPOMEX. Serie Científica 5. 459-470. Ortiz, M.A. y J. Benítez. 1996. Elementos Teóricos para el Entendimiento de los Problemas de Impacto Ambiental en Planicies Deltaicas: la región de Tabasco y Campeche. p 483-503. Botello, A. V., J. L. Rojas-Galaviz, J. Benítez y D. Zárate-Lómeli (Eds.). En Golfo de México, Contaminación e Impacto Ambiental: Diagnostico y Tendencias. EPOMEX, Serie Científica 5. Ortiz, P. M.A. y A.P. Méndez L. 1999. Repercusiones por ascenso del nivel del mar en el litoral del golfo de México. En: Gay G. C. (comp). 1999. México: una visión hacia el siglo XXI. El Cambio Climático en México. Centro de Ciencias de la Atmosfera. Ortiz, M.A. y A.P. Méndez Linares. 2003. Vulnerabilidad al ascenso del Nivel del mar y sus implicaciones en las costas Bajas del Golfo de México y Mar Caribe. Gay, C. (Ed). México: una visión hacia el Siglo XXI. El cambio climático en México. UNAM. Ortiz, M.A. y A.P. Méndez Linares. 2004. Repercusiones por ascenso del nivel del mar en el Litoral del Golfo de México. pp 73-85.Rivera Arriaga, E., G. J. Villalobos, I. Azuz Adeath, y F. Rosado May (Eds.), El Manejo Costero en México. Universidad Autónoma de Campeche, SEMARNAT, CETYS-Universidad, Universidad de Quintana Roo. 73-85 pp. Ortiz, M.A. y G. de La Lanza Espino. 2007. Diferenciación del espacio costero de México: un inventario regional. Instituto de Geografía. Serie Textos Universitarios. UNAM. 138 pp. Ostrom, E. 2000. El Gobierno de los Bienes Comunes. La evolución de las instituciones de Acción Colectiva. Primera Edición. UNAM, Crim, FCE. México. 112 Padilla, C. 2006. Metodología utilizada en el estudio de la comunidad arrecifal de las playas del Municipio Solidaridad: Generalidades. Revista de Medio Ambiente, Turismo y Sustentabilidad: 2(1): 69-78. Páez, F. 2008. Efectos del cambio climático para las costas, la pesca y la producción acuícola: una síntesis. Centro de Estudios de Justicia Agraria. V Reunión Nacional de Magistrados de los Tribunales Agrarios. Revista de los Tribunales Agrarios. No. 44. pp. 54-63. Páez, F., G. Ramírez-Reséndiz, A.C. Ruíz-Fernández y M.F. Soto-Jiménez, 2007. La Contaminación por Nitrógeno y Fósforo en Sinaloa: Flujos, Fuentes, Efectos y Opciones de Manejo. UNAM, ICMyL, Colegio de Sinaloa, SEMARNAT, CONACyT. Palacio, Á. G. 2004. Riesgos naturales y susceptibilidad del terreno ante la ocurrencia de huracanes. Aplicación de SIG en la costa baja acumulativa del suroeste de Campeche. Cap. 19: 287-306. In: Rivera Arriaga E., G.J. Villalobos Zapata, I. Azuz Adeath y F. Rosado May (Eds), El Manejo Costero en México.. Universidad Autónoma de Campeche, SEMARNAT, CETYS-universidad, Universidad Autónoma de Quintana Roo. 654 p. Pandolfi, J.M. y J. Jackson. 2006. Ecological persistence interrupted in Caribbean coral reefs. Ecological Letters 9:818826. Pannier, F. 1992. El ecosistema de manglar como indicador de cambios globales en la zona costera tropical. Ciencia. 43:11-113. Páramo, S. 1984. Ictiofauna del Río González y lagunas adyacentes, Tabasco, México. Universidad y Ciencia 1:2:5-19. Parrotta, J. A. 1993. Casuarina equisetifolia L. ex J.R. and G. Forst. Casuarina, Australian pine. SO-ITF-SM-56. New Orleans, LA: U.S. Department of Agriculture, Forest Service, Southern Forest Experiment Station. Parry, M.L., O.F. Canziani, J.P. Palutikof, P.J. van der Linden y C.E. Hanson (eds.). 2007. Impacts, Adaptation and Vulnerability. Contribution of Working Group II to the Fourth Assessment Report of the IntergovernmentalPanel on Climate Change. Cambridge University Press, Cambridge, UK, and New York, pp. 315-356. Nordstrom, K.F., 2000: Beaches and Dunes of Developed Coasts. Cambridge UniversityPress, New York, 338 pp. Patriquin, D.G. 1975. Migration of blowouts in seagrass beds at Barbados and Carriacou, West Indies and its ecological and geological implications. Aquatic. Botany 1: 163-189. PEMEX, IMP, UNAM, Battelle. 1999. Diagnóstico de los Efectos Ambientales de la Industria Petrolera Asociados a la Región Sur de PEP (PARS). Versión [CD-ROOM]. Informe final. VI Volúmenes. México: UNAM. Penchaszadeh, P.E. y J.J.Salaya. 1985. Estructura y ecología trófica de las comunidades demersales en el Golfo Triste, Venezuela. Cap-12: 571 a 598. In: Yañez-Arancibia, A. (ed.). Recursos Pesqueros Potenciales de México: La pesca acompañante del camarón. Progr. Inv. de Alimentos, ICMyL, INP, UNAM, México, D.F., 748 p. PEP-UAEM, 2008. Estudio de la Dinámica Costera del litoral norte del municipio del Carmen, Campeche. 522pp. Pethick, J. 2001. Coastal management and sea-level rise. References and further reading may be available for this article. To view references and further reading you must purchase this article.CATENA 42 (2-4): 307-322. Pfeffer, W.T., J.T.Harper, S, O.' Neel. 2008. Kinematic Constraints on Glacier Contributions to 21st-Century Sea-Level Rise. Science 321: 1340. Pérez, J.F. y J.J. Mendoza. 1998. Marine Fisheries, Genetic Effects and Biodiversity. Naga, The ICLARM Quarterly, OctDec.: pp. 7-14. Perrilliat, M. C. 1960. Moluscos del Mioceno de la Cuenca salina del Istmo de Tehuantepec, México. Univ. Nal. Autón. México, Inst. Geol. Paleontología Mexicana 8: 1-38. Phillips, R.C., R.L.Lewis III. 1983. Influence of environmental gradients on variations in leaf widths and transplant success in North American seagrasses. Maine Technology Society Journal 17: 59-68. Petit, J. R.J.,D. Jouzel, N. I.Raynaud, J.-M.Barkov, I. Barnola, M. Basile, J.Bender, M.Chappellaz, G.Davisk, Delaygue, V. M.Delmotte, M.Kotlyakov., V. Y. Legrand, C. Lipenkov, L.Lorius, C.Pe´ Pin, E.M.Ritz, Saltzmank y M. Stievenard. 1999. Climate and atmospheric history of the past 420,000 years from the Vostok ice core, Antarctica. Nature 399, 429. Pilkey, H.O. y J.A. Cooper. 1994. Climate. Society and sea level rise. Science 303: 1781-1782. Pinilla, C. 1995 “Elementos de teledetección”, RAMA, Madrid. “Teleobservación Satelital de ambientes costeros: conceptos básicos y sus aplicaciones”, Karszenbaum, H.; Gagliardini, A.; Dogliotti A. y Bava, J. Universidad Nacional de la República, Agosto. Pilkey, O.H. y T.W.Davis. 1987, An analysis of coastal recession models, North Carolina coast, in D. Nummedal, O.H. Pilkey and J.D. Howard, eds., Sea-level Fluctuation and Coastal Evolution: SEPM (Society for Sedimentary Geology) Special Publications No. 41, Tulsa, Okla., p. 59-68. Pitcher, T.J. y P.J.B. Hart. 1982. Fisheries ecology. Croom Helm and Am. Ed., 414 p. PNUD, 2007. Informe sobre Desarrollo Humano México 2006-2007. México: Programa de Naciones Unidas para el Desarrollo. PNUD, 2008a. Índice de Desarrollo Humano Municipal en México 2000-2005.México: Programa de Naciones Unidas para el Desarrollo. PNUD, 2008b. Informe sobre Desarrollo Michoacán 2007. México: Programa de Naciones Unidas para el Desarrollo. 113 PNUD, 2005b. Informe sobre desarrollo humano México 2004. México: Ediciones Mundi-Prensa. Psuty, N. P. 1965. Beach-Ride Development in Tabasco. Annals of the Association of American Geographers, vol. 55 México, pp. 112-124. Psuty, N. P. 1967. The Geomorphology of Beach Ridges in Tabasco, México. Coastal Studies Series No. 18, Louisiana State University Press, Baton Rouge. Pulich Jr., W.M. 1985. Seasonal growth dynamics of Ruppia maritima and Halodule wrightii in southern Texas, USA and evaluation of sediment fertility status. Aquatic Botany 23: 53-66. Rahmstorf, S. 2007. A Semi-Empirical Approach to Projecting Future Sea-Level Rise. Science 315: 368–70 Ramírez, J.C., I. Peña-Ramírez y D. Villanueva-Flores, 1991. Distribución y abundancia de la tortuga perica, Caretta caretta gigas, Linnaeus (1758), en la costa occidental de Baja California Sur, México. Archelon, 1(2):1-4. Ramírez, G.P., B.J.López Ocaña. 1998. Mangrove vegetation assessment in the Santiago River Mouth, Mexico, by means of supervised classification using Landsat TM imagery. Forrest Ecology and Management 105 (1-3):217-229. Randall, J. E. 1965. Grazing effect on seagrasses by herbivorous reef fishes in the West Indies. Ecology 46:255-260. Rangel Ruiz, L. J. 2000. Estudio taxonómico de moluscos terrestres y dulceacuícolas de la región maya de México I. Reserva de la Biosfera Pantanos de Centla. Universidad Juárez Autónoma de Tabasco. Informe final SNIBCONABIO proyecto No. M068. México D. F. Rebstock, G. A. 2003. Long-term change and stability in the California current System: lessons from CalCOFI and other long-term data sets. Deep Sea Research Part II: Topical Studies in Oceanography, 50(14-16), August, pp. 2583-2594. Reséndez, M. A., Salvadores, M. L. 2000. Peces de la Reserva de la Biosfera “Pantanos de Centra”. Resultados preliminares. Universidad y Ciencia 15:30:141-146. Revelle, R. 1983. Probable future changes in sea level resulting fromincreased atmospheric carbon dioxide. Changing Climate. National Academy Press, Washington, District of Columbia, 433-448. Ripa, P., Toward a Physical Explanation of the Seasonal Dynamics and Thermodynamics of the Gulf of California, Journal of Physical Oceanography Volume 27, 5, 597–614 1997. Ritchie, K.B. y G.W. Smith. 2005. Coral Health and Disease. IN E. Rosenberg y Y. Loya (Eds.)pp. 259-264. ISBN 3540-20772-4 Springer-Verlag. Rico, G.V., M. Palacios. 1996. Salinidad y el nivel de agua como factores en la distribución de la vegetación en la ciénega del NW de Campeche, México. Acta Botánica Mexicana 34:53-61. Robinson, R. A., H.Q.P. Crick, J.A. Learmonth, I.M.D. Maclean, C.D. Thomas, 2008. Traveling through a warming world: climate change and migratory species. Endangered Species Res. Published online June 17, 2008. 13pp. Roble, M.B., y J.C. Zieman. 1984. Diet variation in the fish fauna of a tropical seagrass feeding ground. Bulletin of Marine Science 34: 335-345. Rodríguez, H. 2006. Desarrollo Humano y Desastres en Veracruz. pp 73-89. En: Inundaciones 2005 en el Estado de Veracruz.1 Universidad Veracruzana. Rodríguez, R.E., A.T. Banaszak, E.Jordán-Dahlgren. 2001. Necrotic patches affect Acropora palmate (Scleractinia: Acroporidae) in the Mexican Caribbean. Diseases of Aquatic Organisms 47(3): 229-234. Rojas, P.M. y I. Fernández-Méndez. 2006. La pesca en aguas continentales. En: Pesca, Acuacultura e Investigación en México. Guzmán-Amaya, P. y D. F. Fuentes-Castellanos. (Coord.) CEDRSSA/Comisión de Pesca. Cámara de Diputados. pp 49-67. Rojo, J.A., B. Aguilar-Palomino, V.H. Galván-Piña, E. Godínez-Domínguez, S. Hernández-Vázquez, S. Ruíz-Ramírez y G. Lucano-Ramírez. 2001. Ictiofauna de la pesquería ribereña en Bahía de Navidad, Jalisco, México, asociada al evento El Niño 1997-1998. Revista Biologica Tropical 49(3-4): pp 915-929. Romer, Alfred S. 1956. Osteology of the reptiles. The Univ. Of Chicago Press. Chic. Ill., 772pp Romero, G. J, M. A. García, J. A. Bautista, A. P. H. Pérez 2000. Caracterización de la Reserva de la Biosfera Pantanos de Centla. Universidad y Ciencia 15(30):15-20. Ropelewski, C. F. y M. S. Halpert. 1986. North American precipitation and temperature patterns associated with the El Niño/Southern Oscillation (ENSO). Monthly Weather Review 114:2352-2362. Rothwell, R.G. 1989. “Minerals and Mineraloids in Marine Sediments”, Elsevier Applied Science, London, 278 pp. Rosengaus, M. 1998. Efectos destructivos de ciclones tropicales, MAPFRE Ed. 251p Rosenzweig, C., G. Casassa, D.J. Karoly, A. Imeson, C. Liu, A. Menzel, S. Rawlins, T.L. Root, B. Seguin, P. Tryjanowski, 2007: Assessment of observed changes and responses in natural and managed systems. Climate Change 2007: Impacts, Adaptation and Vulnerability. Contribution of Working Group II to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change, M.L. Parry, O.F. Canziani, J.P. Palutikof, P.J. van der Linden and C.E. Hanson, Eds., Cambridge University Press, Cambridge, UK, 79-131. Ruiz, L.A., R.C.A.Berlanga. 1999. Modifications in coverage patterns and land use around the Huizache-Caimanero lagoon system, Sinaloa, Mexico: A multi-temporal analysis using LANDSAT images. Estuarine Coastal and Shelf Science 49(1):37-44. 114 Ruiz, A.C., F. Páez-Osuna, M. Frigmani, T. Tesi, y H. Bojórquez-Leyva (2007).Recent Sedimentary History of Organic Matter and Nutrient Accumulation in the Ohuira lagoon, NW Mexico. Archieves of environmental contamination and toxicology. 53(2):159-167. Saba, V., P. Santidrián-Tomillo, R. D. Reina, J. R. Spotila, J. A. Musick, D. A. Evans y F. V. Paladino. 2007. The effect of El Niño-Southern Oscillation on the reproductive frequency of eastern leatherback turtles. Journal of Applied Ecology, 44:395-404. Saenger, P. 2002. Mangrove Ecology, Silviculture and Conservation. Kluwer Academic Publishers: 291-294. Sáenz, A. 2000. Servicios ambientales de los manglares: ¿Qué perdemos cuando los transformamos? Greenpeace. Expedientes ambientales. Manglares bosques costeros. 53 p. Saffran, K., K. Cash, y K. Hallard. 2001. Canadian water quality, guideline for the protection of aquatic life. Canadian Council of Minister of Enviroment. CCME WATER QUALITE INDEX 1.0 User´s Manual: 1-5. SAGARPA, 2003. Anuario estadístico de pesca 2002. Comisión Nacional de Acuacultura y Pesca, 266 p. SAGARPA, 2005. Anuario estadístico de pesca 2005. Comisión Nacional de Acuacultura y Pesca, 220 p. SAGARPA, 2007 (en prensa). Anuario estadístico de pesca 2006. Comisión Nacional de Acuacultura y Pesca. Sahagian, D.L. y S.M.Holland. 1991. Eustatic Sea-Level Curve Based on a Stable Frame of Reference: Preliminary Results, Geology 19: 1208-1212. Salazar, S. I., 1998. Calentamiento global y efectos costeros. Ava. Cient, 25:10-20. Salvadores, B. M. L. y M. A. Reséndez. 1990. Modificaciones en la composición ictiofaunística del sistema lagunar El Carmen-Machona Tabasco, por la apertura de Boca de Panteones. Universidad y Ciencia 7:14:5-13 Sanchez, A, J A Guimenez, H. I Valdemono y V. Gracia. 2008. Implications of climatic change on Spanish Mediterranean low-lying cots: the Ebro delta case. Journal of Coastal research. 24 (2): 306 316. Sánchez, A.J., M.A Salcedo, R. Florido, A. Armenta, C. Rodríguez-Leal, A. Galindo y E. Moguel. 2007. Pantanos de Centla, un humedal costero tropical. En: De la Lanza Espino y S. Hernández-Pulido (comp.) Las Aguas Interiores de México, Conceptos y Casos. AGT Editor, S.A. México. 399-422. Sánchez, P., A. Yañez-Arancibia, J. Ramírez-Gordillo, J.W. Day, Templet, P.H. 2004. Some socio-economic indicators in the Mexican status of Gulf of Mexico. Ocean & Coastal Management 47 (11-12):581-597. Sánchez, S. N., L.R. Garduño y R.P. Negrete. 2005. Análisis del nivel del mar en seis puertos del Golfo de México a través de un método alternativo; Depto. El Hombre y su Ambiente, UAM-Xochimilco. Depto. Climatología. Centro de Ciencias de la Atmósfera, UNAM. Contactos 57, 21-27. Sánchez, N. 1999. El Cambio Global en Golfo y Caribe Mexicano y su influencia en doce pesquerías de importancia comercial. Tesis de Doctorado. Facultad de Ciencias. UNAM. 450 pp. Sánchez, L., J.E. Valdez-Holguín, B. Shirasago, M.A. Cisneros y A. Zarate. 2002. Changes in the Spawning Environment of Sardinops caeruleus in the Gulf of California during El Niño 1997–1998. Estuarine, Coastal and Shelf Science, 54(2): 207-217. Sand, K., 1977. Effect of epiphytes on eelgrass photosynthesis. Aquat. Bot. 3, 55-63. Sand, K., Borum, J., 1991. Interactions among phytoplankton, periphyton, and macrophytes in temperate freshwaters and estuaries. Aquat. Bot. 41, 137-175. Sand, K., Revsbech, N.P., 1987. Photosynthesis and light adaptation in epiphyte macrophyte associations measured by oxygen microelectrodes. Limnol. Oceanogr. 32, 452-457. Sanger, C. 1987. Ordering the Oceans: The making of the law of the sea. University of Toronto Press. Saunders, M. A. y Adam S. Lea1, 2008. Large contribution of sea surface warming to recent increase in Atlantic hurricane activity. Nature 451, 557-560 (31 January 2008) DOI: 10.1038/nature06422 Schallenberg, M., C.J. Hall and C.W. Burns. 2003: Consequences of climate-induced salinity increases on zooplankton abundance and diversity in coastal lakes. Marine Ecol. Prog. Ser., 251, 181–189. Schimak, G. 2005. Environmental Knowledge and Information Systems. Environmental Modelling & Software 20 (2005) 1457 – 1458. Schlacher, T.A., J. Dugan, D.S. Schoeman, M. Lastra, A. Jones, F. Scapini, A. McLachlan y O. Defeo. 2007. Sandy beaches at the brink. Diversity and Distributions 13 (5):556-560. Schneider, S.H., 1994. Detecting climatic change signals: Are there any fingerprints? Science 263, 341-347. Secretaria de Marina, 2002. Atlas de Contaminación Marina en el Mar Territorial y Zonas Costeras de la República Mexicana. Secretaria de Marina, Armada de México 176 pp. Secretaría CIT, 2004, Convención Interamericana para la Protección y Conservación de las Tortugas Marinas –Una Introducción. Septiembre 2004, 33pp. Segnestam, L., Winograd M. y Farrow Andrew. 2000. Desarrollo de indicadores: Lecciones Aprendidas de América Central. Banco Internacional para la Reconstrucción y el Desarrollo / Banco Mundial. Washington, D.C. SEMARNAP, 1997. México. Primera Comunicación Nacional ante la Convención Marco de las Naciones Unidas Sobre el Cambio Climático. 115 SEMARNAP, 1999. NORMA Oficial Mexicana de Emergencia NOM-EM-001-RECNAT-1999, Que establece las especificaciones para la preservación, conservación y restauración del manglar. D. O. F. 16 de agosto. 1ª. Sección. pp. 33-39. SEMARNAP, 2000. Anuario Estadístico de Pesca 1999. Secretaría de Medio Ambiente, Recursos Naturales y Pesca, 271 p. SEMARNAP/DGAP, 2000. Federaciones y/o uniones regionales de sociedades cooperativas de la industria pesquera y otras formas de organización social que operan a nivel nacional. Documento interno. SEMARNAP –INP, 2000. Sustentabilidad y Pesca Responsables en México. Evaluación y Manejo. [Versión CD]. SEMARNAP. México. Shaw, J., Taylor, R.B., Forbes, D.L., Ruz, M.H., and Solomon, S., 1998, Sensitivity of the Canadian Coast to Sea-Level Rise: Geological Survey of Canada Bulletin 505, 114 p. Short, F.T., H.A. Neckles. 1999. The effects of global climate change on seagrasses. Aquatic Botany 63:169–196. Short, F.T., S. Wyllie-Echeverria.1996. Natural and human-induced disturbance of seagrasses. Environ. Conservation 23(1), 17-27. Short, F.T., D.M. Burdick, J.E. Kaldy. 1995. Mesocosm experiments quantify the effects of eutrophication on eelgrass, Zostera marina L. Limnology. Oceanography 40: 740-749. Short, F.T., 1987. Effects of sediment nutrients on seagrasses: Literature review and mesocosm experiment. Aquat. Bot. 27, 41-57. Short, F.T., C.A. Short. 1984. The seagrass filter: Purification of estuarine and coastal water. In: Kennedy, V.S. (Ed.), The Estuary as a Filter. Acadamic Press, Orlando, pp. 395-413. Short, F.T., 1980. A simulation model of the seagrass production system. In: Phillips, R.C., McRoy, C.P. (Eds.), Handbook of Seagrass Biology: An Ecosystem Perspective. Garland STPM Press, New York, pp. 275-295. Smith, D. J., J.D. Suggett, R. Neil, N.R. Baker. 2005. Is photoinhibition of zooxanthellae photosynthesis the primary cause of thermal bleaching in corals? Global Change Biology 11: 1–11. Smith, J.B. y Co-authors. 2001. Vulnerability to Climate Change and reasons for concerns: a synthesis, Climate Change 2001. Impacts, adaptation and vulnerability. Contribution of Working Group II to the Thrid assessment Report of the Intergovermental Panel on Climate Change. J.J. Carthy, O.F. Canziani, N.A. Leary, D.J. Dokken, and K.S. White. Eds. Cambridge University Press, Cambridge, 913-967. Smith, R.C., B.B. Prezelin, K.S. Baker, R.R. Bidigare, N.P. Boucher, T. Coley, D. Karentz, S. MacIntyre, H. Matlick, D. Menzies, M. Ondrusek, Z. Wan, K.J. Waters. 1992. Ozone depletion: Ultraviolet radiation and phytoplankton biology in Antarctic waters. Science 255: 952-959. Snedaker, S.C., J.F. Medder, M.S. Ross and R.G. Ford. 1994. Mangrove ecosystem collapse during predicted sea-level rise: Holocene analogues and implications. J. Coastal Res. 10: 497-498 Sosa, E., M.L.A. Liceaga-Correa y J.C. Seijo. 2008. The Punta Allen lobster fishery: current status and recent trends. In: FAO Fisheries Technical paper 504, Case studies in fisheries self-governance. pp. 149-162. Spotila, J. R., R. R. Reina, A. C. Steyermark, P. T. Plotkin and F. V. Paladino. 2000. Pacific leatherback turtles face extinction. Nature, 405, 529–530. Spotila, J.R. E.A. Standora, S.J. Morreale and G. J. Ruiz de Clark, 1981. Effects of incubation temperature on the sex of hatchling Caribbean green turtles. Final Report to Rutger University for sub-grant activity on USFWS Projet 14-16002-80-222. 29 pp. Stanley, G.D. 2003. The evolution of modern corals and their early history. Earth-Sci. Rev. 60: 195-225. Stoner, A. W. 1983. Distributional ecology of amphipods and tanaidaceans associated with three seagrass species. J. Crust. Biol. 3: 505-518. Struyf, E, S. Van Damme y P. Meire. 2004. Possible effects of climate change on estuarine nutrient fluxes: a case study in the highly nitrified Schelde estuary (Belgium, The Netherlands) Estuarine, Coastal and Shelf Science 60: 649-661. Suárez, C. 1991. Modificaciones naturales y artificiales en las lagunas de Unare y Piritu y sus efectos ambientales. Universidad Pedagógica Experimental Libertador. Instituto Pedagógico de Caracas. Departamento de Ciencias de la Tierra, Caracas. SURVAS (Synthesis and Upscaling of Sea Level Rise Vulnerability Assessment Studies) Sussman. M., B.L. Willis, S.Victor y D.G. Bourne. 2008. Coral pathogens identified for white syndrome (WS) epizootics in the Indo-Pacific. PLoS ONE 3(6) e2393:1-14 Talbot, M.M.B., W.T. Knoop y G.C. Bate. 1990. The dynamics of estuarine macrophytes in relation to flood/siltation cycles. Botany Marine 33: 159-164. Tamayo, J. L. 1970. Geografía moderna de México. Editorial Trillas, México. 390 pp. Technical Report Series TR-E-6 Internat. COSAT. Resour. Manag. Proj. Univ. Rhode Island, N.Y., Gob. of Ecuador and USAID. 121-139 pp. Tejeda, M., A y M.C. Ochoa. 2007. Proyecto Plan de Acción Climática del Estado de Veracruz (México). (Resumen). México: Organización Mexicana de Meteorólogos, A.C. Memoria del Congreso 10071116-01. 116 Tejeda, M. y A. Coord. 2006. Proyecto para desarrollar el Plan de Acción contra el Cambio Climático en el Estado de Veracruz. [Versión Power Point]. México: Universidad Veracruzana. Tepetlán, S. y A.D. Aldana. 2008. Macrofauna bentónica asociada a bancos ostrícolas en las lagunas costeras Carmen, Machona y Mecoacán, Tabasco, México. Revista Biológica Tropical (Int. J. Trop. Biol. ISSN-0034-7744) Vol. 56 (Suppl. 1): 127-137. Thayer, G. W. y A. J. Chester.1989. Distribution and abundance of fishes among basin and channel habitats in Florida Bay. Bulletin Marine Science 44:200-219. Thieler, E.R., y E.S. Hammar-Klose. 2000a, National Assessment of Coastal Vulnerability to Sea-Level Rise: U.S. Pacific Coast. U.S. Geological Survey, Open- 11 File Report 00-178. Thieler, E.R., y E.S. Hammar-Klose. 2000b, National Assessment of Coastal Vulnerability to Sea-Level Rise, U.S. Gulf of Mexico Coast: U.S. Geological Survey, Open-File Report 00-179. Thieler, E.R., y E.S. Hammar-Klose. 1999, National Assessment of Coastal Vulnerability to Sea-Level Rise, U.S. Atlantic Coast: U.S. Geological Survey, Open-File Report 99-593, 1. Thom, B.G. 1982. Mangrove ecology – a geomorphological perspective, In: B.F. Clough, ed. Mangrove Ecosystems in Australia, Australian National University Press, Camberra. P.:3-17. Thom, B.G. 1967. Mangrove ecology and deltaic geomorphology, Tabasco, Mexico. Journal of Ecology 55:301-347. Tomlinson, P.B. 1986. The botany of Mangroves. Cambridge University Press. 450pp. Titus, J.G. 1990. Strategies for adapting to the greenhouse effect. APA Journal 56(3): 311-323. Titus, J.G. 1987. Sea level rise and wetland loss: an overview Greenhouse effect; sea level rise and coastal wetlands, EPA (Environmental Protection Agency), EUA, pp. 1-35. Toledo, A. 2005. Marco Conceptual: caracterización ambiental del Golfo de México, p.25-52. In: A.V. Botello, J. Rendónvon Osten, G. Gold-Bouchot y C. Agraz-Hernández (Eds.). Golfo de México Contaminación e Impacto Ambiental: Diagnóstico y Tendencias. 2da. Edición. Univ. Autón. De Campeche, Univ. Nal. Autón. De México, Instituto Nacional de Ecología. 696 p. Toledo, A. 2004. Entre la ciencia y la política. Integrando los componentes marinos, costeros y continentales del Golfo de México. pp 937-959. Caso-Chávez, M., I. Pisanty, y Ezcurra, E. (Eds). Diagnostico Ambiental del Golfo de México. Mexico: INE –SEMARNAT, Instituto de Ecología, A. C., Hearteresearch Institute for Gulf of Mexico Studies. Toledo, A. 2003. Ríos, costas, mares. Hacia un análisis integrado de las regiones hidrológicas de México. INE-Semarnat, Colegio de México, A.C., Colegio de Machacan, A. C. Torgny Vinje, Terje Brinck Løyning, Igor Polyakov, “EFFECTS OF MELTING AND FREEZING IN THE GREENLAND SEA “, Disponible en: http://www.frontier.iarc.uaf.edu/~igor/research/convec/vinje.pdf Torres, R.V, G.A. Márquez, R.A. Bolongaro-Crevenna, H.J. Cavaría y D.G. Expósito. 2009. Tasa de erosión y vulnerabilidad costera en el estado de Campeche debida a efectos del cambio climático. Torrey, M. 1978. Morfogénesis de los vertebrados. Editorial Limusa, México. 776 pp Travieso, A.C., P. Moreno-Casasola y A. Campos. 2005. Efecto de diferentes manejos pecuarios sobre el suelo y la vegetación en humedales transformados a pastizales. Interciencia 30 (1):12-18. Tudela, F. Coord., 1990. La modernización forzada del trópico húmedo: el caso de Tabasco, México. El Colegio de México. Turner, E., 1991. Factors affecting the relative abundante of shrimp in Ecuador. In: Olsen, S. And L. Arriaga (Eds.)A sustainable shrimp mariculture industry for Ecuador. UICN, 2001. Unión Internacional para la Conservación de la Naturaleza. .Ruling of the IUCN Red List Standards and Petitions Subcommittee on Petitions Against the 1996 Listings of Four Marine Turtle Species. UICN/CSE, 1995. Estrategia Mundial para la Conservación de las Tortugas Marinas. 24 pp. Ulloa, P.A., J.L. Patiño-Valencia, M.L. Guevara-Rascado, S. Hernández-Ventura, R. Sánchez-Regalado y A. Pérez Velázquez. 2008. Peces marinos de valor comercial del estado de Nayarit, México. INP, CRIP Bahía Banderas, Nayarit, 91pp. United Nations Environment Programme, 1995. Global Biodiversity Assessment. Heywood, V. H. y R. T. Watson (eds.). Cambridge University Press, Cambridge, Reino Unido y Nueva York, EE.UU., pp.1140. UNESCO, 2003 The Integrated Strategic Design Plan for the ocean observations module of the Global Ocean Observing System. GOOS REPORT N° 125. IOC Information Documents Series No. 1183. pp. 56-59. Van Tussenbroek, B.I. 1994. The impact of Hurricane Gilbert on the vegetative development of Thalassia testudinum in Puerto Morelos Coral Reef Lagoon Mexico: A retrospective study. Bot. Mar. 37, 421-428. Vázquez, G.F., D.M. Elías, J.E.C. Aguayo y B. Alejandro. 1996. Trace metal species in aquatic samples of the Tabasco Lagoons, Mexico. Environment International 22(3): 377-382. Vázquez, F. 1994. El Sistema lagunar El Carmen-Pajonal-La Machona del Estado de Tabasco: Su hidrodinámica, la estabilidad de sus bocas y de su línea de costa. UNAM. 117 Vega, M. A. 2007. Plan De Conservación Para La Reserva de La Biosfera Pantanos de Centla y El Área De Protección de Flora y Fauna Laguna de Términos.México: Pronatura, The Nature Conservancy, CONANP. Vega, M.A. y M. Hernández de Santillana, 2004. Fish community structure and dynamics in a coastal hypersaline lagoon: Rio Lagartos, Yucatan, Mexico. Estuarine, Coastal and Shelf Science 60: 285-299. Vega, A. 2003. Reproductive strategies of the spiny lobster Panulirus interruptus related to the marine environmental variability off central Baja California, México: management implications. Fisheries research. 65(1-3): 123-135. Velásquez, V., G. 1994. Los Recursos Hidráulicos del Estado de Tabasco..México: UJAT. Centro de Investigaciones de la División Académica de Ingeniería y Tecnología. Unidad Chontalpa. Villamar, C. A., D. Aburto-Perdomo, J. I. Fernández-Méndez, A. Vásquez y P. Rojas-Carrillo. 2007. Políticas para el Fomento de la Producción Pesquera y Acuícola. En: Calva J. L. (Coord.) Desarrollo Agropecuario, Forestal y Pesquero. Agenda para el Desarrollo. UNAM. Miguel Angel Porrúa. Cámara de Diputados. Vol 9: 351-382p. Villers, L y I. Trejo. 1995. Vegetación actual de México y escenario aplicando un incremento de 2°C en temperatura y disminución del 10% en la precipitación. In SEMARNAP-UNAM-US Country Studies. México ante cambio climático. Segundo Taller de Estudio de País, México Vitousek P. M. 1994. Beyond global warming: ecology and global change. Ecology 75(7):1861-1876. Voice, M, N. Harvey y K. Walsh. 2006 (Editors). Vulnerability to Climate Change of Australia’s Coastal Zone: Analysis of gaps in methods, data and system thresholds. Report to the Australian Greenhouse Office, Canberra, Australia. June 2006. Walsh, J. J., T. E. Whitledge, W. E. Esaias, R. L. Smith, S. A. Huntsman, H. Santander and B. R. de Mendiola. 1980. The spawning habitat of the Peruvian anchovy, Engraulis ringens. Deep Sea Research Part A. Oceanographic Research Papers, 27(1): 1-27. Waluda, C.M., C. Yamashiro and P.G. Rodhouse. 2006. Influence of the ENSO cycle on the light-fishery for Dosidicus gigas in the Peru Current: An analysis of remotely sensed data. Fisheries Research. 79(1-2), June, pp. 56-63. Wanless, H.R., L.P.Tedesco, K.M. Tyrrell. 1988. Production of subtidal tubular and surficial tempestites by Hurricane Kate, Caicos Platform British West Indies. Journal Sediment Petrolology 58, 739-750. Watson, R.T., M. C. Zinyowera, R. H. Moss y D.J. Dokken. 1997. Resumen para responsables de políticas. Impactos regionales del cambio climático: evaluación de la vulnerabilidad. Informe especial del Grupo de trabajo II del IPCC. 16 p. Watson, R., M. Zinyowera, R. Moss. 1997. Impactos regionales del Cambio climático: evaluación de la vulnerabilidad. IPCC, Ginebra, Suiza. Watson, R.T., D.L. Arbritton, T. Barker, I.A. Bashmakov, O. Canziani, R. Chris, et al. 2001. Climate Change 2001: Synthesis Report. Intergovermental Pannel on Climate Change, Genova. Ward, L.G., W.M. Kemp, W.R. Boynton. 1984. The influence of waves and seagrass communities on suspended particulates in an estuarine embayment. Maine. Geology 59: 85-103. Wayne, L., M. Byrnes, L Bristsch, S. Penland, P. Wilkey, T. Williams y J. Williams.1993. A method for classifying land loss by geomorphology and process; in Coastlines of the Gulf of México, American Society of Civil Engineers, Nueva York, pp. 85-95. Wibbels, T., Z.-M Hillis-Starr y B. Phillips. 1999. Female-biased sex ratios of hatchling hawksbill sea turtles from a Caribbean nesting beach. Journal of Herpetology 33(1):142-144. Webster, PJ, Holland, G.J., Curry, J.A., H.R. Chang. 2005. Changes in tropical cyclone number, duration, and intensity in a warming environment, Science, 309: 1844-1846. Weil, E., G.W. Smith, D.L. Gil-Agudelo. 2006. Status and progress in coral reef disease research. Diseases of Aquatic Organisms 69:1–7. Weiss y Overpeck Climate Change and Sea Level. (En preparación). Department of Geosciences. University of Arizona. Gould-Simpson Room 208Tucson, AZ. Wentworth, C. K. 1922. A scale of Grade and Class Terms for Clastic Sediments. Journal Geology 30(5): 377-392. West, R.J. 1990. Depth-related structural and morphological variations in an Australian Posidonia seagrass bed. Aquatic Botanic 36:153-166. West, R. C., N.P. Psuty y B. Thom. 1969. The Tabasco Lowlands of Southeastern Mexico. Coast Studies Series No. 27, Louisiana State University Press, Baton Rouge. Whiteford, R. 1999. A Diversity of Ecosystems – Alaska. Endangered Species Bulletin, 24(2):6-7 White, M. y M. W. Downton. 1991. The shrimp fishery in the Gulf of Mexico: relation to climatic variability and global atmospheric patterns. In: M. H. Glantz, R. W. Katz y N. Nicholls (Eds). Teleconnections linking worldwide climate anomalies. Scientific basis and societal impact. Cambridge University Press. U. K. PP459-491. West, R.C., N. P. Psuty y B.G. Thom. 1985. Las Tierras Bajas de Tabasco, en el Sureste de México. Biblioteca Básica Tabasqueña. Gobierno del Estado de Tabasco. Wigley T.MI., M. Salmon, M. Hulme, S.C.B. Raper. 2009. Model for the Assessment of Greenhouse-gas induced Climate Change (MAGICC, 5.3). NCAR, Boulder, Colorado. 118 Woolard, J., R.M. Engeman, H.T. Smith y J. Griner. 2004. Cheloniidae (marine turtle) nest predation. Herpetological review 35(4):379-380. Woolf, P. 1997. Topografía. alfaomega. 9° Edición. 634 pp. Wilkinson, C. y D. Souter. 2008. Status of Caribbean Coral Reefs after Bleaching and Hurricanes in 2005. Global Coral Reef Monitoring Network and Reef and Rainforest Research Centre, Townsville Australia 152 p. Williams, S.L., W.C. Dennison. 1990. Light availability and diurnal growth of a green macroalga Caulerpa cupressoides and a seagrass Halophila decipiens. Marine Biology 106: 437-444. Wolff, M., M. Taylor, J. Mendo y C. Yamashiro. 2007. A catch forecast model for the Peruvian scallop (Argopecten purpuratus) based on estimators of spawning stock and settlement rate. Ecological Modelling. 209(2-4), December, pp. 333-341. Worcester, S.E. 1995. Effects of eelgrass beds on advection and turbulent mixing in low current and low shoot density environments. Maine. Ecololgy Programme Service 126: 223-232. WorldFish Center, 2007. The threat to fisheries and aquaculture from climate change. Policy Brief. 8 p. WorldFish Center, 2007. Fisheries and aquaculture can provide solutions to cope with climate change. 4 p. Worrest, R.C. 1989. What are the effects of UV-B radiation on marine organisms? In: Schneider, T. et al. (Eds.), Atmospheric Ozone Research and its Policy Implications. Elsevier, Amsterdam, The Netherlands, pp. 269-278. Yáñez, A, R.R. Twilley y A. L. Lara-Domínguez. 1998 b. Los ecosistemas de manglar frente al cambio climático global. Madera y Bosques 4(2):3-19 3. Yáñez, E., M. A. Barbieri, C. Silva, K. Nieto y F. Espíndola. 2001. Climate variability and pelagic fisheries in northern Chile. Progress in Oceanography, 49(1-4): 581-596. Yañez, A., Lara-Domìnguez, A. L., Sánchez-Gil, P. y Day, J. 2004. Interacciones ecológicas estuario-mar: marco conceptual para el manejo ambiental costero. pp 433-490. Caso-Chávez, M., I. Pisanty, y Ezcurra, E. (Eds). Diagnostico Ambiental del Golfo de México. Mexico: INE –SEMARNAT, Instituto de Ecología, A. C., Hearte Research Institute for Gulf of Mexico Studies. Yetter, J. Ch. 2004. Hydrology and geochemistry of freshwater wetlands on the Gulf coast of Veracruz, México. Thesis Master of Science. University of Waterloo, Ontario, Canada. 168 pp. Zavala, J. 2009. Variaciones del nivel del mar en estaciones mareográficas del Golfo de México. Comunicación personal. Servicio Mareográfico Nacional, UNAM. Zavala, J. 1996. Impacto de las Actividades Petroleras sobre la Hidrología Superficial del Distrito de Agua Dulce, Tabasco, México, p 505-520. Botello, A.V., J. L. Rojas-Galaviz, J. A. Benítez, D. Zarate-Lomelí (Eds). Golfo de México, Contaminación e Impacto Ambiental: Diagnóstico y Tendencias. Universidad Autónoma de Campeche. EPOMEX. Serie Científica, 5. Zavala, J. 1988. Regionalización Natural de la Zona Petrolera de Tabasco. Instituto Nacional de Investigaciones de los Recursos Bióticos y Gob. Edo. De Tabasco. Villahermosa, Tabasco, México. Zavala, J., S. L. Morey, and J. J. O’Brien, Seasonal circulation on the western shelf of the Gulf of Mexico using a highresolution numerical model, J. Geophys. Res., 108(C12), 3389, doi:10.1029/2003JC001879,2003. Zervas, C., 2001. Sea Level Variations of the United States 1854-1999, NOAA Technical Report NOS CO-OPS 36, 201 p.12. Zimmerman, M.S., R. J. Livingston. 1976. Seasonality and physicochemical ranges of benthic macrophytes from a North Florida estuary Apalachee Bay USA. Contribution Marine Science. 20: 33-45. Zimmerman, R.C., Smith, R.D., Alberte, R.S., 1989. Thermal acclimation and whole-plant carbon balance in Zostera marina L. (eelgrass). J. Exp. Mar. Biol. Ecol. 130: 93-109. Zurita G., J.C. R. Herrera y B. Prezas. 1993. Tortugas marinas del Caribe. En: Biodiversidad marina y costera de México. S. I. Salazar-Vallejo y N E. González (eds). Comisión Nacional Biodiversidad y CIQRO, México. 865: 735-751. 119 Páginas electrónicas consultadas: http://www.ambiental.net/noticias/biodiversidad/CoralesManglaresCaribeAmenazados.htm http://www.conabio.gob.mx/conocimiento/manglares/doctos/manglaresMexico.pdf http://www.conanp.gob.mx/q_anp.html http://www.conapesca.sagarpa.gob.mx/wb/cona/cona_produccion_pesquera_y_acuicola_2005 http://www.coris.noaa.gov/activities/reef_managers_guide/pdfs/reef_managers_guide.pdf http://www.crid.or.cr/digitalizacion/pdf/spa/doc16980/doc16980-i.pdf http://www.desenredando.org/public/libros/1993/ldnsn/html/cap3.htm http://www.dinas-coast.net/ http://www.dhushara.com/Biocrisis/green.pdf http://www2.jpl.nasa.gov/srtm/. http:/www.edcdaac.usgs.gov/gtopo30/gtopo30.asp http://www.ejournal.unam.mx/cns/no03/CNSE0313.pdf http://e0srp01u.ecs.nasa.gov/srtm/version2/SRTM3/North_America http://www.forum.villaclara.cu/ponencias/trabajo/90 http://geongrid.geo.arizona.edu/arcims/website/slrworld/viewer.htm http://www.gosic.org/goos/GLOSS_data_access.htm http://www.grida.no/climate http://www.icmyl.unam.mx/arrecifes/seagrass.html http://www.imacmexico.org/ev_es.php?ID=25485_208&ID2=DO_TOPIC http: //www.ine.gob-mx/cclimático/edo_sector http://www.ine.gob.mx/dgioece/cuencas/descargas/cong_nal_06/tema_05/15_lilly_gama.pdf http://www.ine.gob.mx/ueajei/publicaciones/normas/rec_nat/no_059.html http://www.ine.gob.mx/ueajei/publicaciones/normas/rec_nat/no_059.html http://www.invemar.org.co/redcostera1/invemar/docs/6571plegable_estadoarrecifescoralinos.pdf http://www.oilwatch.org/index.php?option=com_content&task=view&id=112&Itemid=43&lang= http://portal.semarnat.gob.mx/estados/veracruz/noticias/Pages/manglares_incubadoras.aspx http://quintanaroo.turista.com.mx/section-viewarticle-86.html. http://www.ramsar.org/lib/lib_manual2004s.htm http://www.ramsar.org/profile/profiles_mexico.htm http://www.rsis-ntsasia.org/resources/publications/policy-briefs/environment/ClimateChange.pdf http://smn.cna.gob.mx/noticias/frentefrio4.pdf http://www.unep-wcmc.org/marine/seagrassatlas/ http://www.unep-wcmc.org/resources/PDFs/In_the_front_line.pdf. 120 ACRÓNIMOS ANP.- Área Natural Protegida CCG.- Cambio Climático Global CONAGUA.- Comisión Nacional del Agua CONANP.- Comisión Nacional de Áreas naturales Protegidas COOP.- Panel de Observación de las Costas y los Océanos DEM.- Modelo Digital de Elevación EE.- Enfermedades Emergentes ERIC.- Extractor Rápido de Información Climatológica EUA.- Estados Unidos de America GCRMN.- Red Global de Arrecifes Coralinos GEI.- Gases de Efecto Invernadero GPS.- Global Position System IMTA.- Instituto Mexicano de Tecnología del Agua INE.- Instituto Nacional de Ecología INEGI.- Instituto Nacional de Estadística, Geografía e Informática IPPC.- Panel Intergubernamental sobre Cambio Climático IVC.- Índice de Vulnerabilidad Costera NASA.- Administración Nacional para la Atmósfera y el Espacio NCAR.- Centro Nacional para la Investigación Atmosférica PDI.- Procesamiento Digital de Imágenes PIB.- Producto Interno Bruto PNUD.- Programa de Naciones Unidas para el Desarrollo RAMSAR.- Convención relativa a los Humedales de Importancia Internacional especialmente como Hábitats de Aves Acuáticas, SEMARNAT.-Secretaría de Medio Ambiente y Recursos Naturales SIG.- Sistema de Información Geográfica SMN.- Servicio Mareográfico Nacional SRTM.- Shuttle Radar Topography Missión 121