Stanbio AST / GOT Liqui-UV
Anuncio

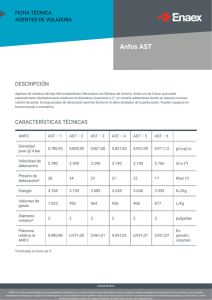
Enzima AST (R2). Composición: Stanbio AST / GOT Liqui-UV® Para la determinación cuantitativa cinética de AST/GOT en suero humano para procedimientos manuales y/o automatizados PRINCIPIO Y RESUMEN La Aspartato Aminotransferasa (AST) es una de varias enzimas que catalizan el intercambio de grupos amino y oxo entre alfa-aminoácidos y alfa-oxoácidos. Está ampliamente distribuida en los tejidos corporales con una cantidad significativa en corazón e higado1. En pequeñas cantidades se encuentra en músculo esquelético, riñones, páncreas, bazo, pulmones y cerebro. El daño a estos tejidos da por resultado una liberación de la enzima AST a la circulación general. En el infarto del miocardio la AST sérica puede empezar a incrementarse dentro de las 6-8 horas después del ataque, con un pico a los 2 días y vuelve a la normalidad para el cuarto o quinto día después del infarto2. En enfermedades como hepatitis, necrosis hepática, cirrosis y metástasis en hígado, se ha encontrado también aumento en las concentraciones séricas de AST.3 Karmen4 es el primero en reportar un método cinético para la medición de la actividad de AST en suero. Subsecuentemente, el método se ha ido modificando y optimizando por Bergmeyer et al5. Los procedimientos de ensayo para la medición de AST es similar al método recomendado por la Federación Internacional de Química Clínica (IFCC)6. La secuencia de la reacción enzimática empleada en el presente ensayo es como sigue: AST L-Aspartato + 2-Oxo-glutarato Oxalacetato + L-Glutamato MDH Oxalacetato + NADH + H + L-Malato + NAD+ + H2O La AST cataliza la transferencia del grupo amino aspartato a 2-oxoglutarato para producir oxalacetato y glutamato. El oxalacetato formado en la primera reacción va a reaccionar con el NADH en presencia de malato deshidrogenasa (MDH) para formar NAD. La actividad de AST se determina midiendo el valor total de oxidación del NADH a 340 nm. La lactato deshidrogenasa se incluye en el reactivo para convertir el piruvato endógeno de la muestra a lactato durante la fase lag anterior a la medición. REACTIVOS AST Buffer (R1). Composición: L-Aspartato 240 mmol/L. MDH (músculo de porcino) 600 U/L. LDH (músculo de conejo) 600 U/L. Tris Buffer, pH 7.5 80 mmol/L. 2-Oxoglutarato 12 mmol/L. NADH (sal disódica) 0.18 mmol/L. Presentación: Equipo para 50 - 100 pruebas. Precauciones: Para uso diagnóstico in vitro. Tome las precauciones normales para el manejo de reactivos de laboratorio. Los reactivos contienen azida de sodio que puede ser tóxico si se ingiere. Se ha reportado que la azida de sodio puede reaccionar con el plomo y cobre de tuberías, pudiendo formar metales de azidas explosivas. Consulte su hoja de seguridad para más información. Preparación del reactivo: El Buffer y los reactivos enzimáticos líquidos están listos para su uso. Prepare el reactivo de trabajo en una proporción de 5 partes de Buffer (R1) y 1 parte de enzima (R2); por ejemplo, 50 mL de Buffer y 10 mL de enzima. ESTABILIDAD Y ALMACENAMIENTO DEL REACTIVO Los reactivos son estables hasta su fecha de caducidad marcada en la etiqueta cuando se almacena a 2-8 °C y están protegidos de la luz. Los reactivos deben verse claros y sin color. Descartar si se ven turbios o si contienen partículas. El reactivo de trabajo es estable por 4 semanas a 2-8°C o 5 días a temperatura ambiente (15 - 25°C). El reactivo de trabajo deberá desecharse si la absorbancia inicial leída contra agua a 340 nm es menor de 1.100 MATERIALES REQUERIDOS PERO NO INCLUIDOS - Espectrofotómetro capaz de realizar lecturas de absorbancia a 340 nm con 1 cm de paso de luz. - Baño de temperatura constante a 37ºC o portacubeta de temperatura controlada. - Pipetas serológicas o automáticas - Tubos de ensayo - Cronómetro. RECOLECCIÓN Y ALMACENAMIENTO DE LA MUESTRA Suero no hemolizado es la muestra de elección. Debe utilizarse plasma tratado con EDTA o plasma con heparina. Siempre que sea posible, las muestras deben separarse y analizarse el mismo día que se recolectan. Guarde el suero en tubos bien tapados. La enzima en suero se reporta estable por un mínimo de 7 días a 2-8°C). SUBSTANCIAS INTERFERENTES La hemólisis debe ser evitada ya que la concentración de AST en los glóbulos rojos excede 10 veces la del suero7. Si tenemos niveles de bilirrubina de hasta 40 mg/dL y de triglicéridos hasta 2000 mg/dL, no habrá interferencia en esta prueba11. Es conocido que ciertas drogas y substancias afectan los valores de AST9. PROCEDIMIENTO MANUAL por este método. 1. Prepare el reactivo de trabajo de AST de acuerdo a las instrucciones. Muestras ictéricas y con turbiedad marcada requerirán un blanco de muestra. 2. Calibre a cero el espectrofotómetro a 340 nm con agua destilada. VALORES ESPERADOS 3. Por cada Muestra y Control, agregar 1.0 mL de reactivo de trabajo a la cubeta o tubo de ensayo y llevar a 37°C por 3 minutos. 4. Adicionar 100 µL (0.10 mL) de suero a cada tubo respectivamente y agitar levemente. 5. Leer y anotar la absorbancia al minuto 1. Continúe incubando a 37°C y anotar el cambio de absorbancia a los 2 y 3 minutos. El cambio debe ser constante. 6. Determine el cambio de absorbancia por minuto (DA/ min) y multiplicar por el factor 1746 para obtener los resultados en U/L. NOTA: Si la cubeta no está a temperatura controlada, incube las muestras a 37ºC entre lectura y lectura. CONTROL DE CALIDAD Se recomiendan los sueros control Ser-T- Fy I Normal y Ser- T- Fy II Anormal de Stanbio en cada ensayo. Otros controles comerciales disponibles con valores de AST probados por este método también pueden ser utilizados. La actividad de AST determinada en estos materiales y por este método deberá caer dentro de los rangos establecidos para los controles. Dos niveles de controles deben ser analizados en cada ensayo. CALIBRACIÓN La actividad de AST se basa en el Coeficiente de Extinción Micromolar del NADH a 340 nm (véase RESULTADOS). La guía de calibración del fabricante, deberá ser seguida para calibrar su analizador. Probando el contenido de ALT de un suero control con valores de AST conocidos, éste puede ser utilizado para asegurar que la calibración del instrumento ha sido realizada correctamente. RESULTADOS Los valores se derivan en base al “coeficiente de extinción de absortividad micromolar” de NADH a 340 nm (0.0063). Una unidad por litro (U/L) de actividad de AST/GOT, es la cantidad de enzima que oxida un µmol/L de NADH por minuto. U/L = ∆A/min x Absortividad U/L = ∆A/min 0.0063 x Rango normal: 8 - 33 U/L (37ºC) El rango deberá servir solamente como guía. Se recomienda que cada laboratorio establezca su propio rango de valores normales ya que existen diferencias entre instrumentos, laboratorio y población local. CARACTERÍSTICAS Comparación: Se analizó un grupo de 62 muestras dentro de un rango de actividad de AST de 12 - 463 U/L por el método AST descrito y también por el de un reactivo comercial similar disponible. La comparación de los resultados obtenidos proporcionó un coeficiente de correlación de 0.993 y con una ecuación de regresión de y = 0.988 x + 0.43. ( La comparación de estudios se llevó a cabo de acuerdo a la guía tentativa NCCLS EP9-T). Precisión: Se estableció un intraensayo de 20 ensayos con tres diferentes niveles de sueros controles comerciales. La precisión de valores totales fue obtenida probando estos 3 controles comerciales por cinco días consecutivos. ENTRE ENSAYO Suero 1 Suero 2 Suero 3 Media ALT (U/L) 25 51 116 Desviación Std. (U/L) 0.8 1.6 0.9 C.V. (%) 3.3 3.1 0.8 PRECISION TOTAL Suero 1 Suero 2 Suero 3 Media ALT (U/L) 26 49 115 Desviación Std. (U/L) 1.1 0.7 0.8 C.V. (%) 4.4 1.4 0.7 Se llevaron a cabo estudios de precisión de acuerdo con la guía tentativia de la NCCLS, EP5-T. Linealidad. Es lineal hasta 600 U/L a 37°C de acuerdo a la guía NCCLS, EP6-P. Volumen Total Volumen de Muestra Sensibilidad. En base a la resolución del instrumento de A = 0.001, éste método muestra una sensibilidad de 1.75 U/L. 1.10 0.10 U/L = ∆A/min x 1746 REFERENCIAS 1. International Federation of Clinical Chemistry. Provisional Concentrations of Enzymes. Clin Chem 23:887, 1977. 2. Wroblewski, F. and LaDue, J.S.Proc. Soc. Exper. Biol. And Med. 91: 569 (1956). LIMITACIONES Si el cambio de ∆A/min es mayor de 0.342, diluya una parte de muestra con 9 partes de solución salina isotónica y repetir el ensayo. Multiplicar el resultado por 10. Los valores de AST para recién nacidos no han sido establecidos 3. Karmen A : A note on thr spectrophotometric assay of glutamic-oxalacetic transaminase in human blood J Clin Invest 34:131, 1955 4. Bergmeyer H.U. Scheibe P, Wahlefeld AW: Optimization of methods for aspartate aminotransferase and alanine aminotransferase. Clin Chem 24: 58, 1978. 5. Bergmeyer, H.U, principles of Enzymatic Analysis Verlag Chemic 1978 6. Young DS Effects of drugs on clinical laboratory tests. AACC Press, Washington 1990.D.C., 7. Henry JB Clinical Diagnosis and Management by laboratory Methods. 17th W.B. Sanders Co. 1984, p 1437. 8. Stanbio Laboratory Data. Fabricado en EUA por: Stanbio Laboratory 1261 North Main Street Boerne TX; 78006. Distribuido en México por: Laboratorios Licon S.A. Viveros del Rocío No. 33 Col. Viveros de la Loma C.P. 54080 Tlalnepantla, Edo. de México Tel.: (55) 5362-0299 Fax: (55) 5362-1792