Unidad didáctica 4 Sólidos, líquidos y gases.
Anuncio

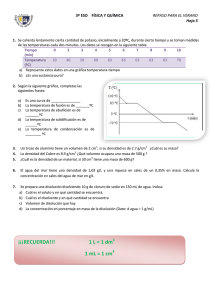
Unidad didáctica 4 Sólidos, líquidos y gases. 1.- Estados de agregación de la materia. Estados de agregación: son las tres formas o apariencias en que se puede presentar la materia: estado sólido, estado líquido y estado gaseoso. 1.1.- Características de los estados de agregación según la teoría cinético - corpuscular. Estado sólido: las partículas están unidas por unas fuerzas muy intensas que no les permiten dejar sus posiciones fijas. Sólo pueden vibrar ligeramente sobre estas posiciones, por eso mantienen constantes su forma y su volumen y son incompresibles. Estado líquido: las fuerzas entre las partículas son más débiles, por lo que pueden moverse con cierta facilidad, además de vibrar, pueden girar y deslizarse unas respecto de otra. Mantienen constante su volumen pero pueden variar su forma. Son incompresibles. Estado gaseoso: las partículas están muy separadas unas de otras porque las fuerzas entre ellas son casi nulas y se mueven con gran velocidad. Las partículas poseen movilidad total: vibración, rotación y traslación. Varía tanto la forma como el volumen, o sea, los gases son compresibles. Para saber más En las estrellas, la temperatura es tan alta que los electrones escapan de los átomos y la materia está en forma de plasma (el cuarto estado de la materia), un gas muy denso e ionizado, compuesto por aniones y cationes, separados entre sí y libres. El plasma conduce la electricidad y se ve afectado por los campos magnéticos. Los fluorescente, los letreros de neón, las pantallas de plasma, contienen plasma. También se encuentran en estado de plasma algunas zonas de las llamas y el aire que se encuentra en el recorrido de un rayo. El condesado de Bose-Einstein es el quinto estado de la materia. Se alcanza cuando la temperatura es muy baja. Es un estado tan frío y denso que los átomos pueden quedar inmóviles. 1.2.- Diagrama de fases. El diagrama de fases de una sustancia pura es una gráfica que muestra las condiciones de presión y temperatura a las que dicha sustancia existe como sólido, líquido o gas. En un diagrama se pueden encontrar: Regiones: zonas donde solo existe una fase, que corresponde a uno de los estado de agregación. Líneas de coexistencia o ramas de equilibrio, que corresponde a las condiciones de P y T a las que coexisten en equilibrio dos fases. Hay tres, de fusión (coexistencia de sólido y líquido), de sublimación (coexistencia de sólido y gas) y de vaporización (coexistencia de líquido y gas). Puntos singulares. Son dos. El punto triple, T, en el que coexisten en equilibrio las tres fases: sólido, líquido y gas; y el punto crítico, C, que marca el final de la rama de vaporización. Unidad 4: Sólidos, líquidos y gases pag. 1 2.- Leyes de los gases ideales. Para simplificar el estudio de los gases se utiliza un gas hipotético, llamado gas ideal o perfecto que es aquel cuyas partículas ocupan un volumen despreciable frente al del recipiente que contiene el gas y en el que las fuerzas de atracción entre ellas son nulas. Presión de un gas: fuerza ejercida por el gas sobre la unidad de superficie de la pared del recinto que lo contiene. Es debida a los continuos choques de las moléculas del gas contra las paredes del recipiente que lo contiene. La unidad de presión del sistema internacional es el Pascal (N/m2). Pero no es una unidad muy apropiada para medir la presión en gases, así que, se suele tomar como unidad la atmósfera. Equivalencias: 1 atm = 760 mm de Hg = 101.325 Pa. 2.1.- Ley de Boyle - Mariotte. Si se representa en una gráfica, cómo varía la presión al ir variando el volumen de un gas contenido en el interior de un cilindro (manteniendo constante la temperatura), se obtiene una hipérbola, (que recibe el nombre de isoterma porque une puntos con la misma temperatura). Esto indica que: El volumen ocupado por un gas, a temperatura constante, es inversamente proporcional a la presión aplicada. p·V=K Si se repite la experiencia a una temperatura distinta, el producto de la presión por el volumen alcanza también un valor constante pero diferente del anterior. 2.2.- Ley de Charles. Temperaturas absolutas. Si se representa, cómo varía el volumen de un gas al variar la temperatura (manteniendo constante la presión), se obtiene una línea recta, (que recibe el nombre de isobara porque une puntos con la misma presión). Esto indica que: A presión constante, el volumen ocupado por un gas es directamente proporcional a la temperatura a que está sometido. V=k·T Si la experiencia se repite a presiones distinta, la ecuación es parecida pero con k diferente. Todas las isobara se cortan en un punto, 273'15 ºC, que es el cero absoluto de temperatura. En el cero absoluto el volumen del gas se haría cero. La escala absoluta recibe el nombre de escala Kelvin. Unidad 4: Sólidos, líquidos y gases pag. 2 2.3.- Ley Gay Lussac. Temperaturas absolutas. Si ahora se representa, como varía la presión de un gas al variar la temperatura (manteniendo constante el volumen), se obtiene una línea recta (que recibe el nombre de isocora porque une puntos con el mismo volumen). Esto indica que: A volumen constante, la presión que ejerce un gas es directamente proporcional a la temperatura a que está sometido. p=k·T Si la experiencia se repite con un volumen distinto V2, la expresión es parecida pero con k diferente. Todas las isocoras también se cortan en el punto, 273'15 ºC, el cero absoluto de temperatura. En el cero absoluto la presión del gas se haría cero. 2.4.- Ecuación general de los gases ideales. Si se combinan las tres ecuaciones anteriores: p1 x V1 = p2 x V2 (T = cte) V1 V2 = T1 T2 (p = cte) p1 p2 = (V = cte) T1 T2 Se obtiene: p1 × V1 p2 × V2 = T1 T2 Para una masa de gas dada, el producto de la presión por el volumen dividido por la temperatura absoluta permanece siempre constante. p× V = R = cte ó pV = RT (para 1 mol) T Puede escribirse también: R es una constante universal, que sólo depende de las unidades empleadas para medir p, V, y T. Se puede calcular su valor sabiendo que 1 mol de cualquier gas ideal, en c.n., ocupa un volumen de 22'4 litros, resultando: 1 atm × 22'4 L atm L R= = 0'082 1 mol × 273'15 K K mol Si en lugar de tratarse de 1 mol, se considera un número n de moles se obtiene la ecuación general de los gases ideales: P·V=n·R·T Equivalencias: R = 0' 082 atm l cal J = 1' 99 = 8' 3149 K mol K mol K mol Unidad 4: Sólidos, líquidos y gases pag. 3 2.5.- Mezcla de gases. Ley de Dalton de las presiones parciales. Cuando se mezclan varios gases que no reaccionan químicamente entre sí, cada uno de ellos se comporta como si estuviera solo en el recipiente que los contiene. Como la presión de un gas depende de forma directa del número de partículas existentes, a la presión total de la mezcla debe contribuir cada gas en función del número de partículas del mismo existentes en la mezcla. Presión parcial, de un gas en una mezcla, es igual a la presión que ejercería el gas si ocupara, por separado, todo el volumen de la mezcla, en las mismas condiciones de temperatura. pi = Xi · pTotal La presión total de una mezcla de gases es igual a la suma de las presiones parciales de cada gas, en las mismas condiciones de volumen y temperatura. pTotal = Σpi = R⋅T ∑ ni V 3.- Clasificación de las sustancias. Sustancia ¿Tiene más de un componente que pueden separarse por métodos físicos? (Decantación, filtración, tamizado, cambio de estado,…) Si No Mezcla Sustancia Pura 1. Tamaño de las partículas 2. ¿Aspecto? 1. Muy pequeño 2. Transparente Mezcla Homogénea ¿Se descompone en elementos más simples por métodos químicos? (Combustión, oxidación, digestión…) 1. Intermedio. 1. Grande. 2. Turbio al trasluz 2. Opaco Coloide Mezcla Heterogénea Si Elemento No Compuesto Para saber más… Fase continua Tipos de coloides Gas Líquido Sólido Fase dispersa Gas Líquido Sólido No es posible. Los gases son solubles entre sí. Espuma. Ej.: espuma de afeitado Espuma sólida. Ej.: piedra pómez, aerogeles. Aerosol líquido. Ej.: niebla, algunos spray. Emulsión. Ej.: leche, mayonesa, sangre. Gel. Ej.: gelatina, gominola, queso. Aerosol sólido. Ej.: humo. Sol. Ej.: pinturas, tinta china. Sol sólido. Ej.: cristal de amatista. Unidad 4: Sólidos, líquidos y gases pag. 4 Mezcla: sustancia que tiene dos o más componentes que se pueden separar utilizando solo métodos físicos. • Mezcla homogénea: mezcla de aspecto uniforme, formada por partículas tan pequeñas que no se pueden ver ni al microscopio. Es transparente. Suele recibir el nombre de disolución. Ej.: el agua de mar, agua y azúcar, etc. • Coloide, suspensión o dispersión: mezcla de aspecto uniforme (aunque, a veces, no es permanente) formada por partículas de tamaño intermedio. Aparece turbia al mirarla al trasluz. Ej.: la niebla, pintura, leche, etc. • Mezcla heterogénea: mezcla de aspecto no uniforme, formada por partículas bastante grandes. Es opaca. Ejemplo: el cocido, granito, agua y aceite, etc. Sustancia pura: sustancia que tiene un único componente y, por tanto, no se puede separar en sustancias más simples utilizando sólo métodos físicos. • Elemento: componente básico de la materia que no puede descomponerse en otros más sencillos ni por métodos físicos ni por métodos químicos normales (se excluyen los procesos nucleares y radiactivos). Ej.: hidrógeno, nitrógeno, plata, cobre, mercurio, etc. • Compuesto: sustancia pura formada por más de un elemento químico, unidos en una proporción fija, en los que se puede descomponer por métodos químicos normales. Ej.: agua, dióxido de carbono, sal, etc. 4.- Disoluciones. Componentes de una disolución. • Disolución: es una mezcla homogénea de dos o más sustancias, que no reaccionan entre sí, en proporción variable. • Disolvente: es la sustancia que hace de medio de disolución y suele estar en mayor proporción. • Soluto: es la sustancia que se disuelve y suele estar en menor proporción. 4.1.- Clasificación de las disoluciones. • Diluida si contiene una pequeña proporción de soluto. • Concentrada si la proporción de soluto respecto a la del disolvente es grande. • Saturada si, a cierta temperatura, contiene la máxima cantidad posible de soluto disuelto. Se dice que ya no admite más soluto a esa temperatura. • Sobresaturada si contiene más soluto disuelto del que realmente admite el disolvente. Este tipo de disoluciones es inestable y basta cualquier alteración de las condiciones (temperatura, presencia de núcleos de cristalización, etc.) para que precipite el exceso de soluto. Unidad 4: Sólidos, líquidos y gases pag. 5 4.2.- Concentración de una disolución. La concentración de una disolución, es una medida de la cantidad de soluto que hay disuelto en ella. Se puede expresar de distintas formas: • Tanto por ciento en masa- número de gramos de soluto contenido en 100 g de disolución. % en masa = gramos de soluto ⋅ 100 gramos de disolución • Gramos por litro- número de gramos de soluto disuelto por litro de disolución. representa por g/l. • Molaridad- número de moles de soluto contenidos en un litro de disolución. M= Se moles de soluto gramos de soluto ; moles de soluto = Litros de disolución masa molecular • Molalidad- número de moles de soluto existentes en una disolución por cada kilogramo de disolvente. moles de soluto m= kg de disolvente • Fracción molar- número de moles de un componente dividido por el número total de moles presentes en la disolución. moles de cada componente X= moles totales La suma de las fracciones molares de todos los componentes de una disolución es igual a 1. La fracción molar no tiene unidades. Para poder pasar de una expresión de la concentración (masa-masa) a otra (masa-volumen) o viceversa, es necesario conocer la densidad de la disolución. La densidad es el cociente entre la masa de la disolución y su volumen. 4.3.- Solubilidad. • La solubilidad, es la máxima cantidad de soluto que se disuelve en una determinada cantidad de disolvente, a una temperatura dada. La teoría cinético-corpuscular explica que las sustancias se disuelven por un proceso de difusión que consiste en que, gracias al movimiento caótico de las partículas y a los continuos choques entre ellas, las partículas de soluto se entremezclan de forma espontánea con las del disolvente hasta repartirse homogéneamente por el volumen total del recipiente (algo similar a lo que hacen los gases). Unidad 4: Sólidos, líquidos y gases pag. 6 4.4.- Factores que afectan a la solubilidad. • La naturaleza del soluto y el disolvente: la solubilidad depende de las interacciones entre las partículas del soluto, de las interacciones entre las partículas del disolvente y las interacciones soluto-disolvente. Solo la última favorece el proceso de disolución. • La temperatura: al aumentar la temperatura, aumenta la movilidad de las partículas (soluto y disolvente) favoreciendo su dispersión. • La agitación: favorece el proceso de disolución porque permite la interacción entre las partículas del soluto y del disolvente. • La pulverización o división: cuanto más dividido están soluto y disolvente, mayor superficie de contacto hay entre ellos y, por tanto, mayor interacción, lo que facilita la disolución. 4.5.- Propiedades coligativas de las disoluciones. Propiedades constitutivas son las que dependen tanto de la concentración como de la composición de la disolución. Ejemplo: densidad, viscosidad, color, etc. Propiedades coligativas son las que solo dependen de la concentración del soluto. propiedades coligativas permiten determinar masas moleculares. Las • Ascenso ebulloscópico: es el aumento de la temperatura de ebullición de un disolvente cuando se le añade un soluto. • Descenso crioscópico: es la disminución de la temperatura de fusión (o de congelación) de un disolvente cuando se le añade un soluto. • Ósmosis: es un proceso particular de difusión o paso de partículas de disolvente a través de una membrana semipermeable. Este tipo de membrana sólo deja pasar a través de sus poros partículas de un determinado volumen, permitiendo, el paso de las moléculas de disolvente, pero no las de soluto (más voluminosas). Ejemplos de membranas de este tipo son el pergamino, las membranas animales y vegetales, etc. Si la membrana semipermeable separa dos disoluciones de diferente concentración, las partículas del disolvente pasarán desde la disolución más diluida a la más concentrada hasta que se igualen las concentraciones. Esto es debido a que las moléculas de soluto en su movimiento desordenado, chocan contra las paredes del recipiente que las contiene y contra la membrana, ejerciendo una presión que recibe el nombre de presión osmótica. Unidad 4: Sólidos, líquidos y gases pag. 7 Lógicamente esta presión será mayor donde la disolución sea más concentrada. Para compensar esta diferencia de presión, pasará disolvente de la disolución menos concentrada a la más concentrada hasta que las concentraciones se igualen y por tanto se iguale también la presión osmótica a ambos lado de la membrana, momento en que dejará pasar disolvente de un lado a otro de la membrana. Cuando dos disoluciones tienen la misma presión osmótica se llaman isotónicas. En caso de que las presiones sean diferentes, se llama hipertónica a la disolución de mayor presión e hipotónica a la que la tiene menor. La presión osmótica, π, se calcula: π·V=n·R·T o también con la ecuación de Van't Hoff: π=M·R·T Donde: π = presión osmótica (atm). V = volumen de la disolución (L). n = número de moles de solutoR = 0'082 atm·L/ K·mol. T = temperatura absoluta (K). M = molaridad. Unidad 4: Sólidos, líquidos y gases pag. 8 Cuestiones 1.- Busca el significado de las siguientes propiedades: ductilidad, densidad, viscosidad, fragilidad, maleabilidad, dureza, brillo, elasticidad, flexibilidad, tenacidad, flotabilidad. 2.- A temperatura ambiente la sal es un sólido. En estas condiciones, las partículas que constituyen la sal: a- Poseen completa libertad de movimiento. b- Poseen suficiente movilidad como para adaptarse a la forma del recipiente. c- No pueden desligarse de las partículas vecinas a las que están unidas. d- No hay ninguna partícula, sólo hay cubitos de hielo. 3.- ¿Es el vidrio un sólido o un líquido? 4.- Completa el siguiente cuadro: Propiedades Sólidos Forma Líquidos Gases Volumen ¿Compresible? Disposición de las partículas Grados de libertad 5.- Un recipiente de 20 m3 contiene acetileno a la presión de 30 atm y a una temperatura dada. ¿Qué volumen ocupará dicho gas si, manteniendo constante la temperatura, la presión se reduce a la décima parte? 6.- Explica por qué se expande un globo cuando se eleva en el aire. 7.- Razona cuál de las siguientes gráficas representa la ley de Boyle, cuál la de Charles y cuál la de Gay-Lussac? 8.- De la siguiente lista de sustancias, indica las que son puras y las que son mezclas: aire, gelatina, potaje de patatas, agua de río, calcio, yogur natural, agua de lluvia, batido de vainilla, platino, alcohol, ozono, natillas, yodo, cerveza, manzanilla, potasio, agua oxigenada, lentejas, agua del grifo, plomo y arena de la playa. Unidad 4: Sólidos, líquidos y gases pag. 9 9.- De las mezclas de lista anterior señala las que son mezclas homogéneas, heterogéneas o coloides. 10.- De las sustancias puras del ejercicio 8 indica las que son compuestos y las que son elementos químicos. 11.- Una disolución de azúcar en agua ¿Hervirá a más o menos de 100 °C? 12.- Tienes dos vasijas: una de agua de lluvia y otra de agua de mar. ¿Cuál es más fácil de congelar? ¿Por qué? 13.- ¿Por qué en invierno es habitual echar sal en las carreteras? 14.- ¿Por qué los peces de agua salada se mueren si se introducen en agua dulce? 15.- ¿Cuándo dos disoluciones son isotónicas? 16.- ¿Por qué se hinchan las ciruelas pasas al introducirlas en agua? Unidad 4: Sólidos, líquidos y gases pag. 10 Problemas de gases 1.- Un gas ideal ocupa un volumen de 5 L cuando la presión es de 1'2 atm. Si se mantiene constante la temperatura ¿cuál deberá ser su presión para que el volumen sea de 10 L? R.- 0'6 atm 2.- Introducimos 268 cm3 de un gas ideal, a 18°C y 750 mm de Hg de presión, en un recipiente en el que se ha hecho el vacío, y cuya capacidad es de 800 cm3. ¿A qué temperatura deberá calentarse el gas si la presión permanece constante? R.- 595'6 ºC 3.- Un recipiente cerrado de 50 L contiene hidrógeno a 15 °C y 1'5 atm de presión. Se pregunta: a) ¿Cuál es la masa de hidrógeno contenido en el recipiente? b) Si el recipiente se pone en comunicación con la atmósfera exterior, donde la presión es de 760 mm Hg, ¿cuál es la masa y el volumen de hidrógeno, medido en C.N., que sale del recipiente? R.- a) 6'36 g H2, b) 2'12 g H2 y 23'74 L H2 4.- Se ha encontrado que la densidad de un gas es 2'07 g/L a 30 °C y a 2 atm de presión. ¿Cuál es su densidad en condiciones normales? R.- 1'15 g/L 5.- A una P y T determinadas el CO2 tiene una densidad que es 0'758 la de un gas X. ¿Cuál es la masa molecular de X? ¿Cuál es la densidad de X en C.N.? R.- a) 58 g/mol, b) 2'6 g/L 6.- Una mezcla de gases, a la presión atmosférica está constituida por 18 % de H2, 24 % CO, 6 % CO2, y 52% N2 (concentraciones en volumen). Calcular: a) La masa molecular aparente de la mezcla, b) La densidad de la mezcla en c.n. c) Las presiones parciales en mm Hg de cada uno de los componentes. R.- a) 24'28 g/mol, b) 1'08 g/L, c) 136'8 mm Hg, 182'4 mm Hg, 45'6 mm Hg y 395'2 mm Hg 7.- En un recipiente de 10 L se han introducido 15 g de oxígeno y 8 g de nitrógeno. La temperatura es 27 °C. Calcular: a) Presión parcial del nitrógeno en el recipiente. b) Presión total de la mezcla. c) Temperatura a la que habría que enfriar la mezcla para que la presión total fuera de una atmósfera. R.- a) 0'71 atm, b) 1'86 atm, c) 160'5 K 8.- Un matraz de un litro contiene a 30°C cantidades equimoleculares de NO2 gaseoso y N2O4 gaseoso. Si la masa total del gas en el matraz es de 1'60 g, calcular la presión total. R.- 0'58 atm Unidad 4: Sólidos, líquidos y gases pag. 11 Problemas de gases para hacer en casa 1.- Un gas ideal ocupa un volumen de 1'5 L a la temperatura de 20 °C y a la presión de 1 atm. Si, a presión constante, calentamos el gas hasta 40 °C, ¿cuál sería el volumen del mismo? R.- 1'6 L 2.- Tenemos 2 litros de cloro a 2 atm de presión y a una temperatura de 27 °C. Calentamos el gas hasta que se duplica el volumen y la presión. Se pide: a) valor de la temperatura final, b) masa que hay de cloro en gramos, c) nº de moles de cloro. R.- a) 1200 K, b) 11'5 g Cl2, c) 0'16 mol Cl2 3.- Dos muestras de gas cripton se señalan con las letras A y B. La muestra A ocupa 150 cm3 a la presión de 300 mm de Hg y a la temperatura de 15 °C. Se ha determinado su masa que es 0'210 g. La muestra B ocupa 250 cm3 a la presión de 125 mm Hg y a la temperatura de 80 °C, pero no se ha determinado su masa. Con estos datos se desea saber en cuál de las dos muestras hay mayor cantidad de gas y cuál es la densidad del cripton en c.n. R.- a) En la muestra A, b) 3'74 g/L 4.- Se ha encontrado que un gas desconocido tiene una densidad 2'5 veces más grande que la del oxígeno a la misma presión y temperatura. ¿Cuál es su peso molecular? R.- 80 g/mol 5.- Suponiendo que el amoniaco es un gas ideal, calcular: a) La densidad absoluta de un mol de amoniaco en C.N. b) La densidad relativa del amoniaco respecto al oxígeno. c) Cuál sería la presión parcial del amoniaco al 14 % volumétrico en una mezcla con aire sabiendo que la presión total del sistema es de 0'75 atm. Dato: MNH3 = 17 g/mol R.- a) 0'76 g/L, b) 0'53, c) 0'105 atm 6.- Una mezcla de dos gases constituida por 4 g de metano, de fórmula CH4, y 6 g de etano, de fórmula C2H6, ocupan un volumen de 21'75 L. Calcula: a) La temperatura a que se encuentra la mezcla si la presión total es de 0'5 atm. b) La presión parcial que ejerce cada uno de los dos gases presentes en la mezcla. R.- a) 295 K, b) 0'278 atm y 0'222 atm 7.- En un recipiente de 10 litros hay 16 g de oxígeno y 56 gramos de nitrógeno a 0 °C. ¿Qué presión ejerce esa mezcla gaseosa? R.- 5'6 atm 8.- La composición del aire seco es aproximadamente 78 % de N2, 21 % de O2 y 1 % de Ar (composición molar). Cuando la presión barométrica es 750 mm de Hg calcúlense las presiones parciales ejercidas por estos tres componentes en el aire seco y la masa molecular aparente de la mezcla. R.- a) 585 mm Hg, 157'5 mm Hg y 7'5 mm Hg, b) 28'96 g/mol Unidad 4: Sólidos, líquidos y gases pag. 12 Problemas de disoluciones 1.- Se disuelven 5 g de HCl en 35 g de agua. La disolución resultante tiene una densidad de 1'06 g/cm3. Hallar la concentración de dicha disolución en: a) % en peso, b) la molaridad, c) la molalidad. d) la fracción molar de cada componente. R.- a) 12'5 %, b) 3'5 M, c) 4 m, d) 0'07 y 0'93 2.- Un ácido nítrico concentrado de densidad 1'405 g/cm3 contiene 68'1 % en peso de nítrico. Calcular la molaridad y molalidad del ácido. R.- a) 15'43 M, b) 33'75 molal 3.- Calcular la molaridad y molalidad de una disolución de ácido sulfúrico al 27 % en peso cuya densidad es 1'198 g/cm3. R.- a) 3'5 M, b) 3'84 m 4.- Se añaden 6 g de cloruro potásico a 80 g de una disolución de cloruro potásico al 12 %. Hallar el tanto por ciento en peso de de cloruro potásico de la disolución que resulta. R.- 18'4 % 5.- Se disuelven 180 g de sosa cáustica en 400 g de agua. La densidad de la disolución resultante a 20 °C es de 1'34 g/cm3. Calcular la concentración de la disolución en: a) % en peso b) g/l c) molaridad d) molalidad e) la fracción molar de cada componente R.- a) 31'03 %, b) 4'5 mol NaOH, c) 10'47 M, d) 11'25 m, e) 0'17 y 0'83 6.- ¿Cuál es la riqueza de una disolución 5 molal de ácido sulfúrico? ¿Y su molaridad? La densidad de la disolución es 1'4 g/cm3. R.- a) 32'89 %, b) 4'7 M 7.- Hallar el volumen de disolución 0'4 M de ácido sulfúrico que contiene 2'5 g de H2SO4 puro. R.- 0'08 L dis 8.- ¿Cuántos cm3 de ácido sulfúrico comercial del 98 % y 1'83 g/cm3 de densidad son necesarios para preparar 500 cm3 de disolución 0'1 M? R.- 2'73 cm3 9.- ¿Cuántos cm3 de ácido clorhídrico comercial hay que medir para preparar 1 litro de disolución 2 molar? El HCl comercial es del 36 % de riqueza y densidad =1'18 g/cm3. R.- 172'31 cm3 10.- Se desea preparar exactamente 1 litro de NaOH 0'75 M. ¿Cuántos cm3 de disolución de NaOH de densidad 1'16 g/cm3 y 14'15 % en peso deben emplearse? R.- 182'8 cm3 11.- Se mezcla 1 L de ácido nítrico de densidad 1'380 g/cm3 y 62'7 % con 1 L de ácido nítrico de densidad 1'130 g/cm3 y 22'38 %. Hallar: a) la concentración del ácido resultante en % b) el volumen de ácido que se forma c) su molaridad. La densidad del ácido formado es igual a 1'276 g/cm3. R.- a) 44'55 %, b) 1967 cm3 dis, c) 9'02 M 12.- En 30 cm3 de una disolución hay 6 g de una sustancia desconocida. Si la presión osmótica de esta disolución es 8'2 atm a la temperatura de 27 °C. ¿Cuál será la masa molecular de la sustancia? R.- 600 g/mol Unidad 4: Sólidos, líquidos y gases pag. 13 Problemas de disoluciones para hacer en casa 1.- Calcular cómo pueden prepararse 250 g de una disolución de carbonato sódico al 10 % de Na2CO3 a partir de la sal hidratada Na2CO3·10 H2O y agua. MNa = 23 R.- 67'45 g sal y 182'5 g H2O 2.- Calcular la cantidad de sosa cáustica y de agua que se necesitan para preparar 5 litros de una disolución al 20 % cuya densidad es 1'219 g/cm3. ¿Cuál es la molaridad de esta disolución? R.- 1219 g NaOH, 6'096 M 3.- Se disuelve una cierta cantidad de cloruro magnésico hidratado, MgCl2·6H2O, en un peso igual de agua. Calcular la concentración de la disolución en: a) % de sal anhidra b) % de sal hidratada. MMg= 24'3, MCl = 35'5 R.- a) 23'45 %, b) 50 % 4.- Calcular las cantidades de carbonato sódico hidratado, Na2CO3·10H2O, y de agua que se necesitan para preparar 12 L de disolución al 13'90 % de carbonato anhidro y de densidad igual a 1'145 g/cm3. R.- 5153 g sal y 8587 g H2O 5.- Calcular el volumen de disolución al 12 % en peso de CuSO4 que podrá prepararse con 1 kg de sulfato de cobre (II) cristalizado CuSO4.5H2O. La densidad de la disolución es 1'131 g/ cm3. Datos: MCu = 63'5, MS = 32, MCuSO4. 5H2O = 249'5 MCuSO4 = 159'5 R.- 4695'5 cm3 6.- Se mezcla 1 L de ácido nítrico de densidad 1'380 g/cm3 y 62'7 % con 1 L de ácido nítrico de densidad 1'130 g/cm3 y 22'38 %. Hallar: a) la concentración del ácido resultante en % b) el volumen de ácido que se forma c) su molaridad. Densidad del ácido formado = 1'276 g/cm3. R.- a) 44'55 %, b) 1'967 L dis, c) 9'02 M 7.- Se desea preparar exactamente 1 L de NaOH 0'75 M. ¿Cuántos cc de disolución de NaOH de densidad 1'16 g/cm3 y 14'15 % en peso deben emplearse? R.- 182'8 cm3 dis 8.- Para preparar 10 L de KOH exactamente 0'1111 M sólo hay disponibles 40'22 g de KOH puro. ¿Cuántos cm3 de disolución de KOH de densidad 1'3010 g/cm3 y 31 % de riqueza se necesitan para completar la disolución? MK = 39 R.- 54'55 cm3 9.- ¿Qué volumen de alcohol (C2H6O) del 95 % en peso y densidad 0'809 g/cm3 debe utilizarse para preparar 1'5 L de alcohol al 30 % en peso y densidad 0'957 g/cm3? R.- 560'34 cm3 10.- Se disuelven 23 g de alcohol etílico (C2H6O) en 36 g de agua. ¿Cuál es la fracción molar de cada componente de esta disolución? MC2H6O= 46 g/mol MH2O = 18 g/mol R.- Xs = 0'2, Xd = 0'8 11.- Suponiendo que la presión osmótica de la sangre a 37 ºC es 7'65 atm, ¿qué cantidad de glucosa por litro debe utilizarse para una inyección intravenosa que ha de tener la misma presión osmótica que la sangre? R.- 0'301 mol/L 12.- Calcula la presión osmótica a 20 ºC de una disolución acuosa que contiene 5 g de sacarosa, C12H22O11, en 75'0 mL de disolución. R.- 4'8 atm Unidad 4: Sólidos, líquidos y gases pag. 14