Calor y temperatura
Anuncio

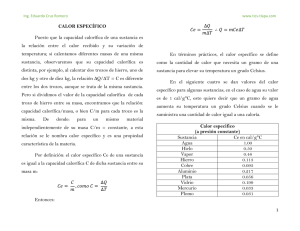
E L C A L O R Y T E M P E R A T U R A C A L O R - Concepto. - Medida del calor: - los calorímetros. - Unidad de calor. - Cantidad de calor o deenergía un cuerpo. calorífica de un cuerpo - Calor específico: --concepto. concepto -- Calor específico - determinación del calor específico. - Equilibrio térmico.- determinación del calor específico. - Equilibrio térmico. LA TEMPERATURA E F E C T O S DILATACIONES D E L C A L O R CAMBIOS DE ESTADO - Concepto. - Temperatura absoluta. - Medida del calor: - termómetros. - escalas termométricas: equivalencias. - Concepto. - Dilatación en sólidos: clases. - Dilatación en líquidos: - dilatación real y aparente. - aplicaciones de la dilatación. - dilatación anómala del agua. - Dilatación en gases: - a presion constante (1ª ley de Gay - Lussac). - a volumen constante (2ª ley de Gay –Lussac). - temperatura constante (ley de Boyle – Mariotte) . - expresión de las leyes de Gay – Lussac en función de las temperaturas absolutas. - Ecuación general de los gases perfectos en función de las temperaturas absolutas. - Cambios de estado - Calor y trabajo: - máquinas térmicas - ley de Joule - Gráfica - Leyes. CALOR Y TEMPERATURA Las partículas que forman todos los cuerpos, sean sólidos, líquidos o gases están en continuo movimiento. Este movimiento recibe el nombre de agitación térmica. Por estar moviéndose, cada una de esas partículas tiene energía (energía cinética). La energía total del cuerpo, debido a la agitación térmica, es la suma de todas las energías. A esta energía se le llama energía térmica La temperatura de un cuerpo es la medida de intensidad de la agitación térmica de sus partículas. Por tanto cuanto mayor sea el grado de agitación térmica de un cuerpo mayor es su temperatura. La temperatura se mide con el termómetro. Cuando se ponen en contacto dos cuerpos con diferentes temperaturas se observa que, al cabo de un tiempo, éstas se han igualado. Se dice que se ha alcanzado el equilibrio térmico. Esto ha sido posible por el paso de una cierta cantidad de energía térmica del cuerpo más caliente, que es el que tiene mayor temperatura, al más frío. A esta energía térmica que se ha pasado de un cuerpo a otro se le llama calor. El calor produce varios efectos en los cuerpos como: dilatación, cambios de estado y elevación de la temperatura. El calor es una forma de transferir energía entre dos cuerpos que están a diferente temperatura. * La energía pasa del cuerpo de mayor temperatura al de menor temperatura * La energía térmica y la temperatura del cuerpo más caliente disminuyen * La energía térmica y la temperatura del cuerpo más frío aumentan * La energía térmica perdida por un cuerpo es igual a la energía térmica ganada por el otro * La temperatura final de ambos cuerpos es la misma. Están en equilibrio térmico El sentido del paso del calor está determinado por la temperatura y no por la cantidad de energía térmica. En resumen: CALOR: es una forma de energía que existe en todos los cuerpos, es la energía cinética debida al movimiento desordenado de sus moléculas. TEMPERATURA: es el nivel térmico (nivel de agitación de las moléculas) que alcanza el calor en un cuerpo. Es la medida de la energía cinética media de las moléculas de un cuerpo. Por lo tanto calor no es lo mismo que temperatura: * La temperatura es una magnitud física que mide el grado de agitación de las partículas, es decir, la cantidad de energía interna que poseen. Se mide con el termómetro. * El calor es energía en tránsito, que sólo se manifiesta cuando se transfiere energía de un cuerpo caliente (que posee mayor temperatura) a otro frío (con menor temperatura). Se mide con el calorímetro. UNIDADES DE CANTIDAD DE CALOR O DE ENERGÍA CALORÍFICA (Q) Teniendo en cuenta que el calor es una forma de energía y que la energía es la capacidad para producir trabajo, para medir la cantidad de calor emplearemos las unidades de trabajo. Por tanto en el S. I. es el julio la unidad de cantidad de calor o de energía calorífica. Otras unidades: - caloría (cal): es la cantidad de calor que es necesario comunicar a un gramo de agua pura para que su temperatura aumente en un grado centígrado. - también se emplea la kilocaloría = 1.000 cal Equivalencias: 1 julio = 0, 24 cal 1 cal = 4,16 J CANTIDAD DE CALOR O ENERGÍA CALORÍFICA ALMACENADA EN UN CUERPO Partimos de que: la cantidad de calor necesaria para que la temperatura de un cuerpo aumente un determinado valor (Δt) es proporcional a la masa de un cuerpo. la cantidad de calor o energía calorífica ganada o perdida por un cuerpo (ΔQ) es proporcional a la variación de la temperatura (Δt). en la cantidad de calor absorbida o cedida por un cuerpo interviene un factor (k) que depende de la naturaleza del cuerpo Estos enunciados expresan mediante la fórmula: ΔQ = m · k · Δt ΔQ = variación de energía calorífica o cantidad de calor m = masa del cuerpo k = una constante de proporcionalidad propia de cada sustancia Δt = variación de la temperatura CALOR ESPECÍFICO (c) La energía calorífica Q absorbida o cedida por un cuerpo cuando su temperatura pasa de t a t´, es igual al producto de su calor específico c por su masa m y por la variación que experimenta la temperatura (t – t´). Q = m · c · (t – t´) Calor específico (c) de una sustancia es la energía calorífica o la cantidad de calor (Q) que hay que aplicar a la unidad de masa (m) de una sustancia para que su temperatura aumente un grado centígrado. De la fórmula anterior se deduce que el calor específico (c) es igual a: ; por tanto el calor específico en el S I se expresa en: o también se utiliza equivalencia entre J/kg·ºC y cal/g·ºC Sabemos que 1 J = 0,24 cal entonces resulta EQUILIBRIO TÉRMICO La energía calorífica se transmite de los cuerpos de mayor a menor temperatura hasta que los dos tienen la misma temperatura, es decir hasta que han alcanzado el equilibrio térmico, de forma que la cantidad de calor que cede un cuerpo es igual a la cantidad de calor que gana el otro. Q perdido por el cuerpo de mayor temperatura = M · c · (t – t´´) Q ganado por el cuerpo de menor temperatura = M´ · c´ · (t´´ - t´) Q perdido = Q ganado M · c · (t – t´´) = M´ · c´ · (t´´ - t´) M = masa del cuerpo que está a mayor temperatura M´= masa del cuerpo que está a menor temperatura c = calor específico del cuerpo que está a mayor temperatura c´= calor específico del cuerpo que está a menor temperatura t = temperatura más alta t´´ = temperatura final de la mezcla t´ = temperatura más baja Ej.: Tenemos dos recipientes con la misma cantidad de agua uno de ellos está a 30º C y el otro a 80º C. Mezclamos el agua de ambos recipientes. ¿Cuál será la temperatura final de la mezcla t´´? Partimos de que al final las dos masas de agua tendrán la misma temperatura y de que la cantidad de calor que cede el agua del recipiente a mayor temperatura será igual a la cantidad de calor que gana el agua del recipiente a menor temperatura Datos: M = masa de agua en cada recipiente c = calor específico del agua 4.186 J/kg·ºC o también 1 cal/gr·ºC t = temperatura más alta t´´ = temperatura de la mezcla t´= temperatura menor Q cedida = M · c · (t – t´´) Q ganada = M · c · (t´´ - t´) Q cedida = M · c · (80ºC – t´´) Q ganada = M · c · (t´´ - 30ºC) Como Q cedida = Q ganada podemos igualar ambas fórmulas y resulta: M · c · (80ºC – t´´) = M · c · (t´´ - 30ºC) Simplificando, ya que M y c tienen el mismo valor en los dos miembros, resulta: (80ºC – t´´) = (t´´ - 30ºC) 80ºC + 30ºC = t´´+ t´´ 2 t´´ = 110ºC DETERMINACIÓN EXPERIMENTAL DEL CALOR ESPECÍFICO Para determinar experimentalmente el calor específico de un cuerpo se utiliza un aparato llamado calorímetro, que consta de dos recipientes colocados uno dentro de otro y separados entre sí por una sustancia aislante. El recipiente exterior está bien cerrado para impedir que el vaso interior emita calor o lo reciba del ambiente exterior. Como accesorios el aparato lleva también un termómetro y un agitador. Para determinar el calor específico se procede de la siguiente manera: 1º.- Se echa en el calorímetro una masa M´ de agua y se mide su temperatura t´. 2º.- Se determina la masa M y la temperatura t del cuerpo cuyo calor específico c queremos determinar y lo introducimos en el calorímetro. 3º.- Agitamos el agua para que se distribuya el calor uniformemente y medimos la temperatura de la mezcla t´´ Como el calorímetro está herméticamente cerrado la cantidad de calor que cede una sustancia es igual a la cantidad de calor que gana la otra. Supongamos que el cuerpo tiene mayor temperatura que el agua Q cedida por el cuerpo = Q ganada por el agua M · c · (t - t´´) = M´ · c´ · (t´´ - t´) despejando c, calor específico del cuerpo queda: En realidad este valor no es del todo exacto, ya que no hemos tenido en cuenta el calor absorbido por el calorímetro y los accesorios. Para obtener el resultado con mayor precisión el calorímetro suele llevar un dato llamado equivalente en agua del calorímetro (a). Este valor a debe añadirse en los cálculos a la masa del agua con lo que la fórmula empleada para hallar el calor específico de un cuerpo sería: (Nosotros en nuestros cálculos, a la hora de resolver problemas, prescindiremos de este dato). Ej.: Una bola de plomo de 1 kg y calentada a 200ºC se introduce en un calorímetro con 0,5 kg de agua a 12ºC, resultando la temperatura final de la mezcla a 23ºC. Calcula el calor específico del plomo. (calor específico del agua 4.186 J/kg·ºC) Datos: M (masa del plomo) = 1 kg M´(masa del agua) = 0,5 kg t (temperatura del plomo) = 200ºC t´´ (temperatura final de la mezcla) = 23ºC t´ (temperatura del agua) = 12ºC c (calor específico de la sustancia)= x c´(calor específico del agua) = 4.186J/kg·ºC Aplicando la fórmula resulta: LA TEMPERATURA Los átomos y moléculas en una sustancia no siempre se mueven, agitación térmica, a la misma velocidad. Esto significa que hay un rango de energía cinética, llamada energía térmica, en las moléculas. En un gas, por ejemplo, las moléculas se mueven en direcciones aleatorias y a diferentes velocidades - algunas se mueven rápido y otras más lentamente. La temperatura es la medida de la energía térmica de las partículas en una sustancia. Como lo que medimos es su movimiento medio, la temperatura no depende del número de partículas en un objeto y por lo tanto no depende de su masa. Por ejemplo, la temperatura de un cazo de agua hirviendo es la misma que la temperatura de una olla de agua hirviendo, a pesar de que la olla sea mucho más grande y tenga millones y millones de moléculas de agua más que el cazo. En resumen: la temperatura es una medida de la energía media de las moléculas en una sustancia y no depende del tamaño o tipo del objeto. TEMPERATURA ABSOLUTA La temperatura de un cuerpo depende de la velocidad de sus moléculas. A medida que se va enfriando sus moléculas disminuyen de velocidad. Si seguimos enfriando llegará un momento en que sus moléculas no tendrán ningún movimiento. A la temperatura a la que las moléculas de cualquier sustancia permanecen inmóviles se la llama cero absoluto. A la temperatura del cero absoluto la energía cinética de las moléculas de las sustancias es nula. MEDIDA DE LA TEMPERATURA: TERMÓMETROS Los termómetros más conocidos son los que se basan en la dilatación, es decir la variación de las dimensiones de un cuerpo con la temperatura. Clases de termómetros Termómetros de líquidos: contienen un pequeño depósito con el líquido, conectado a un tubo muy fino. Cuando aumenta la temperatura, el líquido se dilata y sube por el interior del tubo. Termómetros bimetálicos: formado por dos láminas metálicas, enrolladas en espiral, soldados una contra la otra, a lo largo de toda su longitud. Cuando la temperatura aumenta, una de las láminas se dilata más que la otra y la espiral se desenrolla. El movimiento se amplifica mediante un sistema de palancas sujetas a la extremidad de la espiral y que termina en una aguja que indica la temperatura. Pirómetros o termómetros sin contacto: miden la temperatura a partir de la radiación de calor emitida por los objetos. Estos termómetros permiten utilizarse si tener que tocar los objetos, lo que permite medir la temperatura de los objetos cuando están en movimiento o alejados, así como también cuando sus temperaturas son muy elevadas. Termómetros digitales: miden la temperatura por medio de un circuito electrónico. La información que captan es enviada a un microchip que la procesa y la muestra numéricamente en la pantalla digital. Termómetro de máxima y mínima: Es muy utilizado en meteorología para identificar las temperaturas máximas y mínimas que se presentan a lo largo de un día. Termógrafos para registran continuamente la temperatura en una gráfica. ESCALAS TERMOMÉTRICAS: EQUIVALENCIAS Para graduar un termómetro estableciendo una correspondencia dilatación-temperatura se construye una escala con dos puntos fijos para todas las escalas termométricas: el punto de fusión del hielo y el de ebullición del agua a la presión de 1 atm. Las escalas termométricas más comunes son: ESCALA TERMOMÉTRICA PUNTO DE FUSIÓN DEL HIELO PUNTO DE EBULLICIÓN DEL AGUA CELSIUS O CENTIGRADA 0º C 100º C FAHRENHEIT 32º F 212º F KELVIN O ABSOLUTA 273º C 373º C REAUMUR 0º R 80º R Escalas Termométricas Relación entre las Escalas Termométricas CUESTIONES 1. Cita un ejemplo de un cuerpo que tenga mucha cantidad de calor y poca temperatura y otro de un cuerpo que tenga poco calor y mucha temperatura. 2. Dos cuerpos de igual masa se hallan en la misma habitación y, por tanto, tienen la misma temperatura, sin embargo, la cantidad del uno puede ser mucho mayor que la del otro. ¿A qué es debido? 3. Suponiendo que dos cuerpos de igual masa tengan la misma cantidad de calor ¿cuál de ellos tendrá mayor temperatura? ¿por qué? 4. Dos cuerpos de igual masa tienen la misma temperatura ¿cuál tendrá mayor cantidad de calor? ¿por qué? 5. Si se comunica el mismo número de calorías a un kilogramo de mercurio y a un kilogramo de agua: a) ¿en cuál aumenta más la temperatura? ¿por qué? b) ¿cuál nos producirá mayor sensación de calor? ¿por qué? 6. Un kilogramo de agua y un kilogramo de mercurio bajan su temperatura desde 80º C a 0º C ¿cuál desprende más cantidad de calor? (el calor específico del agua es mayor que el del mercurio). PROBLEMAS 7. Si para calentar un gramo de una sustancia y elevar su temperatura en 3º C se necesitan 4 cal, di si el calor específico de esa sustancia es mayor o menor que la del agua ¿por qué? 8. Calcula cuántas calorías equivalen a 850 julios. 9. Calcula cuántos julios equivalen a 1,5 kcal. 10. ¿Qué cantidad de calor desprende1 litro de agua al pasar de 100º C a 15º C. 11. Calcula la cantidad de calor que hay que aplicar a una pieza de hierro de 2 kg para pasar su temperatura de 60ºC a 80ºC. (calor específico del hierro c= 4ífico del hierro c= 473 J/kg · ºC). 12. Calcula la temperatura final de una bola de aluminio de 0,5 kg si su temperatura inicial es de 40º C y se introduce en un recipiente de 2 litros de agua cuya temperatura es de 60º C. Calor específico del aluminio es c= 908 J/kg·ºC y el calor específico del agua c = 4.816 J/kg·ºC). 13. ¿Qué temperatura tenía un bloque de 3 kg de plomo si después de aplicarle 20.930 J tiene una temperatura de 65º C? (el calor específico del plomo es 1.381 J/kg·ºC) 14. ¿Qué cantidad de calor es necesario comunicar a 3,4 kg de agua para elevar su temperatura de 10º C a 100º C? 15. Un trozo de cobre de 40 g a 10º C se calienta hasta adquirir una temperatura de 100º C. Calcula la cantidad de calor que se les ha comunicado. Da la respuesta en julios y en calorías. (calor específico del cobre: 0,37 J/g · ºC). 16. Calcula el calor específico del aluminio sabiendo que un bloque de 500 g absorbe 8.680 cal al pasar de 20º C a 100º C 17. ¿Qué significa que el calor específico del hielo es 2,1 J/g · ºC? 18. Se saca de agua hirviendo un trozo de plata de 50 g y minutos después se temperatura es de 25º C ¿Qué cantidad de calor ha desprendido? (calor específico de la plata. 0,46 J/g ·ºC) 19. ¿Cuántos grados aumentará la temperatura de una barra de aluminio de 150 g al aplicarle 8.372 J? (calor específico del aluminio: 0,88 J/g · ºC). 20. Calcula el calor específico de cierto metal sabiendo que si se aplican 4.800 cal a 200 g del mismo, su temperatura aumenta en 30 ºC). 21. Se mezclan 100 g de agua a 0º C con 40 g de agua a 60º C. Calcula la temperatura de la mezcla. 22. Se sumerge en 3 litros de agua a la temperatura de 10º C un bloque de hierro de 2 kg que está a 150º C. Calcula la temperatura final de la mezcla. (calor específico del hierro. 0,47 J/g · ºC). 23. Se sumergen 200 g de un metal a 200º C en un calorímetro que contiene 500 g de agua a 20º C. Calcula el calor específico del metal sabiendo que la temperatura final fue de 22º C. 24. Un calorímetro contiene 800 g de agua a 7º C. Si sumergimos en ella 500 g de cierto metal a 100º C, la temperatura final es de 12º C. Calcula el calor específico del metal. 25. Un hornillo de gas es capaz de elevar en 10 minutos la temperatura de 5 kg de agua de 20 a 80º C ¿cuántas kilocalorías proporciona cada minuto? 26. ¿Cuántos julios proporciona la combustión de 1 kg de petróleo si produce 11 kcal cada gramo? 27. Para elevar de 15º C a 40º C la temperatura de 20.000 litros de agua, un calentador consume 15 litros de gas, cuyo poder calorífico es de 5.000 kcal/m 3. Calcula el calor que se ha perdido durante el calentamiento. 28. Expresa la temperatura de 50º C en las distintas escalas termométricas. 29. Un médico inglés mide la temperatura de un paciente y obtiene 106º F ¿cuál será la temperatura en ºC? 30. Completa la siguiente tabla: CENTIGRADO FAHRENHEIT KELVIN REAUMUR 200º C 40º F - 5º C 400 K 40º R