Clase 4:Radiación del cuerpo, efecto fotoeléctrico y modelos atómicos
Anuncio

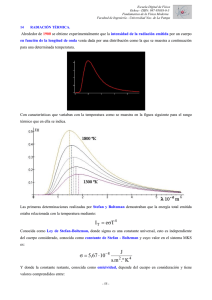
Clase 4:Radiación del cuerpo, efecto fotoeléctrico y modelos atómicos El experimento de Millikan Determina la carga del electrón 1.602 x 10 -19 C Atomizador de gotas de aceite Fuente de Rayos X (ioniza las gotas) Lente para observar Aplico voltaje + - https://www.youtube.com/watch?v=ijHKu6iXi Rk Radiación: un problema sin resolver • Un problema que no se puede explicar con la mecánica Newtoniana Al vacío Cuerpo Negro • Kirchhoff (1860) Energía absorbida y energía emitida. • Absorción al = 1 absorbe todo a cualquier l Cuerpo Negro Teorema de Kirchhoff Solucion a la función Stefan s = 5.6728 x 10-8 Wm-2 K-4 Boltzmann: Sólo para el cuerpo negro O bien En esta época no había cuerpos negros, pero en 1895, se logra mediante la siguiente afirmación Nuevo modelo de prueba Un sólido con una cavidad: La probabilidad que la luz se refleje es muy baja Densidad de energía (U) • Relacionada con la potencia emisiva J Velocidad de la luz • Sustituyendo en Stefan-Boltzmann Densidad de energía (U) • Relacionada con la potencia emisiva J Velocidad de la luz • Sustituyendo en Stefan-Boltzmann a = 7.569 x 10 -16 J m-3 K-4 Solución a la radiación del Cuerpo Negro • Wein: u es una función que tiene – Valor máximo para la longitud de onda – Este valor es inversamente proporcional a T. Falla por encima de 1773 K con respecto a los experimentos Otra solución • Rayleigh-Jeans • Inaceptable porque u crecería sin limite para las long. De onda pequeñas (catastrofe UV) La final • Planck ¿Por qué es la más adecuada? • Reproduce los resultados experimentales a toda temperatura. • Da mejores resultados en UV que la de Wein y permite obtener valores que la de Rayleigh Jeans no consigue en UV. El efecto fotoeléctrico • Emisión de electrones ¿Cómo se puede lograrse? -Calentando -Un campo eléctrico suficientemente grande -Una partícula -Luz e- e e e Metal • w es la energía “unión” metal-electrón. • Para emitir e- necesita que Eabsorbida> w por lo tanto se conoce como función trabajo Descripción de su medición (ejemplo) • Se elige el ánodo como la superficie metálica de la cual se van a • desprender los electrones, • los electrones tienen que vencer el campo eléctrico opuesto a su trayectoria para alcanzar el cátodo. • Al llegar al ánodo, se mide la corriente eléctrica en el galvanómetro (G). • Puede, desde luego, incrementarse la diferencia de potencial con la fuente de poder y registrar en el voltímetro (V) la diferencia de potencial • que logra que no haya carga atravesando por el galvanómetro En este punto La energía cinética máxima de los fotoelectrónes se convierte en energía potencial eléctrica Dj0 = diferncia que anuló la corriente a través del galvanómetro 1 2o Dj0 = --mn 2 Albert Einstein entra en el Juego… Explicación plausible: 1) La radiación electromagnética se comporta termodinámicamente como si consistiera en “cuantos” de energía de magnitud hn. 2) Un cuanto incide sobre cada uno de los electrones del metal, produce su salida de la atracción del sólido y le da una E. Cinética adicional En ecuaciones… ef =w + mn 2 pf = h l 2 w =hn0 ef =hn La energía cinética de los fotoelectrones es: mn 2 2 =hn - hn0 Y nos vamos a relatividad… • Einstein propone que los fotones tienen cantidad de movimiento: pf = h l ef = hn = mc2 hv = h = mc = pf c l Problema • Calcular la masa de un fotón de rayos X con una longitud de onda de 1 A Problema • Calcule al pérdida de energía cinética para producir un fotón de rayos X con l = 1x 10 -11 m. Problema • Calcule al pérdida de energía cinética para producir un fotón de rayos X con l = 1x 10 -11 m. DE = hn= hc = l DE = 19.96 x 10-15 J Efecto Compton • Dispersión de ondas electromagnéticas f Electrón en reposo Implicaciones • El fotón puede transmitir energía al electrón, lo que reduce su frecuencia menor cantidad de movimiento Descubrimiento del núcleo atómico • Becquerel : 1896 observa ennegrecimiento de placas fotográficas: a: Núcleos He B a g b g: Radiación Electrom. b: e- desc. núcleo Atomo de Rutherford • Experimento de Geiger y Marsden prueba la existencia del núcleo a Dispersiones de hasta 90 º, rebote de partículas Modelo de Rutherford • Existencia de un núcleo atómico, alrededor del cual se encuentran los electrones.