Tema 5 Masa Molecular, Cantidad de sustancia: el Mol, Masa y
Anuncio
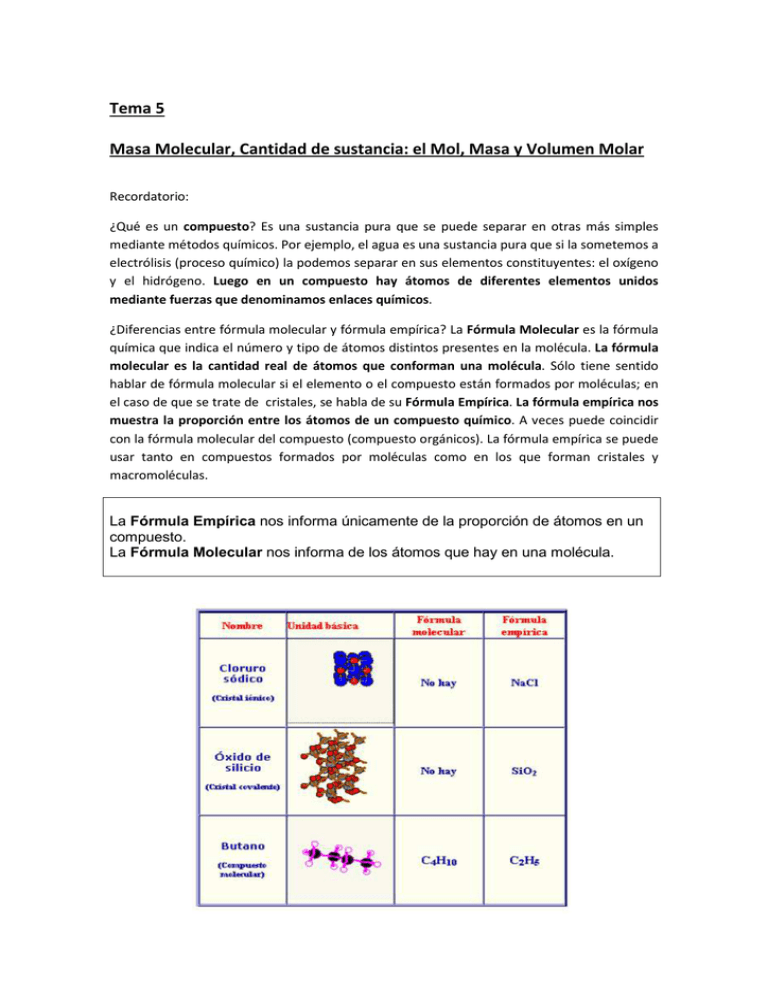
Tema 5 Masa Molecular, Cantidad de sustancia: el Mol, Masa y Volumen Molar Recordatorio: ¿Qué es un compuesto? Es una sustancia pura que se puede separar en otras más simples mediante métodos químicos. Por ejemplo, el agua es una sustancia pura que si la sometemos a electrólisis (proceso químico) la podemos separar en sus elementos constituyentes: el oxígeno y el hidrógeno. Luego en un compuesto hay átomos de diferentes elementos unidos mediante fuerzas que denominamos enlaces químicos. ¿Diferencias entre fórmula molecular y fórmula empírica? La Fórmula Molecular es la fórmula química que indica el número y tipo de átomos distintos presentes en la molécula. La fórmula molecular es la cantidad real de átomos que conforman una molécula. Sólo tiene sentido hablar de fórmula molecular si el elemento o el compuesto están formados por moléculas; en el caso de que se trate de cristales, se habla de su Fórmula Empírica. La fórmula empírica nos muestra la proporción entre los átomos de un compuesto químico. A veces puede coincidir con la fórmula molecular del compuesto (compuesto orgánicos). La fórmula empírica se puede usar tanto en compuestos formados por moléculas como en los que forman cristales y macromoléculas. La Fórmula Empírica nos informa únicamente de la proporción de átomos en un compuesto. La Fórmula Molecular nos informa de los átomos que hay en una molécula. Masa Molecular Relativa (masa molecular) De la misma forma que visteis el concepto de masa atómica, podemos decir que la masa molecular es la que corresponde a la masa de una molécula. Lógicamente, la masa de una molécula es pequeñísima, por eso se prefiere usar unidades de masa atómica en lugar del gramo o del quilogramo. Cuando medimos la masa de una molécula en unidades de masa atómica, la simbolizamos como Mr (masa molecular relativa). Para determinar la masa molecular sumaremos las masas de todos los átomos que constituyen la molécula. La masa molecular es la masa que tiene una molécula. Composición Centesimal La composición centesimal de un compuesto es el tanto por ciento en masa de cada uno de los elementos que lo componen. En el caso de que un compuesto esté constituido por moléculas, para calcular el tanto por ciento en masa de cada elemento dividiremos la masa de cada tipo de átomos que componen la molécula por la masa molecular y multiplicaremos por cien. Si el compuesto no está formado por moléculas (si es un cristal..) el porcentaje lo obtendremos a partir de su fórmula empírica de la misma forma que lo indicado en el párrafo anterior. Composición centesimal del ácido sulfúrico H2S04 Cantidad de sustancia: el mol Masa Molar La masa molar (M) es la masa de un mol de átomos, moléculas, iones, particular, etc… Se expresa en kg/mol o en g/mol. La relación entre cantidad de sustancia ,masa y masa molar es : n(mol)= ( ) ( ) Cuando la masa molar se expresa en g/mol, su valor numérico coincide con la masa relativa. Volumen Molar El volumen molar es el volumen que ocupa un mol de un gas medido a 273 K de temperatura y 1 atmósfera de presión. El volumen molar de todos los gases en esas condiciones (condiciones normales) es de 22,4 litros En 22,4 litros de cualquier gas, medido a 273 K y 1 atm, hay 6,022∙ 1023 átomos o moléculas