tabla periodica 1
Anuncio

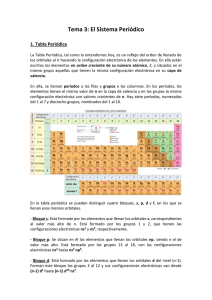
I Tabla Periódica Capítulo 4 * CAPÍTULO 4: TABLAPENTÓOTCA * tabla periódica actual fue establecida por Dimitri Mendeleief en I 869 en base al elemento carbono' La tabla periódica es la ordenación y clasificación de los ele- La mentos químicos considerando sus propiedades fisicas y quí- * * micas. La tabla periódica actual se fundamenta en dos criterios' * El número atómico creciente x La configuración electrónica. En la tabla periódica los elementos se encuentran distribuidos en forma ¿e ntas (periodos) y columnas (grupos o familias) Períodos.- Corresponde a las filas o divisiones horizont¿les' a los que se le asigna números del 1 al 7 o con las letra mayúsculas desde la K hasta la Q. Los elementos que pertenecen a un mismo período se caracterizan por presentar el mismo número de niveles energéticos. Periodo * Elementos de transición.- Se ubican en la parte central de la tabla periódica y presentan propiedades y características muy particulares debido a que tienen un retraso en el llenado de los electrones en el penúltimo nivel energético. Son elementos metálicos con propiedades diferentes a los del grupo IA y IIA Los elementos de tiansición ubican sus últimos electrones en el subnivel d y por esta razón pertenecen al bloque d' Número de Grupo r (K) 2 2(L) 8 3 (M) 8 4 (N) 18 5(o) 18 6 (P) 32 'l (a) 6 IB nsr(n-l)dlo IIB ns2 (n-1)d'o IIIB IVB ns2 (n-1)dt ns2 (n-l)d VB ns'z.(n-1)d' VIB VIIB nsl(n-1)d5 ns2 (n-l)ds ns2 (n-1)d6 VIIIB ns2 (n-1)d7 ns2 (n-1)d8 está formado por 3 columnas. Los elementos que pertenecen a un mismo grupo se caracferizanpor presentar configuraciones Elementos de transición interna.- Son los elementos que por comodidad se ubican bajo la tabla periódica y pefienecen a los períodos 6 y 7, se les conoce como LANTANIDOS yACTINIDOS cada período tiene 14 elementos, pertenecen al bloque f por presentar sus últimos electrones en el subnivel f. electrónicas externas similares así como propiedades químicas muy parecidas. Se conocen dos clases de grupos tipo "A" y "8". Los del tipo A se les conoce como elementos representativos y a ios del tipo B como elementos de transición. PROPIEDADES PERIÓDICAS El,ementos representativos.- Se caracterizan por preseútar configuraciones electrónicas estables, el niimero de grupo se determina por el número de electrones ubicados en el último Son aquellas propiedades que varían periódicamente con el incremento del número atómico, estas propiedades dependen de la ubicación del elemento dentro de la tabla periódica. nivel energético conocidos como electrones de valencia. Grupo IA.- Se catacleriza por presentar 1 electrón exterilo y coresponde a una configuración electrónica general ns!, a los elementos de este grupo se le conoce como METALES ALCALINOS y se caracterizaí por ser de gran Energía de ionizacién.- Es la energía mínima necesaria que debe absorber un átomo gaseoso para perder su electrón y convertirse en un ión gaseoso positivo. reactivida4 reaccionan vigorosamente con el agua. Grupo IIA.- Los elementos de este grupo presentan 2 electrones extemos, corresponde a una configuración electrónica general ns2 y se les conoce como METALES Cuando la energía es absorbida el proceso es "Endotérmico" y la energía involucrada será siempre de signo positivo, si la energía es desprendida el proceso es "Exotérmico" y la energía involucrada será positiva. La energía de ionización aumenta de izquierda a derecha en un mismo periodo y disminuye de arriba hacia abajo en un mismo gruPo. ALCALINO TÉRREOS Grupo IIIA.- Presentan 3 electrones externos, la configuración electrónica general es ns2 npr. Preuniversitario "stephen W. Hawking" Configuración electrónica general Grupos o familias.- Están constituidos por 18 columnas o divisiones verticales que forman los 16 grupos. El grupo VIII B * ración electrónica general es ns2 np2. Grupo VA.- Presentan 5 electrones externos, la configuración electrónica general es ns2 np3. Grupo VIA.- Presentan 6 eiectrones externos, la configuración electronica general es ns2 npa. Grupo VIIA.- Hay 7 electrones de valencia, la configuración electrónica general es ns'npt, se les conoce como HALÓGENOS, presentan una elevada electronegatividad y consecuentemente son muy reactivos' Grupo VIIIA.- Presentan 8 electrones externos, la configuración electrónica general es ns'npu, se les conoce como ó¡.sBs NOBLES o INERTES, poseen elevada estabilidad química. elementos tipo Grupo IVA.- Presentan 4 electrones externos, la configu- t2