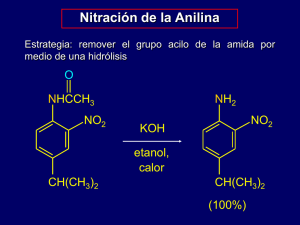
Document
Anuncio
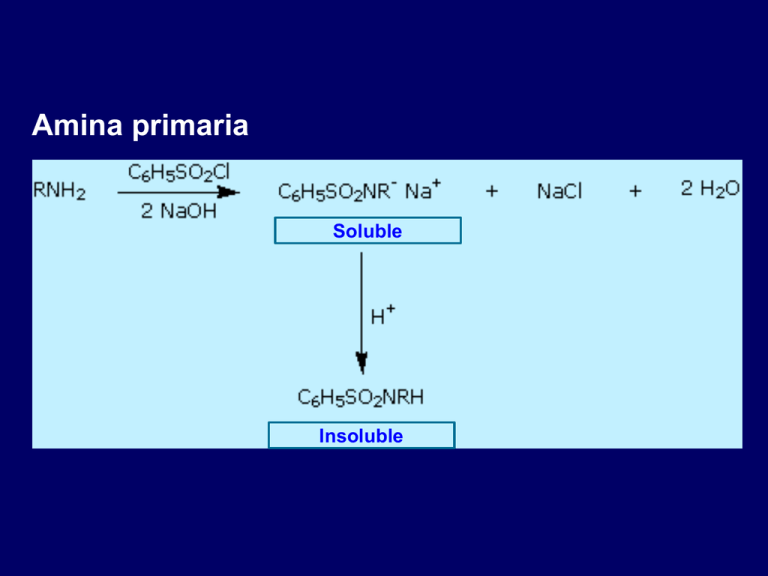
Amina primaria Soluble Insoluble Amina secundaria Insoluble No hay reacción Amina terciaria Insoluble Soluble FORMACIÓN DE AMIDAS CARBOXAMIDAS Preparación de las amidas Las aminas no reaccionan con los ácidos carboxílicos para formar amidas. La única reacción que ocurre es un equilibrio ácido-base. O O RCOH + R'NH2 – RCO + + R'NH3 calor O RCNHR' + H2O Ejemplo O COH + H2N 225°C O + H2O CNH (80-84%) Reacciones de los Cloruros de Acilo Los cloruros de acilo reaccionan con el amoniaco y las aminas para formar amidas: O O RCCl + R'2NH + HO– RCNR'2 + H2O H + Cl– O A través de: R C Cl NR'2 Ejemplo O O C6H5CCl + HN NaOH H2O C6H5CN (87-91%) Reacciones de los anhídridos de ácido Los anhídridos de ácidos reaccionan con amoniaco o aminas para formar amidas: O O O RCOCR RCNR'2 + RCO– + 2R'2NH H + R'2NH2 O A través de: O R NR'2 C OCR O Ejemplo O O CH3COCCH3 + H2N CH(CH3)2 O CH3CNH CH(CH3)2 (98%) DROGAS SULFAS ÁCIDO FÓLICO (Vitamina B9) Factor de crecimiento ÁCIDO FÓLICO: FACTOR DE CRECIMIENTO Sulfanilamida Ácido p-aminobenzoíco http://dept.lamar.edu/chemistry/martincb/folic%20acid.gif Sulfa un antimetabolito Sulfadiazina, antibiótico ¿Cuál la sulfa que todavía se usa? Bactrim (sulfametoxazol y trimetoprim) es un antibiótico PROPONER SU SÍNTESIS QUÍMICA A PARTIR DE BENCENO FORMACIÓN DE IMINAS O N + R Z R' en H N H Z H N Z Z + R H H O H R' REACTIVO PRODUCTO N H H N H AMONIACO H N R AMINA PRIMARIA H NH2 IMINA R H R H N R R IMINA BASE DE SCHIFF R' N H N NH2 HIDRAZINA H R' NH2 HIDRAZONA R R' O N + R Z R' en H N H N Z + R H Z H N Ph H Z H O H R' PRODUCTO REACTIVO H N N Ph H H N H N Ph FENILHIDRAZINA R OH H N OH H HIDROXILAMINA O N C NH2 H O H N N C NH2 H H R' N FENILHIDRAZONA OH OXIMA R R' N H N SEMICARBAZIDA R R' C O NH2 SEMICARBAZONA O H3C C N + H N O H CH3 H O H + H3C H Kobs -1) (min pH C O H CH3 FORMACIÓN DE ENAMINAS Formación Enaminas Después de la adición de R2NH, el proton se pierde en el átomo de carbono adyacente R R O O C H + R2NH H C NH HO + H N C C N H H C H R N H2O C + H3O+ C C H R R R R R C H H C H Gilbert Stork (nacio el 31 de diciembre de 1921 en Bruselas, Bélgica). Químico orgánico belga que radica los Estados Unidos enamina imina Aminas secundarias más utilizadas piperidina pirrolidina morfolina Sal de iminio 1er. Paso. Activación del grupo carbonilo 2o. Paso. Adición de la amina 2ª 3er. Paso. Equilibrios ácido base Formación de agua como grupo saliente 4o. Paso. Eliminación de agua y del protón del carbono β para formar la enamina (pasando por la sal de iminio) Paso 1 Paso 2 Paso 3 Trabajo final ADICIÓN DE MICHAEL: ADICIÓN-1,4 4 3 2 1 Nitrosación de Alquilaminas Ion nitrito, ácido nitroso y el cation nitrosilo – •• •• O •• • O• •• N •• H + •• O H •• N H H + H •• O •• H •• • O• •• + •• N + + •• O •• • O• ION NITROSONIO H •• N •• • O• Catión nitrosilo y nitrosación R2 R2 R1 R1 N •• H + •• N + + N •• • O• ION NITROSONIO H •• N •• • O• Nitrosación de alquilaminas secundarias R2 R1 R2 + N •• • O• •• N R1 H R1 R2 N •• H •• N N + H + •• N + •• • O• •• • O• •• + la nitrosación de aminas secundarias forma una N-nitroso amina Ejemplo •• (CH3)2NH NaNO2, HCl H2O •• (CH3)2N •• N (88-90%) NITROSAMINA •• • O• Algunas N-nitroso aminas (CH3)2N N O N-nitrosodimetilamina (curtido de pieles) N N N N O N-nitrosopirrolidina (nitrito para curar tocino) N O N-nitrosonornicotina (humo del tabaco) Nitrosación de alquilaminas primarias R H + N R •• N •• • O• •• N H H H N •• H N + H R + •• N + •• • O• •• • O• •• + Es análogo a la nitrosación de aminas secundarias a partir de este punto Nitrosación de alquilaminas primarias R R •• N •• N •• • O• H + •• N •• N O H H H •• + R H + •• N •• N + H + •• • O• H Nitrosación de alquilaminas primarias La nitrosación de una alquilamina primaria da una sal de un ion alquildiazonio El proceso se llama diazoación H R + N N •• + •• O •• H Iones alquildiazonio R + N N •• + + • R •N N •• Los iones de alquildiazonio pierde con facilidad N2 para dar carbocationes Ejemplo: Nitrosación de la 1,1-dimetilpropilamina NH2 OH + N HONO H2O – N2 + (80%) + (3%) N (2%) Nitrosación de alquilaminas Hasta el momento no hay alguna química útil asociada con la nitrosación de alquilaminas terciarias R R R R + N N •• R R •• N •• • O• Nitrosación de arilaminas Nitrosación de arilaminas terciarias La reacción que se lleva a cabo es una SEA N(CH2CH3)2 1. NaNO2, HCl, H2O, 8°C N(CH2CH3)2 2. HO– N (95%) O Nitrosación de N-alquilarilaminas Es similar a las alquilaminas secundarias; se obtienen N-nitrosoaminas NaNO2, HCl, H2O, 10°C NHCH3 N O NCH3 (87-93%) Nitrosación de arilaminas primarias Se obtienen iones de aril diazonio Los iones aril diazonio son mucho más estables que los iones de alquildiazonio La mayoría de los iones de aril diazonio son estables bajo las condiciones en las que se forman (0-10°C) + RN + ArN N rápido lento N + R Ar + N2 + + N2 Ejemplo (CH3)2CH NH2 NaNO2, H2SO4 H2O, 0-5°C (CH3)2CH + N N HSO4– Origen sintético de las sales de arildiazonio Ar H Ar NO2 Ar NH2 Ar + N N Transformaciones sintéticas de las sales de arildiazonio Transformaciones de las sales de aril diazonio Ar Ar Cl Ar CN + N Ar Ar Ar F Ar I N H Ar Br OH Mecanismo: carbocatión arilo 1) Preparación de fenoles + N Ar N H2O, calor Ar OH Ejemplo NH2 (CH3)2CH 1. NaNO2, H2SO4 H2O, 0-5°C 2. H2O, calor OH (CH3)2CH (73%) Mecanismo: carbocatión arilo 2) Preparación de los fluoruros de arilo Ar + N N HBF4 (ó HPF6) Ar F CALOR Se calienta el sal del tetrafluoroborato del ion diazonio; este proceso se conoce como reacción de Balz-Schiemann (químicos alemanes Günther Schiemann y Günther Balz). Ejemplo NH2 1. NaNO2, HCl, H2O, 0-5°C CCH2CH3 O 2. HBF4 3. calor F CCH2CH3 O (68%) Mecanismo: carbocatión arilo 3) Preparación de nitrocompuestos Ar + N NaNO2 N CALOR Ar NO2 Transformaciones de las sales de aril diazonio Ar Ar Cl Ar CN + N Ar Ar Ar F Ar I N H Ar Br OH Mecanismo: radicales libres 1) Preparación de los yoduros de arilo Es por medio de la reacción de una sal de arildiazonio con yoduro de potasio Ar + N N KI Ar I Ejemplo NH2 Br 1. NaNO2, HCl H2O, 0-5°C I Br 2. KI, temp. amb. (72-83%) Transformaciones de las sales de aril diazonio El ácido hipofosforoso (H3PO2) reduce a las sales de diazonio; el etanol también lo puede hacer. Esta reacción se conoce como desaminación reductiva Ar + N N Ar H Ejemplo NH2 CH3 NaNO2, H2SO4, H3PO2 CH3 (70-75%) Transformaciones de las sales de aril diazonio Ar Ar Cl Ar CN + N Ar Ar Ar F Ar I N H Ar Br OH Mecanismo: radicales libres con sales cuprosas Preparación de cloruros o bromuros de arilo y derivados de benzonitrilo Ar Ar Cl Ar Br CN Ar + N N Los cloruros o bromuros de arilo se preparan al calentar la sal de diazonio con cloruro de cobre (I) o bien bromuro de cobre (I) Las reacciones de sustitución que usan halogenuros de cobre(I) se conocen como reacciones de Sandmeyer Traugott Sandmeyer, investigador suizo Ejemplo NH2 1. NaNO2, HCl, H2O, 0-5°C NO2 2. CuCl, calor Cl NO2 (68-71%) Ejemplo NH2 Cl 1. NaNO2, HBr, H2O, 0-10°C Br Cl 2. CuBr, calor (89-95%) Preparación de Aril Nitrilos Ar + N Cu(CN)2 N Ar CN Los arilnitrilo se preparan cuando una sal de diazonio se hace reaccionar con cianuro de cobre (I) bajo calentamiento Este es otro tipo de la reacción Sandmeyer Ejemplo NH2 CH3 1. NaNO2, HCl, H2O, 0°C CN CH3 2. CuCN, calor (64-70%) calor calor HCl HBr Lo que hace valiosas a las sales de diazonio Permiten 1) la introducción de los siguientes sustituyentes en el anillo bencénico: OH, F, I, y CN 2) obtener patrones de sustitución en el anillo que de otra manera serían muy difíciles de obtener ¿Cómo se podría sintetizar el siguiente compuesto? Ejemplo NH2 NH2 Br2 NaNO2, H2SO4, Br H2O, CH3CH2OH Br H2O Br Br Br (100%) Br (74-77%) ¿Cómo llevaría a cabo las siguientes transformaciones? Reacciones de Azo acoplamiento Azo ACOPLAMIENTO Las sales de diazonio son electrófilos débiles. Solo reaccionan con compuestos aromáticos fuertemente activados hacia la sustitucion electrofílica aromática. Ar + N N + Ar' H Ar N N Ar' Un compuesto azo Ar' debe tener un grupo electrodonador fuerte como OH, OR, o NR2. Ejemplo OH + + C6H5N N OH N NC6H5 Cl– COLORANTES AZOÍCOS USADOS EN LA INDUSTRIA ALIMENTICIA Análisis espectroscópico de Aminas Espectroscopía de Infrarrojo La banda de alargamisnto del enlace N—H aparece en el intervalo de 3000-3500 cm-1 Las aminas primarias dan dos señalesen esta región, una para una vibración de alargamiento simétrico, y la otra para un alargamiento antiasimétrico H R N H R H simétrico N H antiasimétrico Espectroscopía de Infrarrojo -1 Transmitancia (%) Número de onda , cm RNH2 Las aminas primarias dan dos señales por alargamiento del enlace N—H Espectroscopía de Infrarrojo -1 Transmitancia (%) Número de onda , cm R2NH RMN-1H Desplazamientos químicos en: H3C CH2NH2 H3C d 3.9 ppm N C H Está más protegido que O CH2OH d 4.7 ppm C H RMN 13C Los carbonos unidos a N están más protegidos que los unidos a O. CH3NH2 d 26.9 ppm CH3OH d 48.0 ppm UV-VIS Un grupo amino en un anillo bencénico desplaza la max a una longitud de onda más larga. La protonación del N da lugar a un espectro de UV que se parece al del benceno + NH2 NH3 max 204 nm 256 nm max 230 nm 280 nm max 203 nm 254 nm Espectrometría de Masas Los compuestos que solo contienen C, H, y O tienen pesos moleculares pares. Si esta presente un número impar de átomos de N, el peso molecular sera impar. Un pico de un ion molecular con un valor m/z impar sugiere que la muestra que está siendo analizada contiene N. Espectrometría de Masas •• El nitrógeno estabiliza a los carbocationes, los cuales dirigen los patrones de fragmentación. (CH3)2NCH2CH2CH2CH3 e– •+ (CH3)2NCH2CH2CH2CH3 + (CH3)2N CH2 + •CH2CH2CH3 Espectrometría de Masas •• El nitrógeno estabiliza a los carbocationes, los cuales dirigen los patrones de fragmentación. CH3NHCH2CH2CH(CH3)2 e– •+ CH3NHCH2CH2CH(CH3)2 + CH3NH CH2 + •CH2CH(CH3)2