a) 5 H2O2 + 2 MnO4 - IES Dolmen de Soto
Anuncio
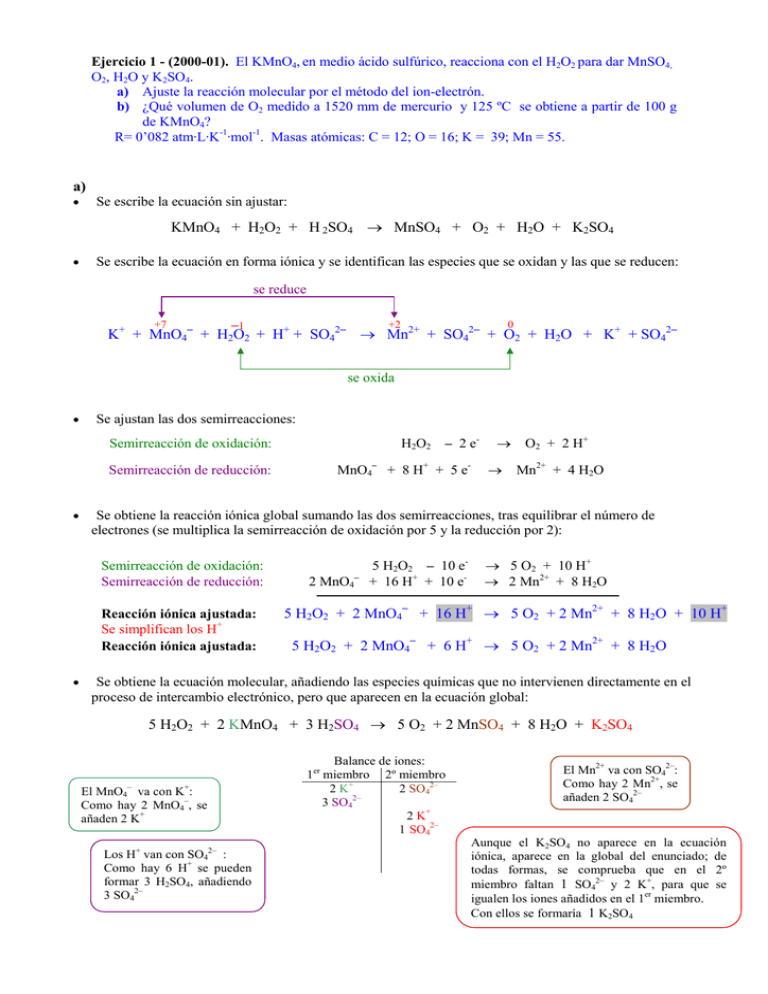
Ejercicio 1 - (2000-01). El KMnO4, en medio ácido sulfúrico, reacciona con el H2O2 para dar MnSO4, O2, H2O y K2SO4. a) Ajuste la reacción molecular por el método del ion-electrón. b) ¿Qué volumen de O2 medido a 1520 mm de mercurio y 125 ºC se obtiene a partir de 100 g de KMnO4? R= 0’082 atm·L·K-1·mol-1. Masas atómicas: C = 12; O = 16; K = 39; Mn = 55. a) • Se escribe la ecuación sin ajustar: KMnO4 + H2O2 + H 2SO4 → MnSO4 + O2 + H2O + K2SO4 • Se escribe la ecuación en forma iónica y se identifican las especies que se oxidan y las que se reducen: se reduce +7 +2 –1 0 K+ + MnO4– + H2O2 + H+ + SO42– → Mn2+ + SO42– + O2 + H2O + K+ + SO42– se oxida • Se ajustan las dos semirreacciones: H2O2 – 2 e- Semirreacción de oxidación: Semirreacción de reducción: • → O2 + 2 H+ Mn2+ + 4 H2O Se obtiene la reacción iónica global sumando las dos semirreacciones, tras equilibrar el número de electrones (se multiplica la semirreacción de oxidación por 5 y la reducción por 2): Semirreacción de oxidación: Semirreacción de reducción: Reacción iónica ajustada: Se simplifican los H+ Reacción iónica ajustada: • MnO4– + 8 H+ + 5 e- → – 2 MnO4 5 H2O2 – 10 e+ 16 H+ + 10 e- → 5 O2 + 10 H+ → 2 Mn2+ + 8 H2O 5 H2O2 + 2 MnO4– + 16 H+ → 5 O2 + 2 Mn2+ + 8 H2O + 10 H+ 5 H2O2 + 2 MnO4– + 6 H+ → 5 O2 + 2 Mn2+ + 8 H2O Se obtiene la ecuación molecular, añadiendo las especies químicas que no intervienen directamente en el proceso de intercambio electrónico, pero que aparecen en la ecuación global: 5 H2O2 + 2 KMnO4 + 3 H2SO4 → 5 O2 + 2 MnSO4 + 8 H2O + K2SO4 El MnO4– va con K+: Como hay 2 MnO4–, se añaden 2 K+ Los H+ van con SO42– : Como hay 6 H+ se pueden formar 3 H2SO4, añadiendo 3 SO42– Balance de iones: 1er miembro 2º miembro 2 SO42– 2 K+ 2– 3 SO4 2 K+ 1 SO42– El Mn2+ va con SO42–: Como hay 2 Mn2+, se añaden 2 SO42– Aunque el K2SO4 no aparece en la ecuación iónica, aparece en la global del enunciado; de todas formas, se comprueba que en el 2º miembro faltan 1 SO42– y 2 K+, para que se igualen los iones añadidos en el 1er miembro. Con ellos se formaría 1 K2SO4 b) 5 H2O2 + 2 KMnO4 + 3 H2SO4 → 5 O2 + 2 MnSO4 + 8 H2O + K2SO4 Como Mm( KMnO4) = 158 g/mol 100 g KMnO4 ⋅ 1 mol KMnO4 5 mol O2 ⋅ = 1'58 mol O2 158 g KMnO4 2 mol KMnO4 0’633 g de KMnO4 VO2 = nO2 ⋅ R ⋅ T P atm⋅L 1'58 mol ⋅ 0'082 mol ⋅K ⋅ 398 K = = 25'8 L O2 atm 1520 mmHg ⋅ 7601 mmHg





