Calor diferencial de solución
Anuncio

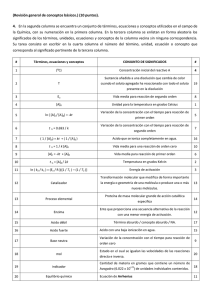
Laboratorio 6. Calor diferencial de solución Objetivo Determinar la solubilidad del ácido oxálico a diferentes temperaturas. Calcular el calor diferencial de la solución saturada. Teoría Uno de los casos más simples de equilibrio es el de una solución saturada en contacto con un exceso de soluto. En este equilibrio las moléculas viajan del sólido a la solución con la misma velocidad a la que las moléculas en la solución pasan al sólido. La concentración que del soluto que se encuentra en esa solución saturada se denomina la solubilidad del soluto la cual usa una escala arbitraria. En éste experimento utilizaremos la escala molal, la solubilidad será la molalidad (ms) del soluto en la solución saturada. Podemos establecer la constante para dicho equilibrio la cual es: K= a2 a 2* ( 6-1) Donde, a2 representa la actividad del soluto en la solución saturada y a2* la actividad del soluto puro. La alternativa para el estado estándar el el soluto puro a la temperatura y presión que está envuelto, haciendo a2* igual a uno. La actividad a2 se relaciona a la molalidad, m, del soluto por promedios del coeficiente de actividad γ, función de T, P y composición. Luego K = [a2] m = ms = γs ms, donde el subscrito s indica que la relación aplica a la solución saturada. El cambio en de la temperatura a Kelvin a presión constante refleja un cambio en ms, y por lo tanto un cambio en γs el cual afecta ambas variaciones en la temperatura y concentración de la solución. La ecuación de van’t Hoff requiere que: ⎛ ∂ ln K ⎞ ∆H 0 ⎟⎟ = ⎜⎜ 2 ⎝ ∂ T ⎠ p RT ( 6-2) Donde ∆Ho es el cambio en entalpía de la solución. Esta cantidad no debe ser confundida con cualquier calor medible experimentalmente de la solución; éste debe ser determinado indirectamente. Tomando en cuenta el efecto de la temperatura y la concentración en γs el resultado para presión constante es: ⎡ ⎛ ∂ ln γ ⎞ ⎤ d ln m [∆H DS ]m=ms s ⎟⎟ = ⎢1 + ⎜⎜ ⎥ RT 2 ⎢⎣ ⎝ ∂ ln m ⎠T , P ,m=ms ⎥⎦ dT ( 6-3) Donde [∆HDS]m=ms es el calor diferencial de la solución con saturación a temperatura y presión dada. Para los casos en el cual el coeficiente de actividad γ para el soluto cambie poco con concentración en el vecino intermediario de saturación, el término de la izquierda de la ecuación viene a ser: d ln ms [∆H DS ]m=ms = dT RT 2 ( 6-4) En ésta aproximación, el calor diferencial de la solución saturada puede ser calculado a una temperatura dada, multiplicando por R la pendiente de la gráfica de ln ms vs 1/T. El calor de la solución la cual estamos considerando es el calor absorbido cuando 1 mol del sólido es disuelto en una solución que está prácticamente saturada. Éste difiere del calor de la solución en una dilución infinita la cual el calor de la solución se encuentra en tablas, por una cantidad equivalente al calor de dilución de saturación a dilución infinita. Procedimiento 1. Estandarización de NaOH 0.5 M con Ftalato ácido de potasio (KHP) utilizando fenolftaleina como indicador. a. Pese aproximadamente 0.200 gramos de Ftalato ácido de potasio, colóquelos en un matraz erlenmeyer. b. Agregue 10 mL de agua destilada c. Valore con NaOH 0.5 M d. Determine la concentración real del hidróxido de sodio utilizando la siguiente ecuación estequiometrica NaOH(aq) + C6H4C2HO4K Æ C6H4C2O4KNa + H2O(l) 2. Determinación de la solubilidad de ácido oxálico En el laboratorio usted encontrara el siguiente montaje: Solucion saturada de Borax Controlador de temperatura Figure 6-1. Montaje experimental o La solubilidad del ácido oxálico se determinará a 35, 25, 15, y 5 oC. o Prepare un solución saturada de ácido oxálico, añadiendo un exceso de los cristales a una temperatura alta y enfriando la solución para que el material disuelto se cristalice. o Caliente la solución hasta alcanzar la temperatura de 35 oC. o Espere 15 minutos hasta que la solución alcance el equilibrio. o Tome dos muestras de 5 mL y colóquelas en botellas de pesada separadas las cuales han sido previamente pesadas. o Pese la solución en la botella. o Transfiera cuantitativamente la solución a un matraz Erlenmeyer de 250 mL. o Añada fenolftaleína como indicador y titule con NaOH 0.5 M estandarizado. o Baje la temperatura del baño a 25 oC añadiendo agua fría. o Repita el procedimiento del paso 4 en adelante y con las demás temperaturas. Cálculos Determinación de la concentración real del NaOH (M) VNaOH (L)= VNaOH (mL) 1000 2. Moles de KHP= gramos de KHP 1 mol (PM) 204.23 g 3. Moles de NaOH= Moles de KHP 4. Molaridad NaOH (M)= Moles NaOH 3 = V NaOH (L) 1 Exprese la molaridad como el promedio. Solubilidad Peso molecular acido benzoico = 122.048 g/mol 5.VNaOH (L)= VNaOH (mL) 1000 6. Peso de la solución (Ws) = (Peso botellita con tapa + Muestra) - (Peso botellita vacía con tapa) 7. Moles de acido benzoico = VNaOH gastado(L) x Molaridad (promedio) (NaOH) 8. Gramos de acido benzoico = moles del acido benzoico x PM (122.048 g/mol) 9. Peso del agua (g) = Peso de la solución – Peso del acido benzoico 10. Peso agua (Kg) = 11. Molalidad = peso del agua (g) 9 = 1000 1000 moles (acido benzoico) 7 = Kg de agua 10 T (K) = C + 273.15 Haga los cálculos para todas sus muestras y tabúlelos # V NaOH Muestr gastado (L) a Peso de Moles de Gramos Peso del la acido de acido agua solución (g) 1 2 3 4 5 6 7 8 benzoico benzoico Molalidad (m) Para la construcción de la grafica experimental Exprese la temperatura en grados Kelvin. Construye una Tabla de la siguiente forma. Temperatura (K) Molalidad 1/T ln m (m) Grafique lnm (Eje x) Vs 1/T(K) (Eje y) para todos los 8 valores. Esto nos sirve para hallar el calor diferencial de solución ( ∆H s ln ) haciendo uso de la pendiente. Utilice la siguiente ecuación: ln m = −∆H s ln 1 + cons tan te R T Nota: Si su muestra es acido oxálico recuerde que : Acido Oxalico = H2C2O4 PM= 90.04 g/mol, por lo tanto, Gramos de ac. oxálico = moles de ac. oxálico x PM (90.04 g/mol) Moles de acido oxalico = VNaOH gastado(L) x Molaridad (NaOH) 2 Haga los demás cálculos de la misma forma como se hace para acido benzoico. Para la construcción de la grafica teórica de Acido benzoico Utilizando los valores de solubilidades del acido benzoico en agua y la densidad del agua a diferentes temperaturas. Determine el calor diferencial teórico. Temperatura (C) Densidad Solubilidad del agua (g/mL) acido benzoico (g/100mL) 10 0.999 0.21 20 0.998 0.29 30 0.9956 0.42 Por ejemplo para los valores a 10 C molalidad ( Acidobenzoico) = 0.21g ac.benzoico 1mL 1000 g agua 1mol ac.benzoico x x x 100mL 0.999 g agua 1Kg agua 122.048 g Haga lo mismo con sus demás datos y construya la siguiente tabla. Temperatura (K) Molalidad 1/T ln m (m) Determine el calor diferencial de solución con la ecuación siguiente: ln m = −∆H s ln 1 + cons tan te R T Compare el valor experimental con el valor teórico. Para la construcción de la grafica teórica de Acido Oxálico Utilizando los valores de solubilidades del acido oxalico en agua y la densidad del agua a diferentes temperaturas. Determine el calor diferencial teórico. Temperatura (C) Solubilidad del acido benzoico (g/100g) 10 6.08 20 9.52 30 14.23 40 21.52 Por ejemplo para los valores a 10 C molalidad ( Ac. Oxalico) = 6.08 g ac.oxalico 1000 g agua 1mol ac.oxalico x x = 0.6752moles / kg agua 100 g 1Kg agua 90.04 g Haga lo mismo con sus demás datos y construya la siguiente tabla. Temperatura (K) Molalidad 1/T ln m (m) Determine el calor diferencial de solución con la ecuación siguiente: ln m = −∆H s ln 1 + cons tan te R T Compare el valor experimental con el valor teórico. Referencias A. Seidell and W. F. Linke, "Supplement to Solubilities of Inorganic and Organic Compounds," 3d ed., vol. III, D. Van Nostrand Company, Inc., Princeton, N.J., 1952. A. Seidell, "Solubilities of Inorganic and Metal Organic Compounds," 3d ed. vol. I, D. Van Nostrand Company, Inc., Princeton, N.J., 1940. A. Seidell, "Solubilities of Organic Compounds," 3d ed., vol. II, D. Van Nostrand Company, Inc., Princeton, N.J., 1941. A. T. Williamson, Trans. Faraday Soc., 40: 421 (1944). J. H. Hildebrand and R. L. Scott, "Solubilities of Nonelectrolytes," Reinhold Publishing Corporation, New York, 1950. W. J. Mader, R. D. Mold, and M. J. Mold in A. Weissberger (ed.), "Technique of Organic Chemistry," vol. 1, "Physical Methods of Organic Chemistry," 3d ed., pt. 1, chap. 11, Interscience Publishers, Ins., New York, 1959.