•150-complicaciones endoteliales.qxd
Anuncio
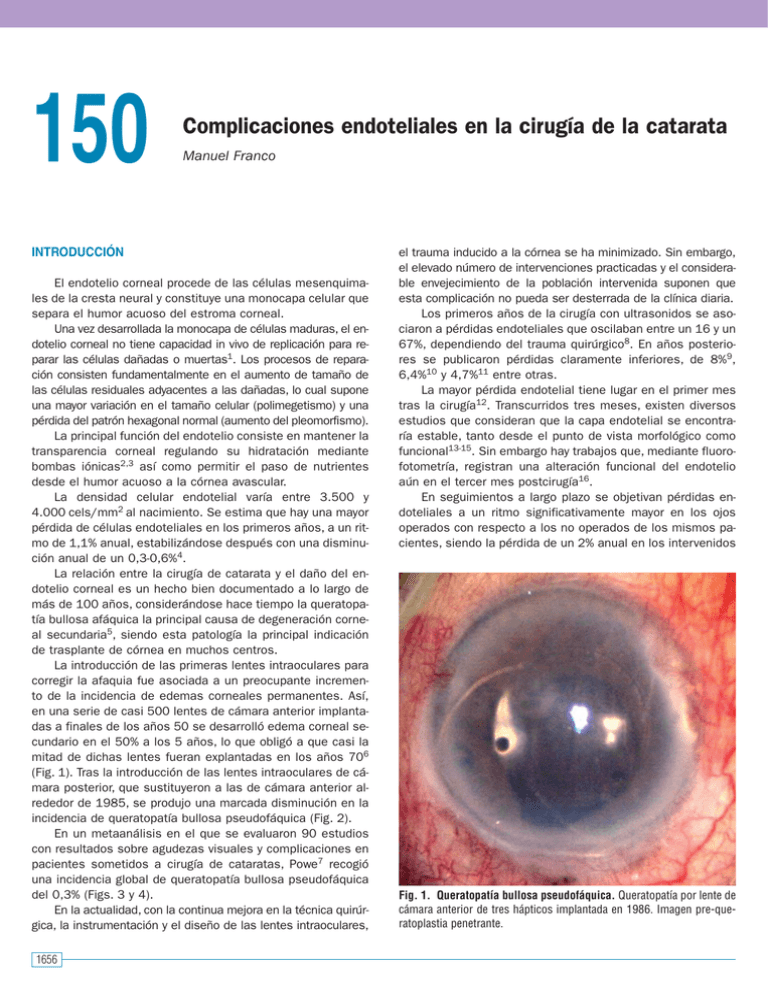
150 Complicaciones endoteliales en la cirugía de la catarata Manuel Franco INTRODUCCIÓN El endotelio corneal procede de las células mesenquimales de la cresta neural y constituye una monocapa celular que separa el humor acuoso del estroma corneal. Una vez desarrollada la monocapa de células maduras, el endotelio corneal no tiene capacidad in vivo de replicación para reparar las células dañadas o muertas1. Los procesos de reparación consisten fundamentalmente en el aumento de tamaño de las células residuales adyacentes a las dañadas, lo cual supone una mayor variación en el tamaño celular (polimegetismo) y una pérdida del patrón hexagonal normal (aumento del pleomorfismo). La principal función del endotelio consiste en mantener la transparencia corneal regulando su hidratación mediante bombas iónicas2,3 así como permitir el paso de nutrientes desde el humor acuoso a la córnea avascular. La densidad celular endotelial varía entre 3.500 y 4.000 cels/mm2 al nacimiento. Se estima que hay una mayor pérdida de células endoteliales en los primeros años, a un ritmo de 1,1% anual, estabilizándose después con una disminución anual de un 0,3-0,6%4. La relación entre la cirugía de catarata y el daño del endotelio corneal es un hecho bien documentado a lo largo de más de 100 años, considerándose hace tiempo la queratopatía bullosa afáquica la principal causa de degeneración corneal secundaria5, siendo esta patología la principal indicación de trasplante de córnea en muchos centros. La introducción de las primeras lentes intraoculares para corregir la afaquia fue asociada a un preocupante incremento de la incidencia de edemas corneales permanentes. Así, en una serie de casi 500 lentes de cámara anterior implantadas a finales de los años 50 se desarrolló edema corneal secundario en el 50% a los 5 años, lo que obligó a que casi la mitad de dichas lentes fueran explantadas en los años 706 (Fig. 1). Tras la introducción de las lentes intraoculares de cámara posterior, que sustituyeron a las de cámara anterior alrededor de 1985, se produjo una marcada disminución en la incidencia de queratopatía bullosa pseudofáquica (Fig. 2). En un metaanálisis en el que se evaluaron 90 estudios con resultados sobre agudezas visuales y complicaciones en pacientes sometidos a cirugía de cataratas, Powe7 recogió una incidencia global de queratopatía bullosa pseudofáquica del 0,3% (Figs. 3 y 4). En la actualidad, con la continua mejora en la técnica quirúrgica, la instrumentación y el diseño de las lentes intraoculares, 1656 el trauma inducido a la córnea se ha minimizado. Sin embargo, el elevado número de intervenciones practicadas y el considerable envejecimiento de la población intervenida suponen que esta complicación no pueda ser desterrada de la clínica diaria. Los primeros años de la cirugía con ultrasonidos se asociaron a pérdidas endoteliales que oscilaban entre un 16 y un 67%, dependiendo del trauma quirúrgico8. En años posteriores se publicaron pérdidas claramente inferiores, de 8%9, 6,4%10 y 4,7%11 entre otras. La mayor pérdida endotelial tiene lugar en el primer mes tras la cirugía12. Transcurridos tres meses, existen diversos estudios que consideran que la capa endotelial se encontraría estable, tanto desde el punto de vista morfológico como funcional13-15. Sin embargo hay trabajos que, mediante fluorofotometría, registran una alteración funcional del endotelio aún en el tercer mes postcirugía16. En seguimientos a largo plazo se objetivan pérdidas endoteliales a un ritmo significativamente mayor en los ojos operados con respecto a los no operados de los mismos pacientes, siendo la pérdida de un 2% anual en los intervenidos Fig. 1. Queratopatía bullosa pseudofáquica. Queratopatía por lente de cámara anterior de tres hápticos implantada en 1986. Imagen pre-queratoplastia penetrante. 150. COMPLICACIONES ENDOTELIALES EN LA CIRUGÍA DE LA CATARATA Fig. 2. Queratopatía bullosa pseudofáquica. Patología desarrollada en paciente con lente de cámara posterior. comparado con un 0,9-1% en los no operados17. Otros trabajos18, con un seguimiento de 10 años en pacientes intervenidos de cataratas, evidencian un ritmo anual de pérdida de células endoteliales de 2,5%, cifra que llega a ser entre 2,5 y 8 veces la pérdida fisiológica en ojos no intervenidos. Se estima que con ese ritmo de pérdida anual una córnea que fuera intervenida con una población de 2.200 cels/mm2 precisaría 60 años para alcanzar la considerada densidad celular crítica de 500 cels/mm2,19, antes de desarrollar una queratopatía bullosa pseudofáquica. Fig. 4. Microscopía electrónica de barrido de córnea que requirió ser trasplantada por queratopatía bullosa pseudofáquica. Incremento de los espacios entre las láminas de colágeno estromal. De acuerdo con estos estudios en los que se hizo un seguimiento a largo plazo podemos suponer que la cirugía de catarata induciría cierto estrés en la capa endotelial que sería responsable de un aumento en el ritmo fisiológico de muerte celular. DAÑO ENDOTELIAL Y CIRUGÍA DE CATARATA: FACTORES PREDISPONENTES Existen diferentes factores preoperatorios, intraoperatorios y postoperatorios que pueden predisponer al desarrollo de un fracaso endotelial. Factores preoperatorios 1. Edad La edad avanzada del paciente es un factor que se ha asociado de manera significativa con un mayor riesgo de pérdida celular, independientemente del tipo de catarata17,20. Sin embargo hay trabajos que no confirman esta relación21. 2. Longitud axial Se ha encontrado mayor pérdida endotelial en ojos con longitud axial menor22. Fig. 3. Imagen de microscopía óptica de córnea (tinción de Hematoxilina-Eosina) con queratopatía bullosa pseudofáquica. Se pueden apreciar engrosamiento estromal, pliegues en la cara posterior con membrana de Descemet interrumpida y pequeñas bullas en el epitelio. 3. Población endotelial escasa Bourne18 evidenció en su seguimiento de 10 años de pacientes intervenidos con córnea guttata una pérdida significa1657 VIII. COMPLICACIONES tivamente mayor (7,2% anual) de células endoteliales en comparación con las córneas que no presentaban esta alteración. Es de suponer que en estos pacientes la cifra crítica de 500 céls/mm2 se alcanzaría considerablemente antes que en córneas con poblaciones normales. Waltman23 recoge que el 25% de los ojos no operados de pacientes con queratopatía bullosa pseudofáquica presentaban una densidad endotelial escasa (menor de 1.500 céls/mm2). En estos casos la población endotelial de reserva estaría limitada ante el trauma quirúrgico (Fig. 5). 4. Polimegetismo Se ha demostrado una relación entre la variación en el tamaño celular y el desarrollo de edema corneal postcirugía de modo que pacientes que desarrollaron edema corneal presentaban un coeficiente de variación en el tamaño celular de 40,7 frente a un 27,4 en el grupo que no desarrolló edema24 (Fig. 6). Fig. 5. Imagen de microscopía electrónica de barrido de córnea con queratopatía bullosa pseudofáquica. Excrecencias en la membrana de Descemet que se corresponden con guttas. 5. Patología concomitante • Diabetes. Hay trabajos que no encuentran diferencia entre los pacientes diabéticos y no diabéticos en cuanto a los cambios en el endotelio corneal postcirugía25. Lee26 demuestra que disminuye la densidad endotelial y aumenta el polimegetismo de manera significativa en los pacientes intervenidos de catarata con retinopatía diabética proliferante en comparación con pacientes no diabéticos. Se considera que la hiperglucemia incrementa los niveles de glucosa en humor acuoso y esto alteraría la función endotelial normal. Otros autores27 han valorado la permeabilidad de la capa endotelial tras cirugía de catarata, comparando paciente diabéticos y no diabéticos. Han encontrado que la permeabilidad endotelial aumenta significativamente en los diabéticos, especialmente en el cuarto día postcirugía. La recuperación de la permeabilidad corneal se alcanza a las 6 semanas en el grupo de diabéticos frente a 3 semanas en el grupo de no diabéticos. • Uveítis. La inflamación intraocular puede ocurrir como consecuencia de diversos estímulos. Pese a que, en principio, es una respuesta protectora, en algunas ocasiones se amplifica y perpetúa de forma patológica convirtiéndose en dañina. Las moléculas que inducen y amplifican la inflamación se denominan mediadores inflamatorios e incluyen diversas categorías de moléculas cuyo efecto nocivo puede también afectar al endotelio corneal. Rowland28, inoculando leucocitos en la cámara anterior de conejos, demostró que algunos de esos mediadores al estar presentes en el segmento anterior producían un daño perfectamente objetivable sobre el endotelio. Elgebaly 29 demostró posteriormen1658 Fig. 6. Polimegetismo en valoración preoperatorio. El coeficiente de variación es de 0,44. 150. COMPLICACIONES ENDOTELIALES EN LA CIRUGÍA DE LA CATARATA te cómo la exposición de endotelios corneales bovinos a leucocitos determinaba graves daños en los 5-10 minutos siguientes a la exposición. Es necesario además recalcar la posibilidad de reactivación del cuadro inflamatorio en estos pacientes, como consecuencia de la cirugía de catarata, favoreciendo el deterioro endotelial. Dicha reactivación sería especialmente prevalente cuando la uveítis estuviese asociada a ciertas entidades como artritis idiopática juvenil o la enfermedad de Behçet30,31. Por ello la cirugía de cataratas en pacientes con uveítis debería realizarse siguiendo una serie de pautas que minimizasen el riesgo de reactivación32. Factores intraoperatorios 1. Incisión La simple incisión en limbo o córnea es capaz de inducir cierta pérdida endotelial en el centro de la córnea en animales33. Es de suponer que a mayor extensión de la incisión, la pérdida celular inducida será mayor. Se ha evaluado el daño endotelial en función de la localización de la incisión, sin encontrar diferencias entre el abordaje lateral o superior22. La pérdida celular es homogénea en toda la cornea cuando la cirugía es con ultrasonidos, a diferencia de la cirugía extracapsular que implica mayor pérdida en la proximidad de la incisión17. 2. Medicamentos Durante la cirugía del cristalino se introducen distintas sustancias químicas que pueden resultar tóxicas para el endotelio, tales como soluciones de irrigación, midriáticos, anestésicos, mióticos, antibióticos o colorantes. Las soluciones de irrigación intraocular tienen potencial toxicidad para el endotelio. La solución de irrigación ideal debe mantener los valores de osmolaridad y pH dentro de un rango fisiológico y aportar iones esenciales y fuentes de energía para las células endoteliales34. Edelhauser demostró en estudios con córneas humanas in vitro que la solución de suero fisiológico provocaba edema corneal y daño endotelial35. La solución de Ringer producía los mismos efectos, aunque en menor medida, mientras que la solución salina balanceada (BSS®) mantenía la estructura y la función endotelial de varias horas a indefinidamente si se enriquecía con bicarbonato, dextrosa y glutation reducido (BSS® Plus)34. La solución salina balanceada enriquecida (BSS® Plus) se ha mostrado en laboratorio mejor para proteger el endotelio que el BSS® solo, aunque los ensayos clínicos no han demostrado una aparente diferencia a largo plazo36. La adrenalina se añade con frecuencia a las soluciones de irrigación para mejorar la dilatación pupilar. Los casos de edema corneal tras la utilización de adrenalina intracamerular se han atribuido al pH y a la toxicidad de los conservantes como el bisulfito sódico37. Los anestésicos intracamerulares son empleados con frecuencia. La lidocaína al 1% o 2% se ha mostrado segura en estudios in vitro cuando su exposición no sobrepasa 1 minuto. Por el contrario tanto la lidocaína al 4% como la bupivacaina al 0,5% pueden provocar efectos citotóxicos sobre el endotelio durante el primer minuto, por lo que deben evitarse38. En estudios clínicos se ha demostrado que el uso de lidocaína al 1% intracamerular frente a placebo no produce diferencias significativas en el recuento endotelial39. Los mióticos intraoculares también presentan posible toxicidad endotelial: – La Acetilcolina (Miochol®) actuando durante 30 minutos in vitro altera la función y la estructura endotelial, provocando necrosis. – En un test similar, el carbacol (Miostat®) es bien tolerado y no produce cambios morfológicos en el endotelio40. Sin embargo, in vivo, ambas soluciones son bien toleradas41. Posiblemente la mayor toxicidad del Miochol® se deba a la falta de un disolvente apropiado. La cefuroxima, 1 mg en 0,1 ml de BSS® al final de la cirugía de la catarata ha demostrado reducir la incidencia de endoftalmitis postquirúrgica y ser segura para el endotelio42. Aunque es discutido el uso de antibióticos en soluciones de irrigación, tanto la vancomicina43 como la gentamicina44 se han mostrado seguras para el endotelio a las concentraciones habituales. El colorante azul tripán se considera seguro para el endotelio al 0,1%45 existiendo una forma comercial desarrollada específicamente para su uso ocular intracamerular (VisionBlue® 0,06%). En estudios realizados con conejos, la povidona yodada tanto al 5% como al 10% induce una severa toxicidad endotelial si se introduce en cámara anterior46. Aunque su uso es tópico, debemos evitar la entrada inadvertida de povidona al interior ocular durante la cirugía dada su gran toxicidad. 3. Viscoelásticos Desde la aparición de las sustancias viscoelásticas en 197947 una de sus principales utilidades ha sido proteger el endotelio del trauma quirúrgico. Los viscoelásticos que mejor protegerán el endotelio serán aquellos con más capacidad de revestimiento y que se mantengan en el interior del ojo por más tiempo. Esto lo cumplen mejor los visoelásticos dispersivos que los cohesivos. Los primeros tienen en su composición condroitín sulfato y hialuronato sódico. El condroitín sulfato tiene dos cargas negativas, mientras que el hialuronato sódico tiene una. Esta triple carga negativa favorece su adhesión a la membrana celular endotelial, que presenta una carga eléctrica positiva. Por otra parte las cadenas de los viscoelásticos dispersivos son 1659 VIII. COMPLICACIONES pequeñas y soportan bien las turbulencias de los fluidos, eliminándose sólo de manera parcial durante la cirugía. Los viscoelásticos cohesivos, al estar formados por cadenas largas entrelazadas son eliminados rápidamente y en bloque de la cámara anterior. Después de someter durante tres minutos una monocapa de células endoteliales de conejo recubierta de diferentes sustancias viscoelásticas a una corriente de irrigación, se encontró48 que el 90% de las células que habían sido recubiertas con Viscoat® permanecían tapizadas, frente al 50% de las recubiertas por hidroxipropilmetilcelulosa y al 10% de las que habían sido recubiertas por hialuronato sódico. La hidroxipropilmetilcelulosa se comporta como una sustancia dispersiva, aunque no tiene ninguna carga eléctrica en sus moléculas. En otro estudio49, realizado con veinte ojos de cerdo, se simuló cirugía de catarata y se midió la retención de diversos viscoelásticos en cámara anterior. El tiempo que se necesitó para retirar completamente el viscoelástico con un sistema de irrigación-aspiración era significativamente mayor para el Viscoat® que para los otros que fueron evaluados (Provisc®, Healon 5® y Discovisc®), cuyos tiempos de eliminación eran similares. McDermott50 tras hacer cirugía de cataratas en ojos de conejos en los que empleó diferentes viscoelásticos trepanó el botón central y midió el grosor de la película de viscoelástico que tapizaba la superficie endotelial. Encontró que con Healon GV® el viscoelástico adyacente al endotelio tenía un grosor de 0,4 µm, mientras que con Amvisc Plus® el grosor era de 14 µm y con Viscoat®, 300-400 µm. A pesar de estos trabajos hay estudios comparativos en los que no se objetivaron diferencias en cuanto a pérdidas endoteliales en función del tipo de viscoelástico empleado (dispersivo o cohesivo)51,52. La utilidad de las sustancias dispersivas, dada su mayor adherencia a la superficie endotelial, tal vez sea mayor cuando se haga cirugía de córneas comprometidas y/o cristalinos densos que hagan prever un mayor trauma quirúrgico. Sin embargo la mayor capacidad para mantenerse en el interior del ojo que presentan los viscoelásticos dispersivos puede provocar mayores picos hipertensivos en el postoperatorio, al bloquear la malla trabecular53. Para evitarlo se deberá hacer una retirada minuciosa de estas sustancias, además de evitar su empleo durante la fase de implantación de la lente, en la que bastará con un material cohesivo, de más fácil eliminación. 4. Ultrasonidos La vibración de la aguja del faco con frecuencia ultrasónica genera ondas de choque y microburbujas que, como efecto nocivo, serán responsables de un posible daño endotelial durante la cirugía. En el estudio de Olson54 con ojos de animales y humanos se objetiva, mediante microscopía electrónica, un daño desigual en las células endoteliales tras el empleo de ultrasonidos. Para explicar este hallazgo el autor considera que lo que él llama «campo de radiación» del faco1660 emulsificador podría no ser uniforme así como que la tolerancia individual de las distintas células a un mismo daño sería diferente. Los ultrasonidos se asocian asimismo a la liberación de radicales libres, que son nocivos para el endotelio55,56. Para tamponar los radicales libres se defiende el empleo de soluciones con glutation57 o ácido ascórbico58. Un tiempo prolongado de ultrasonidos se ha demostrado que es un fuerte factor predictor de la pérdida de células endoteliales22,59. Para evitar el empleo de ultrasonidos surge la idea de eliminar el cristalino mediante un sistema basado en pulsos de solución salina (AquaLase®)60. Sin embargo Sandoval61 no encuentra diferencias en cuanto a paquimetría ni pérdida de células endoteliales entre el grupo intervenido mediante este sistema y el sometido a ultrasonidos convencionales. Resultados similares se habían obtenido por estos mismos autores utilizando ojos de cadáver en un trabajo previo62. Tradicionalmente la aguja de faco vibra en sentido longitudinal (faco coaxial) con una frecuencia variable en función del fabricante del equipo. Recientemente se ha introducido el sistema oscilatorio de ultrasonidos (faco torsional) que puede ser usado solo o en combinación con el longitudinal. Entre sus principales ventajas está que genera menos energía térmica, reduciendo el riesgo de quemaduras, y que, según algunos trabajos63, acorta el tiempo de ultrasonidos y la potencia empleada por lo cual induciría menor daño endotelial. Vargas64 en un estudio hecho con ojos de cadáver encuentra menor pérdida endotelial en aquellos en los que había sido empleada la técnica oscilatoria en comparación con la técnica convencional. El fenómeno de «chattering» (repulsión de los fragmentos de cristalino por la punta del faco que vibra en sentido longitudinal) se da con más frecuencia con núcleos duros. Estos fragmentos, empujados desde la aguja del faco, dañarían estructuras como el endotelio. Si la aguja oscila en sentido lateral se minimiza el fenómeno de «chattering» incrementando la eficiencia de los ultrasonidos por lo que esta técnica podría estar especialmente indicada para la cirugía de núcleos densos. 5. Zona en la que se realiza la facoemulsificación Cambiar el espacio de emulsificación del cristalino de la cámara anterior a la cámara posterior y al espacio intracapsular, aumentando así la distancia entre el extremo de la aguja del faco y el endotelio, supuso una disminución en la pérdida de células endoteliales65. Con objeto de orientar la energía liberada por la aguja de ultrasonidos lejos del endotelio corneal hay autores que recomiendan técnicas diferentes de la habitual como es el «reversed tip and snip» evaluado por Kohlhaas66. Se trata de trabajar con el bisel de la aguja de ultrasonidos orientado hacia la cápsula posterior. Dicho autor compara la pérdida endotelial en un grupo intervenido mediante esta técnica («reversed tip and snip») y otro en el que se emplea el «divide y vencerás» obteniendo una menor pérdida celular en el primero. 150. COMPLICACIONES ENDOTELIALES EN LA CIRUGÍA DE LA CATARATA En otros trabajos se defiende la idea de que trabajar en un plano anterior no es más nocivo que hacerlo en el saco capsular. Alió67 compara la técnica de «stop and chop» con la que llama «phaco-out» que consiste en luxar el núcleo a cámara anterior, donde se emulsifica. Entre ambos grupos no obtiene diferencia en cuanto a pérdidas endoteliales (11,18% y 11,20% respectivamente), aunque se registró un mayor edema corneal en el segundo durante las primeras dos semanas postcirugía. Esto último lo atribuyen a la menor distancia entre la aguja del faco y la córnea, así como al mayor volumen de viscoelástico empleado en el grupo de «phaco-out», lo que dificultaría el lavado completo del mismo al final de la cirugía. Tanto los ultrasonidos en plano anterior como el posible viscoelástico retenido provocarían cierta disfunción transitoria del endotelio. neal inducido por trabajar a través de incisiones muy estrechas en el grupo de la microincisión. Alió71, comparando los resultados de la cirugía microincisional con la coaxial encuentra que no hay diferencias en pérdidas endoteliales, tiempo de facoemulsificación y paquimetrías entre ambos grupos. Sin embargo Zafiarakis72 recoge una pérdida endotelial de 3,6% en el grupo intervenido con técnica MICS, significativamente menor que la que se registra en un segundo grupo intervenido mediante faco coaxial (6,1%). 7. Volumen de fluidos El volumen de líquido empleado en la infusión es otro de los factores que se han relacionado con una mayor pérdida de células endoteliales20. De ahí que mejorar la fluídica sea objetivo de la cirugía moderna. 6. Técnica de eliminación del núcleo Antes de la popularización de las técnicas de nucleofractura un tiempo prolongado de cirugía, una mayor liberación de ultrasonidos y el gran volumen de fluidos circulando por la cámara anterior conllevaba un mayor daño endotelial. Todo ello suponía un incremento en la pérdida de endotelio como se demostró en el trabajo de Hayashi68 que recoge, a los tres meses de la cirugía, una pérdida significativamente menor de células endoteliales en el grupo intervenido mediante la técnica de «divide y vencerás», comparado con el grupo en el que sólo se realizó esculpido sin nucleofractura (10,4% vs. 17,2% respectivamente). Otros estudios como el de Kosrirukvongs59 confirman que la pérdida endotelial es mayor con la técnica de «chip and flip» (23,2%) que con «divide y vencerás» (9,9%). Posteriormente, aparecen las técnicas de «chop» que aspiraban a reducir el empleo de ultrasonidos y el tiempo de cirugía minimizando así el trauma quirúrgico. En estudios que comparan la técnica de «faco-chop» con la de «divide y vencerás» se recoge una pérdida endotelial significativamente menor en el primer grupo (4,72%) comparado con el segundo (13,80%)11. La técnica de «stop and chop», en la que se esculpe un surco central antes de proceder a la nucleofractura, no parece conllevar un mayor daño para el endotelio que la técnica de «faco-chop»69. Comparando la técnica de «faco-chop» con otra técnica de nucleofractura como es la «preslice», en la que se fractura el núcleo con el empleo de dos choppers, no se encontraron diferencias en el daño endotelial inducido21. La tendencia de los últimos años es realizar la cirugía por incisiones progresivamente menores. Estudios que comparan la pérdida endotelial entre la cirugía coaxial por 3,2 mm y la microincisional bimanual han concluido que la pérdida endotelial no era significativamente mayor en ningún grupo, aunque la paquimetría en el primer día postcirugía era mayor en el segundo grupo70. En dicho trabajo esto último se atribuye a un mayor tiempo de cirugía y a un posible mayor trauma cor- 8. Tipo de catarata Para algunos autores la energía ultrasónica liberada en el ojo no es un factor independiente que justifique el daño endotelial20. Al realizar un análisis univariante y multivariante para valorar los factores de riesgo de daño endotelial en la cirugía de catarata Hayashi concluye que la consistencia del núcleo es el principal factor de riesgo, seguido del tamaño nuclear y de un volumen de infusión grande. Por tanto, según este estudio20, a mayor consistencia y tamaño del núcleo, mayor será el daño endotelial. Se concluye que aunque los ultrasonidos empleados en la cirugía están en relación con la consistencia del núcleo, la energía liberada no es un factor predictor significativo. El daño provocado se explicaría por el trauma directo de unos fragmentos nucleares de consistencia dura sobre el endotelio así como por el incremento de maniobras quirúrgicas asociado a la cirugía de este tipo de cristalino, no por el ultrasonido en sí (Fig. 7). En un estudio de Bourne17 en el que comparan dos grupos de pacientes intervenidos mediante cirugía extracapsular y ultrasonidos encuentran una pérdida endotelial similar en ambos. Sin embargo, cuando se analiza el subgrupo de cataratas densas, encuentran que realizar cirugía con ultrasonidos conlleva un riesgo alto de pérdida celular marcada (52,6%) si se compara con la cirugía extracapsular (23,1%). Esto lleva a los autores a considerar que tal vez la facoemulsificación no sea la técnica idónea para intervenir ese tipo de cataratas. 9. Cirugía complicada Aquellos casos en los que se prevea una mayor manipulación quirúrgica (sinequias, síndrome de iris flácido, opacidades corneales, cristalinos subluxados, etc.) se asociarán también con una cirugía más prolongada, compleja y con mayor 1661 VIII. COMPLICACIONES Factores postoperatorios 1. Presencia de vítreo en cámara anterior Fig. 7. Cirugía mediante técnica de chop en núcleo denso. El riesgo de fracaso endotelial es mayor que con cataratas menos densas. riego de complicaciones. Cabe suponer que una eventual rotura capsular con o sin vitreorragia implicará un mayor daño endotelial. En el trabajo de Bourne17 se recoge un riesgo 2,6 veces mayor de pérdida endotelial importante (que consideran mayor de un 15%) si hubo complicaciones quirúrgicas de rotura capsular o vitreorragia. El contacto entre vítreo y endotelio fue considerado uno de los factores principales en la génesis de la queratopatía bullosa afáquica antes de la implantación de las lentes intraoculares, que tendían a mantener al primero alejado de la córnea74. La cirugía extracapsular de catarata, en la que se preserva el saco capsular, supuso una ostensible reducción del número de pacientes con presencia de vítreo en cámara anterior. La edematización corneal inducida por vítreo puede ser directa (mecánica) o indirecta, al causar inflamación crónica del segmento anterior. Homer75, en una serie de 17 pacientes, logró reducir el edema corneal en 9 de ellos al realizar vitrectomía anterior, identificando como factor claramente beneficioso la realización temprana de la vitrectomía. Leibowitz76 demostró que la realización de vitrectomía anterior suponía una mejoría sustancial en términos de hidratación corneal, produciéndose en algunos casos una significativa mejoría del edema corneal secundario, aunque los cambios que el vítreo ocasionaba en el endotelio (objetivados mediante microscopía especular) permanecían a pesar de la extracción del mismo75. 2. Lentes intraoculares heterotópicas 10. Experiencia del cirujano Es lógico sospechar que durante el periodo de aprendizaje de la cirugía con ultrasonidos los factores que influyen en una mayor pérdida endotelial están incrementados. Durante la curva de aprendizaje esperamos encontrar un tiempo quirúrgico prolongado con un mayor consumo de solución de irrigación, así como el empleo de mayor potencia de ultrasonidos y un aumento de las maniobras intraoculares. Sin embargo en un estudio73 que evaluó la pérdida endotelial inducida en la cirugía practicada por un residente junior (con un año de experiencia quirúrgica, en el que había realizado aproximadamente 100 cirugías) se encontró que había un 11,6% de pérdida. La cirugía se realizó mediante la técnica «divide y vencerás». Dicho porcentaje es comparable al presentado en otros trabajos de cirujanos experimentados. En dicho estudio encuentran que los núcleos con densidad grado 3 y un tiempo absoluto de ultrasonidos prolongado eran factores predictores independientes de pérdida endotelial. Esto lleva a los autores a concluir que aunque la técnica «divide y vencerás» se demuestra segura en un cirujano junior, sería recomendable que durante la curva de aprendizaje se evitase la selección de núcleos densos para así reducir los tiempos de ultrasonidos. Sin embargo es lógico suponer que si el porcentaje de complicaciones es mayor en el período de aprendizaje y esto se asocia con una mayor pérdida endotelial17 se producirá un mayor daño celular en el grupo de cirujanos no experimentados. 1662 Hay que distinguir las lentes intraoculares de cámara anterior, cuya contribución al daño endotelial es potencialmente mucho mayor, de las de cámara posterior, menos dañinas en términos de incidencia de queratopatía bullosa pseudofáquica. Por lo que respecta a la patogenia del edema inducido por lentes intraoculares de cámara anterior, se explicaría fundamentalmente por un mecanismo de contacto directo que podría ser: • Constante, así en los casos de lentes intraoculares mal posicionadas. • Inconstante, debido a inestabilidad de cámara (por heridas quirúrgicas filtrantes, bloqueos pupilares, etc.) o a movimientos de la lentes intraoculares (pseudofacodonesis)77. Por lo que se refiere a los movimientos de las lentes intraoculares, pueden determinar contactos periféricos dando lugar a un síndrome denominado del «contacto intermitente»78, relacionado con los movimientos de la cabeza y/o la posición de algunos pacientes, que incluso podrían afectar a la córnea indirectamente mediante la alteración de la dinámica normal del humor acuoso, creando flujos turbulentos que dañarían el endotelio. En relación con las lentes intraoculares de cámara posterior implantadas en sulcus, su potencial influencia en la génesis de queratopatía bullosa pseudofáquica podría ser: • Indirecta, induciendo liberación de mediadores inflamatorios como consecuencia del roce y subsiguiente 150. COMPLICACIONES ENDOTELIALES EN LA CIRUGÍA DE LA CATARATA trauma constante sobre dos estructuras muy vascularizadas y sensibles como son el iris y el cuerpo ciliar. Este mecanismo también puede jugar un papel coadyuvante en el caso de las lentes intraoculares de cámara anterior, por el contacto de los hápticos con el iris, perpetuando la respuesta inflamatoria. • Directa (menos común), mediante contacto directo con el endotelio de hápticos luxados a cámara anterior (Fig. 8). 3. Otros Las sinequias anteriores podrían también contribuir al daño corneal provocando una separación entre endotelio y Descemet79 o incluso desgarros en la capa endotelial al despegarse (bien espontánea o iatrogénicamente). En los primeros años del empleo de las lentes intraoculares se relacionaron algunas sustancias derivadas de su material, producidas por la degradación de sus componentes, con lesiones post-quirúrgicas del endotelio80. Sin embargo, la utilización de materiales cada vez más biocompatibles (lentes acrílicas, de colámero, de hidrogel…), ha minimizando este daño potencial. Finalmente, la uveítis crónica postquirúrgica es un factor conocido de daño endotelial, pudiendo deberse a numerosas causas (mecánicas, tóxicas, infecciosas, inmunológicas…). La liberación de mediadores inflamatorios, y su difusión al endotelio pueden causar daños directamente o mediante el inicio de una respuesta inflamatoria celular81. MANEJO CLÍNICO DEL EDEMA CORNEAL POSTQUIRÚRGICO La aparición de edema corneal en grado variable tras la cirugía de catarata ocurre en aproximadamente el 53% de los Fig. 8. Háptico de lente de cámara posterior en cámara anterior. Lente intraocular de cámara posterior con háptico luxado a cámara anterior que deforma ligeramente el iris. pacientes82. Debemos valorar si el edema se ha producido en el postoperatorio inmediato o si su aparición es tardía, y si se produjeron complicaciones durante la cirugía o posteriormente. Además de la exploración con lámpara de hendidura y la toma de la presión intraocular, puede resultar útil el uso de la biomicroscopía ultrasónica de segmento anterior, pues nos permite localizar alteraciones estructurales a través de córneas no transparentes83. Es importante conocer el tipo de edema desde el punto de vista de su etiopatogenia, para decidir el tratamiento más adecuado: Edema corneal por defecto endotelial • Primario (distrofia de Fuchs, distrofia endotelial hereditaria congénita, córnea guttata). El edema aparece en el estroma, progresa y es irreversible. • Secundario (inflamación, cirugía). Aparece en el estroma y puede ser reversible si la causa desaparece sin llegar a causar daño irreparable. Si el edema del estroma se hace crónico se afectará el epitelio, provocando una queratopatía bullosa. Edema corneal con endotelio normal • Por aumento de la presión intraocular: el edema aparece de forma aguda y aparecerán microquistes en el epitelio. Puede ser consecuencia de material viscoelástico retenido en cámara anterior o motivado por inflamación. Deberemos emplear colirios hipotensores, especialmente beta-bloqueantes o alfa-2-agonistas evitando los inhibidores de la anhidrasa carbónica tópicos, que provocan disfunción de las células endoteliales84, y las prostaglandinas por ser proinflamatorias. Si sospechamos de la inflamación como responsable incrementaremos la pauta de medicación tópica corticoidea. • Aunque todos estos tipos de edema pueden concurrir, el trauma quirúrgico es la principal causa de edema corneal en el postoperatorio inmediato de la cirugía de catarata85. Dado que las células endoteliales del adulto no se pueden dividir, tras la pérdida producida durante la cirugía las células endoteliales migran, agrandándose y estableciendo nuevas uniones intercelulares para sellar las zonas de membrana de Descemet denudada. Además existe un incremento del número de bombas por célula, por lo que la mayoría de los edemas postquirúrgicos se resuelven de forma espontánea en unos días o semanas82. Otras causas de edema corneal precoz no autolimitado son: • El desprendimiento de la membrana de Descemet, la presencia de material cristaliniano retenido y posiciones inadecuadas de la lente intraocular: estas situaciones nos obligarán a realizar ciertas maniobras qui1663 VIII. COMPLICACIONES rúrgicas para reponer la membrana de Descemet, eliminar los restos de cristalino o recolocar la lente. • La aparición de endoftalmitis: deberemos ser agresivos en el tratamiento para evitar una descompensación corneal, además del daño a otros niveles del globo ocular. • El síndrome tóxico de segmento anterior: lo sospecharemos ante la presencia de un edema corneal difuso con inflamación marcada, limitada al segmento anterior, que aparece en el postoperatorio inmediato (1248 h. tras la cirugía). Su etiología es tóxica y entre las posibles causas se incluyen: soluciones intraoculares con una composición, concentración, pH u osmolaridad inadecuada, así como la presencia de conservantes en las soluciones empleadas, restos de detergentes, endotoxinas bacterianas, residuos metálicos o material viscoelástico degradado86. Se produce un daño agudo en el segmento anterior donde las células del endotelio corneal son la estructura más sensible. Una vez descartada la etiología infecciosa se debe iniciar tratamiento intenso con esteroides tópicos para atenuar la respuesta inflamatoria. En ocasiones el daño inducido en el endotelio será irreversible y se precisará realizar una queratoplastia. Si después de eliminar todas las causas tratables para la pérdida o disfunción endotelial persiste el edema podemos considerar el empleo de soluciones hipertónicas como el cloruro sódico al 5% en colirio o pomada oftálmica. Pueden mejorar a los pacientes con edema corneal leve o moderado, especialmente tras despertarse, cuando el edema es máximo debido a la falta de evaporación mientras los párpados están cerrados85. Fracaso endotelial corneal Si no se llega a eliminar el edema o éste aparece de forma tardía, tenemos que sospechar una pérdida endotelial grave, con una población por debajo de las 500 cels/mm2. En este caso mantendremos los colirios hipertónicos, y si aparecen quistes epiteliales pueden emplearse lentes de contacto terapéuticas. Si finalmente progresa a queratopatía bullosa deberemos realizar una queratoplastia lamelar posterior o penetrante87. En los casos de descompensación aguda tras cirugía, la decisión final de realizar una queratoplastia puede diferirse unos tres meses, con intención de comprobar la estabilidad de la situación. CONCLUSIÓN A pesar de las mejoras introducidas en los equipos de ultrasonidos y en las técnicas quirúrgicas a lo largo de los últimos años, hemos de tener en cuenta los principales factores que se asocian a una mayor pérdida endotelial inducida por la cirugía de catarata. 1664 Hay elementos sobre los que no podemos influir, pero sí hemos de considerar antes de la cirugía, como son una mayor edad del paciente, una menor longitud axial del globo ocular y la presencia de una córnea guttata, que nos obligan a ser más cuidadosos en nuestro abordaje quirúrgico. En cuanto a los factores directamente relacionados con la cirugía es recomendable: minimizar el tamaño de la incisión sin comprometer la arquitectura de la misma, reducir el empleo de fármacos intracamerulares (que de ser empleados, no deberían llevar conservantes), escoger un viscoelástico dispersivo para la primera fase de la cirugía (en especial si se prevé una cirugía prolongada y/o en córneas comprometidas) y cohesivo para la segunda, reducir el tiempo y la potencia de ultrasonidos así como el volumen de fluidos circulantes por la cámara anterior. Asimismo hemos de emplear la técnica de núcleofractura que se ha mostrado menos nociva para el endotelio como es el «stop and chop» o «faco chop». Por otra parte hay que ser extremadamente cuidadosos en el abordaje de los núcleos densos, los cuales idealmente han de ser excluidos de la curva de aprendizaje de los residentes que se están iniciando en la cirugía con ultrasonidos. Si hay complicaciones como vitreorragia es obligado realizar una vitrectomía anterior meticulosa y debemos evitar lentes intraoculares mal posicionadas. Por último, si el primer ojo de un paciente desarrolló una queratopatía bullosa pseudofáquica sería recomendable realizar una microscopía especular en el segundo ojo antes de realizar la cirugía, algo que podemos considerar siempre que sospechemos un endotelio comprometido. BIBLIOGRAFÍA 1. Murphy C, Alvarado J, Juster R, Maglio M. Prenatal and postnatal cellularity of the human corneal endothelium: a quatitative histologic study. Invest Ophthalmol Vis Sci 1984; 25: 312-322. 2. Maurice D M. The location of the fluid pump in the cornea. J Physiol (Lond) 1972; 221: 43-54. 3. Hodson S, Miller F. The bicarbonate ion pump in the endothelium wich regulates the hydratation of rabbit cornea. J Physiol (Lond) 1976; 263: 563-577. 4. Bourne W M, Nelson L R, Hodge D O. Central corneal endothelial cell changes over a ten-year period. Invest Ophthalmol Vis Sci 1997; 38: 779-782. 5. Hess C. Klinische und experimintelle studie ubre die entstehung der strefenformigen hornhauttraubung nach starextraktion. Graefes Arch Clin Exp Ophthalmol 1892; 38: 1. 6. Nordlohne ME. The intraocular implant lens: development and results with special reference to the Binkhorst lens. Baltimore: Williams & Wilkins; 1975. 7. Powe NR, Schein OD, Geiser SC, Tielsch JM, Luthra R, Javitt J, Steinberg EP. Synthesis of the literature on visual acuity and complications following cataract extraction with intraocular lens implantation. Cataract Patient Outcome Research Team. Arch Ophthalmol 1994; 112: 239-252. 8. Sugar J, Mitchelson J, Kraff M. The effect of phacoemulsification on corneal endothelial cell density. Arch Ophthalmol 1978; 96: 446448. 9. Ravalico G, Tognetto D, Baccara F, Lovisato A. Corneal endothelial protection by different viscoelastics during phacoemulsification. J Cataract Refract Surg 1997; 23: 433-439. 150. COMPLICACIONES ENDOTELIALES EN LA CIRUGÍA DE LA CATARATA 10. Kreisler KR, Mortenson SW, Mamalis N. Endothelial cell loss following «modern» phacoemulsification by a senior resident. Ophthalmic Surg 1992; 23: 158-160. 11. Pirazzoli G, D´Eliseo D, Acciarri R. Effects of phacoemulsification time on the corneal endothelium using phacofracture and phaco chop techniques. J Cataract Refract Surg 1996; 22: 967-969. 12. Lesiewska-Junk H, Kaluzny J, Malukiewicz-Wisniewska G. Long term evaluation of endothelial cell loss after phacoemulsification. Eur J Ophthalmol 2002; 12: 30-33. 13. Carlson KH, Bourne WM. The clinical measurement of endothelial permeability. Cornea 1988; 7:183-189. 14. Coulangeon LM, Menerath JM, Sole P. Fluorofotometrie par instillation. I. Débit d´humeur aqueuse et perméabilité endothéliale cornéenne. J Fr Ophthalmol 1987; 10: 365-373. 15. Schultz RO, Glaser DB, Matsuda M, Yee RW, Edelhauser HF. Response of the corneal endothelium to cataract surgery. Arch Ophthalmol 1986; 104: 1164-1169. 16. Diaz-Valle D, Benítez del Castillo JM, Castillo A, Sayagués O, Moriche M. Endotelial damage with cataract surgery techniques. J Cataract Refract Surg 1998; 24; 951-955. 17. Bourne RR, Minassian DC, Dart JK, Rosen P, Kaushal S, Wingate N. Effect of cataract surgery on the corneal endothelium: Modern phacoemulsification compared with extracapsular cataract surgery. Ophthalmology 2004; 111: 679-685. 18. Bourne WM, Nelson LR, Hodge DO. Continued endothelial cell loss ten years after lens implantation. Ophthalmology 1994; 101: 10141023. 19. Bates AK, Cheng H, Hiorns RW. Pseudophakic bullous keratopathy: relationship with endothelial cell density and use of a predictive cell loss model. A preliminary report. Curr Eye Res 1986; 5: 363-366. 20. Hayashi K, Hayashi H, Nakao F, Hayashy F. Risk factors for corneal endotelial injury during phacoemulsification. J Cataract Refract Surg 1996; 22: 1079-1084. 21. Pereira AC, Porfírio F, Freitas LL, Belfort R. Ultrasound energy and endothelial cell loss with stop-and-chop and nuclear preslice phacoemulsification. J Cataract Refract Surg 2006; 32: 1661-1666. 22. Walkow T, Anders N, Klebe S. Endothelial cell loss after phacoemulsification: relation to preoperative and intraoperative parameters. J Cataract Refract Surg 2000; 26: 727-732. 23. Waltman SR. Penetrating keratoplasty for pseudophakic bullous keratopathy. Arch. Ophthalmol 1981; 99: 415-416. 24. Rao GN, Aquavella JB, Goldberg SH, Berk SL. Pseudophakic bullous keratopathy, relationship to preoperative corneal endothelial status. Ophthalmology 1984; 91: 1135-1140. 25. Shetlar DJ, Bourne WM, Campbell RJ. Morphologic evaluation of Descemet´s membrane and corneal endothelium in diabetes mellitus. Ophthalmology 1989; 96: 247-250. 26. Lee JS, Lee JE, Choi HY, Oum BS, Cho BM. Corneal endothelial cell change after phacoemulsification relative to the severity of diabetic retinopathy. J Cataract Refract Surg 2005; 31: 742-749. 27. Goebbels M, Spitznas M. Endothelial barrier function after phacoemulsification: a comparison between diabetic and non-diabetic patients. Grafes Arch Clin Exp Ophthalmol. 1991; 229: 254-257. 28. Rowland FN, Donovan MJ, Lindsay M, Weiss WI, O´Rourke J, Kreutzer DL. Demonstration of inflammatory mediator-induced inflammation and endothelial cell damage in the anterior segment of the eye. Am J Pathol 1983; 110:1-12. 29. Elgebaly SA, Forouhar F, Gillies C, Williams S, O´Rourke J, Kreutzer DL. Leukocyte-mediated injury to corneal endothelial cells. A model of tissue injury. Am J Pathol 1984; 116: 407-416. 30. Ozdal PC, Vianna RN, Deschênes J. Visual outcome of juvenile rheumatoid arthritis-associated uveitis in adults. Ocul Immunol Inflamm 2005; 13: 33-38. 31. Hiraoka M, Fujino Y. Cataract surgery and intraocular lens implantation in patients with Behcet's disease. Nippon Ganka Gakkai Zasshi 1999; 103: 119-123. 32. Foster CS, Opremcak EM. Therapeutic surgery: cornea, iris, cataract, glaucoma, vitreous, retinal. In: Foster CS, Vitale AT, eds. Diagnosis and treatment of uveitis. Philadelphia: Saunders; 2002: 748-756. 33. Galin MA, Fetherolf E, Lin L, Sugar A. Experimental cataract surgery. Ophthalmology 1979; 86: 213-218. 34. Nuyts RM, Edelhauser HF, Holley GP. Intraocular irrigating solutions: a comparison of Hartmann's lactated Ringer's solution, BSS and BSS Plus. Graefes Arch Clin Exp Ophthalmol 1995; 233: 655-661. 35. Edelhauser HF, Van Horn DL, Hyndiuk RA, Schultz RO. Intraocular irrigating solutions. Their effect on the corneal endothelium. Arch Ophthalmol 1975; 93: 648-657. 36. Benson WE, Diamond JG, Tasman W. Intraocular irrigating solutions for pars plana vitrectomy. A prospective, randomized, double-blind study. Arch Ophthalmol 1981; 99: 1013-1015. 37. Slack JW, Edelhauser HF, Helenek MJ. A bisulfite-free intraocular epinephrine solution. Am J Ophthalmol 1990; 110: 77-82. 38. Chang YS, Tseng SY, Tseng SH, Wu CL. Cytotoxicity of lidocaine or bupivacaine on corneal endothelial cells in a rabbit model. Cornea 2006; 25: 590-596. 39. Carino NS, Slomovic AR, Chung F, Marcovich AL. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg 1998; 24: 1602-1608. 40. Yee RW, Meenakshi S, Yu HS, Wallace GA, Kozielec G. Effects of acetylcholine and carbachol on bovine corneal endothelial cells in vitro. J Cataract Refract Surg 1996; 22: 591-596. 41. Olson RJ, Kolodner H, Riddle P, Escapini H Jr. Commonly used intraocular medications and the corneal endothelium. Arch Ophthalmol. 1980; 98: 2224-2226. 42. Endophthalmitis Study Group, European Society of Cataract & Refractive Surgeons. Prophylaxis of postoperative endophthalmitis following cataract surgery: results of the ESCRS multicenter study and identification of risk factors. J Cataract Refract Surg 2007; 33: 978-988. 43. Sandboe FD, Medin W, Bjerknes R. Toxicity of vancomycin on corneal endothelium in rabbits. Acta Ophthalmol Scand 1998; 76: 675-678. 44. Petroutsos G, Savoldelli M, Pouliquen Y. The effect of gentamicin on the corneal endothelium. An experimental study. Cornea 1990; 9: 62-65. 45. Kothari K, Jain SS, Shah NJ. Anterior capsular staining with trypan blue for capsulorhexis in mature and hypermature cataracts. A preliminary study. Indian J Ophthalmol 2001; 49: 177-180. 46. Alp BN, Elibol O, Sargon MF, Aslan OS, Yanyali A, Karabas L, Talu H, Caglar Y. The effect of povidone iodine on the corneal endothelium. Cornea 2000; 19: 546-550. 47. Balazs EA, inventor; Biotrics, Inc, assigne. Ultrapure hyaluronic acid and the use thereof. US patent 4 141 973. February 27, 1979. 48. Poyer JF, Chan KY, Ashinoff SA. A new method to measure the retention of viscoelastic agents on a rabbit endothelial cell line after irrigation and aspiration. J Cataract Refract Surg 1998; 24: 84-90. 49. Oshita T, Okamoto F, Hiraoka T, Kiuchi T, Sato M, Kawana K. Retention and removal of a new viscous dispersive ophthalmic viscosurgical device during cataract surgery in animal eyes. Br J Ophthalmol 2006; 90: 485-487. 50. McDermott ML, Hazlett LD, Barret RP. Viscoelastic adherence to corneal endothelium following phacoemulsification. J Cataract Refract Surg 1998; 24: 678-683. 51. Schwenn O, Dick HB, Krummenauer F, Christmann S, Vogel A, Pfeiffer N. Healon 5 versus Viscoat during cataract surgery: intraocular pressure, laser flare and corneal changes. Graefes Arch Clin Exp Ophthalm 2000; 238: 861-867. 52. Kiss B, Findl O, Menapace R, Petternel V, Wirtitsch M, Lorang T, Gengler M, Drexler W. Corneal endothelial cell protection with a dispersive viscoelastic material and an irrigating solution during phacoemulsification: low-cost versus expensive combination. J Cataract Refract Surg 2003; 29: 733-740. 53. Rainer G, Menapace R, Findl O, Kiss B, Petternel V, Georgopoulos M, Schneider B. Intraocular pressure rise after small incision cataract surgery: a randomised intraindividual comparison of two dispersive agents. Br J Ophthalm 2001; 85: 139-142. 54. Olson LE, Marshall J, Rice NS, Andrews R. Effects of ultrasound on the corneal endothelium: I. The acute lesion. Br J Ophthalm 1978; 62: 134-144. 55. Topaz M, Motei M, Assia E, Meyerstein D, Meyerstein N, Gedanken A. Acoustic cavitation in phacoemulsification: chemical effects, modes of action and cavitation index. Ultrasound Med Biol 2002; 28: 775-784. 56. Hull DS. Oxygen free radicals and corneal endothelium. Trans Am Ophthalmol Soc 1990; 88: 463-511. 1665 VIII. COMPLICACIONES 57. Joussen AM, Barth U, Cubuk H, Koch H. Effect of irrigating solution and irrigation temperature on the cornea and pupil during phacoemulsification. J Cataract Refract Surg 2000; 26: 392-397. 58. Rubowitz A, Assia E, Rosner M, Topaz M. Antioxidant protection against corneal damage by free radicals during phacoemulsification. Invest Ophthalmol Vis Sci 2003; 44: 1866-1870. 59. Kosrirukvongs P, Slade SG, Berkeley RG. Corneal endothelial changes after divide and conquer versus chip and flip phacoemulsification. J Cataract Refract Surg 1997; 23: 1006-1012. 60. Mackool RJ, Brint SF. AquaLase: a new technology for cataract extraction. Curr Opin Ophthalmol 2004; 15: 40-43. 61. Sandoval H, Fernández de Castro LE, Vroman DT, Solomon KD. Randomized, double-masked clinical trial evaluating corneal endotelial cell loss after cataract extraction and intraocular lens implantation. Fluid-based system versus ultrasound phacoemulsification. Cornea 2006; 25: 1043-1045. 62. Sandoval H, Sarraf O, Vroman DT, Solomon KD. Corneal endotelial cell damage after lens extraction using the fluid-based system compared to ultrasound phacoemulsification in human cadaver eyes. Cornea 2004; 23: 720-722. 63. Fine IH, Packer M, Hoffman RS. New phacoemulsification technologies. J Cataract Refract Surg 2002; 28: 1054-1060. 64. Vargas LG, Holzer MP, Solomon KD, Sandoval HP, Auffarth GU, Apple DJ. J Cataract Refract Surg 2004; 30: 478-482. 65. Kraff MC, Sanders DR, Lieberman HL. Monitoring for continuing endothelial cell loss with cataract extraction and intraocular lens implantation. Ophthalmology 1982; 89: 30-34. 66. Kohlhaas M, Klemm M, Kammann J, Richard G. Endothelial cell loss secondary to two different phacoemulsification techniques. Ophthalmic Surg Lasers 1998; 29: 890-895. 67. Alio JL, Mulet, ME, Shalaby AM, Attia WH. Phacoemulsification in the anterior chamber. J Cataract Refract Surg 2002; 28: 67-75. 68. Hayashi K, Nakao F, Hayashi F. Corneal endothelial cell loss after phacoemulsification using nuclear cracking procedures. J Cataract Refract Surg 1994; 20: 44-47. 69. Vajpayee RB, Kumar A, Dada T, Titiyal JS, Sharma N, Dada VK. Phaco-chop versus stop-and-chop for phacoemulsification. J Cataract Refract Surg 2000; 26: 1638-1641. 70. Kahraman G, Amon M, Franz C, Prinz A, Abela-Formanek C. Intraindividual comparison of surgical trauma after bimanual microincision and conventional small-incision coaxial phacoemulsification. J Cataract Refract Surg 2007; 33: 618-622. 71. Alió J, Rodríguez-Prats JL, Galal A, Ramzy M. Outcomes of microincision cataract surgery versus coaxial phacoemulsification. Ophthalmology 2005; 112: 1997-2003. 1666 72. Zafirakis P. A comparison of endothelial cell loss following phacoemulsification between the MICS Millenium platform and Infinity phacoemulsification platform. Free paper in XXIV Congress of ESCRS. London; 2006. 73. O´Brien P, Fitzpatrick P, Kilmartin DJ, Beautty S. Risk factors for endothelial cell loss after phacoemulsification surgery by a junior resident. J Cataract Refract Surg 2004; 30: 839-843. 74. Leahey BD. Bullous keratitis from vitreous contact: edema of cornea secondary to vitreous contact. Arch Ophthamol 1951; 46: 22-32. 75. Homer PI, Peyman GA, Sugar J. Automated vitrectomy in eyes with vitreocorneal touch associated with corneal dysfunction. Am J Ophthalmol 1980; 89: 500-506. 76. Leibowitz HM, Lang RA, Chang R, Theodore J, Oak SS. Corneal edema secondary to vitreocorneal contact. Arch Ophthalmol 1981; 99: 417-421. 77. Miller D, Doane MG. High-speed photographic evaluation of intraocular lens movements. Am J Ophthalmol 1984; 97: 752-759. 78. Drews RC. Intermittent touch syndrome. Arch Ophthalmol 1982; 100: 1440-1441. 79. Obstbaum SA, Galin MA. Cystoid macular oedema and ocular inflammation. The corneo-retinal inflammatory syndrome. Trans Ophthalmol Soc U K 1979; 99: 187-191. 80. Holyk PR, Eifrig DE. Effects of monomeric methylmethacrylate on ocular tissues. Am J Ophthalmol 1979; 88: 385-395. 81. Carlson AN, Stewart WC, Tso PC. Intraocular lens complications requiring removal or exchange. Surv Ophthalmol 1998; 42: 417-440. 82. Moreno J, Aliseda D, García A, Munuera JM, Maldonado M. Valoración del número de revisiones necesarias tras facoemulsificación sin complicaciones. Arch Soc Esp Oftalmol 2000; 75: 321-326. 83. Pazos-Gonzalez B, Rodríguez-Ares MT, Sánchez-Salorio M. Patología de la córnea. Edema corneal. In: Sánchez-Salorio M, García-Feijoo J, Pazos-González B. Biomicroscopía ultrasónica en oftalmología. Madrid: Tecnimedia Editorial; 1998: 49-61. 84. Konowal A, Morrison JC, Brown SV, Cooke DL, Maguire LJ, Verdier DV et al. Irreversible corneal decompensation in patients treated with topical dorzolamide. Am J Ophthalmol 1999; 127: 403-406. 85. Yi DH, Dana MR. Corneal edema after cataract surgery: incidence and etiology. Semin Ophthalmol 2002; 17: 110-114. 86. Mamalis N, Edelhauser HF, Dawson DG, Chew J, LeBoyer RM, Werner L. Toxic anterior segment syndrome. J Cataract Refract Surg 2006; 32: 324-333. 87. Van Dooren BT, Mulder PG, Nieuwendaal CP, Beekhuis WH, Melles GR. Endothelial cell density after posterior lamellar keratoplasty: five- to seven-year follow-up. Am J Ophthalmol 2007; 144: 471473.








