PRÁCTICO I: Grupos funcionales en Química Orgánica 1. Clasifique
Anuncio
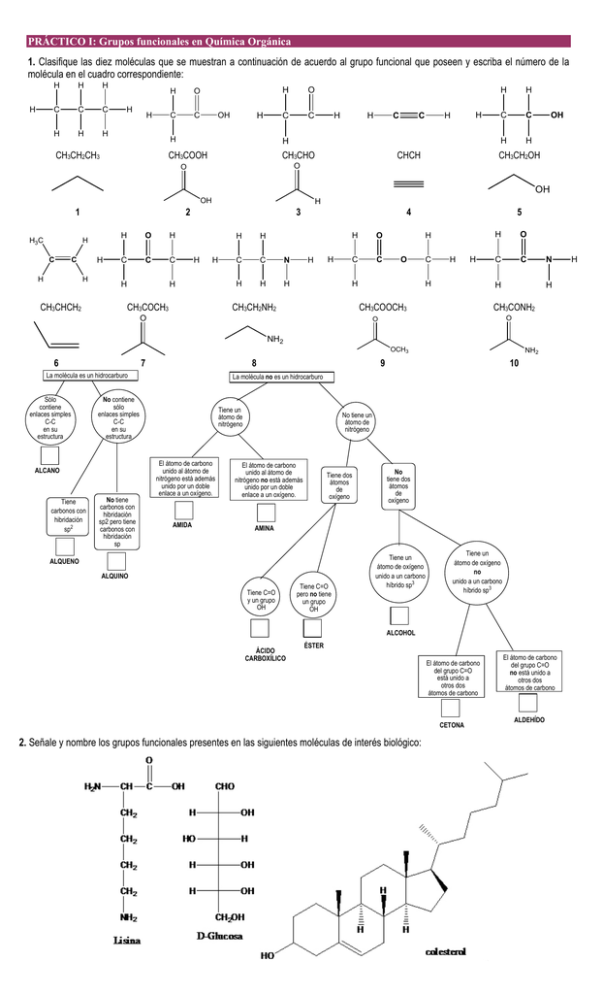
PRÁCTICO I: Grupos funcionales en Química Orgánica 1. Clasifique las diez moléculas que se muestran a continuación de acuerdo al grupo funcional que poseen y escriba el número de la molécula en el cuadro correspondiente: H H H H C C C H H H H H H O C C H OH H CH3CH2CH3 H O C C H H C C H H H CH3COOH CH3CHO CHCH H H C C H H OH CH3CH2OH O O OH OH 1 H3C 2 H C H C H H H CH3CHCH2 H O H C C C H 3 H H H CH3COCH3 H H C C N H H H 4 H H H O C C H O H CH3CH2NH2 5 C H H H O C C H CH3COOCH3 O H N H CH3CONH2 O O NH2 OCH3 6 7 8 La molécula es un hidrocarburo Sólo contiene enlaces simples C-C en su estructura Tiene carbonos con hibridación sp2 No tiene carbonos con hibridación sp2 pero tiene carbonos con hibridación sp 10 La molécula no es un hidrocarburo No contiene sólo enlaces simples C-C en su estructura ALCANO NH2 9 Tiene un átomo de nitrógeno El átomo de carbono unido al átomo de nitrógeno está además unido por un doble enlace a un oxígeno. AMIDA No tiene un átomo de nitrógeno El átomo de carbono unido al átomo de nitrógeno no está además unido por un doble enlace a un oxígeno. Tiene dos átomos de oxígeno No tiene dos átomos de oxígeno AMINA ALQUENO ALQUINO Tiene C=O y un grupo OH Tiene C=O pero no tiene un grupo OH Tiene un átomo de oxígeno unido a un carbono híbrido sp3 Tiene un átomo de oxígeno no unido a un carbono híbrido sp3 ALCOHOL ÁCIDO CARBOXÍLICO ÉSTER El átomo de carbono del grupo C=O está unido a otros dos átomos de carbono CETONA 2. Señale y nombre los grupos funcionales presentes en las siguientes moléculas de interés biológico: El átomo de carbono del grupo C=O no está unido a otros dos átomos de carbono ALDEHÍDO H PRÁCTICO I: Grupos funcionales en Química Orgánica 3. Complete el siguiente puzzle “Sudoku”1 de 9 x 9 cuadros, conteniendo a su vez 3 x 3 sub-cuadros. La idea del juego es completar cada una de las filas, columnas y sub-cuadros con los números 1 al 9 correspondientes, en este caso, a nueve grupos funcionales. Fenol Alcohol Ác. carboxílico Aldehído RNO2 RCONH2 Éster RCH2NH2 RNO2 Ph-OH RCH2OH RCH2NH2 RCH2OH Aldehído RCOR Éster RCHO Nitro Amina Fenol Aldehído Cetona RCOR 1 Aldehído RCHO 2. Ácido carboxílico RCOOH 3. Alcohol RCH2OH 4. Fenol Ph-OH 5. Cetona RCOR 6. Éster RCOOR 7. Amida RCONH2 8. Nitro RNO2 9. Amina RNH2 Sudoku Home Page: http://www.sudoku.com. Amida RCHO RNO2 Éster 1. Alcohol RCH2NH2 Ph-OH PRÁCTICO I: Grupos funcionales en Química Orgánica 4. Escribir una fórmula estructural para cada uno de los siguientes casos: a) un alcohol y un éter de fórmula molecular C4H10O b) un aldehído y una cetona de fórmula molecular C3H6O c) un ácido carboxílico y un éster de fórmula molecular C3H6O2 d) una amina de fórmula molecular C3H9N e) una amida de fórmula molecular C3H7NO 5. El ciclo de Krebs (ruta metabólica) es una sucesión de reacciones químicas, que forman parte de la respiración celular en todas las células aeróbicas. Este ciclo, también llamado ciclo del ácido cítrico o ciclo de los ácidos tricarboxílicos, es parte de la vía catabólica que realiza la oxidación de hidratos de carbono, ácidos grasos y aminoácidos hasta producir CO2, liberando energía en forma de poder reductor (NADH y FADH2) y ATP.2 Señale y nombre los grupos funcionales presentes en las moléculas involucradas en el ciclo de Krebs. 6. Dados los compuestos que se muestran más abajo, para el grupo señalado indique el nombre de dicho grupo funcional y la hibridación del carbono que forma parte de él: COOH Br Grupo funcional: Hibridación del C: Grupo funcional: Hibridación del C: H HO H Grupo funcional: Hibridación del C: OH OCH3 CH3 H O Grupo funcional: Hibridación del C: 2 El metabolismo oxidativo de glúcidos, grasas y proteínas frecuentemente se divide en tres etapas, de las cuales el ciclo de Krebs es la segunda. En la primera etapa los carbonos de estas macromoléculas dan lugar a moléculas de acetil-CoA de dos carbonos, e incluye las vías catabólicas de aminoácidos (p. ej. desaminación oxidativa), la beta oxidación de ácidos grasos y la glucolisis. La tercera etapa es la fosforilación oxidativa, en la cual el poder reductor (NADH y FADH2) generado se emplea para la síntesis de ATP. El ciclo de Krebs también proporciona precursores para muchas biomoléculas, como ciertos aminoácidos. Por ello se considera una vía anfibólica, es decir, catabólica y anabólica al mismo tiempo. PRÁCTICO II: Introducción general a la química orgánica. Propiedades de las moléculas orgánicas 1. Para los siguientes compuestos complete las estructuras de Lewis y asigne la carga formal a los C, N, y O. a) .. ..H b) CH3 N H .. H ..H CH3 N .. H ..O c) d) O .. CH3 N H .. O C .. O .. 2. En cada una de las estructuras siguientes elija el enlace que más se ajuste a la descripción: i) el enlace C-C más largo en: H-C≡C-CH2-CH3 ii) el enlace C-C más corto en: H3C-C≡C-CH2-CH=CH2 H H iii) el enlace C-H más largo en: C C H H2C H iv) el enlace C-H más corto en: H H2 C C C H H H 3. a) Clasifique los siguientes sustituyentes de acuerdo a su efecto inductivo (+I ó –I): CH3 CF3 NO2 Cl CO2H NH2 CO2H NH2 Sustituyente +I -I b) Clasifique los siguientes sustituyentes de acuerdo a su efecto resonante (+M ó –M): CH3 OH NO2 Cl Sustituyente +M -M 4. De cada grupo de estructuras resonantes que se muestran a continuación, designar la que más contribuirá al híbrido de resonancia. Explique. a) CH3CH2C CHCH2 CH3CH2C CH3 CH CH2 CH3 b) c) O O OH OH d) H H O H O O 5. Los compuestos que se muestran poseen los siguientes momentos dipolares: H a) H b) O O µ = 2.73 D µ = 3.11 D De una explicación al incremento del valor del momento dipolar de b) con respecto a a). PRÁCTICO II: Introducción general a la química orgánica. Propiedades de las moléculas orgánicas 6. a) Dados los siguientes compuestos, formule estructuras en las que se muestren los enlaces de hidrógeno (si los hay) que cabría esperar en los compuestos puros en estado líquido. b) Indique cuales de ellos pueden formar enlace de hidrógeno con agua. Explique. i) (CH3)2NH ii) CH3CH2F iii) (CH3)3N iv) (CH3)2CO v) CH3OCH2CH2OH 7. Prediga el orden de solubilidad en agua de los siguientes compuestos, justificando su respuesta: a) Metanol: CH3OH CH 3 O b) Acido metanoico: c) Tolueno: C H OH 8. a) Para los siguientes compuestos (A-H), indique cuáles, en estado líquido puro, cumplen con las siguientes afirmaciones: i) El compuesto establece, exclusivamente, enlaces de hidrógeno intramolecular. ii) El compuesto establece, exclusivamente, enlaces de hidrógeno NH O intermolecular. (B) (A) iii) El compuesto establece enlaces de hidrógeno tanto inter- como intramolecularmente. iv) El compuesto no establece enlaces de hidrógeno. COOH (D) Nota: en cada afirmación puede incluirse desde ninguno hasta tres compuestos. b) Muestre los enlaces de hidrógeno que establece el compuesto F con H2O. c) Entre el compuesto E de la parte (a) y el O siguiente compuesto (J), ¿cuál presenta mayor punto de ebullición? Explique. (J) SH (C) NH2 (E) O O (F) H2N O (H) (G) OCH3 9. La estructura del linestrenol, componente de ciertos anticonceptivos orales, se representa a continuación: Localizar, en dicha estructura, un ejemplo de cada uno de los siguientes enlaces o átomos: a) Un enlace covalente polarizado b) Un enlace covalente no polarizado c) Un átomo de carbono con hibridación sp. d) Un átomo de carbono con hibridación sp2. e) Un átomo de carbono con hibridación sp3. f) Un enlace entre átomos de hibridación diferentes. g) Un átomo de carbono primario, uno secundario y uno terciario. h) Un átomo de carbono cuaternario. OH Linestrenol 10. Represente las estructuras de resonancia de las siguientes especies, indicando en cada caso cuál es la más estable y por qué. (a) (b) (c) (d) N H3C C H C H O O O H3C C H3CO H N H2C O (f) (e) C C H C H C H2 N CH3 (g) C N (h) H2C CH2 N NH2 O (i) (j) Cl 11. Compare la estabilidad de cada uno de los siguientes pares de iones orgánicos: (b) (a) C6H5 C H C H CH2 , H3C C H C H H3C CH2 H2 C O , H2C C H (c) C H3C (d) H3 C CH3 N H3C C H C H C H N CH3 , CH3 H3CO C H C H H3C H3C O C H N CH3 C H O , H3C C C H CH2 PRÁCTICO III: Práctico de visualización tridimensional: Hibridación, enlace de hidrógeno, análisis conformacional 1. a) Visualice la obtención del carbono híbrido sp3 y la representación tridimensional de etano. b) Visualice la obtención del carbono híbrido sp2, el solapamiento de orbitales p, el enlace ¶ y un triple enlace. c) Visualice la representación tridimensional de un carbocatión alílico. Compare con el ejercicio 4 b) del Práctico II. 2. Para los siguientes compuestos: (I) 5-Hexen-1-ino (II) 3-Hexen-1-ino Analice las siguientes distancias de enlace: H-C1 C1-C2 C2-C3 C3-C4 C5-C6 (I) (II) a) Para el compuesto (I) explique la diferencia de distancia entre H-C1, H-C4 y H-C6. b) Explique la diferencia en la distancia C2-C3 entre ambos compuestos. H-C4 H-C6 3. Visualice los enlaces de hidrógeno que establecen los siguientes compuestos con agua: i) metilamina; ii) tetrahidrofurano 4. Visualice tridimensionalmente el estudio conformacional para etano y butano. 5. Formule todos los isómeros posibles de fórmula: C4H10, C4H9Br y C3H6O2. Clasifique los isómeros en: isómeros de cadena, isómeros de posición e isómeros de función. 6. Dado 2-Cloro-3-metilbutano, formúlelo en forma caballete y en proyección de Newman. a) Visualice todos los confórmeros que resultan de variar el ángulo diedro Cl-C2-C3-H entre 0º y 360º con incrementos de 60º. b) Prediga y visualice el confórmero más estable. 7. a) Analice los confórmeros de ciclohexano. b) Identifique las interacciones desfavorables 1,3-diaxiales en el confórmero silla y las 1,4-pseudoaxiales en el confórmero bote. 8. a) Represente el confórmero silla axial y ecuatorial de t-Butilciclohexano. b) Indique el confórmero más estable. PRÁCTICO IV: Isomería. Estereoisomería 1. Diga si cada una de las estructuras siguientes representa al 2,4-dimetiloctano o a un isómero: a) CH3 b) H C H3C H2C H2 C C H H2 C CH3 H2 C c) H2C CH2 H2 C H2 C H C H C CH3 CH3 CH3 CH3 CH3 2. a) Represente los compuestos siguientes en las proyecciones que se indican en cada caso. H OH HO H Cuñas H H H3C Newman Proyección de caballete Cuñas Proyección de caballete Cuñas Newman H Br COOH Newman CH3 H3C H Br Br H Proyección de caballete 3. Represente las conformaciones en equilibrio de los siguientes compuestos, indicando cuál es la más estable. a) cis-1,2-Dimetilciclohexano b) trans-1,2-diclorohexano c) d) CH3 HO Br 4. Indique la relación estereoquímica entre los siguientes pares de compuestos y la configuración absoluta de sus carbonos quirales: a) H Br b) CHO CH3 Cl Br CH3 CH3 Cl H CH3 I H3C I CH3 CHO OH HO 5. Formule el siguiente compuesto de acuerdo con la estereoquímica asignada, indicando si es o no ópticamente activo: (2S,3R)-2,3Dimetoxibutano. 6. (EXAMEN) a) Clasifique los siguientes pares de compuestos en: confórmeros, enantiómeros, diasterómeros, par de compuestos meso (un tipo para cada par). A) OH B) OH Cl OH A1 Cl OH OH C) OH C1 OH D) OH OH Cl Cl Cl Cl b) Explique porqué el compuesto C1 es más soluble en agua que el compuesto A1. OH PRÁCTICO IV: Isomería. Estereoisomería 7. Clasificar los siguientes sustituyentes según las reglas de Cahn-Ingold-Prelog y ordenarlos de sustituyente de mayor prioridad a sustituyente de menor prioridad: O C 1 H C H C H 2 H C CH3 3 C 4 CH3 N C CH3 8. Complete las proyecciones correspondientes. a) (R,S)-1,2-Dibromo-1,2-difeniletano H Br H Br Br C6H5 b) (2R,3S)-3-Bromo-2-butanol H Br H OH OH Br c) ¿Presentan actividad óptica los compuestos anteriores? Explique. 9. Complete los recuadros según se indica en cada caso: COOH R/S Cl COOH H Cl H Br H Br R/S COOH CH(CH3)2 H R/S H COOH H2N H (X=OH) R/S CH2X (X=SH) R/S R/S Cl 10. (EXAMEN) a) Indique la relación que guarda el compuesto (A) con cada uno de los compuestos mostrados. Clasifíquelos como: iguales, efímeros, isómeros funcionales, isómeros de posición. OH OH Br Br OH OH OH Br Br Br (A) OCH3 Br HO Br (*) a) Determine la configuración absoluta de los carbonos quirales del compuesto A. b) Explique si el compuesto A es capaz de solubilizarse en agua. Muestre el tipo de interacciones que este compuestos es capaz de establecer con dicho disolvente. Considerando el compuesto (A) y el compuesto (*) de la parte (a), ¿cuál de ellos poseerá el mayor punto de ebullición? Explique. PRÁCTICO V: Alcanos. Alquenos. Alquinos 1. a) Nombre los siguientes compuestos siguiendo las reglas IUPAC. i) ii) b) Escriba la estructura de: iii) 6,6-Dietil-2-metil-4-propiloctano iv) 5-(1-Etil-1-metilpropil)-5-propilnonano 2. Nombre los siguientes compuestos siguiendo las reglas IUPAC e identifique la hibridación de cada átomo de carbono. iii) ii) i) 3. El isopreno, unidad estructural muy importante de muchos productos naturales, tiene el siguiente nombre IUPAC: 2-metil-1,3butadieno. Escriba su fórmula estructural. 4. Indique si los siguientes alquenos poseen configuración Z o E. H3C CH2CH2F C H3C C H Br C CH2CH2CH2CH3 H H3C C C CH2CH3 H Br C C BrH2C Br C H CH2CH3 CH2CH3 5. Indique los productos mayoritarios que se obtienen en las siguientes reacciones de halogenación en condiciones de ruptura homolítica: a) Cl2 / hν b) Br2 / ∆ (A) (B) DBPO Nota: DBPO (DiBenzoyl PerOxide) b) Br2 / ∆ CH3 (C) O O O O 6. La reacción catalizada por la luz entre 2,3-Dimetil-2-buteno y bromo, da dos productos (A y B). Br Br2 / hν + Br A B Proponga un mecanismo adecuado para la obtención de A y de B. 7. Para las siguientes reacciones, indique cual es el producto obtenido y justifique su elección: Br Br HBr ó Br2 Br Br Br ó Br PRÁCTICO V: Alcanos. Alquenos. Alquinos 8. Indique la estructura del alqueno del cual partiría, y los reactivos y condiciones que sean necesarios para convertirlos en cada uno de los siguientes productos: a) b) OH c) Br Br Proponga un mecanismo adecuado para la reacción de la parte (b). ¿Qué diferencia existe entre este mecanismo y el mecanismo del ejercicio 6)? 9. Dadas las siguientes reacciones: Na/NH3 a) HC C CH2CH3 H2/Pd H2/Pd BaSO4 H2O b) (A) H T.Amb. Br (B) (D) NaOH (C) (E) calor a) Complete con productos. b) Indique los mecanismos de obtención de (D) y de (E). 10. ¿Cuál(es) compuesto(s) NO sería(n) producto de la siguiente reacción: CH3 H2SO4 ∆ OH 11. En las proteínas, los aminoácidos establecen diferentes tipos de interacciones atractivas, entre las que se pueden mencionar: interacciones iónicas, enlace de hidrógeno, interacciones dipolo-dipolo e interacciones de Van der Waals (mostradas como líneas punteadas en el esquema a continuación). Identifique en el siguiente esquema cada una de las interacciones mencionadas anteriormente. HN HN O O O NH3 HN H O N H H3C N O O 12. Indique los productos A-D de las siguientes reacciones y los mecanismos de obtención de A, de B y de E. a) b) Me Et Me KOH/MeOH ∆ H Br H Ph H Cl2 CCl4 (A) H Ph Mecanismo E1/E2/SN1/SN2 c) H3C H2 C C C Na NH3(l) H (C) CH3I (D) (B) S PRÁCTICO VI: Práctico de visualización tridimensional: Estereosiomería, mecanismos de reacción 1. a) Identifique los distintos isómeros de posición de buteno. Muestre en cuales existe isomería geométrica (cis/trans). b) ¿Porqué no se puede transformar un alqueno trans en un alqueno cis? c) Explique la diferencia de solubilidades en agua de ácido fumárico y ácido málico: Nombre Ácido fumárico Ácido málico HO2C CO2H Estructura CO2H Solubilidad (H2O) (25°, g/L) CO2H 788 7 d) Determine el momento dipolar (módulo, dirección y sentido) de ácido fumárico y ácido málico. 2. Observe cuando una molécula puede ser quiral. 3. Estudie desde el punto de vista estereoquímico los siguientes compuestos: i) Bromocloroiodometano. ii) 2-Bromo-3-fluorobutano. iii) 2,3-Dibromobutano. 4. Visualice tridimensionalmente los siguientes mecanismos: a) Br- CH3Cl CH3Br + Cl- b) Cl H Br H - Br + Cl- c) OH2 Cl H2O OH H2O H3O+ d) Br Br Br Br Br PRÁCTICO VII: Haluros de alquilo. Sustitución nucleofílica. Eliminación 1. Dadas las siguientes reacciones realizadas sobre el compuesto (A): CH3OH/ 25°C Br D - + CH3O Na / 65°C H3C H3C H3C (X) + (Y) - CH3 (A) (Z) + CH3O Na / 0°C (X) Indique la estructura de los productos (X), (Y) y (Z). Especifique si conservan el átomo de deuterio (D). Proponga mecanismos adecuados para las tres transformaciones. 2. Dadas las siguientes reacciones: Cl Cl EtONa/EtOH i) temp. amb. EtONa/EtOH ii) (A) temp. amb. OCH2CH3 a) b) c) d) (B) OCH2CH3 Indique las estructuras de (A), (B) y el mecanismo de obtención de (A). Determine las configuraciones absolutas de los carbonos quirales de reactivos y productos. Indique si los productos obtenidos son ópticamente activos o no. Indique la relación estereoquímica que guardan entre sí (A) y (B). 3. (EXAMEN) a) Clasifique las siguientes reacciones, según su mecanismo, en SN1, SN2, E1 y E2. i) Cl H2O ∆ ii) I OEt EtO Na T.A. (*) iii) NaOH ∆ Br iv) MeOH T.A. I OMe (*) a) Muestre los mecanismos de las dos reacciones marcadas con (*) en la parte anterior. 4. a) ¿Cuál de los siguientes bromuros de alquilo reaccionará más rápidamente vía una SN2? Br Br Br Br b) ¿Cuál de los bromuros de alquilo de la parte (a) reaccionará más rápidamente en una reacción E1? c) Clasificar los siguientes carbocationes en orden creciente de estabilidad: 1 2 3 d) ¿Cuál es un producto de la siguiente reacción? + Br H H CH3 H Br H CH3 Br2 H Br Br CH3 H CH3 Br Br PRÁCTICO VII: Haluros de alquilo. Sustitución nucleofílica. Eliminación e) ¿Cuál es el producto principal de la siguiente reacción? I (CH3)3CO temperatura ambiente O f) ¿Cuántos potenciales productos de eliminación E2 se pueden formar al hacer reaccionar con NaOH/∆ al siguiente compuesto? Formulelos. H H Br H H Br g) La cloración radicalaria (Cl2, hυ) no es muy selectiva. ¿Cuál de los siguientes compuestos dará la monocloración más selectiva? 5. Para los compuestos representados, indicar si reaccionarán, preferentemente, bajo condiciones SN1 (EtOH, ∆), o SN2 (KI/acetona, temperatura ambiente). Indicar los productos resultantes y los mecanismos de los procesos. b) a) c) Br Cl Cl d) e) Ph Br Br PRÁCTICO VIII: Compuestos aromáticos 1. Para la siguiente secuencia sintética indique los productos A-E. Indique el mecanismo de A Æ B. OCH3 H2SO 4 fum. A Br2 (1 eq.) Fe H3O B + AlCl3 C D Cl HNO3 H2SO4 E O 2. Plantee una secuencia sintética para obtener con buen rendimiento cada uno de los siguientes productos, utilizando como material de partida etilbenceno y los reactivos orgánicos e inorgánicos que considere necesarios. Acido o-nitrobenzoico; Acido p-nitrobenzoico; Acido m-nitrobenzoico 3. (EXAMEN) a) Para cada una de las afirmaciones en la columna I, elegir un sustituyente de la columna II (X) que cumpla con la descripción del compuesto formulado a la derecha de la tabla. Columna I Columna II (X) a) X dona electrones por efecto inductivo X pero no dona ni acepta electrones por -OH resonancia. b) X acepta electrones por efecto -Br inductivo y por efecto resonante. c) X desactiva el anillo y dirige orto/para -CH2CH3 en reacciones de SEAr d) X acepta electrones por efecto inductivo, dona electrones por efecto -NO2 resonante y activa el anillo. b) Indique cual es (X) de los anteriores en el siguiente caso. Proponga un mecanismo que explique esta reacción. X X HNO3 (c) H2SO4 (c) NO2 4. a) Proponga estructuras adecuadas para compuestos aromáticos con la siguiente fórmula general: C7H9N, C6H3Cl2Br, C4H3NO3. b) Calcule el NIC (número de instauraciones o ciclos) para nitrobenceno y benzonitrilo. 5. (EXAMEN) Dado los siguientes compuestos (A-F) indique explicando brevemente: N N A B Br OCH3 NO2 D E F Br C a) ¿Cuál(es) sería(n) más reactivo(s) que el benceno frente a la nitración? b) ¿Cuál(es) compuesto(s) dan sustitución en la posición meta del anillo cuando es(son) tratado(s) con Br2 en presencia de Fe. c) Para alguno de los compuestos elegidos en la parte (a), describa el mecanismo de nitración. 6. Dadas las siguientes reacciones sobre el compuesto C: a) Indique las condiciones de reacciones necesarias para obtener los compuestos (D), (E) y (F). Br Br ? ? C Br F D ? Br E b) Clasifique cada uno de las reacciones de acuerdo al mecanismo de reacción involucrado en el proceso. c) Plantee el mecanismo de reacción para la obtención de (E) a partir de (C). PRÁCTICO VIII: Compuestos aromáticos 7. Proponga una ruta de síntesis del compuesto G a partir de tolueno, usando reactivos orgánicos e inorgánicos necesarios. CO2H NC Br G 8. A partir de benceno preparar: Cl Br O2 N NC Cl 9. Proponga una secuencia sintética razonable para las siguientes transformaciones: NH2 CO2H NO2 Br NO2 Br CN PRÁCTICO IX: Alcoholes, fenoles y éteres 1. Nombre los siguientes compuestos siguiendo las reglas I.U.P.A.C.: O OH i) ii) iii) OH OH OH CH3O iv) OH O(CH2)3CH3 2. Para los siguientes compuestos, analice la capacidad que poseen de establecer enlaces de hidrógeno inter e intramolecular: a) Ácido 4-hidroxibenzoico; b) Ácido 2-hidroxibenzoico 3. Indique los productos formados en las siguientes reacciones: i) KMnO4 / ∆ ii) neutral. OH A KMnO4 / ∆ B OH OH CrO3 C H2SO4 OH CrO3 D H2SO4 PCC OH E T. amb. 4. Determine la estructura de los compuestos indicados con la información que se aporta: 4.1. Un compuesto (A), ópticamente inactivo, que tiene formula molecular C4H10O no sufre oxidación con CrO3/H2SO4 pero desprende hidrógeno al ser tratado con Na. 4.2. Un compuesto (B), ópticamente inactivo, que tiene formula molecular C4H10O no sufre oxidación con CrO3/H2SO4 pero no desprende hidrógeno al ser tratado con Na. 4.3. Un compuesto (C), ópticamente activo, que tiene formula molecular C4H10O sufre oxidación con CrO3/H2SO4. 4.4. Un compuesto (D) que tiene formula molecular C6H6O se desprotona con Na reacciona por una SN2 con CH3Br para dar un compuesto (E). El compuesto (E) tratado con HNO3 (c)/H2SO4 (c) genera mayoritariamente un producto (F) de C7H7NO3. 5. La reactividad de los alcoholes alifáticos difiere de la de los aromáticos (fenoles), indique si hay o no reacción en cada uno de los casos y escriba los productos obtenidos (en los casos afirmativos). CrO3 H2SO 4 ? OH HCl ? ? Na ? CH3I ? PCC ? CrO3 OH Na H2SO4 HCl ? ? CH3I ? PCC ? 6. Formule un alcohol y el agente oxidante correspondiente que genere por oxidación el compuesto: Ácido 3-etil-2,2-dimetilpentanoico. 7. Explique a que se debe las siguientes propiedades físicas de los alcoholes: a) El punto de ebullición del butano es -0.5°C, en tanto que el propanol es de 97°C. b) Los alcoholes que presentan de 1 a 4 átomos de carbono presentan adecuada solubilidad en agua. 8. Plantee la reacción del propanol con cada uno de los siguientes reactivos: a) K2Cr2O7/H2SO4/∆ b) Na(s) c) H2SO4(c)/∆ d) HCl(c) PRÁCTICO IX: Alcoholes, fenoles y éteres 9. Proponga una vía de síntesis para los siguientes compuestos a partir de fenol: a) 2-Bromo-4-metilfenol b) p-nitrofenol c) p-isopropilfenol 10. Complete las siguientes reacciones con el producto orgánico principal: a) OH 1) NaOH 2) A Br b) OH OCH3 CH3Cl AlCl3 B 1) NaOH 2) CH3I C KMnO4 OH- H3O+ D HOOC c) G OH H Br2/Fe HNO3 H2SO4 E + Br2/Fe F PRÁCTICO X: Práctico de visualización tridimensional: Compuestos aromáticos. Ácidos carboxílicos y derivados 1. La piridina y el furano son compuestos heterocíclicos que se clasifican como aromáticos ya que se comportan químicamente como el benceno: O N Piridina (Py) Furano Visualice la distribución electrónica que explica esta semejanza. 2. Frente a una reacción de SEAr se conocen los siguientes órdenes de reactividad y de orientación: anilina (orientador orto y para) > benceno > nitrobenceno (orientador meta). Visualice este hecho. 3. Se conoce el siguiente orden de reactividad de derivados de los ácidos carboxílicos frente a nucleófilos: Anhídrido acético > acetato de metilo > ácido acético Explique este hecho experimental visualizando la distribución de cargas. 4. Un compuesto (A) de fórmula molecular C7H11NO2 puede ser alguno de los siguientes productos: O O2N CH3 NH2 O O H2N HO CN HO OCH3 De (A) se sabe que desvía la luz polarizada y que los experimentos de difracción de Rayos X indican que el compuesto tiene un enlace C-N que mide 1.17 Å. a) Proponga cuál de las estructuras mostradas se corresponde con (A). b) ¿Qué ocurre con (A) si es tratado en medio ácido acuoso y calor? 5. Estudie teóricamente el siguiente mecanismo. Analice cargas atómicas, distancias de enlace y geometrías. d= d= O CH3 d= OCH3 OH H+ q= HO OH2 OH2 CH3 d= OCH3 CH3 q= abi OCH3 CH3 d= d= O CH3 OH OH H+ CH3 OH OCH3 H d= ANALICE GEOMETRÍA d= HO OH + CH3OH ANALICE GEOMETRÍA PRÁCTICO XI: Ácidos carboxílicos y derivados. Aminas. Ácido-base 1. Nombre, siguiendo las reglas de I.U.P.A.C. los siguientes compuestos: O O O O H N O O O O HO O O O 2. Complete las siguientes secuencias de reacciones: OH ? LiAlH4 OH ? O ? ? SOCl2 Cl NaCN ? ? ? ? ? LiAlH4 ? ? 1) CH3NH2 2) NaOH acuoso Neutralización LiAlH4 COOH CH3OH LiAlH4 ? 3. Un compuesto A, de fórmula C7H5N se calienta en medio ácido para dar un compuesto B, de fórmula C7H6O2. B reacciona con cloruro de tionilo obteniéndose un compuesto C, muy reactivo. El compuesto C, tratado con D, de fórmula molecular C2H6O, da el compuesto E. Nota: El compuesto B puede obtenerse a través de oxidación con KMnO4 y calor a partir de propilbenceno. a) Escriba las estructuras de A, B, C, D, y E. b) Escriba todas las reacciones involucradas. 4. Clasifique las aminas siguientes como primarias, secundarias o terciarias y nombre cada compuesto de acuerdo con las reglas IUPAC. NH2 NH2 N H N 5. La 4-metilpiperidina tiene un P.eb. más alto que N-metilpiperidina. Explique. HN CH3 4-Metilpiperidina Peb= 129ºC CH3N N-M etilpiperidina Peb= 106ºC 6. a) Diseñe una síntesis de o-bromoiodobenceno a partir de anilina. b) Muestre cómo puede preparar m-isopropilnitrobenceno a partir de cumeno (isopropilbenceno). 7. Ordene en forma creciente la acidez de los siguientes compuestos: ciclohexanol, fenol, p-nitrofenol y ácido benzoico. Explique el orden asignado. 8. Explique el orden de acidez de los siguientes compuestos. O Cl OH pKa = 2.86 OH OH OH Cl O O O Cl pKa = 4.05 pKa = 4.52 pKa =4.83 9. (EXAMEN) a) El aminoácido alanina (Ácido 2-aminopropanoico) puede existir bajo dos formas enantioméricas. Explique porqué y formule ambos enantiómeros. b) La alanina presenta una buena solubilidad en HCl dil y una buena solubilidad en NaOH dil. Explique, a través de reacciones, porqué se da este tipo de solubilidades. c) El punto de ebullición del éster etílico de la alanina (2-aminopropanoato de etilo) es menor que el punto de ebullición de la alanina. Explique porqué. d) Cuando la alanina reacciona con otro aminoácido, por ejemplo glicina (Ácido 2-aminoetanoico), se produce un enlace amida conocido como enlace peptídico. Esquematice el tipo de enlace y los grupos funcionales involucrados para la generación del mismo, así como el proceso. PRÁCTICO XI: Ácidos carboxílicos y derivados. Aminas. Ácido-base 10. Complete las siguientes reacciones: a) COOH SOCl2 OH A B b) O O + c) KMnO4/OH∆ OH C OH O D SOCl2 E NH3 F 11. (EXAMEN) El átomo de nitrógeno de la anilina es significativamente menos reactivo como nucleófilo que el átomo de nitrógeno de una amina alifática primaria. ¿Cuál es la explicación racional de esta observación? 12. (EXAMEN) Para el grupo funcional amina: a) Formule una amina de origen natural b) Indique si es posible que forme enlaces de hidrógeno intra e intermolecular. Si es posible cite ejemplos. c) Indique ejemplo de las siguientes reacciones: i) Acetilación de una amina primaria ii) Formación de imina o bases de Schift iii) Reacción de diazotación de aminas aromáticas iv) Clasifique las aminas como ácidas, básicas o neutras y explique. 13. (EXAMEN) Ordene los siguientes grupos de compuestos según acidez creciente. Explique claramente su razonamiento. i) OH OH OH NC H3CO ii) O Cl O Cl OH Cl Cl Cl OH OH (X) O 14. Ordene los siguientes grupos de compuestos en función de su basicidad, justificando su respuesta: a) NH2 NO2 NH2 O H2N N H H2N H3CO Cl b) NH2 NH2 H N NH2 H N CH3 PRÁCTICO XI: Ácidos carboxílicos y derivados. Aminas. Ácido-base 15. Ordene los siguientes grupos de compuestos en función de su acidez, justificando su respuesta: a) OH OH OH OH OH CH3 NO2 b) NO2 OH O2N OH OH NO2 16. a) Explique porqué el ácido m-metoxibenzoico es más fuerte que el ácido benzoico, mientras que el ácido p-metoxibenzoico es más débil. b) Busque una explicación para la siguiente diferencia de acidez: O OH Ácido pirúvico pKa = 2.49 O OH OH Ácido láctico O pKa = 3.85 PRÁCTICO XII: Práctico de visualización tridimensional: Ácido-base. Compuestos bioorgánicos 1. Prediga el orden de acidez del los siguientes compuestos: ciclohexanol, fenol, 2,4-dinitrofenol, justificando el orden predicho. 2. Explique los siguientes hechos experimentales: a) 4-Metoxipiridina es más básica que Piridina b) Anilina es más básica que p-Bromoanilina c) La basicidad de B es menor que la de A: N N A O B O 3. Visualizar la influencia de la estereoquímica de una molécula orgánica con respecto a un receptor biológico. ¿Qué importancia bioquímica tiene la estereoquímica de las moléculas orgánicas? 4. Visualizar la interacción mediante enlaces de hidrógeno entre dos bases de ADN doble hebra: Guanina y Citosina. Visualizar la interacción entre 2 pares de bases adyacentes en una secuencia de ADN doble hebra. ¿De qué tipo de interacciones se tratan? 5. Visualizar una cadena de ADN dextrógira y levógira como ejemplo de quiralidad resultante de disposición macromolecular. 6. Visualizar la influencia de dobles enlace en ácidos grasos, y un componente de las membranas biológicas, la fosfatidilserina. a) ¿Que tipos de ácidos grasos encuentra en la fosfatidilserina? ¿Cómo afecta la presencia de dobles enlaces a las propiedades físicas y bioquímicas de los lípidos? PRÁCTICO XIII: Aldehídos y cetonas. Compuestos polifuncionales 1. Nombre, siguiendo las reglas de I.U.P.A.C., los siguientes compuestos: O Br O OH CHO CH3 2. Explique el siguiente orden experimental de reactividad de aldehídos frente a nucleófilos: CF3 CHO CHF2 > CHO CH2F > > CHO CH3 CHO 3. Para las siguientes reacciones indique los productos obtenidos, así como el mecanismo de obtención de C. i) LiAlH4 / Et2O A ii) H3O+ CrO3 / H+ O OH OH B / H+ C H NH2OH / H+ D 4. Indique los productos de las siguientes reacciones, así como el mecanismo de obtención de (A). Propanal 2-butanona i) CH3MgBr / Et2O ii) H3O (A) + i) φMgBr / Et2O (B) ii) H3O + 5. Un compuesto (A) de fórmula general C8H16 se somete a ozonólisis reductiva, rindiendo dos compuestos (B) y (C). De (B) se conoce que es ópticamente activo y da reacción positiva de Tollens. De (C) se sabe que es ópticamente inactivo, da negativa la reacción de Fehling y positivo el ensayo de iodoformo. Deduzca las estructuras de (A), (B) y (C) que cumplan con dichos resultados. 6. Un compuesto D (C4H8O) reacciona con NH2OH, dando una oxima. Además se sabe que al reaccionar con el reactivo de Grignard CH3MgBr, se obtiene un alcohol secundario de fórmula C5H12O ¿Cuál es su estructura? Plantee su razonamiento y escriba las reacciones involucradas. 7. (EXAMEN) Dado 3 isómeros A, B y C de fórmula molecular C8H8O2. i) B se reduce para dar un compuesto E sólo por tratamiento con LiAlH4, mientras que Ay C reaccionan con NaBH4 para dar los productos D y F, respectivamente. ii) C da reacción de haloformo positiva. iii) D, E y F reaccionan con PCC para dar los productos de oxidación C, G y H respectivamente. iv) A, G y H reaccionan con el reactivo de Fehiling. Formule las estructuras de A a H, indicando que tipos de isómeros son A, B y C. Explique brevemente su razonamiento para llegar a las estructuras de los compuestos indicados. 8. (EXAMEN) Proponer las estructuras de los productos intermedios y finales (A) hasta (E). Esquematice el mecanismo de obtención de (E) a partir de (D). 1) 1-Bromobutano Mg Et2O 3 CHO (D) 2) H3O+ KOH, H2O, T.A. (A) Na (B) Br (C) C6H14O (E) C9H20O PRÁCTICO XIII: Aldehídos y cetonas. Compuestos polifuncionales 9. (EXAMEN) a) Complete la siguiente secuencia de reacciones con productos: H3O+ CrO3 H2SO4 A CH3CH2NH2 H+ B C b) Mecanismo de obtención de (C) a partir de (B) c) ¿cuál de los siguientes agentes (a la izquierda) elegiría para llevar a cabo las reacciones indicadas (a la derecha)? Asigne y explique brevemente. O O O OH LiAlH4/Et2O OH O O O OEt OEt NaBH4/Et2O OH O KMnO4/frío O OH OH + EtOH OEt 10. (EXAMEN) a) Complete la secuencia con los productos (Y), (Z) y (W). O Cl OCH3 H2 O T.A. PCC (Y) C4H8O3 i) CH3MgBr (exc) (Z) C6H6O3 ii) neutraliz. (W) C6H4O2 b) Indique el mecanismo de obtención de (W) a partir de (Z). Compuestos polifuncionales: 1) Nombre, siguiendo las reglas de I.U.P.A.C., los siguientes compuestos: O O O H H3CO HO O OCH3 NH2 O O O CN N OH OH OH H 2) Indique, cuando corresponda, los productos formados en las siguientes reacciones: i) NaBH4 O H ? OEt ? ii) H3O+ H2/Pd T.A. H3C i) LiAlH4/Et2O ii) H3O+ H ? 3) Indique en cada uno de los siguientes compuestos cual o cuales de las interacciones electrostáticas (enlace de hidrógeno, fuerzas de Van der Waals, interacciones iónicas, interacciones dipolo-dipolo) posee cada una de las siguientes sustancias en su estado líquido puro. O O O-K+ HO OCH3 NH2 PRÁCTICO XIII: Aldehídos y cetonas. Compuestos polifuncionales 4) Complete con reactivos y productos las siguientes reacciones: OH N H ? O H H O N H CH3 CH3 i) LiAlH4/Et2O ii) neutralización (A) O K2Cr2O7/H+ O H ? (B) N H3CO CH3 O 5) (EXAMEN) a) Complete las secuencias de reacciones con productos: O O HO OCH3 (I) OH i) CH3MgBr (2 eq) A ii) neutraliz. C7H12O4 H+ B C8H16O3 H3O+ B C6H12O2 OH O3 Zn/HCl D C7H12O3 SOCl2 KOH E ∆ C7H11ClO2 F C7H10O2 (II) b) Indique el mecanismo de la transformación de (I) en (A) c) Nombre utilizando las reglas IUPAC el compuesto (I). 6) (EXAMEN) a) El ácido acetilsalicílico (principio activo de la Aspirina) introducido por Hoffman en 1898, es el analgésico y antiinflamatorio más recetado en el mundo. En el siguiente esquema se representa una posible secuencia sintética para la obtención del mismo, indique los reactivos y productos de A a E. OH OH o-Nitrofenol (A) NH2 B COOH D i) NaNO2/HCl/0ºC C C7H5NO ii) CuCN E OAc COOH Ácido acetilsalicílico b) Detalle el mecanismo de obtención de ácido salicílico a partir de ácido acetilsalicílico según: OAc OH COOH H3O+ COOH ∆ c) El ácido acetilsalicílico es más o menos soluble en agua que el ácido salicílico. Explique esta diferencia de solubilidad.