Mecanismos de resistencia a la terapéutica antifúngica
Anuncio

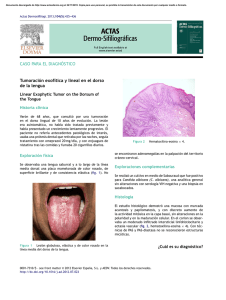
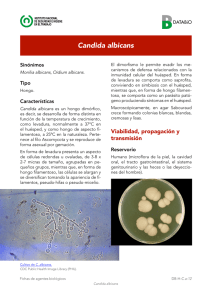
Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. Mecanismos de resistencia a la terapéutica antifúngica José Pontón y Guillermo Quindós Departamento de Inmunología, Microbiología y Parasitología. Facultad de Medicina y Odontología. Universidad del País Vasco. Bilbao. Vizcaya. España. La resistencia a los antifúngicos presenta implicaciones importantes en la morbilidad y la mortalidad de las micosis; las consecuencias clínicas de esta resistencia se observan en los fallos en el tratamiento y en los cambios en la prevalencia de las especies fúngicas. Desaparecidas en gran medida las resistencias al fluconazol asociadas con el tratamiento y la profilaxis de la candidiasis orofaríngea en pacientes infectados por el VIH, los estudios recientes con aislamientos de hemocultivos sugieren que la resistencia a los antifúngicos no supone un problema terapéutico significativo. Sin embargo, los hongos son organismos que presentan una gran plasticidad ante los cambios ambientales y se han descrito mecanismos de resistencia a los principales grupos de antifúngicos. Por analogía con lo observado con los antibacterianos, el uso más frecuente de antifúngicos podría producir un aumento en la resistencia microbiana a estos fármacos. Palabras clave: Antifúngicos. Resistencia. Mecanismos. Azoles. Polienos. Equinocandinas. Mechanisms of resistance to antifungal therapy Resistance to antifungal agents has important implications in morbidity and mortality associated with mycoses. The clinical consequences of this resistance can been observed in treatment failure and changes in the prevalence of fungal species. Resistances to fluconazole associated with the treatment and prophylaxis of oropharyngeal candidiasis in patients with HIV infection have largely disappeared, and recent studies with isolates from blood cultures suggest that resistance to antifungal agents does not constitute a significant therapeutic problem. However, fungi are organisms that present great plasticity with regard to environmental changes, and mechanisms of resistance to the main groups of antifungal agents have been described. Through analogy with what has been observed with antibacterial agents, more frequent use of antifungal agents could increase microbial resistance to these drugs. Key words: Antifungal agents. Resistance. Mechanisms. Azoles. Polyenes. Echinocandins. En las últimas décadas se ha observado un aumento en la incidencia de las micosis, que se asocia con altas tasas de morbilidad y mortalidad, especialmente en pacientes inmunodeficientes1,2. A modo de ejemplo y teniendo en cuenta únicamente las micosis más frecuentes en nuestro medio, se ha descrito una mortalidad del 49% en pacientes con candidiasis sistémica y ésta asciende al 50-100% en enferFinanciación del proyecto PI030662/2003: Fondo de Investigación Sanitaria, y proyectos G03/075, subproyecto «Infección y trasplante. Infección fúngica invasora en el trasplante de órgano sólido y de progenitores hematopoyéticos (RESITRA)» y C03/10, subproyecto «Utilidad de la serología anti-Candida y de la detección de galactomanano en el diagnóstico y la definición de grupos de riesgo de infecciones invasoras por Candida y/o Aspergillus en pacientes con neoplasias hematológicas» del Fondo de Investigación Sanitaria (Redes Temáticas de Investigación Cooperativa), Ministerio de Sanidad y Consumo. Correspondencia: Dr. J. Pontón. Departamento de Inmunología, Microbiología y Parasitología. Facultad de Medicina y Odontología. Universidad del País Vasco. Apartado 699. 48080 Bilbao. Vizcaya. España. Correo electrónico: jose.ponton@ehu.es 56 Med Clin (Barc). 2006;126(Supl 1):56-60 mos con aspergilosis invasora3,4. Un variado número de factores son responsables del mal pronóstico que presentan las micosis invasoras. Entre estos factores destacan la dificultad diagnóstica, la deficiencia inmunológica de gran parte de los pacientes y la alta tasa de fallos terapéuticos. El desarrollo de resistencias a los antifúngicos es un hecho inevitable, dada la gran capacidad de adaptación a los cambios ambientales que presentan los hongos. El conocimiento de la resistencia a los antifúngicos es esencial para el desarrollo de estrategias profilácticas y terapéuticas eficaces que eviten los problemas que están apareciendo en la actualidad con las micosis por hongos resistentes. En la resistencia del hongo al antifúngico desempeñan un papel muy importante factores del hongo como la resistencia innata o primaria (presente antes de la exposición al antifúngico) y la adquirida (desarrollada tras el contacto con el antifúngico), la especie fúngica, el tamaño de la población fúngica, el cambio fenotípico y la capacidad para formar biopelículas (fig. 1). Sin embargo, desde el punto de vista clínico es necesario considerar, no sólo la resistencia in vitro sino también la resistencia clínica, ya que el tratamiento depende no sólo de la concentración mínima inhibitoria (CMI) del antifúngico sino de otros factores como la penetración y distribución del fármaco, su naturaleza fungistática o fungicida, su mecanismo de acción y la interacción con otros fármacos, así como del estado del sistema inmunitario del paciente, del lugar de la infección y del potencial incumplimiento terapéutico (fig. 1)5. El desarrollo de moléculas con actividad antifúngica se ha producido mucho más lentamente que el de antibacterianos, y aunque el número de antifúngicos ha ido aumentando en las últimas décadas (fig. 2), la mayoría pertenece a un grupo limitado de familias que comparten mecanismos de acción y, por tanto, de resistencia6 Resistencia a los antifúngicos en las micosis superficiales La resistencia a los antifúngicos en pacientes con micosis superficiales es actualmente un fenómeno infrecuente, pero tuvo una gran importancia hace una década en pacientes con sida y candidiasis superficiales tratados profilácticamente con azoles7. La candidiasis orofaríngea, con una complicación esofágica habitual, era la infección oportunista más frecuente en las personas infectadas por el VIH y afectaba a la práctica totalidad de los pacientes8. El fluconazol fue el fármaco de elección para el tratamiento y profilaxis de la candidiasis orofaríngea, y se describió hasta un 41% de resistencias al fluconazol en los aislamientos clínicos de estos pacientes7. Dado que algunas especies del género Candida, como C. krusei y C. glabrata, son menos sensibles al fluconazol que C. albicans, se observó un aumento de la incidencia de especies de Candida diferentes de C. albicans en muestras orofaríngeas de pacientes colonizados y con candidiasis orofaríngea tratados con fluconazol9. La introducción de la terapia antirretoviral de alta actividad ha pro- Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. PONTÓN J, ET AL. MECANISMOS DE RESISTENCIA TERAPÉUTICA ANTIFÚNGICA Hongo Resistencia innata y adquirida al antifúngico Especie Tamaño de la población fúngica Cambio fenotípico Biopelículas Fallo terapéutico Paciente Estado del sistema inmunitario Lugar de la infección Presencia de cuerpos extraños Incumplimiento terapéutico Antifúngico Dosis inapropiada Acción fungiestática Absorción, distribución y metabolismo pobres Interacciones con otros fármacos Fig. 1. El fracaso terapéutico en las micosis de un gran número de pacientes también ha aumentado las resistencias a este antifúngico y el aislamiento de especies diferentes de C. albicans12. Sin embargo, el aislamiento de C. krusei, especie resistente al fluconazol, en hemocultivos continúa siendo infrecuente. La resistencia a los polienos ha surgido en paralelo al aumento de infecciones fúngicas causadas por hongos emergentes como Trichosporon asahii, Candida lusitaniae, Candida guillermondii, Aspergillus terreus, Fusarium, Scopulariopsis y Scedosporium13. Muchos de estos hongos presentan una resistencia primaria a la amfotericina B y pueden causar infecciones sistémicas que presentan una alta mortalidad5. N.° acumulado de antifúngicos 40 35 30 Total Tópicos Sistémicos 25 20 15 10 5 Mecanismos de acción y resistencia 0 1900 Griseofulvina 1920 1940 1960 1980 2000 Años Fig. 2. Evolución del número de antifúngicos. ducido una disminución en la frecuencia de las candidiasis y de la resistencia al fluconazol en los pacientes infectados por el VIH10. La candidiasis vulvovaginal es una presentación frecuente en mujeres en edad reproductora que suele tratarse con azoles. A pesar de la frecuencia en su presentación y del amplio uso de antifúngicos azólicos, no se ha observado un aumento en la resistencia a estos antifúngicos11. Sin embargo, es importante tener en cuenta que las vulvovaginitis recurrentes son un problema médico importante y que las infecciones producidas por C. glabrata y otras especies diferentes de C. albicans menos sensibles al fluconazol están aumentando en frecuencia. Resistencia a los antifúngicos en las micosis sistémicas Dado que la candidiasis sistémica es la micosis invasora más importante, la profilaxis y el tratamiento con fluconazol Fue el primer fármaco con actividad específica para los hongos. Su espectro de acción se reduce casi exclusivamente a los dermatófitos. Su mecanismo de acción no se conoce con exactitud pero se cree que interfiere con el ensamblaje de los microtúbulos14. Flucitosina La flucitosina o 5-fluorocitosina es un antifúngico que inhibe la síntesis de ácidos nucleicos en la célula fúngica. Para ejercer su acción, este antifúngico debe ser tomado por la célula fúngica para convertirlo en 5-fluorouracilo, que se incorpora al ARN y afecta a la timidilato sintasa. Su espectro de acción se reduce a los géneros Candida y Cryptococcus, levaduras que poseen la citosina permeasa necesaria para internalizar el fármaco, y la uracil fosforribosil transferasa para convertir el 5-fluorouracilo en un sustrato apropiado para la síntesis de los ácidos nucleicos. La resistencia a este antifúngico se creía bastante común, pero estudios recientes obtenidos con la metodología propuesta por el National Committee for Clinical Laboratory Standards (NCCLS) de EE.UU. han observado que el 8% de los aislamientos de Candida procedentes de hemocultivos obtenidos en hospitales estadounidenses son resistentes a la flucitosina, mientras que el porcentaje observado en EuMed Clin (Barc). 2006;126(Supl 1):56-60 57 Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. PONTÓN J, ET AL. MECANISMOS DE RESISTENCIA TERAPÉUTICA ANTIFÚNGICA TABLA 1 Dianas y mecanismos de resistencia de los principales grupos de antifúngicos Antifúngico Flucitosina Polienos Amfotericina B Nistatina Azoles Fluconazol Itraconazol Voriconazol Alilaminas Terbinafina Morfolinas Amorolfina Equinocandinas Caspofungina Diana Mecanismo de resistencia Timidilato sintasa Fallo en la transformación de la flucitosina en metabolitos activos Ergosterol Sustitución del ergosterol por otros esteroles Disminución del contenido en ergosterol Aumento en la actividad catalasa Citocromo P-450 (ERG11 o CYP51) Mutaciones que modifican la diana Sobreexpresión del gen ERG11 Sobreexpresión de bombas de achique Interferencia con la acción sobre la 14-alfa-demetilasa Alteraciones en otras enzimas de la biosíntesis del ergosterol Disminución de la permeabilidad de la membrana plasmática al fármaco Escualeno epoxidasa (ERG1) Mutaciones en ERG1 Sobreexpresión de CDR1, CDR2 y CaMDR1 D14 reductasa (ERG24) D8-D7 isomerasa (ERG2) Sobreexpresión de ERG24 Sobreexpresión de CDR1, CDR2 β-1,3 glucano sintasa (FKS1) Mutaciones en FKS1 Entre paréntesis se muestra el gen que codifica la diana. Modificada de Carrillo-Muñoz et al30. ropa es del 0,2%15,16. La resistencia a la flucitosina se produce tanto de forma primaria como secundaria por defectos en las enzimas permeasa, desaminasa y/o fosforibosil transferasa17 (tabla 1) y se presenta especialmente en el serotipo B de C. albicans18. Polienos Los antifúngicos poliénicos comprenden la amfotericina B y la nistatina. Su mecanismo de acción implica la unión al ergosterol, el esterol principal de la membrana fúngica y la alteración de la permeabilidad de la membrana plasmática. Estos antifúngicos son activos contra una gran variedad de hongos y la amfotericina B ha sido durante mucho tiempo el fármaco de elección para el tratamiento de las micosis sistémicas. Sin embargo, como se ha mencionado anteriormente, existe un número importante de hongos emergentes que presentan una resistencia natural a la amfotericina B. A pesar de su gran utilización, la resistencia adquirida a los polienos es muy baja, aunque se ha descrito el aislamiento de levaduras resistentes en pacientes con cáncer19. La emergencia de hongos resistentes a los polienos se debe a la producción de cambios cualitativos y cuantitativos en los esteroles de la membrana (tabla 1). Así, se ha descrito la sustitución del ergosterol por otros esteroles en Aspergillus y Cryptococcus y la disminución del 74-85% del contenido en ergosterol en C. albicans20. También se ha descrito un aumento en la actividad catalasa que produce una disminución de la sensibilidad al daño oxidativo21. El mecanismo de acción de las formulaciones lipídicas de la amfotericina B es idéntico al de la amfotericina B convencional, aunque son mucho menos tóxicas. Azoles Los azoles son la familia más amplia de fármacos antifúngicos y comprenden los imidazoles y los triazoles. El espectro de acción está restringido a la mayoría de las especies de Candida y Cryptococcus. Sin embargo, C. krusei y C. glabrata presentan una sensibilidad disminuida al fluconazol. Los nuevos triazoles presentan un espectro de actividad ampliado. El voriconazol tiene un amplio espectro de actividad que incluye Candida, Cryptococcus neoformans, Fusarium, Blastomyces dermatitidis, Coccidioides immitis, dermatófitos, 58 Med Clin (Barc). 2006;126(Supl 1):56-60 Histoplasma capsulatum, Malassezia, Scedosporium apiospermum (Pseudallescheria boydii), Sporothrix schenckii y Absidia corymbifera, y es fungicida frente a algunos hongos filamentosos. El posaconazol tiene un espectro de actividad antifúngica similar al itraconazol pero es más potente frente a Aspergillus y Rhizopus, y muestra actividad sobre Coccidioides. El ravuconazol es más activo que el itraconazol y el fluconazol contra hongos levaduriformes. Es activo contra Aspergillus, hialohifomicetos, dermatófitos y hongos dematiáceos, pero carece de actividad sobre los zigomicetos, Sporothrix, Pseudallescheria y Fusarium. El mecanismo de acción fundamental de los azoles se basa en la inhibición de la 14-alfa-demetilación del lanosterol en la ruta biosintética del ergosterol6. La ausencia de ergosterol y su sustitución por otros esteroles hace que la membrana plasmática presente alteraciones en su permeabilidad y fluidez. La diana principal de los azoles es el citocromo P-450 lanosterol 14-alfa-demetilasa (Erg11p o Cyp51p, dependiendo de las diferentes nomenclaturas), que cataliza la eliminación del grupo 14-alfa-metil del lanosterol. La enzima Erg11p contiene protoporfirina ligada a hierro en el centro activo a la que se unen los azoles por su átomo de nitrógeno del anillo imidazólico o triazólico. El resto de la molécula del azol se une a la apoproteína de una forma que depende de la estructura de cada azol. La conformación exacta del centro activo difiere en las diferentes especies fúngicas, y la unión de cada azol con cada una de las diversas clases de enzimas Erg11p determinará su espectro de actividad. La sustitución del anillo imidazólico por otro triazólico ha permitido aumentar la especificidad de la unión a la enzima Erg11p y, en el caso del voriconazol, extender su actividad a Aspergillus y otros hongos filamentosos. La resistencia a los azoles puede ocurrir por una variedad de mecanismos que incluyen mutaciones que modifican la diana, sobreexpresión del gen ERG11, sobreexpresión de bombas de achique de la membrana que sacan el antifúngico del interior de la célula fúngica, interferencia con la acción sobre la 14-alfa-demetilasa, alteraciones en otras enzimas de la biosíntesis del ergosterol y la disminución de la permeabilidad de la membrana plasmática al fármaco22 (tabla 1). Probablemente uno de los mecanismos más importantes de resistencia a los azoles sea el fallo en la acumulación intracelular del fármaco mediante la sobreexpresión de los ge- Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. PONTÓN J, ET AL. MECANISMOS DE RESISTENCIA TERAPÉUTICA ANTIFÚNGICA TABLA 2 Puntos de corte para establecer la sensibilidad y resistencia a algunos antifúngicos según el National Committee for Clinical Laboratory Standards CMI (µg/ml) Antifúngico Fluconazol Itraconazol Flucitosina Sensible SDD Intermedio Resistente ≤8 ≤ 0,125 ≤4 16-32 0,25-0,5 – – – 8-16 ≥ 64 ≥1 ≤ 32 SDD: sensible dependiendo de la dosis. TABLA 3 Dosis diarias de fluconazol que son probablemente eficaces para tratar la infección por Candida Dosis diaria (mg) CMI (µg/ml) 100 200 400 800 ≤4 ≤8 ≤ 16 ≤ 32 nes que codifican las bombas de achique (CDR, MDR y FLU1). La expresión heteróloga de los genes CDR1 y CDR2 en Saccharomyces cerevisiae confiere resistencia a varios azoles (fluconazol, itraconazol y ketoconazol) y a otros antifúngicos e inhibidores metabólicos23. El gen MDR1 no se expresa durante el crecimiento in vitro de cepas de C. albicans sensibles al fluconazol, pero se encuentra sobreexpresado en muchos aislamientos clínicos resistentes al fluconazol. La delección de los 2 alelos del gen MDR1 en aislamientos resistentes de C. albicans los convierte en sensibles. La resistencia suele ir apareciendo gradualmente debido a la presión continua que el antifúngico ejerce sobre el hongo. Aunque cada uno de los mecanismos mencionados puede disminuir la sensibilidad de un aislamiento de C. albicans al fluconazol, es muy probable que varios mecanismos contribuyan a la resistencia final. En cepas de C. albicans con alta resistencia a los azoles se ha confirmado la naturaleza multifactorial de la resistencia en el 75% de los aislamientos. La sobreexpresión de los genes que codifican las bombas se ha demostrado en el 85% de los casos, las mutaciones en el gen ERG11 en el 65% y la sobreexpresión de ERG11 en el 35%24. La importancia de la resistencia a los azoles ha sido mínima hasta el momento, con excepción de las infecciones orofaríngeas en pacientes infectados por el VIH25,26. Alilaminas y morfolinas Son antifúngicos utilizados en el tratamiento de micosis superficiales que presentan un espectro de acción que incluye fundamentalmente a los dermatófitos y una baja actividad sobre Candida. También actúan sobre la ruta biosintética del ergosterol. La terbinafina inhibe la escualeno epoxidasa (Erg1p), resultando su acción fungicida27 (tabla 1), mientras que la amorolfina inhibe las enzimas D14 reductasa (Erg24) y la D8-D7 isomerasa (Erg2p). La resistencia a la terbinafina es muy infrecuente y se ha relacionado recientemente con una mutación en el gen ERG128 (tabla 1). Equinocandinas Son lipopéptidos que incluyen la equinocandina B, la aculeacina A, la cilofungina, la anidulafungina, la caspofungina y la micafungina29,30. De todos ellos, la caspofungina se en- cuentra ya comercializada en España y la micafungina lo será en un futuro inmediato. Su mecanismo de acción antifúngica se basa en la producción de daños en la pared celular al unirse a la β-1,3 glucano sintasa (Fks1p) responsable de la síntesis del β-1,3 glucano, uno de los polisacáridos de la pared celular. Esta acción resulta fungicida para Candida y fungistática para Aspergillus. La caspofungina también es activa contra Pneumocystis jirovecii pero no es activa contra Cryptococcus, Fusarium, zigomicetos y Scedosporium. La resistencia a la caspofungina es excepcional y se produce por mutaciones en el gen FSK131 (tabla 1). Como era de esperar por su mecanismo de acción, no se han observado resistencias cruzadas con polienos y azoles. Sordarinas Inhiben la síntesis de proteínas bloqueando la función del factor de elongación 2 (EF2) de la célula fúngica. No existe todavía ningún representante de uso clínico. Utilidad de los métodos in vitro para predecir la resistencia a los antifúngicos El objetivo final de las pruebas de sensibilidad in vitro a los antifúngicos es predecir la respuesta de los pacientes al tratamiento. Sin embargo, el establecimiento de una correlación entre la sensibilidad in vitro de un hongo a un antifúngico y la eficacia clínica de ese antifúngico para tratar la micosis es difícil de obtener y no está totalmente resuelto en la actualidad. En general, para la mayoría de los antimicrobianos el éxito terapéutico disminuye a medida que aumenta la CMI del aislamiento, pero se ha observado que hasta el 50% de los pacientes infectados con un organismo resistente a un antimicrobiano responden clínicamente al tratamiento con ese agente32. Teniendo en cuenta estas limitaciones, y según los datos obtenidos en pacientes con candidiasis orofaríngea e infección por el VIH, se han establecido puntos de corte para determinar si un aislamiento es sensible o resistente al fluconazol, el itraconazol y la flucitosina (tabla 2). Así, un aislamiento que presente una CMI ≤ 8 µg/ml será sensible al tratamiento con fluconazol mientras que un aislamiento que presente una CMI ≥ 64 µg/ml será resistente al tratamiento con este antifúngico. La categoría «sensible dependiente de la dosis» se aplica a los aislamientos clínicos que responden a dosis de antifúngico superiores a las habitualmente empleadas. Los puntos de corte para itraconazol y flucitosina se presentan en la tabla 2. Basándose en estos datos, Hospenthal et al33 han propuesto las dosis diarias de fluconazol que son probablemente más eficaces para tratar la infección por Candida (tabla 3). En la actualidad, existe una gran variedad de métodos para el estudio de la sensibilidad in vitro a los antifúngicos que presentan buena correlación con los métodos propuestos por el NCCLS para Candida y C. neoformans (documento M27-A2) y para hongos filamentosos (documento M38-A). Estrategias para combatir la resistencia a los antifúngicos En la actualidad se están desarrollando nuevas estrategias para combatir la resistencia a los antifúngicos e impedir que esta resistencia adquiera las dimensiones de la resistencia a los antibacterianos. Estas estrategias incluyen el diagnóstico temprano y rápido, la correcta utilización de los antifúngicos ya existentes, el desarrollo de nuevas moléculas antifúngicas con una mejor farmacocinética y mayor actividad antifúngica, las nuevas presentaciones de algunos antifúngicos, la combinación de antifúngicos y el aumento de la dosis5,34. Med Clin (Barc). 2006;126(Supl 1):56-60 59 Documento descargado de http://www.elsevier.es el 25/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. PONTÓN J, ET AL. MECANISMOS DE RESISTENCIA TERAPÉUTICA ANTIFÚNGICA REFERENCIAS BIBLIOGRÁFICAS 1. García Ruíz JC, Pontón J. Infecciones fúngicas invasivas en pacientes con hemopatías malignas: una aproximación clínica. Med Clin (Barc). 2000;115:305-12. 2. García Ruíz JC, Amutio E, Pontón J. Infección fúngica invasora en pacientes inmunodeficientes. Rev Iberoam Micol. 2004;21:55-62. 3. Gudlaugsson O, Gillespie S, Lee K, Vande Berg J, Hu J, Messer S, et al. Attributable mortality of nosocomial candidemia, revisited. Clin Infect Dis. 2003;37:1172-7. 4. Lumbreras C, Gavaldá J. Aspergilosis invasora: manifestaciones clínicas y tratamiento. Rev Iberoam Micol. 2003;20:79-89. 5. Masia M, Gutiérrez F. Antifungal drug resistance to azoles and polyenes. Lancet Infect Dis. 2002;2:550-63. 6. Ghannoum MA, Rice LB. Antifungal agents: mode of action, mechanisms of resistance, and correlation of these mechanisms with bacterial resistance. Clin Microbiol Rev. 1999;12:501-17. 7. Maenza JR, Merz WG, Romagnoli MJ, Keruly JC, Moore RD, Gallant JE. Infection due to fluconazole resistant Candida in patients with AIDS: prevalence and microbiology. Clin Infect Dis. 1997;24:28-34. 8. Aguirre JM. Candidiasis orales. Rev Iberoam Micol. 2002;19:17-21. 9. Martins MD, Lozano-Chiu M, Rex JH. Point prevalence of oropharyngeal carriage of fluconazole resistant Candida in human immunodeficiency virus-infected patients. Clin Infect Dis. 1997;25:843–6. 10. Martins MD, Lozano-Chiu M, Rex JH. Declining rates of oropharyngeal candidiasis and carriage of Candida albicans associated with trends toward reduced rates of carriage of fluconazole-resistant C. albicans in human immunodeficiency virus-infected patients. Clin Infect Dis. 1998;27:1291-4. 11. Spinillo A, Nicola S, Colonna L, Marangoni E, Cavanna C, Michelone G. Frequency and significance of drug resistance in vulvovaginal candidiasis. Gynecol Obstet Invest. 1994;38:130-3. 12. Price MF, LaRocco MT, Gentry LO. Fluconazole susceptibilities of Candida species and distribution of species recovered from blood cultures over a 5-year period. Antimicrob Agents Chemother. 1994;38:1422-7. 13. Espinel-Ingroff A. In vitro antifungal activities of anidulafungin and micafungin, licensed agents and the investigational triazole posaconazole as determined by NCCLS methods for 12,052 fungal isolates: review of the literature. Rev Iberoam Micol. 2003;20:121-36. 14. Develoux M. Griseofulvin. Ann Dermatol Venereol. 2001;128:1317-25. 15. Pfaller MA, Jones RN, Messer SA, Edmond MB, Wenzel RP. National surveillance of nosocomial blood stream infection due to Candida albicans–Frequency of occurrence and antifungal susceptibility in the Scope program. Diag Microbiol Infect Dis. 1998;31:327-32. 16. Barchiesi F, Arzeni D, Caselli F, Scalise G. Primary resistance to flucytosine among clinical isolates of Candida spp. J Antimicrob Chemother. 2000;45:408-9. 17. Fasoli MO, Kerridge D, Morris PG, Torosantucci A. 19F nuclear magnetic resonance study of fluoropyrimidine metabolism in strains of Candida glabrata with specific defects in pyrimidine metabolism. Antimicrob Agents Chemother. 1990;34:1996-2006. 60 Med Clin (Barc). 2006;126(Supl 1):56-60 18. Quindós G, Ruesga MT, Martín-Mazuelos E, Salesa R, Alonso-Vargas R, Carrillo-Muñoz AJ, et al. In-vitro activity of 5-fluorocytosine against 1,021 Spanish clinical isolates of Candida and other medically important yeasts. Rev Iberoam Micol. 2004;21:63-9. 19. Nolte FS, Parkinson T, Falconer DJ, Dix S, Williams J, Gilmore C, et al. Isolation and characterization of fluconazole-and amphotericin B-resistant Candida albicans from blood of two patients with leukemia. Antimicrob Agents Chemother. 1997;41:196-9. 20. Dick JD, Merz WG, Saral R. Incidence of polyene resistant yeasts recovered from clinical specimens. Antimicrob Agents Chemother. 1980;18:158-63. 21. Sokol-Anderson ML, Brajtburg J, Medoff G. Amphotericin B-induced oxidative damage and killing of Candida albicans. J Infect Dis. 1986;154:76-83. 22. Morschhauser J. The genetic basis of fluconazole resistance development in Candida albicans. Biochim Biophys Acta. 2002;1587:240-8. 23. Sanglard D. Resistance of human fungal pathogens to antifungal drugs. Curr Opin Microbiol. 2002;5:379-85. 24. Perea S, Lopez-Ribot JL, Kirkpatrick WR, McAtee RK, Santillan RA, Martinez M, et al. Prevalence of molecular mechanisms of resistance to azole antifungal agents in Candida albicans strains displaying high-level fluconazole resistance isolated from human immunodeficiency virus-infected patients. Antimicrob Agents Chemother. 2001;45:2676-84. 25. Sanglard D, Odds FC. Resistance of Candida species to antifungal agents: molecular mechanisms and clinical consequences. Lancet Infect Dis. 2002;2:73-85. 26. Li X, Brown N, Chau AS, López-Ribot JL, Ruesga MT, Quindós G, et al. Changes in susceptibility to posaconazole in clinical isolates of Candida albicans. J Antimicrob Chemother. 2004;53:74-80. 27. Ryder NS. The mechanism of action of terbinafine. Clin Exp Dermatol. 1989;14:98-100. 28. Klobucnıkova V, Kohut P, Leber R, Fuchsbichler S, Schweighofer N, Turnowsky F, et al. Terbinafine resistance in a pleiotropic yeast mutant is caused by a single point mutation in the ERG1 gene. Biochem Biophys Res Comun. 2003;309:666-71. 29. Arévalo MP, Carrillo-Muñoz AJ, Salgado J, Cárdenes D, Brió S, Estivill D, et al. Antifungal activity of the echinocandin Anidulafungin (VER002-6, LY-303366) against yeast pathogens: a comparative study with M27-A microdilution method. J Antimicrob Chemother. 2003;51:163-6. 30. Carrillo-Muñoz AJ, Quindós G, Lopez-Ribot JL. Current developments in antifungal agents. Curr Med Chem-Anti-Infective Agents. 2004;3:297-323. 31. Douglas CM, D’Ippolito JA, Shei GJ, Meinz M, Onishi J, Marrinan JA, et al. Identification of the FKS1 gene of Candida albicans as the essential target of 1,3-beta-D glucan synthase inhibitors. Antimicrob Agents Chemother. 1997;41:2471-9. 32. Odds FC, Brown AJP, Gow NAR. Antifungal agents: mechanisms of action. Trends Microbiol. 2003;11:272-9. 33. Hospenthal DR, Murraya CK, Rinaldi MG. The role of antifungal susceptibility testing in the therapy of candidiasis. Diagn Microbiol Infect Dis. 2004;48:153-60. 34. Kontoyiannis DP, Lewis RE. Antifungal drug resistance of pathogenic fungi. Lancet. 2002;359:1135-44.