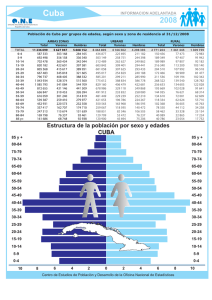
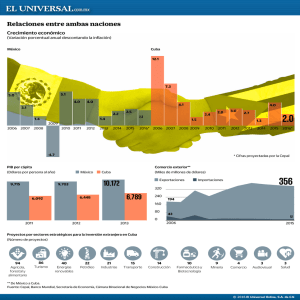
Diversidad de Organismos - Red Cubana de la Ciencia
Anuncio

III Diversidad de organismos Introducción Rodolfo Claro1 La diversidad de especies en los ecosistemas tropicales, y en particular los marinos, ha sido muy poco estudiada. Si bien en estos se concentra más del 80 % de las especies del planeta, el número de científicos en esas regiones no sobrepasa el 6 %, y de ellos, muy pocos están especializados en biosistemática. Además, en estas regiones se concentran precisamente los países más pobres, con menores posibilidades económicas para sufragar las investigaciones que, en el ámbito marino, son particularmente costosas y logísticamente complejas. No obstante, a pesar de las limitaciones existentes en recursos materiales y humanos, la diversidad de especies de la plataforma de Cuba ha sido bastante estudiada, particularmente en los últimos 30 años. A juzgar por la cantidad de especies registradas (publicadas y en archivos), resulta evidente que la plataforma de Cuba posee una riqueza de especies probablemente mayor que las otras islas de Caribe. En ello influye, en primer lugar, el hecho de que Cuba es la mayor de Las Antillas, con una plataforma marina relativamente extensa, comparable con algunas regiones continentales, y con un complejo régimen hidrológico que favorece la conectividad entre sus diferentes sistemas costeros. Ello favorece el autoreclutamiento y contribuye a la biodiversidad regional mediante la exportación a otros paises del área, y también se beneficia con el asentamiento de larvas oceánicas provenientes de regiones alejadas corriente arriba. Por otra parte, posee numerosas bahías, caletas, esteros y otros accidentes costeros, que posibilitan el establecimiento de una gran variedad y amplitud de biotopos marinos tropicales (ver Habitats). Estas características, unido a una envidiable posición geográfica dentro de la provincia Caribeña, con costas en el Mar Caribe occidental, el Golfo de México y el Canal Viejo de las Bahamas, favorecen interrelaciones ecológicas muy diversas que permiten la existencia de una gran diversidad de organismos. Una característica distintiva de los ecosistemas marinos es su pobre endemismo. Existe una notable conectividad y múltiples interrelaciones en el medio acuático y sus especies, por lo que sus provincias biogeográficas son muy poco definidas por su composición de especies únicas. Las especies marinas raramente están confinadas en pequeñas áreas o hábitats limitados, por ello también la extinción de especies es menos probable que en los ecosistemas terrestres (Norse, 1993). Si bien el número de especies marinas conocidas es menor que el de las terrestres, su diversidad táxica (taxones superiores) es mayor que en tierra. Si consideramos las mencionadas relaciones de conexión de la plataforma cubana con otras del Gran Caribe, es de esperar que su fauna y flora sean pobres en especies endémicas. Sin embargo, su riqueza de especies, variedad de hábitats y estado de conservación de los mismos, caracterizan a esta región como una de las de mayor diversidad biológica del hemisferio occidental. Se estima que hay cerca de 230 000 especies marinas conocidas hasta ahora, pero que el número real podría llegar a los dos millones, aunque algunos autores estiman cifras mayores (Hawksworth y Kalin-Arroyo, 1995). Cada año se descubren no menos de 100 nuevas especies marinas. Las zonas profundas, muy poco estudiadas, albergan una gran cantidad de especies aún desconocidas (Hawksworth y Kalin-Arroyo, op.cit.) Hasta la fecha, el número de invertebrados marinos registrados en Cuba sobrepasa la cifra de 5 700 especies y la de cordados más de 1 060 (principalmente peces). Considerando además los microorganismos y la flora marina, se conocen unas 7 300 especies marinas en Cuba (solo los grupos taxonómicos analizados en este trabajo). La Tabla 1 presenta un resumen del número de especies para cada uno de los principales taxones (filo hasta órden en algunos casos). A partir del conocimiento existente sobre la diversidad de especies en el Gran Caribe hemos estimado (con muy variable nivel de apreciación para cada taxón) que el número de especies probables en las aguas marinas de Cuba, pudiera sobrepasar la cifra de 10 500. A partir de esta burda estimación, se infiere que al menos el 30% de las especies de la flora y fauna marina de Cuba aún están por descubrir. Estos porcentajes pueden ser mucho más elevados en relación con los microorganismos y con la fauna de aguas profundas, la cual, debido a su relativa poca accesibilidad, ha sido mucho menos estudiada. De unos 35 filos representados en los ecosistemas marinos de Cuba, solo 14 son objeto de estudios biosistemáticos de forma regular, aunque en estos últimos se encuentran representados los taxones considerados más importantes por su diversidad, abundancia y funciones en el ecosistema marino. No obstante, algunos grupos muy diversos, como los protozoos y los nemátodos, han recibido muy poca atención a pesar de su abundancia y diversidad. Tabla 1. Diversidad de taxones superiores en los ecosistemas marinos, número de especies estimado de especies descritas a nivel global (en todos los ecosistemas, según Rupert y Barnes, 1994; Hawksworth y Kalin-Arroyo, 1995), número estimado de especies marinas y especies registradas en aguas de Cuba. (ND = no hay datos). Nombre común Categoría taxonómica No. de especies Global En Cuba Total Marinos Registradas Viruses 4 000 000 ND ND Bacterias 1 000 000 ND 131 Dominios BACTERIA (o EUBACTERIA) y ARCHAEA Hongos 72 000 500 38 Dominio EUKARYA, Filos ASCOMYCOTA Y DEUTEROMYCOTA Microalgas (algas ND ND 441 Reino VEGETAL + filos CYANOPHYTA unicelulares, cianofíceas, y (dominio BACTERIA) + fitoflagelados) CHROMOPHYTA y CHLOROPHYTA (Reino PROTISTA) Macroalgas y fanerógamas 400 000 7 500 483 Reino VEGETAL Protozoos 200 000 ND Reino PROTISTA <1 000 ND ND 704 Filo Granuloreticulosa, clase Foraminifera Metazoos 1 320 000 ND ND Reino ANIMAL Esponjas Filo Porífera 10 000 6 780 280 Placozoos Filo Placozoa 1 1 0 Celenterados Filo Cnidaria 10 000 . 9 000 310 Ctenóforos Filo Ctenophora 50 50 6 Gusanos planos Filo Platyhelminthes 20 000 4 000 95 Mesozoos Filo Gnathostomulida 80 80 ND Filo Orthonectida y Rhombozoa 50 50 ND Gusanos alargados o Filo Nemertea o Rhynchocoela 900 800? ND aplanados Filo Gastrotricha 430 250? ND Filo Nematoda. 25 000 4 000? ND 61 Moluscos Gusanos, Poliquetos Crustáceos Equinodermos Briozoos Gusanos Gusanos flecha Tunicados Lampreas, peces Reptiles Mamíferos Total Filo Nematomorpha Filo Rotifera Filo Acanthocephala Filo Kinorhyncha (Echinodera) Filo Loricifera Filo Tardigrada Filo Sipunculida Filo Echiura Filo Priapulida Filo Mollusca Filo Annelida, clase Polychaeta Filo Pogonophora Filo Arthropoda (subfilo Crustacea) Crustáceos no decápodos Crustáceos Decápodos Filo Echinodermata Filo Bryozoa Filo Entoprocta Filo Phoronida Filo Brachiopoda Filo Hemichordata Filo Chaetognatha Filo Chordata Subfilo Urochordata, clase Ascideacea Subfilo Vertebrata, clase Gnathostomata Clase Reptilia Clase Mammalia 320 1 500 1 150 150 9 600 320 140 16 70 000 12 000 80 40 000 ND ND 6 000 5 000 150 14 325 ND 70 45 000 2 300 25 000 ≈1 730 000 20? 75? 500? 150 9 pocos 320 140 16 60%? 8 000 80 80%? ND ND 6 000 80%?? 150 14 325 ND 70 ND 2 300 >20 000 7 126 ≈230 000 ND ND 3 ND ND ND 8 ND ND 1 545 391 3 1 348 705 643 387 84 ND ND ND ND 9 ND 62 998 6 22 ≈7 300 El conocimiento de las bacterias y hongos marinos es aún incipiente, considerando la gran diversidad genética y específica de dichos organismos. Las macroalgas y fanerógamas, han sido bastante bien inventariadas no así las microalgas, ya que los estudios realizados han estado dirigidos más bien a evaluar el fitoplancton en su conjunto. Por otra parte, varios taxones han sido bastante bien estudiados, tal es el caso de los moluscos, los crustáceos, las esponjas, los celenterados, los equinodermos y los peces. El nivel de conocimientos acumulado difiere notablemente entre las zonas de la plataforma. Así, por ejemplo, el Golfo de Batabanó y las aguas interiores y exteriores del Archipiélago SabanaCamagüey han recibido atención preferencial, por su accesibilidad e importancia para la pesca y el turismo marítimo. Los Golfos de Ana María y Guacanayabo, así como la zona noroccidental de la isla y la estrecha faja de plataforma que bordea las provincias orientales, han sido pobremente estudiadas, aunque en todas ellas se han realizado investigaciones de diversa índole que han aportado información importante sobre su diversidad de organismos. En este capítulo se presentan, de forma resumida, los conocimientos acumulados sobre los principales grupos taxonómicos, y de cada uno de ellos, las especies destacadas por su importancia económica y su papel en el ecosistema marino de la plataforma cubana y aguas adyacentes. No se pretende un análisis detallado de todos los grupos, sino solo resumir el conocimiento sobre la biodiversidad de aquellos taxones de los cuales se ha logrado integrar la información existente para Cuba, tratando de identificar su diversidad relativa, su estado de conservación y utilidad, las amenazas a que están sometidos, así como los vacíos en el conocimiento. Los mencionados resúmenes han sido confeccionados por los especialistas más destacados en el País, en cada uno de 62 los taxones. Para muchos de los filos que tienen representantes en el medio marino, el nivel de conocimientos es muy pobre, y a falta de especialistas en los mismos, el editor de esta obra presenta una breve síntesis tomada de la literatura, con el objeto de identificar los taxones poco conocidos, presentes o probables en aguas cubanas, y promover el estudio de los mismos (indicados con un *). Considerando que no existía hasta la fecha un estudio integral de la diversidad de organismos marinos de Cuba y la necesidad de hacer un balance del conocimiento existente, en esta obra se presentan las listas de especies de los principales grupos taxonómicos reportadas hasta el momento de edición de esta obra, lo cual puede constituir un punto de partida para la revisión y proyección del inventario exhaustivo de la diversidad de especies marinas de Cuba. A partir de la utilización del código genético como elemento básico para el estudio de la evolución y diferenciación de las células y organismos, la taxonomía ha sufrido radicales cambios en sus conceptos y aplicaciones. Ello ha implicado frecuentes modificaciones y criterios en la nomenclatura y ordenación filogenética, en base a diferentes criterios, sobre los cuales aún no se ha definido uno universal. Por tanto, no se sigue un riguroso criterio en la ordenación de los taxones superiores, aunque para los microorganismos se utiliza la nomenclatura dada por Madigan et al. (1999), y para los invertebrados la brindada por Rupper y Barnes (1994) y en los casos en que se han hecho revisiones más recientes, se adopta la más aceptable a criterio del autor. Bacterias - Dominios BACTERIA Y ARCHAEA María Elena Miravet Regalado y Gladys M. Lugioyo Gallardo 4 Las bacterias son microorganismos procariontes no visibles a simple vista, que presentan una amplia variedad de características morfológicas, fisiológicas y genéticas lo cual les permite vivir en cualquier tipo de hábitat, incluso en aquellos que presentan condiciones extremas de temperatura, salinidad o pH. Las pertenecientes al dominio Bacteria se encuentran normalmente en las aguas, el suelo, el tracto digestivo de los animales y en muchos otros hábitats, mientras que las bacterias del dominio Archaea en su mayoría son anaerobias, se desarrollan en ambientes inusuales o extremos como: fuentes termales, aguas hipersalinas, suelos y aguas altamente ácidas o alcalinas. Algunas arquea-bacterias muestran propiedades bioquímicas poco comunes como las metanogénicas, las cuales producen metano como parte esencial de su metabolismo energético (Madigan et al. 1999). La diversidad microbiana es indispensable para el sostenimiento de la biosfera, no sólo por el importante papel que juegan los microorganismos como descomponedores de contaminantes y restos orgánicos, sino también como productores y consumidores de gases relacionados con el clima del planeta. Las bacterias pueden utilizar fuentes alternativas de energía, sobrevivir sin oxígeno e incluso, usar diferentes fuentes de carbono orgánico e inorgánico, por lo que son extremadamente eficientes en la absorción y el reciclaje de carbono en el océano. Así, la biomasa bacteriana que se produce es consumida por diferentes organismos de niveles tróficos superiores, lo que garantiza el 4 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente Ave.1ra, No.18406 Rpto. Flores. Playa. La Habana, Cuba. C.P. 12100, Cuba. memiravet@homail.com y calvarez@infomed.sld.cu 63 funcionamiento del flujo de carbono y energía a través de la trama alimentaria, aún en condiciones de oligotrofía (Karl, 2002). Algunas bacterias marinas intervienen en la formación de nódulos de manganeso, otras contribuyen a la precipitación de carbonato de calcio y muchas viven en simbiosis con peces u otros organismos, estableciendo relaciones mutuamente ventajosas como las que existen entre las bacterias fijadoras de nitrógeno, epífitas de las microalgas (Pérez-Nieto, 2001). Debido a su amplia diversidad metabólica y alto poder catalítico, muchas bacterias son capaces de descomponer petróleo, otras reducen su viscosidad y algunas hasta degradan plásticos, lo cual tiene importantes implicaciones económicas y ambientales. Desde el punto de vista biotecnológico, las bacterias marinas constituyen fuentes potenciales de producción de sustancias biológicamente activas como antibióticos, inmuno-estimulantes, enzimas, etc. El estudio de la diversidad de los procariontes ha estado muy limitado por muchos años debido a las dificultades para caracterizar los microorganismos después de su aislamiento en cultivos puros y a la inhabilidad de aislar aquellos no cultivables. Se reconoce que solamente 5 000 especies de bacterias han sido descritas mediante de cultivos puros. A partir de la década de los ochentas, el empleo de las nuevas técnicas moleculares de amplificación y secuenciación del gen ARNr 16 S, han permitido describir nuevas especies de bacterias que no habían sido aisladas antes en cultivos puros (Botella-Grau, 2000). En la actualidad, se dispone aproximadamente de unas 22 000 secuencias completas del gen ARNr 16S procedentes de microorganismos cultivados y no cultivados, lo que ha puesto en evidencia la existencia de nuevas especies y la reubicación de otras aparentemente similares (Sherr y Sherr, 2000). Dentro del dominio Bacteria se han descrito 12 grupos de los cuales, las bacterias Gram positivas (Verrucomicrobiales) y las subdivisiones alfa y gamma del grupo Proteobacteria se encuentran distribuidas en una amplia variedad de hábitats acuáticos. Otros grupos filogenéticos, como las bacterias de la subdivisión delta-Proteobacteria, aparecen mejor adaptadas a micronichos anóxicos y las bacterias del filo Cytophaga-Flexibacter-Bacteroides, en agregados que flotan en las aguas. Por otra parte, las bacterias del grupo beta-Proteobacteria han sido detectadas en aguas dulces y se encuentran ausentes en ambientes marinos. No obstante, el análisis de las secuencias de la subunidad 8S del ARN en bacterias aisladas de diferentes ambientes sugiere que algunas especies microbianas marinas se encuentran distribuidas globalmente (Kirchman et al. 2001). En Cuba, los estudios sobre diversidad de bacterias han estado dirigidos en su gran mayoría, a la identificación de bacterias aerobias o anaerobias facultativas, heterótrofas y mesófilas pertenecientes al dominio Bacteria y en menor proporción, al aislamiento y recuento de bacterias que pertenecen al dominio Archea. Dentro del dominio Bacteria también se ha trabajado en un grupo grande y heterogéneo de fototrofos oxigénicos que poseen pigmentos y realizan fotosíntesis: las cianobacterias. Este grupo de organismos se trata en la sección de microalgas. Las bacterias aisladas proceden de aguas marinas o interiores, de sedimentos marinos, de fangos salinos sulfurosos y de diferentes organismos como: corales, esponjas, algas, moluscos y peces. Los aislados de aguas y sedimentos marinos provienen tanto de la plataforma (manglares, arrecifes coralinos, fondos fangosos, fango-arenosos y arenosos), como de las aguas oceánicas hasta los 200 m de profundidad. Hasta el momento en Cuba se han registrado 131 especies y 47 géneros. Muchos aislados no han podido ser identificados hasta el nivel de especie. Entre las bacterias identificadas se encuentran 64 representados miembros de 12 familias los cuales han sido descritos en otras regiones del océano mundial. En la plataforma norte occidental, se ha encontrado un mayor número de especies que en la suroccidental, quizás debido al mayor número de trabajos realizados en la primera región. En las aguas oceánicas adyacentes, el número de especies registradas es similar en el norte y el sur, aunque en esta última región se aislaron cepas que pertenecen a Arthrobacter, Halobacterium (actualmente Halorubrum), Lactobacillus y Photobacterium que no aparecieron en el norte, donde a su vez se encontraron bacterias de los géneros Corynebacterium, Neisseria, Sarcina y Staphylococcus que no fueron aislados en el sur (Lugioyo, 2003). En las aguas neríticas de la plataforma se han identificado especies cosmopolitas pertenecientes a los géneros Bacillus, Flavobacterium, Micrococcus, Pseudomonas y Vibrio, independientemente del tipo de biotopo, mientras que las especies de la familia Enterobacteriaceae predominan en las zonas costeras impactadas por residuales albañales (Miravet, 2003). Formas más frecuentes de bacterias marinas (a - cocos, b - bacilos, c - espirilos, d: diferentes tipos de colonias de bacterias). A partir de la morfología, la coloración a la tinción Gram y la respuesta a los ensayos bioquímicos es posible la identificación de las bacterias hasta nivel de especie. En el caso particular de las cepas aisladas de la zona suroccidental, se encontró una mayor heterogeneidad fenotípica entre los aislados de los fondos blandos que entre aquellos procedentes de los arrecifes. Ello parecer ser consecuencia de una mayor diversidad de fuentes de materia orgánica disponibles en la macrolaguna que en los arrecifes, los cuales, generalmente se encuentran en aguas oligotróficas. Por otra parte, las bacterias aisladas de los sedimentos de la plataforma presentan mayores potencialidades para descomponer compuestos orgánicos in vitro que aquellas aisladas de las aguas, 65 quizás debido a que en los sedimentos disponen de una mayor variedad de compuestos orgánicos, lo que favorece el desarrollo de una amplia actividad metabólica. Esta capacidad catalítica garantiza la descomposición de compuestos orgánicos complejos que precipitan sin haberse degradado totalmente en la columna de agua, contribuyendo así a la autodepuración del ecosistema marino (Miravet, 2003). En Cuba la mayoría de los aislados procedentes de las aguas y sedimentos marinos se encuentran depositados en la Colección de Bacterias Marinas realizada por el Instituto de Oceanología (depositada actualmente en el Centro de Bioactivos Marinos) la cual cuenta en total con 400 cepas de bacterias, de las cuales, el 70% se encuentra identificado. Del total de aislados, el 28,2 % degrada petróleo, el 26,9 % produce tensioactivos, el 45 % presenta actividad beta-hemolítica y el 37 % produce compuestos antimicrobianos. De estos últimos, el 17 % presenta actividad frente a Escherichia coli y Bacillus subtilis, el 7 % tiene actividad antifúngica frente a Candida albicans y Aspergillus niger y el 13 % de los aislados presenta ambas actividades. También, del total de aislados, el 26% es capaz de producir compuestos de bajo peso molecular intercalantes del ADN, característica conocida de muchos compuestos antitumorales. Dentro de las cepas productoras de antibióticos aisladas de aguas cubanas se encuentran las especies Bacillus brevis, B. cereus, B. licheniformis, B. mycoides, B. pumilus, B. subtilis, Halobacterium sacharovorus, Planococcus halophilus y Pseudomonas stutzeri. También, se cuenta con un aislado de Micrococcus varians que es productor de un compuesto glicoproteico con actividad inmunoestimulante y antitumoral en ensayos con animales de experimentación. Entre de las bacterias degradadoras de hidrocarburos se encuentran Acinetobacter, Arthrobacter, Bacillus cereus, Corynebacterium, Flavobacterium, Klebsiella, Micrococcus, Pseudomonas y Vibrio y entre las especies productoras de tensioactivos Bacillus cereus, B. circulans, B. firmus, B. licheniformis, B. macerans, B. mycoides y B. pumilus, entre otras (Morales et al. 2003). La combinación de algunas cepas degradadoras de hidrocarburos y productoras de tensioactivos se ha empleado en la formulación de un bioproducto, el cual se ha utilizado con gran efectividad en derrames de hidrocarburos que han afectado las costas cubanas. Esta bioremediación ha permitido minimizar los daños ambientales y acelerar la recuperación del ecosistema, por lo que se trabaja en el desarrollo de este bioproducto para su producción a mayor escala. De igual manera, la producción de tensioactivos por bacterias marinas ofrece amplias perspectivas de desarrollo, no sólo por su posible empleo como aditivo en cosméticos y alimentos, sino también, por su aplicación en la industria petrolera. Tal es el caso de un compuesto tensioactivo que se obtuvo por vía fermentativa a partir de Bacillus cereus y se aplicó en 19 pozos de petróleo de un polígono experimental lográndose un notable incremento en la productividad de estos (ver sección Productos y Servicios de la diversidad biológica). Algunas especies tienen notable importancia ecológica por su participación en el ciclo del azufre, como las bacterias sulfatoreductoras y oxidadoras del sulfhídrico: Desulfovibrio sp. y Thibacillus thiooxidans respectivamente, las cuales se han aislado de fangos salinos sulfurosos con propiedades medicinales, y de aguas y sedimentos fangosos en la zona costera al sur de la Provincia Habana. También se han identificado bacterias luminiscentes de diferentes fuentes: la especie Vibrio harveyi se ha aislado de organismos marinos y aguas oceánicas y las especies Photobacterium phosporeum y Vibrio splendidus Tipo I, procedentes de las aguas oceánicas adyacentes. La especie Photobacterium leiognathi se aisló sólo de las aguas de la plataforma, debido a los requerimientos 66 ambientales de esta especie, la cual necesita para su desarrollo altas concentraciones de nutrientes y elevadas temperaturas. La bioluminiscencia de estas bacterias se debe a la presencia de la enzima luciferasa, la cual es de utilidad en la industria biomédica para el marcaje de anticuerpos, así como en la evaluación de residuales industriales mediante su empleo en ensayos de toxicidad (Stuart et al. 2001). En la desembocadura de algunos ríos de la provincia Ciudad de La Habana se aislaron e identificaron bacterias parásitas pertenecientes al género Bdellovibrio spp., las cuales pueden contribuir a la eliminación de bacterias coliformes en el medio marino y también pudieran aplicarse en el control de enfermedades bacterianas en cultivos de algunos vegetales (Z. Romay 2004, com. pers.) Entre las bacterias nocivas a los peces e invertebrados marinos, en Cuba se han reportado Aeromonas hydrophila (en tilapia), A. salmonicida (en camarón) conocida causante de furunculosis en peces, Staphylococcus sp. y Vibrio alginolyticus (en langosta, camarón y ostión), V. anguillarum (causante de las vibriosis en peces óseos) y V. vulnificus (en langosta y ostión), Flavobacterium sp. y Pseudomonas sp. (en bonito, carpa, tilapia y camarón de cultivo), Plesiomonas sp. (en camarón) y Cytophaga (en bonito) (Miravet, 1998). También se han identificado miembros de otros géneros y especies como Aerococcus viridans, Bacillus coagulans, Vibrio nereis, V. harveyi, V. parahaemolyticus, Chromatium violaceum (Miravet, 1998), que si bien no todos manifiestan patogenecidad en los organismos marinos, pueden transmitirse al hombre a través de la trama alimentaria pudiendo ocasionar daños a la salud. Otras especies de bacterias reportadas son aquellas indicadoras de contaminación albañal, las cuales han recibido especial atención por los daños que ocasionan a la salud humana, ya que son causantes de diversas enfermedades gastrointestinales agudas y respiratorias. Estas bacterias en su mayoría pertenecen a la familia Enterobacteriaceae, destacándose entre ellas Escherichia coli, Enterobacter cloacae, E. aerogenes, etc., y otras a la familia Vibrionaceae como Aeromonas hydrophila, Vibrio cholerae no O1 y V. cholerae no O1 grupo II de Heiberg que se han aislado e identificado de aguas costeras, sedimentos arenosos, fangos salinos y de organismos marinos como ostiones, camarones, langostas, almejas, mejillones y algunos peces de interés comercial (González, 1997; 2001). La abundancia de bacterias nocivas para la salud humana presentes en zonas marino-costeras de interés recreativo es evaluada regularmente por las autoridades del Ministerio de Salud Pública encargadas de este control. De igual forma, las autoridades de Control de Calidad del Ministerio de la Industria Pesquera chequean sistemáticamente la presencia de bacterias nocivas en los organismos marinos que se usan como alimentos. Las investigaciones sobre la diversidad de microorganismos, han tomado gran auge a partir de la introducción de las técnicas moleculares (Sherr y Sherr, 2000), las cuales facilitaron el descubrimiento de nuevas especies. En Cuba el nivel de conocimientos sobre las bacterias marinas aún es pobre. Los estudios han estado dirigidos fundamentalmente a la identificación de bacterias aerobias y anaerobias facultativas, mesófilas y quicio-organotrofas, su variación espacio-temporal y su relación con algunos parámetros físico-químicos y meteorológicos con el fin de encontrar especies y/o grupos indicadores de calidad ambiental. Aunque no se ha estudiado la ecología y funciones de las bacterias quicio-litotrofas, las especies Desulfovibrio desulfuricans, Thiobacillus thiooxidans y Beggiatoa sp. se han aislado de los fangos sulfurosos de algunas salinas de Cuba. Estas bacterias participan en la formación de compuestos bioactivos del azufre por lo que su presencia y concentración en estos fangos se han 67 usado como criterios para evaluar el grado de deterioro de dichos peloides en condiciones de almacenamiento. En cuanto a la diversidad y abundancia de bacterias anaerobias como las metanogénicas y fototrofas, se desconoce totalmente, debido a dificultades inherentes al cultivo de dichos microorganismos. Desde el punto de vista geográfico, las investigaciones sobre diversidad de bacterias marinas en la plataforma cubana se han limitado a las zonas norte y sur-occidental. De la región central y nororiental, sólo existe información sobre la distribución cuantitativa de bacterias heterótrofas aerobias mesófilas y la intensidad con que descomponen la materia orgánica. De los Golfos de Ana María y Guacanayabo sólo existe información cuantitativa del número total de microorganismos y la biomasa bacteriana. En las aguas oceánicas adyacentes al Archipiélago Cubano, los estudios se han realizado en la capa fótica, hasta 200 m de profundidad, por su importancia para los organismos fotosintetizadores, primeros eslabones de la trama alimentaria. En esas aguas la concentración de microorganismos fue mayor en el norte que en el sur. En ambas regiones las mayores concentraciones de bacterias heterótrofas mesófilas se encontraron en el nivel superficial y en la capa termoclina, observándose una disminución hacia el final de la capa fótica. Esta distribución esta directamente relacionada con la concentración de materia orgánica que utilizan estos microorganismos como fuente de carbono y energía. Los factores que constituyen amenazas específicas para el mantenimiento de la diversidad microbiana en el ecosistema marino son los mismos que atentan contra el sostenimiento de la vida en el planeta (contaminación, cambios climáticos). Sin embargo, los microorganismos tienen una reconocida capacidad de adaptación ante condiciones ambientales adversas, formando estructuras resistentes (esporas) o logrando reducir al mínimo su actividad metabólica, lo que les permite mantenerse en un estado “latente” (“dormant state”), hasta que se recuperan las condiciones ambientales favorables. Esta capacidad de adaptación de los microorganismos constituye una estrategia para la sobrevivencia. Una importante amenaza para la diversidad bacteriana lo constituyen los factores que atentan contra la conservación “ex situ”. Los aislados que se conservan en colecciones (muchos de los cuales no han sido aún estudiados) corren el riesgo de perder potencialidades fisiológicas y bioquímicas, a veces debido a la presencia de plásmidos en el interior de las células y otras por falta de las condiciones óptimas de mantenimiento. El conocimiento y uso de los microorganismos marinos es aún es incipiente, teniendo en cuenta la gran diversidad de especies que se asume que existen en el ecosistema marino. Aunque son relativamente pocas las especies que se encuentran en explotación desde el punto de vista biotecnológico (la mayoría son cepas productoras de antibióticos, enzimas e inmunoestimulantes), este campo de investigación debe ser priorizado por las amplias posibilidades de obtener nuevas moléculas bioactivas y las ventajas económicas que presenta la producción de metabolitos por vías fermentativas (Blunt et al. 2003). Hongos – Dominio EUKARYA, Reino FUNGI, Filos ASCOMYCOTA y DEUTEROMYCOTA. 68 Diana Enríquez Lavandera y María Elena Miravet Regalado 5 Los hongos se diferencian fácilmente de los procariotas por poseer células más grandes (10-100μm), núcleo verdadero (con envoltura nuclear), vacuolas y mitocondrias, es decir, una típica célula eucariótica. Presentan nivel de organización unicelular, pluricelular o dimórfico. Contienen paredes celulares rígidas constituidas principalmente por quitina, en combinación con diversos polisacáridos. A diferencia de las células de las algas y otras plantas vasculares, las células de los hongos no poseen cloroplastos y también se diferencian en la constitución química de la pared celular y las sustancias de reserva. Tienen respiración fundamentalmente aeróbica y nutrición heterótrofa. Presentan reproducción asexual y sexual, generalmente con la producción de esporas móviles (Herrera y Ulloa, 1998). El Reino Fungi, está formado por tres filos: Ascomycota, Basidiomycota y Deuteromycota (Hyde y Pointing 2000). La característica esencial del filo Ascomycota, a la cual debe su nombre, es la producción de ascas durante la reproducción sexual, en cuyo interior se generan las esporas denominadas ascosporas. Las ascas se agrupan en cuerpos fructíferos microscópicos y macroscópicos, llamados ascocarpos. Su reproducción puede ser asexual y sexual, constituyen el mayor grupo de hongos y son cosmopolitas. Todos los hongos, incluidos en el filo Basidiomycota, forman esporas durante la reproducción sexual, llamadas basidiosporas sobre células especializadas con el nombre de basidios. Generalmente cada basiodio engendra cuatro basidiosporas en su zona apical. Los basiodios se encuentran generalmente organizados en un himenio que se localiza en un basiodiocarpo. Su reproducción puede ser asexual y sexual. El filo Deuteromycota comprende un gran número de especies con reproducción asexual, por medio de esporas denominadas conidios. Este filo se encuentra en revisión y reorganización porque se considera que se trata de los estados asexuales de ascomicetes, cuyos estados sexuales no han sido encontrados o nunca han existido (Alexopoulos et al., 1996). Solo en un pequeño número de Deuteromycota se ha podido correlacionar el estado asexual con el sexual. La inmensa mayoría de estos hongos son terrestres, aunque existen acuáticos, tanto marinos como dulceacuícolas. La mayoría de los hongos marinos son saprobiontes, es decir viven asociados a la materia orgánica en descomposición, aunque existen algunas especies parásitas de plantas y animales marinos. En las algas se reportan alrededor de 31 especies de ascomicetes marinos parásitos, en las cuales se pueden observar decoloraciones o la formación de estructuras de fijación. Las especies Lindra thalassiae, Lindra maritima y Lulworthia sp. muy comunes en nuestras costas, parasitan a Sargassum sp. El hongo Haloguignardia irritans parasita a Cystoseira sp. y Halidrys sp. En algunas algas rojas se observan decoloraciones, como la provocada por Chadefaudia marina en Rhodymenia palmata (Kohlmeyer y Kohlmeyer, 1979). El hongo Cytospota rhizophoreae ocasiona la muerte de semillas, retoños y la destrucción de las raíces aéreas del mangle rojo, Rhizophora mangle (Enríquez, 2004). Los hongos juegan un papel primordial como descomponedores primarios de sustratos orgánicos entre los que se encuentran los compuestos lignocelulósicos, los cuales, no pueden ser utilizados por otros organismos y cuya acumulación en el ecosistema terrestre o acuático pudiera convertirse en una causa frecuente de contaminación. Por tanto, los hongos contribuyen a la 5 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente Ave.1ra, No.18406 Rpto. Flores. Playa. La Habana, Cuba. C.P. 12100, Cuba. diana@oceano.inf.cu; 69 mineralización de las fuentes de carbono absorbidas de sus alrededores, al reciclaje de nutrientes y al movimiento de materia y energía en su medio ambiente (Liberra y Lindeguist, 1995). Otra actividad importante de los hongos es su contribución a la formación de partículas de arena a partir de la fragmentación de las conchas y los esqueletos calcáreos de moluscos y foraminíferos. También se ha demostrado que los hongos marinos pueden degradar algunos compuestos del petróleo como el n-hexadecano, 1-hexadeceno, pristano y en menor grado, n-tetradecano, lo que puede ser utilizado en la bioremediación de ecosistemas marinos dañados con estos contaminantes (González et al., 2000). Los hongos constituyen una fuente importante de productos biológicamente activos, incluyendo compuestos de interés farmacológico como los esteroides, alcaloides, antibióticos y antitumorales. Algunos hongos producen productos químicos como el etanol, y enzimas que se emplean como aditivos alimentarios. De algunos hongos marinos se han obtenido ácidos grasos como el oleico, el palmítico y el linoleico, así como muchos aminoácidos (Miller, 2000). Los datos generados al valorar la diversidad de los hongos microscópicos en un lugar pueden ser utilizados como indicadores del nivel de perturbación de ese ambiente, y específicamente indican el primer nivel de respuesta a la destrucción sistémica del ecosistema (González et al. 2000). Los hongos se encuentran ampliamente distribuidos y viven en cualquier sitio que presente material orgánico. Se encuentran en temperaturas de 4 a 60 °C, no obstante, el rango de temperaturas óptimas para el desarrollo de las especies tropicales fluctúa entre 25 y 28 °C e incluso hasta 35 °C. Sin embargo, las especies cosmopolitas son más tolerantes a las variaciones de temperatura, un ejemplo típico es Corollospora maritima, una de las especies frecuentes no solo en el Caribe, sino también en todo el mundo (Enríquez, 2004). El cosmopolitismo de los hongos se debe fundamentalmente a su distribución por pequeños fragmentos de sus micelios y sobre todo, por la enorme cantidad de esporas microscópicas que son transportadas fácilmente por las corrientes de aire y agua a lugares lejanos y diversos (Herrera y Ulloa, 1998). Los principales factores que controlan la distribución de los hongos marinos son: temperatura, salinidad, existencia de hospederos y sustratos disponibles, presión hidrostática, iluminación, contaminación, oleaje y oxigeno disuelto (Kohlmeyer, 1983; Jones, 2000). Estudios recientes han demostrado que la existencia de sustratos y hospederos adecuados es el principal factor para el desarrollo de dichos organismos (González et al. 1998). Los hongos se encuentran en todos los biotopos que forman el ecosistema marino: desde las zonas costeras hasta las profundidades oceánicas. Se conocen como “hongos marinos estrictos” cuando se desarrollan y esporulan sólo en ambientes marinos y estuarinos, y “hongos marinos facultativos” cuando provienen del hábitat terrestre o de aguas dulces pero que son capaces de crecer y en ocasiones esporulan en condiciones marinas (Kohlmeyer y Kohlmeyer, 1979 y Hyde et al., 2000). Se han descrito alrededor de 80 060 especies de hongos. De éstas aproximadamente 78 660 son terrestres, 1 000 son dulceacuícolas y solo 444 son marinas (Hyde y Pointing, 2000). Para la región del Caribe, se han registrado 11 250 especies de hongos pertenecientes a 2 643 géneros y 386 familias, la mayoría de ellos terrestres (Minter et al., 2001). En Cuba se han registrado 3 870 especies de hongos (Minter et al., 2001), de las cuales solo 38 especies son marinos. De ellos 29 corresponden al filo Ascomycota y nueve al grupo de los hongos mitospóricos del filo Deutoromycota (actualmente en revisión para su reubicación taxonómica). Hasta el momento, no se han encontrado representantes del filo Basidiomycota en aguas cubanas (González et al., 2003). 70 Son pocos los hongos que dependen de un hospedero especifico, entre ellos podemos citar Didymosphaeria rhizophorae, Keissleriella blepharospora y Robillarda rhizophorae. Estas especies se encuentran restringidas a las raíces y hojas del mangle rojo, Rhizophora mangle. Por el contrario, especies como Corollospora gracilis, Lindra marinera y Arenariomyces parvulus se han encontrado colonizando varios tipos de sustratos, siendo muy frecuentes y con un amplio rango de distribución geográfica (Enríquez et al., 2001). Las especies Corollospora marítima, Arenariomyces parvulus y A. triseptatus se han aislado tanto del interior como de la superficie de los foraminíferos que se encuentran comúnmente en las playas de Cuba (Enríquez et al., 2001). Entre las especies más abundantes están Lindra marinera, Corollospora maritima y Arenariomyces parvulus, las cuales representan más del 60% del total de los aislamientos realizados en la zona costera. Los hongos de los géneros Corollospora, Varicosporina y Arenariomyces aislados frecuentemente en la zona litoral de Cuba, utilizan como fuente de carbono el n-hexadecano, el cual constituye una fracción de los hidrocarburos alifáticos. Esta habilidad es muy frecuente entre las especies de hongos marinos arenícolas lo que los convierte en candidatos potenciales para trabajos de bioremediación (Kirk y Gordon, 1988). La mayoría de las especies identificadas en la plataforma cubana han sido aisladas de la zona litoral a partir de sustratos orgánicos como restos de maderas, cocos, algas, corales, foraminíferos, hojas, semillas y raíces de mangles y en menor proporción, de sedimentos y muestras de agua. También se han aislado de la espuma de mar, la cual acumula entre sus burbujas considerable variedad de esporas. Liberra et al. (1998) obtuvieron el antibiótico Corollosporina a partir de Corollospora marítima, especie muy abundante en Cuba. También de Dendryphiella salina se ha producido Glicerol dendryphiellate A y Dendryphiellins A1, E1y E2 (Guerrero et al., 1990). Los hongos marinos arenícolas por lo común son saprobios e inócuos para la salud, pero existen también en la arena de las playas especies patógenas al hombre que ocasionan diversos tipos 71 de micosis. En las playas cubanas, este tipo de estudio será acometido en un futuro inmediato. Es necesario evaluar la prersencia de dichos hongos para su control y prevenir la infección de las personas que se exponen a la arena de las playas con fines recreativos o de trabajo (Gonzalez et al., 2000). Hasta la fecha las investigaciones sobre los hongos marinos en Cuba se limitan a algunas áreas muy pequeñas, como el litoral de la zona noroccidental, que es la mejor estudiada (Capó de Paz, l986 y Enríquez, 2004), la zona norte oriental y la Ciénaga de Zapata (Villamigos, 2004). De las especies registradas, 25 han sido encontradas en la región noroccidental y 13 provienen de las otras zonas. Es evidente la necesidad de extender el estudio de la diversidad de hongos marinos al resto de las regiones de la plataforma cubana. LOS VEGETALES MARINOS* Los vegetales marinos incluyen una gran diversidad de organismos (unicelulares o pluricelulares) del Reino Vegetal, todos ellos caracterizados por la presencia de diversos pigmentos asimiladores y que producen sustancias orgánicas que son sintetizadas directamente a partir de sustancias inorgánicas (CO2, agua y sales nutrientes) con la ayuda de la luz como fuente de energía (fotosíntesis). Algunos protozoos (Protista) y bacterias (Cianobacteria) también tienen esa característica. En esta obra los separamos arbitrariamente en dos categorías, tomando en cuenta sus funciones y zonación en el medio marino: las microalgas (generalmente unicelulares), y las macroalgas y fanerógamas que componen el macrofitobentos. Las microalgas, Reinos MONERA, PROTISTA y VEGETAL Sandra Loza Álvarez 6 La mayoría de las microalgas son unicelulares, de vida planctónica, es decir, son pelágicos y conforman el llamado fitoplancton, pero otras viven asociadas al sustrato (bénticas) o a otros organismos que habitan en este (epibiontes). Las llamadas ticopláncticas se pueden encontrar comúnmente en el plancton costero pero pasan la mayor parte de su vida en el suelo marino (Guillard y Kilham 1977; Barron, 1985). Mediante la fotosíntesis, las microalgas producen aproximadamente el 90% de la producción primaria del océano abierto y de algunas zonas costeras, lo que constituye la base de la trama alimentaria en esos ecosistemas y sirven de alimento a muchas larvas de peces, moluscos, crustáceos y otros organismos durante las primeras etapas de su vida. Por otra parte, el oxígeno que genera la fotosíntesis representa una parte sustancial del que utilizan los organismos acuáticos para su respiración. En ese proceso las microalgas utilizan una parte importante del carbono contenido en el anhídrido carbónico absorbido por el agua de mar, por lo que ejercen una importante función depuradora de la atmósfera. Muchas de las zonas de mayor riqueza pesquera en el mundo se caracterizan por la abundancia de estos organismos, los cuales también pueden tener un uso directo mediante cultivos a gran escala para la alimentación animal y con fines farmacológicos. 6 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente Ave.1ra, No.18406 Rpto. Flores. Playa. La Habana, Cuba. C.P. 12100, Cuba. sandra@oceano.inf.cu 72 Algunas especies de microalgas pueden provocar las llamadas mareas rojas o florecimientos algales, por una excesiva multiplicación celular que se manifiesta en un cambio de coloración del agua en forma de bandas, manchas o estrías cuyo color varía en dependencia de la pigmentación de la especie que la produce (ECOHAB, 1995). Estos eventos ocurren principalmente en el período primavera-verano, relacionados con el aumento de la temperatura del agua y la disponibilidad de nutrientes, o con cambios ambientales locales o globales, como el enriquecimiento del agua (eutrofización). Las floraciones algales, producidas por especies inócuas causan la muerte masiva de peces por daños en las branquias. Otros organismos acuáticos pueden ser afectados por la reducción del oxígeno disponible como resultado de la descomposición de la materia orgánica. También afectan a los bañistas, la salud pública y producen impactos en el medio ambiente. Las producidas por especies tóxicas provocan intoxicaciones alimentarias como la “ciguatera”, afecciones neurológicas, diarreicas, paralíticas, etc. Las especies que comúnmente causan estos eventos pertenecen con mayor frecuencia al grupo de las dinoflageladas, aunque también se presentan algunas especies de diatomeas y cianobacterias (Florida Department of Environmental Protection, 1998). Hasta la fecha han sido registradas en Cuba 441 especies de microalgas (López-Baluja et al., 1992) siendo las diatomeas, los dinoflagelados y las cianobacterias los grupos que aportan el mayor número de especies en las aguas de plataforma. Las ecoregiones orientales son más ricas en términos de abundancia y biomasa de microalgas que las occidentales y como es característico de las regiones tropicales, resulta mayor el número de especies que aparecen con baja frecuencia (especies raras), mientras que las especies de amplia distribución no son abundantes (López-Baluja et al., 1992). Las aguas oceánicas, por su parte, se caracterizan por una mayor riqueza de especies en invierno que en verano (Gil et al., 1990). Las microalgas se caracterizan por su gran diversidad de formas y estructuras. Esta figura muestra algunas especies comunes en la plataforma cubana. A continuación se resume la información existente sobre cada uno de los principales filos de microalgas presentes en la platafoma de Cuba y en aguas oceánicas adjacentes. 73 Algas procariotas – Reino MONERA, Filo CYANOPHYTA Cianofíceas - Clase CYANOPHYCEAE Las cianofíceas o cianobacterias incluyen un gran número de algas unicelulares y pluricelulares que se distinguen generalmente por una coloración verde-azul. Se caracterizan por su bajo nivel de organización celular, carencia de un núcleo bien definido, ausencia de reproducción sexual y estados flagelados móviles. La reproducción celular se produce por división del protoplasma o a través de endosporas, exosporas, hormogonios y heteroquistes. Presentan dos categorías morfológicas de organización: formas filamentosas (pluricelulares) y formas no filamentosas. Las últimas son principalmente formas coccoides de células simples (unicelulares) o agrupadas en colonias palmeloides, cuyos contornos pueden ser esféricos, cilíndricos, fusiformes, etc. Poseen una flexibilidad fisiológica favorable para resistir condiciones extremas de salinidad, temperatura y pH y son capaces de producir envolturas mucilaginosas que las aislan del medio externo cuando ocurren cambios bruscos de salinidad (Brock, 1976; Golubic, 1980). Este grupo ha sido ampliamente utilizado para la producción de fármacos y cosméticos. Sus pigmentos fotosintéticos le confieren propiedades que estimulan el sistema inmunológico proporcionando protección sobre varios tipos de enfermedades, presentan actividad antitumoral y en el tratamiento de úlceras y hemorroides sangrantes. Sus compuestos nitrogenados son importantes, además, como agentes queladores (Stewart y Pugh, 1963). Por otra parte, el desarrollo masivo de formas filamentosas de cianobacterias sobre la superficie de los corales por efecto de la eutrofización provoca la muerte de estos organismos, causando severos daños a los arrecifes coralinos. En los ecosistemas hipersalinos este grupo es responsable de la viscosidad de las salmueras que afecta la producción de sal (Sorgeloos et al., 1986). En aguas de la plataforma de Cuba se han registrado 37 especies de cianobacterias (Loza et al., 2003), de las cuales solo ocho habían sido reportadas con anterioridad (López-Baluja y Borrero, 1977; López-Baluja et al., 1980; Loza et al., 1994). En aguas oceánicas solo ha sido registrada la especie Oscillatoria thiebautii. Este incremento en el número de especies de cianobacterias ocurrido en los últimos años en algunas localidades, pudiera estar relacionado con los elevados niveles de fósforo y amonio observados en el medio marino costero (Loza et al., 2003). Entre las especies de cianobacterias más abundantes en la plataforma cubana están Oscillatoria thiebautii, Johamnesbaptistia pellusida, Phormidium muscicola, Chroococcus sp, Anacystis montana, Spirulina subsalsa, S. margaritae, S. nodosa, Microcystis aeruginosa, Gleocapsa turgida y Aphanothece elabens. En Cuba se ha explotado con éxito el género Spirulina (dulceacuícola) para la fabricación de cápsulas y cremas por su elevado contenido energético y propiedades dermatológicas. Los fangos procedentes de ambientes hipersalinos ricos en cianobacterias son utilizados en muchos centros asistenciales y clínicas fisio-terapéuticas con fines medicinales en tratamientos de diversas afecciones (óseas, artríticas, quemaduras, etc). Protozoos - Reino PROTISTA, Fito-flagelados - Filos CHROMOPHYTA Y CHLOROPHYTA Los fitoflagelados conforman un grupo muy diverso formado por las clases Cryptophyceae, Raphidophyceae, Chrysophyceae, Dyctyochophyceae o Silicoflagelados, Prymnesiophyceae o Haptophyceae (Coccolitoforidos), Euglenophyceae, Prasinophyceae y Chlorophyceae. La mayoría de 74 las células flageladas pertenecientes a estas clases presentan tallas menores de 5 µm (Tomas, 1993) por lo que resulta engorroso el estudio de su taxonomía y características tróficas y frecuentemente son agrupados en una clasificación más amplia como “microflagelados” (Davis y Sieburth, 1984). Se caracterizan por presentar una superficie cubierta con estructuras escamosas compuestas de material orgánico, calcificada o silicificada. Los esqueletos de sílice se encuentran interna o externamente y presentan un organelo filiforme (haptonema), el cual puede ser largo y espiralado o corto y no espiralado, el cual sirve de anclaje y para capturar el alimento. Se encuentran en todos los biotopos marinos y presentan los tres tipos tróficos (autotrófico, heterotrófico y mixotrófico; Tomas, 1993). La presencia o ausencia de cloroplastos resulta el criterio más obvio para distinguir entre flagelados autotróficos (fitoplancton) y heterotróficos (protozooplancton, según Sieburth et al., 1978) y estos últimos constituyen los consumidores por excelencia de las poblaciones de bacterias, controlando su crecimiento en el medio natural. Además, los flagelados, en general, sirven de alimento a los ciliados y a las larvas del mesozooplancton (Tomas, 1993). En aguas cubanas los fitoflagelados están representados por pocas especies que se caracterizan por una baja frecuencia de aparición. En la plataforma, las clases Chlorophyceae y Dyctyochophyceae se encuentran más frecuentemente representadas por las especies Poropila dubia y Dictioca fibula, respectivamente, y Euglenoficeae por los géneros Euglena sp y Eutreptia sp. Las pequeñas células flageladas pertenecientes a las restantes clases (Cryptophyceae, Crysophyceae, Prasinophyceae, Raphidophyceae) son agrupadas como microflagelados y presentan una gran abundancia y frecuencia de aparición. En aguas oceánicas se han registrado unas 20 especies de Coccolitoforidos (Haptoficeas) (Gil et al., 1990). Algas eucariotas - Reino VEGETAL, Filo BACILLARIOPHYTA Diatomeas - Clase BACILLIOPHYCEAE Las diatomeas son algas pardo-doradas con un exoesqueleto silíceo o frústula donde se distinguen variadas ornamentaciones. Se clasifican en Centradas o Pennadas, de acuerdo a la simetría que presenta su exoesqueleto. Pueden ser unicelulares, asociadas en cadenas o embebidas en masas mucilaginosas. Su talla varía entre 2 y 2000 µm. Muchas especies forman esporas de resistencia durante condiciones ambientales adversas. Las deficiencias de fosfatos o temperaturas extremas pueden provocar la producción de estas estructuras que van a los sedimentos para emerger cuando las condiciones se tornan favorables (Hoban et al., 1980; Barron 1985; Smetacek 1985; Lara–Villa et al., 1996). Las diatomeas constituyen un grupo netamente autótrofo (Lara-Villa et al., 1996) por lo que desempeñan un importante papel como productores primarios de materia orgánica y energía al formar parte del primer eslabón de la trama alimentaria de los sistemas acuáticos. Se estima que la producción fitoplanctónica marina es de 2 x 1013 Kg C/ año (Strickland 1972) y que probablemente las diatomeas contribuyen con un 20 a 25 % de la producción primaria neta mundial, dado su predominio en las zonas costeras y de surgencia de los océanos (Werner 1977). En general, una alta abundancia numérica tipifica a las áreas más fértiles de los sistemas acuáticos (Schrader y Matherne 1981) ya que se presenta una fuerte relación de alta abundancia de diatomeas con aguas que poseen altas concentraciones de silício, nitratos y fosfatos (Barron y Baldauf 1989, Lara-Villa et al., 1996). En Cuba se han identificado 181 especies de diatomeas, entre las cuales se observa una mayor abundancia de las pertenecientes a los géneros Navicula, Thalassiosira, Nitzschia y Chaetoceros. Las diatomeas tienen altos requerimientos de nutrientes, por lo cual son más abundantes en aguas 75 costeras que en las aguas oceánicas, donde se incrementa su abundancia solo durante el invierno y en las zonas de afloramientos (Gil et al., 1990). Entre los organismos que componen el fitoplancton, las diatomeas presentan la mayor abundancia relativa y una amplia distribución geográfica, con formas de vida libre o, bentónica en diferentes hábitats: aguas dulces y salobres, costeras y oceánicas, arrecifes, lagunas, bahías, ambientes hipersalinos, manglares, etc. Por otra parte, la acumulación de estas microalgas en los sedimentos representa únicamente de uno a cinco porciento de la asociación originalmente viva (1985a, 1987), lo que evidencia su importancia en investigaciones de geología, evolución, biogeografía, ecología y sistemática (Barron 1992; Moreno et al., 1996). Reino VEGETAL, Filo DINOPHYTA (PYRRHOPHYTA) Dinoflagelados - Clase DINOPHYCEAE Los dinoflagelados son organismos unicelulares, aunque algunos forman cadenas o estados palmeloides. La mayoría presenta asimetría característica, con o sin pigmentos fotosintéticos y dos flagelos. Las células son uninucleadas o binucleadas, móviles ó inmóviles, pláncticas, bénticas, simbiontes o parásitas. De acuerdo a la constitución de la pared celular o teca, algunas especies se clasifican en "tecadas”, cuando está formada por placas celulósicas con ornamentación y “atecadas o desnudas”. Presentan formas de nutrición autótrofa, heterótrofa y algunos pueden combinar su carácter autótrofo y heterótrofo (mixotrofia; Spector, 1984; Sournia, 1986; Gaines y Elbrächter, 1987). Producen quistes como un estadio de su ciclo de vida, aunque no todas las especies se enquistan, y una misma especie es capaz de producir quistes diferentes. Las condiciones ambientales adversas propician el enquistamiento, período durante el cual la célula permanece en estado de latencia hasta que el ambiente le es favorable. Los dinoflagelados constituyen el grupo más abundante del fitoplancton después de las diatomeas, con un número estimado de especies que varía entre 1 400 y 2 000 (Taylor, 1987; Sournia et al., 1991: Licea et al., 1995). Presentan una gran sensibilidad a las variaciones del medio ambiente por lo que se les usa como indicadores biológicos de algunos parámetros ambientales (salinidad, temperatura, y movimientos de las masas de agua) (Graham, 1942; Taylor, 1976; Gamboa-Marquez et al., 1994). Los dinoflagelados se caracterizan por presentar, con mayor frecuencia, especies que causan floraciones algales. Se conoce que más de 100 especies de dinoflagelados producen toxinas, cuyos efectos dañinos varían grandemente de una especie a otra (Florida Department of Environmental Protection, 1998). En Cuba se han registrado 145 especies de dinoflagelados, entre las que se destacan por su abundancia los géneros Gymnodinium, Amphidinium, Gyrodinium, Protoperidinium y Oxytoxum. Por lo general la abundancia de dinoflagelados es menor en las aguas costeras que en las oceánicas. Los géneros Gymnodinium, Amphidinium y Protoperidinium son los de más amplia distribución en aguas someras. Las aguas oceánicas, se caracterizan por el predominio (en densidad y biomasa) de dinoflagelados en las dos épocas del año, gracias a que sus requerimientos en nutrientes son bajos, siendo la especie Oxytosum variabile la que se encuentra con mayor frecuencia (Gil et al., 1990). En Cuba los eventos de floraciones algales han sido poco frecuentes y no han existido reportes de toxicidad, nocividad, o pérdidas en recursos naturales (Popowski y Borrero, 1992). No obstante, es muy probable que muchos eventos de este tipo no hayan sido reportados debido al escaso conocimiento que, en general, existe sobre el tema por parte de la población y de las 76 autoridades sanitarias. Entre las especies de microalgas registradas para las aguas cubanas como productoras de mareas rojas se encuentran Gymnodinium variabile, Peridinium aciculiferum (López Baluja, 1979), Gymnodinium splendens (Borrero, 1982) y Protoperidinium balechii (Delgado et al., 2000b). La toxicidad de los dinoflagelados no está limitada a las especies de vida libre o planctónica. Se ha descrito la implicación de varias especies epi-bentónicas. En Cuba están presentes varias especies de dinoflagelados epífitos de macroalgas, que han sido reportadas por otros autores como tóxicas o potencialmente nocivas. Entre ellos se encuentran Prorocentrum lima, P. mexicanum, P. concavum, P. belizeanum y Gambierdiscus toxicus (Bagnis, 1979; Valdés et al., 1992; Delgado et al. 2000a; Popowski et al., 2001). Esta última especie es la causante de la “ciguatera”, reconocida como la principal afectación provocada por toxinas marinas trasmitidas por la trama trófica en la zona tropical (Bagnis et al., 1985; Bravo, 1993), con una notable incidencia en nuestra población, según las estadísticas del Centro Nacional de Toxicología (CENATOX). La región noroccidental de la plataforma cubana ha sido más estudiada por presentar una mayor frecuencia de casos de intoxicación por ciguatera. En esa región se registraron las mayores densidades de esta especie en los meses comprendidos entre mayo y agosto (Valdés et al., 1992; Popowski et al., 2001). El resto de las regiones de la plataforma han sido poco estudiadas pero existen informaciones anecdóticas de intoxicación en casi todas ellas aunque más escasos. El desconocimiento sobre la materia limita el registro de intoxicaciones en humanos por toxinas de origen marino. Las microalgas en general han sido estudiadas principalmente en las ecoregiones noroccidental y suroccidental de Cuba. La información existente sobre las restantes zonas es escasa y data de la década de los setentas. Sobre las microalgas tóxicas solamente se han realizado algunos estudios ecológicos en la zona noroccidental. Por otra parte, la carencia de tecnologías adecuadas para la clasificación de organismos microscopicos (microscopia electrónica, epifluorescencia, etc) y la identificación de toxinas, ha limitado el desarrollo de las investigaciones en el país. El macrofitobentos, Reino VEGETAL Ana María Suárez 7 Entre los recursos bióticos presentes en la plataforma cubana, el macrofitobentos, formado por las macroalgas y las fanerógamas marinas, no ha sido adecuadamente valorado, tal vez por la poca tradición en su aprovechamiento. Las primeras se caracterizan por tener organización celular y a la planta completa se le denomina talo, En zonas templadas las macroalgas pueden formar densos bosques submarinos de más de 20 metros de alto. Se conocen tres filos de macroalgas: Rhodophyta (algas rojas), Ochrophyta (algas pardas) y Chlorophyta (algas verdes). Por su parte, las fanerógamas (Magnoliophyta) son plantas superiores con flores, sin tallo desarrollado, adheridas al sustrato por rizoides y con una morfología adecuada para soportar la presión hidrostática. El fitobentos presenta una gran importancia ecológica al servir de refugio y alimento a una fauna muy diversa y constituir la base de la producción primaria en la zona nerítica (Lalana, 1984; Lalana et al., 1989); también, porque pueden ser indicadoras de impacto ambiental, ya que su aparición masiva, puede ser la respuesta a la eutrofización del medio o a la desaparición masiva de herbívoros 7 Centro de Investigaciones Marinas, Universidad de La Habana, Calle 16 No. 114, entre 1ra. y 3ra., Miramar, Playa, CP 11300, Ciudad Habana, Cuba amisa@comuh.uh.cu, amisa2@yahoo.com 77 (por causas naturales o antrópicas. También puede ocurrir un desarrollo explosivo de algas, cuando ocurren desastres naturales en los arrecifes coralinos, que tienen como consecuencia la muerte masiva de éstos (Aguilar et al., 2000). Desde el punto de vista económico el macrofitobentos constituye un recurso importante, ya que de muchas especies se obtiene alimento humano y pienso animal (DíazPiferrer, 1957; Cano-Mallo, 1996), se ha utilizado para la recuperación de los suelos, y en especial de las algas se obtienen sustancias bioactivas (antitumorales, antinflamatorios, antioxidantes y otros) que ya forman parte de muchos medicamentos (García Alonso et al., 1992). Entre los productos más tradicionales obtenidos de las algas están sus ficocoloides (agar, alginatos y carragenanos) utilizados en varias industrias, como la alimenticia y la de cosméticos, entre muchas otras (Díaz Piferrer, 1961a, b; Areces, 1989; Areces y Soberats 1992). A nivel mundial, existen alrededor de 15 000 especies de algas, de las cuales más del 50 % son macroalgas marinas y de ellas más del 50% son algas rojas; mientras que de las fanerógamas, que forman los pastizales marinos en las plataformas continentales e insulares, se han registrado 45 especies. La zona de mayor diversidad es el Indo-Pacífico, en biotopos de fondos duros y pastizales (Lüning, 1990). Cuba pertenece a la región fitogeográfica Antillana, que incluye a Bahamas y llega hasta Bermudas (zona de transición) (Suárez, 1989a). En total se han consignado para la plataforma de Cuba 483 especies de macroalgas, de las cuales 160 son clorofíceas, 68 feofíceas y 255 rodofíceas. Además, otras 101 especies se consideran como probables por su actual distribución geográfica (Suárez, 2005). Los biotopos con mayor diversidad son: el seibadal o pastizal marino, le sigue, el arrecife coralino y el manglar de los cayos; la menor diversidad se encuentra en las lagunas costeras rodeadas del mangle costero y en los fondos fangosos o fangoso-arenosos (Suárez, 1989b). El resultado de todo lo anterior es una gran diversidad de biotopos con múltiples microambientes, que se repiten por todo el Caribe. Esto trae como consecuencia, que también halla gran diversidad de especies y una amplia distribución de poblaciones de todas estas, que permite una alta heterogeneidad genética, dando como resultado también, la existencia de muchas variedades y formas en muchas especies. Algunas algas comunes en la plataforma cubana. 78 El macrofitobentos marino cubano, también incluye 6 especies de fanerógamas: Thalassia testudinum, Syringodium filiforme, Halodule wrightii, Halophila decipiens, H. engelmanni y Ruppia maritima. La primera domina en todas las zonass de Cuba, formando los principales pastizales marinos, en especial en las lagunas arrecifales, donde a veces se encuentra asociada a S. filiforme. Nuestra biodiversidad es menor que la del Océano Pacífico, el Atlántico es más joven, pero podemos considerarla alta y es precisamente nuestra mayor riqueza biológica (Suárez, 1989a). El sustrato, junto a la luz, son los factores fundamentales que influyen en la distribución de las asociaciones fitobentónicas y en cada una de éstas, encontramos especies dominantes (Suárez, 1989b). Los fondos rocosos se caracterizan por la abundancia de algas pardas, es el reino de las Dictyotales, primero con especies de los géneros Dictyota y Dictyopteris hasta 2 m de profundidad, en que comienza la zona de Stypopodium zonale y finaliza en la zona de gorgonias y corales con varias especies de Halimeda, en especial H. opuntia y H. goreaui. En las raíces del manglar de los cayos dominan las algas rojas del orden Ceramiales; también están presentes algas verdes como Anadyomene stellata, Phyllodictyon anastomosans, P. pulcherrimum, Caulerpa verticillata, y Acetabularia spp. Entre el manglar y/o la playa arenosa de los cayos y la cresta del arrecife, se encuentra la laguna arrecifal., cuyo inicio desde la costa generalmente comienza con fondos arenosos y algunas algas verdes que dan paso al seibadal o pastizal marino, formado por las fanerógamas: T. testudinum, como especie principal y S. filiforme. Son dominantes aquí las especies del orden Bryopsidales: Caulerpa cupressoides, C. mexicana, Penicillus capitatus, P. lamouroxii, Halimeda incrassata, H. tuna, Udotea flabellum y U. spinulosa. Después de este pastizal nos encontramos con el arrecife posterior, zona de poca profundidad caracterizada por los “cabezos”, formados por corales macizos y gorgonias, donde hay una plataforma rocosa y nos encontramos de nuevo con las Dictyotales Dictyota spp., Lobophora variegata, S. zonale, Padina spp. y también varias especies de Sargassum,. Entre las cuales S. hystrix es la más común. En todas las oquedades están las algas rojas Liagora spp., Amphiroa rigida, A. tribuloides, asociadas con especies de Jania. Luego llegamos al arrecife somero, donde predominan las algas verdes H. opuntia, H. goreaui y Padina spp., que continúan dominando en el arrecife anterior hasta zonas de arenas y luego en rocas mas profundas. En las playas arenosas abiertas o en ensenadas solo encontramos algas separadas del fondo y traídas por las olas, pues es un sustrato móvil, que impide la fijación de las algas. El manglar costero, con lagunas de aguas altamente productivas, es de poca diversidad y aquí también dominan las algas rojas del orden Ceramiales principalmente el género Bostrychia, en el complejo denominado Bostrychetum, que tiene asociado además a Murrayella periclados y Catenella caespitosa. Los fondos fangosos tienen menor diversidad, pues también, como en fondos arenosos, el sustrato no es conveniente para la fijación de las algas. Predominan los órdenes Gracilariales y Gigartinales (Rhodophyta) y la fanerógama más abundante es H. wrigthii. Estos fondos ocupan principalmente la plataforma suroriental de Cuba. En las playas rocosas, donde es fuerte el embate de las olas, nos encontramos un cinturón de algas en su mesolitoral, formado principalmente por especies de Laurencia, donde sobresale L. papillosa y Fucales de los géneros Sargassum y Turbinaria. En las playas rocosas de menor embate o resguardadas, el fondo está cubierto por Ulva spp. y Chaetomorpha spp. como grupo dominante 79 En un análisis general de la distribución de las algas en las diferentes zonas de nuestra plataforma, nos encontramos, que en la parte norte hay mayor diversidad de especies, lo cual puede deberse a las variaciones de salinidad y temperatura en el Golfo de México y a que la zona es geológicamente más vieja y por lo tanto, puede considerarse como uno de los centros de dispersión hacia Bahamas y Bermudas, por la dirección de las corrientes y el mayor enriquecimiento de éstas (Suárez, 1989a). Acetabularia sp. se encuentra frecuentemente cubriendo las raices de los mangles y otras estructuras sumergidas Las especies del género Stypopodium son abundantes en los arrecifes coralinos El macrofitobentos de la plataforma cubana ha sido mejor estudiado en las regiones suroccidental (Golfo de Batabanó y Archipiélago de los Canarreos; Kusel, 1972; Suárez y Pérez 1989; Jiménez, 1990; Jiménez y Alcolado, 1990; Suárez, y Osa de la, 1990; Brito y Suárez 1994; Prado y Suárez, 1996) y la norte central (Martínez et al., 1996; Cabrera et al., 2004; Perdomo y Suárez, en prensa). Le sigue en conocimientos la noroccidental (Howe, 1918; Sánchez Alfonso, 1930; Castellanos, 1945; Suárez y Cortés, 1983; Suárez et al., 1989; Trelles et al., 1997; Aguilar et al, 2000). Hay datos muy locales de la ecoregiones suroriental y nororiental (Howe, 1909; Humm y Jackson, 1955; Díaz Piferrer, 1964a; Díaz Piferrer y López, 1959; Cruz de la, 1982; Zayas et al., 2002) y en la surcentral (Moreira et al., 2003a, 2003b). En estos momentos se realizan investigacoines en las regiones surcentral, suroccidental y noroccidental, sobre las cuales el conocimiento es escaso. Hay muchos órdenes, géneros y especies de importancia ecológica y económica, que desde el punto de vista taxonómico necesitan ser revisados. Entre estos grupos están las Corallinales, formadoras de arrecifes y fuente de formación de la arena de las playas; los géneros Caulerpa, Laurencia, Stypopodium, Dictyota, Gracilaria y otros, que tienen importancia farmacológica; y los órdenes Ceramiales, Gigartinales, Gracilariales y Fucales, por ser fuentes potenciales de ficocoloides. Las principales amenazas para la biodiversidad del macrofitobentos de la plataforma de Cuba, están fundamentalmente en la contaminación costera por desechos industriales, la tala de manglares (por sus diversos usos) y el desarrollo del turismo. En particular la construcción de infraestructuras (hoteles, marinas y otras edificaciones de servicios a la actividad), trae consigo cambios en el relieve costero y por tanto en los flujos de las corrientes marinas, todo lo cual modifica el ambiente costero, no sólo perjudicial para las algas sino también para el resto de los organismos marinos. 80 Halimeda copiosa (Foto: Noel López). Las algas calcáreas constituyen un importante componente de la estructura de los arrecifes y los pastos marinos y contribuyen sustancialmente a la formación de las arenas que alimentan las playas. Protozoos – Reino PROTISTA Aida Caridad. Hernández Zanuy 8 Los Protozoos son organismos eucarióticos, considerados hasta hace pocos años como un filo del reino animal por su forma, movilidad y nutrición heterótrofa. Actualmente se les considera como Reino Protista (o Proctotista) con varios filos, que tienen como factor común su nivel de organización unicelular. Se estima que existen más de 80 000 especies principalmente marinas y dulceacuícolas. Aunque la mayoría son solitarios, existen diversas forma coloniales, algunas de gran complejidad estructural (Ruppert y Barnes, 1994). Estos organismos presentan una alta tolerancia a condiciones ambientales extremas como la salinidad, temperatura y particulamente una notable adaptabilidad a diferentes presiones osmóticas. Los protozoos presentan una gran diversidad tanto a nivel específico como de taxones superiores. De acuerdo con su morfología se dividen en cuatro grandes grupos, la mayoría de los cuales tienen representantes en el medio marino: a) Protozoos flagelados o mastigophoros, con más de 6 900 especies que comúnmente se dividen en fitoflagelados (células con cloroplastos), autótrofos (tratados en la sección Microalgas de esta obra) y zooflagelados (sin cloroplastos, heterótrofos) que incluyen los filos: Dynophyta, Parabasalia, Metamonada, Kinetoplastida, Euglenophyta, Cryptophyta, Opalinata, Heterokonta, Chlorophyta, Haptophyta, Choanoflagellida; b) Protozoos ameboides, conocidos anteriormente como Sarcodina, comprende los filos Rhizopoda (amebas), Actinopoda (radiolarios y heliozoos) y Granuloreticulosa (foraminíferos); c) Esporozoos, que incluye unas 4 000 especies de los filos Sporozoa, Microspora y Myxosporidia; y por último d) los Protozoos ciliados (filo Ciliophora), con más de 7 200 especies que habitan principalmente en aguas marinas y dulces así como en la película acuosa de los suelos; aproximadamente un tercio de 8 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente. Ave. 1ra. No. 18406, Rpto. Flores, Playa, La Habana, C.P. 12100. Cuba. aidah@oceano.inf.cu. 81 las especies son ecto o endocomensales o parásitos (Ruppert y Barnes, 1994). La mayoría de estos taxones han sido muy poco estudiados en Cuba. Los protozoos bentónicos se han estudiado en zonas templadas con sedimentos de origen silíceo, pero se conoce poco sobre sus características en los arrecifes coralinos donde predominan los calcáreos y el clima es más cálido. Según P.A, Díaz Pérez, A. Hernández Zanuy y M. V. Orozco Llerena (inédito) en el arrecife de Cayo Diego Pérez, ubicado al sureste del Golfo de Batabanó, se identificaron 41 especies en las arenas gruesas de 7 estaciones, entre las cuales los organismos psammóticos estaban poco representados. P.A. Díaz Pérez, A. Hernández Zanuy y M. V. Orozco Llerena (inédito) identificaron 37 especies, de ellas siete mastigóforos, dos sarcodinos y 17 cilióforos, en dos localidades con diferentes condiciones ambientales, una salina y una pequeña bahía en el litoral habanero. La mayoría de las especies colectadas en esta última son de hábitos bentónicos, mientras que solo seis especies de cilióforos se encontraron en la columna de agua. En la salina, se encontraron 13 especies, todas bentónicas y su diversidad disminuyó con el aumento de la salinidad, aunque siete de ellas se encontraron en salinidades de hasta 75 ppm, y el cilióforo Protocruzia pigerrima, se encontró en un estanque con salinidad de 270 ppm. En este ecosistema se registró el kariorelíctido Trachelocerca phoenicopterus, pertenecienete a un órden de cilióforos primitivos, solo conocido en Cuba por un representante dulceacuícola, el género Loxodes. Por otra parte, Golemansky (1970) registró siete sarcodinos psammófilos en playas del litoral norte de Cuba y representa uno de los pocos antecedentes sobre protozoos de sedimentos marinos, al igual que el encontrado por Díaz y Montoto (1989) en aguas salobres. Foraminíferos - Filo GRANULORETICULOSA, Clase FORAMINIFERA María Elena Chávez Marrero 9 Entre los protistas ameboideos los foraminíferos se distinguen por la presencia de finos pseudópodos anastosomados (granoreticulopodia), que tienen una textura granular a la luz del microscopio, y porque casi todos poseen una concha que rodea el cuerpo, separándolo del entorno circundante. Esta concha puede ser orgánica (no mineralizada), aglutinada (construida por partículas cementadas conjuntamente con el foraminífero), compuesta por carbonato de calcio, o en raras ocasiones por sílice. Su ciclo de vida está caracterizado por la alternancia de generaciones sexuales y asexuales (Goldstein, 1999). La clasificación taxonómica de los foraminíferos es compleja y no existe consenso sobre su nomenclatura. La más reciente es la de Gupta (1999) que divide la actual clase Foraminifera en 4 grupos y 16 órdenes. Los foraminíferos poseen una amplia radiación evolutiva y alta diversidad, se encuentran en todos los ambientes marinos, desde la zona intermareal hasta el mar profundo, y desde el trópico hasta los polos. Se ha estimado que viven actualmente en el océano alrededor de 4 000 especies, de ellas 40 son planctónicas, las restantes son bentónicas, y viven sobre o dentro de la arena, el fango, 9 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente. Ave. 1ra No.18406, Reparto Flores, Playa, La Habana, Cuba. C.P. 12100. mariecha14@yahoo.com 82 las rocas o las plantas. Se encuentran entre los organismos más abundantes del océano mundial y sus conchas representan una de las mayores y más significativas fuentes de producción de carbonato de calcio en el mar (Hottinger et al., 1993). Gracias a su gran sensibilidad a los cambios bruscos del medio ambiente, los foraminíferos pueden servir como bioindicadores para evaluar las condiciones ambientales, en particular de los arrecifes coralinos, y los efectos de la contaminación (Hallock, 2000a). También son útiles en los estudios oceanográficos para interpretar la deriva litoral y la dinámica de los sedimentos. Además, los foraminíferos fósiles son muy útiles y ampliamente utilizados en estudios de bioestratigrafía, paleoecología, paleobiogeografía, así como en la exploración de hidrocarburos. En los ecosistemas marinos juegan un importante papel, dado por la participación de los grandes foraminíferos bentónicos y los planctónicos simbiontes en la producción de carbonato de calcio en los arrecifes coralinos y en el océano mundial. En zonas batiales los lodos de foraminíferos o globigerinas son los sedimentos más abundantes, y los mismos constituyen una fuente imprescindible para el estudio de los cambios climáticos globales, debido a que están formados principalmente por foraminíferos y cocolitosfóridos, siendo los grupos que aportan mayor evidencia paleo-ecológica, por su alta diversidad específica en tiempo y espacio, así como por la estrecha correlación entre los modelos ecológicos y de distribución (Hottinger, 1984). Ammonia beccarii (Linné), especie eurialina muy estudiada, se destaca por su importancia ecológica en la Provincia Caribeña debido a que se adapta fácilmente a las condiciones ecológicas más diversas. Algunos foraminíferos bentónicos grandes como Amphistegina gibbosa, son muy sensibles al blanqueamiento, observándose en ellos la enfermedad antes que en los corales (Hallock et al, 1995; Hallock, 2000b). El estudio de los foraminíferos del Caribe se inició en el siglo IXX con el inventario en Cuba, de 121 especies (Orbigny, 1839). Resumiendo las informaciones dispersas en la literatura, Culver y Buzas (1982) compendiaron 1 189 especies para el Caribe. Amphistegina gibosa D´Orbigny, 1839, especie utilizada como indicador de la vitalidad en los arrecifes coralinos. (Fotos tomadas de Crevinson y Hallock, 2003). En Cuba los foraminíferos se han estudiado con mayor intensidad en las zonas suroccidental, noroccidental y norcentral. Hasta el momento se han registrado 704 especies recientes. Las más comunes entre los foraminíferos bentónicos, coinciden con las 130 especies reportadas por Culver y Buzas (1982) como las más frecuentes en las plataformas someras del Mar Caribe. 83 Con el objetivo de conocer la composición, abundancia y distribución de los foraminíferos del talud al este de la Península de Hicacos en el año 2000, se analizaron muestras de sedimentos superficiales obtenidas mediante succión. Los resultados mostraron un predominio del género Amphistegina entre 82 y 113 m de profundidad, y una tendencia al incremento de la frecuencia de las formas aporcelanadas y lamelares perforadas, con el aumento de la profundidad. Según Álvarez y Borro (1979) en los manglares, lagunas costeras y estuarios habitan esencialmente foraminíferos bentónicos. En las aguas interiores con poco movimiento, aparecen formas bentónicas lamelares perforadas, pertenecientes a las familias Rotaliidae, Elphidiidae, Epistomariidae y Hauerinidae, mientras que en las aguas estancadas la alta concentración de sulfhídrico en el medio impide el desarrollo de conchas calcáreas y favorece la presencia de abundantes formas aglutinadas (arenáceas), entre las que se encuentran las familias Lituolidae, Reophacidae y Ammodiscidae. Algunas especies presentes en aguas costeras de Cuba, donde se observa una gran variedad de formas. En las playas y costas rocosas de la costa norte de la isla, predomina una población muy heterogénea de foraminíferos bentónicos, destacándose las familias Peneroplidae, y Hauerinidae, esta última se caracteriza por la presencia de conchas con paredes gruesas, a veces con costillas y rebordes, mientras que en los sitios más protegidos de las fuertes corrientes, las conchas suelen ser de paredes finas y lisas. Se encuentran además representantes de las familias Lituolidae, Trochamminidae y Saccamminidae pertenecientes a los foraminíferos aglutinados. Ammonia beccarii (Linné, 1758), especie fácilmente Archaias angulatus, (Fichtel y Moll, 1803), adaptable a condiciones ecológicas extremas común en las arenas biogénicas de Cuba. (Fotos tomadas de Crevinson y Hallock, 2003). 84 En los pastos marinos es común encontrar foraminíferos epífitos en las hojas de Thalassia testudinum. Las familias más comunes en este medio son Peneroplidae y Soritidae. Los arrecifes coralinos y fondos duros se caracterizan por la presencia de macro-foraminíferos con diatomeas, rhodofitas y clorofitas como simbiontes. Las familias representadas en ellos son Alveolinidae, Peneroplidae, Soritidae, Meandropsinidae, Acervulinidae, Asterigerinidae, Amphisteginidae y Nummulitidae. En los fondos blandos no arrecifales, a profundidades mayores de 200 m, aparece con mayor frecuencia la tanatocenosis de foraminíferos planctónicos. El número de especies aumenta con la profundidad. En ella es difícil distinguir una biocenosis planctónica típica para esa área, ya que son independientes del carácter del fondo, y son más susceptibles al transporte de las masas de agua. Por ello, además, su procedencia es menos evidente que la de los bentónicos y requiere de un estudio especial de las formas vivientes, pues muchos de los detalles morfológicos que se utilizan para su identificación no siempre se conservan. Entre las familias planctónicas frecuentes están Globigerinidae y Orbulinidae, y. dentro de los foraminíferos bentónicos las familias Uvigerinidae, Cassidulinidae, Fursenkoinidae y Textulariellidae. Protozoos esféricos – Filo ACTINOPODA* Está formado principalmente por protozoos en su mayoría marinos, que se caracterizan por la presencia de actinopodios y un delicado filopodio que irradia desde un cuerpo esférico. Comprende las clases Acantharea, Polycystinea, Phaeodarea y Heliozoea (según Ruppert y Barnes, 1994). Otros autores consideran a Actinopoda como una clase y las clases como supeórdenes (De Wever et al., 2001). Para este trabajo se sigue la nomenclatura de los primeros autores. Los de las tres primeras clases son conocidos como Radiolarios Se caracterizan por su gran belleza y complejo esqueleto de dióxido de silicio o sulfato de estroncio. Son eminentemente planctónicos marinos Algunas especies miden varios milímetros de diámetro y algunas especies coloniales alcanzan hasta 20 cm (Collozoum). Entre los heliozoos se encuentran formas planctónicas y bénticas, marinas y de agua dulce. Protozoos – Reino PROTISTA: Filo ACTINOPODA, Radiolarios – Clases ACANTHAREA, POLYCYSTINEA y PHAEODAREA Emilio Flores Abín 10 Los radiolarios constituyen uno de los grupos de protozoos más diversos e interesantes en el plancton marino. Se caracterizan por la radiación hacia el exterior de finas proyecciones citoplasmáticas denominadas axópodos. Debido a la similitud estructural de sus esqueletos, a los miembros de las tres primeras clases se les conoce como “radiolarios”, aunque la tendencia actual es ubicarlos en categorías taxonómicas diferentes. Los acantarios son marinos, planctónicos, con membrana capsular microperforada y su esqueleto está formado por celestita (sulfato de estroncio), mientras que los heliozoos forman parte 10 Investigador independiente 85 del plancton y más frecuentemente del bentos en medios dulceacuícolas, y en menor grado, en áreas marinas neríticas. Suelen ser pedunculados y carecen de membrana capsular. Los radiolarios poseen membrana capsular perforada y su esqueleto esta compuesto por sílice amorfa con una variedad morfológica muy amplia. A esta características responden en específico los radiolarios de la clase Polycystinea (o super-órden Polycystina) que agrupa a Spumellaria y Nassellaria (De Wever et al., 2001) que son los mas estudiados en general por su importancia ecológica y paleontológica. La inestabilidad de los esqueletos de los acantarios y heliozoos no facilita su preservación en el registro fósil, sin embargo los radiolarios tienen una distribución muy extensa a lo largo de todo el Fanerozoico debido al carácter robusto y la composición de su testa. Su abundancia en los océanos actuales es importante, distribuyéndose en todas las profundidades, principalmente en los primeros cien metros bajo la superficie, y disminuyen en número hacia las aguas más profundas (Petrushevskaya, 1971). Los radiolarios del género Acanthometra tienen una amplia distribución en aguas tropicales En la columna de agua oceánica los radiolarios realizan migraciones diarias verticales hasta los 350 m de profundidad, debidas en parte a los movimientos de las masas de agua, pero también gracias a cierta capacidad para autocontrolar su permanencia a determinados niveles. Esta habilidad para moverse en profundidades variables se traduce en diferentes estrategias alimentarias, por ejemplo, los espumelaridos que viven en niveles superficiales se alimentan de diatomeas, tintínidos (cilióforos) y otros protozoos, pero en ocasiones se asocian a algas simbióticas para obtener su energía del proceso de la fotosíntesis. Los naselaridos, sin embargo, pueblan las capas más profundas del océano y se nutren principalmente de bacterías y materia orgánica en suspensión. Por ser organismos de hábitos planctónicos, los radiolarios se mueven libremente en todas las latitudes respondiendo a la circulación de grandes masas oceánicas. Según Petrushevskaya (1967; 1971b-d) y Renz (1973), las poblaciones de radiolarios en los océanos, desde los polos hasta el ecuador, suelen estar mezcladas en diferentes grados. Muchas formas exhiben distribuciones bipolares, algunas especies de aguas frías se presentan en aguas ecuatoriales, numerosas formas tropicales se encuentran presentes en todos los océanos, y muchas especies son comunes en los océanos Pacífico y Atlántico. Todo esto ha obstaculizado una concreta definición de la biogeografía del grupo, aunque en los últimos años se ha reconocido la existencia de diversas provincias biogeográficas fuertemente controladas por la latitud y la temperatura del agua. 86 La máxima concentración de radiolarios se observa en las áreas cálidas del océano abierto, además es muy común su proliferación en zonas de afloramiento (Kruglikova, 1989). Su mayor diversidad ocurre en las bajas latitudes como es común en otros muchos grupos del plancton marino. Utilizando el método del actualismo, Casey et al. (1983) han propuesto trasladar datos del hábitat de las familias actuales al análisis paleoecológico creando un modelo que proporciona la reconstrucción paleoambiental general. Por otro lado, los radiolarios se han utilizado para elaborar mapas de paleo-temperaturas de la superficie marina, modelos de paleo-circulación marina y en la estimación de paleo-profundidades. En Cuba, el estudio de estos microorganismos se ha orientado concretamente a las formas fósiles halladas en diferentes tipos de sedimentos que afloran a lo largo de la isla y también en rocas extraídas del subsuelo por medio de perforaciones petroleras o de otro tipo, con fines estrictamente paleontológicos, obteniéndose conclusiones. estratigráficas, bio-estratigráficas y paleo-ecológicas, para dar respuesta a intereses propios de la industria petrolera. El análisis de muestras de formas vivientes no cuenta en este perfil, por lo cual es muy pobre la información sobre su diversidad y distribución actual en Cuba. Se han registrado varios cientos de especies fósiles que se distribuyen desde el Mesozoico (Jurásico Superior) hasta el Cenozoico (Eoceno Medio) con una duración aproximada de 108 millones de años. El estudio de estas especies ha adquirido gran importancia en los últimos tiempos debido a que posibilitan la datación de edades relativas de los sedimentos donde no se reportan otros grupos fósiles y por constituir además buenos indicadores paleo-geográficos, paleo-climáticos y paleo-batimétricos. La mayoría de las familias que agrupan a dichas especies han transitado victoriosas los tiempos geológicos y algunas de ellas han alcanzado la época reciente con representantes nuevos que pululan los mares actuales. LOS METAZOOS – REINO ANIMAL Esponjas – Filo PORIFERA Pedro M. Alcolado3 Las esponjas son los organismos pluricelulares de organización más sencilla del reino animal. Son sésiles, tanto marinas como de agua dulce, que se caracterizan por tener la superficie perforada por diminutos poros (de ahí su nombre Porífera) y su cuerpo atravesado por cámaras y canales, a través de los cuales circula el agua impulsada por células flageladas. El agua sale por una o varias aberturas mayores. No presentan órganos, y por lo tanto las funciones se realizan por células temporalmente o definitivamente especializadas, con gran independencia y coordinación entre ellas. Tradicionalmente se ha considerado que no tienen verdaderos tejidos, pero esto es objeto de polémica en la actualidad. Su cuerpo se sostiene por un esqueleto que puede incluir espículas calcáreas o silíceas, fibras de espongina, y capas de carbonato de calcio. Algunas no tienen esqueleto y su forma se mantiene por turgencia. Su simetría es radiada en sus etapas larval y juvenil, pero al crecer comúnmente la pierden. Pueden alcanzar gran tamaño y despliegan una gran variedad de colores y formas. Las esponjas realizan múltiples funciones: mantienen retenidos en su biomasa elementos biogénicos del ecosistema; brindan refugio a larvas, juveniles y adultos de gran cantidad de organismos de casi todos los filos; filtran grandes volúmenes de agua, reteniendo materia orgánica particulada (viva y muerta) y disuelta (Reiswig, 1971) por lo que algunos las consideran 87 descontaminadoras; constituyen alimento para algunos peces (Randall y Hartman, 1968), tortugas (Meylan, 1988) e invertebrados; son competidores por la ocupación del espacio en los arrecifes; y algunas (como Cliona vesparia, según Wiedenmayer (1978) intervienen en el proceso de petrificación de sedimentos en el arrecife y por lo tanto se consideran hermatípicas. Las esponjas perforantes juegan un papel muy importante en la bioerosión del material calcáreo y contribuyen a la formación de sedimentos y renovación del arrecife (Neumann, 1966; Rützler, 1975; Hartman, 1977). Las esponjas están presentes prácticamente en todas los biotopos, en los cuales tienden a ocupar casi siempre uno de los tres o cuatro primeros lugares en biomasa. Por otra parte, establecen variadas e importantes relaciones simbióticas con animales y vegetales. Las esclerosponjas contribuyen a la creación y mantenimiento del armazón calcáreo de las partes más profundas de los arrecifes, por eso son consideradas organismos hermatípicos (Lang et al., 1975). Por otra parte, apenas una media docena de especies del Atlántico Occidental Tropical son esponjas comerciales tradicionales. Además las comunidades de esponjas sirven como bioindicadoras del grado de severidad y estabilidad ambiental y de algunos factores fisicos que afectan un sitio determinado (Alcolado, 1984, 1992; Muricy, 1989). Algunas especies son portadoras de sustancias biológicamente activas (esteroles, terpenoides, nucleiósidos y ácidos nucleidos, compuestos de bromopirrol, derivados de dibromo-tirosina, benzoquinonas preniladas, ácidos grasos, etc.), por lo que constituyen importantes recursos potenciales para la producción de fármacos (anticancerígenos, antiherpéticos, antiartríticos, antibacterianos, antivirales, antimicóticos, etc.). La sistemática de las esponjas se ha caracterizado por constantes cambios en su ordenamiento interno y en la identificación de las especies que persisten en la actualidad, estimulados sobre todo por los avances y aplicación de las técnicas de la biología molecular. Recientemente, a partir de evidencias de estudios de sistemática molecular, las esponjas calcáreas han sido consideradas como pertenecientes a un filo separado de Porifera, cercano a los ctenóforos, con el nombre antiguo, Calcispongia, y no el de su clase actual, Calcarea (Zrzavý, 1998; Borchelini et al., 2001). Por otra parte, ya empiezan a aparecer evidencias que sugieren que Homoscleromorpha tampoco pertenece a los poríferos (Borchelini et al., 2004). Sin embargo, en el presente acápite se prefirió por el momento incluir la información relativa a estos grupos y se incluyen sus especies dentro del número total de esponjas registradas para Cuba. A juzgar por la literatura consultada, son reconocidas como válidas alrededor de 500 especies de esponjas en el Gran Caribe y es posible que existan realmente más de 700. Para todo el mundo se estiman más de 7 000 especies (Hooper y Van Soest, 2002). Dado que no parecen existir barreras geográficas efectivas para la dispersión de las esponjas es muy probable que prácticamente todas las especies de la región corriente abajo (norte de Brasil, Mar Caribe y Golfo de México) se encuentren en aguas cubanas. En mi criterio, y contrariamente a lo planteado por Hechtel (1976), en el Atlántico Occidental Tropical parecen distinguirse dos provincias zoogeográficas de esponjas neríticas, una Antillana al norte de Recife y otra Brasileña Tropical al sur. Estas Provincias se separan marcadamente de las del Pacífico Oriental Tropical y del Atlántico Oriental Tropical. 88 Algunas de las diversas formas de las esponjas: 1 = ramosas, 2 = vasiforme, 3 = de copa, 4 = incrustante, 5 = subesférica, 6 = peltada, 7 = de maza, 8 = tubular y 9 = subhemisférica. Hasta la fecha se han compilado 263 especies registradas o colectadas en aguas cubanas (Alcolado, 2002 y registros inéditos). De éstas, 255 están identificadas hasta nivel de especie (ver lista en este CD). Si consideramos la cantidad de especies estimadas para el Gran Caribe, quedan aún muchas por encontrar, principalmente en arrecifes y aguas profundas. El conocimiento de las esponjas calcáreas (clase Calcarea) de Cuba es prácticamente nulo, y el de las silíceas (Hexactinellida), muy pobre. La probabilidad de encontrar nuevas especies para la ciencia en el Atlántico Occidental Tropical aún parece elevada. En Cuba, como en cualquier parte, las esponjas están presentes prácticamente en todos los hábitats marinos, en los que tienden a ocupar casi siempre uno de los primeros lugares en biomasa. La diversidad de especies de esponjas es mayor en los arrecifes coralinos, y disminuye sucesivamente en los fondos rocosos interiores, pastos marinos arenosos y arenofangosos, raíces de mangle, pastos marinos fangosos, y finalmente en fondos fangosos donde sólo algunas especies pueden sobrevivir a la fuerte sedimentación y a la consitencia excesivamente blanda del fondo. Aplysina ocracea (Foto: Rafael Mesa) Callyspongia fallax (Foto: Noel López) Niphates digitalis (Foto: Rafael Mesa) . En las zonas bajas de los arrecifes (menos de 7 m de profundidad) las especies más comunes son Aplysina fistularis, Clathria virgultosa, Cliona caribbea forma aprica, Chondrilla nucula, Scopalina ruetzleri, Cliona vesparia y Spirastrella coccinea. En las zonas más profundas (7-35 m) son éstas Aplysina cauliformis, C. caribbea f. aprica, Ectyoplasia ferox, Iotrochota birotulata, 89 Mycale laevis, Niphates amorpha, Aiolochroia crassa y S. ruetzleri. Otras especies que a veces dominan aquí son A. fistularis, Callyspongia vaginalis, C. nucula y Niphates digitalis. En las mayores profundidades de la plataforma (entre 30 y 35 m) las especies A. cauliformis, Ircinia felix y E. ferox aparecen como las más comunes y frecuentes. En la terraza areno-rocosa arrecifal profunda, Phoriospongia rubra, Oceanapia stalagmitica y Tectitethya crypta suelen estar entre las más comunes. En áreas influidas por la contaminación orgánica y química, y por los sedimentos suspendidos, de la Bahía de La Habana y de los ríos Almendares y Quibú de la Ciudad de La Habana, se observa un predominio de Clathria venosa y I. birotulata f. musciformis a 10-15 m de profundidad (Alcolado y Herrera-Moreno, 1987). En las raíces de mangle los poríferos más comunes son Tedania ignis, Lissodendoryx isodictyalis, Dysidea etheria, S. ruetzleri, Hyrtios proteus, Haliclona manglaris y Mycale microsigmatosa. En menor grado también sobresalen Haliclona implexiformis, Clathrina primordialis, Halichondria melanadocia, I. felix, Stelleta kallitetilla y Spongia spp. Las especies más comunes en los pastos marinos y fondos arenosos de Cuba son A. fistularis f. fulva, Cliona varians, C. vesparia, H. proteus, y C. nucula. En menor cuantía también pueden sobresalir Hyrtios violacea, T. ignis, Clathria schoenus, S. ruetzleri, I. felix, Amphimedon viridis, Geodia gibberosa, Spongia obscura y D. etheria. En fondos fangosos son más frecuentes H. melanadocia, C. nucula, Suberites aurantiaca, Mycale angulosa, Niphates ramosa y Timea squamata. En menor grado también se destacan T. ignis, A. fistularis f. fulva, y D. etheria. Durante inmersiones a bordo de dos minisumergibles (el soviético “Argus” en 1983 y norteamericano “Johnson Sea Link II” en 1997) en el batial del noroeste y sur de Cuba, se observó que las esponjas más comunes eran Dactylocalyx pumiceus (150-470 m), especies de Pachastrella (290-700 m) y varias especies litístidas. Un parche de fondo fangoso estaba poblado por Pheronema annae (370-560 m). Sobre la pared del talud insular, se observó una marcada abundancia y frecuencia de una esponja de color amarillo, la que no pudo ser colectada. En esa misma pared, entre los 100 y 150 m solían abundar Ceratoporella nicholsoni, Stromatospongia vermicola, S. norae y Discodermia polydiscus. En los arrecifes de Cuba los mayores valores del ïndice de heterogeneidad de Shannon´s (H’; calculado con logaritmos naturales) fueron 2,00, 3,03, 3,36, 3,34 y 3,51 natios para las profundides de 1-2, 5, 10, 15 y 20 m, respectivamente. Todos estos, excepto el primero, fueron obtenidos en el Archipiélago Sabana-Camagüey. El valor más alto (3,51 natios) fue encontrado en Cayo Esquivel, en el mismo archipiélago (Alcolado, 1999). Se observó también un valor muy similar a 20 m de profundidad frente al Rincón de Guanabo, al este de La Habana (Alcolado, 1989). Para pastos marinos, el mayor índice de heterogeneidad obtenido fue 1,85 natios (Alcolado, 1985a) en el Golfo de Batabanó; para fondos rocosos interiores, 3,40 natios, en el mismo golfo (Alcolado, 1985a, 1990); y para manglares 2,37 natios (Alcolado, 1985b) en Punta del Este, sudeste de la Isla de la Juventud. De acuerdo con Páez-Costa (1990a), la extracción de esponjas en Cuba hasta fines de los años 80 representó el 30% de la pesca mundial. La especie Hippospongia lachne (conocida como “esponja hembra”) fue la más importante por su calidad y la que prevaleció en la pesca del Golfo de Batabanó (suroeste de Cuba). Otras especies comerciales del país son Spongia obscura, S. barbara, S. pertusa y S. graminea, en conjunto conocidas como “esponjas machos”. El género Spongia 90 prevaleció en la pesca de las cercanías de Caibarién (Archipiélago Sabana-Camagüey, norte central de Cuba). Los Anuarios de Pesca de la FAO reportan una extracción de 500 TM en 1935 pero a partir de 1939 se produjo su colapso (hasta cero en 1950) después de una epizootia provocada por una enfermedad fungosa conocida como tizón (bligth) causada por el hongo Spoingiophaga communis que aniquiló masivamente las esponjas comerciales en todo el Gran Caribe, reforzada en 1944 por los efectos de un huracán. A partir de 1959 las capturas raramente sobrepasan las 50 TM anuales. Páez-Costa (1990a) refiere que las mayores extracciones de esponjas siempre correspondieron a las zonas esponjeras de Caibarién, seguida por las del Golfo de Batabanó y muy por debajo, por las de Punta Alegre (también en el Archipiélago Sabana-Camagüey, pero más al este) donde la pesca se interrumpió en 1988. La fauna de esponjas de Cuba ha sido moderadamente inventariada y estudiada desde el punto de vista taxonómico a todo lo largo del sur, noroeste y centro norte de Cuba, abarcando los más variados biotopos (Alcolado, 2002). Los sectores al este de la Bahía de Nuevitas, por el norte, y al este de la Bahía de Guantánamo, por el sur (o sea el extremo más oriental de Cuba) aún no han sido explorados. Páez-Costa (1990a, 1990b y 1990c) realizó un detallado análisis bibliográfico sobre la biología, pesca y cultivo de las esponjas comerciales de Cuba. Alcolado et al. (2004a) brindaron comentarios generales sobre el inventario de especies, cultivo y algunas características de las comunidades de poríferos de Cuba. También se han realizado estudios metodológicos usando índices ecológicos en comunidades de esponjas, así como un trabajo donde la familia Aplysinidae es analizada en relación con los compuestos halogenados de sus extractos (Alcolado et al., en prensa). Entre las principales amenazas reales y potenciales de pérdida de diversidad para las esponjas en Cuba se destaca la sobrepesca. Páez-Costa (1990a) refiere que en el Golfo de Batabanó las poblaciones de esponja “hembra” H. lachne sufríeron disminuciones en algunas áreas tanto por la sobrepesca como por la degradación ambiental. La pesca de peces y camarones con redes de arrastre constituye una de las principales amenazas para las esponjas en amplias zonas de la plataforma cubana. Grovas-Hernández y Oliva-Mieres (1999) recomiendaron manterner las regulaciones de talla mínima legal para la pesca - 35,6 cm para H. lachne, 30.6 cm para S. obscura (macho cueva), y 20,8 cm para S. pertusa, S. barbara y S. gramine. También los fondos esponjíferos comerciales en el Golfo de Batabanó se han afectado por el incremento de la sedimentación debido, en parte, a la erosión costera producida al desaparecer el frente de mangle rojo en grandes extensiones de la costa sur de la Provincia de la Habana. A causa de ello grandes volúmenes de sedimentos fangosos de la costa se incorporan al agua y a los fondos en grandes extensiones. Los pescadores refieren este fenómeno como la aparición, hace más de 15 años, de “un limo en el agua que mata las esponjas”. Los incrementos marcados de la salinidad en el Archipiélago Sabana-Camagüey amenazan con la eliminación de las esponjas, particularmente en las bahías de San Juan de los Remedios y Nuevitas, donde se observan aumentos de salinidad después de construida la carretera sobre el mar (“pedraplén”) de Cayo Santa María. Se estima que entre salinidades de 36 y 42 partes por mil, aproximadamente 10 especies de esponjas dejan de tener la posibilidad de existir en un sitio por cada incremento de una parte por mil de salinidad (P. Alcolado, inédito). La contaminación orgánica existente en la Bahía de la Habana, reduce dramáticamente la diversidad de especies de esponjas en los arrecifes, y en casos extremos, una gran disminución de su 91 biomasa. En grados intermedios parece existir cierta estimulación del desarrollo y diversificación de las esponjas, en detrimento de los corales pétreos, lo que parece haber estado ocurriendo en los arrecifes del Archipiélago Sabana-Camagüey. La contaminación orgánica también trae como consecuencia la desaparición de pastos marinos ricos en esponjas, entre ellas las comerciales, y la sustitución de éstos por fondos fangosos con aguas turbias y cargadas de sedimentos, no propicios para los poríferos. Ello ha ocurrido en amplias zonas del Archipiélago Sabana-Camagüey (Puerto de Sagua, Ensenada de Cayo Vaca, cercanías de Caibarién, Bahía de Buenavista, etc.). La eutrofización disminuye la transparencia del agua y estimula el desarrollo de algas epifitas, lo que impide el desarrollo de los pastos marinos incluso a poca profundidad. También constituyen amenazas la colecta indiscriminada de esponjas para utilizarlas o venderlas como adorno, en áreas cercanas a asentamientos humanos como las ciudades de La Habana, Matanzas, Varadero, etc, así como el aumento del buceo practicado por turistas y aficionados en todo el país. Se han observado enfermedades y disfunciones en las esponjas asociadas al cambio climático a través del aumento de la temperatura del agua y de los polvos transportados por el viento desde el desierto del Sahara. En la esponja barril Xestospongia muta, tanto en Cuba como en la región del Gran Caribe, se ha observado una enfermedad en la que partes de la esponja se blanquean y se desintegran fácilmente al ser tocadas. En otras áreas del Gran Caribe se mencionan blanqueamientos y otras enfermedades de esponjas (Wetrhus, 1998; Luke, 2001). Según información del Atlas Nacional de Cuba (1970), Páez-Costa (1990a) y del autor, en el Archipiélago Sabana-Camagüey se han perdido fondos esponjíferos en Ensenada de Cayo Vaca, la mitad occidental de la Bahía Buenavista, en Bahía Los Perros y en Bahía Jigüey. En el Golfo de Batabanó se perdieron: en el sur de La Coloma, en el oeste de Ensenada de la Broa, en el este de la Isla de la Juventud y en el extremo sudoccidental y la zona sur central de la Península de Zapata. Las causas incluyen la contaminación orgánica, hipersalinización (bahías de Jigüey y Los Perros), sedimentación y afectación de los fondos por redes de arrastre . Para el uso sostenible y conservación de las esponjas se recomienda: a) controlar y mitigar las causas de la contaminación, la sedimentación y la salinización; b) controlar mejor el esfuerzo de pesca; c) desarrollar el cultivo suspendido de esponjas en tendederas como vía ambientalmente responsable y económicamente viable; d) eliminar el uso de artes de pesca que deterioren los fondos esponjíferos y de arrecifes coralinos; e) regular y controlar la carga de turistas buzos y entrenarlos en el buceo responsable, que evita el daño a la biota; f) regular y controlar la colecta de esponjas (y otros organismos) con fines de artesanía y ornato; g) profundizar en el estudio de la sistemática de las esponjas incorporando análisis molecular. Placozoos – Filo PLACOZOA* Solo se conoce una especie de este filo (Trichoplax adhaerens), muy parecida a las esponjas, la cual habita en fondos marinos de diversas regiones del océano mundial. Son considerados como los metazoos más primitivos conocidos (Ruppert y Barnes, 1994). No se ha registrado en Cuba. Celenterados -Filo CNIDARIA* Este diverso filo comprende organismos muy carismáticos como las hidras, las aguamalas, las anémonas, los corales, las gorgonias y otros que se caracterizan por tener simetría radial, por lo cual son incluidos en la División Radiata del Reino Animal. Presentan cavidad gastrovascular, que realiza 92 funciones de circulación y digestión, y tentáculos que rodean la boca y ayudan a la captura e ingestión del alimento (son generalmente carnívoros). La gran mayoría son marinos, excepto las hidras y otros pocos hidrozoos de agua dulce. La mayoría son organismos sésiles que habitan en aguas someras tropicales, fijos a las rocas o formando parte de los arrecifes coralinos. Se conocen unas 9 000 especies vivientes de este filo, cuyas fórmas fósiles son conocidas desde el Pre-Cambrico, aunque predominantemente desde el Cámbrico, aunque en el Caribe aparecen en el Cretácico (Iturralde-Vinent, capítulo 1). Comprende las clases Hydrozoa (recientemente propuesta como superclase por Boero y Bouillon, 2000), Scyphozoa, Cubozoa y Anthozoa. Celenterados -Filo CNIDARIA: Hidrozoos – Superclase HYDROZOA Susel Castellanos Iglesias 11 Los hidrozoos viven en solitario o formando colonias. Algunos secretan un esqueleto de carbonato de calcio (colenostum), como los hidrocorales formadores de crestas arrecifales (subclase Lepthomedusae o hidrozoos tecados) y otros tienen un exoesqueleto quitinoso flexible (perisarco), que cubre el pólipo o zooide (sub-clase Anthomedusae, hidrozoos atecados; Builon y Boero, 2000). Las colonias de hidrozoos varían en forma y tamaño de acuerdo a la estructura y función que realiza cada pólipo o individuo. Están interconectados los gastrozoides, encargados de la digestión, los gonozoides formadores de medusas durante la reproducción y los dactilozoides, especializados en la captación de estímulos y en la defensa, aunque también favorecen la captura del alimento. Los neumatóforos, son zooides presentes en los sifonóforos que permiten la flotación y la natación. Los millepóridos (orden Capitata) presentan un cilosistema de pólipos; y un gastrozoide central rodeado por 5 dactilozoides cargados de células urticantes llamadas cnidoscistos. Estas células urticantes descargan una sustancia quemante, tóxica y nociva para el hombre, por lo cual estos organismos son conocidos como corales de fuego. Los hidrozoos son muy comunes en el medio marino y en agua dulce, como algunas medusas pequeñas y especies del género Hydra (Ruppert y Barnes, 1994). Tienen un ciclo de vida variable, con períodos estacionales activos o de reposo. Pueden reproducirse continuamente durante todo el año. Algunas especies tienen estadios de medusas que solo pueden vivir días o semanas. Un caso excepcional son los hidrozoos formadores de arrecifes, (familias Milleporidae y Stylasteridae) cuyas estructuras sólidas pueden durar muchos años. En todos los casos se renueva la colonia con individuos jóvenes. Los representantes de las subclases Actinulidae, Trachymedusae, Narcomedusae y Siphonophorae son planctónicos y los que pertenecen a las subclases Anthomedusae, Leptomedusae y Limnomedusae son bentónicos durante su estado de pólipo sésil, que es el predominante. Estos últimos crecen sobre otros animales (epizooicos) o sustrato no vivo Los hidrozoos se destacan por su eficiente función como depredadores muy voraces, por lo que juegan un importante papel en las relaciones tróficas del ecosistema. Su dieta incluye huevos y larvas de muchos invertebrados y peces, copépodos y pequeños crustáceos. La 11 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente Ave.1ra, No.18406 Rpto. Flores. Playa. La Habana, Cuba. C.P. 12100, Cuba. susselc@yahoo.es 93 intensidad de depredación diaria de algunas especies de hidroides sugiere que la contribución en la transferencia de energía del plancton al bentos es mucho mayor que la sugerida solamente por los valores de biomasa de los hidrantes (Gili, et al., 1996) y es posible que pueda afectar la abundancia de larvas de peces (Alvariño, 1980b). Los hydrozoos forman asociaciones simbióticas con otros organismos como foresia, mutualismo y comensalismo (Mackie et al., 1987). Estas relaciones inter o intra-específicas dan la posibilidad a los científicos de predecir el resto de los componentes faunísticos (Zamponi, 1983), cuando uno de ellos no está presente en la asociación conocida, ya sea por estrés o alguna otra causa de origen natural o antrópica. Algunas especies del género Hydractinia, forman densas incrustaciones sobre las conchas ocupadas por cangrejos hermitaños (macaos), brindándoles aparente protección contra los depredadores (Ruppert y Barnes, 1994) o como un mecanismo de respuesta ante el estress de las condiciones ambientales (Damián, 2003). Los hidrozoos planctónicos, como los sifonóforos, son reconocidos como indicadores de condiciones oceanográficas, movimientos de masas de aguas, giros ciclónicos, afloramientos y forman parte importante de las capas dispersoras de sonido (Gasca, 2002). Investigaciones bioquímicas evidencian el potencial de algunas especies para la producción de fármacos (Stepanjants, 1998). Las especies del género Obelia, presentes en Cuba, están asociadas al fenómeno de la bioluminiscencia. Este carácter se relaciona con una proteína Ca-dependiente (Morin y Raynolds, 1974; Freeman y Ridway, 1986) llamada Obelina, la cual tiene un gran potencial de uso en el diagnóstico temprano de enfermedades malignas. Los Hidrozoos, con aproximadamente 3 260 especies conocidas a nivel mundial (Schuchert, 1997), son muy diversos y abundantes gracias a su alta capacidad de adaptación para colonizar muy diferentes hábitats en un amplio rango de profundidades y temperaturas. Son comunes desde el Antártico hasta las zonas tropicales y están presentes en los arrecifes, los manglares y los pastos marinos. Frecuentemente se encuentran adheridos a las rocas, conchas, pilotes de los muelles y a otros organismos. Pueden ser muy abundantes en zonas neríticas y epipelágicas hasta 200 m, aunque también están presentes en las zonas batial y abisal (Vervoort, 1966). Se han encontrado en las fuentes hidrotermales profundas, entre 540 m y 4 578 m (Calder y Vervoort, 1998). Algunos hidrozoos son cosmopolitas, como el género Obelia (Cornelius, 1982a). La fijación de muchas especies sobre los cascos de los barcos sugiere uno de los más probables mecanismos de su amplio rango de distribución (Stepanjants, 1998). Una intensa sedimentación inhibe la fijación de algunas especies de hidrozoos (Genzano et al., 2002). El epizoismo, determinado por el crecimiento de pequeñas colonias de hidrozoos sobre otros celenterados por encima del nivel del sustrato, se plantea que es un mecanismo para evadir los sedimentos y para el alcance de las rápidas corrientes enriquecidas de nutrientes, más que una respuesta a la competencia por el espacio. Los metales pesados y otros elementos tóxicos afectan el crecimiento de las colonias de hidrozoos (Genzano et al., 2002). Calder (1991; 1992; 1997) registró 93 especies de Hidroides para la plataforma de Bermudas, mientas que Gasca (1993, 2002) encontró 72 especies de sifonóforos en el Golfo de México y 42 en el Mar Caribe. En Cuba se han registrado 109 especies (ver lista en este CDROM), 60 de ellas pertenecientes a la clase Hydroidomedusae, 28 a la subclase Siphonoforae y 21 a los órdenes Capistata y Filifera (Lalana. et al., 2001). Podemos asumir que el número de especies debe ser bastante mayor ya que este grupo ha sido poco estudiado en el país El sifonóforo conocido como barquito portugués o fragata portuguesa, Physalia phisalys, tiene tentáculos cubiertos de células urticantes (cnidoscitos) de 10 a 15 metros de longitud. En dependencia del tamaño y la sensibilidad de la victima, el veneno descargado por los 94 cnidoscitos por contacto puede llegar a causar la muerte. Este hidrozoo arriba a nuestras costas principalmente desde el inicio de la primavera y durante el verano ocasionando graves daños a los bañistas. Tanto o más peligrosos por las fuertes quemaduras que producen, son los hidrocorales Millepora complanata y M. alcicornis (conocidos como corales de fuego), muy abundantes en los arrecifes coralinos de Cuba. Los hidroides atecados Halochordile disticha e Hydractinia sp. son también muy urticantes y comunes sobre rocas, pilotes, corales y gorgonias en aguas costeras. Algunas especies de hidrozoos representadas en la plataforma insular de Cuba. En los meses de primavera es muy común encontrar en las aguas costeras cubanas, aglomeraciones gelatinosas, popularmente conocidas como “caribe”, (en inglés – seabather´s eruption), las cuales causan lesiones en la piel cubierta por la ropa de los bañistas, buzos y pescadores. Este fenómeno está asociado probablemente a la presencia de organismos urticantes como los hidrozoos (en sus fases de pólipo y/o medusa) y las anémonas. Mediante análisis serológico de los pacientes afectados, se ha comprobado que esta erupción es provocada, entre otras causas, por los estadios larvales de la medusa Linunche unguiculata (Cnidaria, clase Scyphozoa; Vidal Haddad et al., 2001), conocida como dedalillo y que puede ser un componente del “caribe”. La presencia de estos organismos, muy comunes sobre las raíces de los mangles y la vegetación marina, son los causantes de las frecuentes lesiones quemantes que afectan a los pescadores de las aguas cubanas durante la faena diaria de trabajo. Halochordile disticha (a la izquierda) es un hydrozoo atecado muy común en las aguas tropicales y muy urticante al contacto con la piel del ser humano; es conocido como arbolito de navidad. Millepora alcicornis (a la derecha) es un hidrozoo atecado, que presenta u exoesqueleto de carbonato de cálcio y se destaca por um ciclosistema de pólipos muy urticantes, de ahi su nombre común, coral de fuego. Es uno de los principales formadores de crestas coralinas, junto com los corales pétros (Fotos: Noel López). 95 Especies de sifonóforos presentes en Cuba, catalogadas como relativamente raras, fueron colectadas en un estudio sobre composición y abundancia del plancton, en el Golfo de México. Entre estas especies están Lensia fowleri , Ceratocymba leuckarti y Abyla haeckeli (SuarezMorales, et al., 2002). Alvariño (1974) y Michel y Foyo (1976), consideraron a Bassia bassensis como rara para el Mar Caribe, sin embargo, Gasca (1999) la reportó con las mayores densidades en las aguas superficiales de las costas mexicanas del Caribe. Macrorynchia allmani (izquierda) es común en los sustratos rocosos de los arrecifes coralinos, principalmente sobre las paredes de taludes y techos sombreados de solapas. Sertularella diphana (derecha) es común en los arrecifes coralinos, de coloración rosada en el medio natural, resalta por su forma de pluma, sobre sustrato rocoso asociada a esponjas incrustantes, algas y bordes de colonias de corales. (Fotos: Noel López) Los registros de hidrozoos en Cuba se han limitado a muestreos generales del plancton y del bentos, en pastos marinos y arrecifes pocos profundos de las zonas noroccidental y norte central (Juarez –Fernández, 1965; Ortiz, 1995; 2000a; 2001b; Lalana, et al., 2001). No se han realizado muestreos en las zonas al sur de Cuba y tampoco en biotopos tales como los manglares, fondos blandos y el batial superior. Medusas - Clases SCYPHOZOA y CUBOZOA* Incluye Cnidarios con formas predominantemente medusoides conocidas como “aguamala”. Se conocen unas 200 especies de Scyphozoa que habitan desde las aguas frías hasta las tropicales, algunas a gran profundidad. Comprende los órdenes Stauromedusae o Lucernariida (sésiles), Coronatae (campana con profundas estrías, generalmente de aguas profundas), Semaeostomae (con campana en forma de plato y márgenes festoneados, común en todos los mares del mundo) y Rhizostomae (campana sin tentáculos, en aguas tropicales y subtropicales). Estas son parecidas a las hidromedusas de Cubozoa. De esta última (antes considerada un órden de Scyphozoa) se conocen solo unas 15 especies, todas las cuales habitan en mares tropicales o subtropicales. La mayoría de las especies de ambos grupos son pelágicas pero prefieren las aguas costeras. Por su tamaño y la presencia de nematocistos tóxicos, estas especies constituyen un peligro para los bañistas en las playas (Ruppert y Barnes, 1994). No obstante, por esta misma característica constituyen potenciales portadores de sustancias biológicas activas con perspectivas farmacológicas. En Casiopea xamachana por ejemplo, se han encontrado compuestos con efectos sobre receptores colinérgicos. En general estas clases han muy sido pobremente estudiadas en Cuba. 96 Aurelia aurita (Scyphozoa del órden Semaeostomae), una de las más conocidas medusas pelágicas de aguas superficiales, tiene una amplia distribución en aguas tropicales y subtropicales. Se alimenta del plancton que atrapa el mucus que cubre su campana ciliada. Es medianamente tóxica y su contacto puede producir erupción de la piel y picazón. Casiopea xamachata (orden Rhizostomae), muy común en Cuba, Florida, Bahamas y en casi todo el Caribe, puede ser muy abundante localmente. Habita preferentemente en aguas tranquilas cerca de los manglares y en macrolagunas con poca circulación de las aguas. Generalmente descansa sobre el fondo con los filamentos orales hacia arriba para acelerar el crecimiento de las algas zooxantellas con las cuales viven en simbiosis y que les suministran parte de su alimento. Gracias a ello, con condiciones adecuadas de iluminación puede sobrevivir y crecer duranre mucho tiempo, utilizando los productos fotosintéticos de las algas. Las casiopeas son medianamente tóxicas, y el contacto con la piel puede ser urticante y producir erupciones y picazón. Su disco puede alcanzar de 15 a 30 cm de diámetro. 97 La medusa bala de cañón, Stomalophus meleagris (Scyphozoa, orden Rhizostomae), aunque no muy abundante, aparece ocasionalmente en aguas costeras superficiales de la Florida y el Caribe. Alcanza hasta 18 cm de diámetro. Generalmente mantiene simbiosis con pequeños peces pelágicos. No presenta efectos urticantes. Clase ANTHOZOA* La clase Anthozoa comprende un grupo de cnidarios muy diverso, con más de 6 000 especies que incluyen organismos muy conocidos como los corales, las anémonas marinas, las gorgonias y las plumas de mar. A diferencia de los Scyphozoa (forma de medusas), los antozoos tienen el cuerpo en forma de pólipos, que pueden ser solitarios o coloniales, en los cuales el estadío medusoide está ausente. No obstante, la mayoría son coloniales que alcanzan gran talla, aunque sus pólipos individuales son generalmente pequeños. Se divide en dos subclases: Zoantharia (o Hexacorallia) y Octocoralia. Esta última incluye los órdenes Stolonífera (estoloníferos), Telestacea (telestaceos), Alcyonacea (corales blandos y gorgonias), y Pennatulacea (plumas de mar) de los cuales se resume a continuación solo el órden Alcyonacea por su gran importancia y por el nivel de conocimientos alcanzado en el grupo. En la subclase Zoantharia se incluyen los órdenes Zoanthidea (zoantídeos), Actiniaria (anémonas), Scleractinia (corales pétreos), Rugosa o Tetracoralla (tetracorales), Corallimorpharia (coralimorfarios), Ceriantharia (anémonas tubulares) y Antipatharia (corales negros). Celenterados – Filo CNIDARIA: Clase ANTHOZOA, Subclase OCTOCORALLA, Gorgonias - Orden ALCYONACEA Sergio González-Ferrer 12 12 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente Ave 1ra. # 18406, Playa, La Habana, C.O. 12100, Cuba. azuladomarino@hotmail.com 98 Los octocorales también son conocidos como gorgonios, gorgonias, gorgonarios, gorgónidos y también como gorgonáceos, término este último que ya no se considera aceptable de acuerdo con Bayer (1981) y Sánchez et al. (en prensa). Se incluyen en este grupo aquellos pólipos coloniales que poseen ocho tentáculos rodeando la boca y son capaces de construir un endoesqueleto córneo flexible. Dicho esqueleto está formado por una varilla central, compuesta por partículas calcáreas unidas o fusionadas (Suborden Scleraxonia), o por una sustancia orgánica denominada gorgona, compuesta por proteínas y mucopolisacáridos con algún grado de calcificación (suborden Holaxonia). Rodeando este eje se presenta una gruesa mesoglea, perforada por tubos gastrodérmicos, que comunica las cavidades gastrovasculares de los pólipos, y por hendiduras que permiten que éstos se oculten ante condiciones desfavorables. Los pólipos de las gorgonias tienen en su mayoría zooxantelas simbiontes que les garantizan la mayor parte de sus requerimientos alimentarios. Las colonias de algunas especies como Eunicea mammosa suelen ser muy ramificadas, otras como Gorgonia ventalina fusionan sus ramas a modo de enrejado, mientras que las colonias de Ellisella barbadensis carecen de ramificaciones. Otras especies como Briareum asbestinum y Erythropodium caribaeorum tienen formas incrustantes, y algunas como Plexaura homomalla (Jordan, y Nugent, 1978) pueden cambiar su forma en dependencia del ambiente que colonizan. En el caso de las especies zooxanteladas, el crecimiento de las ramas puede ocurrir en el sentido de la penetración de la luz, por lo que se pueden presentar formas arqueadas o inclinadas que han crecido sobre sustratos más o menos verticales. La coloración de las gorgonias resulta variable, dependiendo de las características y concentraciones de las zooxantelas, de los pigmentos presentes en los tejidos de los pólipos y de los minerales coloreados que componen las espículas calcáreas embebidas en los tejidos. Las gorgonias habitan los sustratos duros tropicales y subtropicales, resultando muy abundantes principalmente en los arrecifes. Según García-Parrado (1997) los miembros de este grupo también se pueden encontrar en aguas interiores y estuarinas, donde son capaces de tolerar las variaciones de salinidad típicas de esos ambientes, y en profundidades de hasta 4 000 m. En la composición y diversidad de las asociaciones de gorgonias influyen factores como la iluminación, la profundidad, la temperatura, la salinidad, la topografía del relieve, el régimen hidrometeorológico, la naturaleza del sustrato y la presencia de sedimentos o contaminantes. Las gorgonias desempeñan un importante papel en los arrecifes gracias a su abundancia y longevidad, a su diversidad y complejidad estructural; el reciclaje de nutrientes (en el caso de las especies azooxanteladas que generan desechos), la formación de arenas (dada por el aporte de espículas); y la captura y sedimentación de partículas, por sus formas estilizadas (Gil, en línea). Esto último beneficia, en algunos casos, la obtención de alimento por parte de los organismos sésiles más próximos al suelo y contribuye a la deposición y consolidación de los sedimentos en los arrecifes. Muchas especies de gorgonias sirven de escondite a los peces, otras soportan parásitos, como algunos copépodos y cangrejos del género Balanus (Hernández-Muñoz, 2004), o sirven de alimento a peces como el parche rayado, Chaetodon capistratus, a moluscos del género Cyphoma o al poliqueto Hermodice carunculata. Algunas especies zooplanctófagas de ofiuroideos, crinoideos y tunicados encuentran en las ramas de las gorgonias una posición ventajosa para la colecta de sus alimentos. Las gorgonias son utilizadas por los ecólogos en las evaluaciones del estado ambiental de los ecosistemas que colonizan. Por ejemplo, algunas, especies como Eunicea calyculata forma typica, E. mammosa, E. tourneforti, Gorgonia flabellum, G. ventalina, Muricea muricata, Eunicea flexuosa, Plexaurella dichotoma, Pterogorgia anceps, P. citrina y P. guadalupensis, pueden ser indicadoras de tensión hidrodinámica a partir de las características de los escleritos de su eje esquelético y la mayor 99 o menor presencia de ramas. (Alcolado et al., 1980; Alcolado, 1981; Herrera, 1991; García-Parrado, 1997). Otras como Briareum asbestinum, Eunicea clavigera, Plexaura kuekenthali, Pterogorgia anceps, P. guadalupensis y P. citrina poseen ramas aplanadas o la superficie poco irregular, lo que les permite evitar la acumulación de sedimentos en ambientes sometidos a dicho estrés. Algunas especies como Plexaura kuekenthali, E. flexuosa, Eunicea tourneforti, E. calyculata forma coronata y E. calyculata forma typica, entre otras (Herrera y Alcolado, 1983; Herrera, 1991; HernándezMuñoz, 2004), tienen características hasta ahora no identificadas que las hacen resistir ambientes con algunas formas de contaminación. En Cuba se han registrado 68 especies de gorgonias (García-Parrado y Alcolado, 1996; ver listado en este CD-ROM). Se destacan entre éstas por su abundancia a pocos metros de profundidad (zonas de crestas o bajos coralinos) Gorgonia flabellum, Muricea muricata, Eunicea mammosa, E. tourneforti y Eunicea flexuosa. En las terrazas rocosas (5 a 10 m de profundidad) son frecuentes E. mammosa, E. flexuosa, Plexaurella dichotoma, Pseudopterogorgia americana, Gorgonia ventalina y Muriceopsis flavida. En fondos más tranquilos, de relieve más irregular (a profundidades entre 15 y 20 m), P. kuekenthali, Eunicea calyculata forma coronata, Briareum asbestinum, Pseudopterogorgia americana y E. flexuosa, son con frecuencia muy conspicuas y abundantes. Principales formas de las colonias de gorgonias y tipos de distribución de su ramas. Especies como Eunicea flexuosa y Pseudopterogorgia sp. suelen ser utilizadas en la confección de adornos de mesa y prendas como collares, aretes y pulsos, dada la similitud de estos artículos con los obtenidos de los corales negros (Antipathes sp.). Las gorgonias se emplean como materia prima para la obtención de sustancias con propiedades antivirales (Cimino et al., 1984), antibacterianas (Jensen et al., 1996), antinflamatorias (Jacobson y Jacobs, 1992), antitumorales (Rodríguez y Martínez, 1993), acaricidas (García-Parrado, 1997), así como prostaglandinas (Gerhart, 1986). Estos elementos, según García-Parrado (1997), se sintetizan en las colonias con fines defensivos, dado que la protección que brindan los cnidocitos resulta insuficiente en el caso de las gorgonias. Se destacan Pseudopterogorgia americana, de la cual se extrae un potente antitumoral conocido como “Coralán”, y Plexaura homomalla, en la que se han encontrado grandes concentraciones de prostaglandinas, un producto de gran utilidad en la medicina humana y veterinaria (García-Parrado, 1997). Las gorgonias del Caribe son muy populares entre los acuaristas por su durabilidad, belleza y variedad y constituyen un singular espectáculo para los buceadores. 100 Pseudopterogorgia americana (Foto: Noel López) Eunicea calyculata forma typica (Foto: Fonseca) Gorgona ventalina (Foto: Noel López) De los grupos zoológicos sésiles que habitan la plataforma marina de Cuba, las gorgonias son uno de los más estudiados desde el punto de vista ecológico y farmacológico. Sin embargo, estos estudios se circunscriben principalmente a la costa norte de Cuba y mayoritariamente a los arrecifes costeros de las provincias La Habana y Ciudad de La Habana. El conocimiento acerca de las poblaciones de gorgonias en la costa sur de Cuba es muy pobre, y el de las especies de aguas profundas es casi nulo. Entre las amenazas que pueden provocar problemas irreversibles a las gorgocias se cuentan enfermedades como la aspergilosis, la banda negra; los daños por la acción devastadora de algunos corales como Millepora alcicornis y M. complanata, que colonizan el esqueleto de la colonia eliminando el tejido vivo; el sobrecrecimiento de algas en zonas afectadas de sus estructuras, y en menor medida la pérdida de zooxantelas (blanqueamiento). En general, las comunidades de gorgonias están afectadas por los tensores que generan malas condiciones ambientales en los arrecifes coralinos, así como por la extracción no sostenible de algunas de sus especies como materias primas para la producción de fármacos y artesanías. Celenterados – Filo CNIDARIA: Clase ANTHOZOA, Subclase ZOANTHARIA, corales pétreos - Orden SCLERACTINIA. Sergio González-Ferrer12 En el orden Scleractinia se agrupan las especies de la clase Anthozoa con pólipos capaces de secretar un exoesqueleto basal de carbonato de calcio (aragonito). Estas son conocidas popularmente como corales pétreos. Estos animales poseen una corona de tentáculos rodeando la boca en el extremo apical, mientras que en el extremo basal producen un cáliz tabicado que les garantiza un sustrato para su fijación y refugio ante sus depredadores. Los corales escleractinios pueden estar formados por un pólipo único fijo a su estructura calcárea, cuya talla generalmente es de pocos centímetros, o por varios pólipos de la misma especie interconectados, generalmente menores de 1 cm, que pueden llegar a formar colonias pétreas de varios metros de envergadura. Los pólipos de los corales pétreos se alimentan principalmente de zooplancton o eventualmente de pequeños crustáceos o peces que pueden digerir extra-corporalmente. Una parte de ellos se conocen como corales zooxantelados, ya que poseen en sus tejidos millones de algas 101 unicelulares simbiontes conocidas como zooxantelas. Estas algas les aportan a los pólipos el 98 % o más de sus productos fotosintéticos (Delbeek y Sprung, 1994), favoreciendo sus procesos de crecimiento, reproducción y también la calcificación (Younge, 1963; Barnes, 1985; Prahl y Erhardt, 1985; Muller-Parker y D`Elia, 1997). El pólipo por su parte le aporta al alga soporte y protección en sitios con buenas condiciones de iluminación, CO2 proveniente de su respiración, y fertilizantes procedentes de los desechos metabólicos de su alimentación. Los escleractinios zooxantelados han sido los principales responsables de la formación de arrecifes coralinos, desde el período Paleógeno de la era Cenozoica hasta la actualidad. Éstos en su mayoría, se encuentran restringidos a las aguas transparentes tropicales y subtropicales, requieren de salinidades similares a las de las aguas oceánicas, buenas condiciones hidrometeorológicas y un sustrato sólido para la fijación. En general, pocos corales zooxantelados consiguen aproximarse a los 100 m de profundidad o habitar latitudes superiores a los 30º norte y sur. Los escleractinios azooxantelados se establecen generalmente en sustratos protegidos de la luz, a profundidades que fluctúan desde unos pocos cm hasta más de 6 000 m. Los corales pétreos constituyen las estructuras arrecifales más importantes para la protección de las costas contra la erosión; son uno de los principales productores de arena para la creación y mantenimiento de las playas y conforman el elemento estructural principal de los arrecifes coralinos, el ecosistema más destacado de los mares tropicales. Estos animales facilitan refugio, alimento o sustrato a innumerables organismos. Según Smith (1978), los corales participan activamente en el balance químico del océano y en el balance de CO2 del planeta. Desde el punto de vista geológico los escleractínios constructores de arrecifes han contribuido significativamente a la ampliación de los límites geográficos de las plataformas de los continentes e innumerables islas en las zonas cálidas. Las estructuras arrecifales fósiles y emergidas originadas por los corales pétreos son fuente de materias primas como arena, cal, bloques o losas para la construcción. Gran parte del petróleo y el gas que se extrae actualmente provienen de antiguos arrecifes (Hallock, 1997; Cortés, 2001), erigidos fundamentalmente por el crecimiento de los corales escleractinios. Muchas personas de las comunidades costeras emplean los esqueletos de estos corales en la elaboración de artesanías, y son fuente de inspiración en manifestaciones artísticas como la pintura y la fotografía. Por ser organismos sésiles de lento crecimiento y gran longevidad, algunas colonias, principalmente de los géneros Montastraea, Siderastrea y Dendrogyra, almacenan información sobre las condiciones ambientales, que pueden ser utilizadas para inferir las variaciones climáticas y oceanográficas, y su composición específica puede ser utilizada como bioindicador del estado ambiental (JiménezCenteno y Rixen, 2004). Además, se cuentan entre los organismos más vistosos de los arrecifes, atractivos para el turismo, lo que genera cuantiosos ingresos. Según Cairns (1999) se conocen 1 314 especies de escleractinios en el mundo. De éstas 645 son corales zooxantelados, 658 son corales azooxantelados y 11 se han encontrado con o sin zooxantelas. Del total de escleractinios zooxantelados, solamente alrededor del 12 % se encuentra en el océano Atlántico. Esto es resultado de las extinciones masivas provocadas por los cambios geográficos y ambientales ocurridos fundamentalmente entre el Mioceno y el Pleistoceno (GonzálezFerrer e Iturralde-Vinent, 2004) a lo que se suma que el área cálida del Atlántico es comparativamente menor que la de los océanos Indico y Pacífico (Schuhmacher, 1978). En Cuba se han registrado 133 especies de corales escleractinios, de los cuales 55 son zooxantelados y 78 son azooxantelados. Se han dedicado muy pocos esfuerzos al estudio de los corales azooxantelados, por lo que se supone que el número de especies registradas se incremente en el futuro, y por lo tanto de corales pétreos en general. 102 Formas más comunes de los corales escleractínios Se destacan las especies Acropora palmata, A. cervicornis, Diploria strigosa y D. clivosa por su contribución en la formación de crestas y bajos coralinos. Las especies Agaricia agaricites forma agaricites, A. humilis, Montastraea annularis, M. faveolata, Siderastrea radians, S. siderea, Stephanocoenia intersepta, Porites astreoides, P. porites y P. furcata se caracterizan por su constancia y abundancia en casi todos los ambientes arrecifales de fondos duros. Las especies Agaricia lamarckiana y A. agaricites forma purpurea son más comunes en las zonas arrecifales profundas; mientras que las especies Manicina areolata y Cladocora arbuscula, se encuentran generalmente sobre fondos no consolidados, poco profundos. También se destacan el coral zooxantelado Eusmilia fastigiata cuya forma guacanayabensis se considera endémica del Golfo de Guacanayabo (Zlatarski, 1982), y el coral azooxantelado Trematotrochus corbicula, por considerarse hasta el momento una especie endémica de Cuba (González-Ferrer y Cairns, 2004). Colpophyla natans (Foto: Sergio González) Leptoseris cucullata (Foto: Sergio González) De acuerdo con Alcolado et al. (2001 a, b) y González-Ferrer et al. (2003), se destacan con las mejores condiciones de salud de los corales: los arrecifes de Cayo Sigua y sur del Anillo de Cazones “Nirvana”, en el Archipélago los Canarreos; las crestas “Pequeño Edén” (nordeste de Cayo Caballones) y la de Cayo Mates sur, así como los arrecifes frontales del Canal de las Mulatas, Mulatas este, Cayo Cinco Balas y Boca de Juan Grin en Jardines de la Reina; y las crestas de los cayos Dattón y Fragoso, así como el arrecife frontal al este de cayo Coco, en Sabana-Camagüey. Los corales escleractinios se cuentan entre los primeros indicadores para evaluar la calidad ambiental de los arrecifes de Cuba. En este sentido merece especial atención la especie Acropora palmata, por su sensibilidad a las alteraciones de las condiciones ambientales normales; su rápido crecimiento en condiciones adecuadas en comparación con la mayoría de las especies; su esqueleto robusto, que perdura guardando evidencias de condiciones ambientales pasadas; y su crecimiento en sitios poco profundos, lo que facilita su observación. Otra aplicación del uso actual de los corales en Cuba la tenemos en la especie Porites porites, cuyos esqueletos se utilizan como materia prima en la producción de un biomaterial conocido como hidroxiapatita porosa Coralina® (HAP-200), que ha 103 tenido una gran aplicación en ramas de la medicina como la neurocirugía, la ortopedia, el tratamiento de afecciones maxilofaciales y en implantes oculares. De los estudios ecológicos realizados en los últimos años se conoce que los corales han sufrido más los problemas de escala regional (incremento de las temperaturas, enfermedades, huracanes, alta competencia con las algas por el dominio del sustrato) que los de tipo local antropogénico (contaminación, sobrepesca, daños náuticos y de buceo) . Por otra parte, la acción humana sobre los corales pétreos sin la debida proyección de carácter sostenible muchas veces resulta más devastadora al término de un año que el paso de un huracán. Porites asteroides, invadido por una esponja incrustante (Foto: Susana Perera) En muchos arrecifes, las poblaciones de las especies Acropora palmata, A. cervicornis y M annularis (sl) entre otras, sufrieron mortalidades masivas que se traducen actualmente en elevados índices de mortalidad antigua. Las enfermedades de corales más frecuentes en Cuba son la banda negra, la plaga blanca, las manchas negras y el blanqueamiento. Se le ha prestado especial atención a la recuperación de las colonias de Acropora palmata (Alcolado et al., 2001a, b; González-Ferrer 2001, 2003), por ser los pilares estructurales principales de las formaciones de crestas coralinas. Esta recuperación está sucediendo de forma “parcheada” y no homogenea a lo largo de los arrecifes, por el proceso de recape de las partes muertas (oversheeting) y por la presencia de colonias jóvenes resultantes de los procesos de reclutamiento. El recape ocurre preferentemente en las partes de las ramas más expuestas al sol y posteriormente va irradiándose hacia el resto. Por eso en algunas crestas del Archipiélago Sabana-Camagüey al observar las poblaciones de A. palmata desde la superficie, da la impresión de una recuperación del 100%, sin embargo al observar las colonias desde el fondo se puede ver como el recapamiento no alcanza, hasta el momento, las partes más sombreadas de las ramas que se mantienen expuestas a otros organismos colonizadores (González-Ferrer et al., 2003). 104 Diploria labyrinthiformi (Foto: Andrés Jiménez Castillo) El conocimiento sobre los corales escleractinios de Cuba se puede considerar insuficiente hasta el momento, si tenemos en cuenta que los estudios se han concentrado en los corales zooxantelados, que representan el 41 % del total. Los trabajos sobre esas especies han sido encaminados fundamentalmente a la sistemática de los corales y de los organismos asociados (Zlatarski y Estalella, 1980, 1982; Estalella, 1986) y a evaluar su distribución, cubrimiento, resistencia frente a diferentes condiciones ambientales y tallas de las especies en los arrecifes (Herrera y Martínez-Estalella, 1987, Guardia y Gonzáles-Sansón, 1997 a, b; 2000; Herrera, 1990; Caballero, 2002, entre otros). Otros estudios se han orientado a la evaluación del estado de salud de sus poblaciones (protocolos CARICOMP, 1994 y AGRRA: Gingsburg et al., 1998; Alcolado et al., 2001a, b; González-Ferrer 2001, 2003). Las áreas mejor estudiadas son el Archipiélago SabanaCamagüey (principalmente al norte de Cayo Coco); el Archipiélago Jardines de la Reina, (principalmente al sur de los Cayos Anclitas hasta Caballones); el Archipiélago de Los Canarreos, (fundamentalmente en las cercanías de Cayo Largo del Sur); cayo Levisa en el Archipiélago de los Colorados; así como los arrecifes al norte de las provincias Habana, Ciudad de La Habana y Matanzas; Playa Larga-Playa-Girón al sur de Matanzas, los de María la Gorda en Pinar del Río y los del este de la Isla de la Juventud.. Temas como las interacciones entre especies de coral, poblaciones de simbiontes, períodos reproductivos, tasas de crecimiento, esclerocronología, trasplantes y cultivo artificial, entre otros, no han sido desarrollados hasta el momento. Anémonas, coralimorfarios y zoantídeos - Celenterados – Filo CNIDARIA: Clase ANTHOZOA, Subclase ZOANTHARIA, Anémonas, coralimorfarios y zoantídeos – Ordenes: ACTINIARIA, CORALLIMORPHARIA y ZOANTHINIARIA Carlos Varela 13 13 Centro de Investigaciones Marinas, Universidad de La Habana Calle 16 No. 114, entre 1ra. y 3ra., Miramar, Playa, CP 11300, Ciudad Habana, Cuba cvarela@cim.co.cu 105 . Con el nombre de anémonas se conocen representantes de tres órdenes de zoantarios en forma de pólipos, solitarios y algunos coloniales, sésiles, con más de ocho tentáculos y septos, generalmente en ciclos de seis. Las verdaderas anémonas o actiniarios, los coralimorfarios y los zoantídeos forman parte de los cnidarios más evolucionados debido a que presentan un estrato intermedio que puede ser desde una mesoglea, semejante a la de las medusas de la clase Scyphozoa, hasta la presencia de parénquima en las especies más complejas. Todas las especies de estos órdenes son marinas y su mayor diversidad se observa en las aguas tropicales someras, aunque se han colectado a más de 5 500 m de profundidad. Los actiniarios son, en su gran mayoría, especies solitarias a diferencia de los restantes cnidarios sésiles. Sus pólipos presentan en su región aboral un disco pedal, el cual generalmente es aplanado y se adhiere con fuerza al sustrato. Estos cnidarios aparecen frecuentemente en fondo rocoso, como habitantes de los arrecifes coralinos, aunque también en los pastos marinos y fijados a las raíces de los mangles. Los coralimorfarios se encuentran generalmente en agrupaciones y es frecuente ver algunos unidos por las proyecciones de su base. La columna de estos organismos es lisa y ligeramente más rígida que la de los actiniarios. Los zoantídeos presentan una base estolonal de la que se yerguen los individuos, casi paralelos entre sí. Los tentáculos, a diferencia de los dos órdenes anteriores están dispuestos en dos ciclos alrededor del margen del disco oral. Este órden ha sido menos estudiado que los dos anteriores. Al igual que los corales, algunos representantes de estos órdenes poseen zooxantelas, en asociación simbiótica. Estas microalgas se encuentran fundamentalmente en los tentáculos y el disco oral. Las especies de anémonas que poseen estas algas suelen vivir en lugares claros y someros donde es posible la entrada de la luz solar, necesaria para que las algas realicen la fotosíntesis. Muchos de los representantes de estos grupos ostentan llamativos colores, lo cual les confiere una singular belleza. Por ello, son altamente valorados por los aficionados a la acuariofilia y se exhiben en la mayoría de los acuarios. Por otra parte, muchos de estos organismos son portadores de sustancias bioactivas, como son los inhibidores de las proteasas, con importantes aplicaciones farmacológicas, por lo que son objeto de investigación a nivel mundial Muchas de las especies de estos grupos provocan una toxicidad relativa en aquellas personas que las manipulan. Su contacto puede producir desde erupciones en la piel hasta llegar a causar serios trastornos alérgicos a personas sensibles a sus toxinas. Desde finales del siglo XIX se presentaron los primeros registros de estos cnidarios en aguas de la plataforma cubana, pero solo a partir de los ochenta se les ha prestado cierta atención. Se han registrado 26 especies de anémonas marinas: 5 de coralimorfarios, 7 de zoantídeos y 14 de actiniarios, todos ellos habitantes de la zona litoral, hasta los 50 m de profundidad (Herrera-Moreno, 1981; Lalana et al., 2001; Varela, 2002; Varela et al., 2001; 2002; 2003, Varela y Arias, 2004; PérezHernández y Varela, en prensa;). En los dos primeros casos dicho número de especies está muy cercano al reportado para el Atlántico occidental tropical y el Mar Caribe, mientras que en el caso de las verdaderas anémonas, representa más de la mitad. 106 La mayoría de las anémonas prefieren los fondos duros para su fijación. El zoantideo Zoanthus pulchelus habita preferentemente en la zona intermareal rocosa, mientras que Bartholomea annulatta prefiere las oquedades y grietas del fondo y Calliactis tricolor se fija en la concha de los gasterópodos que sirven de refugio a los macaos y anomuros. Aiptasia pallida, sin embargo, es más frecuente sobre las raices de los mangles. En la zona intermareal rocosa, es muy frecuente encontrar especies como Bunodosoma granulifera, Isoaulactinia stelloides y Phyllactis flosculifera. Estas dos últimas anémonas en ocasiones pueden quedar completamente fuera del agua al bajar la marea. Las mismas pueden fijar a su columna, con las ventosas que poseen, pequeñas piedras y granos de arena con los cuales se recubren y esto les ayuda a resistir la desecación. Otra especie que puede hallarse también en esta zona es el zoantídeo Zoanthus pulchellus. Condylactis gigantea, al igual que Stichodactyla helianthus, actualmente se estudian en Cuba para la obtención de sustancias con fines terapéuticos para enfermedades asociadas a alteraciones en el mecanismo proteolítico como el asma bronquial, trastornos en la coagulación, pancreatítis, cáncer y artritis reumatoidea. Tambien Bunodosoma granulifer y Phyllactis flosculifera son objeto de investigación por su potencial farmacológico (ver Capítulo 4, Productos de la Biotecnología). Bunodeopsis globulifera se encuentra en pastos marinos, sobre las hojas de Thalassia testudinum. El contacto de esta pequeña anémona con la piel produce una ligera irritación. En este hábitat también es posible encontrar agrupaciones de Stichodactyla helianthus. Condylactis gigantea (Foto: Rafael Mesa). Bunodeopsis globulifera (Foto: Noel López), En el sublitoral rocoso aparece una mayor abundancia de especies, donde prácticamente están representadas todas las registradas para Cuba. En esta zona es muy frecuente observar la especie Stichodactyla helianthus que forma agrupaciones o parches, algunos de ellos de varias decenas de individuos. Otras especies que también aparecen formando agrupaciones son los coralimorfarios 107 Ricordea florida y Discosoma sanctithomae. En algunas zonas el zoantídeo Palythoa caribbaeorum puede tapizar el fondo, llegando en algunas ocasiones a competir con los corales por el espacio. En rocas aisladas también es posible observar ejemplares de los actiniarios Condylactis gigantea y Bartholomea annulata. El zoantídeo Zoanthus sociatus en ocasiones, puede cubrir extensas áreas de este tipo de fondo. La mayoría de estas especies ocupan oquedades y grietas del fondo, siendo solamente visibles los tentáculos en muchos casos, tal como ocurre con Condylactis gigantea, que es la especie que alcanza la mayor talla y Bartholomea annulata. Lebrunia danae, por el día, extiende los falsos tentáculos muy ramificados a la entrada de su refugio, por lo que puede ser confundida, por los buceadores inexpertos, con una macroalga. Existen especies como Telmatactis cricoides, de hábitos crípticos, que viven debajo de piedras y rocas del fondo por lo que su presencia puede pasar inadvertida. En las raíces sumergidas de Rizophora mangle es frecuente observar agrupaciones de la especie Aiptasia pallida. Sobre el Sargassum flotante que llega a nuestras costas podemos encontrar pequeñas anémonas de la especie Anemonia sargassensis Asociados a los actiniarios pueden encontrarse pequeños camarones pertenecientes a los géneros Periclimenes y Thor quienes suelen vivir sobre el disco oral de las anémonas, fundamentalmente de la especie Stichodactyla helianthus, pues poseen adaptaciones fisiológicas especiales que les permiten tolerar la toxicidad de esta anémona. Bajo esta misma especie suelen encontrarse cangrejos del género Mithraculus y sobre los tentáculos, copépodos de la especie Aspidomolgus stoichactinus. Además de invertebrados, también peces de las familias Apogonidae (cardenales), Pomacentridae (chopas y cromis) y Gobiidae (sapitos) viven asociados a estos organismos. Estos peces nadan entre los largos tentáculos de las anémonas, fundamentalmente de las especies Condylactis gigantea y Bartholomea annulata, buscando refugio. Se ha observado que a diferencia de los peces payasos de la familia Amphiprionidae (en arrecifes del Pacífico), estos peces no son inmunes a las toxinas de los nematocistos y pueden convertirse en alimento para estas anémonas. Entre las especies más urticantes en Cuba, tenemos a Lebrunia danae, la cual sin duda es respetada por todos los amantes del mundo marino que alguna vez han estado en contacto con este animal. Otras especies relativamente urticantes son Bartholomea annulata, Stichodactyla helianthus y Condylactis gigantea. La sistemática de las anémonas ha recibido cierta atención en el Golfo de Batabanó y la región noroccidental de Cuba, mientras que las zonas al norte y al sur de las provincias orientales prácticamente no han sido inventariadas. Las especies, que habitan en aguas profundas, aún permanecen sin estudiar. Celenterados – Filo CNIDARIA, Clase ANTHOZOA, Subclase ZOANTHARIA, corales negros - Orden ANTIPATHARIA* Se conocen en el mundo unas 200 especies de antipatarios, de las cuales 32 se han registrado para el Mar Caribe. En Cuba solo se conocen 11 especies, de estas cinco fueron registradas entre 1868 y 1980 y no han sido encontradas nuevamente, quizás por tratarse de especies de aguas muy profundas (fueron colectadas con draga entre 182 y 1335 m) y sus límites batimétricos inferiores están por debajo de los 60 m. 108 Los esqueletos de estos organismos han sido objeto de curiosidad y alto valor económico por lo que son considerados como corales preciosos aunque solo aproximadamente 10 especies se utilizan en joyería. Los principales explotadores de este recurso son: Filipinas, Nueva Zelandia, Australia, Corea y Hawai. También se extraen del Mar Rojo, el Golfo Pérsico y el Océano Indico. En el Caribe lo comercializan México, Cuba, Barbados, Islas Caimán, Antillas Holandesas, Florida, Islas Vírgenes, República Dominicana, Jamaica y San Vicente. Desde la década de los sesenta, se conoció de la existencia de densas poblaciones de una especie (Antipathes sp.), que aún no ha sido descrita, en varios sitios aislados del borde de la plataforma de Cuba, la cual posee alta calidad para el uso en joyería. Sus ramas pueden alcanzar hasta 373 cm de altura, y habita fundamentalmente por debajo de los 30 m de profundidad, aunque ha sido observada desde 18 hasta 91 m. Este recurso, altamente vulnerable, se empezó a explotar en 1980, sin una evaluación de su distribución y potencial. En la década de los noventa se establecieron regulaciones para limitar su extracción: una cuota anual máxima de 200 kg, y una talla mínima de colecta de las colonias de 120 cm de altura y 2 cm de diámetro de la base. A partir de 1994 solo se autorizó la colecta a una empresa de joyeria (Coral Negro S.A) bajo la supervisión de inspectores designados para cada expedicón. No obstante, existen indicios de una extracción furtiva grande y es evidente la casi total desaparición de la especie en Cuba. Los corales negros han sido utilizados con fines medicinales tradicionalmente. Se les asignan propiedades tales como tónico, astringente y absorbente, antihemorrágico, antinflamatorio y más recientemente han sido usados como componente de polvos dentífricos. En estudios realizados en Cuba se encontraron compuestos biológicamente activos en el mucus extraído de la especie comercial, con propiedades reguladoras del sistema cardiovascular aunque estas investigaciones no han continuado. Ctenóforos - Filo CTENOPHORA y Gusanos planos - Filo PLATYHELMINTHES Gema Hidalgo Rodríguez 14 Ctenóforos - Filo CTENOPHORA Los ctenóforos son organismos planctónicos (holoplancton), exclusivamente marinos. Unas pocas especies, conocidas como medusas rastreras, habitan sobre el fondo o en simbiosis sobre la superficie de algunas plantas y animales. Se les conoce como nueces marinas y también como linternas de mar, por la luminiscencia verde azul que producen y el efecto de colores en movimiento, determinado por la difracción de la luz a través de sus cilios. Son casi transparentes y de forma esférica, cilíndrica, aplanada o en forma de cinturón. Su cuerpo está compuesto por un sistema de conductos internos, rodeados por una masa gelatinosa o mesénquima y su tamaño va 14 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente. Ave. 1ra No.18406, Reparto Flores, Playa, La Habana, Cuba. C. P. 12 100. gemasobrina@yahoo.es 109 generalmente de unos pocos milímetros a varios centímetros de largo. Generalmente son hermafroditas y pueden reproducirse continuamente mientras haya alimento disponible. Los ctenóforos se caracterizan por presentar ocho bandas ciliadas o filas de "ctenes" (peines) que dividen el cuerpo en secciones iguales, de las cuales se deriva el nombre del filo (Ruppert y Barnes, 1994). En algunos sobresalen dos tentáculos contráctiles pero, a diferencia de los cnidarios, éstos no son urticantes, aunque poseen células adhesivas que intervienen en la captura de sus presas. Consumen larvas y animales pequeños como copépodos, anfípodos u otros ctenóforos y, a su vez, son consumidos por varias especies de medusas, así como por tortugas marinas y algunos peces. Este filo está formado por 100 a 150 especies, distribuidas en todos los océanos del mundo (Mills, 2005a). Este grupo ha sido muy poco estudiado ya que, debido a su delicado cuerpo, su colecta es difícil con redes de plancton. Suelen ser especialmente abundantes durante la primavera y principios del verano (Mills, 2005b), algunos en zonas costeras y la mayoría en aguas oceánicas. En los últimos años, la exposición de ctenóforos del género Mnemiopsis en acuarios ha captado la atención del público. Estos son organismos resilientes (con elevada capacidad adaptativa) y de fácil mantenimiento. Sin embargo, es necesario tomar extremas precauciones durante su traslado y manipulación, ya que su entrada accidental a otros ecosistemas, en los cuales no existan sus depredadores naturales, puede traer consecuencias ecológicas desastrosas, al convertirse en potenciales competidores con otras especies planctófagas como las larvas de los peces (Mills, 2005b). En el zooplancton de las aguas cubanas es común la presencia de especies de este filo, pero la información específica sobre el mismo es muy limitada. Entre sus representantes se destacan Beroe sp. y Mnemiopsis sp. (Campos, 1981; Lalana et al. 2001; Ortiz, 1991), cuyos ejemplares forman agregaciones cerca de la superficie. Las especies Pleurobrachia sp., Mnemiopsis leidyi y la carismática Cestum veneris, se han reportado en época de invierno para el litoral norte habanero (Ortiz, 2001). Ésta última, conocida como cinturón de Venus, alcanza dimensiones cercanas al metro de longitud (Ortiz, 1991). Se han observado además Ocyropsis maculata y Velamen parallelum (entre 10 y 15 m de profundidad) en la zona suroriental de Cuba (comn. personal N. López). Los ctenóforos suelen confundirse con los cnidarios por su forma medusoide Platelmintos - Filo PLATYHELMINTHES Comprende las clases Udonellidea, Monogenea, Trematoda y Cestoda (Cestoidea), enteramente parásitas, así como una evolutivamente antecesora de vida libre, denominada Turbellaria (planarias). El cuerpo de los platelmintos es macizo (acelomado) y aplanado dorsoventralmente, con un sistema digestivo ciego (que tiene un único orificio de comunicación con el exterior) y aparato reproductor hermafrodita en la mayoría, así como estructuras de fijación especializadas en 110 el caso de los parásitos. Sus tallas van generalmente desde menos de un milímetro hasta unos pocos centímetros de largo. La clase Udonellidea está integrada por organismos parásitos de copépodos, los cuales a su vez, son parásitos de peces. La clase Monogenea incluye a organismos ectoparásitos, presentes en las branquias y superficies externas principalmente de peces, así como en las vejigas urinarias de tortugas marinas. Se conocen más de 1 500 especies de monogeneos (Williams y Williams, 1996). Los tremátodos y céstodos son endoparásitos de vertebrados, comúnmente encontrados en el intestino y los ciegos pilóricos de varias especies de peces, reptiles y mamíferos marinos (Ruppert y Barnes, 1994). Los tremátodos presentan ciclos de vida complejos, que incluyen hasta tres hospederos intermediarios, generalmente moluscos. A nivel global se han descrito más de 9 000 especies de tremátodos y 5 000 especies de céstodos (Williams y Williams, 1996). La clase Cestoda parasita principalmente especies oceánicas, por lo que su diversidad e intensidad de parasitación en zonas costeras no suele ser alta (Moravec et al., 1995; Williams y Williams, 1996; Nikolaieva y Ezpeleta, 1967). Muchas veces los individuos aparecen como larvas, lo cual limita su identificación. Los miembros de la clase Turbellaria son marinos en su mayoría (algunos de agua dulce y terrestres), de vida libre, que habitan asociados a sedimentos, rocas, conchas o entre la vegetación, en espacios intersticiales sombreados. Algunas formas son casi transparentes u opacas, mientras que otras exhiben un bello colorido. De esta clase se han descrito unas 3 000 especies en el mundo (Ruppert y Barnes, 1994). Existen unas pocas especies comensales y parásitas de moluscos, crustáceos, equinodermos, ascidias y peces. Los turbelarios poseen abundantes células glandulares, que secretan sustancias para adherirse al sustrato y envolver a la presa, ya que suelen ser carnívoros, depredadores de diferentes invertebrados pequeños, aunque pueden alimentarse excepcionalmente de cuerpos muertos de animales, algas y diatomeas. Presentan considerable capacidad regenerativa de sus tejidos, lo que resulta de interés para el desarrollo de investigaciones sobre estos mecanismos. El parasitismo constituye un factor modulador de las poblaciones de peces al incidir sobre su mortalidad, especialmente a través de su debilitamiento, disminución de la fecundidad y tasas de crecimiento, y aumento de su vulnerabilidad a la depredación (Fernández, 2002), además de afectar la comercialización de las especies parasitadas por razones estéticas o de riesgo al consumidor. Los impactos negativos de los parásitos sobre el huésped pueden incluir desde la destrucción del epitelio cutáneo, branquial y gastrointestinal, hasta trastornos metabólicos tales como inflamación, necrosis, hemorragias, anemia, destrucción de órganos, entre otros (Roberts, 2001), así como posibilitar la acción de otros organismos patógenos oportunistas. El grado de parasitismo es un indicador de los cambios en las condiciones ambientales de los peces (Williams y Williams, 1996). Los ectoparásitos son más frecuentes en peces en cautiverio, mientras que los endoparásitos predominan generalmente en el medio natural, donde no contribuyen al desarrollo de serias patologías cuando se mantiene un equilibrio huésped-patógenoambiente. Algunas especies parásitas manifiestan un grado de especificidad para determinado hospedero, lo cual evidencia su estrecha adaptación evolutiva y facilita en ocasiones su identificación. En Cuba se han registrado 96 especies de este filo, de las cuales dos son de vida libre (clase Turbellaria) y 94 parásitas: 24 de la clase Monogenea, 63 de Trematoda, seis de Cestoda y uno de Turbellaria, encontradas en peces ornamentales y comerciales, principalmente de las ecoregiones noroccidental y suroccidental (Coy y Lorenzo, 1982; Fernández, 2002). El nivel de conocimientos 111 sobre la diversidad del filo en Cuba es pobre para las especies marinas o estuarinas, en contraste con las especies dulceacuícolas. La parasitofauna de los peces ornamentales recibe hoy especial atención, debido a su importancia para el manejo zoosanitario de los peces en cautiverio objeto de exhibición en los acuarios. La intensidad de parasitación de algunas especies de este filo puede ser superior a 1 000 individuos por pez De la clase Turbellaria, las más conspicuas son las planarias del orden Polycladida. Entre ellas, Pseudoceros pardalis (planaria leopardo) y Pseudoceros splendidus, notables por su coloración contrastante. Éstas, aunque no están incluídas en las cifras anteriores, han sido fotografiadas a 24 metros de profundidad en arrecifes frontales del Archipiélago Jardines de la Reina (comn. personal N. López). Las planarias marinas son probablemente comunes en la mayoría de nuestras costas, aunque están muy poco estudiadas. Sus densidades en muestras del macrozoobentos, obtenidas en fondos particulados del litoral habanero, ascienden a 10 ind./m2. Los efectos negativos de Stylochus megalops, como depredador del ostión antillano Crassostrea virginica, se aprecian tanto en sus bancos naturales como en las líneas de cultivo (Espinosa, 1981). Pseudoceros crozieri vive en asociación con las colonias de la ascidia Ecteinascidia turbinata, las cuales no aparecen dañadas, por lo que se sugiere que P. crozieri consume el tapete microbiano que cubre a las ascidias (Hernández, 2004). Filo GNATHOSTOMULIDA* Se trata de un filo (unas 80 especies conocidas) de pequeños gusanos acelomados que habitan en los espacios instersticiales de arenas finas, especialmente en aquellas con poco o ningún oxígeno y ricas en sulfuro de hidrógeno. La mayoría de las especies conocidas se concentran a lo largo de las costas al este de América del Norte. No se conocen en aguas cubanas hasta el momento. Este filo se agrupa con los Platyhelmynthes debido a la similitud de las paredes de su cuerpo (Ruppert y Barnes, 1994). Mesozoos - Filos ORTHONECTIDA Y RHOMBOZOA* En estos dos filos se incluyen unas 50 especies de pequeños gusanos parásitos que tienen una estructura muy simple pero complejo ciclo de vida. Estos organismos parasitan y absorben los nutrientes disueltos en los tejidos y cavidades internas de los invertebrados marinos. Los miembros del filo Orthonectida se han encontrado en gusanos planos, nemertineos, poliquetos, moluscos bivalvos, estrellas frágiles y otros grupos. Los Rhombozoos de la clase Dicyemida viven fijos a las cavidades nefroticas de los calamares, sepias, pulpos y se supone que absorben los metabolitos de la urina primaria del hospedero, aunque no causan patologías evidentes. 112 Filo NEMERTEA O RHYNCHOCOELA* Comprende unas 900 especies de gusanos alargados, musculosos y aplanados dorsoventralmente, que se distinguen por la presencia de una pronunciada proboscis que utilizan para la captura del alimento. Son depredadores de otros invertebados. La mayoría son animales marinos béntónicos, aunque se conocen algunas especies pelágicas de aguas profundas. Las especies de aguas someras habitan generalmente bajo las conchas y las rocas o entre las algas, o enterrados en el fango o la arena. Unas pocas especies viven en ecto-simbiosis con cangrejos, en el manto de la cavidad de los moluscos bivalvos o en el atrio de los tunicados. Tres géneros viven en agua dulce y otros seis son terrestres tropicales o subtropicales (Ruppert y Barnes, 1994). No hemos encontrado información sobre este grupo de organismos en Cuba LOS ASCHELMINTOS* El antes considerado filo Aschelminthes (o Nemathelminthes) se reconoce hoy como un grupo de filos (antes clases) que comparten algunos caracteres comunes. Aunque muy rico en formas, muestran el mismo grado de organización en la capa intermedia del cuerpo, la cual se halla limitada a unos pocos puentes de tejido conjuntivo y cierto número de órganos que desembocan en una cavidad corporal grande. Tradicionalmente se describen como animales pseudoacelomados, o acelomados, o sea que la cavidad del cuerpo se encuentra llena de hemolinfa, de forma similar a los artrópodos y moluscos. En este grupo se incluyen los filos Gastrotricha, Nematoda, Nematomorpha, Rotífera, Acanthocephala, Kynorhyncha, Loricifera y Tardigrada. Filo GASTROTRICHA Son acelomados de agua dulce y marinos, estos últimos intersticiales. Se deslizan sobre el fondo sobre un cilio ventral y temporalmente se anclan por medio de tubos adhesivos, pelos sensoriales o espinas escamosas (Ruppert y Barnes, 1994). Habitan en el bentos litoral, casi exclusivamente en arenas limpias, por debajo de la línea de pleamar, algunas en la vegetación. Se conocen unas 430 especies marinas y de agua dulce. En Cuba no han sido estudiados. Filo NEMATODA Gusanos tubulares, alargados, fusiformes o filamentosos con una cutícula, sin cilios, lisa o anillada, de vida libre o parásita. Adaptados a vivir en pequeños espacios, principalmente intersticiales, sedimentos acuaticos y la vegetación. Según López (2001): “los Nemátodos de vida libre marinos pertenecen a la clase Adenophorea. Son extremadamente abundantes alcanzando frecuentemente el millón ó más de individuos por metro cuadrado. Habitan desde las zonas intermareales hasta las grandes profundidades oceánicas. Exhiben una alta diversidad, correlacionada con la textura del sedimento, la temperatura y la salinidad. Desempeñan una importante función en el flujo energético del ecosistema mediante la degradación de la materia orgánica y la fijación y reciclaje de nutrientes. Ellos solos metabolizan el doble del Carbono que toda la macrofauna. Son buenos indicadores de la calidad ambiental de los ecosistemas marinos. Se conocen alrededor de 4 000 especies, pertenecientes a más de 500 géneros y 49 familias y se calculan alrededor de 15000 especies aún por describir. Este grupo, a pesar de su importancia ha sido muy poco estudiado en Cuba, hasta el momento solo se han registrado, en aguas someras, 4 órdenes, 9 familias, 17 géneros y 11 especies, y en aguas profundas (entre 1 650 y 1 940 m) un total de 87 taxones, entre familias y géneros”. Filo NEMATOMORPHA 113 Gusanos filamentosos, tubulares, sin cilios, muy alargados, con cutícula lisa o bien con un borde o costura de sedas en los adultos, parecidos a nemátodos muy alargados. Los Gordioides viven en las aguas dulces, como parásitos de insectos. Los Nectonematoidea son marinos, los adultos de vida pelágica, los jóvenes parasitan a los crustáceos (Ruppert y Barnes, 1994). Un único género y pocas especies (Riedl, 1983). No han sido estudiados en Cuba. Filo ROTIFERA Se distinguen por una corona ciliada en el extremo anterior. Se cuentan entre los organismos pluricelulares más pequeños. De las más de 1 500 especies conocidas solo 1/20 son marinos que viven en fondos arenosos y ricos en vegetación de aguas someras, aunque algunos habitan en el plancton costero (Riedl, 1983). Son muy abundantes en el zooplancton de agua dulce y ejercen una importante función en el reciclaje de nutrientes. Son ampliamente utilizados para alimentar los primeros estadíos larvales de organismos marinos en condiciones de cultivo. En Cuba, se emplean en condiciones experimentales con esos fines, y en el cultivo de las primeras etapas de desarrollo de los camarones. Gusanos de cabeza espinosa - Filo ACANTHOCEPHALA Es un filo constituido por gusanos parásitos obligatorios de invertebrados durante su etapa juvenil, generalmente crustáceos como huéspedes intermediarios, aunque los adultos viven en el tracto digestivo de los vertebrados, especialmente los peces (Ruppert y Barnes, 1994). Presentan una proboscis protráctil anterior armada de espinas curvadas con las cuales se enganchan en los tejidos de sus hospederos. Sus tallas varían entre unos pocos milímetros de largo y más de seis centímetros. No se consideran patógenos peligrosos para los peces, sin embargo pueden causar daños locales en el sitio de fijación en el intestino, donde la proboscis puede estar profundamente embebida en la mucosa (Fernández, 2002). Ello produce inflamaciones y necrosis como respuesta del hospedero (Roberts, 2001). Se conocen unas 1 150 especies, que son más frecuentes en los peces oceánicos (Ruppert y Barnes, 1994). Nikolaieva y Espeleta (1967) reportaron la presencia de algunas especies como parásitos en peces de las familias Lutjanidae, Labridae, Istiophoridae y Scombridae de la zona noroccidental de Cuba. Neoechinorhynchus galvani se encontró como parásito del pez barbero, Acanthurus bahianus (Fernández, 2002). Filo KYNORHYNCHA Se distingue de otros aschelmintos por tener la cutícula dividida en segmentos bien definidos. El filo está formado por unas 150 especies marinas que viven en la superficie de los fangos o en los espacios intersticiales de la arena, tanto en fondos someros desde la zona intermareal, como en aguas profundas (Ruppert y Barnes, 1994). No han sido estudiados en Cuba. Filo LORICIFERA Es el último filo descubierto, del cual solo se conocen nueve especies, ninguna reportada en Cuba hasta ahora, pero sí en el Atlántico occidental. Son animales muy pequeños que viven en espacios intersticiales de los fondos marinos de grava (Ruppert y Barnes, 1994). Filo TARDIGRADA Son pequeños organismos muy especializados (unas 600 especies conocidas) que habitan en los intersticios de las playas, el suelo, líquenes, algas e incluso en las películas de agua, principalmente 114 en ambientes terrestres o de agua dulce, aunque algunos son marinos (Ruppert y Barnes, 1994). No han sido estudiados en Cuba. Gusanos celomados no segmentados: Filos SIPUNCULA, ECHIURA, PRIAPULIDA* En este grupo se incluyen tres filos (Sipuncula, Echiura y Priapulida) con apariencia externa muy similar. Aunque no parecen tener una relación cercana, si conservan caracteres asociados a ancestros con diferentes líneas evolutivas (Ruppert y Barnes, 1994). Filo SIPUNCULIDA Es un filo integrado por organismos bentónicos vermiformes, exclusivamente marinos, conocidos generalmente como gusanos "maní", cuyo tamaño está comprendido entre 3 mm y más de 50 cm, aunque la mayoría no excede los 10 cm de largo. Son de vida libre, aunque en ocasiones incluyen alguna fase pelágica y sólo se conoce una especie parásita. La mayoría habita en aguas someras, enterrados en el fango o la arena, en las conchas de moluscos muertos o en intersticios de las rocas y corales, donde pueden alcanzar altas densidades (Ruppert y Barnes, 1994). El extremo oral está rodeado por tentáculos y la sección anterior del cuerpo, normalmente retraída en su interior, se extiende hacia afuera mediante movimientos musculares para alimentarse de microorganismos como algas, diatomeas y protozoos que viven entre las partículas de sedimento. En el mundo se conocen unas 320 especies del filo (Matthews, 2004). Murina (1968) registró ocho especies para aguas de Cuba y del Golfo de México, pero la información acerca del grupo es muy pobre. Se encuentran con frecuencia en el bentos de aguas cubanas, por lo que pudieran ser importantes en la dieta de invertebrados y peces En arrastres de fondo realizados en el Golfo de Batabanó, es común la presencia de una especie que parece ser Sipunculus nudus, aunque su identificación hasta ahora no es precisa. Filo ECHIURA Los equiuros, conocidos como gusanos cuchara por la forma de su cuerpo, son parecidos a los sipunculidos en tallas y hábitos de vida. Muchas especies viven en madrigueras en la arena o el fango aunque algunas habitan en orificios de las rocas y los arrecifes. Los machos enanos son muy diminutos (1-3 mm). Se conocen unas 140 especies, la mayoría de aguas someras, aunque algunas en zonas profundas. Los equiuros pueden ser un importante alimento para determinadas especies de peces (Ruppert y Barnes, 1994). No han sido inventariados en Cuba. Filo PRIAPULIDA Se conocen solo 16 especies vivientes y 11 fósiles de gusanos de cuerpo generalmente robusto (de 1 mm a 20 cm) en forma de pepinos que viven enterrados en la arena o el fango, con poco movimiento, 115 tanto en aguas someras como profundas. Las especies de mayor talla generalmente habitan en aguas frías. Las especies de pequeña talla tienen amplia distribución incluyendo el trópico (Riedl, 1983; Ruppert y Barnes, 1994). No han sido estudiados en Cuba. Moluscos – Filo MOLLUSCA José Espinosa Sáez 15 Los moluscos son uno de los grupos de invertebrados más numerosos y extendidos por todo el planeta, con una radiación evolutiva estimada en más de 100 000 especies recientes y varias miles más fósiles. Actualmente se consideran 10 clases dentro de este filo, ocho con representantes recientes y algunas con fósiles (Monoplacophora, Caudophoveata, Solenogastra, Polyplacophora, Gastropoda, Bivalvia, Scaphopoda y Cephalopoda) y dos sólo con especies fósiles (Hyolitha y Rostroconchia). El origen de los moluscos es marino y aunque especies de algunas clases han logrado adaptarse a los ambientes fluviales (gasterópodos y bivalvos) y terrestres (gasterópodos), es en el mar donde están representadas todas sus formas y alcanzan su máxima diversidad de especies, fundamentalmente en la zona nerítica de las regiones tropicales. Son organismos bilaterios de forma variable, con división máxima en cabeza y tronco, por lo general con cutícula y/o manto con secreciones calcáreas y un pie ventral. La cavidad respiratoria aparece bajo un repliegue libre del manto, de forma generalizada o bien terminal, en el límite entre las dos secciones. Por lo general poseen branquias pinnadas y una rádula. El corazón está situado en el espacio pericardial. Pocos grupos de invertebrados han dejado tan profundas huellas en la historia de la humanidad como los moluscos, siendo utilizados como fuente de alimento, herramientas, adornos, monedas u objetos de cambio comercial, inspiración arquitectónica y su influencia ha traspasado formas tan sutiles de la conciencia del hombre como las artes y la religión. La colección de conchas de moluscos es uno de los pasatiempos más difundidos y con mayor número de adeptos en todo el mundo, junto con la filatelia y la numismática. Los moluscos tienen una gran importancia ecológica, por ser uno de los grupos numéricamente dominantes entre las comunidades de invertebrados marinos macrobentónicos de varios hábitats marinos, donde ocupan un papel relevante en la trama alimentaría de numerosas especies zoobentofagas, incluyendo muchas de valor comercial, como los peces y las langostas. Además, a su muerte, las conchas de los moluscos forman parte importante del componente biogénico de las arenas carbonatadas de los fondos y las playas, como por ejemplo en la Playa de Varadero donde conforman hasta el 31 % de la arena de esta playa (Juanes, 1996). Numerosas especies de moluscos sirven de alimento al hombre. Entre las más conocidas están los ostiones, las almejas, los mejillones y otros, según los recursos y las tradiciones locales En la actualidad el cultivo y el procesamiento industrial de numerosas especies, fundamentalmente de bivalvos, es una actividad económica muy importante en muchas regiones del mundo. Otro renglón de mucho valor es el cultivo y explotación de perlas, que se desarrolla fundamentalmente en países asiáticos. Por el contrario muchas especies de moluscos resultan perjudiciales a la actividad humana, 15 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente Ave 1ª No. 18406, Playa, Ciudad de La Habana, C.P. 11200, Cuba espinosa@oceano.inf.cu 116 ya sea como transmisores de enfermedades, incrustantes y perforadoras de los cascos de las embarcaciones y otras construcciones navales de madera y por obstruir los canales de las industrias que utilizan el agua de mar en sus sistemas de enfriamiento. El conocimiento sistemático de la malacofauna cubana, es el más completo que existe sobre los invertebrados marinos de nuestro archipiélago. La bibliografía que trata sobre la diversidad de especies de moluscos marinos cubanos es muy extensa y resulta prácticamente imposible referirla en una apretada síntesis. Se destacan como trabajos pioneros las obras de Orbigny (1842) y de Arango (1878-80) del siglo XIX y el inconcluso inventario de Aguayo y Jaume (1947-51). Los inventarios publicados más completos fueron realizados por Espinosa et al. (1994) y fundamentalmente Espinosa et al. (1995) donde se enlistan 1 501 especies de moluscos marinos registradas para Cuba, pero dichas listas quedaron desactualizadas prácticamente desde su publicación, lo que sugiere la necesidad de un nuevo conteo de los moluscos marinos de Cuba. El segmento cubano de moluscos marinos recientes comprende un total de 1 545 especies (1 123 gasterópodos, 320 bivalvos, 39 escafópodos, 36 cefalópodos, 26 poliplacóforos y un aplacóforo), la gran mayoría de las cuales [1 162 (75,2%)] se distribuyen por las zonas nerítica y litoral, mientras que para la zona circalitoral y el sistema afital o profundo se registran 323 (20,7%) y unas 60 especies (3,8%) tienen hábitos de vida pelágicos. Cuba constituye la localidad tipo de 287 especies de moluscos marinos (249 gasterópodos, 27 bivalvos, 8 escafópodos y 3 cefalópodos). Considerando tanto los moluscos marinos como los terrestres (según Espinosa y Ortea 2000) y los fluviátiles (inédito), hasta el presente hay registradas para Cuba un total de 2 917 especies de moluscos, de las cuales 2 488 (85,2%) son gasterópodos (Tabla 2). La alta diversidad de especies de moluscos marinos del Archipiélago cubano parece estar favorecida por la incidencia de varios factores. En primer lugar Cuba es la mayor de las Antillas, con una plataforma marina relativamente extensa, con numerosas bahías, caletas, esteros y otros accidentes costeros, que posibilitan la presencia de casi todos los hábitats marinos y costeros tropicales. Todo esto unido a una envidiable posición geográfica dentro de la Provincia Caribeña (sensu Briggs, 1977), situada en el centro del llamado “Mar Mediterráneo Americano”, con costas en el Mar Caribe occidental, el Golfo de México y el Canal Viejo de las Bahamas.. Tabla 2. Número de especies de moluscos por clases y hábitats presentes en Cuba. . Clase Gastropoda Bivalvia Scaphopoda Cephalopoda Polyplacophora Aplacophora TOTAL Marinos 1 123 320 39 36 26 1 1 545 Terrestres 1 300 1 300 Fluviátiles 60 8 68 En general existe un gran desnivel en el conocimiento de la diversidad de los invertebrados marinos de la provincia Caribeña (sensu Briggs, 1974), aún en aquellos grupos más estudiados como son los crustáceos, moluscos y equinodermos. Esta diferencia se refleja en la escasez de inventarios confiables de la riqueza de especies en las diferentes áreas y países que conforman el Gran Caribe, que impide disponer de datos comparables sobre la composición y distribución de los invertebrados marinos caribeños. La aparente alta conectividad zoogeográfica entre localidades cercanas, la reconocida existencia de un cierto grado de endemismo local en determinadas áreas y para algunos 117 grupos zoológicos, y el elevado número de especies presentes, determinan la gran complejidad biogeográfica de esta provincia. Los moluscos de Cuba presentan una gran diversidad de formas y especies. Aquí se muestran representantes de los principales taxones, de izquierda a derecha: 1-3 - gasterópodos, 4- cefalópodo, 5 – escafópodo, 6 - bivalbo y 7poliplacófodo En el caso de los moluscos marinos caribeños, algunos autores como Petuch (1987) y DíazMerlano y Puyana (1994) distinguen provincias zoogeográficas independientes para los gasterópodos. Sin embargo, Espinosa (1992) demostró la unidad faunística de los bivalvos de toda esta región, coincidiendo con Warmke y Abbott (1961) para la Provincia Caribeña de moluscos marinos. Elsia pratensis (a la izquierda), es un gasterópodo herbívoro, comúnmente asociado a las praderas de Thalassia testudinum. Prunum apicinum (a la derecha) es un gasterópodo carnívoro, muy común en fondos areno-fangosos. La gran mayoría de los moluscos marinos antillanos actuales poseen una alta capacidad de dispersión (desarrollo larvario planctotrófico), lo que implica que el endemismo local sea relativamente nulo o muy bajo, muy inferior al 10% considerado por Briggs (1977) como criterio para el establecimiento de subprovincias zoogeográficas independientes. Las relaciones faunísticas de los moluscos marinos cubanos dentro de la Provincia Caribeña señalan elevadas afinidades con las restantes Antillas Mayores (Puerto Rico, Jamaica y La Española) y Las Bahamas. También 118 muestran valores de similitud significativamente altos la Península de Yucatán y los Cayos de la Florida (según Espinosa, 1992 y datos inéditos del autor). Las relaciones faunísticas de muchas especies de moluscos marinos cubanos, pueden indicar cierta tendencia a la mayor afinidad zoogeográfica de la costa sur, por ejemplo la región de Cienfuegos, con la vecina isla de Jamaica, que con la zona de Caibarién, localidad situada prácticamente frente a Cienfuegos, pero en la costa norte de Cuba, y cuya afinidad con las Bahamas es más marcada. Estas tendencias son débiles y no llegan a constituir verdaderas fronteras zoogeográficas. Al analizar las tendencias ecológicas generales de las comunidades de moluscos marinos en la zona nerítica de Cuba (Tabla 3), se observa que en los substratos particulados (arena-fango) con macrovegetación bentónica, fundamentalmente en praderas de Thalassia testudinum, las mayores densidades y biomasas corresponden a especies de gasterópodos herbívoros y detritófagos, principalmente de la familia Cerithiidae (Cerithium eburneun, Cerithium atratum y Cerithium muscarum fundamentalmente), mientras que donde la macrovegetación está ausente, son los bivalvos los que presentan los valores más significativos, sobre todo el venérido Chione cancellata, cuyas densidades y biomasas pueden ser muy altas en algunos fondos de fango microaleurítico (522 ind/m2 y 1,008 g/m2, según Herrera y Espinosa, 1987). La mayor diversidad y complejidad de las asociaciones de moluscos en las costas cubanas se encuentran en los arrecifes coralinos, aunque las densidades y la biomasa son por lo general muy bajas. Eventualmente la biomasa puede incrementarse marcadamente por la presencia de especies de tamaño grande como es el gasterópodo Strombus gigas. Tabla 3. Tendencias ecológicas generales de las comunidades de moluscos marinos neríticos de Cuba. Mv. B. macrovegetación bentónica. S - número total de especies. N- número total de individuos. R1 - indice de riqueza de especies de Margalef (1951). J’- equitatividad. C’- dominancia. D- densidad total (ind/m2). B- biomasa total (g/m2). ↓ valor bajo. ↑ - valor alto. Ï - valor muy alto. Índices ecológicos Hábitats S N R1 J' C' D B Sustratos particulados Ï Ï Ï Fango sin Mv.B. ↓ ↓ ↓ ↓ Arena sin Mv.B. ↓ ↓ ↓ ↓ ↓ ↓ ↓ Fango con Mv.B. ↓ ↓ ↓ ↓ ↓ ↓ ↓ Ï Ï Arena con Mv.B. ↓ ↑ ↓ ↑ ↑ Sustratos duros Arrecife coralino Litoral rocoso Manglares Ï ↓ ↓ ↓ ↑ Ï Ï ↓ ↓ Ï ↓ ↓ ↓ ↑ Ï ↓ ↑ Ï ↓ ↓ Ï La alta diversidad de especies de moluscos presentes en los arrecifes coralinos parece estar relacionada con la presencia en este biotopo de una gran disponibilidad de microhábitats, que son aprovechados tanto por especies oportunistas como por otras muy especializadas. Esto determina la presencia en los arrecifes coralinos de innumerables moluscos depredadores de las presas más variadas, muchas veces exclusivos, de algas, esponjas, hidroideos, corales, briozoos, gusanos, crustáceos, equinodermos e incluso peces, además de existir especies comensales, parásitas y filtradoras. 119 En la zona litoral de las costas rocosas, los moluscos son el grupo dominante tanto en densidad, por especies de las familias Littoriinidae y Neritidae, como en biomasa, donde los quitones, y fundamentalmente Acanthopleura granulata, hacen el mayor aporte. Las costas de manglares están pobladas por gasterópodos de las familias Neritidae, Batillariidae, Potamididae y Ellobiidae principalmente, cuyas densidades y biomasas suelen ser muy variables, pero nunca llegan a alcanzar valores tan altos como los que se pueden encontrar en los fondos particulados o blandos infralitorales. En asociación directa con las raíces del mangle rojo, Rhizophora mangle, se encuentran tres especies de bivalvos cuyas densidades y biomasas pudieran ser las mayores encontradas entre los moluscos de las costas cubanas. Dos de ellas, Crassostrea virginica (= Crassostrea rhizophorae) e Insognomon alatus se desarrollan en salinidades bajas a normales (15 - 36 ppm), mientras que la tercera, Mytilopsis leucopheata prefiere salinidades por lo general inferiores a las 15 ppm. Cassis flamea se entierra en los sedimentos arenosos para protegerse de sus depredadores. No obstante, no logra escapar a la depredación del hombre (para ornamentación), por lo que sus poblaciones han sido seriamente afectadas. Por su virtual omnipresencia en los ecosistemas marinos y su relativa conectividad (sensu Bradbury, 1977) con los factores del medio donde se desarrollan, los moluscos son utilizados como bioindicadores, tanto para caracterizar determinados biotopos como para evaluar y monitorear la calidad del ambiente marino (del Valle, 1989; Alcolado y Espinosa, 1996, y otros). Alcolado et al. (1998) demostraron la importancia de la riqueza de especies del megazoobentos total como un bioindicador ambiental y de la biodiversidad global de los ecosistemas marinos. En los fondos de substrato particulado (fango-arena) existe una alta correlación entre el número total de especies del megazoobentos y el número de especies de moluscos. Esto permite el monitoreo de las condiciones ambientales en áreas de interés económico o conservacionista a través del número y la riqueza de especies de moluscos de estos ecosistemas (Alcolado y Espinosa, 1996). Espinosa (1992) y Alcolado et al. (1998) han señalado la disminución de la riqueza de especies de moluscos provocada por algunos factores estresantes del ambiente, como el aumento de la salinidad, la materia orgánica particulada en los sedimentos y el aumento en éstos de la fracción de cieno (fango). En zonas y localidades históricamente sometidas a un fuerte impacto antrópico, como la Bahía de La Habana, la perdida de la diversidad de especies de moluscos es notable, como se puede apreciar de las numerosas referencias que hace Arango Molina (1878 – 80), de moluscos comunes en dicha bahía, algunos de los cuales se comercializaban en los mercados de La Habana para el consumo humano, durante el siglo XIX. 120 Aunque en la fauna marina de Cuba existe un alto potencial de especies de moluscos (unos 80 bivalvos y varios gasterópodos y cefalópodos) que pueden servir de alimento al hombre, sólo tres especies, el ostión Crassostrea virginica, la almeja Arca zebra y el cobo Strombus gigas están sometidas a explotación oficialmente regulada. El inapropiado manejo de las pesquerías de almejas al sur de Las Tunas ha determinado la perdida de importantes bancos naturales de este bivalvo (Baisre, 2000; Espinosa, 1992). El cobo, (Strombus gigas Linné, 1758), sufrió el impacto de la sobrepesca ya desde la década de los setenta (Ferrer y Alcolado, 1994), se vedó para la pesca comercial durante varios años y actualmente se explota bajo licencias por zonas, previa evaluación del recurso. Además se encuentra incluido en el Apéndice II de la Convención Sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES). En los últimos años en Cuba ha proliferado el comercio de varias especies de moluscos marinos, para la ornamentación, tanto por el sector estatal como el privado, lo cual ha provocado la declinación de las poblaciones de varias especies. Entre las más amenazadas por el comercio de sus conchas están el quinconte rosado (Cassis madagascariensis Lamarck, 1822), muy demandado por la industria artesanal italiana para la confección de camafeos, el quinconte carey (Cassis tuberosa Linné, 1758), el quinconte de flámulas (Cassis flammea Linné, 1758), el cobo porcelana (Strombus costatus Gmelin, 1791), el cobito rojo (Strombus pugilis Linné, 1758), el cobito rana (Strombus raninus Gmelin, 1791), el negro maco (Cypraea zebra Linné, 1758), el tritón (Charonia variegata Lamarck, 1816), la coba o fotuto (Turbinella angulata Lightfoot,1786), la cinturita (Cyphoma gibbosum Linné, 1758), la ostra espinosa (Spondylus americanus Hermnann, 1781), y algunas otras más, cuyas conchas las hacen codiciadas por coleccionistas o simplemente como adorno y recuerdos de viaje por los turistas que nos visitan Algunas especies de bivalvos se destacan negativamente por el daño que causan a la economía. Las especies de las familias Pholadidae y Teredinidae, perforadoras de las maderas sumergidas, son un azote para los barcos e instalaciones portuarias de este material. También algunas especies de bivalvos figuran entre los principales organismos incrustantes, que provocan grandes problemas en las industrias que utilizan el agua de mar en sus sistemas de enfriamiento, al reducir la eficiencia de las bombas de succión, tupir los filtros y los tubos intercambiadores de calor. Esto disminuye el intercambio térmico con el consiguiente aumento en el consumo de combustible. Los principales bivalvos incrustantes en las costas cubanas son Brachidontes exustus y Crassostrea virginica, aunque otras especies dotadas de mecanismos de fijación al substrato también pueden formar parte de esa fauna indeseada (Espinosa, 1992). Los moluscos han sido inventariados con bastante detalle en el Golfo de Batabanó, el Golfo de Guanacahabibes, el litoral norte Habana-Matanzas y el Archipiélago Sabana-Camagüey. Sin embargo, se han realizado pocos estudios en el Archipiélago Jardines de la Reina y el norte y sur de las provincias orientales. Anélidos - Filo ANNELIDA, Poliquetos - Clase POLYCHAETA Diana Ibarzábal Bombalier 16 16 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente. Nueva dirección: Acuario Nacional, 1ra. y 60, Miramar. Playa. dianai@acuarionacional.cu 121 Los anélidos son gusanos segmentados, este carácter es conocido como metamerismo y consiste en que todos los órganos del cuerpo, como por ejemplo las gónadas, los vasos sanguíneos, los órganos renales, los cordones nerviosos así como los músculos y el sistema locomotor, se repiten en cada segmento o metámero, solo el sistema digestivo corre a lo largo del animal a través de todos los segmentos. En el extremo anterior, la cabeza está representada por el prostomio que contiene el cerebro, la parte terminal es llamada pigidio, en ella se encuentra el ano y es donde se forman los nuevos segmentos que permiten el crecimiento del animal. El filo incluye las clases Oligochaeta, con unas 3 100 especies entre ellas las lombrices de tierra, muchas especies de agua dulce y muy pocas marinas; Hirudinea, la cual cuenta con unas 500 especies marinas, de agua dulce y terrestres conocidas como sanguijuelas y la clase Polychaeta, que incluye los poliquetos, gusanos marinos (Ruppert y Barnes, 1994) de los que nos ocuparemos en detalle a continuación. El nombre poliqueto viene del griego (poly= muchas + chaetas= setas o flechas). Su carácter principal es un cuerpo anillado con pies laterales o parapodias (para = laterales + podias = pies) en cada segmento, que llevan numerosas estructuras quitino-proteicas llamadas setas. Este carácter los distingue de sus parientes cercanos, los oligoquetos o lombrices de tierra. Los poliquetos conforman un grupo muy antiguo, el anélido ancestral se desarrolló en el mar, sobre sedimentos arenosos o fangosos, por tanto los poliquetos son considerados los primeros representantes del filo en el planeta. Algunas familias actuales ya estaban presentes desde el Paleozoico y a partir de ese período comenzaron a evolucionar. Los poliquetos son eminentemente marinos, aunque hay algunas especies en aguas dulces y salobres. Prácticamente ocupan todos los biotopos marinos desde las zonas costeras e intermareales hasta las grandes profundidades. El grupo se encuentra ampliamente distribuido en todas las costas y mares del mundo y se caracteriza por una alta diversidad de especies, elevada abundancia y biomasa y gran adaptabilidad a diferentes condiciones ambientales. La mayoría de los poliquetos son de pequeño tamaño y tienen hábitos de vida crípticos, razón por la que son poco conocidos. Algunas familias con ejemplares grandes y vistosos son las más comunes y conocidas como los gusanos plumero (Sabellidae) y los arbolitos de navidad (Serpulidae). Por su abundancia y amplia distribución, los poliquetos juegan un importante papel en las tramas alimentarias de muchos peces e invertebrados de valor económico, en particular de especies dominantes en el ecosistema nerítico, como los roncos y de gran abundancia en las macrolagunas como las sardinas (Sierra et al., 2001). Algunos estadios reproductivos de poliquetos se agrupan en grandes masas en la columna de agua y se convierten en apetecible alimento para peces y aves marinas. Recientemente ha florecido el comercio de poliquetos como carnada en la pesca recreativa. Un uso algo más reciente es su empleo como organismos ornamentales en peceras y acuarios donde los serpúlidos y los sabélidos son los más cotizados por sus vistosas y coloreadas corolas. Pero su principal importancia radica en sus interacciones ecológicas.. La inmensa mayoría de las especies son bentónicas durante gran parte de su vida. Aunque algunas familias son planctónicas, muchas especies pasan por una fase larval pelágica y posteriormente se asientan en el fondo. Hay familias exclusivas de un sustrato determinado y otras que son indiferentes a éste. Las larvas de la familia Sabellaridae se caracterizan por la selección del tamaño de las partículas de sedimento para asentarse (Wilson, 1977) y los ofélidos (familia Opheliidae) presentan una distribución muy localizada con un estrecho intervalo del tamaño de las partículas (Wilson, 1953, Pettibone, 1982). 122 Los poliquetos viven en comunidades con un número de animales tan alto que pueden modificar el sustrato donde viven. En algunas bahías suelen ser el grupo dominante del bentos. En los fondos blandos ya sean arenosos, fangosos o una mezcla de ambos, pueden vivir en tubos dentro del sedimento o reptando entre la vegetación, algunas especies hacen galerías que cambian las condiciones de aireación y oxigenación e intercambian partículas desde las capas más profundas del sedimento hacia la superficie de éste, jugando un papel similar al de sus parientes las lombrices de tierra. La composición de especies de poliquetos que habitan en los espacios intersticiales del sustrato blando, está supeditada a las características de los sedimentos, como el tamaño de los granos, la materia orgánica depositada y la cantidad de oxígeno en el agua intersticial. En sustratos duros como las costas rocosas, los arrecifes etc., los poliquetos pueden estar asociados a la abundante fauna sésil de estos hábitats (esponjas, gorgonáceos, corales etc) y la vegetación que crece entre ellos, perforar la roca coralina o utilizar sus cavidades, dando lugar a la fauna críptica, una de las categorías más importantes de la infauna por presentar una elevada abundancia y diversidad de especies. En los fondos rocosos donde abundan las familias tubícolas, los tubos calcáreos en grandes masas transforman la naturaleza de la roca aumentando la fricción del agua y por tanto la corrosión. Se han encontrado impresionantes densidades de individuos de las familias Serpulidae y Spirorbidae en las tuberías de enfriamiento de industrias y plantas cuyo sistema de enfriamiento utiliza el flujo de agua marina, a tal punto que deben removerse periódicamente para un funcionamiento normal. Muchos poliquetos se encuentran asociados a otros animales bentónicos. Dentro de las esponjas existen elevadas cantidades de poliquetos de vida libre que se encuentran embebidos dentro de la masa de espongina, los más frecuentes son los eunícidos y los sílidos. Otras especies viven entre los pies ambulacrales de estrellas y estrellitas frágiles sin hacerles daño. El gusano escamoso Hermenia verruculosa registrado en los arrecifes cubanos tiene una relación comensal con el ofiuro Ophiocoma pumila, pues un patrón de color similar en ambos animales le permite al poliqueto un camuflaje casi perfecto (Pettibone, 1975). También hay poliquetos parásitos de crustáceos, peces y de otros poliquetos. Aunque los poliquetos son muy resistentes a los cambios ambientales, sus comunidades están siendo afectadas por la degradación de sus hábitats, como resultado de la contaminación marina, los cambios de salinidad, la falta de oxígeno etc. Sin embargo, algunas familias están estrechamente vinculadas con la contaminación marina y son considerados como indicadores, hasta tal punto que la presencia de determinadas especies es un indicio de que existe contaminación orgánica en el lugar aún antes de sentirse sus efectos. Hasta el momento se han descrito en el mundo más de 8 000 especies de poliquetos, de las cuales unas 1 462 han sido listadas para la región del Gran Caribe (Salazar, 1996). De ellas en Cuba se han registrado 391 entre las cuales se encuentran 31 especies tipo (ver lista en este CD-ROM ). Considerando los limitados inventarios realizados y la gran diversidad encontrada en ellos, podemos suponer la presencia de muchas especies aún no reportadas e incluso no descritas. La Tabla 4 muestra el número de especies encontradas hasta el momento por zonas. Resaltan la suroccidental y el Archipiélago Sabana-Camagüey como las zonas de mayor número de especies, posiblemente porque son las zonas más estudiadas de la plataforma. Tabla 4. Número de especies registradas en cada zona según la bibliografía consultada y estimación del nivel de conocimiento sobre la base de la intensidad de los muestreos realizados en cada una de ellas. Zonas No. especies Nivel de estudio Suroriental, Costa Sur de Oriente 8 bajo Surcentral, Archipiélago Jardines de la Reina 44 medio 123 Surcentra, Sur Macizo de Guamuaya Suroccidental, Archipiélago de los Canarreos Suroccidental, Península Guanahacabibes Noroccidental, Archipiélago Los Colorados Noroccidental, Norte Habana-Matanzas Norcentral, Archipiélago Sabana-Camagüey Nororiental Costa Norte Oriente 3 361 4 68 39 98 45 bajo alto bajo bajo medio alto bajo Una de las familias más abundantes y diversas en todos los biotopos de nuestra plataforma es Syllidae, la cual ha sido bien estudiada por San Martín (1990, 1991, 1992). Hasta el momento se han registrado 101 especies, de las cuales 28 son especies Tipo. Los sílidos son dominantes en el sustrato blando de los arrecifes (Ibarzábal, 1997), en las praderas de Thalassia (Ibarzábal, 1990a) y en fondos arenosos (Ibarzábal, 1985). Son particularmente abundantes dentro de las esponjas, Haplosyllides floridana, por ejemplo, alcanza densidades elevadas dentro de la esponja Xestospongia muta, ampliamente distribuida en las costas cubanas. (San Martín et al., 1997). En el Golfo de Batabanó las mayores abundancias de poliquetos (1 500-3 200 ind/m2) se encontraron en pastos marinos, uno de los hábitats más ricos en cuanto a la infauna bentónica (Ibarzábal, 1990b). Este biotopo presente también en las lagunas arrecifales, presentó las mayores densidades del sustrato no consolidado de los arrecifes cubanos (800-1 400 ind/m2), y valores altos de diversidad (H’=2,52-2,98 natios) con especies dominantes de sílidos y nereidos como Nereis riseii, Ceratonereis longicirrata, Ehlersia mexicana, Exogone dispar y Syllis variegata (Ibarzábal, 1997). En el Golfo de Batabanó, se han observado enjambres de pequeños gusanos que dan una coloración iridiscente a la superficie del mar en noches de luna nueva, los mismos están formados por agregaciones de los estadios reproductivos de Nereis riseii. Algunos géneros de poliquetos comunes en la plataforma Cubana. La especie Eupolyodontes batabanoensis, (tipo cubana; Ibarzábal, 1988), fue colectada en el norte de Cayo Largo del Sur, Golfo de Batabanó, enterrada profundamente en el sedimento de una pradera de Thalassia. Es una de las especies de mayor tamaño encontradas en el Caribe (se han colectado ejemplares de 70 cm de largo y 2,5 cm de ancho). El animal fabrica un tubo muy grueso, esponjoso, que sobresale unos centímetros del sedimento por donde intercambia el agua y obtiene el alimento. 124 En un estudio donde se incluyeron casi todos los hábitats marinos, realizado en Punta del Este, Isla de la Juventud, se obtuvieron las mayores densidades de poliquetos en la playa arenosa (1 592 ind/m2), sin embargo la diversidad fue baja (<1 natio), dominando fuertemente dos especies de Spionidae (Prionospio cirrobranchiata y Scolelepis squamata) y el ofélido Armandia maculata, que presentó la mayor abundancia relativa (60,5%; Ibarzábal, 1985). Armandia maculata y Polyophthalmus pictus, estuvieron presentes en 75-90% del total de las estaciones muestreadas en sustratos arenosos de los arrecifes del Archipiélago de los Canarreos y son particularmente abundantes en las zonas de embate y traseras de la meseta arrecifal (Ibarzabal, 1997). En fondos fangosos y fango-arenosos con presencia de materia orgánica, los poliquetos de las familias Spionidae, Paraonidae y Orbiniidae son los dominantes y los más abundantes. Las especies Laonice cirrata, Prionospio steenstrupi, Paraprionospio pinnata, Prionospio cirrobranchiata, Scolelepis squamata, Naineris setosa y Aricidea jefreysii son frecuentes y abundantes en las lagunas interiores del Archipiélago Sabana-Camagüey y en los sedimentos del Golfo de Batabanó (Ibarzábal, 1990a; 1997). En hábitats de sedimentos blandos sin vegetación los poliquetos pueden ser también muy abundantes, aunque generalmente la diversidad de especies es media o baja. En los fondos fangosos de la Ensenada de la Broa se encontraron 700-1 400 ind/m2 y valores de H´ entre 1,6 y 2,0 natios. En algunas localidades costeras del Archipiélago Sabana-Camagüey, se obtuvieron densidades de 400 a 2 900 ind/m2 y valores de riqueza de especies entre 1 y 2 según el índice de Margalef. En estas localidades las especies más importantes son Aricidea jefreysii, Prionospio steenstrupi, Branchioasychis americana. En las bahías, donde predominan los fondos fangosos ricos en materia orgánica y las condiciones ambientales pueden ser hostiles para la vida marina por la presencia de elementos contaminantes y por las variaciones de salinidad y temperatura, se encuentran elevadas densidades y biomasas de un pequeño número de especies. Se han encontrado indicadoras de contaminación marina en las bahías de Cárdenas (Arenicola cristata), Guayabal (Streblospio benedicti) y La Habana (S. benedicti, Stenoninerei martinsi y Schistomeringos rudolphi) (Herrera y del Valle 1980; Ibarzabal 1989; 1997). En las macrolagunas del Archipiélago Sabana-Camagüey, el aumento de la salinidad ocasionó una disminución brusca de la riqueza de las especies de poliquetos. El número de especies disminuyó de 97 en zonas con salinidades de 36 a 37 ppm a 1-3 especies en localidades donde la salinidad alcanzó valores de 48 ppm. En la zona costera de la ciudad de Cárdenas, afectada por un foco de contaminación orgánica, el número de especies disminuyó de 11 a solo dos. La conocida calandraca, Arenicola cristata (familia Arenicolidae) se extrae en grandes cantidades para ser usada como carnada en la pesca recreativa. Los fondos de la zona aledaña a la entrada de la bahía de la Habana y la Playa del Chivo están prácticamente cubiertos por el sabélido Bispira brunnea. Otra de las familias más conocidas en nuestros ecosistemas es Amphinomidae. Sus especies habitan en fondos arenosos y areno-fangosos, entre la vegetación marina o entre los corales. Hermodice carunculata y Eurythoe complanata, presentes en todas las zonas costeras cubanas, son conocidas como gusanos de fuego porque presentan setas dorsales silíceas muy finas, aserradas en forma de arpón, huecas y conectadas con una glándula venenosa. La mayoría de las especies de esta familia son carnívoras, se alimentan de esponjas, corales, gorgonias y anémonas aunque también son carroñeros. En los últimos años algunas especies de esta familia se están utilizando en la extracción de sustancias bioactivas con fines farmacológicos. 125 Gusano de fuego, Hermodice carunculata Sabela Spirobranchus giganteus (Fotos: Noel López) La familia Eunicidae es dominante en sustratos duros o asociados a otros organismos, tanto por su densidad y biomasa (pues son animales de gran tamaño), como por su diversidad (35 especies registradas en Cuba). Las especies del género Eunice, E. mutilata, E. filamentosa, E. fucata y E. vittata, se encontraron en los arrecifes de los Archipiélagos de los Canarreos, Jardines de la Reina y en las zonas exteriores de Sabana Camagüey (Ibarzábal 1997; Ibarzábal, et al., 1999). Las mayores abundancias de la criptofauna arrecifal en el Archipiélago de los Canarreos son debidas a esta familia, presente en rocas de la pendiente externa entre la meseta y 10 m (80−140 ind/l). La biomasa, sin embargo, está ligada a las especies Eunice filamentosa, E. mutilata y E. schemacephala (Ibarzábal, 1997). Entre las especies de sustratos duros se observa todo tipo de alimentación pero predominan los carnívoros, herbívoros y filtradores. Otro grupo importante en los arrecifes, son los gusanos escamosos pertenecientes a las familias Aphroditidae, Polynoidae y Sigalionidae. Los poliquetos Pontogenia sericoma, Hermenia verruculosa, Thormora jukesi y Sthenelais articulata se presentan con frecuencia en piedras coralinas de diferentes lugares de los arrecifes cubanos. Entre las especies más atractivas de serpúlidos y sabélidos en nuestros arrecifes, se encuentran Spirobranchus giganteus y Pomatostegus stellatus, con patrones de coloración en sus radiolos que varían entre el naranja, rojo, marrón y amarillo. De los sabélidos, en Cuba se han registrado 26 especies (Ibarzábal, 1986; San Martín, 1994) entre las cuales la más vistosa es Sabellastarte magnifica, que puede alcanzar hasta 20 cm de longitud y posee una gran corola coloreada en bandas marrón y blanco. Esta especie se encuentra fundamentalmente en aguas costeras tranquilas y en el talud arrecifal. También son frecuentes en nuestros fondos Bispira melanostigma, Anamobaea oerstedi y Bispira brunnea, En los arrecifes y zonas cercanas a estos son también frecuentes los gusanos terebélidos (Familia Terebellidae) llamados también espaguetis. Generalmente se encuentran debajo de las rocas dejando extendidas hacia afuera los filamentos branquiales sobre el sedimento. Entre las especies más conocidas están Loimia medusa, Eupolymnia nebulosa y Terebella rubra. El conocimiento de los poliquetos es básico en los estudios ambientales, tanto en aquellos lugares que sufren alteraciones (ya sea por causas antrópicas o naturales), para calcular el grado y el tipo de daño, como en zonas ecológicamente sanas para estimar la riqueza o productividad del lugar. 126 Filo POGONOPHORA* Este filo fue descubierto solo en el siglo XX. Se conocen unas 80 especies de gusanos alargados, exclusivamene marinos, que habitan generalmente a profundidades mayores de 100 m. Son organismos sésiles que habitan en tubos construidos por una secreción de proteinas y quitina, fijados al sustrato, generalmente de forma vertical, aunque algunos son flexibles. Frecuentemente se encuentran en densidades de hasta 200 individuos/m2 (Ruppert y Barnes, 1994). En 1965 fueron encontrados por primera vez estos organismos en aguas cubanas y del Golfo de México, cuando fueron registradas tres posibles nuevas especies, dos del género Siboglinum y una de Polybrrachia (Moskalev y Gómez-Hernández, 1967). Artropodos - Filo ARTHROPODA, Crustáceos - Subfilo Crustacea* Constituye el único grupo importante de artrópodos acuáticos, formado por unas 38 000 especies. La mayoría son marinos, aunque existen bastantes especies de agua dulce, y unos pocos son terrestres o semi-terrestres. Debido a su alta diversidad de taxones superiores, ha sido necesaria una clasificación jerárquica con mayor número de niveles que en otros invertebrados. El subfilo se subdivide en 10 clases con muy diferente diversidad de especies: Malacostraca (22 651 especies), Branchiopoda (821), Ostracoda (5 650), Copepoda (8 405), Mystacocarida (9), Branchiura (150), Tantulocarida (4), Reimpedía (2), Cephalocarida (9) y Cirripedia (900) (Ruppert y Barnes, 1994). La Clase Malacostrata, la de mayor diversidad, comprende los super-órdenes Eucarida (órdenes Decapoda y Euphausiacea) y Peracarida (órdenes Amphipoda, Isopoda, Cumanacea, Tanaidacea y Mysidacea), así como las subclases Hoplocarida (orden Stomatopoda) y Eumalacostraca. A los efectos prácticos de este trabajo, se analizan dos grupos de taxones, el orden de los Decápodos, que es el más numeroso y más familiar, por contener especies tales como los cangrejos, camarones, langostas, etc., y en otro grupo se analizan los “no decápodos”, donde se incluye una gran variedad de taxones, generalmente menos conocidos, pero no menos importantes en el ecosistema marino. Artropodos - Filo ARTHROPODA, Subfilo Crustacea: Crustáceos NO DECÁPODOS Manuel Ortiz, Rogelio Lalana y Carlos Varela17 Bajo la denominación de crustáceos no decápodos están incluidos más de la mitad de las especies conocidas del sub-filo Crustacea. Dentro de esta categoría en las aguas cubanas están presentes los cephalocaridos, los reimpedíos, los branquiópodos, los ostrácodos, los copépodos, los cirripedios, los branquiuros (que son muy semejantes a los anteriores), los nebaliáceos, los hoplocáridos y los peracáridos. Para su cladificación, hemos seguido la nomenclatura de Brusca y Brusca (1990). De ellos, los más numerosos en los mares cubanos son los copépodos, tanto planctónicos como bentónicos, los cuales juegan un papel primordial en las tramas alimentarias de muchas especies de 17 Centro de Investigaciones Marinas, Universidad de La Habana Calle 16 No. 114 e/ 1ra. y 3ra . Playa. Ciudad de La Habana C.P. 11300. Cuba. ortiztouzet@yahoo.com; rlalana@cim.co.cu 127 importancia económica. También los isópodos y los anfípodos merecen ser citados entre los grupos más abundantes e importantes en las relaciones tróficas de los ecosistemas cubanos. Muchas de estas especies constituyen parte del alimento de las etapas juveniles de peces de interés comercial. Por otra parte, algunos copépodos e isópodos son parásitos de otros crustáceos o de peces, al menos en algunos de sus estadios. Los crustáceos no decápodos cubanos estaban muy poco estudiados hasta finales de los años 70. Solamente se conocían algunas de las especies de copépodos planctónicos, cirripedios, estomatópodos e isópodos marinos parásitos. En ello influyó su pequeño tamaño, a pesar de su gran abundancia, así como la dispersión de la literatura. Los crustáceos de la clase Cephalocarida, fueron descubiertos recientemente. Se trata de uno de los grupos más primitivos de crustáceos conocidos. Son de muy pequeño tamaño, de cuerpo alargado, no sobrepasando los 4 mm de largo. Cabeza sin ojos, compuesta de un escudo cefálico, que a continuación presenta 8 segmentos toráxicos, 11 abdominales y un telson con ramas caudales. En el mundo se conocen actualmente cerca de 20 especies. En Cuba solo un representante del género Ligthiella, (Lalana, et al., 1983) ha sido registrado (ver lista de crustáceos no decápodos en este CD-ROM). Los de la clase Reimpedia, también recién descubiertos y primitivos, son muy alargados, poseen dos cordones nerviosos ventrales y los segmentos del tronco son todos muy semejantes. Una sola especie ha sido hallada por una expedición espeleológica cubano-norteamericana. Se trata de Speleonectes gironensis (Yager, 1994). A la clase Branchipoda pertenecen crustáceos pequeños, que no sobrepasan los tres cm de largo. Pueden presentar su cuerpo incluido en un carapacho que protege la cabeza o presentar la cabeza separada de los restantes segmentos corporales. Sus apéndices son foliáceos y generalmente tri-ramosos. La mayor parte de estos curiosos crustáceos son dulciacuícolas, sin embargo, existen algunos representantes marinos. El grupo está representado en Cuba por los órdenes Anostraca (no poseen carapacho), y Conchostraca (tronco entre dos valvas articuladas) ambos de agua dulce; Cladocera, grupo con representantes marinos (con el carapacho encerrando el tronco, pero no la cabeza ni el abdomen, casi siempre una espina apical al final del cuerpo). Hasta el momento se conocen 24 especies de branquiópodos en Cuba. Algunos crustáceos no decápodos presentes en aguas cubanas. 128 Los de la clase Ostracoda poseen un carapacho compuesto de dos valvas articuladas dorsalmente lo que los hace muy semejantes en apariencia, a un bivalvo pequeño. Los no expertos, solo los diferencian por la presencia del ojo naupliar. Poseen además, varios apéndices torácicos fusionados a la cabeza. Los ostrácodos se encuentran entre los animales marinos más exitosos ya que habitan desde aguas someras hasta los 7 000 m de profundidad, los hay en aguas salobres y dulces. Incluye individuos carnívoros, comedores de carroña, herbívoros y filtradores La mayoría son bentónicos cavadores, viven sobre microalgas, fondos duros o epibénticos, y otros totalmente planctónicos. Ellos son parte importante en la dieta de algunos peces y de numerosos invertebrados comedores de fondo. Han sido registradas para el país 47 especies marinas, anquialinas y dulceacuícolas. La clase Maxillopoda agrupa los crustáceos que poseen seis segmentos torácicos y generalmente cuatro abdominales y el telson. Pueden o no presentar carapacho. Con varios apéndices torácicos fusionados a la cabeza. De esta clase solamente hay dos que están representadas en los mares cubanos. A la subclase Copepoda pertenece un gran grupo de pequeños crustáceos sin carapacho, pero con escudo cefálico o cefalosoma presente. Con un par de maxilípedos. Tórax de cinco segmentos libres (el primero fusionado con la cabeza) Antena 1 uni-ramosa; Antena 2 uni o bi-ramosa. Con 4-5 pares de toracópodos, generalmente bi-ramosos. Abdomen con cinco segmentos sin apéndices, incluyendo el segmento anal o telson, que lleva una furca caudal bien desarrollada, a cada lado. Los sexos son separados y las hembras se distinguen muy fácilmente, pues suelen llevar sus huevos en ovisacos adosados al segmento 1 abdominal. Existen más de 9 000 especies de copépodos descritas. En las aguas cubanas y regiones adyacentes existen especies planctónicas pertenecientes a los órdenes Cyclopoida y Calanoida, mientras que la mayoría de las bentónicas pertenecen al orden Harpacticoida. Algunas especies son parásitas de peces. Los copépodos, por su gran abundancia, juegan un papel fundamental en la trama alimentaria acuática, al consumir fitoplancton (productores primarios) y trasladar esa energía a los niveles tróficos superiores. Algunos copépodos son bien distorsionados o aberrantes, en tal grado, que solo los expertos, son capaces de distinguirlos. Más de 140 especies de copépodos planctónicos marinos han sido registrados para las aguas cubanas (Campos, 1982). Los representantes de la subclase Cirripedia permanecieron durante siglos confundidos entre los moluscos, debido a que su aspecto externo, se asemeja más a estos que a los propios crustáceos. Los escaramujos, también conocidos como “bellotas de mar” o “percebes” constituyen un grupo de crustáceos marinos sumamente aberrantes, pues sus larvas planctónicas sufren una torsión que les permite fijarse al sustrato por la región anterior, mediante una sustancia cementante, producida por sus antenas, que se consolida inmediatamente al sustrato, donde permanecerán fijados durante el resto de su vida. A partir de entonces se transforman en un adulto completamente distinto a los restantes crustáceos conocidos. Estos organismos constituyen un azote para las instalaciones industriales que utilizan agua de mar para sus sistemas de enfriamiento, donde forman parte de las incrustaciones y organismos indeseables (fouling), y tupen las cañerías y rejas que facilitan la circulación del agua. Desde el punto de vista morfológico los cirripedios se pueden dividir en tres grupos. Al primero de ellos pertenecen los que presentan su masa visceral encerrada en un capítulo, que está separado del sustrato mediante un pedúnculo de fijación, como sucede, por ejemplo, en el género Lepas. Este grupo posee como mínimo, cinco placas fundamentales: una carina, dos tergos y dos escudos. Poseen su pedúnculo completamente desnudo o cubierto de escamas. Al segundo grupo pertenecen las especies que no poseen pedúnculo de fijación, con lo cual el capítulo se asienta 129 directamente sobre el sustrato, como sucede en el género Balanus. Al tercer y último grupo de cirripedios pertenecen los saculínidos constituidos por unas pocas especies que son eminentemente endoparásitas, sobre todo de crustáceos decápodos. Se han registrado 23 especies en Cuba. A la clase Malacostraca pertenecen los crustáceos más evolucionados y más conocidos. Veremos inicialmente a los representantes de la subclase Phyllocarida, la cual incluye al orden Leptostraca. A este grupo de no más de 25 especies pertenecen los crustáceos conocidas como nebaliáceos. Se caracterizan por presentar un abdomen compuesto por 7 segmentos, lo cual es un caso único entre los crustáceos malacostracos. Son muy fáciles de distinguir, ya que presentan un rostro articulado y pequeño, que posee la apariencia de una visera de gorra, así como un carapacho compuesto por dos piezas o valvas unidas en su dorso, dentro de las cuales queda incluida toda la región torácica y la mitad de la abdominal. A ambos lados del rostro aparecen los ojos compuestos y no poseen urópodos. Son relativamente abundantes sobre fondos de Thalassia o de microalgas. Hay dos especies registradas para Cuba. Squilla rugosa, estomatópodo Cornuda diadema, cirripedio ectoparásito de una ballena (Fotos de M. Ortiz). La subclase Eumalacostraca incluye los restantes crustáceos no decápodos. Al superorden Hoplocarida, orden Stomatopoda pertenecen las esquilas o galeras, que poseen el cuerpo alargado, las anténulas tri-ramosas y las antenas bi-ramosas con escama antenal bien desarrollada. Poseen un carapacho cubriendo la cabeza y los cuatro primeros segmentos del tórax. Las hembras suelen portar sus huevos, con la ayuda de los toracópodos anteriores, pues los pleópodos en los estamotópodos, son respiratorios. Se trata de un grupo de crustáceos depredadores sumamente voraces, capacitados para cortar en dos, cualquiera de sus presas, que pueden ser hasta peces y camarones. En Cuba se conocen 16 especies, de las cuales las pequeñas pueden ser observadas entre las microalgas. Una buena parte de las de mayor talla, son muy abundantes en la captura incidental (morralla) que se obtiene en la pesca de camarones. El superorden Peracarida, se caracteriza porque las hembras generalmente poseen un marsupio formado por varios pares de oostegitos. Hay representantes de seis órdenes en Cuba con más de 280 especies. El primero de ellos, es el orden Amphipoda. Generalmente no sobrepasan un cm de largo corporal. Los dos primeros pares de apéndices toráxicos casi siempre subquelados y fuertes, sobretodo en los machos. Existen cuatro subórdenes, de los cuales tres están representados en el Archipiélago Cubano. El último, incluye una especie de la familia Cyamidae, ectoparásito de una ballena. Los anfípodos del suborden Gammaridea son los más complejos de estudiar, ya que cuenta con más de 4 500 especies conocidas. En Cuba han sido registradas cerca de 100 especies marinas, estuarinas y dulciacuícolas. Se caracterizan por poseer la cabeza bien proporcionada; ojos 130 relativamente pequeños; el lóbulo externo del maxilípedo bien desarrollado; presentan su cuerpo generalmente comprimido lateralmente; con un pleón con 3 pares de pleópodos y un urón con tres pares de urópodos bien diferenciados Son casi todos bentónicos, simbiontes, epigeos e hipogeos. No hay especies parásitas. Los del suborden Hyperiidea son anfípodos que se caracterizan por presentar generalmente los ojos muy desarrollados, pues se trata de especies depredadoras. Su cuerpo suele ser comprimido lateralmente, pero algunos lo poseen muy alargado y casi cilíndrico. Poseen maxilípedo sin lóbulos externos. Sus pleópodos son muy desarrollados para la natación. Son sumamente abundantes y de hábitos pelágicos, alcanzando a veces grandes profundidades. Algunos son simbiontes de medusas y otros integrantes del plancton gelatinoso, como salpas y doliolos. Se conocen cerca de 300 especies, que aparecen distribuidas por todo el océano mundial. Suelen formar parte de la dieta de los grandes cetáceos marinos, pero también de ciertos peces. Se han registrado 21 especies para Cuba. Los del suborden Caprellidea, poseen el tórax de su cuerpo cilíndrico y alargado, y su abdomen está reducido considerablemente, mientras que sus pereiópodos 3 y 4 pueden ser vestigiales o alargados. Suelen vivir colgados de las colonias de briozoos o de hydrozoos, pero también sobre las ramas de Sargassum flotante. Son todos marinos y estuarinos. Hay menos de 10 registros de especies en las aguas cubanas. El orden Isopoda incluye las cochinillas, que se caracterizan por poseer generalmente el cuerpo deprimido, con la cabeza delante o inmersa en el borde anterior del primer segmento torácico, presentar los segmentos abdominales más o menos fusionados, llevar las ramas de los urópodos de no más de dos artejos y poseer un pleotelson posterior. En Cuba existen representantes de seis subórdenes. Los de Anthuridea son muy alargados, con los urópodos del pleotelson curvados hacia arriba, formando un cono. Se conocen cerca de 15 especies en las aguas cubanas. Los del suborden Gnathiidea poseen una mandíbula muy exagerada, que sobresale hacia delante, por debajo de la cabeza, poseen solamente cinco pares de pereiópodos, pero seis segmentos toráxicos. Son ectoparásitos de peces en una fase de su vida. Los del suborden Asellota poseen el cuerpo cilíndrico, con el primer par de pleópodos siempre presente en los machos, aunque puede faltar en las hembras. El primer par de pereiópodos del macho es siempre subquelado. Son abundantes en los mares cubanos. Los del suborden Valvifera son los isópodos más comunes y conocidos. Su cuerpo suele ser ovalado en vista dorsal y su cabeza y pleotelson redondeados. A este grupo pertenecen las familias Sphaeromatidae y Limnoridae, taladradores considerados una plaga a nivel mundial, por los intensos daños que provocan en cualquier tipo de madera introducida en el mar. Los del suborden Oniscidea son generalmente semiterrestres y fáciles de encontrar en las rocas o sobre la arena, mientras que los del suborden Epicaridea son parásitos de otros crustáceos tales como camarones, cangrejos ermitaños, y anfípodos. No están bien estudiados. Las especies de las familias Cymothoidae, Aegidae, Cirolanidae y Gnathiidae suelen ser ectoparásitos de los peces. Se fijan usualmente en las bases de las aletas, alrededor de los ojos o sobre la lengua de su hospedero. Se han registrado para Cuba 110 especies de isópodos marinos y estuarinos. Los crustáceos del orden Mysidacea (ahora órdenes, Lophogastrida y Mysidacea) presentan un aspecto exterior muy semejante al de un camarón comercial. Se diferencian de estos por ser mucho más pequeños, raramente sobrepasando un cm de largo total; poseen generalmente, un estatocisto en la base del endopodito del urópodo y llevan un marsupio pequeño, en el caso de las hembras. Los machos exhiben sus pleópodos mucho más desarrollados que las hembras. Algunas especies son supra-bentónicas, otras bentónicas o espongícolas. Hay 25 especies marinas, estuarinas, y dulciacuícolas del grupo, conocidas para el país. 131 Los peracáridos del orden Cumacea se caracterizan por presentar la región del cefalotórax en forma abultada, donde casi siempre exhiben un pesudorostro de dos piezas, que protegen el rostro. El abdomen es delgado y largo y puede o no llevar pleópodos. El telson casi siempre es corto y los urópodos suelen ser mucho más largos. Las antenas de los machos son siempre muy alargadas. Hay cumáceos bentónicos, algunos de los cuales suelen ser espongícolas. Se han registrado 15 especies, todas marinas, para el Archipiélago Cubano. Al orden Tanaidacea pertenecen los peracáridos de cuerpo cilíndrico, muy semejantes en apariencia a los isópodos antúridos, pero se diferencian de estos por poseer siempre el primer par de pereiópodos quelados y los urópodos multi-articulados. Se trata de un grupo de crustáceos únicamente marino en el país. Son muy comunes las hembras de Leptochelia spp. Han sido reportados para Cuba 13 especies del grupo. Finalmente, dentro del superorden Eucarida, tenemos los representantes del orden Euphausiacea, que se distinguen por presentar un cefalotorax completo, no poseer maxilípedos; llevar apéndices bi-rramosos y branquias externas. Se trata de un grupo que puede confundirse con pequeños camarones. Son eminentemente gregarios y pelágicos. Se han registrado para Cuba solo seis especies. En este CD-ROM se presenta la lista de especies registradas para Cuba, la cual se basa fundamentalmente en el trabajo de Ortiz y Lalana (1998). Artropodos - Filo ARTHROPODA, Crustáceos Subfilo Crustacea: cangrejos, camarones, langostas y anomuros Clase MALACOSTRATA, Orden DECAPODA Juan Carlos Martínez-Iglesias 18 Los crustáceos decápodos incluyen una gran diversidad de taxones marinos, de agua dulce, terrestres y semi-terrestres. Se distinguen por la presencia de un carapacho bien desarrollado que encierra las cámaras branquiales (branquiosteguitos) y por la modificación de los primeros tres pares de toracópodos como maxilípedos. Los restantes cinco pares son típicamente patas ambulatorias o pereiópodos andadores (McLaughlin, 1980). De estas patas ambulatorias o caminadoras algunas pueden presentar modificaciones, e inclusive, el último par puede estar muy reducido o ausente (Guzmán, 2003). Los crustáceos juegan un papel ecológico muy importante por su función de transferir la energía desde los niveles tróficos bajos a los más altos en la trama alimentaria (González-Sansón, 1984). Gracias a su alta densidad y biomasa en los ecosistemas costeros, constituyen la base alimentaria principal de numerosas especies de peces comerciales. Entre los decápodos, se destacan valiosos recursos pesqueros, principalmente las langostas (palinúridos y nefrópsidos), los camarones (peneidos y carideos) y los cangrejos y jaibas (estos últimos cangrejos nadadores). Los decápodos poseen variadas formas de alimentación, como filtradores (algunos anomuros), carroñeros (algunos braquiuros), depredadores (carideos y dendrobranquiados) y detritófagos (algunos braquiuros y callianásidos entre otros). 18 Instituto de Oceanología, Ministerio de Ciencia, Tecnología y Medio Ambiente. Ave. 1ra # 18406, Reparto Flores, Playa, La Habana, Cuba. C.P. 12100. jcarlos@oceano.inf.cu 132 La distribución de los decápodos abarca todas las latitudes y regiones del planeta y una gran variedad de hábitats, desde la zona costera terrestre pasando, por la franja intermareal, hasta las grandes profundidades, y en ecosistemas tan complejos como los ambientes hidrotermales en la zona afótica y profunda. Las especies que habitan en las cuevas o en la capa afótica, presentan adaptaciones sensoriales especializadas para orientarse y proveerse de alimentos y por lo general son ciegos y tienen sus córneas despigmentadas. Entre los crustáceos, el orden de los Decápodos posee el mayor número de especies, unas 10 000 (Ruppert y Barnes, 1994), que equivalen a casi una tercera parte de las conocidas para la clase. En el Atlántico occidental este grupo ha recibido atención desde los trabajos de GuérinMéneville (1856), aunque no es hasta finales del siglo XIX cuando empezaron a estudiarse con mayor intensidad. En la actualidad se conocen unas 1 100 especies aproximadamente en esta región. En Cuba se han registrado 642 especies (ver lista en este CD-ROM), que pertenecen a 59 familias y a 276 géneros. La Tabla 5 relaciona los principales grupos representados en aguas cubanas, el número de especies en cada uno y las familias con mayor diversidad de especies, entre las cuales se distinguen el infraórdenes Caridea y las familias Majidae y Xanthidae (Brachyura), muchas de cuyas especies, se reportan entre las más abundantes en la dieta de los peces comerciales (Sierra et al., 2001). Tabla 5. Infraórdenes de Decapoda presentes en aguas cubanas y familias con mayor diversidad de especies. Infraorden No. % Familias No. % sp Sp. Stenopodidea 7 1,1 Stenopodidae 3 0,6 Caridea 136 21,1 Majidae 79 12,3 Astacidea 10 1,5 Xanthidae 72 11,2 Thalassinidea 11 1,7 Alpheidae 54 8,4 Palinura 11 1,7 Galatheidae 45 7,0 Anomura 117 18,2 Palaemonidae 28 4,3 Brachyura 331 51,5 Los infraórdenes Caridea y Brachyura han sido relativamente bien estudiados, aunque algunos grupos por su complejidad sistemática (por ejemplo las familias Xanthidae, Goneplacidae y Pinnotheridae) requiren de mayor atención. Otros grupos como Anomura (las familias Diogénidae y Paguridae) y Thalissinidea han recibido menor atención. Considerando la composición y distribución de las especies de Decápodos en el Gran Caribe estimamos, conservadoramente, que entre 95 y 130 especies no registradas hasta ahora, tienen probabilidades de estar presentes en aguas cubanas. Las especies de la familia Gecarcinidae, que habitan en el ambiente terrestre y/o asociadas al manglar, están representadas por tres especies, siendo muy abundantes Cardisoma guanhumi, Gecarcinus ruricola y Gecarcinus lateralis. Dichas especies completan su ciclo reproductivo en el medio marino, donde se desarrollan los juveniles o megalópas (según la especie). Algunas especies marinas como Grapsus grapsus y Ocypode quadrata (pertenecientes a las familias Grapsidae y Ocypodidae respectivamente) de manera esporádica o habitual incursionan en ambientes terrestreestuarinos, como playas y áreas rocosas (Powers, 1997), en la zona intermareal, en la línea posterior de las áreas de las dunas, entre la vegetación de la línea costera, en cuevas y grietas cerca del agua (Abele y Kim 1986). 133 Asociadas a la parte emergida del manglar también se encuentran algunas especies de Uca, Callinectes sapidus, Callinectes ornatus, etc. Entre las raíces del manglar habitan muchas especies de peneidos, carideos, braquiuros y langostas, en especial sus portlarvas y juveniles. Algunas formas típicas (a nivel de familias) de los crustáceos decápodos presentes en aguas cubanas. El número de especies de decápodos en los pastos marinos es muy variable, fluctuando entre 23 y 77 en los muestreos realizados. Son dominantes (por sus índices de abundancia relativa y presencia), Alpheus normani, Periclimenes americanus, Portunus depressifrons, Pitho aculeata, Mithrax sculptus, Pitho lherminieri, Panulirus argus. En el Golfo de Batabanó las dos primeras especies y la langosta espinosa (Panulirus argus) son las especies más abundantes en este hábitat. La diversidad específica de decápodos en el mismo puede considerarse de media a alta, según la densidad y desarrollo de las hojas de T. testudinum, otras fanerógamas y las macroalgas. En pastos marinos muy densos, generalmente la diversidad de especies es alta, mientras que en fondos fangosos y desprovistos de vegetación la diversidad es muy baja y variable: entre 2 y 12 especies (Martínez-Iglesias y Alcolado, 1990). Cangrejo araña, Stenorynchus seticornis sobre un coral (Foto: Noel López) Camarones boxeadores, Odontodactylus hispidus, en el ósculo de una esponja (Foto: Rafael Mesa) 134 Según Martínez-Iglesias y García-Raso (1999) la mayor diversidad de especies fue observada en las lagunas arrecifales con valores del Índice de Riqueza (R’) de Margalef (1977) entre 10,1 y 12,2 y en la pendiente externa con valores que fluctuaron entre 8,3 y 12,.6 (Martínez-Iglesias y García-Raso, 1999). En total fueron registradas 142 especies de decápodos en las lagunas arrecifales y 121 en la pendiente externa. En las lagunas arrecifales, los representantes más notables por su presencia y abundancia relativa (con la excepción de la langosta Panulirus argus) fueron Alpheus peasei, Pitho aculeata, Mithrax coryphe, Synalpheus dominicensis, Micropanope nuttingi y Pitho lherminieri. En las crestas arrecifales (incluyendo zonas de embate, meseta y trasera) predominaron Paraliomera longimana, Mithrax pilosus, Paguristes cadenati, Paraliomera dispar, Mithrax coryphe, Metalpheus rostratipes, Petrolisthes galathinus, Mithrax sculptus, Paguristes grayi, Mithrax holderi, Calcinus tibicen y Thunor simus. Las especies más notorias en la pendiente externa fueron: Paguristes grayi, Mithrax holderi, Synalpheus paraneptunus, Stenorhynchus seticornis, Mithrax coryphe, Automate evermani. Según los autores antes mencionados en el complejo de la cresta arrecifal se encontró la menor diversidad de decápodos, con valores de R´ entre 7,4 y 8,1 y un total de 81 especies, lo cual parece ser resultado de las perturbaciones ocasionadas por un mayor hidrodinamismo. En Cuba la langosta Panulirus argus (Latreille, 1804) constituye el renglón económico exportable fundamental de la industria pesquera. Sus capturas alcanzaron las 13 600 TM en 1985, pero se considera su potencial sostenible entre 8 000 y 9 000 TM anuales A pesar de que han ocurrido deficiencias ocasionales en su manejo (aunque suficientes para ocasionar impactos importantes en la población de este crustáceo), se considera como el recurso pesquero mejor administrado en Cuba (Baisre, 2004). Los camarones blanco (Litopenaeus schmitti) y dorado (Farfantepenaeus notialis) también constituyen importantes recursos pesqueros en los Golfos de Ana María y Guacanayabo. Sus capturas sobrepasaron las 5 000 TM anuales en la década de los ochenta, pero disminuyeron drásticamente con posterioridad, a pesar de la aplicación de numerosas regulaciones para su protección, al parecer como consecuencia de la degradación de su hábitat. Las capturas actuales no sobrepasan las 2 000 TM anuales. El camarón blanco, ha sido objeto de cultivo a ciclo completo en varias granjas, aunque los rendimientos han estado por debajo de lo esperado. Los crustáceos decápodos constituyen uno de los objetos alimentarios más importantes de los peces comerciales de Cuba. Sierra et al. (2001) reportaron que de 365 especies de peces analizados, el 60% consumen principalmente crustáceos, mayormente decápodos, en particular los peces de importancia pesquera. Resulta pues evidente la gran importancia de estos organismos en las tramas alimentarias y la economía de los ecosistemas neríticos de Cuba. El nivel de conocimientos sobre los crustáceos decápodos en Cuba, aun es insuficiente. En particular deben evaluarse en mayor detalle los arrecifes coralinos, las zonas estuarinas y aguas profundas del talud insular. Las zonas más estudiadas han sido: el Archipiélago de los Canarreos y el Archipiélago Sabana-Camagüey. Las otras zonas han recibido poca atención. Desde la Expediciones del ATLANTIS en los años 1938-39 no se han realizado colectas de esa magnitud en Cuba, aunque ese esfuerzo fue dirigido en lo fundamental hacia las aguas profundas, cercanas a la plataforma. Las principales amenazas a la diversidad de crustáceos en Cuba está dada por la degradación de los biotopos costeros. Las afectaciones a las lagunas costeras y zonas estuarinas de la región suroriental parecen haber afectado las zonas de cría de los camarones comerciales (Farfantepenaeus notialis y Litopenaeus schmitti) y se asume como la causa principal de la reducción actual de sus 135 poblaciones (Baisre, 2004). Tal degradación ambiental pudiera haber afectado a la diversidad de especies de crustáceos en esa región, aunque no se han realizado estudios para evaluar sus efectos. La pesca intensiva, en esos hábitats ya afectados, pudiera haber contribuido a la disminución de las poblaciones de las mencionadas especies comerciales y de su diversidad genética. El excesivo esfuerzo pesquero provocó la suspensión de la pesca de esas especies en la Ensenada de la Broa. El cangrejo comercial Menippe mercenaria ha sido sobrepescado en las aguas interiores del Archipiélago Sabana-Camagüey desde la década de los setenta. Además de un excesivo esfuerzo pesquero, han incidido las disfunciones o aberraciones provocadas en la reproducción de apéndices por la pérdida de estos, tanto de manera natural (por la acción de los depredadores) como por la práctica de utilizar sus muelas para el consumo. La pesca intensiva constituye una amenaza potencial para las jaibas o cangrejos nadadores del género Callinectes, aunque el nivel de explotación actual no parece haber afectado aún sus poblaciones. La conservación de los ecosistemas costeros y marinos es evidentemente la principal vía para el mantenimiento de la biodiversidad de los crustáceos decápodos de la zona marino costera de Cuba. Equinodermos – Filo ECHINODERMATA Rosa del Valle García y Mercedes Abreu Pérez 19 Los miembros de este filo poseen un endo-esqueleto calcáreo formado por placas u osículos compuestos de carbonato de calcio. Tienen el cuerpo generalmente cubierto de espinas o tubérculos y en estado adulto presentan simetría radial pentámera, con las partes del cuerpo organizadas en un eje oral-aboral. La característica más distintiva de los equinodermos es el “sistema acuíferovascular”, compuesto por canales celómicos y apéndices superficiales, con funciones locomotoras y de alimentación. El sistema reproductor es muy simple y la fertilización por lo general es externa. Poseen un sistema nervioso no centralizado, formado por una red con anillos y nervios radiales. Carecen de sistema excretor; son exclusivamente marinos y solo unas pocas especies han logrado adaptarse al medio salobre. Habitan la mayor parte de su vida sobre el fondo del mar, exceptuando algunas especies pelágicas. El filo Echinodermata está integrado por seis Clases: Crinoidea (lirios de mar y estrellas plumosas), Asteroidea (estrellas de mar), Ophiuroidea (estrellas canastas y estrellas frágiles), Echinoidea (erizos y galletas de mar, etc), Holothuroidea (pepinos o cohombros de mar) y Concentrycicloidea (margaritas de mar; Ruppert y Barnes, 1994), las cuales se encuentran representadas en el mundo por unas 6 500 especies (Hendler et al, 1995). Los equinodermos son abundantes (en densidad y/o biomasa) y realizan importantes funciones en el ecosistema marino. En los pastos marinos del Caribe el erizo verde Lytechinus variegatus constituye un elemento fundamental en la movilización de la energía acumulada por la vegetación. Estos organismos consumen grandes cantidades de Thalassia testudinum; pero poseen un bajo coeficiente de asimilación, por lo que la mayor parte de las hojas ingeridas pasan a formar parte del detrito, el cual es consumido por los microorganismos, contribuyendo con ello a acelerar el ciclo de descomposición de la vegetación (Alcolado et al., 2001a; 2001b). 19 Instituto de Oceanología. Ministerio de Ciencia, Tecnología y Medio Ambiente. Ave. 1ra. No. 18406, Rpto. Flores, Playa, La Habana, C.P. 12100. Cuba. rdvalle_chb@yahoo.es y mercedesa@oceano.inf.cu 136 En los arrecifes coralinos de la región caribeña el erizo negro, Diadema antillarum es uno de los herbívoros más importantes. Estos, organismos al “raspar” las superficies duras, controlan el crecimiento de las algas. La mortalidad masiva de esta especie ha sido ampliamente documentada en toda la región Caribeña (Huges et al., 1985; Carpenter, 1988; Forcucci, 1994). Como consecuencia, a principios de la década de los ochenta, se produjo un notable incremento en la cobertura de las algas y una reducción en el asentamiento de las larvas de corales en la región (Huges et al., 1985; Carpenter, 1988; Forcucci, 1994). Ciertas especies de holoturoideos epi-bentónicos que habitan en los sustratos particulados, como Isostichopus badionotus y Holothuria mexicana, son detritófagos, que consumen la microbiota, la materia orgánica y los nutrientes contenidos en los sedimentos, contribuyendo con ello a disminuir la estratificación. Además, enriquecen los sedimentos con sus paquetes fecales, que pueden contener hasta el doble del nitrógeno que el sedimento circundante. En el Archipiélago Cubano han sido registradas 375 especies, representadas por: 33 crinoideos, (Suarez, 1974; Espinosa et al., 1997) 75 asteroideos, (Abreu, 1997; Fernández, 2001); 154 ofiuroideos (Abreu, 1990 y 2003); 63 equinoideos (Abreu et al., 2000) y 48 holoturoideos. Solo la clase Concentrycicloidea no ha sido registrada en Cuba. Algunas especies de equinodermos, representativas de las clases presentes en Cuba. De las 33 especies de crinoideos, solo 8 (23 %) han sido observadas en profundidades menores a 30 m y todas ellas pertenecen al grupo de las estrellas plumosas. Estos organismos habitan en los arrecifes coralinos escondidos durante el día entre las oquedades de las rocas o los 137 corales, y por las noches salen de sus escondites o extienden sus brazos para alimentarse. En este hábitat se destacan por su frecuencia las especies Nemaster rubiginosus y Nemaster discoideus. Las restantes 26 especies se distribuyen de manera no uniforme a partir de 30 m hasta las grandes profundidades oceánicas, como ocurre con Coccometra hagenii, la cual ha sido colectada a una profundidad de 1 046 m. La Clase Asteroidea está representada en aguas cubanas por 75 especies, 20 de las cuales (26 %) se distribuyen en la zona nerítica. Entre ellas, las estrellas Linckia guildingüi y Ophidiaster guildingüi han sido encontradas con mayor frecuencia en los arrecifes coralinos; mientras que en los sustratos arenosos con macrovegetación la más frecuente y abundante es la estrella Oreaster reticulatus. En las bahías y lagunas costeras, donde predominan los sedimentos areno-fangosos, en muchos casos sin vegetación, puede observarse con relativa frecuencia a la estrella de nueve brazos Luidia senegalensis, reconocida como una voráz carnívora, en cuyos estómagos se ha encontrado un número considerable de bivalvos. En las playas o las planicies arenosas puede observarse, con relativa frecuencia a Astropecten duplicatus, la cual es también conocida por ser un importante depredador de bivalvos. De las 56 especies de asteroideos que comienzan su distribución a profundidades mayores a los 30 m, se destacan las especies Benthopecten spinosus y Pteraster aciculata, registradas en profundidades entre 1 300 y 3 700 m la primera y entre 260 y 3 712 m la segunda. La estrella de mar, Oreaster reticulatus (foto IdO, a la izquierda) es quizá la especie más conocida entre los asteroideos. Ha sido tradicionalmente utilizada con fines ornamentales, por lo que sus poblaciones requieren ser evaluadas y protegidas. Algunas estrellitas frágiles, como Ophiomyxa flaccida (Foto de Noel López, a la derecha) habitan en las oquedades de los arrecifes o debajo de las rocas, por lo que son poco visibles. La clase Ophiuroidea es la mejor representada en todos los biotopos costeros del Archipiélago Cubano tanto por el número de especies (163) como por su frecuencia y abundancia. A profundidades menores de 30 m, se han encontrado 55 especies destacándose en los arrecifes coralinos la presencia de los géneros Ophiomyxa, Astrophytom, Ophiocoma, Ophioderma y Ophiothrix. En los sustratos particulados con macrovegetación, se destacan por su frecuencia Ophiolepis paucispina y Ophionereis reticulata, mientras que en los sustratos particulados sin vegetación de las bahías, lagunas costeras, playas o planicies arenosas, los ofiuroideos más frecuentes son Amphiodia trychna y Amphipholis gracillima. En áreas semi-cerradas con escasa o muy poca circulación de agua, donde existe gran aporte de materia orgánica, como es el caso de la Bahía de Santa Clara (centro-norte de Cuba), han sido registradas densidades muy elevadas de Ophiothrix suensonii (hasta 8,84 ind/m²) y Ophiothrix angulata (hasta 7,57 ind/m²; del Valle et al., 138 2002) ambas asociadas a macroalgas del género Laurencia. En los manglares, los ofiuroideos más frecuentes son: Ophiopsila riisei y Ophionereis olivacea. Es interesante que la única especie de estrella frágil registrada en el litoral rocoso es Ophioderma brevicadum. y las dos especies encontradas a mayores profundidades son: Homolophiura abyssorum y Ophiomusium lymani (983 m y 584 m respectivamante). De los 63 equinoideos registrados en Cuba, 22 han sido observados en profundidades menores a 30 m, destacándose, tanto por su frecuencia como por su abundancia, (en densidad y biomasa), las especies Echinometra lucunter, Echinometra viridis, Eucidaris tribuloides, Tripneustes ventricosus y Diadema antillarum. Esta última, antes de la década de los ochenta era muy abundante en el litoral rocoso de Cuba, donde cohabitaba cona Echinometra lucunte. Sin embargo, después de la mortalidad masiva del erizo negro, E. lucunter es la más frecuente y abundante de este biotopo. Alcolado et al. (2004c) evaluaron las densidades de D. antillarum en 199 crestas arrecifales del Archipiélago Cubano y demostraron que la recuperación de esta especie está ocurriendo muy lentamente, aunque existen algunos sitios de Jardines de la Reina (9,25 a 21,1 ind/10 m²) y del Golfo de Batabanó (5,8 a 11,7 ind/10 m²) en los cuales las densidades fueron, de muy elevadas a moderadas. En los sustratos particulados areno-fangosos con macrovegetación, las especies Meoma ventriciosa y Clypeaster rosaceus han sido encontradas en grandes densidades, pudiendo ser esta última, también abundante en los fondos arenosos. En los sustratos fangosos sin macro-vegetación de las bahías y lagunas costeras Moira atropus es la más frecuente; mientras que en las playas y/o las planicies arenosas protegidas Leodia seiexperfora la especie más frecuente y abundante. Las especies del filo Echinodermata encontradas a mayor profundidad fueron: Pourtalesia miranda (450-5850 m) y Aceste bellidifera (550-5220 m). En la década de los setenta el erizo Arbacia punctulata era encontrado con una alta frecuencia en la Bahía de Cárdenas (M. Ortíz, com. pers.), sin embargo, en los inventarios realizados por las autoras de este trabajo, a partir de la segunda mitad de la década de los ochenta en todo el Archipiélago Sabana-Camagüey, no se encontró ningún ejemplar. Erizo negro (Diadema antillarum, a la izquierda). Después de una epidemia que devastó las poblaciones en el Caribe, parece haberse incrementado la proporción de ejemplares con espinas blancas (Foto: Andrés Jiménez Caballero). El tegumento del pepino de mar, (Isostychapus badionotus,a la derecha) es apreciado como alimento en varios países, y sus 139 órganos internos son portadores de sustancias biológicamente activas. Habita preferentemente en aguas tranquilas tanto en fondos blandos como en arrecifes coralinos (Foto: Noel López) De las 51 especies de holoturoideos registradas en Cuba, 26 habitan en profundidades mayores de 30 m y las 25 restantes se distribuyen en los diferentes biotopos presentes en la plataforma insular. El pepino de mar, Actinopyga agassizi, se encuentra con frecuencia en los arrecifes coralinos, mientras que Holothuria thomasi, que habita exclusivamente en este hábitat, no es tan común. Las especies más frecuentes y abundantes en los pastos marinos son Holothuria mexicana y Holothuria floridana. En las bahías y lagunas costeras se encuentra Isostichopus badionotus, en ocasiones en densidades muy elevadas, y en las playas o las planicies arenosas es común Holothuria arenicola. Los pepinos de mar tienen alta demanda en el mercado internacional, en especial en los países asiáticos, ya que con ellos se elabora el famoso trépan o bêche de mère. De las 51 especies registradas en Cuba, solo Isostichopus badionotus se explota con esos fines. La pesca de esta especie se inició a fines de 1999. Durante los dos primeros años, se capturaron más de tres millones de individuos, sin embargo, en los años posteriores ocurrió una disminución de la captura y el esfuerzo (Alfonso et al., 2004a) aunque se recuperó posteriormente. Actualmente las principales zonas de pesca son: el noreste del Golfo de Guacanayabo, la región al sur de Santa Cruz del Sur y Ciego de Ávila, el noreste de la Isla de la Juventud y algunas bahías al norte de Holguín (Alfonso et al., 2005). El mayor potencial se encuentra en el sistema de cayos del Canal del Pingües y regiones adyacentes (Alfonso et al., 2004a; Alfonso et al., 2005). Algunas especies de equinoideos tienen también una alta demanda en el mercado internacional, debido a que sus huevas son muy apreciadas para el consumo humano. En Cuba los erizos no han sido aún explotados con fines comerciales. Numerosas especies de equinodermos poseen sustancias con actividad biológica (anticancerígena anti-oxidantes, anti-micótica, etc.) por lo que en algunas instituciones científicas del país, se han realizado investigaciones encaminadas a aislar éstos compuestos, con la perspectiva de desarrollar su utilización sostenible. El filo Echinodermata es uno de los grupos de invertebrados bentónicos mejor estudiados en Cuba. Las primeras investigaciones datan desde finales del siglo XIX y se ha publicado hasta la fecha un número considerable de artículos relacionados con la sistemática, la biología, la ecología y la bio-indicación. (Abreu, 1990; 1997; 2003; Abreu et al., 2000; 2005; Del Valle y Abreu, 2004; Del Valle et al., 2000; 2005; Espinosa et al., 1997 y otros). Las zonas mejor estudiadas son: Archipiélago Sabana-Camaguey, Archipiélago de los Canarreos, Archipiélago Jardines de la Reina y costa norte Habana-Matanzas. Sin embargo, es escasa la información existente sobre los equinodermos del Archipiélago de Los Colorados, del norte y sur de la región oriental, de la costa sur del Macizo de Guamuhaya y de la Península de Guanahacabibes. El nivel de conocimientos también difiere a nivel de hábitats, siendo los menos estudiados los manglares, las costas rocosas bajas y acantiladas, los sedimentos arenosos y fangosos con cobertura de vegetación sumergida inferior al 10 % y las playas. 140 Brizoos - Filo BRYOZOA Norberto Capetillo Piñar 20 Los briozoos son animales coloniales, que pueden formar parches sobre el substrato de 7 a 10 cm de diámetro o pueden elevarse sobre este en estolones y como formas arborescentes o foliáceas (Soule y Soule, 1995). Los individuos (zooides) que las conforman suelen medir menos de un mm de longitud, y están encerrados en una cubierta protectora (zooecio), generalmente calcificada, la cual porta un conjunto de ornamentaciones, diseños o estructuras que son muy usadas en su clasificación. Suelen agruparse con los filos Phoronida y Brachiopoda bajo el término de celomados lofoforados, ya que todos los miembros de estos grupos poseen un órgano para capturar alimentos llamado lofóforo, un celoma dividido, secretan una cubierta protectora y salvo algunos braquiópodos, poseen aparato digestivo en forma de U (Ruppert y Barnes, 1994). Este filo se distribuye por casi todos los mares del mundo y es muy común hallarlos en diferentes biotopos,, desde los someros hasta los profundos y alejados de la costa. Según J.van der Land (1994), se conocen unas 5 000 especies vivientes, las que se agrupan en 147 familias y 330 géneros, aunque gracias a la aplicación de nuevas técnicas de microscopia y estudios recientes, ya debe haberse sobrepasado esas cifras. Un dato curioso es que se han registrado unas 15 000 especies extintas de briozoos, que abundaron en los mares durante el Paleozoico, hace unos 200 millones de años, conjuntamente con lo braquiópodos (Shrock y Twenhofal, 1953). La fauna de briozoos recientes de las plataformas continentales de América, desde los Golfos de California y de México por el norte hasta el Cabo de Hornos, han sido objeto de estudios desde hace más de siglo y medio (Moyano, 1980). Se conocen para el Golfo de México al menos 226 especies. En Cuba, Canu y Bassler (1928) registraron 51 especies de aguas someras y profundas, aunque sólo para algunos sitios de la costa norte de la provincia de La Habana. Otros autores aportaron informaciones sobre la composición de especies y distribución en varios biotopos, aunque en muchos casos a nivel de géneros (Kuchirova, 1967; Cook, 1977; Gómez, 1985; Lalana et al., 1985 y Lalana y Ortiz, 1992). Zlatarski y Martínez-Estalella (1982) encontraron 43 especies como fauna acompañante de los corales escleractínios de Cuba, de las cuales 39 especies habían sido reportadas por Canu y Bassler (op. cit.) y cuatro constituyeron nuevos registros. Capetillo et al. (2002) presentaron recientemente una organización taxonómica del grupo en Cuba. Hasta la fecha se han registrado 60 géneros y 84 especies agrupadas en 37 familias. Cuatro géneros: Aetea, Thalamoporella, Diaperoforma y Cupuladria y doce especies: Reginella floridana, Reteporella prominens, Stylopoma informata, Margaretta buski, Aetea ligulata, A. truncata, Bugula neritina, B. stolonifera, Cupuladria canariensis, Diaperoforma radicata, Membranipora tuberculata y Thalamoporela distorta son nuevos registros para las aguas cubanas (ver lista de especies en este CD-ROM). En Cuba los briozoos se encuentran en casi todos los biotopos de la plataforma, hasta las aguas profundas. Las fases larvales también se localizan en el océano, formando parte del zooplancton (Marikova, y Campos, 1967). Estas muestran una marcada selectividad específica por el substrato (Ryland, 1959). Especies como Stylopoma informata, Bugula neritina, Steginoporella 20 Centro de Investigaciones Pesqueras, Ministerio de Industria Pesquera 5ta. Ave. y Calle 246, Santa Fé, Playa. Ciudad Habana. Telef: (537) 209-7875, Fax: (537) 204-5895. norberto@cip.telemar.cu, norbertcap@yahoo.com 141 magnilabris, son comunes sobre substratos duros como corales, rocas y conchas de moluscos, entre otros. Thalamoporela distorta y Membranipora tuberculata aparecen con frecuencia sobre las macroalgas Sargasumm sp. y Halimeda sp. Aetea ligulata y A. sica, son comunes como fauna epifita de Thalassia testudinum, y de algunas macroalgas, aunque a veces se localizan sobre otras colonias de briozoos como Stylopoma informata. Sobre las raíces de los mangles, las especies más frecuentes son: Bugula stolonifera, B. neritina y Zoobotrium sp., las cuales suelen encontrarse asociadas con esponjas, hidroides, poliquetos y anfípodos. En las praderas de Thalassia testudinum se han colectado especies pertenecientes a los géneros: Aetea, Membranipora, Thalamoporela y Scruparia (este último es un nuevo registro para aguas cubanas), los que en su mayoría se asocian con hidroides y esponjas. Las especies más comunes en los arrecifes coralinos son: Steginoporella magnilabris, Smittipora sp., Parellisina curvirostris, Stylopoma spongitis y Exechonella antillea. La mayoría de ellas son crípticas y habitan en las grietas, pequeñas cuevas y en la cara opuesta a la luz de los corales muertos. También es común encontrar algunas colonias de estos organismos sobre las conchas de moluscos muertos y rocas sueltas. Algunos briozos presentes en las aguas de la plataforma cubana. Los briozoos tienen una importante función en los arrecifes coralinos, pues contribuyen a mantener el equilibrio entre los corales y las algas. (Soule y Soule, 1995). Estos organismos se emplean en la actualidad como indicadores de estrés ambiental, provocado tanto por la actividad 142 antrópica (contaminación orgánica e impacto del buceo sobre las comunidades sublitorales (Garrabou et al., 1998), como por eventos meteorológicos como los monzones (Sholz, 1990), lo que les confiere un gran valor para los estudios de monitoreo ambiental. Gracias a que sus exoesqueletos han contribuido a la formación de las rocas calizas de muchos estratos geológicos, por lo que pueden ser útiles en los estudios de los núcleos extraídos en los sondajes realizados en la prospección de petróleo (Storer y Usinger, 1972). Los briozoos, conjuntamente con otros organismos, constituyen una parte importante de los llamados “crecimientos marinos indeseables” (“fouling”), ya que llegan a formar grandes y masivas incrustaciones sobre los cascos de las embarcaciones, en los conductos de toma de agua para refrescamiento de las industrias, sobre muelles y pilotes, etc. En Cuba estas asociaciones están formadas por gusanos tubulares, cirrípedios, tunicados, hidroides, macrofítas y briozoos (Kuchirova, 1967). En Cuba los briozoos del género Schiporella ocupan el primer lugar como componentes de las incrustaciones, seguido por Bugula spp. Con una menor frecuencia de aparición se han observado a los géneros Arachnidium y Bowerbankia y raras veces a los integrantes del género Scrupocellaria (Kuchirova, 1967). La especie más común es Bugula neritina, la cual se desarrolla sobre substrato de madera o metal, formando densas agrupaciones. Stylopoma informata ha sido observada sobre pilotes de madera, metal y concreto, y puede llegar a cubrir más de las tres cuartas partes de la superficie de los pilotes de madera sobre los cuales se asientan algunos centros de acopio para la pesca, ubicados en el Golfo de Batabanó. Zoobotium verticillatum 143 Por otra parte, los briozoos son portadores de sustancias biológicamente activas con acción anti-cancerígena. Bugula neritina, por ejemplo, constituye la fuente fundamental para la extracción de una sustancia llamada Bryoestatina, la cual tiene la propiedad de detener el crecimiento de las células cancerígenas (Dominick, 2003). Similares propiedades se han encontrado en Zoobotrium sp., por lo que ambas son potencialmente utilizables en la lucha contra el cáncer. Estas especies, aunque están presentes en aguas cubanas, no soportarían una extracción continuada por lo que para su explotación se requeriría desarrollar técnicas de cultivo y otras tecnologías. En general el nivel de conocimientos en Cuba sobre los briozoos es pobre y no existe literatura especializada acerca de su ecología y distribución. La mayoría de las informaciones se limitan a listados de especies registradas como fauna acompañante de otros organismos o de inventarios generales realizados en cinco de las nueve zonas de la plataforma, aunque con bajo y muy variable número de muestreos. Estos se han concentrado en los arrecifes coralinos, mientras que los otros biotopos han sido muy pobremente estudiados. Considerando las potencialidades de las especies de este filo como portadores de bioactivos, resulta importante la realización de inventarios en todas las zonas y biotopos de la plataforma, así como estudios biológicos detallados de las especies con perspectivas. Filo ENTOPROCTA* Este pequeño filo incluye unas 150 especies marinas sésiles (con excepción del género Urnatella, de agua dulce) de pequeña talla (menos de 5 mm) que viven fijos a las rocas, conchas, muelles, o son comensales de las esponjas, poliquetos, briozoos y otros organismos. La mayoría son coloniales aunque los miembros comensales de la familia Loxosomatidae son solitarios. Hasta hace poco, este grupo se incluía en el filo Bryozoa por su similitud con dichos organismos (Ruppert y Barnes, 1994). No hay información sobre su presencia en aguas cubanas. Filo PHORONIDA* El filo Phronida esta formado por solo 14 especies de cuerpo agusanado, filtradores, marinos todos, que viven en tubos quitinosos enterrados en la arena o fijos a las rocas, conchas y otros objetos sumergidos, en aguas someras. No han sido estudiados en Cuba Filo BRACHIOPODA* Todas las especies son marinas y habitan desde la zona intermareal hasta grandes profundidades. La mayoría viven fijas a las rocas u otros sustratos duros, aunque algunas formas como las del orden Ligulida habitan en hoyos verticales en la arena o el fango. Se conocen unas 325 especies vivientes, pero la cifra de fósiles de las eras Paleozoica y Mesozoica sobrepasa las 12 000 especies (Ruppert y Barnes, 1994). ). En Cuba, no se han inventariado, con excepción de unas pocas especies registradas por Dall (1886). Las larvas del género Ligula han sido observadas en el plancton de las zonas suroccidental y suroriental de Cuba. 144 Los braquiopodos semejan moluscos bivalvos, por poseer un manto y una concha calcárea de dos valvas, e incluso estuvo incluido en el filo Mollusca hasta mediados del siglo XIX. Gusanos flecha - Filo CHAETOGNATHA* Este filo agrupa a organismos exclusivamente marinos, en su mayoría holoplanctónicos, translúcidos de cuerpo alargado a modo de torpedo, con aletas laterales y caudales para nadar o flotar en la columna de agua. Su longitud fluctúa entre 12 y 30 mm y presentan reproducción hermafrodita, con fertilización interna por espermatoforos. Son sumamente activos y voraces. Atrapan otros animales planctónicos, principalmente larvas de peces y pequeños crustáceos, mediante unas espinas captoras localizadas a ambos lados de la cabeza (Rupert y Barnes, 1994). Se reconocen unas 125 especies en el mundo (Thuesen, 2005). La mayoría habitan en aguas tropi9cales hasta unos 900 m de profundidad, aunque algunas especies sólo pueden vivir en el estrato fótico, restringidas a la zona nerítica o en aguas abiertas. Los quetognatos se han utilizado como indicadores de condiciones hidrológicas como temperatura, salinidad u oxígeno disuelto (Fraser, 1952; Fagetti, 1968). Algunas especies pueden ser utilizadas como marcadores de movimientos verticales de agua, así como para la comprensión de los factores que condicionan la distribución de las poblaciones de peces. Cumplen una importante función en las tramas tróficas pelágicas, al ocupar la segunda posición entre los organismos del zooplancton, en cuanto a abundancia, a continuación de los copépodos (Boltovskoy, 1981). Por otra parte, pueden constituir hospederos intermediarios de algunos parásitos de peces. Algunas especies de quetognatos registrados en el plancton de las aguas cubanas. 145 La sistemática de este grupo ha sido muy pobremente estudiada en Cuba, solo se han registrado nueve especies (Suárez-Caabro, 1955). Campos (1981) refiere la presencia de siete especies en el zooplancton de Golfo de Batabanó. En la región suroriental de la plataforma cubana también se reporta su amplia distribución, así como su predominio numérico en algunos sitios sobre otros grupos del plancton, con excepción de los copépodos (Fabré et al., 1986). PROTOCHORDATA* Historicamente, tres grupos de animales: Hemichordata, Urochordata y Cephalochordata, han sido tratados como miembros del filo Chordata, atendiendo a la presencia de notocordio durante las primeras etapas de desarrollo. Sin embargo, la homología de este carácter en los Hemichordados ha sido cuestionada, por lo que actualmente algunos autores consideran informalmente a esos grupos como Protocordados o cordados primarios (Ruppert y Barnes, 1994). Filo HEMICHORDATA Está constituido por gusanos alargados y solitarios o por colonias tipo hydroides formadas por pequeños zooides, todos marinos. Comprende dos clases, Enteropneusta y Pterobranchia. La primera está formada por unas 70 especies bentónicas de aguas someras, aunque algunas habitan en mares profundos asociadas a chimeneas hidrotermales. Algunas viven bajo las rocas y conchas y muchas especies comunes construyen madrigueras mucosas en el fango o la arena. La Clase Pterobranchia incluye hemicordados epibénticos coloniales marinos, que raramente se encuentran en aguas someras. Sus zooides son pequeños (menos de 5 mm de largo) y semejan briozoos o hidroides. Son más comunes en aguas profundas cerca de la Antártica, pero también se han reportado en aguas tropicales y subtropicales incluyendo las costas de Florida y Bermuda. Filo CHORDATA, subfilo UROCHORDATA Los subfilos Urochordata y Cephalochordata no poseen la columna vertebral típica de los cordados, pero tienen cuatro caracteres distintivos de estos: en alguna etapa de su ciclo de vida: poseen notocordio, un falso cordón nervioso dorsal, ranuras branquiales (hendiduras faringeas) y cola postanal. Tanto el notocordio como el cordón nervioso están ausentes en los adultos. Los urocordados adultos son conocidos como Tunicados. Son animales marinos sésiles, comunes y conspicuos, que poco se parecen a los cordados. Se conocen tres clases: Ascidiacea, Thaliacea y Larvacea (Ruppert y Barnes, 1994). Ascideacea comprende la mayoría de las especies y son los tunicados más comunes. Las otras dos clases están adaptadas a la vida planctónica. Han sido muy pobremente estudiadas en Cuba. PROTOCHORDATA, Filo HEMICHORDATA, Tunicados - Subfilo UROCHORDATA: Ascidias – Clase ASCIDIACEA Aida Caridad Hernández Zanuy8 Los tunicados son organismos estrictamente marinos. Poseen su cuerpo cubierto por una sustancia denominada tunicina. Pueden ser solitarios o coloniales, estos últimos formados por zooides. Este grupo comprende cuatro clases; dos (Thaliacea y Larvacea) son planctónicas, mientras que las otras dos son bentónicas: Sorberacea, que se diferencia porque su faringe no ha evolucionado en un 146 complejo saco branquial y sus especies son exclusivamente abisales, y Ascidiacea caracterizada por no poseer cola durante su vida adulta. La Clase Ascidiacea, está dividida en dos subclases: Enterogona con dos órdenes (Aplousobranchia, Phlebobranchia) y Pleurogona con un solo orden (Stolidobranchia). Estas clases se diferencian según la posición de las gónadas con respecto al tubo digestivo y teniendo en cuenta la estructura del saco branquial en el adulto. Está formada por 19 familias, 156 géneros y 2 300 especies (Monniot et al. (1995). Las ascidias se distribuyen por todos los mares del mundo ocupando sustratos libres permanentemente sumergidos en el mar en numerosos hábitats incluyendo aquellos que se encuentran bajo los hielos polares. Durante su etapa larval poseen una cola que les permite trasladarse en la columna de agua pequeñas distancias hasta encontrar un sustrato adecuado en el cual permanecen el resto de su vida. La distribución geográfica de las ascidias está determinada por su capacidad de dispersión y longevidad de las fases larvarias vágiles, por la capacidad de dispersión de los adultos, las condiciones hidrológicas, los cambios de posición del mar y la tierra durante las eras geológicas y por la disponibilidad de hábitats adecuados (Primo, 2003). Los estudios zoogeográficos en ascidias son muy escasos. Monniot et al. (1995) analizaron la distribución mundial de este grupo, Pérès (1958) y Naranjo (1995) lo hicieron en la provincia mediterránea, Tokioka (1963) en aguas de Japón, Monniot y Monniot (1983) en la Antártica y Primo (2003) en Sudáfrica. Rodríguez (1962) considera como una unidad zoogeográfica para las ascidias, la comprendida desde las islas Bermudas hasta Florianópolis en Brasil (Provincia Atlántico tropical americana), mientras que Millar (1971) coloca el límite norte en Cabo Hateras y el límite sur en Río de Janeiro (Provincia Atlántico tropical y subtropical americana). Este último autor realizó un estimado de 83 especies para el área, aunque estudios recientes elevan a 120 el número total de especies registradas en la región hasta la fecha (Hernández-Zanuy, 2003). Según la distribución mundial de las ascidias propuesta por Monniot et al. (1995), estimo que 37 géneros pudieran estar representados en la provincia definida por Rodríguez (1962). La mayoría de las descripciones corresponden a estudios realizados en el siglo pasado o el anterior, en Puerto Rico, Jamaica, Florida y algunas islas de las Antillas Menores. El estado actual del conocimiento de la sistemática del grupo en esta región es pobre, y existen familias que requieren de una completa revisión. Las ascidias son uno de los principales miembros de las comunidades de organismos incrustantes (“fouling”) en las instalaciones costeras (puertos, dársenas, sistemas de enfriamiento, etc). Son consideradas filtros mecánicos y biológicos de la calidad del agua del mar (Monniot et al., 1995). Un individuo de dos o tres cm puede filtrar de dos a tres litros de agua por hora. También acumulan selectivamente ciertos metales pesados en sus células sanguíneas (Michibata, 1989), por lo que pueden ser utilizadas como indicadores de contaminantes específicos, incluso de la contaminación radiactiva (Papadopoulou y Kanias, 1977). Recientemente las ascidias se han utilizado como organismos bioindicadores para definir el grado de transformación en ecosistemas costeros sometidos a perturbaciones ambientales derivadas de la acción del hombre (Naranjo et al., 1996). Al parecer, las diversas estrategias ecológicas que presentan las ascidias, entre las que se destacan las de tipo químico (Ramos y Ros, 1990), hacen de este grupo un material ideal para el estudio de sustancias bioactivas (Ireland et al., 1993). De los seis compuestos de origen marino con actividad antitumoral que han alcanzado la fase clínica, tres se han aislado de ascidias: Didemnina B, Aplidina y Ecteinascidina 743 (Rinehart, 2000), dos de ellos provenientes de especies comunes en la 147 región Caribeña y en Cuba (Ecteinascidia turbinata y Trididemnum solidum), y una de la región Atlántico Mediterránea (Aplidium albicans). Después de 77 años de colectado el material en la expedición del Albatros, en 1868, Van Name (1945) registró 17 especies para Cuba. Desde entonces se han realizado varios inventarios que demuestran la amplia distribución y abundancia de este grupo, tanto en bahías como en manglares y arrecifes coralinos cubanos (Espinosa et al., 1998; Hernández-Zanuy 1990; 1992; 1999; Hernández-Zanuy y Carballo 2001) los que permitieron, reunir el material necesario para la confección del primer catálogo de las ascidias de Cuba, que incluye 59 especies (Hernández-Zanuy, 2003). Con el presente trabajo se eleva a 62 el número de especies registradas (ver lista de especies en este CD-ROM). La mayor riqueza de especies (36) se encontró en los arrecifes coralinos, en comparación con las bahías (22), los manglares (20) y los fondos blandos con vegetación (19). Junto con otros invertebrados, las ascidias contribuyen a la construcción de ese biotopo (Vasseur, 1977). La composición, distribución, abundancia y diversidad de ascidias en los arrecifes coralinos fue estudiada en cuatro sectores (laguna, complejo de meseta, explanada rocosa abrasiva y pendiente externa) de tres arrecifes del Golfo de Batabanó (Hernández-Zanuy y Carballo, 2001). Las pendientes externas presentaron los mayores valores de riqueza de especies, mientras que las lagunas fueron las zonas de mayor abundancia. En las mesetas y en las explanadas rocosas abrasivas, las ascidias están pobremente representadas. De los tres arrecifes estudiados, el más rico en especies fue el de Cayo Diego Pérez y el más pobre el cercano a Cayo Juan García, aunque en este último se encontró la mayor abundancia. Entre las especies que utilizan como sustrato las bases o zonas dañadas de los corales vivos, y donde la turbulencia es tenue, se destacaron Pyura lignosa, Pyura discrepans, Halocynthia microspinosa y Polycarpa spongiabilis. En las zonas con gran batimiento del agua, donde las ascidias se fijan sobre restos de corales muertos, se destacaron Ascidia interrupta y Cystodytes dellechiajei. Sobre fondo sedimentario con poca turbulencia y sedimentación predomina Pyura munita, mientras que en aquellos donde estos procesos son intensos, Trididemnum solidum es más abundante. Algunas especies de ascidias comunes en aguas de la plataforma cubana Las ascidias, junto a las esponjas, constituyen los grupos más frecuentes y abundantes en las comunidades asociadas a las raíces de mangle rojo en los cayos de la plataforma cubana, gracias al relativamente elevado contenido de materia orgánica (fitoplancton y otras partículas en suspensión) en ese hábitat. Una de las ascidias más abundantes en los manglares de los cayos que bordean el archipiélago cubano es la especie colonial Ecteinascidia turbinata Esta especie posee un ciclo de vida corto, reproducción continua durante todo el año, y posibilidades de fijación y crecimiento sobre sustratos artificiales, lo que facilita su producción a partir del cultivo en el medio natural (Hernández-Zanuy, 2004). Sus poblaciones están siendo utilizadas en el Caribe y en el Mar 148 Mediterráneo con fines productivos, a pequeña escala, para abastecer las demandas de empresas farmacológicas (Carballo, 2000). No obstante, la posibilidad cada vez más creciente de comercialización de esos productos, constituye una alerta para la conservación de las poblaciones de especies potencialmente demandadas como materia prima de estas industrias farmacéuticas (Pain, 1996). Ecteinascidia turbinata (Foto: IdO), muy común en los manglares de Cuba, puede desarrollar poblaciones muy numerosas. Esta especie es fuente de compuestos anti-tumorales e inmuno-moduladores muy prometedores para la cura de algunos tipos de cáncer. Otras especies de ascidias con amplia distribución en diferentes hábitats, están siendo utilizadas en Cuba para la búsqueda de drogas antimaláricas (Ramirez et al., 2004; Mendiola et al., en prensa) y como fuente de enzimas de tipo aspártico-dependiente para el tratamiento del virus del SIDA con resultados alentadores (Ramirez et al., 2004). Las bahías presentan condiciones favorables para el desarrollo de poblaciones numerosas de ascidias, gracias a la alta concentración de nutrientes, la presencia de sustratos duros y el intercambio de aguas provocado por las mareas y las embarcaciones. En las Bahías de Vita y Jururú (costa norte de la provincia Holguín) se encontraron 21 especies pertenecientes a 7 familias y 11 géneros (Hernández-Zanuy, 1999). Las especies más ampliamente distribuídas y abundantes fueron Pyura momus, Rhodosoma turcicum y Phallusia nigra. En la entrada de ambas bahías predominan las familias Pyuridae y Styelidae, mientras que en el interior de la bahía Vita están igualmente representadas las familias Pyuridae y Corellidae. En general, la abundancia del grupo aumenta hacia las zonas más internas de las bahías (3,1-14,7 ind/m2 y 5,6 g/m2) cuando existe un intercambio eficiente de agua con el mar abierto. En las bocas de esas bahías predominan especies comunes a las de los arrecifes coralinos aunque en las primeras, la densidad es baja (0,13-1,4 ind/m2 y 0,6 g/m2). En los fondos blandos de cuerpos de agua semicerrados, como las macrolagunas del Archipiélago Sabana-Camagüey, la diversidad de las ascidias es baja (Espinosa et al., 1998). En esta región se registró la presencia de 19 especies, de las cuales Molgula occidentalis, Microcosmus exasperatus y Microcosmus goanus resultaron ser las especies más ampliamente distribuídas y abundantes. Las densidades fluctuaron entre 0,5 y 20 individuos por minuto de rastreo, aunque alcanzó 139 ind/min en una estación. Los estudios de las ascidias de aguas cubanas se han limitado a muestreos hasta 30 m de profundidad en los arrecifes de la eco-región suroccidental, dos bahías en la nororiental y en los fondos de sedimentos no consolidados del Archipiélago Sabana-Camagúey. En la región 149 noroccidental se ha obtenido mayor información sobre las ascidias que habitan sobre las raíces sumergidas de mangle rojo. Es pobre la información sobre las que habitan la pendiente arrecifal a más de 30 m, los fondos no consolidados y otros biotopos de la mayoría de las bahías y puertos, las cuevas sumergidas y extensas regiones de la plataforma. Los ejemplares de Clavelina picta (a la izquierda) se fijan sobre los ápices de los gorgonáceos que abundan en las explanadas de arena ubicadas entre 15 y 25 m de profundidad, frente a las playas de la costa norte de Cuba semejando jardines. Microcosmus exaspzeratus (a la derecha) es una ascidia de amplia distribución mundial que en Cuba abunda sobre las raíces del mangle rojo, en pilotes de los muelles, sobre barcos hundidos, bajo restos de corales o piedras en el arrecife frontal y otras estructuras sumergidas (Fotos: Noel López) Filo CHORDATA, Peces - Subfilos CEPHALOCHORDATA (ACRANIA) y VERTEBRATA (CRANIATA) Rodolfo Claro1 En los cefalocordados (Acrania) el notocordio se extiende del rostro hasta el ápice de la cola. No tienen cráneo ni vértebras, huesos o cartílagos. Son conocidos como lancetas o amphioxus. Inicialmente fueron descritos como moluscos, y posteriormente han sido considerados como formas evolutivas intermedias entre los invertebrados y los vertebrados. Se conocen unas 25 especies de forma corporal muy semejante, que habitan en aguas tropicales y templadas de todos los océanos. Son animales bénticos, usualmente de aguas someras, que se entierran en fondos de arena gruesa, dejando afuera la cabeza para filtrar las partículas alimenticias en suspensión. Aunque de pequeña talla, en algunos países asiáticos constituyen un alimento apreciado, ya que a diferencia de los peces, no tienen esqueleto. Duarte-Bello y Buesa (1974) asumen la presencia en Cuba de dos especies (de los dos géneros conocidos), Branchiostoma caribbaeum y Asymetron lucayanum, la primera reportada en aguas de Jamaica en altas densidades (5 000 ind./m2). Lampreas y myxinos – superclase AGNATHA (CICLOSTOMATA) Comprende dos clases vivientes: Cephalaspidomorphi (Petromyzontes - lampreas) y Myxini (mixinos). Incluye vertebrados con cráneo, sin mandíbulas, en su lugar presentan un aparato bucal succionante no derivado de los arcos branquiales como es el caso de las mandíbulas en los peces. Sin aletas pares, con 1-15 pares de aberturas branquiales, sin escamas, piel viscosa y esqueleto cartilaginoso. Viven normalmente en los fondos hasta los 500 m, casi siempre aislados, algunas veces adheridas a otros peces, tortugas o embarcaciones. Se conocen unas 84 especies actuales 150 pertenecientes a 12 géneros y dos familias (Nelson, 1994). En aguas cubanas solo se han registrado dos especies de la clase Myxini: Eptatretus minor y E. Springeri. Peces cartilaginosos y óseos – superclase GNATHOSTOMATA La superclase Gnathostomata contiene el grupo de vertebrados más diverso del planeta. Se caracterizan por la presencia de mandíbulas derivadas de los arcos branquiales modificados. Comprende todos los organismos conocidos como peces, divididos en cuatro clases: Placodermi (placodermos primitivos fósiles), Chondrichthyes (peces cartilaginosos), Acanthodii (acantoideos fósiles), Sarcopterygii (coelacantos, porolepimorfos, rhizodontimorfos, osteolepimorfos y tetrápodos, todos fósiles, salvo una especie viviente en peligro de extinción, Latimeria chalumnae) y Actinopterygii (comprende la mayor parte de las especies conocidas de peces óseos). Los Chondrichthyes y Actinopterygii son generalmente incluidos en la División Teleostei, que comprende todos los tiburones, rayas, quimeras y peces óseos (Nelson, 1994, Nelson et al. 2004). En el medio acuático, los peces se cuentan entre los organismos de mayor diversidad, juegan un papel determinante en esos ecosistemas y constituyen el principal recurso alimentario de los mares y océanos (77% del total de productos pesqueros), con producciones anuales que sobrepasan los 70-75 millones de toneladas métricas (TM) como resultado de la pesca, y 1-1,5 millones por el maricultivo (FAO, 1999) Estos organismos además, constituyen un importantísimo elemento en la economía de muchas naciones, por ser fuente de trabajo para millones de personas y por su incalculable valor recreativo y estético. No obstante, algunas especies tóxicas son un factor de preocupación y peligro por sus efectos adversos. Debido a su diversidad y abundancia, los peces juegan un papel trascendental en las comunidades de todos los ecosistemas marinos. Se conocen más de 25 000 especies de peces (Nelson, 1994) o sea más de la mitad de todas las especies vivientes de vertebrados (unas 48 200). Los peces habitan en todos los ecosistemas acuáticos, desde los charcos de marea, hasta las grandes fosas oceánicas (más de 11 000 m de profundidad) y en todas las latitudes. Presentan gran diversidad de formas y adaptaciones al medio ambiente. Su mayor diversidad se encuentra en las regiones tropicales, aunque en aguas templadas continentales y oceánicas se localizan las poblaciones más densas y productivas. La ictiofauna del Caribe es la más rica del Atlántico gracias a la amplia distribución de los arrecifes coralinos, con los cuales está relacionada una gran parte de las especies. Además, el régimen de circulación existente en la región favorece el transporte de larvas desde las Antillas Menores (Roberts, 1997) y su dispersión en la plataforma cubana. La existencia de un complejo régimen hidrológico, con numerosos giros ciclónicos y anticiclónicos en la zona oceánica alrededor del Archipiélago Cubano, favorece el auto-reclutamiento a su propia plataforma, pero también parte de las larvas originadas en aguas cubanas pueden alcanzar las plataformas de otras regiones del Caribe (Claro et al., 2001b; Claro y Lindeman, 2003; Paris et al., 2005). Las investigaciones sobre la biosistemática de los peces marinos de Cuba tuvo un destacado desarrollo en el siglo XIX con los estudios de Don Felipe Poey y Aloy (Poey, 1865-1968; 1875-77; 2000) quien describió las características morfológicas de 542 especies marinas y fluviatiles, de las cuales 111 son válidas actualmente. Durante el siglo 20 se presentaron varias revisiones (DuarteBello, 1959; Duarte-Bello y Buesa, 1973; Guitart, 1974-1978; Rodríguez et al., 1984; Claro, 1994; Claro y Parenti, 2001) que han mantenido actualizada la información sobre la diversidad de especies de este grupo. 151 La ictiofauna marina de Cuba es probablemente la más rica de las Antillas. Han sido reportadas hasta la fecha 1030 especies, de las cuales 38 (todos peces óseos) son de aguas fluviales, aunque muchas de estas también se encuentran en ambientes estuarinos e incluso con alta salinidad. De las consideradas fluviales, 21 son endémicas de Cuba, en su mayoría del orden Cyprinodontiformes. No se incluyen en estas cifras unas 25 especies introducidas en esos ecosistemas para el cultivo, algunas de las cuales se han adaptado a las condiciones naturales del país, aunque otras se mantienen en aguas interiores gracias a su reproducción en condiciones artificiales. Algunas familias de peces ampliamente representados en la ictiofauna cubana. Pertenecen a la Clase Chondrichthyes (tiburones, rayas y una sola especie de chimera) 72 especies y el resto, 992, son de la clase Actinopterygii (peces óseos) (ver lista de especies en este CD-ROM). Otras tres especies han sido introducidas para el cultivo en jaulas flotantes (Dicentrarchus labrax Linnaeus, 1758, Sparus aurata, Linnaeus, 1758 y Sciaenops ocellatus Linnaeus (1766) de las cuales al menos la última ha escapado al medio, aunque no parece haber prosperado hasta ahora. 152 El pez perro, Lachnolaimus maximus (una hembra en la foto a la izquierda) presenta dimorfismo sexual. Los machos tienen la cabeza más prolongada, de color oscuro, y la primera espina dorsal alargada, en forma de filamento. La morena pintada, Gymnothorax morringa (foto a la derecha) al igual que otras morenas, acecha a sus presas potenciales desde su refugio en las grietas de los arrecifes (Fotos: Noel López). De las especies estrictamente marinas, 15 han sido reportadas exclusivamente para aguas cubanas, lo que no quiere decir que sean definitivamente endémicas. Probablemente ello sea consecuencia de un mayor nivel de conocimientos sobre la ictiofauna en Cuba que en otros países del Caribe, gracias a cierta tradición en esta disciplina. Todas esas especies son muy raras y algunas están sujetas a revisión. Aproximadamente 150 especies fueron consideradas como raras y unas 240 como no comunes, mientras que otras 150 especies fueron consideradas como abundantes en número, al menos en alguna de las zonas (ver abundancia relativa en la lista de especies en este CDROM). La mayor riqueza de especies se presenta en el orden Perciformes, en el cual se registran 62 familias, 245 géneros y unas 485 especies. Entre las familias con mayor diversidad en las aguas costeras de Cuba, cabe mencionar: Serranidae, Carangidae, Labridae, Scaridae, Lutjanidae, Labridae, Labrisomidae, Gobiidae y Haemulidae (Claro y Parenti, 2001). A juzgar por los límites de distribución de las especies de peces reportadas en el Gran Caribe, y que no están registradas para Cuba, estimamos que al menos unas 85 especies más pudieran estar presentes en aguas cubanas. Del total de especies registradas para Cuba, unas 620 son típicas de la zona litoral, de las cuales más de 520 guardan determinada asociación con el fondo (demersales), mientras que unas 100 especies prefieren la columna de agua como hábitat (pelágico-neríticas), aunque muchas viven en muy poca profundidad (menos de 10 m) y vinculadas a los arrecifes, manglares y otros biotopos someros. Unas 100 especies habitan en el talud insular, en su gran mayoría entre 100 y 1 200 m de profundidad (zona Batial), y unas 170 especies son pelágico-oceánicas, de las cuales aproximadamente 80-100 prefieren el estrato superior o zona epi-pelágica (60-100 m) y unas 70-90 prefieren la zona meso-pelágica (150-700 m) aunque algunas de ellas transitan de uno a otro estrato. Una gran parte de estas especies pelágico-océanicas son migratorias, de amplia distribución en la zona tropical. De las especies que tienen hábitos demersales, unas 350 habitan en los arrecifes coralinos o mantienen relación con éstos al menos durante parte de su ciclo de vida. A pesar de esta alta diversidad de especies en los arrecifes, solo una pequeña proporción de ellas posee poblaciones 153 relativamente abundantes, un alto porcentaje son especies raras o poco comunes y muchas poseen hábitos crípticos, por lo que raramente son visibles por el hombre. Los peces arrecifales constituyen la base de las pesquerías en las islas tropicales (Munro, 1983) y Cuba no es una excepción. No obstante, una alta proporción de estos peces son capturados en los pastos marinos durante sus movimientos de forrajeo. Gracias a la notable extensión y desarrollo de las zonas estuarinas en Cuba, también la ictiofauna de esos hábitats resulta importante por su alta productividad, aunque con menor valor de mercado y diversidad. Por otra parte, la alta diversidad de especies en los arrecifes brinda al entorno una exuberante belleza y atracción para el buceo contemplativo, lo que constituye un elemento fundamental de atracción para el turismo. La distribución de las especies “residentes” en los arrecifes guarda estrecha relación con la complejidad estructural de esos biotopos e incluso la diferencia en la composición de las asociaciones es mayor entre tipos de arrecifes que entre regiones relativamente alejadas unas de otras, en iguales hábitats (Alevizon y Brooks, 1975; Claro y García-Arteaga, 1994). La mayor diversidad de peces en los arrecifes se observa en las pendientes y crestas arrecifales. De las zonas inventariadas de Cuba mediante censos visuales, la mayor riqueza de especies en las pendientes arrecifales, se encontró en el Archipiélago Sabana-Camagüey, en muestreos realizados en los años 1988-1989. Sin embargo, como resultado de la sobre-pesca y las enfermedades de los corales, provocadas por eventos ENSO en la década de los noventa, en el año 2000 la riqueza de especies fue menor que en los años 1988-1989 (Claro et al., 2000), e inferior a la de las zonas suroccidental y sur central. La mayor riqueza de especies se encuentra en el Área Protegida de Doce Leguas, en el Archipiélago Jardines de la Reina. En la zona costera HabanaMatanzas, Aguilar (2005) encontró valores bajos del índice de Shannon (de alrededor de tres) en tres estaciones al norte de la Ciudad de La Habana (mediante censo estacionario), dos de ellas fuertemente afectadas por la contaminación urbana. García-Cagide et al. (2005) en siete estaciones (mediante transectos lineales) ubicadas entre Playa Baracoa y Puerto Escondido (provincias Habana y Ciudad Habana), que incluyen áreas menos afectadas por factores antrópicos, obtuvieron valores similares a los registrados en otros arrecifes de Cuba (Tabla 6), aunque en las áreas contaminads de la costa Habanera, obtuvo valores similares a los de Aguilar (2005). Las tendencias de las curvas acumulativas de especies (Fig. 1) y los indicadores de la estructura de las comunidades (Tabla 6) muestran que, en todas las pendientes arrecifales estudiadas de Cuba la diversidad de especies es mayor que las encontradas por los mismos autores y con los mismos métodos, en Martinica y Guadalupe, y al parecer semejantes a la de Florida. 154 Fig. 1. Comparación de las curvas acumulativas de especies en cuatro zonas de la plataforma cubana (NC-norte central o Sabana-Camagüey; SC – sur central o Jardines de la Reina ; SW – suroccidental o Los Canarreos y Habana-Matanzas) con otros sitios del Gran Caribe (tomado de Claro et al., 1998; y datos inéditos del autor). Tabla 6 Número de especies, índice de Diversidad (H´), índice de riqueza (R1), índice de equitatividad (J), densidad y biomasa de peces en censos visuales realizados en varios hábitats arrecifales de Cuba. Abreviaturas: SW - Golfo de Batabanó; NC - Archipiélago Sabana-Camagüey; SC - Archipiélago Jardines de la Reina. (se incluyen solo datos obtendos con igual metodología) Zona Hábitat SW Crestas Parches Pendientes Manglares Crestas Parches Pav, rocoso Pendientes Pendientes* Manglares Pendientes* Crestas Pendientes Manglares Pendientes NC NC SC Área (m2) 11895 55668 30370 21580 22470 16498 7940 20610 10557 39705 6 175 4200 11340 5200 4560 Fecha No. Sp. 1984-85 113 129 136 82 125 131 92 132 118 87 106 103 136 58 107 1987-89 1987-89 2000 1997 No. Familias 40 36 39 29 41 38 29 33 32 30 32 32 38 24 HabanaMatanzas Guadalupe Pendientes 3800 199 76 Martinica Pendientes 5400 199 89 *Estaciones seleccionadas, comunes en ambos períodos 28 30 H´ R1 J 0,67 0,47 0,58 0,51 0,62 0,58 0,70 0,56 0,59 0,28 0,69 0,65 0,46 0,26 0,65 Densidad (ind/m2) 2,131 7,459 2,040 6,789 2,385 2,907 1,083 2,019 3,03 19,90 1,04 2,397 4,617 10,23 2,279 Biomasa (g/m2) 114,39 582,41 111,31 154,28 117,10 138,50 84,66 139,86 243,18 165,47 80,32 108,82 203,73 141,67 117,49 4.58 3,26 4,14 3,22 4,29 4,11 4,55 3,95 4,06 1,82 4,64 4,37 3,28 1,55 4,40 7,66 6,86 8,48 4,72 7,89 8,36 6,85 8,54 8,24 4,44 7,91 7,67 8,61 3,63 7,94 3,39 2,57 5,60 5,63 0,54 0,40 2,841 9,438 63,55 62,96 En las pendientes arrecifales entre 15 y 30 m de profundidad de las tres zonas más estudiadas, predominan en número el cromis azul (Chromis cyanea), la jenízara (Clepticus parrai), la doncella 155 (Thalassoma bifasciatum), la chopita bicolor (Stegastes partitus), el loro listado (Scarus croicensis), y el loreto (Gramma loreto).). Formando densas agrupaciones en forma de parches pueden ser extraordinariamente abundantes algunos sapitos (Gobidae) del género Coryphopterus, pero con muy baja biomasa, por su pequeña talla. Aunque en menor número pero con la biomasa más alta, están presentes los pargos (Lutjanidae) y los roncos (Haemulidae). Los tiburones y otros grandes depredadores son más comunes en este hábitat que en otros de aguas someras. Al comparar la densidad y biomasa de peces en los arrecifes de Cuba entre sí, y estos con los de otros sitios del Caribe, se observa que, aunque en algunas islas como Martinica, la densidad de peces puede ser mayor que en Cuba (Fig. 2) en esta última la biomasa de peces es dos a tres veces mayor y en el caso del Archipiélago Jardines de la Reina, similar a la observada en arrecifes de la Florida que es casi cuatro veces mayor que en Martinica y Guadalupe. Tales diferencias en la biomasa se deben a que el peso promedio de los peces en las islas de las Antillas Menores es muy bajo (30 g promedio en Guadalupe y solo 10 g en Martinica), en comparación con los de Cuba (45 a 70 g) y la Florida (100 g). Ello parece ser consecuencia de una excesiva explotación pesquera en las Antillas Menores (Gobert, 1990), donde los depredadores de mediana y gran talla son ya muy escasos. Fig. 2. Densidad, biomasa y peso promedio de los peces en las pendientes arrecifales de las zonas sur central (SC), suroccidental (SW), norte central (NC-89 - toda la zona, en 1988-89; NC-89 estaciones seleccionadas en 1988-89 y NC- 00 – en estaciones seleccionadas comunes a ambos períodos en el año 2000; y Habana-Matanzas) de Cuba y otras regiones del Caribe (Islas Margarita y Guadalupe, y Key West Florida). En las crestas arrecifales, la diversidad de especies es casi tan alta como en las pendientes, con un claro predominio de Haemulon flavolineatum, Thalassoma bifasciatum y H. sciurus, Scarus croicensis y Abudefduf saxatilis. Los herbívoros, principalmente barberos (Acanthurus spp.) y loros (Scarus y Sparisoma spp.) son más importantes por su densidad y biomasa en este biotopo que en otros tipos de arrecifes. Estos además, realizan una importante labor sanitaria en los arrecifes, al consumir parte de las algas que crecen sobre estos, evitando así el crecimiento excesivo de estas. En los arrecifes de parche y cabezos, las especies más frecuentes y abundantes son los roncos (Haemulidae), principalmente Haemulon plumieri, H. flavolineatum y H. sciurus. Los pargos (en particular Lutjanus griseus y L. synagris), aunque con una menor densidad ocupan un lugar destacado en este hábitat, debido a su alta biomasa en especial en el Golfo de Batabanó (Claro et al., 156 1990). Las doncellas (Labridae), los barberos (Acanthurus spp.) y algunos loros (Scarus croicensis, Sparisoma viride), también son abundantes en este biotopo. La diversidad de especies en los cabezos y parches puede ser alta si estos se encuentran cerca de los arrecifes, pero en aquellos aislados en pastos marinos o arenales, la diversidad es mucho menor aunque la biomasa es generalmente muy alta. Unas 90 especies prefieren ambientes estuarinos o al menos transitan por estos (GonzálezSansón, et al., 1978; González-Sansón y Aguilar Betancourt, 1983). En los manglares no estuarinos, que bordean los islotes y cayos, donde prevalecen condiciones más parecidas a las de los arrecifes, se han reportado cerca de cien, aunque generalmente en un censo visual de unos 100 m lineales de manglar se observan solo unas 20-22 especies como promedio (Valdés-Muñóz, 1981; Valdés-Muñóz et al., 1990: Claro y García-Arteaga, 1993). En las zonas estuarinas prevalecen las especies de las familias Gerridae (pataos y mojarras), Mugilidae (lisas), Sciaenidae (corvinas). No obstante, en algunas regiones, como las lagunas costeras del Litoral Sur de la zona suroriental, las poblaciones de una especie introducida en los embalses de agua dulce, la tilapia (Oreochromis aurea), desplazó a las especies autóctonas, cuya densidad disminuyó notablemente (GonzalezSansón y Aguilar Betancourt, 1983). Asociados a los manglares costeros y de los cayos (no estuarinos), así como en los pastos marinos aledaños, habita un número apreciable de especies típicas de esos biotopos y las etapas juveniles de muchas de las especies arrecifales, algunas de importancia pesquera, por lo que la conservación de los manglares y los pastos marinos resulta muy importante para el mantenimiento de una pesca sostenible. Son particularmente importantes en esos manglares, los pargos (Lutjanidae), los roncos (Haemulidae), las anchoas (Engraulidae), las manjúas y sardinas (Clupeidae) y los cabezotes (Atherinidae). Las etapas juveniles de los pargos, roncos y otros peces comerciales, trascurre principalmente en los pastos marinos y para algunas especies también en los manglares aledaños (Nagelkerken et al., 2000; Lindeman et al., 2000 Cocheret de la Morinière, 2002). Un grupo importante de especies comerciales o de gran impacto en el ecosistema costero son consideradas “visitantes o transeúntes” de los arrecifes, manglares y pastos marinos. Son en su mayoría de hábitos pelágico-neríticos, entre los que se destacan por su frecuencia y abundancia la picúa, Sphyraena barracuda, los jureles (Carangidae, principalmente Caranx ruber, C. bartholomaei y C. latus), así como algunos escómbridos costeros (Scomberomorus regalis, S. maculatus, S. cavalla). Se considera que la ictiofauna cubana, ha sido bastante estudiada, aunque algunas especies requieren ser revisadas. No obstante, aún existen regiones poco estudiadas, como la sur central, la suroriental, la norte oriental y la noroccidental, así como las aguas profundas alrededor del Archipiélago. Aunque en las aguas someras se han realizado numerosos inventarios, pocos se han orientado a las especies de hábitos crípticos, tanto en arrecifes como en manglares y pastos marinos, para cuya captura se requieren métodos especializados. Los peces aportan entre 50 y 60% de la captura total (sin incluir la pesca incidental o “morralla” de los arrastres de camarones) en aguas cubanas. Aproximadamente 140 especies de peces son objeto de pesca, pero solo unas 30 tienen una importancia notable como recurso. Las capturas de peces en la plataforma y zona económica exclusiva alcanzaron casi 29 000 TM en 1989 y muestran desde entonces tendencia a disminuir por sobrepesca de algunos recursos, impactos ambientales, etc. (vea epígrafe Pesca). 157 El pez dama o damero (Rinchodon typus) es, entre los tiburones, la especie que mayor talla alcanza (hasta 15 m), aunque se alimenta de pequeñas presas. Esta especie constituye un gran atractivo para el turismo de buceo, sin embargo, sus poblaciones están diezmadas y se encuentran amenazadas por la pesca indiscriminada. Entre los peces comerciales ocupan un lugar destacado los pargos (principalmente Lutjanus synagris, L. analis, L. griseus y Ocyurus chrysurus), los batoideos (Dasyatis americana y en pequeña proporción, el obispo - Aetobatus narinari y otras), los atunes pequeños (Katsuwounus pelamis y Tunnus atlanticus) y los tiburones. Algunas especies no comerciales, como la manjúa, Jenkinsia lamprotaenia, juegan un papel determinante, como carnada viva, en las pesquerías de túnidos. La explotación excesiva de esta especie, limita ya desde hace algunos años, la eficiencia de las capturas de atunes pequeños en la zona suroccidental (García-Coll, 1984). La cherna criolla (Epinephelus striatus) y la guasa (Epinephelus itajara) se consideran especies en peligro crítico por la IUCN. La primera especie fue una de las más importantes en las pesquerías comerciales en el Gran Caribe, pero la pesca irracional, en especial sobre las agregaciones de desove, produjo el rápido colapso de sus poblaciones en toda el área. La guasa prácticamente ha desaparecido de muchos lugares en Cuba y el Caribe, aunque actualmente es ya común su presencia en áreas protegidas marinas del Archipiélago Jardines de la Reina. Los peces constituyen un elemento esencial en el paisaje submarino, el cual constituye uno de los principales atractivos para el turismo internacional en Cuba. Lamentablemente, debido a insuficientes medios de vigilancia y a una pobre educación ambiental, muchos de los arrecifes utilizados para el buceo contemplativo, al menos en la década de los noventa, se caracterizaron por 158 una pobre presencia de peces de mediana y gran talla, los cuales son una de las principales motivaciones para el buceo Ello se debe a la pesca comercial en algunos casos, y la pesca de subsistencia o la recreativa en otros. El establecimiento de algunas reservas de pesca en los sitios de desarrollo turístico, está contribuyendo a la rehabilitación de la diversidad de peces en los mismos. Las principales amenazas a los peces marinos de la plataforma cubana son: la pesca no sostenible, la degradación de las áreas de reclutamiento y cría (pastos marinos, lagunas costeras, manglares) por hiper-salinización y contaminación y la degradación de los arrecifes coralinos por cambios globales y factores antrópicos. Filo CHORDATA: Tortugas Marinas - Clase REPTILIA, Orden Chelonia Félix Guillermo Moncada Gavilán 21 Las tortugas marinas constituyen un grupo primitivo y singular, con características anatómicas únicas que no han cambiado prácticamente desde que aparecieron en la Tierra. Su característica más representativa es la presencia de un caparazón protector de forma hidrodinámica adherido a las costillas; compuesto por una parte superior, que es el caparazón en si, y una parte inferior llamada peto o plastrón, que se encuentran unidos mediante un puente óseo. Está formado por escudos o placas corneas, excepto en la tortuga tinglado, en la que esta formado por placas óseas recubiertas de piel. Presentan los miembros modificados en forma de aletas, lo cual les facilita el desplazamiento en el ambiente marino con gran habilidad. La cabeza es relativamente grande y, al igual que las aletas, no pueden retraerla dentro del caparazón. Tienen la piel cubierta de escamas. Los machos adultos difieren en apariencia de las hembras en que poseen la cola mas larga. Como todos los reptiles, son de sangre fría (poiquilotérmicos), es decir que la temperatura de su cuerpo está regulada por la temperatura ambiental. Poseen pulmones y por tanto deben salir a la superficie para respirar. Realizan migraciones entre sus áreas de alimentación y reproducción, las cuales efectúan cada 2 ó 3 años. Se aparean en las cercanías de las playas donde desovan, y después de la fertilización las hembras salen durante la noche a la playa para depositar sus huevos. Una hembra desova varias veces en la temporada de reproducción con un intervalo de unos 15 días entre cada ovo-posición. Un nido contiene alrededor de 100 huevos como promedio. Estos organismos juegan un papel importante en los ecosistemas marinos porque reciclan nutrientes e inciden en la distribución y abundancia de los organismos en los pastos marinos y arrecifes coralinos. Cuando llegan a las playas fertilizan las costas de muchas islas y de los continentes (Frazier, 1999). Debido a sus hábitos alimenticios, la tortuga verde incrementa la productividad de los pastos marinos y la tortuga carey contribuye a mantener la dinámica de los arrecifes coralinos al alimentarse de esponjas que en ocasiones pueden encerrar y asfixiar el arrecife, por lo que se le consideráa un controlador biológico (Chacón et al., 2000). 21 Centro de Investigaciones Pesqueras, Ministerio de Industria Pesquera 5ta. Ave. y Calle 246, Barlovento, Santa Fé, Playa. Ciudad Habana. Telef: (537) 209-7875, Fax: (537) 204-5895. fmoncada@cip.telemar.cu, felimonca@yahoo.es 159 En la actualidad se reconocen en el mundo siete especies de tortugas marinas, las cuales se encuentran agrupadas en dos familias: Cheloniidae y Dermochelydae. La primera familia comprende a las especies Caretta caretta (tortuga caguama), Eretmochelys imbricata (tortuga carey), Lepidochelys olivacea (tortuga golfina), Chelonia mydas (tortuga verde), Natator depressus (tortuga kikila) y Lepidochelys kempii (tortuga lora). La segunda familia comprende solo a la especie Dermochelys coriacea, (tortuga baula, laud o tinglado). Muchos especialistas consideran a la tortuga negra del Pacifico Oriental (Chelonia agassizii) como una octava especie; sin embargo otros la consideran como una subespecie de Chelonia mydas, basados en investigaciones sobre su morfología, genética y composición bioquímica que confirman la existencia de solo siete especies (Bowen y Karl, 1997 y Meylan y Meylan, 2000). De estas, seis habitan en el Mar Caribe: la caguama, el carey, la tortuga verde, la tortuga golfina, la tortuga lora y el tinglado. Las tortugas marinas se distribuyen en todo el trópico y en aguas de temperaturas cálidas, en zonas poco profundas a lo largo de las costas y alrededor de las islas, aunque pueden ser encontradas en mar abierto debido a sus migraciones. La tortuga verde tiene una amplia distribución tropical y subtropical en las plataformas continentales y cerca de las islas. Es rara en aguas templadas (Pritchard y Mortimer, 1999). Sus limites geográficos se encuentran dentro de la isoterma de 20°C y sus migraciones se efectúan dentro de ésta durante las estaciones del año (Márquez, 1996). Sus principales colonias reproductivas se localizan en Australia, Costa Rica, las Islas de Aves (Venezuela), Cabo Verde, Malasia, Sarawak y Borneo (Márquez, 1996). El carey es la especie más tropical de todas las tortugas marinas (Witzell, 1983). Se encuentra solitaria o en pequeños grupos en casi todas las costas continentales e insulares, dentro del cinturón tropical. Por lo general su área de distribución no va más allá de las latitudes 25°N y 35°S y es común observarlos en zonas rocosas, de arrecifes coralinos, o con mantos de algas marinas (Márquez, 1996). Las áreas de anidación más importantes en el Caribe se encuentran en la Península de Yucatán, Isla Mona (Puerto Rico), Barbados y Cuba. La caguama se encuentra ampliamente distribuida en los mares templados, subtropicales y tropicales de los océanos Atlántico, Pacífico e Indico. En el océano Atlántico han sido vistas en lugares tan al norte como la Isla de Terranova (Squires, 1954) y norte de Europa (Brongersma, 1972), y tan al sur como en Argentina (Frazier, 1984). Durante sus migraciones realiza largas travesías, cruzando grandes extensiones oceánicas (Musick y Limpus, 1997). En las aguas del Gran Caribe se encuentra principalmente en las áreas de anidación y forrajeo de esta región. El tinglado es una especie esencialmente pelágica distribuida en todos los mares del mundo. Se encuentra en lugares tan al norte como Escandinavia, Terranova, Columbia Británica, Japón y Liberia y tan al sur como en las aguas de Chile, Argentina, Sudáfrica, Tanzania y Nueva Zelandia. En Cuba se han reportado cinco especies: la tortuga verde, la caguama y el carey que son las más abundantes y objeto de pesca comercial, se encuentran generalmente en sitios de anidación o alimentación, mientras que el tinglado y la golfina, son observadas de manera esporádica o en raras ocasiones respectivamente (Carrillo y Moncada, 1998). Estas especies se distribuyen prácticamente en toda la plataforma cubana donde existen pastos marinos, arrecifes coralinos y playas arenosas adecuadas para su alimentación y reproducción. La tortuga verde tiene como su principal hábitat los pastos marinos formados por la fanerógama Thalassia testudinum y varias especies de algas que constituyen el principal alimento de esta especie (Hirth, 1997). Este hábitat cubre aproximadamente el 70 % de la plataforma cubana (Buesa, 1974; Jiménez y Ibarzabal, 1982; Suárez y Cortes, 1983; Jiménez y Alcolado, 1990). 160 Los Cayos de las Doce Leguas (zona sur central), donde existen numerosas playas arenosas adecuadas para la anidación, y donde abundan los arrecifes coralinos, constituyen la zona principal de reproducción del carey (Moncada et al, 1999) y es además la zona de alimentación más importante para esta especie en toda la plataforma cubana (Anderes y Uchida, 1994). La caguama presenta su mayor abundancia al norte de Pinar del Río. Sus principales áreas de reproducción se encuentran en la región suroccidental, principalmente en la Península de Guanahacabibes y en las islas y cayos del Archipiélago de los Canarreos (Playa el Guanal, al sur de Isla de la Juventud, que es el sitio más importante de anidación de esta especie en el Archipiélago Cubano; Cayos de San Felipe, Cayo Largo del Sur y Cayo Rosario). Existen también algunas anidaciones en la costa norte de la isla, en los cayos exteriores del Archipiélago Sabana – Camagüey, como es el caso de Cayo Cruz, y anidaciones aisladas en la región suroriental, en los Cayos de las Doce Leguas. La disposición y número de las placas del carapacho permiten la identificación rápida de las cinco especies de tortugas marinas registradas en aguas de Cuba. Hasta el siglo pasado las tortugas marinas fueron muy numerosas en los mares tropicales y subtropicales. Sin embargo, en las últimas décadas, factores como la sobrepesca, la captura incidental, la destrucción de los hábitats de alimentación y anidación (por actividades de desarrollo turístico, urbano e industrial), y la contaminación de los mares que causa la muerte de muchas tortugas debido a la ingestión de petróleo, plásticos y otros desperdicios, han diezmado considerablemente y pueden continuar diezmando sus poblaciones a nivel mundial. En Cuba la principal amenaza es la pesca furtiva, la cual se trata de reducir a través de las medidas y acciones de la Oficina Nacional de Inspección Pesquera. Las tortugas marinas han sido utilizadas en Cuba desde nuestros aborígenes, aunque solo a partir de la década de los sesenta, se establecieron registros de su captura. Los niveles más altos se reportaron entre 1968 y 1975, cuando no existía una veda reproductiva, llegándose a alcanzar una captura máxima de alrededor de 1 000 toneladas entre las tres especies. A partir de 1976 y hasta 1990 se aplicó una veda durante el período de reproducción, que se modificó en 1987 para brindar mayor protección a los periodos reproductivos de cada especie. En esos años la captura promedio fue 161 de unas 800 TM anuales. A partir de 1991 se aplicó una reducción progresiva del esfuerzo pesquero, hasta establecerse, en 1994, una captura máxima de 50 toneladas. Todas las especies de tortugas marinas están consideradas en la actualidad como especies en peligro de extinción en el Libro Rojo de la Unión Internacional para la Conservación de la Naturaleza y de los Recursos Naturales (Groombridge, 1982), y también se encuentran registradas en el Apéndice I de la Convención sobre el Comercio Internacional de Especies Amenazadas de la Fauna y Flora Silvestre (CITES). Las primeras actividades de conservación de las tortugas marinas en Cuba se iniciaron en la década de los setenta por parte del Centro de Investigaciones Pesqueras (CIP) y por pescadores amantes de esta actividad, mediante la protección de los nidos y las crías en algunas playas de anidación en Cayo Largo del Sur, Playa Larga, (Cardona y De la Rua, 1972). Posteriormente el Centro de Investigaciones Pesqueras realizó investigaciones sobre la biología de estas especies, lográndose incrementar el conocimiento sobre las mismas en la plataforma cubana. Con el tiempo se han incorporado otras instituciones como el Centro de Investigaciones Marinas (CIM) y la Facultad de Biología de la Universidad de la Habana. Arriba: caguama, Careta careta y tortuga verde, Chelonia mydas (fotos: Erich Escobar); abajo: tortuga carey, Eretmochelys imbricata (foto: Félix Moncada) y tinglado, Dermochelys coriacea (foto: Erich Escobar) Los estudios realizados en Cuba han estado dirigidos principalmente a conocer el estado de las poblaciones anidadoras de la tortuga carey a partir de los monitoreos en los Cayos de las Doce Leguas, donde se ha observado una tendencia al incremento desde los años finales de la década de 162 los noventa (Moncada et al., 1998; 1999). Igualmente, se han estudiado las poblaciones de la tortuga verde y la caguama en el sur de la Isla de la Juventud (Nodarse et al., 2000) y en la Península de Guahanacabibes (Martín et al., 1999; 2002). Las investigaciones han tenido también como objetivo, conocer los movimientos de estas especies en las aguas cubanas y áreas adyacentes (Moncada, 1992, Moncada et al., 1996; 1998; 2002; Moncada et al., inédito) y sobre la mezcla y aislamiento de las poblaciones de carey en la plataforma cubana a partir del DNAmt (Espinosa et al., 1994; DíazFernández et al., 1999), así como la identificación de colonias anidadoras para la tortuga verde en la región occidental mediante la misma técnica (Espinosa et al., 1999). También se han realizado estudios sobre la alimentación (Acevedo et al., 1980, Anderes, 1998; Anderes y Uchida, 1994), las pesquerías (Carrillo et al., 1998; Moncada, 1998) y la captura incidental (Moncada et al., 2003). Las acciones instrumentadas en Cuba durante años a través de un programa de manejo han permitido, el control y el uso racional de las tortugas marinas y su dinámica poblacional. Actualmente se capturan bajo un estricto control en solamente dos sitios tradicionales de pesca: Cocodrilo, Isla de la Juventud (costa sur) y Nuevitas (costa norte), en cada uno de los cuales se permite una captura limitada de hasta 25 TM, o sea, 50 TM en total entre las tres especies y dentro de esa cifra una cuota máxima de 500 careyes (aproximadamente 25 toneladas) y las otras 25 TM de tortuga verde y caguama. Otros elementos del Plan de Manejo son los siguientes: • • • • • • • Veda durante el período reproductivo y talla mínima de captura, Monitoreo de la captura en los sitios de pesca tradicional (obtención de datos biológicopesqueros). En el caso del carey se toma además información sobre sus conchas (número y peso total). Monitoreo en playas de anidación (obtención de datos sobre la anidación, tales como: número y densidad de nidos por playa, número de huevos por nidos, porcentaje de eclosión de los nidos, tamaño de las hembras anidadoras). Monitoreo en áreas de alimentación (densidad en determinadas áreas y tamaño de los careyes juveniles y subadultos). Estimación y control de la captura incidental. Control de las conchas (para evitar el comercio ilegal de las conchas que provienen de la pesca autorizada. Estas son almacenadas teniendo en cuenta los requerimientos de CITES, en caso que puedan ser exportadas si se aprueba una propuesta cubana de cambio de apéndice para el carey). Criadero Experimental para investigación y como contribución al medio natural. Filo CHORDATA: Serpientes, Clase REPTILIA, orden SQUAMATA* En Cuba se conoce solo una especie de serpiene marina: el cativo de mar, también conocido como cativo de manglar o cativo de de estero (Nerodia clarkii compressicauda Baird y Girard, 1853), que habita cerca de la orilla de los cayos del Archipiélago Sabana-Camagüey (Sanpedro Marin y Rodríguez Schettino, 2003). Filo CHORDATA: Cocodrilos, Clase REPTILIA, orden CROCODYLIA* Aunque habitan tres especies de cocodrilos en los acuatorios de Cuba, solo una especie se encuentra tanto en agua dulce como en aguas salobres y en los cayos exteriores donde la salinidad es alta. Se trata del mal llamado caimán, conocido también como babilla o caimán de espejuelos (Crocodylus 163 acutus), que fue introducido desde Colombia en 1959 (Sanpedro Marin y Rodríguez Schettino, 2003). Filo CHORDATA: Mamíferos- Clase MAMMALIA Heidi Pérez Cao 22 El término “mamíferos marinos”, no implica relaciones taxonómicas o sistemáticas, es utilizado para designar un grupo de especies no relacionadas filogenéticamente, que ha recolonizado el ambiente acuático total o parcialmente, a partir de ancestros terrestres diferentes, y cuya fuente de alimentación se encuentra en este medio. Como mamíferos, presentan las características anatómicas y fisiológicas típicas asociadas a esta clase de organismos, como son: temperatura corporal constante, presencia de pelos (al menos en los estadios embrionarios), y glándulas mamarias para amamantar a sus crías. Algunas modificaciones estructurales que les permitieron adaptarse a los hábitats acuáticos y que fueron tomadas en cuenta para considerar a los mamíferos marinos como un grupo, incluyen un gran tamaño corporal, forma fusiforme o hidrodinámica, esqueleto apendicular modificado, resultando en la reducción y transformación de los apéndices en aletas natatorias. Los cetáceos y sirenios no presentan extremidades posteriores, en su lugar muestran una aleta caudal que facilita la propulsión en el agua y en los primeros, la mayoría exhibe una aleta dorsal, ambas constituidas por tejido fibroso, sin ningún sostén óseo. La protección térmica está dada por la presencia de una capa de tejido adiposo que varía en espesor en dependencia de la especie, además de una densa capa de pelo en los carnívoros marinos. Los sirenios (orden Sirenia: manatíes y dugones) y carnívoros (orden Carnívora, suborden Pinnipedia: leones y lobos marinos, focas y morsas), los carnívoros fissipedios (osos polares -familia Ursidae, y nutrias marinas -familia Mustelidae) presentan los orificios nasales en la región frontal de la cabeza. E en los cetáceos (orden Cetacea, suborden Mysticeti; ballenas y suborden Odontoceti: delfines, cachalores, zifios, marsopas, belugas y narvales) dichos órganos se encuentran en la parte superior de esta. Los mamíferos marinos también poseen adaptaciones fisiológicas para el buceo, la termorregulación, la osmo-regulación, la comunicación y la orientación; y un sinnúmero importante de adaptaciones conductuales (Reynolds y Rommel, 1999). La principal característica morfológica que divide a ballenas (Misticetos) y delfines (Odontocetos), en subórdenes diferentes, es la presencia o ausencia de barbas o dientes, aunque hay otras diferencias como la forma del cráneo (simétrico en las ballenas y asimétrico en los delfines); el tipo de orificios respiratorios (dos aberturas nasales externas en las ballenas, y una en los delfines, lo que pudiera estar relacionado con la asimetría del cráneo); y la forma de las costillas y el esternón. Las ballenas poseen filas de unas delgadas placas de queratina en la boca, que constituyen el aparato filtrador del agua para atrapar el alimento, y carecen de dientes funcionales, excepto como vestigios embrionarios. Los delfines y odontocetos en general presentan dientes, aunque en algunas especies no atraviesan las encías, como es el caso de algunos zifios (Bryden, 1991). Muchas personas llaman ballenas a los grandes cetáceos, sin embargo, las orcas y los cachalotes presentan dientes, por lo que no pertenecen a este suborden. Esta diferencia entre los dos grupos, también ha determinado diferencias en el tipo de alimento que consumen, estrategias alimentarias y reproductivas, migraciones estacionales muy bien 22 .Acuario Nacional, Ave.1ra. y 60, Playa, Ciudad de la Habana, Cuba. Direccion actual: Curator. Zoomarine, EN 125, Km.65, Guia-8201-864 Albufeira, Portugal. heidipcet@yahoo.es, heidipc@zoomarine.pt 164 definidas con delimitación de áreas para la alimentación y reproducción en el caso de las ballenas, entre otras muchas. En los ecosistemas marinos, los niveles tróficos superiores o depredadores tope, están integrados mayoritariamente por peces carnívoros y aves marinas, no obstante, los mamíferos son también considerados entre los consumidores más importantes, en determinadas regiones geográficas. Los mamíferos marinos probablemente contribuyan de forma trivial a la dinámica de los ecosistemas en términos de su impacto a gran escala en el flujo de energía y el ciclo del carbono; pero el efecto que esta dinámica puede tener sobre su abundancia, dispersión, reproducción y supervivencia, está muy lejos de ser trivial. Si se analiza con profundidad, puede contener información útil acerca de las tendencias a largo plazo y los cambios drásticos naturales o antropogénicos que ocurren dentro de estos ecosistemas, por lo que se les considera especies centinelas (Wells, 1993). El hombre ha utilizado algunas de estas especies históricamente, sobre todo las de hábitos costeros, para consumir su carne, emplear su grasa con múltiples propósitos, así como las barbas de las ballenas, la piel, el pelaje, el espermaceti y el ámbar gris del cachalote. También han sido utilizadas como carnada, lo que ha conllevado en muchos casos a la reducción drástica de sus poblaciones. Algunos odontocetos (cetáceos con dientes), pinnípedos, y sirenios, han sido mundialmente empleados para su exhibición en delfinarios y parques afines; para programas interactivos turísticos en cautiverio y en el medio natural (en esta última modalidad están incluidas las ballenas), actividades bélicas; y para el tratamiento alternativo de niños autistas, con retardo sicomotor y otras patologías o trastornos conductuales. En el ambiente marino, los mamíferos no pueden considerarse como un grupo diverso, si los comparamos con otros taxones, sin embargo, el hecho más destacable de los cetáceos es su diversidad morfológica, fisiológica, conductual y genética. La morfología externa, las estrategias reproductivas y alimentarias, los modelos migratorios e incluso el comportamiento social, varían notablemente de una especie a otra, reflejando su larga historia evolutiva y la pluralidad de ambientes en que viven. En Cuba, los avistamientos de cetáceos se han caracterizado por la escasa información fidedigna y las dificultades en la identificación de las especies, lo que puede haber conllevado a que varias de las citadas en la literatura actual, cuyo rango de distribución comprende nuestra región geográfica, no aparezcan registradas en los listados cubanos, como es el caso del delfín Lagenodelphis hosei y Peponocephala electra, descritas como comunes para el Golfo de México (Wynne y Schawartz, 1999; Wursing et al., 2000). Algunas especies, como los delfines del género Delphinus, citados en los listados cubanos de principios del siglo XX, constituyen errores de identificación (Rice, 1998), por otras especies del género Stenella, especialmente Stenella clymen, que no aparece registrada como de presencia confirmada. Ha existido también ausencia de investigaciones ecológicas, excepto para el caso de la tonina (Tursiops truncatus); que ya se ha venido estudiando en determinadas áreas del Archipiélago Sabana-Camaguey (Pérez-Cao, 2004). Los mamíferos marinos están representados en Cuba por los órdenes Cetacea y Sirenia, y hasta hace pocas décadas, por un integrante del suborden Pinnipedia, dentro del orden Carnivora. De las 126 especies vivientes de mamíferos marinos que han sido clasificadas a nivel mundial, solo 22 especies están confirmadas para aguas cubanas, lo que representa un 17,5% de diversidad relativa. Si son consideradas las especies de posible presencia, el número aumentaría a 29, lo que equivaldría a una diversidad relativa de 23% (ver lista de especies registradas en este CD-ROM). 165 Algunas especies de delfines avistadas en aguas cubanas. La familia Delfinidae presenta 36 especies, dentro de la cual también está incluida la orca (Orcinus orca). En Cuba solo han sido registradas 10 especies de presencia confirmada y 7 de posible presencia La gran mayoría de las especies de cetáceos referidas para Cuba y el área del Gran Caribe, presentan una distribución pantropical o cosmopolita y en las diferentes áreas específicas, está relacionada fundamentalmente con la disponibilidad de las presas y las condiciones oceanográficas (Jefferson et al., 1993). En Cuba, la única especie considerada residente permanente es la tonina o delfín Tursiops truncatus. Es posible observarla durante todo el año en todas las zonas de la plataforma, especialmente aquellas asociadas a la desembocadura de ríos o escurrimientos terrestres, lagunas costeras y bahías cerradas. El delfín tonina, Tursiops truncatus, es altamente apreciada en los acuarios por sus grandes habilidades e incluso su utilidad en algunas terapias con niños discapacitados. Su comercio está regulado por CITES. Otras especies de presencia confirmada pueden entrar ocasionalmente en aguas de la plataforma como las orcas (Orcinus orca) y el delfín moteado (Stenella frontales y/o Stenella attenuata), así como ser frecuentes en el borde de la misma, tal es el caso del cachalote (Physeter 166 macrocephalus), el calderón de aleta corta (Globicephala macrorhynchus) y la ballena jorobada (Megaptera novaengliae). La presencia de algunas especies esencialmente oceánicas se ha confirmado a partir de varamientos, como los zifios (Mesoplodon europaeus y Ziphius cavirostris Varona, 1974), el calderón gris o delfín de Risso (Grampus griseus), el delfín de dientes rugosos (Steno bredanensis) y capturas de estas y otras especies, como el cachalote pigmeo (Kogia breviceps) y el enano (Kogia sima) (Aguayo, 1954; Aguayo y Rivero, 1954; Varona, 2002). Las ballenas comprenden 14 especies, pertenecientes a cuatro familias (Perrin et al., 2002). En general, se alimentan de organismos marinos relativamente pequeños, a través del aparato filtrador altamente especializado, que constituyen las “barbas” aseguradas a las encías de la mandíbula superior. Presentan un gran tamaño corporal, siendo la ballena azul (Balaenoptera musculus), el animal más grande conocido, con más de 30 metros y un peso de más de 170 toneladas (Bannister, 2002). La familia Balenopteridae es la única que ha sido registrada en aguas cubanas y de esta, la especie Megaptera novaengliae (ballena jorobada) es la más común Otras cuatro especies de esta familia han sido registradas, aunque con un solo reporte de varamiento, y de identificación dudosa. Los sirenios, el único grupo herbívoro de mamíferos marinos, está conformado a nivel mundial por cuatro especies vivientes, de las zonas tropical y subtropical. Su distribución es bastante heterogénea, encontrándose especies en las zonas nerítica y oceánica, incluyendo los ambientes estuarinos y fluviales. El manatí antillano Trichechus manatus manatus, es la única especie del orden Sirenia en Cuba, y se distribuye desde el norte de México hasta la región central de Brasil, incluyendo las islas del Caribe. La otra subespecie, Trichechus manatus latirostris, el manatí de la Florida, se ubica desde Louisiana hasta Virginia en la parte norte del Golfo de México y el sudeste de los Estados Unidos (Jefferson et al., 1993). Dos especies de ballenas avistadas en aguas de Cuba. La ballena jorobada (Megaptera noveangliae) es fácilmente identificable por el tamaño de sus aletas pectorales. Existe un área de reproducción históricamente importante en el sudeste del mar Caribe para esta especie, lo que puede haber incidido en que haya sido la especie más observada en Cuba, aunque es considerada rara para esa región. El manatí es encontrado en zonas costeras, estuarinas y cuencas fluviales. Ferrer y Estrada (inédito) plantearon la existencia de doce zonas en Cuba donde los manatíes son observados con mayor frecuencia, destacándose la región del Golfo de Batabanó (en la Ensenada de la Broa - Río Hatiguanico al sur de las provincias La Habana y Matanzas). Según Cuní (1910), en 1856 Gundlach refirió que el número de manatíes se había reducido notablemente, aunque todavía no era raro, y que ya desde 1901, se dictó una resolución prohibiendo su pesca evitar su extinción. 167 Las poblaciones del manatí antillano, Trichechus manatus manatus se encuentran seriamente afectadas por la pesca furtiva y la degradación de los biotopos costeros. La foca monje tropical, Monachus tropicalis, es la única de los pinnípedos que era posible encontrar en esta región geográfica. Habitaba en la costa del Golfo de México, la península de Yucatán, el Mar Caribe occidental, las Antillas menores y mayores, las Bahamas, y los cayos de la Florida. El último registro que se tiene de la especie fue una observación en 1952, en Serranilla Bank, situado en el Mar Caribe entre Honduras y Jamaica. En Cuba, se han encontrado restos de la foca monje en los asentamientos aborígenes, y se piensa que su desaparición estuvo dada por la sobreexplotación a que estuvo sometida por los colonizadores, para la obtención del aceite, debido a que eran víctimas fáciles por su naturaleza lenta, y porque hasta la llegada del hombre, no tenían enemigos en su hábitat. Aunque la presencia de mamíferos marinos ha sido documentada en la región del Caribe y ciertas especies como la ballena jorobada y el manatí antillano han sido estudiadas, existe poca información sobre los problemas que afectan su supervivencia en el área y sobre su biología en general. Muchos de los estudios realizados se caracterizan por ser fraccionados y la mayoría de estos no han sido publicados. Las únicas especies que han sido estudiadas en Cuba a nivel poblacional son la tonina (Tursiops truncatus), en el Archipiélago Sabana-Camagüey, y el manatí antillano (Trichecus manatus manatus). Ambas especies están protegidas por el Decreto-Ley 164, Reglamento de la Pesca comercial, que prohíbe su explotación. Sin embargo, también han sido víctimas de la caza furtiva para el consumo humano, la obtención de grasa, en el caso del manatí, y también para ser utilizada como carnada en el caso de la tonina. Estas especies están expuestas a otras amenazas como la pérdida y degradación de sus hábitats, interrupción del régimen de circulación en las bahías y lagunas interiores (viaductos por el mar y otras construcciones costeras), la contaminación por diversas fuentes terrestres, la eutrofización, el represamiento de los ríos, el incremento de la salinidad, la sobrepesca de las especies presa y el incremento de las actividades náuticas por el desarrollo del turísmo marítimo. En Cuba, el Acuario Nacional ha venido estudiando la población del delfín Tursiops truncatus, en el medio natural, desde 1983, fundamentalmente en el. Archipiélago SabanaCamagüey, y ya se han logrado resultados concretos en cuanto a su abundancia, distribución, 168 caracterización morfométrica, estructura poblacional, microbiología, patologías más frecuentes, presencia de metales pesados y geno-toxicidad, en investigaciones conjuntas con otras instituciones. Sin embargo, estos estudios son insuficientes, ya que los datos obtenidos de abundancia relativa (en la costa norte de Matanzas y áreas adyacentes a Cayo Coco), no se corresponden con la densidad de una población determinada, sino solo con una parte de ella, en dos localidades específicas. Se debe continuar estudiando todo el Archipiélago Sabana-Camagüey, para poder definir la abundancia y el área de distribución de la especie en este ecosistema, y confirmar la hipótesis de la existencia de una población panmítica para el mismo. Se sugiere el empleo de otras técnicas de marcaje, como radiotrasmisores VHF, para obtener el registro real de movilidad y límites territoriales del ecotipo costero en el Archipiélago, y hacer extensivo esto a otras regiones del país. Continuar el proyecto de genética poblacional (estructura poblacional) en el área, que unido a los resultados del estudio propuesto anteriormente, permiten establecer criterios de manejo efectivos de la especie, a partir de la identificación de “stocks” empleando varios marcadores moleculares. Profundizar en el estudio de la estructura social de la especie para nuestro país, lo que constituye una herramienta poderosa a tener en cuenta para el establecimiento de los planes de manejo, y emplear métodos más específicos para el estudio de los patrones conductuales, a partir de los resultados obtenidos con la observación ad limitum en investigaciones anteriores (Pérez Cao, 2004). En el estudio del manatí, se ha recomenzado el estudio de su estado de conservación en el medio natural, por parte del Centro de Investigaciones Marinas y de la Empresa Flora y Fauna, lo que es de vital importancia, por constituir esta una especie severamente amenazada. 169