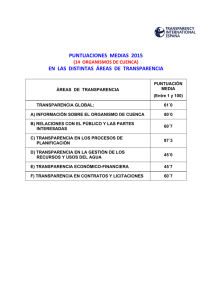
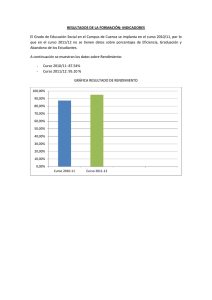
Biodiversidad de la cuenca del río Buritaca, Sierra Nevada de Santa
Anuncio

0 Biodi versidad de la cuenca del río Buritaca, S i er r a N e v a d a d e S a n t a M a r t a , C o l o mb i a ©Nick Bayly 1 Este proyecto fue realizado en el marco del Programa Paisajes de Conservación, financiado por la Agencia de Estados Unidos para el Desarrollo Internacional (USAID), puesto en marcha por Parques Nacionales Naturales de Colombia y el Fondo Patrimonio Natural, y ejecutado en la zona de influencia del Parque Sierra Nevada de Santa Marta por la Fundación de Investigaciones Arqueológicas y Ambientales Tayrona (FIAAT), con el apoyo de Global Heritage Fund. SELVA: Investigación para la Conservación en el Neotrópico hiso la caracterización de biodiversidad en la cuenca del río Buritaca para FIAAT, con el apoyo de Panthera Colombia en el estudio de los mamíferos. 2 CONTENIDO BIODIVERSIDAD DE LA CUENCA DEL RIO BURITACA, SIERRA NEVADA DE SANTA MARTA COLOMBIA.................................................................................................................................................. 4 Logros y Hallazgos Importantes ........................................................................................................... 4 Antecedentes......................................................................................................................................... 5 Metodología........................................................................................................................................... 5 Resultados.............................................................................................................................................. 6 Estatus de la biodiversidad en la cuenca ............................................................................................. 8 Impacto del turismo sobre la biodiversidad ........................................................................................ 9 Recomendaciones ............................................................................................................................... 11 ANFIBIOS DE LA CUENCA DEL RÍO BURITACA ........................................................................................ 13 Resumen .............................................................................................................................................. 13 Introducción......................................................................................................................................... 14 Metodología......................................................................................................................................... 15 Resultados............................................................................................................................................ 18 Discusión .............................................................................................................................................. 21 LAS AVES DE LA CUENCA DEL RÍO BURITACA ........................................................................................ 29 Resumen .............................................................................................................................................. 29 Introducción......................................................................................................................................... 30 Metodología......................................................................................................................................... 31 Resultados............................................................................................................................................ 33 Discusión .............................................................................................................................................. 40 LOS MAMÍFEROS TERRESTRES DE LA CUENCA DEL RÍO BURITACA ..................................................... 46 Resumen .............................................................................................................................................. 46 Introducción......................................................................................................................................... 47 Metodología......................................................................................................................................... 48 Resultados............................................................................................................................................ 52 Discusión .............................................................................................................................................. 56 MARIPOSAS DE LA CUENCA DEL RÍO BURITACA.................................................................................... 63 Resumen .............................................................................................................................................. 63 Introducción......................................................................................................................................... 64 Metodología......................................................................................................................................... 66 Resultados............................................................................................................................................ 68 Discusión .............................................................................................................................................. 74 Anexo 1: Listado de especies de anfibios .............................................................................................. 76 Anexo 2. Listado de especies de aves.................................................................................................... 82 Anexo 3. Listado de especies de mamíferos ......................................................................................... 87 Anexo 4: Listado de especies de mariposas .......................................................................................... 88 3 Agradecimientos Este estudio no hubiera sido posible sin el apoyo y ayuda constante de las comunidades de la cuenca del río Buritaca. Estamos en deuda con todos los guías que nos ayudaron a conocer la zona y nos mostraron los caminos poco transitados. Damos gracias especialmente a Nicolas y Edith Cuadros, Manuel, Vicente y Francisco Quimonquero (Comunidad Wiwa río Buritaca), David Mendoaza (ICANH) y Heiler Ortega (ICANH). Santiago Giraldo (FIAAT) siempre estuvo disponible, dándonos los mejores consejos sobre la logística y solucionando cualquier situación inesperada. El nivel de acceso que logramos durante el proyecto y la cálida acogida de las comunidades, no hubiera sido posible sin los muchos años de arduo trabajo de Santiago en la región. Los mayores Ramón Gil, Santiago Gil, Rumaldo, y José María Lozano, José Antonio Díngula, y Roberto Daza, abogado de la Fundación Ribunduna Tayrona fueron indispensables al mediar para asegurar la aprobación y permiso de la comunidad indígena para hacer investigación en la zona de resguardo. Estamos muy agradecidos con el Instituto Colombiano de Antropología e Historia (ICANH) por autorizar el acceso al Parque Arqueológico Teyuna-Ciudad Perdida y al PNN Sierra Nevada de Santa Marta por su cooperación en el estudio y por facilitar el uso de las instalaciones del parque para las actividades de educación ambiental. Agradecemos a Camila Gómez, Ana Cristina Palma y Valentina Gómez por las ediciones hechas a la versión final de este documento. 4 BIODIVERSIDAD DE LA CUENCA DEL RIO BURITACA, SIERRA NEVADA DE SANTA MARTA - COLOMBIA Dr. Nicholas J. Bayly SELVA: Investigación para la conservación en el Neotrópico www.selva.org.co Email: nick.bayly@selva.org.co Logros y Hallazgos Im portantes ■ 16 especies de anfibios identificadas incluyendo 7 especies endémicas a la Sierra Nevada de Santa Marta ■ Presencia confirmada de 3 ranas clasificadas por la UICN como en peligro y 1 vulnerable ■ 213 especies de aves residentes identificadas, incluyendo 6 especies endémicas ■ Presencia confirmada de 2 especies de aves vulnerables y 2 casi amenazadas ■ Presencia confirmada de 15 especies de mamíferos medianos y grandes en la cuenca ■ 4 especies de felinos fotografiadas: Jaguar, Puma, Ocelote y Leopardus wiedii ■ 56 especies de mariposas identificadas ■ Seleccionamos 20 especies indicadoras del estado de la biodiversidad en la cuenca ■ 37 especies seleccionadas para la ‘Guía de Fauna del camino a Ciudad Perdida’ Especies amenazadas o casi amenazadas de la cuenca del río Buritaca, de izquierda a derecha: Ikagogi tayrona, Colestethus ruthveni, Pristimantis tayrona, y Basileuterus conspicillatus. 5 Antecedentes La cuenca del río Buritaca está ubicada en el flanco norte de la Sierra Nevada de Santa Marta (SNSM), una formación montañosa en la costa Caribe de Colombia que posee una riqueza biológica y cultural única en el mundo (Carbono & Lozando 1997, ProSierra 1998). Esta riqueza atrae a la región cada vez más visitantes nacionales e internacionales, específicamente al Parque Arqueológico Teyuna-Ciudad Perdida ubicado en la parte media de la cuenca del río Buritaca. El interés creciente en la región es una gran oportunidad que puede permitir conservar esta riqueza única por medio del turismo sostenible. Este proyecto hizo una caracterización de la fauna de la cuenca del río Buritaca para determinar cómo la región puede contribuir a la conservación de la biodiversidad Colombiana y simultáneamente proveer bases de información para diseñar actividades de ecoturismo productivas. Este documento resume los hallazgos más importantes, las metodologías, resultados y conclusiones de los censos de anfibios, aves, mamíferos y mariposas. Finalmente incluimos los reportes detallados para cada uno de los grupos individualmente. Metodología Durante tres meses, entre Mayo y Julio de 2012, llevamos a cabo una serie de censos de aves, mamíferos, anfibios y mariposas, a lo largo del camino turístico entre Machete Pelao y Teyuna-Ciudad Perdida. Dividimos el camino en 12 sectores de acuerdo al tipo de hábitat y a la altura sobre el nivel del mar (Fig. 1). Los censos de cada grupo pretendieron cubrir el mayor número posible de estos sectores. Utilizamos métodos estandarizados de detección visual y auditiva como censos en transectos y búsquedas en áreas fijas. De esta forma fue posible estimar las abundancias relativas de las especies y compararlas entre los sectores del camino. Todo esto a su vez fue relacionado con el estado de fragmentación o degradación de cada sector. Para la detección de mamíferos, operamos 10 cámaras trampa en cuatro sectores diferentes del camino. Los datos de los censos se analizaron para evaluar qué tan completa fue la caracterización, en términos del número de especies registradas (por medio de un índice de integridad), y para definir la distribución de las especies a lo largo de la cuenca. Las distribuciones de las especies fueron utilizadas a su vez para detectar las especies indicadoras. Estas especies, al ser monitoreadas a largo plazo, pueden ser utilizadas para detectar cambios ambientales en la cuenca, tanto positivos como negativos. 6 Figura 1. Área de estudio a lo largo del camino a Ciudad Perdida (línea naranja) y la división de sectores que refleja los hábitats y el cambio en altitud. Bosques en diferentes etapas de regeneración Mosaico de bosque y cultivos Machete Pelao Adan Principalmente zonas cultivadas Wiwa Tezhumake El Paraíso 7 9 8 6 3 5 2 1 4 Río Buritaca 10 Ciudad Perdida 1. Machete Pelao 2. Filo vista mar 3. Adan Bosque 4. Alfredo Fincas 5. Wiwa Bosque 6. Wiwa fincas 7. Mumake bosque 8. Filo puente 9. El Paraíso 10. Ciudad Perdida Resultados An fib i o s Durante 19 días de censos a lo largo de seis sectores del camino (sectores 3, 5, 6, 7, 8 y 10), se registraron 343 individuos de 16 especies de ranas (Anexo 1). El análisis de integridad sugirió que se detectaron entre el 80 y el 85% de las especies que pueden estar presentes en la Cuenca. Entre las especies que encontramos, se registraron 7 especies endémicas a la SNSM y 4 especies clasificadas bajo algún grado de amenaza de extinción por la UICN. La mayor riqueza de especies la obtuvimos en Ciudad Perdida, en donde también registramos poblaciones de todas las especies endémicas. En los sectores más bajos de la cuenca registramos gran abundancia de las especies invasivas y adaptadas a las áreas abiertas. Esto refleja el mayor porcentaje de tierras cultivadas. Es importante anotar que es necesario llevar a cabo censos a alturas mayores de 1500 m para registrar más especies endémicas y amenazadas que son exclusivas de los bosques montanos. 7 Aves Los censos de aves se hicieron en 45 días entre Mayo y Julio en todos los sectores del camino. Se detectaron 6687 individuos de 213 especies, incluyendo 6 especies endémicas a la SNSM, 2 especies vulnerables y 2 especies casi amenazadas (Anexo 2). Las especies endémicas estuvieron restringidas a los sectores sobre los 600 m (5, 8, 9 y 10), y fueron más abundantes en el sector 10 (Ciudad Perdida). Los Crácidos son aves grandes y predominantemente terrestres. Son cazadas por las personas y por lo tanto, su presencia y abundancia refleja la presión de cacería. En la cuenca detectamos tres especies de Crácidos en abundancias bajas a moderadas. Desafortunadamente no registramos ningún individuo del Paujil de Pico Azul (Crax alberti), especie críticamente amenazada que ocurre en bosques de tierras bajas bien conservados en la SNSM (Strewe et al. 2010). M am í fe ro s Las cámaras trampa funcionaron durante 496 noches trampa en cinco sectores diferentes (3, 5, 7, 8 y 10) pero debido a fallas en algunas cámaras, solo obtuvimos 376 noches efectivas de muestreo y no obtuvimos datos del sector 3. Se registraron 16 especies de mamíferos silvestres en total y una especie cimarrona (cerdo doméstico, Sus scrofa) (Anexo 3). Detectamos un buen grupo de carnívoros incluyendo al jaguar (Panthera onca), puma (Puma concolor) y ocelote (Leopardus pardalis). También detectamos buenas poblaciones de especies presa como el saino (Tayassu pecari), la guartinaja (Cuniculus paca) y el armadillo (Dassypus novemcinctus). La riqueza de especies fue mayor en Ciudad Perdida que en los otros sectores, al igual que la abundancia de la mayoría de especies. Dada la alta probabilidad de ocurrencia de los depredadores en el área de estudio, la abundancia de algunas presas clave como la guartinaja y el ñeque (Dasyprocta punctata) fue menor de lo esperado. Mariposas Los censos de mariposas se llevaron a cabo durante 17 días en Junio a lo largo de 7 sectores del camino a Ciudad Perdida (2, 3, 4, 5, 6, 8, & 10). Durante 102 horas de esfuerzo se registraron 377 individuos de 56 especies (Anexo 4). La mayor riqueza de especies se detectó en Ciudad Perdida y la diversidad de otros sectores boscosos fue mayor que la de las zonas intervenidas. Seleccionamos cinco especies indicadoras de acuerdo con su distribución en la cuenca, dentro las cuales hay dos especies que sirven para monitorear el aumento en las zonas intervenidas y abiertas en la cuenca. 8 Es t atus de l a bi od iv ers i d ad en l a c ue nc a Los censos a lo largo del camino a Ciudad Perdida arrojaron una alta diversidad de especies de los cuatro grupos estudiados. En el caso de los anfibios, el número de especies registradas representa un tercio del total de especies que han sido reportadas para la SNSM y el 42% de las especies endémicas (ver informe de anfibios). Dado que los censos de anfibios solo cubrieron aproximadamente un tercio del gradiente altitudinal de la SNSM, este resultado sugiere que la cuenca alberga una comunidad casi intacta de anfibios. En el caso de los mamíferos, la riqueza de especies estimada fue de 19 especies lo que concuerda con el número esperado de especies según nuestro conocimiento actual de los mamíferos de Colombia (Alberico et al. 2000). Nuevamente, esto sugiere que la comunidad de mamíferos a lo largo del camino aún retiene una buena riqueza de especies. Las aves también estuvieron bien representadas y, como en los anfibios, el número total de especies incluyó alrededor de un tercio de las especies que ocurren en la región. Dado el rango altitudinal que se cubrió, la carencia de humedales dentro de la zona de estudio y el hecho que no se muestreó durante la época de migración (se espera la ocurrencia de al menos 40 especies migratorias), podemos concluir que la riqueza de especies de aves es bastante alta en la cuenca del Buritaca. De hecho, al comparar estos datos con censos de otras partes de la SNSM, el número total de especies es comparable con el reportado para la cuenca del río Frio (Strewe & Navarro 2004) y para San Lorenzo (Bayly & Gómez 2012). Nuestros censos también registraron una serie de especies sensibles que son indicadoras del estado de salud de los ecosistemas. Por ejemplo la presencia de varias de las especies endémicas y amenazadas que dependen de los hábitats boscosos, en particular las especies de ranas, resalta la integridad relativa de los remanentes de bosque de la zona (RuedaAlmonacid et al. 2004). La presencia de puma y jaguar, que son considerados indicadores positivos de biodiversidad y especies sombrilla, también apuntan a que los ecosistemas de la cuenca están saludables. Estos grandes depredadores solo pueden sobrevivir si las poblaciones de sus presas son saludables y si tienen las áreas de hábitat que requieren (Sergio et al. 2008). Sin embargo, los censos también registraron una gran variedad de especies que están asociadas a hábitats abiertos. En una zona de bosques como la SNSM, estas especies son indicadoras del grado de fragmentación y de degradación de los hábitats naturales. Aunque los hábitats abiertos y transitorios contribuyen a la biodiversidad de la cuenca, si continúa expandiéndose la transformación del paisaje, específicamente a 9 sistemas en los que se elimina la cobertura de árboles, las especies asociadas a sistemas de bosque se verán negativamente afectadas. En resumen, el área que rodea el camino hacia Ciudad Perdida alberga una comunidad representativa de la fauna reportada para alturas bajas y medias de la SNSM. Por lo tanto, la cuenca del Buritáca juega un papel muy importante en la conservación de la biodiversidad a nivel regional, nacional y global. La confirmación de la presencia de 13 especies endémicas, 3 especies en peligro, 3 especies vulnerables y 5 casi amenazadas, hace de la cuenca del Buritáca un centro de endemismo y una prioridad global para la conservación de la biodiversidad. Impact o del turism o sobre la biodivers idad El turismo se ha convertido en la mayor actividad económica de la Cuenca del río Buritaca y si continúa creciendo como lo predicen los expertos, tiene el potencial de convertirse en una forma sostenible de suplir las necesidades económicas de las comunidades a largo plazo. El turismo sin regulación puede tener un impacto negativo en los ecosistemas, dejando huellas permanentes y de paso dañando la biodiversidad que albergan. Sin embargo, el turismo bien manejado puede proveer una alternativa económica a la agricultura, disminuyendo así la transformación de hábitats naturales a sistemas productivos. En el caso del camino hacia Ciudad Perdida, las actividades turísticas parecen tener una huella pequeña confinada a un corredor angosto a lado y lado del camino y alrededor de los alojamientos. En consecuencia, el beneficio esperado de reducir las áreas cultivadas necesarias para satisfacer las necesidades económicas, será mayor al impacto negativo que genera el turismo. La alta diversidad de especies que aún habitan en la Cuenca es evidencia del bajo impacto que el turismo tiene en la zona. De hecho, tanto para anfibios como para mamíferos la mayor riqueza de especies fue detectada alrededor del sitio arqueológico de Ciudad Perdida. Aunque un aumento de deshechos asociados al aumento en turistas podría llevar a contaminar las fuentes de agua, ya se han tomado una serie de medidas para minimizar esta posibilidad. Las poblaciones saludables de ranas en muchas quebradas y ríos indican que la calidad de las aguas es alta todavía. 10 La presencia de una comunidad saludable de mamíferos, incluyendo los grandes felinos, y la abundancia relativa de especies sensibles y amenazadas, sugiere que la diversidad de fauna a lo largo del camino no se ve afectada por el turismo. Entonces si los beneficios económicos del turismo reducen la presión sobre los hábitats naturales por medio de la reducción de la deforestación para agricultura y la reducción de la presión de cacería, la diversidad de fauna se verá beneficiada. Más aún, al promover la observación de fauna como una actividad para los turistas en la cuenca, las comunidades tendrán un beneficio económico adicional y por lo tanto aumentará la valoración por su biodiversidad y se preocuparán por conservarla. La creación de una guía de la fauna de la cuenca del Río Buritaca y el entrenamiento de 27 personas de la comunidad en técnicas de observación e identificación de fauna, ambas actividades de este proyecto, son el primer paso para promover la observación de fauna como actividad importante, fuente de ingresos para las personas y para la conservación de la biodiversidad de la cuenca del Buritaca. ©Paisajes de conservación – Zona de influencia Parque Sierra Nevada de Santa Marta/Hernan Arias 11 Recom endaciones La cuenca del río Buritaca alberga una biodiversidad de importancia nacional e internacional. Es uno de los bloques de bosque mejor conservados de la SNSM en el que habitan poblaciones de especies endémicas y amenazadas. Por lo tanto, desde el punto de vista de la conservación, es crítico que las áreas de bosque existentes se mantengan o aumenten. La promoción del ecoturismo como alternativa económica es un mecanismo por medio del cual esto se puede lograr. Especialmente si la observación de fauna puede generar ingresos que harían que un animal vivo sea más valioso que uno muerto. Las siguientes recomendaciones están orientadas a lograr mantener o aumentar la biodiversidad existente en la región y a llenar algunos vacíos de conocimiento sobre la misma. Es importante anotar que este estudio se llevó a cabo en un tiempo relativamente corto y por lo tanto no representa una evaluación exhaustiva de la fauna presente en la cuenca. Idealmente, habrá más estudios para aumentar la información disponible sobre la biodiversidad y asegurar que las decisiones de manejo estén basadas en ciencia rigurosa. ■ Continuar la caracterización de biodiversidad de mayor altura (>1300 m) donde se espera que ocurran más especies endémicas y amenazadas que no han sido registradas. ■ Implementar un programa de monitoreo a largo plazo utilizando las especies indicadoras para evaluar el estado de la biodiversidad. Idealmente, las actividades de monitoreo deben ser lideradas por la comunidad local con la asistencia de biólogos. ■ Continuar el entrenamiento de los guías en identificación de fauna, para promover la observación de vida silvestre como alternativa económica. ■ Desarrollar un plan de manejo para reducir la tasa de deforestación y degradación. Se puede considerar un esquema de compensación por conservación de bosque, subsidiado por ingresos del turismo. ■ Desarrollar un plan de manejo para la caza de animales silvestres y aves, e incluir la veda total de caza del Paujil de Pico Azul (Crax alberti) hasta que sus poblaciones se recuperen. ■ Implementar programas de reforestación y regeneración en las áreas degradadas y para asegurar la conectividad entre parches de bosque. 12 Bibliograf ia Alberico, M., A. Cadena, J. Hernandez-Camacho, and Y. Munoz-Saba. 2000. Mamiferos (Synapsida:Theria) de Colombia. Biota Colombiana 1: 43-75. Bayly, N.J. & Gómez, C. 2012. Las aves de Finca La Victoria, Sierra Nevada de Santa Marta. SELVA: Investigación para la conservación en el Neotropico, Bogotá. Informe técnico No. CEC01 Edición 3. Carbonó, E & G. Lozano-Contreras. 1997. Endemismos y otras singularidades de la Sierra Nevada de Santa Marta , Colombia. Posibles causas de orígenes y necesidades de Conservarlos. Revista Academica Colombiana de Ciencias. Volumen XXI Número 81: 409-419. PROSIERRA. 1998. Evaluación Ecológica Rápida de la Sierra Nevada de Santa Marta. Definición de Áreas Críticas Para La Conservación en la Sierra Nevada de Santa Marta. Fundación Pro-Sierra Nevada. Santa Marta. Ministerio del Medio Ambiente. UAESPNN. The Nature Conservancy, USAID, Embajada de Japón. Rueda-Almonacid, J.V., Lynch J. D & Amezquita, A (eds). 2004. Libro rojo de anfibios de Colombia. Serie Libros Rojos de Especies Amenazadas de Colombia. Conservación Internacional Colombia, Instituto de Ciencias Naturales-Universidad Nacional, Ministerio del Medio Ambiente. Bogotá, Colombia. Sergio, F., Caro, T., Brown, D., Clucas, B, Hunter, J., Ketchum, J. McHugh, K. & Hiraldo, F. 2008. Top predators as conservation tolos: ecological rationale, assumptions, and efficacy. Annu. Rev. Ecol. Evol. Syst. 39: 1-19. Strewe, R. & Navarro, C. 2004. The threatened birds of the río Frío Valley, Sierra Nevada de Santa Marta, Colombia. Cotinga 22: 47-55. Strewe, R., Lobaton, G. & Villa-de León, C. 2010. Evaluación del estado poblacional de Crax Alberti en la Sierra Nevada de Santa Marta, departamento del Magdalena, Colombia. Boletín del grupo de especialistas en cracidos 30: 5-16. 13 ANFIBIOS DE LA CUENCA DEL RÍO BURITACA, SIERRA NEVADA DE SANTA MARTA, COLOMBIA Liliana Patricia Saboyá Acosta 1 1 Grupo de investigación en Ecología y Sistemática de Anfibios y Reptiles Email: lilianasaboya@gmail.com Res um en Se realizó un inventario de anfibios en la cuenca media del río Buritaca a lo largo del recorrido ecoturístico (Machete Pelao- Ciudad Perdida), en la Sierra Nevada de Santa Marta (SNSM). Se realizó una búsqueda libre al azar (VES) en cuatro sectores con diferente grado de intervención: Adán, Wiwa, Tezhumake, y Ciudad Perdida. Los censos permitieron el registro de 343 individuos de 16 especies de anuros pertenecientes a 9 géneros y 7 familias. Según los estimadores Jacknife 1 y 2 se registró entre el 80-85% de las especies esperadas para esta zona. Se avistó el 32.7% del total de 49 especies de anuros presentes en la SNSM, y 42.1% de las 19 especies endémicas. Las siete especies endémicas identificadas en este estudio presentan algún grado de amenaza según criterios de la UICN. La riqueza de especies fue mayor en el sector de Teyuna-Ciudad Perdida, donde también se registró el mayor número de especies endémicas y fue el área con menor similaridad a los demás sectores muestreados, sin embargo, la riqueza de especies no varió mucho entre las diferentes zonas. El ecoturismo en la cuenca del río Buritaca ha contribuido al mantenimiento de los hábitats naturales. Para las actividades turísticas, se podrían implementar recorridos nocturnos para dar conocer las especies únicas de la región. 14 Introducción El sistema montañoso la Sierra Nevada de Santa Marta (SNSM) es un macizo aislado de las cordilleras de los Andes, localizado al norte del país (Rangel-Ch & Garzón-C 1995, Carbonó & Lozano-Contreras 1997). Debido a sus características geográficas, climáticas y geomorfológicas posee una diversidad ecológica que se expresa en un amplio rango de zonas de vida en una zona relativamente pequeña (Carbonó & Lozano-Contreras 1997, PROSIERRA 1998, Hernández – Camacho & Sánchez 1992). Para el grupo de anfibios, Colombia es considerado el segundo país más diverso a nivel mundial (entre 698-733 especies) (Galeano et al. 2006). La representación de este grupo en la Sierra Nevada de Santa Marta (SNSM) muestra un alto nivel de endemismo (38.6% del total de especies endémicas de vertebrados del macizo). En total, se posee un registro de 3 órdenes, 12 familias, 24 géneros y 52 especies, de las cuales 19 son endémicas. Las especies endémicas están concentradas principalmente en las zonas altas, como es el caso del género Pristimantis del que se conocen ocho especies con distribución restringida al macizo. En términos generales, el 8.4% del total de las especies de anfibios de Colombia se encuentran registradas en la SNSM. A nivel regional, del total de 38 especies del orden anura registradas para tierras bajas del Caribe, casi la mitad posee una distribución restringida a éste sistema montañoso (Rangel-Ch & Garzón-C 1995, PROSIERRA 1998, Galeano et al. 2006). En la mayoría del territorio Colombiano, existe una constante disminución y deterioro de los ecosistemas naturales como resultado de diversas actividades humanas (Villareal et al. 2004, Ruiz et al. 1996). Actualmente, en la SNSM sólo el 14.6% del bosque nativo permanece (Márquez 2004). Estas cifras alarmantes de pérdida de hábitat, sumada a la problemática mundial de anfibios, que actualmente figuran como uno de los grupos de vertebrados con mayor número de especies al borde la extinción o en peligro critico según criterios de la UICN (Stuart et al. 2004), hacen que sea necesario desarrollar estrategias y planes de acción que permitan obtener información sobre el estado de las especies a corto y mediano plazo. Para este fin, los inventarios y programas de monitoreo son fundamentales. En la parte norte de la SNSM se han realizado una serie de trabajos de caracterización de poblaciones de anfibios, donde se destacan principalmente los inventarios realizados por Ruthven (1922), Bernal-Carlo (1991) y trabajos taxonómicos en especies endémicas de Lynch y Ruíz-Carranza (1985) y Lynch (2008). A pesar de esto, el conocimiento sobre la ecología y dinámica de las poblaciones de anfibios es escaso, en particular de las especies endémicas, muchas de las cuales se encuentran clasificadas en peligro crítico como es el caso del género Atelopus. Este estudio tuvo como objetivo determinar la diversidad de los anfibios presentes en la cuenca media del rio Buritaca, una de las más conservadas en la SNSM. El trabajo se enfocó en las zonas ecoturísticas del recorrido entre Machete Pelao y Teyuna-Ciudad Perdida. 15 Metodología Área de Estudio El estudio se realizó en la cuenca media del río Buritaca, SNSM, en cuatro sectores aledaños al recorrido ecoturístico de Machete Pelao a Ciudad Perdida (Tabla 1). Estos sectores presentan diferentes tipos de cobertura vegetal por los diferentes grados de intervención antrópica (Tabla 1). Tabla 1. Coordenadas geográficas, altura promedio de cada sector visitado y esfuerzo de muestreo. Sector 1. Adán 2. Wiwa 3. Tezhumake 4. Ciudad Perdida Latitud 11.141588 11.125802 11.112341 11.101633 11.096667 11.095446 11.081947 11.038161 Longitud -73.856902 -73.856841 -73.865209 -73.875875 -73.884454 -73.895989 -73.902645 -73.92525 Altura promedio 600 m 550 m 600 m 400 m 450 m 800 m 600 m 1100 m Fecha No. horas 22-25 julio 18 hrs 18-21 julio 24 hrs 7-13 julio 36 hrs 14-17 julio 24 hrs Sector 1. Adán: Matriz de bosques y cultivos, grado de intervención antrópica significativa. En la zona de Honduras se pueden encontrar algunas quebradas como el “caño el Zaino” (Fig. 1d). Sector 2. Wiwa: Amplias zonas de potreros, cultivos y áreas de bosque en buen estado. Los estratos intermedios vegetales son más abundantes y los árboles de gran tamaño se encuentran con mayor frecuencia hacia la zona del río Buritaca (Fig. 1c). Los muestreos en este sector fueron concentrados en las zonas de potreros y cultivos. Sector 3. Tezhumake: Vegetación riparia aledaña al río Buritaca. Es común encontrar árboles de gran porte y estratos arbóreos intermedios. En este recorrido se abarcan los sectores aledaños a la cabaña Tezhumake y el filo después del puente (Fig. 1a). Sector 4. Ciudad Perdida: Bosques secundarios cercanos a quebradas que alimentan el río Buritaca. Es común encontrar palmas de tagua, bromelias, musgos y epífitas que contribuyen a la humedad del sector. En este recorrido se abarcaron las quebradas quiebra patas y el cacique, el sector de bocatoma de la cascada, y las terrazas de Ciudad Perdida (Fig. 1b). Muestreo de Anfibios Se realizó una búsqueda libre al azar (VES: Crump & Scott 1994) durante los días 6 a 25 de julio de 2012 en los cuatro sectores descritos previamente (Tabla 1). Se realizaron recorridos en cada sector caminando lentamente a lo largo de las quebradas, trochas y caminos en el bosque. Se llevaron a cabo observaciones y búsquedas de las especies de anfibios que se pudieran encontrar dentro o fuera del agua, en las orillas hasta 10 metros de distancia a cada lado de las quebradas o arroyos, debajo de piedras, hojarasca y sobre la vegetación. Durante varios días, cada zona fue muestreada tres horas en la mañana, iniciando a las 08:00, y tres horas en la noche desde las 18:30. Para cada avistamiento los siguientes datos fueron registrados: hora de observación, microhábitat y actividad (canto, amplexus, reposo, etc.). Se realizaron registros e identificación de especies de anfibios a través de vocalizaciones, observaciones visuales y fotografías del individuo avistado. Ningún ejemplar fue sacrificado. 16 A C B D Figura 1. A. Sector Tezhumake cercano al río Buritaca. B. Ciudad Perdida cercano a la quebrada quiebrapatas. C. Wiwa cerca al sector del río Buritaca conocido como Canquil. D. Adán, sector cercano a fincas. Análisis de Datos Los datos fueron ordenados en EXCEL 2007 ©, posteriormente se realizaron, gráficas, tablas, se calcularon índices y se determinaron porcentajes y frecuencias. Algunos análisis se realizaron usando Estimates 7.5 y SPSS 15.0. ■ Diversidad total Es el conjunto de especies registradas en el área de estudio. Se midió como la riqueza específica obtenida por medio de los estimadores de riqueza no paramétricos, Jacknife 1 y 2 en el programa Estimates 7.5 (Villareal et al. 2004). Se utilizaron los estimadores Jack 1 y 2 debido a que suponen heterogeneidad en las muestras, siendo idóneos para estimar la riqueza de anfibios en el área de estudio compuesta por potreros (Sector Wiwa), bosques secundarios (Ciudad Perdida), bosques riparios (Sector Tezhumake) y matrices bosque-cultivos (sector Adán) (Magurran 2004). También se determinó el grado de asociación por medio del coeficiente de similaridad de Bray Curtis. Las especies únicas (Singletons) y dobles (Doubletons), fueron graficadas con el fin de determinar si las especies raras disminuían a medida que se intensificaba el muestreo, basados en el supuesto de que en la naturaleza no existen individuos solos, sino poblaciones. Por lo tanto, si nosotros tenemos muchos singletons o uniques en una muestra, esto puede indicar que no se ha censado un número suficiente de individuos o que no se han realizado suficientes repeticiones (Villareal et al. 17 2004). Con base en los valores máximos de riqueza predicha por los estimadores, se determinó el porcentaje de especies registradas durante este estudio (Carvajal-Cogollo & Urbina-Cardona 2008). ■ Diversidad alfa Es el número de especies de anfibios en cada hábitat (potrero, bosque ripario, matriz de bosquecultivo y bosque secundario). Fue medida usando estimadores no paramétricos. Se realizó una predicción de la riqueza específica como función de la acumulación de especies por medio de los estimadores Bootstrap y Chao cuantitativo en el programa Estimates 7.5. El estimador Chao supone homogeneidad de hábitat en las muestras lo cual resulta positivo para estimar la riqueza de anfibios en cada área (Magurran 2004). Para medir la equidad se uso el índice de Shannon con logaritmo natural. ■ Abundancia Relativa Para conocer la abundancia de las diferentes especies se utilizó el índice de abundancia relativa (Ar) (Rueda-Solano & Castellanos-Barliza 2010), calculando el número de individuos con respecto al esfuerzo de captura: Ar = Ind / h * H Ind. = número de individuos de cada especie observados en cada hábitat. h = horas totales de búsqueda (para especies diurnas las horas totales de búsqueda diurna y para especies nocturnas las horas totales de búsqueda nocturna). H = número de observadores que participaron en los muestreos. La abundancia relativa de cada especie se puede clasificar usando las siguientes categorías (RuedaSolano & Castellanos-Barliza, 2010): Muy abundante: Ar >1 Abundante: Ar entre 0.99 y 0.75 ind/h-H Común: Ar entre 0.74 y 0.50 ind/h-H Rara: Ar entre 0.49 y 0.25 ind/h-H Muy rara: Ar <0.25 ind/h-H Las abundancias de anfibios encontradas en los cuatro sectores se compararon por medio del análisis de Kruskal-Wallis en el programa SPSS 15.0 (Zar 1999). ■ Especies indicadoras Dentro de los anfibios, las características propias de la biología de los anuros (reproducción, ciclo de vida dependiente de hábitats acuáticos y terrestres, piel permeable, adaptaciones a ambientes extremos) hacen de este grupo un excelente modelo para establecer el nivel de deterioro de los hábitats y ecosistemas (Galeano et al, 2006, Rueda-Almonacid et al, 2004). Para este trabajo se escogieron especies indicadoras de calidad de ambiente de acuerdo a su distribución en la cuenca, características biológicas, y su estatus de peligro de acuerdo a la IUCN. Los diferentes indicadores asignados son los siguientes: Positivo: Cuando los registros estuvieron asociados a hábitats poco perturbados y a la buena calidad en las aguas circundantes. Negativo: Cuando los registros estuvieron asociados a hábitats perturbados y/o transformados y que fueran especies colonizadoras. 18 Resultados Diversidad taxonómica Durante el estudio se muestrearon un total de 204 horas/hombre, registrándose un total de 343 individuos de 16 especies de anuros pertenecientes a 9 géneros y 7 familias (Tabla 2). No se registraron especies de los ordenes Caudata y Gymnophiona. De las especies de anuros reportadas, 8 están catalogadas como endémicas para la SNSM y se encuentran clasificadas con algún grado de amenaza según criterios de la UICN (2012) (Anexo 1). La familia más representativa con cinco especies fue Strobomatidae, con el género Pristimantis. Los géneros más diversos fueron Pristimantis con cinco especies, Leptodactylus con tres y Rhinella con dos especies. Tabla 2. Abundancia de especies de anuros registrados en los cuatro sectores a lo largo del recorrido Machete Pelao-Ciudad Perdida, cuenca del Río Buritaca. Familia Dendrobatidae Hemiphractidae Hylidae Centrolenidae Leptodactylidae Bufonidae Strobomatidae Especie Colostethus ruthveni* Dendrobates truncatus Cryptobatrachus boulengeri* Hypsiboas crepitans Scinax ruber Ikakogi tayrona* Leptodactylus savagei Leptodactylus fuscus Leptodactylus poecilochilus Rhinella marina Rhinella granulosa Pristimantis ruthveni* Pristimantis tayrona* Pristimantis cristinae* Pristimantis sanctamartae* Pristimantis sp.* Total especies Total individuos Adán 13 5 15 8 3 Wiwa 3 14 12 5 9 9 Tezhumake 18 8 33 24 Ciudad Perdida 21 8 22 7 7 54 12 5 7 66 6 5 14 4 8 112 5 3 12 22 8 10 9 111 *especies endémicas de la SNSM Diversidad total Los estimadores de riqueza Jacknife de primero y segundo orden reflejaron un número de especies muy similar al encontrado en campo, representando entre el 80-85% de la riqueza esperada (Fig. 3). El número de especies únicas y dobles encontradas fue disminuyendo al final del muestreo (Fig. 3). Diversidad Alfa La riqueza de anuros fue mayor en el sector de Teyuna-Ciudad Perdida (9 especies), seguido por el sector de Tezhumake (8 especies), mientras que los sectores Wiwa y Adán presentaron la menor riqueza (7 especies cada uno) (Tabla 2). Los estimadores de Riqueza Chao cuantitativo y Bootstrap, reflejaron un número de especies similar al reportado en campo (Tabla 3), indicando que la mayoría de especies presentes en cada sector fueron detectadas. 19 Figura 2. Porcentaje de especies por familia de anuros registrados en la cuenca del río Buritaca, Sierra Nevada de Santa Marta. Dendrobatidae 12% Hemiphractidae 6% Strobomatidae 31% Hylidae 13% Bufonidae 13% Leptodactylidae 19% Centrolenidae 6% Figura 3. Curva de acumulación de especies para los anuros en la cuenca del Río Buritaca, Sierra Nevada de Santa Marta: ▲Jack 2, ■Jack 1 ● Singletons ♦ Sobs ○ Doubletons. 25 Riqueza acumulada 20 15 10 5 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Numero de muestras 20 En términos de la similaridad entre sectores, la mayor similaridad se encontró entre Tezhumake y Adán con una similaridad del 57.8%. Seguido por los sectores de Adán y Wiwa con 53.3% de similaridad. A diferencia de éstos, el sector de Ciudad Perdida tuvo el valor más bajo de similaridad, al compartir sólo tres especies con los sectores Tezhumake y Adán; y dos con el sector Wiwa. En términos generales, el área de estudio presenta valores altos de equitabilidad (J> 0.8) lo que podría ser debido a la alta abundancia de pocas especies y a una cantidad considerable de especies con baja abundancia. Tabla 3. Riqueza observada y estimada de anuros registrados en la cuenca del Río Buritaca, en áreas de bosque ripario (Tezhumake), bosque maduro (Ciudad Perdida), potreros (Wiwa), y matriz de cultivos-bosques (Adán). Tezhumake Ciudad Perdida Wiwa Adan 8 9 7 7 Chao quant 8.83 (90.6%) 9.75 (92.3%) 7 (100%) 7 (100%) Bootstrap 9.2 (86.95%) 10.09 (89.19%) 7.14 (98.03%) 7.48 (93.58%) Sobs Abundancia relativa Los valores de abundancia relativa obtenidos en los cuatro sectores no presentaron diferencias significativas entre sí (H = 3.5, n = 64, p = 0.68). La especie Cryptobatrachus boulengeri mostró la mayor abundancia relativa, con valores altos de Ar en los sectores de Tezhumake (Ar = 0.91) y Adán (Ar = 0.83). Colostethus ruthveni presentó una mayor abundancia en Ciudad Perdida (Ar = 0.87) y alrededor de Adán (Ar = 0.72), principalmente alrededor de las quebradas (Anexo 1). Ikakogi tayrona y Pristimantis cristinae sólo fueron registradas en Ciudad Perdida, donde presentaron una abundancia significativamente alta (Ar = 0.91 para ambas especies). Las otras cuatro especies de Pristimantis también se encuentra restringidas a Ciudad Perdida y son menos abundantes: P. tayrona (Ar = 0,5), Pristimantis. sp (Ar = 0.41), P. sanctamartae (Ar = 0,33) y P. ruthveni (Ar = 0.12) (Anexo 1). Las otras especies fueron registradas en los sectores de Tezhumake, Wiwa y Adán, y en general tuvieron abundancias relativas bajas. De estas, Rhinella marina, Dendrobates truncatus, Hypsiboas crepitans, Leptodactylus savagei y L. fuscus fueron avistadas en más de un sector. Scinax ruber y Leptodactylus poecilochilus sólo fueron registradas en una locación y presentaron uno de los valores más bajos de abundancia (Ar = 0.16 y 0.13 respectivamente) (Anexo 1). Especies indicadoras De las especies presentes en la cuenca del río Buritaca seleccionamos cinco especies indicadoras: Cuatro especies endémicas a la SNSM como indicadoras Positivo, y una especie de amplia distribución en el Neotrópico como indicador Negativo (Tabla 4). 21 Tabla 4. Listado de especies indicadoras reportadas en la cuenca media del río Buritaca (Estatus IUCN: EN: En peligro, VU: Vulnerable, NT: Casi-amenazada, LC: menor preocupación DD: Datos deficientes). Todas las especies menos Leptodactylus fuscus son endémicas a la Sierra Nevada de Santa Marta. Familia Dendrobatidae Hemiphractidae Centrolenidae Leptodactylidae Strobomatidae Especie Colostethus ruthveni Cryptobatrachus boulengeri Ikakogi tayrona Leptodactylus fuscus Pristimantis ruthveni Pristimantis tayrona Pristimantis cristinae Pristimantis sanctamartae Tipo de Indicador Positivo Positivo Positivo Negativo Positivo Positivo Positivo Positivo Estatus IUCN EN EN VU LC EN NT DD NT Distribución en la Cuenca Común Abundante Rara Poco común Rara Rara Rara Rara Discusión La metodología utilizada permitió registrar en 17 días de muestreo (204 horas/hombre), cerca del 85% de las especies esperadas para esta zona según las curvas de acumulación de especies. En términos generales se pudo registrar el 32.7% del total de 49 especies de anuros reportados para la SNSM y el 42.1% de las 19 especies endémicas de este macizo. Aumentando el esfuerzo de muestreo e incluyendo áreas a mayores alturas dentro de la cuenca del río Buritaca, se incrementaría la probabilidad de encontrar otras especies, como Pristimantis megalops, P. insignitus, P. carmelitae (endémicas) y algunas de las especies del género Atelopus como A. laetissimus y A. nahumae que están presentes a mayores alturas. Todas las especies endémicas registradas en este estudio presentan algún grado de amenaza. Las especies Cryptobatrachus boulengeri, Colostethus ruthveni y Pristimantis ruthveni están categorizadas como especies en peligro (EN), debido a que su distribución está restringida a un área menor a 5000 km2, mientras Ikakogi tayrona está categorizada como vulnerable (VU). Pristimantis tayrona y P. sanctamartae están categorizada como casi amenazadas (NT), y P. cristinae está en la categoría de Datos Deficientes (DD). La conservación de los ecosistemas naturales en las cuencas como la del río Buritaca es de gran importancia ya que permite la subsistencia de las poblaciones de anfibios, organismos sensibles al deterioro de hábitats y ecosistemas (Galeano et al. 2006, RuedaAlmonacid et al. 2004). Actualmente en la cuenca del río Buritaca se promueve el ecoturismo, que ha contribuido a la disminución de talas, quemas y la contaminación de aguas destinadas a cultivos y ganadería. El mantenimiento de áreas boscosas en esta cuenca, evita la pérdida de hábitat y la 22 colonización de especies adaptadas a zonas abiertas que podrían aumentar la competencia y reemplazar a especies propias de la zona (Vargas & Bolaño 1999). Intervención antrópica y su relación con los anfibios Debido a actividades propias de los habitantes de la región, cada sector estudiado ha sido intervenido, generando algún grado de perturbación que se refleja principalmente en cambios a la cobertura vegetal. La supervivencia de anfibios en ambientes perturbados se logra a través de las diferencias en el uso de hábitats a nivel intra e interspecífico, por esta razón, en ambientes tropicales la competencia entre los diferentes grupos de anfibios se ve mediada por la distribución de las especies en gradientes espacio-temporales (Cáceres-Andrade & Urbina-Cardona 2009). La riqueza de especies entre los bosques secundarios (Ciudad Perdida), la matriz bosque-cultivos (Adán), potreros (Wiwa) y vegetación riparia (Tezhumake), no presentó una variación significativa, sin embargo, la composición si presentó variación a medida que cambiaba el gradiente altitudinal y el grado de intervención. El análisis de similitud de la anurofauna muestra similitudes en composición entre el sector de Tezhumake (vegetación riparia) y Adán (matriz bosque-Cultivos), mientras que Ciudad Perdida mostró el menor porcentaje de similitud en relación con los otros sectores, lo que puede estar reflejando la diferencia altitudinal. Estas diferencias también pueden estar asociadas a la estructura vegetal y a los microhabitats disponibles en determinada área. Por ejemplo, una mayor cobertura del dosel genera temperaturas más estables y bajas en los bosques y mayor aporte de hojarasca (Cáceres-Andrade & Urbina-Cardona 2009). Variables como la temperatura y humedad relativa influyen mucho en la ecofisiología de los anuros, razón por la cual la diversidad de estos tiende a aumentar en ambientes húmedos y con mayor disponibilidad de microhabitats (Pough et al. 1998, Urbina-C & Londoño-M. 2003). De los cuatro sectores visitados, Ciudad Perdida presentó el mayor número de especies registradas y la mayor tasa de endemismo (8 especies de las 9 reportadas) (Tabla 5). Este hecho puede estar asociado no sólo a las características de la vegetación y la altura, sino también a que el sector se encuentra dentro un área protegida, donde se evita la tala, la quema de bosques y se promueve su conservación. Tabla 5. Número de especies totales, endémicas, especies compartidas y especies exclusivas en cada sector visitado. Adán Wiwas Tezhumake Ciudad Perdida 7 (2) 7 (1) 8 (2) 9 (8) Especies en común 2 2 2 2 Especies exclusivas 1 0 1 6 No. especies (No. esp. endémicas) 23 En las zonas abiertas como potreros (Wiwa) y cultivos (Adán) se registró un menor número de especies (7 especies para los dos sectores), en su mayoría colonizadoras que han logrado adaptarse a esos ambientes (Tabla 5). Ambos sectores se encuentran ubicados en zonas bajas, donde se observaron especies típicas como Hypsiboas crepitans, Leptodactylus savagei, Leptodactylus fuscus y Rhinella marina que son las especies predominantes. La presencia de estas especies, puede estar asociada a los modos reproductivos que presentan. Por ejemplo, las especies de Leptodactylidae hacen nidos de espuma para proteger a las larvas de la desecación y depredación, aumentando así el éxito de su desarrollo. Estas especies son características de zonas abiertas de pastizal y pantanos, y realizan sus posturas en charcas permanentes (Cuentas et al. 2002). Especies como Leptodactylus fuscus y R. marina pueden servir de indicadores del nivel de perturbación en los hábitats de la región (Cáceres-Andrade & Urbina-Cardona, 2009), debido a sus hábitos generalistas y adaptabilidad a diferentes ambientes. Figura 4. Posturas izquierda a derecha: Leptodactylus savagei; Leptodactylus fuscus; Hypsiboas crepitans; Rhinella marina. Especies de interés para el turismo Promover el avistamiento de anfibios como una actividad turísticas sería una buena herramienta pedagógica para sensibilizar al público general sobre la biodiversidad de la SNSM. Se podrían tener en cuenta las especies endémicas como Ikakogi tayrona y Cryptobatrachus boulengeri, que hacen parte de la fauna única de la SNSM y cuentan con poblaciones abundantes fáciles de observar. Además de esto, son especies interesantes y llamativas debido a su coloración. Las especies comunes como Hypsiboas crepitans, Dendrobates truncatus, Rhinella marina, Leptodactylus savagei y L. fuscus son fáciles de observar y de escuchar en las zonas del recorrido y en las cabañas de descanso. La programación de recorridos nocturnos para el avistamiento de anuros (y mamíferos) sería una actividad interesante que permitiría al turista reconocer la anurofauna típica de la SNSM así como observar aspectos ecológicos de las especies (cantos, amplexus, etc). Planes de monitoreo Las especies endémicas utilizadas como indicadoras de calidad de hábitats en la cuenca del Buritaca, carecen de información básica (ecología, distribución e historia natural) que pueda contribuir al conocimiento de sus requerimientos ecológicos y su conservación. Debido a esto, la implementación de monitoreos en diferentes épocas del año puede generar una aproximación al 24 estado actual de las poblaciones. El declive de poblaciones de anuros se puede dar por varios factores como la llegada de especies invasoras (La Marca y Reinthaler 1991, Young et al. 2001, Ron et al. 2003), una mayor radiación ultravioleta (Blaustein et al. 1994, Lizana y Pedraza 1998), el cambio climático (Daszak et al. 2005, Pounds et al. 2006, Lampo et al. 2006), y diferentes agentes patógenos como el Batrachochytrium dendrobatidis (Pounds et al. 2006, Lips et al. 2006). Por esta razón, un programa de monitoreo podría generar la información necesaria para determinar qué factores podrían estar afectando a las diferentes especies e implementar planes que contribuyan a la conservación y mantenimiento de las diferentes poblaciones. Recomendaciones Se sugiere aumentar el esfuerzo de muestreo en la zona, abarcar ecosistemas de gran importancia como los Páramos con el fin de registrar especies en peligro crítico como las especies del género Atelopus presentes en la SNSM. De igual forma para próximos estudios sería pertinente y útil abarcar otros grupos de la herpetofauna como serpientes y lagartos los cuales también tienen un porcentaje significativo en endemismo para la SNSM. En el caso particular de las serpientes, durante el recorrido turístico es común encontrar serpientes tanto venenosas como no venenosas y la creación de fichas para observación sería de gran utilidad para los turistas nacionales e internacionales. © Nick Bayly Ikakogi tayrona – una especie endémica a la Sierra Nevada de Santa Marta, potencialmente de gran interés para el turismo. 25 Bibliograf ia Blaustein A. R., J. M. Romansic, E. A. Scheessele, B A. Han, A. P Pessier, y J. E. Longcore. 2005. Interspecific variation in susceptibility of frog tadpoles to the pathogenic fungus Batrachochytrium dendrobatidis. Conservation Biology 19: 1460-1468. Bernal-Caro, A. 1991. Herpetology of Sierra Nevada de Santa Marta, Colombia. A biogeographical analysis. Univesristy Microfilms International. A Bell & Howell information Company. Carbonó, E & G. Lozano-Contreras. 1997. Endemismos y otras singularidades de la Sierra Nevada de Santa Marta , Colombia. Posibles causas de orígenes y necesidades de Conservarlos. Revista Academica Colombiana de Ciencias. Volumen XXI Número 81: 409-419. Crump, M.L., & N.J. Scott.1994. Standard techniques for inventory and monitoring. Pp. 77171 .Heyer, M. A., R.W. Donelly, L.A. Mcdiarmid, C. Hayek & M.S. Foster. (eds). Measuring and Monitoring Biological Cuentas, D., R. Borja., J. D. Lynch., J. Renjifo. 2002. Anuros del departamento del Atlántico y Norte de Bolívar. Universidad del Atlántico. Editorial Cencys 21. Primera edición. Barranquilla. Colombia 117p. Daszak, P., Scott, D. E., Kilkpatrick, A. M., Faggioni, C., Gibbons, J. W. y Porter, D. 2005. Amphibian population declines at the Savannah River site are linked to climate, not Chytridiomycosis. Ecology 86: 323–323. Galeano, S. P., Urbina, J. C., Gutierrez-C., P.D.A,Rivera-C, M y Páez, V. 2006. Los anfibios de Colombia, Diversidad y estado del Conocimiento. Tomo II 92-104p en: Chavez, M. E. y Santamaría M (eds). 2006. Informe sobre el avance en el conocimiento y la información de la biodiversidad 1998 -2004. Insitituo de investigfaciones de Recursos Biologicos Alexander Von Humboldt, Bogotá D.C. Colombia 2 tomos. Galvis, P, A., Mejía, A., Rueda-Almonacid, J. V. 2011. Fauna Silvestre de la Reserva Forestal Protectora Montes de Oca. Corpoguajira- Colombia en Hechos. Primera edición. 102103 p. Guayasamin, J.M., S, Castroviejo-Fisher., L, Trueb., J, Ayarzaguena., M, Rada & C , Vilá. 2009. Phylogenetics sistematics of glassfrog (Amphibia: Centrolenidae) and their sister taxon Alloprhyne ruthveni. Zootaxa 2100: 1-97. Hernandez-Camacho, J. & H. Sanchez. 1992. Biomas terrestres de Colombia. En: Halfter. La diversidad biologica de iberoamérica I: Acta Zoologica Mexicana: 153-173 p. Kaplan, M. 1997. A new specie of Colostethus from sierra nevada de Santa Marta (Colombia) with comments on intergeneric relationships within the Dendrobatidae. Journal of Herpetology 31: 369-375. La Marca, E. y H. P. Reinthaler. 1991. Population changes in Atelopus species of the Cordillera de Mérida, Venezuela. Herpetological Review 22: 125-128. 26 Lampo M., A. Rodríguez-Contreras, E. La Marca, y P. Daszak. 2006. A chytriomycosis epidemic and a severe dry season precede the disappearance of Atelopus species from the Venezuelan Andes. Herpetological Journal 16: 395-402. Lips K. R., F. Brem, R. Brenes, J. D. Reeve, R. A. Alford, J. Voyles, C. Carey, L. Livo, A. P. Pessier, y J. P. Collins. 2006. Emerging infectious disease and the loss of biodiversity in Neotropical amphibian community. Proc. Natl. Acad. Sci. 103: 3165-3170. Lizana, M., y E. M. Pedraza. 1998. The effects of UV-B radiation on toad mortality in mountainous areas of Central Spain. Conservation Biology 12: 703-707. Lynch, J.D. and Ruiz-Carranza, P.M. 1985. A synopsis of the frogs of the genus Eleutherodactylus from the Sierra Nevada de Santa Marta, Colombia. Occasional Papers of the Museum of Zoology of the University of Michigan:1-59. Lynch, J. 2008. A taxonomic revision of frogs of the genus Cryptobatrachus (Anura: Hemiphractidae). Zootaxa 1883: 28-68. Magurran, A. 2004. Measuring biological diversity. Blackwell Publishing Márquez, G., 2004. Mapas de un fracaso: Naturaleza y conflicto en Colombia. Instituto de Estudios Ambientales Universidad Nacional de Colombia – Instituto Colombiano de Antropología e Historia. Bogotá. Medina-Rangel, G. F., G. Cárdenas-Arevalo & O.V. Castaño-Mora. 2011. Anfibios y Reptiles de los alrededores del complejo cenagoso de Zapatosa, departamento del Cesar, Colombia. En: J.O. Rangel-Ch. (Ed). Colombia Diversidad Biotica. Publicación Especial No.1. Grupo de Biodiversidad y Conservación, Instituto de Ciencias Naturales, Universidad Nacional de Colombia-CORPOCESAR, Bogotá D.C., Colombia. 30p. PROSIERRA. 1998. Evaluación Ecológica Rápida de la Sierra Nevada de Santa Marta. Definición de Áreas Críticas Para La Conservación en la Sierra Nevada de Santa Marta. Fundación Pro-Sierra Nevada. Santa Marta. Ministerio del Medio Ambiente. UAESPNN. The Nature Conservancy, USAID, Embajada de Japón. Pough F. H., RM., Andrews, J.E., Cadle., M. L., Crump, A. H., Savitsky, K. D., Wells. 1998. Herpetology. Prentice hall New Jersey, 577. Pounds J.A., M.R. Bustamante, L.A. Coloma, J.A. Consuegra, M.P.L. Fogden, P.N. Foster, E. La Marca, K.L. Masters, A. Merino-Viteri, R. Puschendorf, S.R. Ron, G.A. SanchezAzofeifa, C.J. Still y B.E. Young. 2006. Widespread amphibian extinctions from epidemic disease driven by global warming. Nature 439: 161-167 Rangel-Ch, O & Garzón-C. A. 1995. Sierra Nevada de Santa Marta, Colombia (Con énfasis en la parte norte Transecto del río Buritaca-La cumbre) En: Ranjel-Ch, J. 1995. Colombia Diversidad Biotica I. pag: 155-170 Renjifo, J. M & M, Lundberg. 1999. Guía de campo Anfibios y Reptiles de Urrá. Editorial Colina. Primera Edición, Medellín, Colombia. 27 Renjifo, J. M., C. A Lasso., M. A. Morales-Betancourt. 2009. Herpetofauna de la Estrella fluvial de Inírida (Ríos Inirida, Guaviare, Atabapo y Orinoco), Orinoquía Colombiana: lista preliminar de especies. Biota Colombiana 10: 171-178. Ron S. R., W. E. Duellman., L. E. Coloma., y M. Bustamante. 2003. Population decline of the Jambato toad Atelopus ignescens (Anura: Bufonidae) in the Andes of Ecuador. Conservation Biology 12:106-117 Rueda-Almonacid, J.V., Lynch J. D & Amezquita, A (eds). 2004. Libro rojo de anfibios de Colombia. Serie Libros Rojos de Especies Amenazadas de Colombia. Conservación Internacional Colombia, Instituto de Ciencias Naturales-Universidad Nacional, Ministerio del Medio Ambiente. Bogotá, Colombia. 348p. Rueda-Solano B. & Castellanos-Barliza G. 2010. Herpetofauna de Neguanje, Parque Nacional Natural Tairona, Caribe Colombiano. Acta biológica Colombiana 15 (1): 195-206. Ruiz-Carranza, P.M. & Lynch, J.D. 1991. Ranas Centrolenidae de Colombia II. Nuevas especies de Centrolene de la Cordillera Oriental y Sierra Nevada de Santa Marta. Lozania 58: 1–26. Ruthven, A. G. 1922. The amphibians and Reptiles of the Sierra Nevada de Santa Marta, Colombia. University of Michigan. Saunders D., R. Hobbs & C. Margules, 1991. Biological consequences of ecosystem fragmentation: A review. Conservation Biology 5: 18-32. Scott, N.J., Jr. 1976. The abundance and diversity of the herpetofaunas of tropical forest litter. Biotropica 8:41. Señaris, J., & G. Rivas. 2006. Anfibios y reptiles de la cuencua alta del río Paragua, Estado Bolivar, Venezuela. Pp 135- 143. En: Evaluación rápida de la niodiversidad de los ecosistemas acuaticos de la cuenca alta del rio paragua. Estado Bolivar, Venezuela. J. C Señaris, C. Lasso, A. Florez (Eds). RAP Bulletin of biological Assessment 49. Conservation Internacional. Washington D. C. USA. Vargas, F. & M. E. Bolaños, 1999. Anfibios y reptiles presentes en hábitats perturbados de selva lluviosa tropical en el bajo Anchicayá, Pacífico colombiano. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 23: 499-511. Villareal, h., m. Alvares, s. Cordoba, f. Escobar, g. Fagua, f. Gast, a. Mendoza, m. Ospina, a. M. Umaña. 2004. Manual de inventarios de biodiversidad. Programa de inventario de biodiversidad. Instituto de investigaciones von Alexander Humboldt. Bogotá, Colombia. Young, B.E., S.N. Stuart, J.S. Chanson, N.A. Cox & T.M. Boucher. 2004. Joyas que están desapareciendo: El estado de los anfibios en el Nuevo Mundo. NatureServe, Arlington, Virginia. 60 p. http://www.natureserve.org/publications/joyas_desapareciendo.pdf Zar, J.H. 1999. Biostatistical Analisis. 3ra Ed. Prentice Hall. Consulta online redlist Castro, F & J. Lynch 2004. Dendrobates truncatus. In: IUCN 2012. IUCN Red List of Threatened 28 Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 01 September 2012. Lynch J., M. P. Ramírez Pinilla, M. Osorno-Muñoz, J. Vicente Rueda, A. Amézquita, M. C. Ardila-Robayo. 2004. Colostethus ruthveni. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 10 August 2012. Lynch J., M. P. Ramírez Pinilla, M. Osorno-Muñoz, J. V. Rueda, A. Amézquita, M. C. Ardila-Robayo 2004. Ikakogi tayrona. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 10 August 2012. Silvano D., C. Azevedo-Ramos, E. La Marca, P. Narvaes, I. di Tada, D. Baldo, F. Solís, R. Ibáñez, C. Jaramillo, Q. Fuenmayor, & J. Hardy 2010. Rhinella granulosa. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 01 September 2012. Solís, F., R. Ibáñez, G Hammerson, B. Hedges, A. Diesmos, M. Matsui, J. Hero, S. Richards, L. Coloma, S. Ron, E. La Marca, J. Hardy, R. Powell, F. Bolaños, G. Chaves, P. Ponce 2009. Rhinella marina. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 31 August 2012. Solís F., R. Ibáñez, G. Chaves, F. Bolaños, J. Savage, C. Jaramillo, Q. Fuenmayor, R. Amanda E. A. Mijares 2004. .Leptodactylus poecilochilus. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 31 August 2012. Solís, F., R. Ibáñez, C. Jaramillo, Q. Fuenmayor, C. Azevedo-Ramos, E. La Marca, L. A. Coloma, S. Ron, J. Hardy, B. Hedges, B. Ibéné, M. Breuil, Robert Powell 2010. Scinax ruber. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 31 August 2012. Ramírez Pinilla M. P., M. Osorno-Muñoz, J. V. Rueda, A. Amézquita, M. C. ArdilaRobayo 2004. Cryptobatrachus boulengeri. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 10 August 2012 Ramírez Pinilla M. P, Mariela P., M. Osorno-Muñoz, J. V. Rueda, A. Amézquita, M. C. Ardila-Robayo. 2004. Pristimantis ruthveni. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 10 August 2012. Ramírez Pinilla M. P, Mariela P., M. Osorno-Muñoz, J. V. Rueda, A. Amézquita, M. C. Ardila-Robayo 2004. Pristimantis sanctaemartae. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 10 August 2012. Ramírez Pinilla M. P, Mariela P., M. Osorno-Muñoz, J. V. Rueda, A. Amézquita, M. C. Ardila-Robayo 2004. Pristimantis tayrona. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 10 August 2012. Reynolds R., U. Caramaschi, A. Mijares, A. Acosta-Galvis, R. Heyer, E. Lavilla, J. Hardy 2004. Leptodactylus fuscus. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 10 August 2012. 29 LAS AVES DE LA CUENCA DEL RÍO BURITACA, SIERRA NEVADA DE SANTA MARTA, COLOMBIA Hernan Arias & Nicholas Bayly1 Email: hederar@yahoo.com & nick.bayly@selva.org.co 1 SELVA: Investigación para la conservación en el Neotrópico Res um en Durante aproximadamente 50 días de muestreo entre junio y agosto 2012 en la cuenca del río Buritaca, registramos 213 especies de aves. Los muestreos no incluyeron el periodo en que las aves migratorias Neotropicales están presentes, o alturas mayores a los 1.700 m, por lo que esperamos que el total de especies para la cuenca sea mayor a 300. Este total de especies (>300) equivaldría a un aproximado de la mitad de las especies conocidas para la SNSM y sus alrededores, convirtiendo a la cuenca del río Buritaca en una zona muy importante para la biodiversidad de aves en la región. Detectamos seis especies de aves endémicas a la SNSM, una de las cuales está clasificada como vulnerable a la extinción y dos como casi amenazadas. En adición a estas especies endémicas registramos dos especies más que se encuentran bajo algún grado de amenaza (Ara militaris y Aburria aburri). Aunque los diferentes sectores incluidos en el estudio muestran fuertes diferencias en la composición del hábitat y el grado de intervención, no encontramos diferencias significativas entre su riqueza y diversidad de especies. La alta riqueza de especies encontrada en algunos sectores con grandes extensiones de cultivos, puede ser explicada por el mosaico de hábitats que presentan, por lo que además de sustentar especies de hábitats abiertos, sustentan especies asociadas a los bosques. Dentro de las especies registradas, identificamos seis especies o grupos de especies que pueden servir como indicadoras de la salud de los hábitats naturales de la cuenca, y 11 especies de gran interés para el turismo. Recomendamos que se realicen muestreos adicionales de las aves migratorias en los meses en que están presentes, y de las especies endémicas y amenazadas asociadas a bosques montanos en alturas mayores de 1.700 m. Finalmente, consideramos urgente que se realicen más censos para evaluar el estatus del Paujil de pico azul (críticamente amenazado) en la cuenca. 30 Introducción Ubicada en la costa norte de Colombia, la Sierra Nevada de Santa Marta (SNSM) es la cadena montañosa costera más alta del mundo. Se extiende desde el nivel del mar hasta los 5.770 metros, en este gradiente se encuentran seis zonas de vida: bosque húmedo o seco de tierras bajas (0-1.050 m), bosque húmedo pre-montano (1.050-1.900 m), bosque húmedo de montaña (1.900-3400 m), páramo (3.400-4.200 m), superpáramo (4.200-5.100 m) y cinturón de nieve (5.100-5.770 m). La SNSM es un sistema montañoso aislado de los Andes, con características únicas en términos geológicos y geográficos. Debido a estas particularidades podemos encontrar fauna y flora endémicas, especies que no se encuentran en ningún otro lugar del mundo. Colombia es el país con la mayor diversidad de aves en el mundo, con más de 1.850 especies reportadas (Hilty & Brown 1986). La SNSM cuenta con más de 600 especies de aves, de estas 21 son endémicas a Colombia, y 18 especies y 55 subespecies son endémicas a la SNSM (Hilty & Brown 1986, Restall et al. 2006, Strewe & Navarro 2004a). Esto hace de la SNSM el mayor centro de endemismos del mundo. Adicionalmente es considerado un sitio de importancia para las aves migratorias y existe evidencia de cómo estas especies usan la SNSM para guardar la energía necesaria para migrar (Bayly et al. 2012, Bayly et al. en prensa). En la SNSM existen varias zonas de conservación y parques nacionales como el PNN Sierra Nevada de Santa Marta y PNN Tayrona, sin embargo, de los bosques y vegetación original sólo se conserva el 15% (ProSierra 1998). La pérdida de hábitats naturales en la SNSM se debe principalmente a la colonización y al cambio en el uso de los suelos. Debido a estas problemáticas muchas de las especies endémicas se la SNSM se encuentran en peligro de extinción, y de algunas no se tiene información desde hace mucho tiempo (Renjifo et al. 2002). La cuenca del río Buritaca, ubicada en el piedemonte de la SNSM sostiene uno de los fragmentos continuos de bosque tropical más grandes en la SNSM. Es uno de los últimos refugios para las especies de aves endémicas de la SNSM, y es un lugar de importancia arqueológica y turística a nivel mundial. La combinación de bosques conservados, su alta biodiversidad, sitios arqueológicos, y la presencia de culturas indígenas hacen de la cuenca del rio Buritaca y el camino hacia Ciudad perdida un lugar único. Esta variedad de recursos presentan retos y oportunidades para el uso y conservación de sus recursos. El objetivo principal de este estudio fue realizar una caracterización de las especies de aves presentes en el camino hacia Ciudad Perdida y sus cercanías, así como una evaluación del estado de las poblaciones de aves presentes en la zona, con énfasis en las especies endémicas y amenazadas. La información será utilizada para desarrollar herramientas ecoturísticas que permitan el uso sostenible y la conservación de la zona. 31 Metodología Área de Estudio El estudio se realizó en la SNSM en el camino hacia Ciudad Perdida desde Machete Pelao, subiendo por la cuenca del río Buritaca hasta el Parque Arqueológico Teyuna-Ciudad Perdida. El área de estudio comprende una matriz de bosques en diferentes estados de conservación y zonas intervenidas, que incluyen cultivos, potreros y asentamientos humanos de diferentes tamaños. Los bosques en mejor estado de conservación se encuentran en la zona alta del camino, las zonas bajas por el contrario, son dominadas por áreas de ganadería y cultivos. Los censos para aves fueron realizados entre el 25 de Mayo y el 23 de Julio de 2012, temporada que corresponde al final de la época reproductiva de la mayoría de las especies de aves. Se realizaron muestreos principalmente desde los 400 msnm hasta los 1.300 msnm, adicionalmente se efectuaron algunas salidas desde los 200 msnm hasta los 1.880 msnm. Figura 1. Distribución de los sectores de estudio y diferentes tipos de hábitat en el camino hacia Teyuna-Ciudad perdida. Bosques en diferentes etapas de regeneración Mosaico de bosque y cultivos Machete Pelao Adan Principalmente zonas cultivadas Wiwa Tezhumake El Paraíso 7 9 8 6 3 5 2 1 4 Río Buritaca 10 Ciudad Perdida 1. Machete Pelao 2. Filo vista mar 3. Adan Bosque 4. Alfredo Fincas 5. Wiwa Bosque 6. Wiwa fincas 7. Mumake bosque 8. Filo puente 9. El Paraíso 10. Ciudad Perdida 32 Método de muestreo Los 23 kilómetros de camino entre Machete Pelao y Ciudad Perdida fueron divididos en 10 sectores (Fig. 1). En estos sectores, excluyendo sector 1 (Fig. 1), se trazaron 28 transectos de 500 metros cada uno, donde se realizaron censos utilizando la metodología de transectos de distancias variables (Ralph et al. 1993). Los transectos se recorrieron entre las 5:40 am y las 11:00 am, horas de mayor actividad de las aves. En algunas ocasiones se realizaron censos complementarios entre las 3:00 pm y las 6:00 pm. Cada transecto fue caminado a paso constante, siendo recorridos en promedio durante 46 minutos. Para cada una de las aves observadas o escuchadas durante los transectos se colectaros los siguientes datos: especie, número de individuos, distancia horizontal al transecto, datos de comportamiento y reproducción. Se realizaron búsquedas y recorridos complementarios a lo largo de los transectos y en otras zonas, utilizando el método de búsqueda intensiva (Ralph et al. 1993), con el fin de maximizar el inventario de especies registradas y la información general sobre especies de interés. También se realizaron salidas en la noche buscando aves nocturnas. Se colectaros los mismos datos que en los censos diurnos excluyendo la distancia. Índices de riqueza y diversidad Para evaluar la integridad de los muestreos en cada sector de estudio y para comparar la riqueza y diversidad de especies entre sectores, utilizamos el programa EstimateS 8.0.2 (Colwell 2009). Calculamos cinco diferentes índices de riqueza de especies, que predicen el número de especies esperadas con base a las curvas de acumulación de especies; para esto, cada recorrido de un transecto es una unidad de muestreo. Relacionando el número de especies esperadas con el número de especies observadas, podemos evaluar qué tan completos fueron los muestreos en cada sector. Además de estimar la riqueza de especies por sector, calculamos dos índices de diversidad, Shannon Weaver y Simpson, utilizando el programa EstimateS 8.0.2 para cada sector. Estos índices toman en cuenta, además de la riqueza de especies, la abundancia de cada especie de tal forma que si unas pocas especies son abundantes, la diversidad es menor. Para evaluar el efecto del estado de conservación de cada sector sobre la riqueza y diversidad de especies, comparamos los índices entre cada sector usando una prueba Kruskall-Wallis en el Programa R. Cada sector fue asignado a una clase de conservación/intervención de la siguiente manera: 1. Conservado (Filo Puente, Wiwa Bosque); 2. Moderadamente intervenido (Mumake Bosque, El Paraíso, Adán Bosque); 3. Altamente intervenido (Alfredo Fincas y Wiwa Fincas). Abundancia relativa Para calcular la abundancia relativa de cada especie registrada durante los transectos, los datos obtenidos se organizaron en el programa Excel 2010. Luego calculamos el número de individuos registrados en cada uno de los sectores de estudio. Dado que el número de transectos completados en cada sector variaba, corregimos los totales de individuos por sector por el esfuerzo de muestreo, para generar una estimación del número de individuos esperados por cada kilómetro de transecto 33 (No. Ind/km). De acuerdo con el No. Ind/km asignamos una clase de abundancia para cada especie en cada sector: No. Ind/km <1 RARA No. Ind/km 1 a 5 OCASIONAL No. Ind/km 5 a 10 COMÚN No. Ind/km >10 MUY COMÚN Además de la abundancia relativa de cada especie por sector, generamos una abundancia para toda la cuenca entre Machete Pelao y Ciudad Perdida, sumando el número de individuos por km para los 9 sectores muestreados (ver Anexo 3). De acuerdo al total, teniendo en cuenta todos los sectores, asignamos las clases de abundancia en la siguiente forma: No. Ind. <5 No. Ind. 5 a 20 No. Ind. 20 a 40 No. Ind. >40 RARA OCASIONAL COMÚN MUY COMÚN Especies indicadoras Las especies indicadoras son especies que por su estrecha relación con diferentes presiones, como la cacería, o diversos factores ecológicos, pueden ser utilizadas en el largo plazo para monitorear el estado de conservación de un sitio. Idealmente, son especies relativamente abundantes, fáciles registrar y que sus poblaciones responden en una manera consistente a cambios en el ambiente, como la fragmentación del bosque. Para seleccionar las especies indicadoras, examinamos la distribución de todas las especies consideradas comunes o muy comunes (ver arriba) con relación al estado de intervención en cada sector. Consideramos que el estado de intervención aumenta entre sectores en el siguiente orden: Ciudad Perdida, Filo Puente, Wiwa Bosque, El Paraíso, Mumake Bosque, Adán Bosque, Wiwa fincas, Alfredo fincas (Fig. 1). No incluimos Vista Mar filo por el bajo esfuerzo de muestreo de este sector. Resultados Se completaron un total de 62 transectos durante 3.063 horas de muestreo, y más de 1.000 horas en exploraciones y búsquedas intensivas. Durante los transectos se detectaron un total de 5.272 individuos de 153 especies. En total, incluyendo los transectos, las exploraciones, y las búsquedas intensivas, se registraron 213 especies pertenecientes a 41 familias. Las familias más comunes fueron Tyrannidae (Atrapamoscas) y Thraupidae (Tangaras) (Fig. 2). De las 213 especies encontradas, 6 son endémicas a la SNSM y hay 4 especies bajo alguna categoría de amenaza (ver abajo). 34 35 30 25 20 15 10 5 Tyrannidae Trogonidae Trochilidae Tinamidae Thamnophilidae Ramphastidae Polioptilidae Picidae Momotidae Incertae sedis Hirundinidae Galbulidae Fringillidae Emberizidae Cracidae Corvidae Cinclidae Cardinalidae Ardeidae Apodidae Accipitridae 0 Figura 2. Distribución del número de especies por familia encontradas en la ruta hacia Ciudad Perdida. Índices de riqueza y diversidad Los índices de riqueza estiman que el número de especies presente en cada sector varía entre 78 y 124 especies (Tabla 1). El porcentaje del número de especies esperadas que fue registrado en cada sector varía entre 77.3% y 88%, con un promedio de 84%. Aunque en los transectos no se registraron todas las especies esperadas, creemos que las búsquedas adicionales detectaron una buena parte de las especies faltantes. No encontramos diferencias en la riqueza de especies esperada para los cinco diferentes índices en relación con el grado de intervención entre sectores (Kruskall Wallis, P > 0.3 en todos los casos). Evaluando los intervalos de confianza (95%) para el estimador de riqueza, Chao 1, tampoco hay evidencia de una diferencia clara entre sectores en la riqueza de especies (Fig. 3). Sin embargo, hay evidencia para una menor riqueza en los sectores vecinos, Wiwa fincas y Mumake bosque, y una mayor riqueza en Wiwa bosque. Al igual que la riqueza de especies, los índices de diversidad entre sectores con diferentes niveles de intervención no mostraron diferencias significativas (Shannon, Kruskall Wallis = 0.61, p = 0.738; Simpson, Kruskall Wallis = 1.93, p = 0.381). Los mayores valores de diversidad están relacionados con sectores principalmente de bosque, aunque no hay un patrón claro (Tabla 2). En términos de especies únicas, Ciudad Perdida tuvo el mayor número (19), seguida por Alfredo fincas (7), y los demás sitios tuvieron menos de 3. 35 Tabla 1. Número de especies observadas para cada sector en los transectos y número de especies esperadas en cada sector según cinco diferentes índices de riqueza. Se presenta el porcentaje promedio para el total de los censos en cada sector (No. especies observados/No. de especies esperadas). Sector Alfredo Fincas Wiwa Fincas Adán Bosque Mumake bosque El Paraíso Wiwa Bosque Filo Puente Ciudad Perdida Especies observados 97 71 95 63 85 93 93 85 ACE 106.9 78.4 104.4 70.1 101.7 112.0 100.9 99.2 Riqueza de especies esperada ICE Chao 1 Chao 2 Mmeans 121.1 104.0 124.7 114.0 86.3 80.0 84.2 92.0 113.4 102.0 108.0 112.9 83.6 70.8 78.2 86.0 109.3 100.5 98.7 105.4 117.9 126.0 151.2 104.4 113.6 100.0 103.6 115.0 118.3 100.8 113.8 101.0 Integridad 85.4% 84.6% 88.0% 81.6% 82.5% 77.3% 87.5% 80.1% Figura 3. Riqueza de especies esperada con intervalos de confianza de 95% en cada sector estudiado en la cuenca del río Buritaca. Los sectores están ordenados desde los más intervenidos a la izquierda a los más conservados a la derecha. 200 No. de especies esperadas 180 160 140 120 100 80 60 40 20 0 Alfredo Fincas Wiwa Fincas Adan Mumake El Paraiso Wiwa Bosque Bosque Bosque Filo Puente Ciudad Perdida 36 Tabla 2: Índices de diversidad de aves por sector en la cuenca del río Buritaca. Los sectores están ordenados desde los más intervenidos arriba a los más conservados abajo. Sector Alfredo Fincas Wiwa Fincas Adán Bosque Mumake bosque El Paraíso Wiwa bosque Filo Puente Ciudad Perdida Shannon-Weaver 3.92 3.71 4.10 3.55 3.80 3.90 3.95 3.60 Simpson 30.32 26.28 46.23 23.46 33.77 38.32 38.63 23.78 Especies endémicas y amenazadas Las siguientes especies, seis endémicas y dos amenazadas (no endémicas), fueron registradas durante los censos en la cuenca del río Buritaca. Debido a su importancia para la conservación de la biodiversidad nacional e global, presentamos a cada una a continuación. Grallaria bangsi - Varios individuos fueron escuchados durante la exploración en la parte alta de Ciudad Perdida por encima de los 1.400 msnm. Es común escucharla en otras zonas de la SNSM entre los 1.800 y 2.500 msnm en bosques montanos. Esta especie se encuentra amenazada de extinción (Vulnerable) debido a su rango restringido a la SNSM y a la pérdida de su hábitat. Scytalopus sanctaemartae - Se encuentra en la cuenca desde los 800 msnm. Es una especie común localmente, especialmente en Ciudad Perdida donde es muy frecuente oírla vocalizando. Es difícil de observar por sus hábitos y coloración no conspicuos. Esta especie está asociada a los bosques pre-montanos entre los 800 y 1.600 m. Es endémica a la SNSM. Automolus rufipectus - Fue registrada en pocas ocasiones durante el tiempo de muestreo, siempre por encima de los 800 metros. Es difícil de observar, ya que se mueve en la vegetación densa en niveles bajos del bosque. La mejor forma para encontrarla es mediante sus vocalizaciones. Esta especie está asociada a los bosques pre-montanos entre los 800 y 1.600 m. Es endémica a la SNSM. Basileuterus conspicillatus - Es la especie endémica más común y fácil de encontrar en el camino. Se le encuentra por encima de los 600 metros en el bosque arriba del alojamiento de los Wiwas y en la sección del camino entre Tezhumake y Ciudad Perdida. Se encuentra amenazada de extinción (casi amenazada) debido a su rango restringido y a la pérdida de su hábitat. Esta especie está asociada a los bosques pre-montanos entre los 800 y 1.600 m. Es endémica a la SNSM. 37 Arremon basilicus - Es una especie común en bosques húmedos por encima de los 1.000 msnm, por lo tanto fue registrada únicamente en Ciudad Perdida y sus alrededores. Se encuentra usualmente en el sotobosque, moviéndose en parejas cerca al suelo, entre los 1.000 msnm y los 2.000 msnm. Es endémica a la SNSM. Atlapetes melanocephalus - Fue registrado en varias ocasiones cerca a las terrazas y los caminos principales de Ciudad Perdida. Prefieren zonas levemente intervenidas donde se mueven generalmente a nivel bajos del bosque en parejas ruidosas. Se encuentra entre los 1.000 m y 2.000 m en bosques y hábitats más abiertos. Es endémica a la SNSM. Aburria aburri - Esta especie de la familia Cracidae se encuentra casi amenazada por la destrucción de su hábitat y la cacería. Es de tamaño grande, apetecida por cazadores. En el camino es común escuchar sus vocalizaciones en la distancia, pero es muy raro obsérvala. Se escucha desde los remanentes de bosque, desde donde Adán continuando por todo el camino hasta Ciudad Perdida. Su rango global incluye a la SNSM y las tres cordilleras de los Andes en Colombia, y los Andes de Venezuela, Ecuador y Perú. Ara militaris - Especie de guacamaya amenazada de extinción (Vulnerable) debido a la cacería para tráfico de mascotas y la pérdida de su hábitat, resultando en la reducción preocupante de sus poblaciones. Es poco común en el camino, se escucha o se ve pasando sobre la cuenca del Buritaca temprano en las mañanas o al atardecer. El uso de la a cuenca por parte de esta especie no es claro, no se sabe si en realidad sólo pasan, o utilizan alguno de los recursos que se encuentran en la zona. Su uso de la cuenca puede variar con la época del año (Strewe & Navarro 2004). Especies de interés para el turismo Se escogieron 11 especies de aves para incluir en una guía de fauna que será utilizada por los guías y visitantes del camino para identificación y referencia. Las especies fueron escogidas por ser de interés para los visitantes, ya sea por belleza, endemismo, vocalizaciones y/o comportamientos particulares entre otras características. Todas son especies relativamente fáciles observar. Aguililla tijereta Cotorra frentirroja Amazilia colirrufa Tucán caribeño Barranquero-Barranquillero Saltarín barbiblanco– Pistolero Oropéndola crestada –Mochilero Arañero embridado Toche pico de plata– Sangre de toro Tangara cabecirrufa – Verdon Pinzón alidorado (Elanoides forficatus) (Aratinga wagleri) (Amazilia tzacatl) (Ramphastos sulphuratus) (Momotus subrufescens) (Manacus manacus) (Psarocolius decumanus) (Basileuterus conspicillatus) (Ramphocelus dimidiatus) (Tangara gyrola) (Arremon schlegeli) 38 Especies indicadoras Escogimos seis especies o grupos de especies con propiedades adecuadas para ser especies/grupos indicadores de la salud ambiental de la cuenca del río Buritaca (Tabla 3). Los patrones de distribución en la cuenca de algunas de estas especies se ven claramente relacionados con el grado de conservación/intervención en cada sector de estudio. Por ejemplo, el semillero, Sporophila nigricollis y el colibrí, Amazilia tzacatl, son abundantes en sectores de cultivos y potreros pero no en sectores de bosques, por lo tanto un aumento en sus poblaciones puede reflejar un aumento en el nivel del degradación de los bosques en la cuenca (Fig. 4). Por el contrario, las abundancias del tucán, Ramphastos sulfuratus, y de la tángara, Eucometis pencillata, aparecen aumentar con el grado de conservación de los bosques en cada sector, por lo tanto un aumento en sus poblaciones puede indicar una mejoría en el estado de conservación de los bosques (Fig. 4). Además de estas cuatro especies, escogimos todas las especies de Cracidae (paujiles y pavos) por su relación con la presión de cacería, y todas las especies endémicas, menos Atlapetes melanocephalus y Grallaria bangsi, por ser especies sensibles que requieren bosques conservados arriba de ≈800 m. Tabla 3. Especies indicadoras seleccionadas para monitorear la salud ambiental de la cuenca del río Buritaca. Especies Tipo de indicador Aumento en su población = Sporophila nigricollis Amazilia tzacatl Ramphastos sulfuratus Eucometis penicillata Especies endémicas Cracidae - paujiles y pavos Negativa Negativa Positiva Positiva Positiva Positiva ↑ fragmentación/degradación de bosques ↑ fragmentación/degradación de bosques ↑ conservación de bosques ↑ conservación de bosques ↑ conservación de bosques arriba de 600 m ↓ presión de casería 39 Figura 4. Abundancia de especies indicadoras con relación al estado de conservación/intervención en cada sector de estudio. Abundancias corregidas por el esfuerzo de muestreo en cada sector. Sporophila nigricollis Amazilia tzacatl 40 35 30 25 20 15 10 5 0 25 20 15 10 5 0 Ramphastos sulfuratus Eucometis penicillata 12 20 18 16 14 12 10 8 6 4 2 0 10 ©Hernan Arias 8 6 4 2 0 Disminuye el nivel de intervención Eucometis penicillata ©Nick Bayly Ramphastos sulfuratus ©Hernan Arias Amazilia tzacatl ©Hernan Arias 40 Discusión Durante aproximadamente 50 días de muestreo entre junio y agosto 2012, registramos 213 especies de aves en la cuenca del río Buritaca. Se realizaron censos a alturas entre 200 m y 1.700 m, con la mayoría del esfuerzo entre los 400 m y los 1.200 m. Mientras que nuestro total de especies sólo representa un poco más de un tercio de las especies registradas para la SNSM y sus alrededores, era lo esperado, debido al rango de alturas muestreadas, al hecho que todos los censos ocurrieron fuera de los meses en que las aves migratorias Neotropicales están presentes en Colombia, a la falta de hábitats acuáticos en la zona de estudio, y al número de días de muestreo. De hecho, comparando nuestros resultados con otros estudios más extensivos en otros lugares en la SNSM, nuestro total de especies es comparable con las 284 especies registradas entre 650 m y 4.200 m en la cuenca del río Frío (Strewe & Navarro 2004b) y las 253 especies registradas en el filo de San Lorenzo entre 850 m y 1.700 m (Bayly & Gómez 2012). Sin embargo, en el valle de San Salvador, Strewe y Navarro (2003) registraron 384 especies entre 0 m y 2.400 m. Este total asombroso incluye varias especies acuáticas y 59 especies de aves migratorias, y sugiere que es posible encontrar muchas más especies en la cuenca del río Buritaca con un mayor esfuerzo de muestreo. Se espera que al menos 40 especies de aves migratorias Neotropicales ocurran en la cuenca, las cuales aumentarían el total de especies a 253, y es esencial realizar censos de ellas entre los meses de septiembre y mayo para evaluar adecuadamente la avifauna en el camino a Ciudad Perdida. Adicionalmente, censos a mayores alturas (>1.800 m) son críticos para entender la comunidad de aves en la región y evaluar el estatus de varias especies endémicas y amenazadas que sólo se encuentran en bosques de montaña (ej. el Periquito de Santa Marta – En peligro). Muestreos entre los 1.800 m y los 2.500 m, probablemente adicionarían entre 20 y 30 especies más. La estimación de la integridad de los muestreos en este estudio sugiere que registramos alrededor de 84% de las especies presentes en cada sector. Tomando en cuenta la falta de especies migratorias en nuestro total, el límite superior de altura de los censos (1.700 m) y la falta de detección de alrededor del 16% de las especies en cada sector, esperamos un final total de alrededor de 310 especies aves para la cuenca del río Buritaca. Riqueza y diversidad de especies entre sectores de estudio No encontramos diferencias significativas en la riqueza de especies entre los diferentes sectores de estudio a lo largo del camino hacia Ciudad Perdida, a pesar de que existen 41 fuertes diferencias entre los hábitats presentes, el grado de degradación y la altura entre ellos (Fig. 1, Tabla 1). La mayor riqueza de especies se encuentra en el sector Wiwa Bosque, una de las áreas de bosque más conservadas. Sin embargo, también encontramos una alta riqueza en los sectores con grandes extensiones de tierras cultivadas. Estos sectores son un mosaico de hábitats abiertos y bosques, y por lo tanto sustentan especies que utilizan ambos hábitats, mientras que en los sectores boscosos sólo ocurren especies asociadas a bosques. Al igual que la riqueza de especies, la diversidad de especies tampoco mostró un patrón claro en relación al grado de transformación de los hábitats entre sectores. Especies endémicas y amenazadas A pesar que sólo muestreamos una parte limitada del gradiente altitudinal presente en la cuenca, y las especies endémicas tienden a ocurrir a alturas mayores a 1.800 m en la SNSM, registramos seis diferentes especies de aves endémicas. Dentro ellas, una está clasificada como vulnerable por la IUCN y dos están consideradas como casi amenazadas (Birdlife International 2012). Las diferentes especies endémicas registradas se encuentran con mayor frecuencia en los bosques premontanos, menos Grallaria bangsi, y mientras que su estatus de conservación la considera como menos preocupante en relación a las especies de bosque montano, la conversión de grandes extensiones de bosque premontano a cafetales puede significar que su hábitat se encuentra bajo una mayor presión que el de las especies de mayores alturas. Por lo tanto, los bosques entre 800 m y 1.700 m en la cuenca del río Buritaca tienen un papel importante en el mantenimiento de las poblaciones de estas especies. Garantizar su protección en el largo plazo en el Parque Nacional Natural SNSM y el Parque Arqueológico Teyuna-Ciudad Perdida es un paso importante para la conservación de estas especies únicas a la SNSM. Además de las especies endémicas, la cuenca mantiene poblaciones importantes de la pava casi-amenazada, Aburria aburri, especie extinta en muchas partes de su rango, como resultado de la destrucción de su hábitat y una alta presión de casería. Es probable que las pendientes fuertes e inaccesibles en la SNSM representen un refugio importante para esta especie. El Paujil de pico azul (Crax alberti) es una especie críticamente amenazada, endémica a Colombia que se encuentra en el piedemonte de la SNSM (<1.200m). Aunque no fue registrado durante este estudio, ha sido avistado en la cuenca del río Buritaca (David Mendoza com pers., Strewe et al. 2010). Esta especie es altamente sensible a la cacería y se ha vuelto tan rara que su población mundial está estimada a menos de 1.000 individuos (Birdlife International 2012). Aunque no tengamos evidencia de su presencia actual en la cuenca, creemos que todavía puede haber una población en las zonas más inaccesibles de la cuenca. Consideramos esencial que sean realizados muestreos adicionales para esta especie. 42 También recomendamos que las comunidades locales consideren parar la casería de esta especie, al menos hasta que sus poblaciones se recuperan. Especies indicadoras Identificamos seis potenciales especies o grupos de especies indicadoras, cuyas poblaciones probablemente reflejan la salud de los ecosistemas en la cuenca del río Buritaca. Estas especies forman un grupo coherente que reflejan las diferentes presiones que actúan sobre los hábitats naturales de la cuenca, sin embargo, información de línea base sobre cómo sus poblaciones responden a las diferentes presiones, como la fragmentación de los bosques, es necesaria. Dentro estas especies, el Tucán Caribeño (Ramphastos sulfuratus) y el Güiche hormiguero (Eucometis pencillata) están principalmente asociadas a bosques. Un aumento en sus poblaciones puede ser considerado como una señal de mejoramiento en la cobertura de bosque y su estado de conservación. Por el contrario, las poblaciones del semillero Sporophila nigricollis y el colibrí Amazilia tzacatl deberían aumentar con la conversión de bosques a tierras cultivadas y por lo tanto reflejan un aumento en la destrucción y degradación de los bosques. Los crácidos son especies de tamaño grande, populares entre los cazadores, y cambios en sus poblaciones pueden reflejar la presión de casería en la cuenca. La mayoría de las especies seleccionadas como indicadoras son fáciles observar e identificar, y pueden ser monitoreadas en el largo plazo por algunos individuos entrenados usando metodologías como la de transectos en varios puntos a lo largo del camino a Ciudad Perdida. Especies de interés para el turismo El aviturismo es un sector creciente en el turismo internacional y nacional. Por ejemplo, en el Reino Unido, la ONG de conservación de aves RSPB, tiene más que un millón de miembros. En los Estados Unidos, se estima que actividades y productos asociados a la observación de las aves generan 36 billones de dólares al año. Colombia, se está convirtiendo en un destino popular para los observadores de aves, dada la increíble riqueza de especies que se encuentra en el país. Dentro de los lugares visitados en Colombia, la SNSM es uno de los más populares por tener el mayor número de especies endémicas continentales en el mundo. Por lo tanto, existe un gran potencial para desarrollar el aviturismo en la cuenca del río Buritaca. Ciudad Perdida en particular, es un lugar excelente para el avistamiento de varias especies endémicas. Para el turista típico, hay una gran variedad de especies coloridas y atractivas que se ven relativamente fácil y podrían ser buscadas durante tours de fauna. Para grupos de observadores de aves especialistas, son necesarios guías con alta experiencia que pueden identificar el 95% de las especies encontradas y un entrenamiento intensivo es requerido para generar guías locales. Para 43 tours generales de fauna, es necesaria menos experiencia, sin embargo, más entrenamiento y experiencia son esenciales para promover de forma eficiente el turismo en la zona. Direcciones futuras Teniendo en cuenta las limitaciones de tiempo para realizar este estudio y la época del año de los muestreos, no esperábamos generar una caracterización definitiva de la avifauna de la región. Sin embargo, registramos la mayoría de las especies esperadas para la región, incluyendo especies endémicas claves. Para llenar los vacios de información, queremos enfatizar la necesidad de evaluar la comunidad de aves migratorias en la cuenca, y más importante todavía, llevar a cabo muestreos para especies endémicas y amenazadas por encima de los 1.800 m, incluyendo al páramo. Dado que la cuenca del río Buritaca tiene uno de los bloques más extensivos de bosque de tierras bajas en la SNSM, también consideramos fundamental la realización de búsquedas adicionales para el críticamente amenazado Paujil de pico azul (Crax alberti). 44 B i blio g ra fi a Bayly, N.J. & Gómez, C. 2012. Las aves de Finca La Victoria, Sierra Nevada de Santa Marta. SELVA: Investigación para la conservación en el Neotropico, Bogotá. Informe técnico No. CEC01 Edición 3. Bayly, N.J., Gómez, C., Gonzalez, A.M., Hobson, K.A. & Rosenberg, K.V. 2012. Fall migration of the Veery (Catharus fuscescens) in northern Colombia: determining the energetic importance of a stopover site. The Auk 219: 449-459. Bayly, N.J., Gómez, C. & Hobson, K.A. (en prensa). Preparing to cross the Caribbean sea – the spring stopover of the Gray-cheeked Thrush Catharus minimus in northern Colombia. Ibis. BirdLife International 2012. Aburria aburri. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 25 September 2012. BirdLife International 2012. Automolus rufipectus. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 25 September 2012. BirdLife International 2012. Basileuterus conspicillatus. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 25/09/2012. BirdLife International 2012. Crax alberti. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 25 September 2012. ©Hernan Arias BirdLife International 2012. Grallaria bangsi. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Downloaded on 25 September 2012. Colwell, R. K. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8.2. User's Guide and application. http://purl.oclc.org/estimates. Hilty, S.L. & Brown, W.L. 1986. The guide to the birds of Colombia. Princeton University Press. PROSIERRA. 1998. Evaluación Ecológica Rápida de la Sierra Nevada de Santa Marta. Definición de Áreas Críticas Para La Conservación en la Sierra Nevada de Santa Marta. Fundación Pro-Sierra Nevada. Santa Marta. Ministerio del Medio Ambiente. UAESPNN. The Nature Conservancy, USAID, Embajada de Japón. Ralph, C.J., Geupel, G.R., Pyle, P., Martin, T.E. & DeSante, D.F. 1993. Handbook of field methods for monitoring landbirds. Albany, C.A:U.S. Department of Agriculture, Forest Service, Pacific Southwest Research Station. Gen. Tech. Rep. PSW-GTR-144. 41 p. Renjifo, L. M., Franco-Maya, A. M., Amaya-Espinel, J. D., Kattan, G. H. & López-Lanús, B. 2002. Libro rojo de aves de Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt y Ministerio del Medio Ambiente, Bogotá, Colombia. 45 Restall, R., Rodner, C. & Lentino, M. 2006. Birds of northern South America. Christopher Helm, London. Strewe, R. & Navarro, C. 2003. New distributional records and conservation importance of the San Salvador valley, Sierra Nevada de Santa Marta, northern Colombia. Ornitologia Colombiana 1: 29-41. Strewe, R. & Navarro, C. 2004a. New and noteworthy records of birds from the Sierra Nevada de Santa Marta region. Bulletin B.O.C. 124: 38-51. Strewe, R. & Navarro, C. 2004b. The threatened birds of the río Frío Valley, Sierra Nevada de Santa Marta, Colombia. Cotinga 22: 47-55. Strewe, R., Lobaton, G. & Villa-de León, C. 2010. Evaluación del estado poblacional de Crax Alberti en la Sierra Nevada de Santa Marta, departamento del Magdalena, Colombia. Boletín del grupo de especialistas en cracidos 30: 5-16. ©Nick Bayly Trogon personatus – Trogón enmascarado 46 LOS MAMÍFEROS TERRESTRES DE LA CUENCA DEL RÍO BURITACA, SIERRA NEVADA DE SANTA MARTA, COLOMBIA Jaime Andrés Cabrera, PhD Panthera Colombia Email: jaime_andresc@yahoo.com Res um en Entre los meses de Junio y Agosto de 2012 instalamos cámaras trampa a lo largo de la cuenca del río Buritaca en la Sierra Nevada de Santa Marta. El objetivo era determinar las especies de mamíferos terrestres presentes a lo largo del camino utilizado para el turismo que ingresa al Parque Arqueológico Teyuna-Ciudad Perdida. Logramos registrar la presencia de 17 especies de mamíferos entre las que se incluyen el Jaguar (Panthera onca) y el Puma (Puma concolor). Nuestros resultados indican que la cuenca aun mantiene un número considerable de mamíferos, por lo cual es importante tener en cuenta un plan de manejo dentro de las estrategias turísticas de la región. Identificamos cinco especies que pueden ser monitoreadas en el largo plazo con cámaras trampa y con la participación de las comunidades locales, para determinar la salud de los hábitats y la biodiversidad presente en la cuenca. Un manejo de la cacería que tenga en cuenta el estado y distribución de mamíferos a lo larga de la cuenca, puede resultar en un aumento de las poblaciones de los mamíferos presentes y también favorecer el eco-turismo a la medida en que los animales se vuelvan menos tímidos con la presencia de humanos. 47 Introducción La Sierra Nevada de Santa Marta (SNSM) cuenta con un listado extenso de especies potencialmente presentes que incluye varias endémicas o por lo menos de distribución bastante restringida. Esta alta diversidad es el resultado de una compleja historia geológica que ha permitido el asentamiento y posterior proceso de especiación de cientos de diferentes especies animales y vegetales en una gran cantidad de diferentes pisos térmicos y asociaciones vegetales (Tschanz et al. 1974) Estas mismas características han convertido a la SNSM en lugar a propósito para asentamientos humanos. Desde las épocas precolombinas la SNSM sostenía considerables números de humanos (Reichel-Dolmatoff 1982), sin embargo es tan solo hasta finales del siglo XIX, que la degradación de los suelos y hábitats naturales ha tomado dimensiones alarmantes. Al respecto, Aide y Cavelier (1994) determinaron que más alarmante que las transformaciones en sí, es el hecho de que estos ecosistemas no puedan regenerarse naturalmente, debido a que los cambios han sido tan profundos que las dinámicas de regeneración natural se han visto interrumpidas de manera permanente. Otra razón para que los procesos de regeneración natural en la SNSM no se den, es el cambio en la comunidad de mamíferos de tamaño mediano y grande. Estos mamíferos por lo general están situados en altos niveles tróficos y sus poblaciones disminuyen rápidamente bajo la influencia de la actividad humana (Fragoso 1999, Tobler et al. 2010). Estas mismas especies también se ven frecuentemente ligadas con eventos de colapso de poblaciones en cascada (Fragoso 2003, ReynaHurtado et al. 2008, Tejeda-Cruz et al. 2009) y son reconocidos como ecológicamente influyentes por sus papeles como ingenieros del paisaje, grandes ramoneadores y dispersores de semillas (Keuroghlian & Eaton 2009, O'Brien 2010b, Stoner et al. 2007, Tobler et al. 2010) y por ello de especial importancia para el mantenimiento del bosque. Son pocos los listados de mamíferos Colombianos que incluyen distribuciones geográficas detalladas de cada especie y aun más escasos los trabajos realizados en la SNSM o en la cuenca del río Buritaca. Utilizando la información existente (Alberico et al. 2000, Emmons 1999, Rodriguez et al. 1995, Rodriguez-Mahecha et al. 2006), determinamos que en la cuenca potencialmente existen 19 especies de mamíferos terrestres por encima de los 500 gramos de peso que serían las especies que consistentemente pueden ser detectadas usando cámaras trampa. Con este trabajo realizamos un primer acercamiento a la composición de especies de mamíferos medianos y grandes de la zona, como insumo para los planes de conservación y manejo que allí se adelantan, así como elemento para ser utilizado en las iniciativas eco-turísticas actuales que vienen adelantando los habitantes campesinos e indígenas de la zona. 48 Metodología Área de estudio La SNSM es la más alta formación rocosa costera del mundo, alcanzando 5800 metros de altura sobre el nivel del mar en su pico más alto (Aide & Cavelier 1994). Según Cleef et al. (1984) la vegetación de la SNSM se puede zonificar a grandes rasgos siguiendo un gradiente altitudinal que empieza con bosques secos espinosos desde el nivel del mar hasta los 200 m. Siguen los bosques secos semi-deciduos o húmedos entre los 200 y 1200 m, dependiendo la zona. De los 1200 a los 2500 metros se pueden encontrar bosques montanos bajos que son reemplazados por bosques montanos altos de los 2500 hasta los 3200 metros. Este inventario se llevo a cabo a lo largo de la cuenca del río Buritaca (11º08’18” N, 73º51’45”O). Esta cuenca es la principal vía de acceso para el turismo que visita el sitio arqueológico de TeyunaCiudad Perdida, y presenta altos niveles de intervención humana por debajo de los 800 metros. Los muestreos se realizaron desde la población de Machete Pelao (164 m) hasta el sitio arqueológico de Teyuna-Ciudad Perdida (1200 m). Esta área se dividió en 7 diferentes zonas, de las cuales escogimos cuatro para llevar a cabo nuestro muestreo (Fig. 1). Cada una de las zonas de muestreo difiere en sus características ecológicas y en el nivel de presión antrópica de que son objeto. La primera zona fue alrededor de la cabaña de Adán e incluye grandes extensiones de cultivos, como cafetales con sombra, y potreros, con algunos fragmentos de bosques secundarios y bosques en un mejor estado de conservación arriba de los 1000 m. La segunda zona es el área que denominamos “Wiwa” que incluye 5 km del camino turístico desde aproximadamente los 440 m hasta los 600 m de altitud. Esta es un área de transición hacia los bosques húmedos mejor conservados que se encuentran por encima de los 800 m y en su mayoría está conformada por bosques secundarios mezclados con potreros y cultivos. La tercera zona fue “Tezhumake”, que incluye 6.4 km del camino turístico y comparativamente con Wiwa, presenta una menor escala de intervención antrópica que consiste principalmente en pequeños claros creados para mantener ganado, mulas y sembrar alimentos. Por último muestreamos el área de “Ciudad Perdida”, ubicada a partir de los 800 m y donde la intervención humana es casi nula, resultando en la presencia de bosques húmedos y montanos maduros o en recuperación. 49 Figura 1: Área de estudio en la cuenca del río Buritaca y las zonas en cuales fueron instaladas cámaras trampa (sectores en verde). Machete Pelao Adan Wiwa Tezhumake El Paraíso 7 9 8 6 3 5 2 1 4 Río Buritaca 10 Ciudad Perdida 1. Machete Pelao 2. Filo vista mar 3. Adan Bosque 4. Alfredo Fincas 5. Wiwa Bosque 6. Wiwa fincas 7. Mumake bosque 8. Filo puente 9. El Paraíso 10. Ciudad Perdida Fototrampeo Con el fin de hacer un inventario de los mamíferos medianos y grandes presentes en la cuenca del Buritaca, entre el 1 de junio y el 17 de agosto de 2012 instalamos 8 trampas cámara marca Bushnell Trophy Cam XLT en cada una de las zonas de muestreo. Además, en la zona Adán instalamos dos Cuddleback capture cámaras durante 60 días a lo largo de un camino secundario, pero desafortunadamente las cámaras fallaron. En Wiwa instalamos 4 cámaras en dos caminos secundarios completando 97 días-cámara. En Tezhumake instalamos 6 cámaras repartidas en dos caminos, completando 174 días-cámara. Por último, en Ciudad Perdida instalamos 6 cámaras en tres caminos, completando 105 días-cámara (Tabla 1). Las cámaras se colocaron en caminos abiertos, generalmente secundarios, que son solamente utilizados por la población local. Cada cámara estuvo alejada de la estación más cercana por lo menos 1 km. Los lugares específicos de instalación para cada cámara fueron escogidos basados en la presencia de señales de actividad animal en cada lugar específico. Cada estación consistió en una cámara colocada en el tronco de un árbol a 30 cm del suelo mirando hacia el camino. Las cámaras estuvieron activas durante las 24 horas del día con un tiempo de espera entre fotos de 5 minutos y la sensibilidad del sensor de movimiento en “alto”. Las cámaras fueron programadas para tomar tres fotos cada vez que detectaran movimiento. 50 Tabla 1: Ubicación y días de funcionamiento de cada una de las estaciones de fototrampeo a lo largo del río Buritaca entre Junio y Agosto de 2012 (no incluye cámaras instaladas en la zona de Adán). Ubicación Latitud Longitud Cámara Zona Wiwa W1 W2 W3 W4 Días funcionamiento 11.11648 11.11911 11.11855 11.103056 73.87239 73.87052 73.86504 73.86444 Total 28 28 28 13 97 Zona Tezhumake FP1 FP2 FP3 FA1 FA2 FA3 11.09544 11.09971 11.10326 11.07329 11.06569 11.05506 73.89581 73.90019 73.9034 73.90897 73.9093 73.91588 Total 29 29 29 29 29 29 174 Zona Ciudad Perdida CPA1 CPA2 CP1 CP2 CP3 11.03502 11.03008 11.035 11.04354 11.04056 73.92544 73.92432 73.925556 73.91939 73.92164 Total 3 3 33 33 33 105 Análisis de datos ■ Construcción base de datos A partir de las fotos obtenidas en campo, construimos una base de datos de los animales existentes en cada una de las zonas de muestreo. Aunque una gran variedad de animales son potencialmente registrados por medio de las cámaras, solamente especies por encima de 500 g de peso fueron incluidas en este listado, ya que son estas especies las que de manera consistente disparan las cámaras (O'Brien 2010a, Payan 2009). Para construir la base de datos consideramos como eventos independientes, aquellas fotos consecutivas que mostraban diferentes especies o con diferentes individuos de la misma especie. También consideramos como eventos independientes cualquier fotografía con por lo menos 30 minutos de diferencia con el evento anterior, no importando si las dos fotos mostraban individuos no reconocibles de la misma especie (Cabrera 2012, O'Brien et al. 2003). ■ Integridad del muestreo Para evaluar que tan completo fue el muestreo (integridad), construimos curvas de acumulación de especies para cada una de las zonas (Colwell & Coddington 1994). Estas curvas grafican el número 51 de especies detectado en relación con el esfuerzo de muestreo. Usualmente el número de especies aumenta a medida que aumenta el esfuerzo, llegando a una asintota cuando la totalidad de las especies presentes han sido registradas. Generalmente este punto de inflexión es difícil de alcanzar directamente con los datos obtenidos en campo, sobre todo en sistemas tan diversos como la SNSM donde el esfuerzo de muestreo seria necesariamente bastante grande. Utilizamos el programa EstimateS 8.0.2 (Colwell 2009) para calcular diferentes estimadores de la riqueza total de especies en cada zona de muestreo, determinar cuál es el mejor estimador posible de este atributo a partir de los datos obtenidos y obtener así un estimado de la riqueza total de especies en cada una de las zonas de muestreo (Colwell et al. 2004, Mao & Colwell 2005). También calculamos el índice Jaccard de similaridad entre las tres diferentes zonas de muestreo, corregido por el estimado Chao1 de riqueza (Chao et al. 2005). Este índice corrige los posibles sesgos debidos a un muestreo incompleto y permite una aproximación a la diversidad β de la cuenca. ■ Biodiversidad y ocurrencia Además de las riquezas totales estimadas para cada una de las zonas de muestreo, también utilizamos el programa EstimateS 8.0.2 (Colwell 2009) para calcular índices de diversidad como herramienta adicional para la comparación de las zonas de muestreo (Magurran 2004). Por último, creamos una historia de capturas/fotos para cada una de las especies registradas en cada una de las zonas de muestreo, agrupando los resultados de cada 5 días consecutivos como un único evento de muestreo (Kery et al. 2010, O’Connell & Bailey 2011). Con esta información y utilizando el programa PRESENCE 3.1 (http://www.mbr-pwrc.usgs.gov/software/presence.html) calculamos el porcentaje de ocurrencia de cada una de las especies en cada una de las zonas de muestreo y para el total de la cuenca del Buritaca. Utilizamos el AIC como herramienta para determinar cual modelo de los ofrecidos por el programa estimaba mejor la ocurrencia en cada una de las zonas (Mackenzie et al. 2006). Ejemplo de una foto tomada por las cámaras trampa – Leopardus wiedii (Oncilla) 52 Resultados Base de datos y frecuencia de eventos por especie En total registramos 17 especies de mamíferos, dos de las cuales fueron pequeños roedores imposibles de identificar a partir de las fotografías. Además registramos otras dos especies, el mono aullador (Alouatta seniculus) y el mono de noche (conocido localmente como cuchi cuchi; Potos flavus), gracias a sus vocalizaciones y/o observación directa. Basado en el número de fotografías por 1000 días cámara para cada una de las especies detectadas, Tezhumake mostró el mayor número de fotos independientes y el mayor número de especies (Tabla 2). Carnívoros como el puma (P. concolor), ocelote (L. pardalis) y taira (E. barbara) fueron las especies más fotografiadas, seguidas por sainos (P. tajacu), armadillos (D. novemcinctus) y marranos domésticos asilvestrados (Tabla 2). Tabla 2: Especies de mamíferos registradas en la cuenca del río Buritaca por las cámaras trampa. Los datos muestran el número total de fotos obtenidas para cada especie en cada una de las zonas de muestreo, el número de fotos por 1000 días cámara y el número total de especies por zona. Especie Cuniculus paca Dassypus novemcinctus Dasyprocta punctata Didelphis marsupialis Eira barbara Leopardus pardalis Leopardus sp. Leopardus wiedii Panthera onca Pecari tajacu Procyon cancrivorous Puma concolor roedor 1 roedor 2 Sciurus granatensis Sus scrofa Tamandua tetradactyla No. de especies No. fotos 3 1 3 1 1 4 1 4 1 2 10 Wiwa Fotos/1000 días 30.93 10.31 30.93 10.31 10.31 41.24 10.31 41.24 10.31 20.62 No. fotos 5 25 9 6 5 1 1 4 1 2 1 4 1 13 Tezhumake Fotos/1000 días 28.74 143.68 51.72 34.48 28.74 5.75 5.75 22.99 5.75 11.49 5.75 22.99 5.75 Ciudad Perdida No. fotos Fotos/1000 días 3 28.57 1 9.52 2 19.05 2 19.05 1 9.52 1 9.52 1 9.52 3 28.57 1 9.52 3 28.57 10 53 Figura 1: Curvas de acumulación de especies basadas en el cálculo y re-muestreo de diferentes estimadores de la riqueza de especies para cada una de las zonas de muestreo. De los estimadores calculados, solamente ACE muestra una tendencia a estabilizarse en los diferentes sitios de muestreo. Riqueza de especies vs. días de muestreo con la riqueza estimada por medio de a. Mau Tao, b. Chao1, c. Chao2, d. Jacknife1, e.ACE. 54 Integridad del muestreo Basado en los resultados de los diferentes estimadores de integridad del muestreo, no se registraron todas las especies que potencialmente están presentes en las zonas de estudio y que podrían haber sido detectadas con las cámaras. Los modelos estiman una riqueza de 19 especies, mientras que registramos solo 13 especies (68%). Tezhumake fue el lugar donde el muestreo se acerco mas a registrar todas las especies presentes (Fig. 2a). El modelo que mejor estimó la cantidad de especies presente para cada una de las zonas de muestreo fue el ACE/Estimador de cobertura por abundancia (Chao et al. 2009; Colwell 2009). Los demás modelos no mostraron ninguna tendencia a estabilizarse y por ello no fueron considerados dentro de los resultados (Fig. 2). Comparando los valores obtenidos de ACE, determinamos que no existieron diferencias significativas entre las tres diferentes zonas de muestreo pero si había una tendencia en la que Ciudad Perdida presenta una mayor riqueza de especies (S(ACE) = 16,4; ES = 1,5), seguida por Tezhumake (S(ACE) = 13,7; ES = 6,3) y Wiwa (S(ACE)=13,4; ES = 1,78). El índice de similaridad de Jaccard basado en el estimado Chao1 muestra que la composición de mamíferos en la zona Wiwa es más similar a Tezhumake (Jaccard = 0,88 (0,17), 7 especies en común) que a Ciudad Perdida (Jaccard = 0,57 (0,2); 5 especies en común). Biodiversidad y ocurrencia La interpolación y modelación de los datos registrados en campo nos permitió calcular los índices de diversidad de Shannon y Simpson. Los dos índices muestran que la zona de Ciudad Perdida es la más diversa, seguida por Wiwa y Tezhumake (Tabla 3). Tabla 3: Resultados de la estimación de los índices de diversidad de las tres diferentes zonas de muestreo, por medio del método de interpolación. Zona de estudio Individuos Shannon Shannon (ES) Simpson Simpson (ES) Wiwa 19.09 2.09 0.07 11.06 1.48 Tezhumake 18.9 1.75 0.23 6.37 2.41 19 2.28 0.03 15.55 0.9 Ciudad Perdida Con excepción del Puma concolor y Cuniculus paca, los modelos de ocurrencia desarrollados para cada una de las especies registradas, no mostraron un efecto importante de la zona de muestreo o del evento del muestreo sobre la presencia de las especies registradas (Tabla 4). El porcentaje del área total de la cuenca ocupada por las especies observadas varía entre el 100 % para Eira barbara y el 16 % para Sus scrofa (Tabla 4). Aunque el modelo que incluyó las diferentes zonas de muestreo como covariable para el cálculo de las ocurrencias no fue el que mejor explicó las diferencias entre cada una de las diferentes especies, utilizamos este modelo para poder calcular las ocurrencias individuales en cada uno de los lugares de muestreo. Así podemos generar una idea de la distribución de cada especie dentro del área de estudio (Tabla 5). 55 Tabla 4: Modelos de ocurrencia evaluados para determinar el efecto de las covariables de la zona de muestreo (zona) y el investigador responsable para el muestreo (muestreo) en la presencia de mamíferos en la cuenca del río Buritaca. El porcentaje de ocurrencia para cada especie fue estimado usando el modelo recibiendo el mayor soporte de los valores AIC. Especie C.paca D. punctata D. novemcinctus P. concolor E. barbara L. pardalis T. tajacu S. scrofa Modelo ψ(zona)p(.) ψ(.)p(.) ψ(zona)p(muestreo) ψ(.)p(.) ψ(zona)p(.) ψ(zona)p(muestreo) ψ(.)p(.) ψ(zona)p(.) ψ(zona)p(muestreo) ψ(zona)p(muestreo) ψ(.)p(.) ψ(zona)p(.) ψ(.)p(.) ψ(zona)p(.) ψ(zona)p(muestreo) ψ(.)p(.) ψ(zona)p(.) ψ(zona)p(muestreo) ψ(.)p(.) ψ(zona)p(.) ψ(zona)p(muestreo) ψ(.)p(.) ψ(zona)p(.) ψ(zona)p(muestreo) AIC 48.76 49.05 54.91 57.82 60.71 63.32 51.31 54.07 60.65 47.78 52.05 53.11 51.66 55.38 58.34 46.78 50.27 51.32 38.59 40.53 42.87 28.45 29.65 31.09 ΔAIC 0 0.29 6.15 0 2.89 5.5 0 2.76 9.34 0 4.27 5.33 0 3.72 6.68 0 3.49 4.54 0 1.94 4.28 0 1.2 2.64 AIC (peso) 0.52 0.42 0.02 0.76 0.18 0.04 0.79 0.19 0.007 0.84 0.09 0.05 0.83 0.13 0.02 0.78 0.13 0.08 0.66 0.25 0.07 0.55 0.3 0.14 Ocurrencia para la cuenca 42% 50% 30% 71% 100% 74% 31% 16% Tabla 5: Ocurrencia de las especies más comunes en cada una de las zonas de muestreo, según el modelo con menor AIC después del modelo nulo que no tuvo en cuenta el efecto de la covariable zona de muestreo. Especies C. paca D. punctata D. novemcinctus P. concolor E. barbara L. pardalis T. tajacu S. scrofa Wiwa X (ES) 0 (0) 0,34 (0,30) 0,51 (0,25) 0,92 (0,35) 1,0 (0) 0,59 (0,54) 0,36 (0,33) 0,25 (0,22) Tezhumake C. Perdida X (ES) X (ES) 0,45 (0,28) 0,84 (0,39) 0,43 (0,26) 0,81 (0,30) 1,17 (0,15) 0,34 (0,27) 0,24 (0,15) 0,40 (0,34) 1,0 (0) 0,66 (0,5) 1,0 (0) 0,67 (0,59) 0,45 (0,30) 0 (0) 0 (0) 0,34 (0,28) Modelo ψ(zona)p(.) ψ(zona)p(.) ψ(zona)p(.) ψ(zona)p(muestreo) ψ(zona)p(.) ψ(zona)p(.) ψ(zona)p(.) ψ(zona)p(.) Significancia n.s n.s n.s n.s n.s n.s n.s n.s 56 Discusión Riqueza de especies y diversidad Son pocos los listados de mamíferos Colombianos que incluyen distribuciones geográficas detalladas de cada especie. Utilizando la información existente (Alberico et al. 2000; Emmons 1999; Rodriguez et al. 1995; Rodriguez-Mahecha et al. 2006), determinamos que en la cuenca del río Buritaca potencialmente existen 19 especies de mamíferos terrestres por encima de los 500 g, que serían las especies que consistentemente pueden ser detectadas con cámaras trampa. De estas 19 especies registramos 13 especies (68%) con las cámaras trampa. Los gráficos de acumulación de especies también indican que son 19 el número total de especies que podríamos haber encontrado en la cuenca. En cualquier muestreo, debido a las restricciones en tiempo y materiales es de esperar este comportamiento, más aun en ambientes tan diversos como la SNSM (Gibbs et al. 2008; Villareal et al. 2004). Teniendo en cuenta estas consideraciones teóricas y prácticas podemos decir que el muestreo fue exitoso en la medida de que provee información suficiente para calcular el número de especies presentes en la zona por métodos analíticos. Los errores estándar calculados para la riqueza de especies esperada en cada zona de estudio son amplios y no permitieron encontrar diferencias significativas entre las tres zonas muestreadas. Sin embargo, los resultados en su conjunto permiten ver las tendencias de cada una de las zonas de muestreo con respecto a la presencia de mamíferos. El estimado ACE de la riqueza total de la cuenca alcanzo las 19 especies esperadas. Entre las tres zonas muestreadas, Ciudad Perdida presentó una clara tendencia a albergar un mayor número de especies en comparación con las otras dos zonas de muestreo, aun cuando el número de fotos y especies registradas no fue el más alto en números absolutos. Después de Ciudad Perdida, la zona de Wiwa tuvo una mayor riqueza en comparación con Tezhumake. Las riquezas totales estimadas para cada una de las zonas y los resultados de sus comparaciones, se ven corroborados por los índices de diversidad calculados (Simpson y Shannon). Su estatus de protección, posición alejada de los asentamientos humanos y conexión a las zonas de bosque mejor conservados en la cuenca, pueden explicar porque la zona de Ciudad Perdida mantiene una mayor riqueza de especies que las otras zonas de estudio. En general la cuenca del río Buritaca muestra una alta riqueza de mamíferos terrestres, que incluye un set importante de grandes carnívoros como el jaguar (Panthera onca), el puma (Puma concolor) y el ocelote (Leopardus pardalis), además de otras especies más raras localmente como Leopardus weidii. La presencia de estas especies, aseguran la existencia de una base nutricional suficiente para mantenerlos, así como una extensión de bosque suficiente con conexiones a cuencas aledañas con características específicas que permiten su presencia. De hecho, registramos presas típicas de estos depredadores como los armadillos, los sainos y las guartinajas. Sin embargo, su permanencia en el tiempo depende de que se tomen las medidas necesarias para su conservación, las cuales incluyen estudios detallados de las dinámicas poblacionales de estas especies, mantenimiento de la cobertura 57 boscosa, y un manejo adecuado de la cacería de las especies de presa, en conjunto con las comunidades locales. Especies indicadoras Franklin (1988) reconoce tres atributos ecosistémicos que deberían ser monitoreados para asegurar la conservación de la biodiversidad de cualquier ecosistema: la composición, estructura y función del ecosistema en cuestión. Usualmente se utilizan especies indicadoras para poder llevar a cabo estos monitoreos de manera eficiente y con un nivel aceptable de incertidumbre. De acuerdo con Noss (1990), idealmente estas especies indicadoras deben cumplir con las siguientes características: Suficientemente sensibles para proveer advertencias tempranas de cambios en el ambiente. Deben estar distribuidas de una manera amplia en la zona de interés. Capaces de proveer una evaluación constante a lo largo de un amplio rango de situaciones. Relativamente independientes del tamaño de la muestra. Fáciles y eficientes desde el punto de vista de los costos para su estudio. Su biología debe ser conocida de manera que se pueda distinguir cuando si los patrones observados se deben a causas antropogénicas. Relevantes desde el punto de vista ecológico. Es difícil encontrar una especie que cumpla todas estas características. Sin embargo, es bueno tenerlas en cuenta a la hora de escoger especies para ser utilizadas para el seguimiento de la biodiversidad y sus tres diferentes atributos. Basados en estas características escogimos para la cuenca del río Buritaca 5 especies de mamíferos que podrían ser utilizadas para el monitoreo de la biodiversidad, al mismo tiempo que presentan un potencial interesante para la educación ambiental y para convertirse en especies bandera de la región. Estas especies son el puma (P. concolor), ocelote (L. pardalis), la guartinaja (C. paca), los sainos (P. tajacu) y los marranos asilvestrados (S. scrofa). Cada una de estas especies cubre alguna parte de los atributos propuestos por Noss y en su conjunto pueden ofrecer una alternativa de monitoreo liderado y ejecutado por la comunidad, utilizando la herramienta de las cámaras trampa. Las dos primeras especies son carnívoros grandes que al parecer son abundantes a lo largo de toda la cuenca. Estas especies pueden ser utilizadas bajo el concepto de especies sombrilla y con ello llevar a cabo un monitoreo indirecto de las especies de niveles tróficos inferiores de las cuales dependen (Murphy et al. 2011). La guartinaja y los sainos son dos de las especies preferidas por los carnívoros y comunidades humanas dentro de sus dietas. Estas dos especies también tienen un efecto importante sobre la composición florística de las áreas donde están presentes (Bonaudo et al. 2005, Keuroghlian & Eaton 2009, Tejeda-Cruz et al. 2009) y al mismo tiempo pueden ser utilizadas para determinar la capacidad de carga de grandes carnívoros en la cuenca. Este grupo de especies indicadoras para la cuenca del Buritaca no estaría completo si no se incluye a los marranos asilvestrados. El monitoreo de estos animales, que parecen estar siendo parte importante de la dieta 58 de los grandes predadores, nos puede dar pistas del grado de intervención a lo largo de la cuenca y al mismo tiempo ser un índice de la transformación que la cuenca sufre. Mamíferos y el turismo El turismo es una de las actividades que ha venido fortaleciéndose en la región como fuente alternativa de subsistencia para las comunidades locales, tanto campesinas como indígenas. Aunque el número de especies registradas por nosotros pasa la decena y gran parte de ellas son bastante carismáticas, es importante recordar que la mayoría de mamíferos son especies nocturnas, crípticas y tímidas, lo cual las hace de difícil observación para los turistas. Una manera de acercar a los turistas al tema de los mamíferos y aprovechar su presencia en la cuenca, son actividades indirectas tales como la búsqueda de huellas, la presentación de material gráfico en los alojamientos, la indicación de procesos ecológicos de los cuales estas especies hacen parte y charlas de su importancia cultural para las comunidades locales. Estas actividades pueden acercar a los turistas a un mundo totalmente desconocido, enriqueciendo su visita a Ciudad Perdida. En la zona de Ciudad Perdida, que por ser sitio arqueológico y Parque Nacional Natural presenta una reglamentación especial que prohíbe la cacería, sería posible explotar la posibilidad de observación de mamíferos si se refuerza la no cacería de estas especies en estas áreas. Esto resultaría en una mayor probabilidad de detección de los animales en las terrazas y con ello un atractivo adicional para los visitantes. A estas actividades también se les puede potenciar con el uso de guías de fauna como las que resultan de este proyecto. Este material ayuda a presentar a los turistas con la gran diversidad de especies que existen en la zona, aun cuando no sean frecuentemente observadas en el camino. Direcciones futuras Es interesante el hecho que las especies como C. paca y D. punctata, que generalmente son especies que muestran frecuencias altas de fotografías, no son las más frecuentes en nuestro muestreo. En cambio son carnívoros como el puma y el ocelote, seguidos muy de cerca por los marranos domésticos cimarrones y armadillos que presentan un mayor número de eventos independientes. Esta situación puede ser resultado del sesgo debido al tamaño de los animales y la manera en que se ubicaron las cámaras (Tobler et al. 2008a). Sin embargo, este sesgo no explica la baja frecuencia de los demás animales, ni tampoco los porcentajes de ocurrencia encontrados para las estas mismas especies de menor talla que representan la base de la dieta de estos carnívoros en condiciones naturales (Payan 2009, Tobler et al. 2008a, b). Para examinar estas patrones, es necesario llevar a cabo muestreos con un mayor número de estaciones fotográficas. Con los datos obtenidos en este muestreo es posible pensar que la baja frecuencia de fotos de mamíferos pequeños y medianos se deba en parte que estas especies menores son activamente buscadas por los cazadores locales para el consumo. De acuerdo a los conceptos básicos de ecología trófica (Ricklefs 1990), el hecho de haber obtenido indicios de bajas densidades de mamíferos de tamaños intermedios, debería traducirse en una disminución considerable en el 59 número de grandes carnívoros que dependen de estas especies. Los resultados nos hacen pensar que en la cuenca del Buritaca esto no está ocurriendo. Una posible explicación es la presencia de marranos domésticos cimarrones que puede estar supliendo la demanda de las especies de grandes carnívoros. Sin embargo esta es una hipótesis que necesita comprobación a partir de un estudio intensivo a lo largo de la cuenca. Nuestros resultados evidencian la necesidad de un estudio más detallado de las dinámicas poblacionales de los mamíferos medianos y grandes a lo largo de esta cuenca y las cuencas aledañas. Estas evaluaciones deben estar acompañados por un monitoreo continuo de los porcentajes de ocurrencia de cada una de las especies de interés, que permitan determinar claramente si la alta ocurrencia de pumas y otros carnívoros determinadas en esta evaluación son resultado de el bajo número de cámaras instaladas o por el contrario, en la cuenca existe una dinámica diferente que permite la presencia de carnívoros en un alto porcentaje del área. Con respecto a las poblaciones de marranos cimarrones, es importante determinar cuáles son las dinámicas que las rigen en la SNSM. Un primer paso necesario es conocer las densidades poblacionales de marranos en la cuenca, la tasa en que son consumidos por los grandes carnívoros y una determinación científica de la probable existencia de una dinámica equilibrada que permite la persistencia de grandes carnívoros en la zona. Los cuales pueden estar funcionando como reguladores naturales de esta especie introducida, evitando las consecuencias negativas de una explosión demográfica de esta especie exótica en los bosques de la cuenca. Este trabajo debe estar acompañado por un acercamiento al conocimiento del estado de las poblaciones de los grandes felinos existentes en la cuenca y en la SNSM en general; además de una comprensión de sus interacciones no solo con los demás animales sino con las comunidades humanas locales. ©Paisajes de conservación – Zona de influencia Parque Sierra Nevada de Santa Marta/Equipo FIAAT-SELVA-Panthera Puma concolor - Puma 60 Bibliograf ia Aide, T. M., and J. Cavelier. 1994. Barriers to Lowland Tropical Forest Restoration in the Sierra Nevada de Santa Marta, Colombia. Restoration Ecology 2: 219-229. Alberico, M., A. Cadena, J. Hernandez-Camacho, and Y. Munoz-Saba. 2000. Mamiferos (Synapsida:Theria) de Colombia. Biota Colombiana 1: 43-75. Bonaudo, T., Y. Le Pendu, J. F. Faure, and D. Quanz. 2005. The effects of deforestation on wildlife along the transamazon highway. European Journal of Wildlife Research 51:199-206. Cabrera, J. A. 2012. Natural licks and people: towards an understanding of the ecological and social dimensions of licks in the Colombian Amazon. Page 153. School of Anthropology and Conservation. University of Kent, Canterbury. Carbone, C., S. Christie, K. Conforti, T. Coulson, N. Franklin, J. R. Ginsberg, M. Griffiths, J. Holden, K. Kawanishi, M. Kinnaird, R. Laidlaw, A. Lynam, D. W. Macdonald, D. Martyr, C. McDougal, L. Nath, T. O'Brien, J. Seidensticker, D. J. L. Smith, M. Sunquist, R. Tilson, and W. N. W. Shahruddin. 2001. The use of photographic rates to estimate densities of tigers and other cryptic mammals. Animal Conservation 4:75-79. Carbone, C., S. Christie, K. Conforti, T. Coulson, N. Franklin, J. R. Ginsberg, M. Griffiths, J. Holden, M. Kinnaird, R. Laidlaw, A. Lynam, D. W. MacDonald, D. Martyr, C. McDougal, L. Nath, T. O'Brien, J. Seidensticker, J. L. D. Smith, R. Tilson, and W. N. W. Shahruddin. 2002. The use of photographic rates to estimate densities of cryptic mammals: response to Jennelle et al. Animal Conservation 5: 121-123. Chao, A., R. K. Chazdon, R. K. Colwell, and T.-J. Shen. 2005. A new statistical approach for assessing similarity of species composition with incidence and abundance data. Ecology Letters 8: 148-159. Chao, A., R. K. Colwell, C. W. Lin, and N. J. Gotelli. 2009. Sufficient sampling for asymptotic minimum species richness estimators. Ecology 90: 1125-1133. Cleef, A. M., O. Rangel, T. v. d. Hammen, and R. Jaramillo. 1984. La vegetacion de las selvas del transecto Buritaca. Pages 267-406 in T. v. d. Hammen, and P. M. Ruiz, editors. La Sierra Nevada de Santa Marta (Colombia) Transecto Buritaca-La Cumbre. J. Cramer, Berlin. Colwell, R. K. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8.2. User's Guide and application. http://purl.oclc.org/estimates. Colwell, R. K., and J. A. Coddington. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society of London B 345: 101-118. Colwell, R. K., C. X. Mao, and J. Chang. 2004. Interpolating, extrapolating, and comparing incidence-based species accumulation curves. Ecology 85: 2717-2727. Emmons, L. H. 1999. Neotropical rainforest mammals: A field guide. University of Chicago Press. 61 Fragoso, J. M. 2003. Long-distance seed dispersal by tapirs increases seed survival and aggragates tropical trees. Ecology 84: 1998-2006. Fragoso, J. M. V. 1999. Perception of scale and resource partitioning by peccaries: behavioral causes and ecological implications. Journal of Mammalogy 80: 993-1003. Franklin, J. F. 1988. Structural and functional diversity in temperate forests. Pages 166-175 in E. O. Wilson, editor. Biodiversity. National Academy Press, Washington DC. Gibbs, J. P., M. L. Hunter, and E. J. Sterling 2008. Problem-solving in conservation biology and wildlife management. Backwell Publishing. Kery, M., J. A. Royle, H. Schmid, M. Schaub, B. Volet, G. Hafliger, and N. Zbinden. 2010. Site-Occupancy Distribution Modeling to Correct Population-Trend Estimates Derived from Opportunistic Observations. Conservation Biology 24: 1388-1397. Keuroghlian, A., and D. P. Eaton. 2009. Removal of palm fruits and ecosystem engineering in palm stands by white-lipped peccaries (Tayassu pecari) and other frugivores in an isolated Atlantic Forest fragment. Biodiversity and Conservation 18: 1733-1750. Mackenzie, D. I., J. D. Nichols, J. A. Royle, K. H. Pollock, L. L. Bailey, and J. E. Hines 2006. Occupancy Estimation and Modeling. Academic Press. Magurran, A. 2004. Meassuring biological diversity. Blackwell pubishing, Oxford. Mao, C. X., and R. K. Colwell. 2005. Estimation of species richness: Mixture models, the role of rare species, and inferential challenges. Ecology 86: 1143-1153. Murphy, D. D., P. S. Weiland, and K. W. Cummins. 2011. A Critical Assessment of the Use of Surrogate Species in Conservation Planning in the Sacramento-San Joaquin Delta, California (U.S.A.). Conservation Biology 25: 873-878. Noss, R. F. 1990. Indicators for monitoring biodiversity: a hierarchical approach. Conservation Biology 4:355-364. O'Brien, T. G. 2010a. Wildlife picture index and biodiversity monitoring: issues and future directions. Animal Conservation 13: 350-352. O'Brien, T. G. 2010b. WILDLIFE PICTURE INDEX: Implementation Manual Version 1.0. Wildlife Conservation Society. O'Brien, T. G., M. F. Kinnaird, and H. T. Wibisono. 2003. Crouching tigers, hidden prey: Sumatran tiger and prey populations in a tropical forest landscape. Animal Conservation 6:131-139. O’Connell, A. F., and L. L. Bailey. 2011. Inference for Occupancy and Occupancy Dynamics. Pages 191-205 in A. F. O’Connell, J. D. Nichols, and K. U. Karanth, editors. Camera Traps in Animal Ecology Methods and Analyses. Springer. 62 Payan, E. 2009. Hunting Sustainability, species richness and carnivore conservation in Colombian Amazonia. Page 151. University College London & Institute of Zoology, Zoological Society of London, London. Reichel-Dolmatoff, G. 1982. Cultural Change and Environmental Awareness: A Case Study of the Sierra Nevada de Santa Marta, Colombia. Mountain Research and Development 2: 289-298. Reyna-Hurtado, R., A. Taber, M. Altrichter, J. Fragoso, A. Keuroghlian, and H. Beck. 2008. Tayassu pecari. IUCN 2010. IUCN Red List of Threatened Species. Version 2010.4. Ricklefs, R. E. 1990. Ecology. W.H. Freeman and Company. Rodriguez, J. V., J. I. Hernandez, T. R. Defler, M. Alberico, R. B. Mast, R. A. Mittermeier, and A. Cadena 1995. Mamiferos colombianos: sus nombres comunes e indigenas. Conservation International. Rodriguez-Mahecha, J. V., M. Alberico, F. Trujillo, and J. Jorgenson 2006. Libro rojo de los mamíferos colombianos. Conservación Interacional & Ministerio de Ambiente, Vivienda y Desarrollo, Bogotá. Rovero, F., and A. R. Marshall. 2009. Camera trapping photographic rate as an index of density in forest ungulates. Journal of Applied Ecology 46: 1011-1017. Stoner, K. E., P. Riba-Hernandez, K. Vulinec, and J. E. Lambert. 2007. The role of mammals in creating and modifying seed shadows in tropical forests and some possible consequences of their elimination. Biotropica 39: 316-327. Tejeda-Cruz, C., E. J. Naranjo, A. D. Cuaron, H. Perales, and J. L. Cruz-Burguete. 2009. Habitat use of wild ungulates in fragmented landscapes of the Lacandon Forest, Southern Mexico. Mammalia 73: 211-219. Tobler, M. W., S. E. Carrillo-Percastegui, R. Leite Pitman, R. Mares, and G. Powell. 2008a. An evaluation of camera traps for inventorying large- and medium-sized terrestrial rainforest mammals. Animal Conservation 11: 169-178. Tobler, M. W., S. E. Carrillo-Percastegui, R. Leite Pitman, R. Mares, and G. Powell. 2008b. Further notes on the analysis of mammal inventory data collected with camera traps. Animal Conservation 11: 187-189. Tobler, M. W., J. P. Janovec, and F. Cornejo. 2010. Frugivory and Seed Dispersal by the Lowland Tapir Tapirus terrestris in the Peruvian Amazon. Biotropica 42: 215-222. Tschanz, C. M., J. Cruz, H. H. Mehnert, and G. T. Cebula. 1974. Geologic Evolution of the Sierra Nevada de Santa Marta, Northeastern Colombia. Geological Society of America Bulletin 85: 273-284. Villareal, H., M. Álvarez, S. Córdoa, F. Escobar, G. Fagua, F. Gast, H. Mendoza, M. Ospina, and A. M. Umaña. 2004. Métodos para el análisis de datos: una aplicación para resultados provenientes de caracterizaciones de biodiversidad. Manual de métodos para el desarrollo de inventarios de biodiversidad. Instituto Alexander Von Humboldt, Bogotá. 63 MARIPOSAS DE LA CUENCA DEL RÍO BURITACA, SIERRA NEVADA DE SANTA MARTA, COLOMBIA Mario Andrés Murcia López Email: mariomurcia30@gmail.com Res um en Se realizaron muestreos de las mariposas de la cuenca del río Buritaca, Sierra Nevada de Santa Marta, en siete sectores diferentes del camino entre Machete Pelao y Ciudad Perdida. Se utilizaron transectos, y teniendo en cuenta los diferentes ecosistemas, se determinaron los patrones de distribución de las diferentes especies de mariposas, para identificar especies bioindicadoras. Se realizó un inventario de mariposas con el fin de identificar especies de interés para el turismo. El estudio se enfocó en las familias de mariposas más fáciles de identificar y que representaban el mayor potencial para cumplir los objetivos. Durante el estudio se identificaron 56 especies de mariposas diurnas. La mayoría de especies detectadas tienen un amplio rango de distribución y mayormente, se encuentran en zonas de alta intervención antrópica. 13 especies fueron identificadas como bioindicadoras, de estas se seleccionaron 4 (Morpho helenor, Philaethria dido, Anartia amathea, y Danaus gillipus), que son relativamente abundantes, y que pueden ser monitoreadas fácilmente, permitiendo detectar cambios en el estado de conservación de la cuenca. Se identificaron 10 especies que por sus características pueden ser de alto interés para los turistas (Diaethria clymena, Marpesia zerynthia, Heraclides thoas, Danaus gillipus, Caligo illioneus, Morpho helenor, Phoebis neocypris rurina, Pteronymia alcmena, Heliconius clysonimus y Arawacus torgana). Armonizar la conservación, y la observación de mariposas puede estimular diferentes estrategias de educación y llevar a la preservación del medio ambiente. 64 Introducción En el mundo se conocen alrededor de 180,000 especies de mariposas, incluyendo las “diurnas” y las “nocturnas” conocidas comúnmente como polillas. Del total de mariposas, aproximadamente 18,000 especies son mariposas “diurnas” y de estas, alrededor de 7,500 especies se encuentran en el Neotrópico. En Colombia, se han reportado 3,273 de estas especies (Andrade-C 2012), lo que convierte a nuestra nación el segundo país con mayor diversidad de mariposas en el mundo. Las mariposas presentan una estrecha relación coevolutiva con gran número de especies de plantas y dependen de ellas a lo largo de su ciclo de vida. En sus primeros estadios de vida, las orugas se alimentan de las plantas y las utilizan como albergue; en muchos casos esta relación es única, es decir, una especie de mariposa depende exclusivamente de una especie de planta. En su estadio adulto, consumen el néctar de las plantas con flores y muchas son fundamentales para su polinización. Debido a esta relación entre mariposas y plantas, en muchos casos la riqueza de plantas está estrechamente relacionada con la riqueza o número de especies de mariposas presentes en diferentes hábitats. Es por esto que toda acción del hombre sobre los bosques que implique tala, fragmentación, o remoción de la capa vegetal, y por lo tanto la pérdida de la variedad de especies de plantas, afecta directamente la riqueza de especies de mariposas, generando muchas veces la extinción de especies sin que hayan sido registradas (Andrade-C. 1998). Las mariposas son organismos con ciclos de vida cortos, lo que permite hacer monitoreos continuos con poco esfuerzo de muestreo y en corto tiempo. Adicionalmente, en muchos casos se cuenta con información sobre su ecología y uso de hábitat, lo que permite su uso como especies bioindicadoras para monitorear el estado de regeneración o perturbación de un ecosistema. Para la región Caribe se han registrado hasta el momento 150 especies de mariposas diurnas (Andrade-C. 2012). Para el departamento del Cesar, en un trabajo realizado en la Sierra Nevada de Santa Marta (SNSM), se reportaron 501 especies de mariposas diurnas y nocturnas (Adams 1973 en Rodríguez-Mahecha, J.V. et al. 2008). Un estudio sobre la fauna del Santuario de Vida SilvestreLos Besotes, en Valledupar (Cesar), reportó 180 especies de mariposas (Rodríguez-Mahecha, J.V., et al. 2012). Para la SNSM se han reportado 3 especies endémicas o restringidas a esta región (Libro Rojo de los Invertebrados Terrestres de Colombia, 2007), que además presentan algún grado de amenaza de acuerdo a las categorías de la UICN. Las especies endémicas a la SNSM son las siguientes: Arhuaco ica, con una distribución altitudinal de 2.600 a 3.100 msnm, categoría UICN Vulnerable. Lymanopoda caeruleata, rango altitudinal de 1.100 a 2.600 msnm, categoría UICN Vulnerable. Morpho rhodopteron, rango altitudinal de 1.600 a 2.400 msnm, categoría UICN En Peligro. 65 En este estudio se realizaron muestreos de las mariposas de la cuenca del río Buritaca, SNSM, teniendo en cuenta las diferentes zonas ecosistémicas encontradas. En estas zonas se determinaron los patrones de distribución de las diferentes especies de mariposas, con el fin de identificar especies bioindicadoras. Estas especies, debido a su estrecha relación con el grado de intervención y cambios en el paisaje, permiten monitorear en el tiempo las alteraciones presentadas por las diferentes actividades humanas. Estas alteraciones en el paisaje pueden afectar de forma positiva o negativa la conservación de los diferentes ecosistemas presentes en la cuenca. Adicionalmente, durante este estudio se llevó a cabo un inventario de mariposas con el fin de identificar especies de interés para el turismo, especies que serán usadas para promover la observación de fauna en la región. Teniendo en cuenta el tiempo disponible para el trabajo de campo y los objetivos, enfocamos el estudio en las familias de mariposas más fáciles identificar y que presentaban el mayor potencial de ser bioindicadoras o especies de interés para el turismo. Es por esto que no esperábamos detectar el mismo número de especies de otros estudios más exhaustivos en la SNSM. Adicionalmente, es importante tener en cuenta que este estudio se realizó en una sola época del año. ©Nick Bayly Caligo telamonius – una especies asociada principalmente con bosques en buen estado de conservación. 66 Metodología Sitios de estudio Se muestrearon siete sectores diferentes del camino entre Machete Pelao y Teyuna-Ciudad Perdida (Fig. 1). Con el fin de vincular las especies de mariposas encontradas con los diferentes hábitats y tipos de vegetación presentes, se definieron tres clases diferentes de estructura vegetal: Zonas altamente intervenidas (ZI): zonas muy potrerizadas, utilizadas principalmente para ganadería, cultivos y vivienda; donde predominan los pastos y en algunos casos arbustos de bajo porte. Zonas de bosque secundario (BST): zonas transicionales entre las áreas intervenidas y zonas más densas de bosques. Presentan marcados efectos de borde por estar en los límites con las zonas de alta intervención humana. Zonas de bosques más densos (BSR): áreas de bosque que pueden ser de crecimiento secundario, pero que muestran regeneración o en el mejor de los casos están mejor conservados por encontrarse en zonas de ladera, altas pendientes, lejos de caminos principales y alejados de los centros de actividad humana. Figura 1. Sectores de estudio (en verde) muestreados para mariposas en la cuenca del río Buritaca. 67 Muestreo de mariposas La metodología usada se basó en transectos lineales que fueron recorridos entre las 7 am a las 4 pm. Se escogieron estas horas ya que son las principales horas de luz y en las cuales las mariposas alcanzan su máxima actividad. La longitud de los transectos variaba de acuerdo a las condiciones del terreno y a la densidad de especies encontradas en cada recorrido, siendo en promedio de 1 km diario. El esfuerzo de muestreo en cada sector estudiado se puede observar en la Tabla 1. En estos transectos se registraron todos los especímenes observados, anotando especie y número de individuos presentes. Algunos individuos, no identificados en vuelo, fueron capturados brevemente con jama mientras se identificaban, posteriormente fueron liberados sin manipulación. Adicionalmente, con el fin de atraer más individuos, se usaron cebos con frutas y pescado en descomposición, los cuales presentaron un muy bajo índice de éxito debido a la alta pluviosidad de la zona. La lluvia lavó los cebos impidiendo la diseminación de su olor, por lo tanto siendo poco atractivos para las mariposas. Debido al tipo de muestreo y al tiempo disponible, fue necesario enfocar los esfuerzos en los grupos más conspicuos, más diversificados y más ampliamente distribuidos, con el fin de poder encontrar especies bioindicadoras y especies de interés para el turismo. Es por esto que el muestreo se enfocó en las familias: Castniidae, Hesperidae, Lycaenidae, Nymphalidae, Papilionidae, y Pieridae. Adicionalmente, para estas familias no es necesario colectar individuos para su posterior identificación, ya que con un registro fotográfico adecuado es posible identificar casi la totalidad de las especies. Selección de especies bioindicadoras Con base en las especies encontradas durante el estudio, se escogieron unas especies bioindicadoras del estado de conservación, regeneración, o intervención de los ecosistemas muestreados en la cuenca del río Buritaca. Estas especies se escogieron siguiendo criterios de distribución general, altitudinal y regional, su abundancia relativa y el uso de hábitat. Es importante seleccionar especies con una abundancia media o alta porque las tasas de detección en especies raras hace difícil encontrar diferencias de abundancia en el tiempo. Las especies seleccionadas incluyen especies que reflejan cambios positivos y/o negativos en el ambiente. ©Paisajes de conservación – Zona de influencia Parque Sierra Nevada de Santa Marta/Mario Mucia Arawacus togarna Una especie de áreas abiertas que refleja el grado de fragmentación de los bosques 68 Resultados Durante el estudio se identificaron 56 especies de mariposas diurnas. La mayoría de especies detectadas tienen un amplio rango de distribución y en su mayoría, se encuentran en zonas de alta intervención antrópica. En la Tabla 1 se pueden ver detalladamente las zonas muestreadas asociadas a su estructura vegetal, el esfuerzo de muestreo y el número de especies detectadas en cada una. Tabla 1 – Esfuerzo de muestreo en cada sector del estudio y tipo de vegetación muestreada. Los números de los sectores corresponden a los números encontrados en la Figura 1. Fecha/s 02 y 16 Junio 2012 14 Junio 2012 15 Junio 2012 10-13 Junio 2012 09 y 13 Junio 2012 03 & 08 Junio 2012 04-08 Junio 2012 Altura (msnm) 600 Sector 2. Vista mar filo 600-1100 3. Adán bosque Tipo de Vegetación Cultivos, potreros, bordes de bosques secundarios (ZI & BSR) Bosques secundarios en regeneración Días de muestreo 2 Horas de muestreo 11 1 7 1 8 4 26 2 12 2 8 5 30 (BSR) 550 400-650 400 450-800 900-1200 4. Alfredo fincas Cultivos, potreros, bordes de bosques secundarios (ZI) 5. Wiwa bosque Bosques secundarios en regeneración y transicionales (BSR) 6. Wiwa fincas Cultivos, potreros, bordes de bosques secundarios (ZI) 8. Filo puente Bosques secundarios y transicionales en regeneración (BST + BSR) 10. Ciudad Perdida Bosques secundarios en regeneración (BSR) A pesar de que el muestreo fue realizado principalmente con registros visuales ya que la atracción con cebos no fue exitosa, la gráfica de acumulación de especies deja ver que el esfuerzo de muestreo fue efectivo, ya que se encontró un buen número de las especies de mariposas que se esperarían para la zona (Fig. 2). Sin embargo, realizar un muestreo que incluyera todas las familias de mariposas, aumentaría el número de especies encontradas considerablemente. En este estudio no se calcularon índices de biodiversidad para los sectores muestreados debido al desbalance en tiempo de los muestreos realizados en cada uno (Tabla 1), y a la dificultad de corregir los datos para este desbalance. Por esto, la Tabla 2 presenta el número de especies y el número de individuos detectados por sector. Ciudad Perdida y Wiwa Bosque fueron los sectores con el mayor número de especies y esto puede estar reflejando la integridad del bosque en estos sectores, pero también puede reflejar un mayor esfuerzo de muestreo. En los sectores de la parte baja del camino (Adán bosque y Vista Mar Filo) se encontraron menos especies y dado que el esfuerzo de muestreo fue relativamente alto en estos sectores, estos valores pueden reflejar un mayor nivel de degradación en la parte baja de la cuenca. 69 Figura 2 – Curva de acumulación de especies durante el estudio en la cuenca del río Buritaca. No. de especies acumuladas 60 50 R² = 0.9501 40 30 20 10 0 0 2 4 6 8 10 12 14 16 No. de días de muestreo Tabla 2 – Riqueza y abundancia de especies encontradas por zona. Ciudad Perdida (BST + BSR) Wiwa Fincas Wiwa Bosque Adan Bosque Alfredo fincas Vista Mar Filo (ZI) (BSR) (BSR) (ZI) (ZI + BST) 24 14 12 21 6 18 7 86 46 34 107 12 81 11 (BST + BSR) Riqueza Abundancia Filo Puente Abundancia En el Anexo 1 se muestra el listado de las especies encontradas y el número de individuos registrados en cada sector. Al hacer esto, también se identificó el tipo de abundancia para toda la cuenca conforme a la cantidad de individuos encontrados y de acuerdo a la siguiente división sugerida para este estudio (Fig. 3): Especies Raras: 1 o 2 individuos encontrados durante el estudio. Especies Ocasionales: de 3 a 7 individuos encontrados durante el estudio. Especies Comunes: de 8 a 15 individuos encontrados durante el estudio. Especies Muy Comunes: de 16 a 30 individuos encontrados durante el estudio. Marpesia petreus Arawacus leucogyna Caligo telamonius Heliconius wallacei Leptophobia aripa Pierella luna Tithorea harmonia Adelpha justina Heliconius erato hydara Heraclides thoas neacles Marpesia corinna Melinaea lilis Pseudoscada timna Urbanus evona Adelpha cytherea daguana Ocasional Especies encontradas y abundancia Heliconius charithonius Altinote stratonice Heliconius clysonymus montanus Heliconius ethilla metalilis Opsiphanes tamarindi Adelpha cytherea olbia Arawacus togarna Caligo atreus Junonia evarete Leptophobia tovaria Parides eurimides Pteronymia alcmena Adelpha boreas Strymon melinus Dryas iulia Oleria amalda amaldina Protesilaus protesilaus Urbanus teleus Anartia amathea Común Urbanus proteus 30 Rara Historis odius Marpesia chiron 25 Heraclides astyalus 20 Dismorphia medora Hamadryas laodamia saurites 15 Caligo illioneus Catasticta sisamnus 10 Archonias brassolis 5 0 Archaeoprepona demophon Figura 3 – Número de individuos encontrados para cada especie detectada en la cuenca del río Buritaca y su abundancia. No. de Individuos Castniomera atymnius drucei (polilla diurna) Morpho helenor peleides Philaethria dido Danaus gilippus Ithomia iphianassa Marpesia berania Mechanitis polymnia veritabilis Eurema albula Diaethria clymena marchalii Aphrissa statira Phoebis neocypris rurina 70 Muy Común Marpesia zerynthia 71 De acuerdo con la Fig. 3 y el Anexo 1, dentro de las 56 especies que se identificaron en total se encontraron 16 especies Raras, 22 Ocasionales, 12 Comunes, y 6 especies Muy Comunes. Entre las especies definidas como Raras se destacan Hamadryas laodamia y Pierella luna, especies que se encuentran confinadas a zonas de bosques primarios o bosques secundarios en regeneración. Dentro de las especies de ocurrencia Ocasional se destaca Pteronymia alcmena, una de las especies conocidas como mariposa Alas de Cristal, que también se encuentra principalmente en bosques húmedos primarios. También se destacan: Marpesia corinna, Parides eurimides, Opsiphane stamarindi, Caligo atreus, Heliconius clysonymus, Heliconius erato y Heraclides thoas, que se encuentran principalmente en zonas de bosque y zonas de transición dentro ellas, incluyendo bordes de ríos y quebradas. Entre las mariposas Comunes y Muy Comunes se destacan Protesilaus protesilaus, Morpho helenor, Marpesia berania y M. zerynthia, estas al igual que las anteriores, se encuentran en zonas de bosque y zonas de transición. Adicionalmente están especies como Diaethria clymena, Phoebis rurina, Philaethria dido, Danaus gilippus, Anartia amathea y Urbanus proteus, las cuales son propias de zonas intervenidas. Es importante destacar que de las 24 especies identificadas en Ciudad Perdida, 14 fueron encontradas sólo allí, lo que permite ver el aislamiento en que se encuentra la zona con relación a las demás debido a su abrupto cambio altitudinal. Especies Bioindicadoras Basados en la distribución de las especies a lo largo de la cuenca y entre hábitats, se puede decir que las especies más adecuadas para ser usadas como bioindicadores para la cuenca del río Buritaca, de acuerdo a su distribución y uso de hábitat son: Indicadores de regeneración y/o conservación de bosques Pierella luna Heliconius clysonymus Pteronymia alcmena Caligo atreus Morpho helenor Indicadoras de bosques secundarios, con efectos de borde y levemente deteriorados por acciones antrópicas (construcción, actividades agropecuarias, quemas, deforestación, fragmentación, etc.) Caligo illioneus y Caligo telamonius Marpesia corinna Parides eurimides Philaethria dido 72 Indicadores de alto grado de intervención y perturbación del hábitat (zonas potrerizadas, bordes de caminos, cultivos y pastizales) Anartia amathea Danaus gillipus Urbanus proteus y todo el género de Urbanus spp. Dryas iulia Las cuatro especies resaltadas en negro, son especies abundantes lo que permite su fácil monitoreo y por lo tanto, la detección de cambios poblaciones que pueden reflejar transformaciones en el estado de conservación de la cuenca. Sus distribuciones reflejan diferentes niveles de degradación del bosque incluyendo: baja (Morpho helenor), intermedia (Philaethria dido) y alta (Anarthia amathea y Danaus gillipus), esto se puede visualizar en la Fig. 4. Figura 4: Especies indicadoras y su abundancia relativa en cada sector del estudio después de corregir por esfuerzo de muestreo. Los sectores de estudio están ordenados desde los más conservados (a la izquierda) hasta los más intervenidos (a la derecha). Morpho helenor - Positivo Philaethria dido - Positivo/negativo 12.0 4.0 Abundancia relativa Abundancia relativa 4.5 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0.0 8.0 6.0 4.0 2.0 0.0 Ciudad Filo Wiwa Adán Vista Wiwa Alfredo Perdida puente bosque bosque Mar filo fincas fincas Ciudad Filo Wiwa Adán Vista Wiwa Alfredo Perdida puente bosque bosque Mar filo fincas fincas Danaus gilippus - Negativo Anartia amathea - Negativo 14.0 12.0 Abundancia relativa Abundancia relativa 10.0 10.0 8.0 6.0 4.0 2.0 0.0 Ciudad Filo Wiwa Adán Vista Wiwa Alfredo Perdida puente bosque bosque Mar filo fincas fincas Aumento del nivel de intervención 10.0 9.0 8.0 7.0 6.0 5.0 4.0 3.0 2.0 1.0 0.0 Ciudad Filo Wiwa Adán Vista Wiwa Alfredo Perdida puente bosque bosque Mar filo fincas fincas Aumento del nivel de intervención 73 Especies de interés para el turismo Se identificaron 10 especies que por su tamaño (mediano a grande), vistosidad (colores), abundancia y facilidad de observación (pasan cerca a caminos o cursos de agua) son de alto interés para los turistas que se encuentren visitando Ciudad Perdida. Las especies se listan a continuación: Diaethria clymena Marpesia zerynthia, junto con otras especies del género Marpesia spp. Heraclides thoas Danaus gillipus Caligo illioneus y otras especies de este género Caligo spp. Morpho helenor Phoebis neocypris rurina Pteronymia alcmena o mariposas alas de cristal Heliconius clysonimus y otras especies del género Heliconius spp. Arawacus torgana ©Nick Bayly Heliconius clysonymus Una especie atractivo para el turismo y un indicador de bosques en buen estado de conservación 74 Discusión En este trabajo registramos la presencia de 56 especies de mariposas diurnas en la cuenca del río Buritaca. Según la curva de acumulación de especies, estas especies representan un porcentaje alto de las especies esperadas para la cuenca dentro las familias muestreadas. Sin embargo, si los muestreos hubieran incluido otras familias, un mayor rango de alturas y otras épocas del año, esperaríamos encontrar un número mayor de especies. Este estudio no encontró especies endémicas o amenazadas, las cuales se encuentra a alturas mayores de los muestreadas, y por lo tanto pueden estar presentes en el parte alta de la cuenca. Los resultados de este estudio muestran que la estructura de las comunidades de mariposas presentes a lo largo de la cuenca del río Buritaca está condicionada y relacionada a los grados de intervención antrópica sobre los ecosistemas en la zona. A pesar del grado de intervención que se encuentra en la cuenca, las actividades agropecuarias no han llegado a extenderse demasiado, y el turismo, como actividad económica, se ha realizado de manera controlada y organizada. Tal vez, es por esto que las áreas de bosque en buen estado de conservación o regeneración, todavía albergan especies típicas de bosques conservados. Sin embargo, la presencia de ciertas especies y la composición general de especies en algunas partes de la cuenca, reflejan un alto grado de intervención, dado que se trata de especies asociadas con zonas abiertas o claras en el bosque. Las relaciones de las mariposas con microhábitats específicos, las convierten en excelentes especies indicadoras, útiles a la hora de desarrollar programas de monitoreo que busquen determinar cómo están cambiando los ecosistemas en el tiempo. Las mariposas son relativamente numerosas, fáciles detectar e identificar, y con poco entrenamiento, miembros de los comunidades de la zona podrían llevar a cabo monitoreos efectivos de las poblaciones de especies claves. La dependencia a los claros del bosque de varias especies, las hacen muy útiles para monitorear el grado de fragmentación de los bosques. Su visibilidad y el hecho de ser visualmente atractivas hacen que las mariposas sean de gran interés para el turismo. De la diversa fauna que es posible encontrar en el camino a Ciudad Perdida, las mariposas son unas de las especies más fáciles ver. Adicionalmente, hay diferentes formas para atraerlas y generar oportunidades de observación, por ejemplo, la siembra de plantas con flores alrededor de los alojamientos, y el uso de las sobras de fruta para atraer especies que las comen, generan oportunidades de avistar y fotografiar diversas especies. Con el fin de involucrar a las comunidades locales y los visitantes en procesos de conservación y restauración del bosque, se podrían construir uno o varios mariposarios en la región, que sean usados como medios pedagógicos, de sensibilización por la protección de los bosques, e incluso como una alternativa económica de bajo impacto. 75 Bibliografia Andrade-C, M.G. 2012. Mariposas Diurnas de Colombia. Consultada el 30 de Julio de 2012. https://sites.google.com/site/mgandradec/ Rodríguez-Mahecha, J.V., J.V. Rueda-Almonacid & T.D. Gutiérrez H. (eds.) 2008. Guía Ilustrada de la fauna del Santuario de Vida Silvestre Los Besotes, Valledupar, Cesar, Colombia. Serie de guías tropicales de campo Nº 7 Conservación Internacional. Editorial Panamericana, Formas e Impresos. Bogotá, Colombia. 574 pp. Amat-G. G., M. GonzaloAndrade-C. & Eduardo C. Amat G. 2007. Libro Rojo de los Invertebrados Terrestres de Colombia. Instituto de Ciencias Naturales – Universidad Nacional de Colombia, Conservación Internacional Colombia, Instituto Alexander von Humboldt, Ministerio de Ambiente, Vivienda y Desarrollo Territorial. 216p. ©Paisajes de conservación – Zona de influencia Parque Sierra Nevada de Santa Marta/Mario Mucia 76 ANEXO 1: LISTADO DE ESPECIES DE ANFIBIOS ESPECIES ENDÉMICAS FAMILIA: CENTROLENIDAE Especie: Ikakogi tayrona (Ruiz-Carranza & Lynch 1991) Nombre común: Rana Cristal del Magdalena Descripción General: Esta especie perteneciente a la familia Centrolenidae una de las más diversas del Neotropico. Es una rana endémica a Colombia con distribución restingida a los bosques sub andinos y lluviosos de la SNSM, se encuentra desde los 980 m hasta los 1790 m. I. tayrona presenta un tamaño entre los 30 y 40 mm, es de coloración verde en el dorso y su vientre es parcialmente transparente, posee espinas humerales pronunciadas y depositan sus huevos por fuera del agua en la superficie de las hojas. Al parecer son las únicas ranas de este grupo donde las hembras cuidan las posturas. Estatus IUCN: Su presencia restringida a menos de 20.000 km2 y su registro en menos de 10 localidades la clasifican como VULNERABLE (VU). Estatus en la cuenca: Es una especie Rara, solo se encontró en el sector de Ciudad Perdida. FAMILIA: HEMIPHRACTIDAE. Especie: Cryptobatrachus boulengeri (Ruthven 1916) Nombre común: Rana de las criptas Descripción General: Cryptobatrachus boulengeri es una especie endémica de Colombia, con distribucion restingida a los bosques humedos tropicalesde tierras bajas y a tierras altas del flanco norte de la SNSM, desde los 360 m hasta los 1790 m. Esta rana presenta un fuerte dimorfismo sexual en el tamaño del timpano. Es una rana de hábitos nocturnos, catalogada dentro del grupo de las “ranas marsupiales”. Los embriones se desarrollan directamente en la espalda de las hembras adultas. Esta especie es facil de confundir con C. ruthveni tambien distribuida en la SNSM, la diferencia radica en que la parte anterior del craneo es estrecha en C. boulengeri (Lynch 2008). Estatus IUCN: Su presencia restringida a un área menor a 5.000 km2 y su registro en menos de cinco localidades, hacen que se encuentre clasificada como EN PELIGRO (EN). Estatus en la cuenca: Es una especie Abundante, fue registrada en todos los sitios de muestreo. 77 FAMILIA: DENDROBATIDAE Especie: Colostethus ruthveni (Kaplan 1997) Nombre común: Ranita Saltarina Descripción General: Colostethus ruthveni es una especie endémica, con distribucion restingida a los bosques lluviosos de la SNSM y bosques secos tropicales cecanos a la costa caribe, entre los 680 m y los 1540 m. Posee una coloración poco vistosa y una franja pálida delgada dorsolateral, la piel en la cabeza, dorso y vientre es lisa con excepción de unos pequeños gránulos en la región lumbar. Es una rana de hábito diurno, perteneciente al grupo de las “ranas venenosas”. Despositan sus huevos en bromelias o charcas temporales. Posteriormente los renacuajos son cargados en la espalda por los machos. Estatus IUCN: Su presencia restringida a un área menor a 5.000 km2 y su registro en menos de cinco localidades, hacen que se encuentre clasificada como EN PELIGRO (EN). Estatus en la cuenca: Es una especie Común, fue registrada en tres de los cuatro sitios visitados (Tezhumake, Ciudad Perdida y Adán) FAMILIA: STROBOMATIDAE Especie: Pristimantis tayrona (Lynch & Ruiz 1985) Nombre común: Ranita de Lluvia Descripción General: Pristimantis tayrona es una especie endémica con distribucion restingida a los bosques lluviosos de la SNSM y bosques sub-andinos y andinos entre los 1,300 y 2,700 m. Esta especie es de tamaño pequeño, presenta el dorso liso, vientre aereolado, usalmente no presenta plieges dorosolateral, y rostro subovoide. Dorsalemnte presenta una coloración café con puntos más oscuros, el vientre y la garganta son ligeramente punteados. Es una especie nocturna generalmente asociada a las bromelias. Presenta desarrollo directo. Estatus IUCN: Su presencia restringida y su registro en menos de 10 localidades hacen que esté clasificada como CASI AMENAZADA (NT). Estatus en la cuenca: Es una especie Rara, sólo se encontró en el sector de Ciudad Perdida. Especie: Pristimantis ruthveni (Lynch & Ruíz-Carranza 1985) Nombre común: Ranita de Lluvia Descripción General: Pristimantis ruthveni es una especie endémica a Colombia, con distribucion restingida a los bosques lluviosos de la SNSM entre los 1,800 y 2,600 m. Esta especie es de tamaño pequeño, presenta el dorso liso, vientre con verrugas, pliegues dorsolaterales hasta el nivel del sacro, el timpano es prominente y rostro subcuminado dorsalmente de color café a crema con 78 marcas café oscuro. Es una especie nocturna y arbórea, es frecuente econtrarla debajo de rocas durante el día. Estatus IUCN: Su presencia esta restringida a menos de 5.000 km2 y es conocida en menos de 5 localidades, por esta razon está clasificada como EN PELIGRO (EN). Estatus en la cuenca: Es una especie Rara, sólo se encontró en el sector de Ciudad Perdida. Especie: Pristimantis cristinae (Lynch & Ruíz-Carranza 1985) Nombre común: Ranita de Lluvia Descripción General: Pristimantis cristinae es una especie endémica de Colombia, con distribucion restingida a los bosques lluviosos de la SNSM y bosques sub-andinos y andinos entre los 1,500 y 2,600 m. Estatus IUCN: No se poseen datos suficientes respecto a su ocurrencia estatus y requerimientos ecologicos por esta razón está clasificada como DATOS DEFICIENTES (DD). Estatus en la cuenca: Es una especie Rara, sólo se encontró en el sector de Ciudad Perdida. Especie: Pristimantis sanctamartae (Ruthven 1917) Nombre común: Ranita de Lluvia Descripción General: Pristimantis sanctaemartae es una especie endémica de Colombia, con distribucion restingida a los bosques lluviosos de la SNSM y bosques sub-andinos y andinos entre los 1,100 y 2,600 m. Esta especie es de tamaño pequeño, presenta el dorso ligeramente rugoso y vientre areolado, plieges dorsolaterales bajos, tímpano prominente y superficial. Dorsalmente presenta una coloracion crema con manchas café oscuras. Es una especie nocturna y arbórea, se le puede encontrar en la rivera de las quebradas y es más activa en el interior. Presenta desarrollo directo (Ramirez-Pinilla 2004). Estatus IUCN: Su presencia restringida y su registro en menos de 10 localidades hacen que esté clasificada como CASI AMENAZADA (NT). Estatus en la cuenca: Es una especie Rara, sólo se encontró en el sector de Ciudad Perdida. ESPECIES COMUNES DE TIERRAS BAJAS FAMILIA BUFONIDAE Especie: Rhinella marina (Linnaeus 1758) Nombre común: Sapo marino Descripción General: Rhinella marina, es una especie común perteneciente a la familia Bufonidae. Esta especie puede alcanzar entre 20-40 cm. La piel del cuerpo es seca y cubierta de verrugas. Presenta un patrón de coloración en el dorso que va desde ocre a marrón con manchas irregulares negras o marrón más oscuras. Presenta dos glándulas bien desarrolladas detrás de los ojos. Ésta especie presenta una amplia distribución en el Neotrópico y se ha convertido en especie invasora en 79 algunos países. Su reproduccion es oportunista, puede realizar posturas de 2.500 a 12.500 huevos depositados en largas hileras pares (Renjifo & Lundberg 1999, Medina-Ranjel et al. 2011). Estatus IUCN: Su amplia distribucion en todo tipo de ambientes hace que sea catalogada como una especie de MENOR PREOCUPACION (LC). Estatus en la cuenca: Es una especie Abundante, fue registrada en todos los sitios de muestreo. Especie: Rhinella granulosa (Spix 1824) Nombre común: Sapo granuloso Descripción General: Rhinella granulosa, es una especie común perteneciente a la familia Bufonidae. Esta especie más pequeña que R. marina alcanza un tamaño que va desde los 5.0 a 7.0 cm. El cuerpo está cubierto por pequeños gránulos y la cabeza es de menor tamaño y con crestas cefálicas. Presenta una coloración parda en el dorso con manchas difusas café oscuro. Ésta especie presenta una amplia distribución en el Neotrópico, vive en lugares abiertos. Durante el día es frecuente encontrarla debajo de piedras o en huecos en el suelo. (Renjifo & Lundberg 1999). Estatus IUCN: Su amplia distribucion en todo tipo de ambientes la clasifican como una especie de MENOR PREOCUPACION (LC). Estatus en la cuenca: Es una especie Poco común, fue registrada en Tezhumake y Adán. FAMILIA LEPTODACTYLIDAE Especie: Leptodactylus fuscus (Schneider 1799) Nombre común: Rana picuda Descripción General: Leptodactylus fuscus es una especie que se encuentra distribuida desde Panamá hasta el norte de Argentina. Su tamaño va desde los 5 hasta 7 cm, la cabeza es puntuda y presenta tres pliegues longitudinales sobre los costados que inician detrás de los ojos y continúan hasta las ingles. El dorso presenta una coloración café con manchas más oscuras, tiene una franja media dorsal café clara desde la punta de la boca hasta la apertura cloacal. Es una especie terrestre y nocturna, habita generalmente estanques, sabanas, pastizales, y áreas urbanas. Las hembras depositan los huevos dentro de nidos de espuma cerca de las orillas de los estanques (Renjifo & Lundberg 1999, Galvis et al. 2011). Estatus IUCN: Su amplia distribucion en todo tipo de ambientes permite que sea catalogada como una especie de MENOR PREOCUPACION (LC). Estatus en la cuenca: Es una especie Poco común, fue registrada en dos sitios de los 4 visitados (Tezhumake y Wiwa). 80 Especie: Leptodactylus savagei (Schneider 1799) Nombre común: Sapo Rojo Descripción General: Leptodactylus savagei es una especie robusta que puede alcanzar hasta 18 cm de tamaño. Es terrestre y de gran tamaño, puede alcanzar hasta 18 cm. Su cuerpo es robusto y de cabeza grande. Su piel es lisa y presenta un patrón de coloración café rojizo con manchas café oscuro, con frecuencia presenta una franja negra encima del tímpano. Los miembros posteriores son musculosos, los labios presentan unas barras conspicuas café rojizo oscuro. Durante el día se esconde en cuevas. Deposita sus huevos en grandes nidos de espuma en playas de quebradas. Es una especie que se distribuye desde centroamerica hasta el norte de Colombia (Renjifo & Lundberg 1999) Estatus IUCN: Su amplia distribucion en todo tipo de ambientes permite que sea catalogada como una especie de MENOR PREOCUPACION (LC). Estatus en la cuenca: Es una especie Poco común, fue registrada en los sectores Wiwa y Adán. Especie: Leptodactylus poecilochilus (Cope 1862) Descripción General: Leptodactylus poecilochilus distribuye en el norte de Sur América en Colombia y Venezuela. Es una especie de tamaño medio, posee una coloración café con manchas negras de forma y tamaño irregular, tiene barras café que van desde el labio hasta la parte inferior del ojo. Posee seis pliegues dorsolaterales, vientre amarillo y rostro puntudo. Esta especie es de hábitos nocturnos y se encuentra asociada a hábitats abiertos en bosques húmedos de tierras bajas, pastizales, potreros, entre otros (Solis et al. 2004, Cuentas et al. 2002). Estatus IUCN: Su amplia distribucion en todo tipo de ambientes la hace ser catalogada como una especie de MENOR PREOCUPACION (LC). Estatus en la cuenca: Es una especie Rara, sólo fue registrada en Tezhumake. FAMILIA: HYLIDAE Especie: Hypsiboas crepitans (Wied-Neuwied 1824) Nombre común: Rana platanera Descripción General: Hypsiboas crepitans al igual que otros miembros de este grupo, presenta hábitos nocturnos y arborícolas. Es una rana mediana entre los 5–8 cm. En el dorso, su coloración varía desde el crema al marrón-rojizo con machas irregulares marrón oscuro sobre el dorso de la cabeza y del cuerpo. Posee barras transversales marrón oscuro sobre las extremidades posteriores. Presenta una amplia distribución en el país. (Medina-Ranjel et al. 2011, Cuentas et al. 2002) Estatus IUCN: Su amplia distribucion en todo tipo de ambientes la hace ser catalogada como una especie de MENOR PREOCUPACION (LC). Estatus en la cuenca: Es una especie Común, fue registrada en tres sitios de los 4 visitados (Tezhumake y Adán y Wiwa). 81 Especie: Scinax ruber (Laurenti 1768) Nombre común: Ranita listada Descripción General: Scinax ruber esta presente en toda Mesoamerica y en el note de Sur Amércia, ha sido reportada hasta alturas de 2600 m. Es una rana pequeña de 2.5-3.0 cm. La cabeza es pequeña y el cuerpo presenta una coloración crema-grisasea. La cara anterior de las ingles y la posterior de los muslos son amarillo palido. Presenta una franja delgada color café en la region supratimpánica. Es una especie noctura y arboricola que habita una gran variedad de habitats (Renjifo & Lundberg 1999, Cuentas et al. 2002, Solis et al. 2004) Estatus IUCN: Su amplia distribucion en todo tipo de ambientes la hace ser catalogada como una especie de MENOR PREOCUPACION (LC). Estatus en la cuenca: Es una especie Rara, sólo fue registrada en el sector de Adán FAMILIA: DENDROBATIDAE. Especie: Dendrobates truncatus (Cope 1861) Nombre común: Rana Venenosa Descripción General: Dendrobates truncatus pertenece a la familia de las ranas venenosas, uno de los grupos más llamativos de anuros en el Neotrópico debido a las coloraciones que presentan y a su característica piel venenosa. Esta especie es endémica a Colombia distribuyéndose principalmente en el flanco oriental de la cordillera central y flanco occidental de la cordillera oriental de los Andes (Castro & Lynch 2004). Presenta un tamaño entre los 2 y 3 cm y tiene un patrón de coloración negro en el cuerpo con dos lineas dorso laterales de color amarillo dorado o verdoso que dan la impresión de formar la figura de una flecha (Renjifo & Lundberg 1999, Medina-Ranjel et al. 2011) Estatus IUCN: Su amplia distribucion en todo tipo de ambientes la hace ser catalagada como una especie de MENOR PREOCUPACION (LC). Estatus en la cuenca: Es una especie Común, fue registrada en tres sitios de los 4 visitados (Tezhumake, Wiwa y Adan). 82 ANEXO 2 . LISTADO DE ESPECIES DE AVES Familia Nombre científico Nombre en Inglés Nombre en Español Abundancia Tinamidae Tinamidae Cracidae Cracidae Cracidae Ardeidae Ardeidae Ardeidae Cathartidae Cathartidae Cathartidae Accipitridae Accipitridae Accipitridae Accipitridae Accipitridae Accipitridae Accipitridae Accipitridae Aramidae Columbidae Columbidae Columbidae Columbidae Columbidae Columbidae Columbidae Columbidae Columbidae Cuculidae Cuculidae Cuculidae Caprimulgidae Caprimulgidae Apodidae Apodidae Apodidae Trochilidae Trochilidae Trochilidae Trochilidae Trochilidae Trochilidae Trochilidae Trochilidae Trochilidae Trochilidae Trochilidae Tinamus major Crypturellus soui Penelope argyrotis Penelope purpurascens Aburria aburri Tigrisoma fasciatum Nycticorax nycticorax Bubulcus ibis Cathartes aura Coragyps atratus Sarcoramphus papa Gampsonyx swainsonii Elanoides forficatus Spizaetus tyrannus Busarellus nigricollis Buteo magnirostris Buteo nitidus Buteo brachyurus Buteo albonotatus Aramus guarauna Columbina talpacoti Claravis pretiosa Columba livia Patagioenas speciosa Patagioenas cayennensis Zenaida auriculata Leptotila verreauxi Geotrygon linearis Geotrygon montana Piaya cayana Crotophaga ani Tapera naevia Nyctidromus albicollis Caprimulgus rufus Streptoprocne rutila Streptoprocne zonaris Chaetura brachyura Florisuga mellivora Glaucis hirsutus Threnetes ruckeri Phaethornis striigularis Phaethornis anthophilus Phaethornis longirostris Colibri delphinae Colibri thalassinus Chrysolampis mosquitus Anthracothorax nigricollis Heliomaster longirostris Great Tinamou Little Tinamou Band-tailed Guan Crested Guan Wattled Guan Fasciated Tiger-Heron Black-crowned Night-Heron Cattle Egret Turkey Vulture Black Vulture King Vulture Pearl Kite Swallow-tailed Kite Black Hawk-Eagle Black-collared Hawk Roadside Hawk Gray-lined Hawk Short-tailed Hawk Zone-tailed Hawk Limpkin Ruddy Ground Dove Blue Ground Dove Rock Pigeon Scaled Pigeon Pale-vented Pigeon Eared Dove White-tipped Dove Lined Quail-Dove Ruddy Quail-Dove Squirrel Cuckoo Smooth-billed Ani Striped Cuckoo Common Pauraque Rufous Nightjar Chestnut-collared Swift White-collared Swift Short-tailed Swift White-necked Jacobin Rufous-breasted Hermit Band-tailed Barbthroat Stripe-throated Hermit Pale-bellied Hermit Western Long-tailed Hermit Brown Violetear Green Violetear Ruby-topaz Hummingbird Black-throated Mango Long-billed Starthroat Tinamú grande Tinamú Chico Pava Canosa Pava Moñuda Pava Negra Vaco Cabecinegro Guaco Común Garcita Bueyera Guala Cabecirroja Gallinazo Negro Rey de los Gallinazos Gavilancito Perlado Aguililla Tijereta Águila Iguanera Gavilán Cienaguero Gavilán Caminero Gavilán Barrado Gavilán Rabicorto Gavilán Gallinazo Carrao Tortolita Rojiza Tortolita Azul Paloma Doméstica Paloma Escamada Paloma Morada Torcaza Nagüiblanca Tórtola Colipinta Paloma-perdiz Lineada Paloma-perdiz Rojiza Cuco-ardilla Común Garrapatero Piquiliso Cuco Sin-fín Bujío Guardacaminos Colorado Vencejo Cuellirrojo Vencejo Collarejo Vencejo Rabicorto Colibrí Nuquiblanco Ermitaño Canelo Ermitaño Barbudo Ermitaño Golirayado Ermitaño Carinegro Ermitaño Colilargo Colibrí Pardo Colibrí Verdemar Colibrí Rubitopacio Mango Pechinegro Picudo Gorgiestrella Rara Ocasional Rara Rara Rara Rara Rara Ocasional Rara Rara Rara Rara Ocasional Rara Rara Ocasional Ocasional Ocasional Ocasional Rara Rara Rara Rara Rara Rara Rara Rara Rara Rara Rara Ocasional Ocasional Común Común Ocasional Ocasional Ocasional Rara Ocasional Rara Ocasional Rara Ocasional Rara Rara Rara 83 Familia Nombre científico Nombre en Inglés Nombre en Español Abundancia Trochilidae Trochilidae Trochilidae Trochilidae Trochilidae Trogonidae Trogonidae Trogonidae Alcedinidae Alcedinidae Alcedinidae Momotidae Galbulidae Ramphastidae Ramphastidae Ramphastidae Ramphastidae Picidae Picidae Picidae Picidae Picidae Falconidae Falconidae Falconidae Falconidae Falconidae Falconidae Falconidae Psittacidae Psittacidae Psittacidae Psittacidae Psittacidae Psittacidae Psittacidae Thamnophilidae Thamnophilidae Thamnophilidae Thamnophilidae Thamnophilidae Thamnophilidae Grallaridae Grallaridae Grallaridae Rhinocryptidae Furnariidae Furnariidae Furnariidae Furnariidae Furnariidae Chalybura buffonii Thalurania colombica Amazilia tzacatl Amazilia saucerrottei Hylocharis cyanus Pharomachrus fulgidus Trogon caligatus Trogon personatus Megaceryle torquata Chloroceryle amazona Chloroceryle americana Momotus subrufescens Galbula ruficauda Ramphastos sulfuratus Aulacorhynchus prasinus Aulacorhynchus sulcatus Pteroglossus torquatus Melanerpes rubricapillus Picoides fumigatus Colaptes rubiginosus Dryocopus lineatus Campephilus melanoleucos Herpetotheres cachinnans Micrastur ruficollis Micrastur semitorquatus Caracara cheriway Milvago chimachima Falco sparverius Falco rufigularis Ara militaris Aratinga wagleri Brotogeris jugularis Bolborhynchus lineola Touit batavicus Pionus menstruus Pionus sordidus Thamnophilus doliatus Thamnophilus atrinucha Myrmotherula schisticolor Formicivora grisea Drymophila caudata Myrmeciza longipes Grallaria guatimalensis Grallaria bangsi Grallaricula ferrugineipectus Scytalopus sanctaemartae Sclerurus albigularis Dendrocincla fuliginosa Dendrocincla homochroa Xiphorhynchus susurrans Lepidocolaptes souleyetii White-vented Plumeleteer Violet-crowned Woodnymph Rufous-tailed Hummingbird Steely-vented Hummingbird White-chinned Sapphire White-tipped Quetzal Gartered Trogon Masked Trogon Ringed Kingfisher Amazon Kingfisher Green Kingfisher Whooping Motmot Rufous-tailed Jacamar Keel-billed Toucan Emerald Toucanet Groove-billed Toucanet Collared Aracari Red-crowned Woodpecker Smoky-brown Woodpecker Golden-olive Woodpecker Lineated Woodpecker Crimson-crested Woodpecker Laughing Falcon Barred Forest-Falcon Collared Forest-Falcon Crested Caracara Yellow-headed Caracara American Kestrel Bat Falcon Military Macaw Scarlet-fronted Parakeet Orange-chinned Parakeet Barred Parakeet Lilac-tailed Parrotlet Blue-headed Parrot Red-billed Parrot Barred Antshrike Western Slaty-Antshrike Slaty Antwren White-fringed Antwren Long-tailed Antbird White-bellied Antbird Scaled Antpitta Santa Marta Antpitta Rusty-breasted Antpitta Santa Marta Tapaculo Gray-throated Leaftosser Plain-brown Woodcreeper Ruddy Woodcreeper Cocoa Woodcreeper Streak-headed Woodcreeper Colibrí de Buffon Ninfa Coroniazul Amazilia Colirrufa Amazilia Coliazul Zafiro Gorgiblanco Quetzal Dorado Trogón de Liguero Trogón Enmascarado Martín-pescador Grande Martín-pescador Matraque Martín-pescador Chico Barranquero ferina Jacamar Colirrufo Tucán Caribeño Tucancito Esmeralda Tucanete Picosurcado Pichí Bandeado Carpintero Habado Carpintero Ahumado Carpintero Cariblanco Carpintero Real Carpintero Marcial Halcón Reidor Halcón-montés Pajarero Halcón-montés Collarejo Caracara Moñudo Pigua Cernícalo Americano Halcón Murcielaguero Guacamaya Verde Perico Frentirrojo Periquito Bronceado Periquito Barrado Periquito Sietecolores Cotorra Cabeciazul Cotorra Piquirroja Batará Barrado Barará Occidental Hormiguerito Pizarroso Hormiguerito Pechinegro Hormiguerito Rabilargo Hormiguero Pechiblanco Tororoi Dorsiescamado Tororoi de Santa Marta Tororoi Ferruginoso Tapaculo Buchirrufo Raspahojas Collarejo Trepatroncos Pardo Trepatroncos Colorado Trepatroncos Cacao Trepatroncos Campestre Rara Ocasional Ocasional Ocasional Ocasional Rara Rara Rara Rara Rara Rara Ocasional Rara Ocasional Ocasional Ocasional Rara Rara Rara Rara Rara Rara Rara Rara Rara Rara Rara Rara Rara Rara Ocasional Rara Rara Rara Ocasional Rara Rara Común Ocasional Rara Rara Rara Ocasional Rara 84 Familia Nombre científico Nombre en Inglés Nombre en Español Abundancia Furnariidae Furnariidae Furnariidae Furnariidae Furnariidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Tyrannidae Cotingidae Pipridae Pipridae Tityridae Tityridae Tityridae Tityridae Vireonidae Vireonidae Vireonidae Vireonidae Vireonidae Corvidae Hirundinidae Xenops minutus Anabacerthia striaticollis Automolus rufipectus Cranioleuca hellmayri Synallaxis albescens Tyrannulus elatus Myiopagis gaimardii Myiopagis viridicata Elaenia flavogaster Elaenia frantzii Ornithion brunneicapillus Serpophaga cinerea Zimmerius chrysops Mionectes olivaceus Mionectes oleagineus Oncostoma olivaceum Atalotriccus pilaris Todirostrum cinereum Rhynchocyclus olivaceus Tolmomyias sulphurescens Platyrinchus mystaceus Pyrrhomyias cinnamomeus Contopus cinereus Sayornis nigricans Machetornis rixosa Legatus leucophaius Myiozetetes cayanensis Myiozetetes similis Pitangus sulphuratus Myiodynastes chrysocephalus Myiodynastes maculatus Megarynchus pitangua Tyrannus melancholicus Tyrannus savana Myiarchus tuberculifer Myiarchus panamensis Attila spadiceus Pipreola aureopectus Manacus manacus Pipra erythrocephala Tityra semifasciata Schiffornis turdina Pachyramphus rufus Pachyramphus polychopterus Cyclarhis gujanensis Vireo leucophrys Vireo olivaceus Hylophilus aurantiifrons Hylophilus flavipes Cyanocorax affinis Stelgidopteryx ruficollis Plain Xenops Montane Foliage-gleaner Santa Marta Foliage-gleaner Streak-capped Spinetail Pale-breasted Spinetail Yellow-crowned Tyrannulet Forest Elaenia Greenish Elaenia Yellow-bellied Elaenia Mountain Elaenia Brown-capped Tyrannulet Torrent Tyrannulet Golden-faced Tyrannulet Olive-striped Flycatcher Ochre-bellied Flycatcher Southern Bentbill Pale-eyed Pygmy-Tyrant Common Tody-Flycatcher Olivaceous Flatbill Yellow-olive Flycatcher White-throated Spadebill Cinnamon Flycatcher Tropical Pewee Black Phoebe Cattle Tyrant Piratic Flycatcher Rusty-margined Flycatcher Social Flycatcher Great Kiskadee Golden-crowned Flycatcher Streaked Flycatcher Boat-billed Flycatcher Tropical Kingbird Fork-tailed Flycatcher Dusky-capped Flycatcher Panama Flycatcher Bright-rumped Attila Golden-breasted Fruiteater White-bearded Manakin Golden-headed Manakin Masked Tityra Brown-winged Schiffornis Cinereous Becard White-winged Becard Rufous-browed Peppershrike Brown-capped Vireo Red-eyed Vireo Golden-fronted Greenlet Scrub Greenlet Black-chested Jay Southern Rough-winged Swallow Xenops Pardusco Hojarasquero Montañero Hojarasquero de Santa Marta Chamicero Coronado Chamicero Pálido Tiranuelo Coronado Elenia Selvática Elenia Verdosa Elenia Copetona Elenia Montañera Tiranuelo Cejón Tiranuelo Salta-arroyo Tiranuelo Cejiamarillo Atrapamoscas Oliváceo Atrapamoscas Ocráceo Piquitorcido Oliváceo Tiranuelo Ojiamarillo Espatulilla Común Picoplano Oliváceo Picoplano Azufrado Pico-de-pala Crestiamari Atrapamoscas Canelo Pibí Tropical Atrapamoscas Cuidapuente Sirirí Bueyero Atrapamoscas Pirata Suelda Crestinegra Suelda Social Bichofué Atrapamoscas Lagartero Sirirí Rayado Bichofué Picudo Sirirí Común Sirirí Tijeretón Atrapamoscas Cabecinegro Atrapamoscas Panameño Atila Culiamarillo Frutero Pechidorado Saltarín Barbiblanco Saltarín Cabecidorado Titira Enmascarada Saltarín Mirlo Cabezón Cinéreo Cabezón Aliblanco Verderón Cejirrufo Verderón Montañero Verderón Ojirrojo Verderón Luisucho Verderón Rastrojero Carriquí Pechiblanco Golondrina Barranquera Ocasional Rara Rara Ocasional Ocasional Ocasional Rara Ocasional Ocasional Ocasional Ocasional Ocasional Rara Ocasional Rara Ocasional Ocasional Rara Ocasional Rara Rara Ocasional Rara Ocasional Rara Rara Ocasional Rara Rara Ocasional Rara Ocasional Rara Ocasional Rara Rara Rara Muy común Ocasional Rara Rara Rara Rara Ocasional Rara Ocasional Rara 85 Familia Nombre científico Nombre en Inglés Nombre en Español Abundancia Troglodytidae Troglodytidae Troglodytidae Troglodytidae Troglodytidae Troglodytidae Troglodytidae Troglodytidae Polioptilidae Cinclidae Turdidae Turdidae Turdidae Turdidae Turdidae Turdidae Turdidae Mimidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Thraupidae Incertae sedis Incertae sedis Incertae sedis Emberizidae Emberizidae Emberizidae Emberizidae Cardinalidae Cardinalidae Parulidae Microcerculus marginatus Troglodytes aedon Campylorhynchus griseus Pheugopedius rutilus Thryophilus rufalbus Cantorchilus leucotis Henicorhina leucophrys Ramphocaenus melanurus Polioptila plumbea Cinclus leucocephalus Catharus fuscater Turdus leucops Turdus flavipes Turdus leucomelas Turdus grayi Turdus olivater Turdus albicollis Mimus gilvus Eucometis penicillata Tachyphonus rufus Ramphocelus dimidiatus Thraupis episcopus Thraupis palmarum Thraupis cyanocephala Tangara heinei Tangara gyrola Tersina viridis Dacnis cayana Cyanerpes caeruleus Cyanerpes cyaneus Volatinia jacarina Sporophila intermedia Sporophila bouvronides Sporophila luctuosa Sporophila nigricollis Sporophila minuta Oryzoborus funereus Coereba flaveola Tiaris obscurus Tiaris fuliginosus Rhodinocichla rosea Saltator maximus Saltator coerulescens Saltator striatipectus Arremonops conirostris Arremon schlegeli Arremon basilicus Atlapetes melanocephalus Piranga flava Cyanocompsa cyanoides Parula pitiayumi Scaly-breasted Wren House Wren Bicolored Wren Rufous-breasted Wren Rufous-and-white Wren Buff-breasted Wren Gray-breasted Wood-Wren Long-billed Gnatwren Tropical Gnatcatcher White-capped Dipper Slaty-backed Nightingale-Thrush Pale-eyed Thrush Yellow-legged Thrush Pale-breasted Thrush Clay-colored Thrush Black-hooded Thrush White-necked Thrush Tropical Mockingbird Gray-headed Tanager White-lined Tanager Crimson-backed Tanager Blue-gray Tanager Palm Tanager Blue-capped Tanager Black-capped Tanager Bay-headed Tanager Swallow Tanager Blue Dacnis Purple Honeycreeper Red-legged Honeycreeper Blue-black Grassquit Gray Seedeater Lesson's Seedeater Black-and-white Seedeater Yellow-bellied Seedeater Ruddy-breasted Seedeater Thick-billed Seed-Finch Bananaquit Dull-colored Grassquit Sooty Grassquit Rosy Thrush-Tanager Buff-throated Saltator Grayish Saltator Streaked Saltator Black-striped Sparrow Golden-winged Sparrow Sierra Nevada Brush-Finch Santa Marta Brush-Finch Hepatic Tanager Blue-black Grosbeak Tropical Parula Cucarachero Ruiseñor Cucarachero Común Cucarachero Chupahuevos Cucarachero Pechirrufo Cucarachero Cantor Cucarachero Anteado Cucarachero Pechigrís Curruca Picuda Curruca Tropical Mirlo-acuático Suramerica Zorzal Oscuro Mirla Ojiblanca Mirla Negra Mirla Buchiblanca Mirla Parda Mirla Cabecinegra Mirla Collareja Sinsonte Común Güicha Hormiguera Parlotero Malcasado Toche Pico-de-plata Azulejo Común Azulejo Palmero Azulejo Montañero Tangará Capirotada Tangará Cabecirrufa Azulejo Golondrina Mielero Azul Mielero Cerúleo Mielero Patirrojo Espiguero Saltarín Espiguero Gris Espiguero de Lesson Espiguero Negriblanco Espiguero Capuchino Espiguero Ladrillo Arrocero Piquigrueso Mielero Común Semillero Pardo Semillero Tiznado Rosita Canora Saltador Ajicero Saltador Papayero Saltador Pío-judío Pinzón Cabecirrayado Pinzón Alidorado Común Ocasional Gorrión-montés de Santa Piranga Bermeja Azulón Silvícola Reinita Tropical Muy común Ocasional Ocasional Común Ocasional Rara Rara Rara Rara Rara Ocasional Ocasional Ocasional Ocasional Rara Muy común Ocasional Rara Ocasional Rara Común Rara Ocasional Rara Común Rara Rara Rara Muy común Rara Ocasional Muy común Rara Ocasional Rara Común Rara Ocasional Ocasional Común Ocasional Rara Rara Común Común 86 Familia Nombre científico Nombre en Inglés Nombre en Español Abundancia Parulidae Parulidae Parulidae Parulidae Icteridae Icteridae Icteridae Icteridae Icteridae Fringillidae Fringillidae Fringillidae Myioborus miniatus Basileuterus conspicillatus Basileuterus culicivorus Basileuterus rufifrons Psarocolius decumanus Icterus chrysater Molothrus bonariensis Molothrus oryzivorus Quiscalus lugubris Carduelis psaltria Euphonia laniirostris Chlorophonia cyanea Slate-throated Redstart White-lored Warbler Golden-crowned Warbler Rufous-capped Warbler Crested Oropendola Yellow-backed Oriole Shiny Cowbird Giant Cowbird Carib Grackle Lesser Goldfinch Thick-billed Euphonia Blue-naped Chlorophonia Candelita Pechinegra Arañero Embridado Arañero Cejiblanco Arañero Cabecirrufo Oropéndola Crestada Turpial Montañero Chamón Común Chamón Gigante Tordo Llanero Jilguero Aliblanco Eufonia Gorgiamarilla Clorofonia Verdiazul Rara Ocasional Rara Común Ocasional Rara Ocasional Ocasional Ocasional Ocasional Muy común Rara 87 ANEXO 3 . LISTADO DE ESPECIES DE MAMÍFEROS Nombre científico y nombre común de todas las especies de mamífero registradas durante el estudio con su correspondiente estatus de abundancia en la cuenca. El tipo de registro indica la manera en que fue registrada su presencia en la cuenca. El estatus en la cuenca se basa en los cálculos del porcentaje de ocurrencia para las especies que presentaron un número de fotos suficiente para llevar a cabo el cálculo: ψ < 25 raro, 25 < ψ < 50: ocasional, 50 < ψ < 75: común, ψ > 75 muy común; ? = tamaño de muestra insuficiente. * = clasificación basada en características ecológicas reportadas para la especie. Nombre Científico Allouata seniculus Nombre Común Mono aullador Tipo de registro audición Estatus en la cuenca ? Cuniculus paca Guartinaja cámaras, huellas ocasional Dassypus novemcinctus Armadillo cámaras, huellas ocasional Dasyprocta punctata Ñeque, Guara cámaras, huellas ocasional Didelphis marsupialis Zorro chucho cámaras ? Eira barbara Taira cámaras muy común Leopardus pardalis Ocelote, tigrillo cámaras, huellas Leopardus sp. común cámaras ? Leopardus wiedii Tigrillo, Oncilla cámaras raro* Panthera onca Jaguar cámaras, huellas raro* Potos flavus Mono de noche audición, observación Pecari tajacu Saino cámaras, huellas Procyon cancrivorous Mapache cámaras Puma concolor Puma cámaras, huellas Sciurus granatensis Ardilla cámaras, observación muy común Sus scrofa Marrano cámaras, huellas, obs. ocasional Tamandua tetradactyla Oso palmero cámaras ? ocasional raro* común raro* 88 ANEXO 4: LISTADO DE ESPECIES DE MARIPOSAS Adelpha boreas Adelpha cytherea daguana Adelpha cytherea olbia Adelpha justina Altinote stratonice Anartia amathea Aphrissa statira Arawacus leucogyna Arawacus togarna Archaeoprepona demophon Archonias brassolis Caligo atreus Caligo illioneus Caligo telamonius Castniomera atymnius drucei Catasticta sisamnus Danaus gilippus Diaethria clymena marchalii Dismorphia medora Dryas iulia Eurema albula Hamadryas laodamia Heliconius charithonius Heliconius clysonymus Heliconius erato hydara Heliconius ethilla metalilis Heliconius wallacei Heraclides astyalus Heraclides thoas neacles Historis odius Ithomia iphianassa Junonia evarete Vista Mar Filo Alfredo fincas Adan Bosque Wiwa Bosque Wiwa Fincas Filo Puente Nombre Científico Ciudad Perdida Para cada especie se indica el número de individuos por sector, y su clase de abundancia para toda la cuenca. 6 1 3 5 3 2 1 1 4 4 5 23 2 1 1 3 1 1 2 3 1 1 5 3 1 15 1 2 1 2 5 3 3 7 5 2 18 1 3 3 5 4 3 4 2 1 1 2 1 3 2 3 2 4 5 TOTAL Tipo de Abundancia 6 4 5 3 4 9 27 2 5 1 1 5 1 2 10 1 12 25 1 8 23 1 3 4 3 4 2 1 3 1 14 5 Ocasional Ocasional Ocasional Ocasional Ocasional Común Muy Común Rara Ocasional Rara Rara Ocasional Rara Rara Común Rara Común Muy Común Rara Común Muy Común Rara Ocasional Ocasional Ocasional Ocasional Rara Rara Ocasional Rara Común Ocasional Leptophobia aripa Leptophobia tovaria Marpesia berania Marpesia chiron Marpesia corinna Marpesia petreus Marpesia zerynthia Mechanitis polymnia Melinaea lilis Morpho helenor peleides Oleria amalda amaldina Opsiphanes tamarindi Parides eurimides Philaethria dido Phoebis neocypris rurina Pierella luna Protesilaus protesilaus Pseudoscada timna Pteronymia alcmena Strymon melinus Tithorea harmonia Urbanus evona Urbanus proteus Urbanus teleus Vista Mar Filo Alfredo fincas Adan Bosque Wiwa Bosque Wiwa Fincas Filo Puente Nombre Científico Ciudad Perdida 89 2 5 8 4 3 5 3 7 5 2 1 1 2 5 1 1 1 1 3 1 17 3 3 3 2 1 1 3 7 2 5 5 3 2 15 1 5 3 2 1 5 7 2 3 9 8 TOTAL Tipo de Abundancia 2 5 15 1 3 1 22 18 3 10 8 4 5 10 27 2 8 3 5 7 2 3 9 8 Rara Ocasional Común Rara Ocasional Rara Muy Común Muy Común Ocasional Común Común Ocasional Ocasional Común Muy Común Rara Común Ocasional Ocasional Ocasional Rara Ocasional Común Común 90 Este informe se hace con el apoyo del Gobierno de Estados Unidos, a través de la Agencia de Estados Unidos para el Desarrollo Internacional (USAID). Los contenidos de la misma son responsabilidad de Fundación de Investigaciones Arqueológicas y Ambientales Tayrona (FIAAT), y no necesariamente reflejan el punto de vista de USAID o del Gobierno de Estados Unidos. Para citar este informe, por favor usar la siguiente forma: Bayly, N.J., Arias, H., Cabrera, J.A., Saboya, L. Murcia, M.A. 2012. Biodiversidad de la cuenca del río Buritaca, Sierra Nevada de Santa Marta, Colombia. Informe tecnico presentado a FIAAT. SELVA: Investigación para la conservación en el Neotrópico y Panthera Colombia, Bogotá, Colombia.