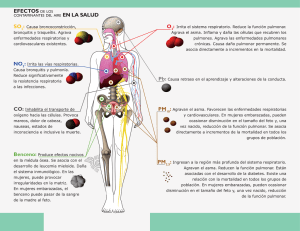
Descargar capítulo muestra
Anuncio

Neumología Sección 2 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Book 2.indb 137 Generalidades del aparato respiratorio............................................... Neumonía adquirida en la comunidad ................................................. Neumonía nosocomial .............................................................................. Asma .............................................................................................................. Enfermedad pulmonar obstructiva crónica ........................................ Neumopatías intersticiales difusas ....................................................... Neumoconiosis ........................................................................................... Hipertensión arterial pulmonar .............................................................. Tromboembolia pulmonar aguda........................................................... Edema agudo de pulmón ......................................................................... Síndrome de insuficiencia respiratoria aguda ................................... Fibrosis quística y bronquiectasias....................................................... Cáncer broncopulmonar .......................................................................... Sarcoidosis pulmonar ............................................................................... Patología de pleura .................................................................................... Patología de mediastino ........................................................................... Patología diafragmática ............................................................................ 139 144 149 154 160 166 168 171 174 177 180 182 186 190 193 199 204 3/2/15 2:47 PM Revisión Dr. Ricardo Stanley Vega Barrientos Médico neumólogo adscrito al Centro de Investigación de Enfermedades Infecciosas Instituto Nacional de Enfermedades Respiratorias Dra. Alma Rosa Bizarrón Muro Médico neumólogo adscrito al servicio clínico de Enfermedades de la Vía Aérea Instituto Nacional de Enfermedades Respiratorias Dr. Jair Rodríguez Barragán Médico neumólogo adscrito al servicio de Urgencias Instituto Nacional de Enfermedades Respiratorias Coordinación Dra. Amaranta Pernett Martín Jefe de residentes de Neumología adultos Instituto Nacional de Enfermedades Respiratorias Book 2.indb 138 3/2/15 2:47 PM 139 1. Generalidades del aparato respiratorio PulMonEs Los pulmones son órganos de tipo elástico y esponjoso, los cuales delimitan al mediastino, manteniéndose unidos a éste por medio del hilio pulmonar (por donde entran y salen vasos arteriales, venosos y linfáticos, así como los bronquios). A pesar de que la cúpula diafragmática derecha se encuentra a una mayor altitud que la izquierda, el pulmón derecho es más largo y ancho que el izquierdo. El vértice del pulmón derecho se hallan en contacto con la tráquea, y el del pulmón izquierdo con la subclavia. En el lado derecho la subclavia se encuentra por delante del vértice, mientras que en el izquierdo su posición es más medial. En la región ventral del vértice del pulmón derecho, en su porción media, se encuentra la vena cava y el tronco braquiocefálico. A tRÁQuEA La tráquea se encuentra conformada desde el orificio inferior de la laringe hasta su bifurcación a nivel de la segunda articulación condrosternal. En la porción inferior se hallan ligeramente inclinada hacia la derecha (por esta razón el bronquio derecho se considera como la continuación directa de la tráquea). El bronquio principal derecho es más corto, ancho y con una orientación más vertical que el izquierdo. En el tórax, la tráquea se encuentra a la derecha en contacto estrecho con la vena cava superior, la vena ácigos y el nervio vago; hacia la izquierda está anexa con el cayado aórtico, el nervio recurrente laríngeo inferior y la arteria subclavia izquierda; por delante, a nivel de la bifurcación, se encuentra el nacimiento del cayado aórtico. Inf eri or eri Cardiaco ial rior B e Post Pulmón derecho r Med Su Apical rio pe ior er Inf rior Ante Po st Anterior Superior r Apical or r Anterior Anterio rio te Book 2.indb 139 Apicoposterior s Po Pulmón izquierdo Lóbulo superior Apical Posterior Lóbulo inferior Apical Anterior Lóbulo medio Superior Inferior Posterior Anterior Medial Cardiaco Bronquios derechos Lóbulo superior Parte superior: Apicoposterior Anterior Lóbulo inferior Parte inferior: Superior Inferior Apical Posterior Medial Anterior Bronquios izquierdos Figura 2.1.1. Distribución segmentaria de los pulmones (A), y de los bronquios (B). sección 2 | Neumología VÍAs AÉREAs InFERIoREs Al entrar por el hilio pulmonar cada bronquio se subdivide en varias ramas. El bronquio principal derecho da lugar a tres ramas; 1) una rama para el lóbulo superior (nace por encima de la arteria pulmonar); 2) una rama para el lóbulo medio (nace por debajo de la arteria pulmonar), y 3) una rama para el lóbulo inferior (nace por debajo de la arteria pulmonar). En lo que respecta al bronquio principal izquierdo, éste sólo da dos ramas, una para el lóbulo superior y otra para el inferior (ambas nacen por debajo de la arteria pulmonar). Cada bronquio da origen a los bronquios segmentarios, los cuales se encargan de la conducción aérea a cada segmento pulmonar de cada lóbulo. La distribución de los segmentos pulmonares, y por lo tanto, de los bronquios segmentarios se encuentra descrita en las Figuras 2.1.1 y 2.1.2. Los bronquiolos disminuyen gradualmente sus diámetros hasta convertirse en bronquiolos respiratorios (estructuras de 1 mm y sin cartílago) y posteriormente en conductos alveolares. Cada conducto alveolar origina una serie de sáculos denominados aurículas, los cuales son la entrada a los alveolos. Existe una unidad respiratoria llamada lobulillo pulmonar, la cual está formada Apical l cAJA toRÁcIcA ósEA El tórax exhibe una estructura cónica con una base inferior deprimida en sentido anteroposterior. En la región ventral se encuentra formada por el esternón, las articulaciones esternocostales y las extremidades anteriores de las primeras diez costillas; las regiones laterales están formadas por los arcos costales; la porción posterior la conforman las vértebras dorsales (doce), con sus correspondientes articulaciones costovertebrales y las extremidades posteriores de las doce costillas. La arteria mamaria interna se encuentra aproximadamente a 1cm del esternón, desde el segundo y tercer arcos costales. Los vasos y nervios intercostales se están localizados en el surco costal, desplazándose por la región inferior de cada costilla, y ocupando una posición media en los espacios intercostales a nivel de la línea axilar posterior. Además de la caja torácica ósea existen estructuras que las cubren, como las clavículas y escápulas en las regiones superoposteriores; los músculos pectorales y deltoides en la región anterior; los músculos espinales, supraespinosos, infraespinosos, serrato mayor, dorsal ancho y trapecio en la región posterior. En individuos normales existen 12 costillas. En situaciones anormales existen costillas supernumerarias que se articulan superiormente con la séptima vértebra cervical; estas costillas pueden confundirse con tumores en la región supraclavicular, o producir trastornos circulatorios o nerviosos por compresión de la arteria subclavia o el plexo braquial, respectivamente. por el bronquiolo respiratorio, sus aurículas, los alveolos, y respectivos vasos sanguíneos, linfáticos y nervios. En estas estructuras ocurre el intercambio gaseoso entre los capilares y los alveolos. Media AnAtoMÍA 3/2/15 2:47 PM 140 Los vasos y nervios intercostales pueden ser lesionados en caso de punciones en la pared anterior del tórax en los bordes inferiores de las costillas, o en las regiones laterales del tórax a la mitad de cada espacio intercostal. Debido a la inclinación hacia la derecha de la tráquea, y a la menor longitud y mayor diámetro del bronquio derecho en comparación con el izquierdo, los cuerpos extraños aspirados por la tráquea tienen una mayor probabilidad de introducirse distalmente al bronquio derecho. Existe una unidad respiratoria llamada lobulillo pulmonar, la cual está formada por el bronquiolo respiratorio, sus aurículas, los alvéolos, y respectivos vasos sanguíneos, linfáticos y nervios. Guía EXARMED ª El oxígeno atraviesa las paredes alveolares hacia los capilares pulmonares por el proceso de difusión. Debido a que el pulmón no posee fibras nerviosas conductoras del dolor, es posible observar procesos pulmonares patológicos sin manifestaciones de dolor. El dolor aparecerá cuando se afecten fibras nerviosas dolorosas de otras estructuras, como la pleura parietal. Book 2.indb 140 A PULMÓN IZQUIERDO Lóbulo superior Lóbulo inferior Segmentos: Segmentos: a) b) c) d) a) b) c) d) Apicoposterior Anterior Superior Inferior Apical Posterior Medial Anterior B PULMÓN DERECHO Lóbulo superior Lóbulo medio Lóbulo inferior Segmentos: Segmentos: Segmentos: a) Apical b) Posterior c) Anterior a) Superior b) Inferior a) b) c) d) e) Apical Posterior Medial Cardiaco Anterior Figura 2.1.2. Esquema de distribución de los segmentos pulmonares. Pulmón derecho El pulmón derecho está dividido por la cisura mayor u oblicua en dos lóbulos, uno superior y otro inferior. Además el pulmón cuenta con una cisura menor que se extiende horizontalmente desde la mitad de la cisura mayor, hasta el borde anterior del pulmón, formando así al lóbulo medio. Pulmón izquierdo El pulmón izquierdo se encuentra dividido en dos lóbulos (superior e inferior), los cuales lo están a su vez por una cisura oblicua, o mayor, que se extiende oblicuamente desde el hilio en la pared posterior por debajo del vértice pulmonar, hacia abajo y adelante, hasta alcanzar el lóbulo anterior. El lóbulo superior de este pulmón incluye al vértice y gran parte de la porción anterior del pulmón, mientras que el lóbulo inferior comprende la base y la porción posterior del mismo. Irrigación e inervación La irrigación pulmonar proviene de los vasos bronquiolos, y en menor proporción de la circulación menor o pulmonar (la encargada del intercambio gaseoso [he- matosis]). Las arterias bronquiales concluyen a nivel de los bronquios respiratorios, cuya sangre regresa por medio de las venas bronquiales sin oxigenarse. La inervación de los pulmones se deriva de los nervios vagos y simpáticos. No existen fibras sensitivas dolorosas. Pleura y mediastino La anatomía correspondiente a la pleura y mediastino se describe más adelante en esta misma sección, en el capítulo correspondiente a patología de pleura. FISIOLOGÍA Inspiración y espiración La respiración consta de una inspiración (proceso muscularmente activo) y de la espiración (en condiciones fisiológicas normales es un proceso muscularmente pasivo, es decir, por relajación muscular), las cuales ocurren como resultado de los cambios de presión dentro de los pulmones. Durante la inspiración el diafragma se contrae y se mueve hacia abajo y los músculos intercostales externos, así como los escalenos y serratos, empujan las costillas hacia arriba, creando una presión 3/2/15 2:47 PM VEntIlAcIón PulMonAR La ventilación pulmonar está altamente influenciada por el grado de distensibilidad de los pulmones y del tórax. La distensibilidad se considera alta o baja dependiendo de la presión necesaria para expandir los pulmones. De la misma manera, el reducido diámetro de los alvéolos hace que el líquido que los recubre adquiera una gran tensión superficial, y por lo tanto mayor tendencia al colapso. Por esta razón, la superficie alveolar se encuentra cubierta por el factor surfactante, cuya principal función es disminuir la tensión superficial de éstos y evitar el colapso permanente. control nervioso y químico de la inspiración y espiración La respiración está controlada por el centro respiratorio bulbar, el cual responde a estímulos nerviosos (principalmente por medio del reflejo neumovagal de HeringBreuer) y químicos. La vía eferente nerviosa está dada por los nervios frénicos, espinales respiratorios y laríngeo inferior. La vía aferente está dada por el vago, glosofaríngeo, trigémino, laríngeo superior y los nervios sensitivos cutáneos y viscerales. La aorta y el seno carotídeo también son puntos de control reflejo por estímulos mecánicos y químicos. El control químico está dado por las concentraciones sanguíneas de oxígeno y dióxido de carbono. Las concentraciones elevadas de dióxido de carbono disminuirán el pH de la sangre, y esto excitará al centro bulbar produciendo una respiración más rápida y profunda. Por otro lado, una disminución en la concentración de dióxido de carbono, igualmente aumentará el valor del pH sanguíneo, resultando en una depresión del centro bulbar, lo cual disminuye la frecuencia respiratoria, así como la profundidad de las inspiraciones. Volúmenes respiratorios A) Volumen corriente (tidal). Es la cantidad de aire que entra o sale del pulmón en cada respiración. El valor aproximado es de 500 mL (Figura 2.1.3). B) Volumen de reserva inspiratoria. Corresponde al máximo volumen introducido a los pulmones en una inspiración forzada, después del volumen corriente. El valor aproximado es de 1 500 a 2 000 mL. C) Volumen de reserva espiratorio. Corresponde al máximo volumen expulsado de los pulmones en una espiración forzada, después del volumen corriente. El volumen aproximado es de 1 500 mL. D) Volumen residual. Es el volumen de aire que permanece en los pulmones después de una espiración máxima. Es imposible determinarlo mediante una espirometría, y sólo se puede cuantificar mediante la técnica de dilución de gases o la pletismografía corporal. Corresponde a 1 000 mL. E) Volumen residual funcional. Es la cantidad de aire en los pulmones después de una espiración normal, no máxima forzada. Tiene un valor aproximado de 2 500 mL. Es igual al volumen de reserva espiratorio más el volumen residual. En varios textos se considera como una capacidad pulmonar. 5 000 Volumen pulmonar (mL) 4 000 Volumen de reserva inspiratoria Capacidad inspiratoria Capacidad vital 3 000 Volumen normal o Volumen tidal 2 000 1 000 Capacidad pulmonar total Volumen de reserva espiratoria Capacidad residual funcional Volumen residual 0 Figura 2.1.3. Volúmenes y capacidades pulmonares expresados en una gráfica de espirometría. Book 2.indb 141 141 El diafragma es el músculo principal de la respiración, y se encuentra controlado por los nervios frénicos, los cuales provienen desde la tercera a la quinta costillas cervicales. Reflejo de Hering-Breuer: la distensión de los alvéolos provocará espiración, mientras que el colapso alveolar provoca la inspiración. ª Uno de los determinantes de la distensibilidad pulmonar es la presión intrapleural, pues si ésta se halla elevada, se requerirán mayores presiones para expandir los pulmones. ª El factor surfactante consiste en una mezcla de 90% de lípidos y 10% de proteínas. La fosfatidilcolina representa 70% de la porción lipídica, con un elevado contenido en forma no saturada. (dipalmitoilfosfatidilcolina); el segundo lípido más abundante es el fosfatidilglicerol (10%). La fosfatidiletanolamina, la esfingomielina, el fosfatidilinositol, la lipofosfatidilcolina y lípidos neutros están presentes en pequeñas cantidades. ª El volumen residual funcional es la cantidad de aire en los pulmones después de una espiración normal, no máxima forzada. Tiene un valor aproximado de 2 500 mL. sección 2 | Neumología negativa y facilitando así la entrada del aire. En algunas ocasiones será necesario un esfuerzo inspiratorio adicional, el cual está dado por músculos accesorios de la respiración, como los trapecios, escalenos y esternocleidomastoideos. Cuando los músculos inspiratorios se relajan, la presión pulmonar se vuelve positiva y el aire es expulsado (espiración). Cuando se requiere un esfuerzo espiratorio adicional se utilizan los músculos abdominales (oblicuo mayor, oblicuo menor, recto anterior y transversos), los intercostales internos, el cuadrado dorsal, el triangular del esternón y la porción inferior del serrato mayor. 3/2/15 2:47 PM 142 F) Volumen de espacio muerto. Es el aire que permanece en las regiones del árbol bronquial donde no hay intercambio gaseoso (por ejemplo, en la tráquea y los bronquios). Corresponde a 140 mL. G) Volumen máximo espirado en el primer segundo de una espiración forzada. Es el volumen que se expulsa en el primer segundo de una espiración forzada. Su valor normal es mayor a 80% del teórico. En el asma y en la enfermedad pulmonar obstructiva crónica se encuentra disminuido. El monóxido de carbono posee una altísima afinidad para la hemoglobina, aún más que el oxígeno (210 veces mayor). Las cantidades excesivas de carboxihemoglobina disminuyen el transporte normal de oxígeno. La intoxicación por monóxido de carbono sucede por aspiración abundante de este gas, tal y como sucede en incendios en lugares cerrados Capacidades pulmonares A) Capacidad vital. Es el volumen total que moviliza los pulmones, es decir, la suma del volumen corriente, el volumen de reserva inspiratorio y el volumen de reserva espiratorio. Otra forma de definirlo es como la cantidad total de aire que puede ser expulsado de los pulmones por medio de una espiración máxima forzada, después de una inspiración máxima forzada. Aproximadamente corresponde a 3 500 mL. B) Capacidad pulmonar total. Es el volumen de aire que hay en el pulmón posterior a una inspiración máxima forzada (Figura 2.1.3). C) Capacidad inspiratoria. Es la cantidad de aire que una persona puede respirar comenzando el nivel de una espiración normal e hinchando al máximo sus pulmones. Es igual al volumen corriente más el volumen de reserva inspiratorio, y equivale aproximadamente a 3 500 mL. Curvas de volumen-tiempo y de flujo-volumen de la espirometría Las curvas de volumen-tiempo expresan el tiempo necesario empleado para la espiración. Las curvas flujovolumen se encargan de relacionar el flujo espirado en cada instante con el volumen espirado en dicho momento (Figura 2.1.4). En las neumopatías de tipo obstructivo (asma y enfermedad pulmonar obstructiva crónica) se puede observar que la parte descendente de la curva flujovolumen aparece cóncavamente (la concavidad será directamente proporcional al grado de obstrucción), y el valor del flujo espirado pico será menor. En el mismo tipo de trastornos, en la curva de volumen-tiempo se observará que la pendiente de la curva es menor de lo normal y una espiración más prolongada (Figura 2.1.5). En las neumopatías de tipo restrictivo (por ejemplo, enfermedad pulmonar intersticial) las curvas de flujovolumen adquieren una morfología similar a la normal, pero con todos los volúmenes disminuidos, con A 5.0 Capacidad vital forzada Fracción espirada de volumen en el primer segundo 3.0 A 5 4 2.0 1.0 0.0 0.0 2.0 4.0 6.0 8.0 10.0 Flujo (L/seg) Volumen (L) 4.0 3 2 Tiempo (seg) B 1 10.0 Flujo (L/seg) 8.0 1 2 3 4 Volumen (L) 6.0 B 4.0 5 0.0 0.0 1.0 2.0 3.0 4.0 Volumen (L) Guía EXARMED FVC Figura 2.1.4. (A) Curva de volumen-tiempo normal donde se puede observar la forma de determinar la fracción espirada de volumen en el primer segundo y la capacidad vital forzada. (B) Curva de flujo-volumen normal donde se observa una fase de ascenso rápido hasta llegar al flujo espiratorio pico o máximo, y luego un descenso más lento hasta la base de la gráfica (momento que señala la capacidad vital forzada). Book 2.indb 142 Volumen (L) 2.0 4 3 2 1 1 2 3 4 5 6 7 Tiempo (s) Figura 2.1.5. Curvas de flujo-volumen (A), y de volumentiempo (B) de un paciente con una neumopatía obstructiva. 3/2/15 2:47 PM 143 8 6 Flujo (L/seg) IntERcAMBIo GAsEoso En condiciones normales existe un nivel de hemoglobina de 15 g/100 mL en sangre. Cada gramo de hemoglobina es capaz de transportar 1.34 mL de oxígeno. Realizando los cálculos matemáticos correspondientes se obtiene que por cada 15 g de hemoglobina se transportan 20.1 mL de oxígeno por cada 100 mL de sangre. El oxígeno se adhiere químicamente a la hemoglobina dependiendo de la tensión parcial del gas en sangre. Normalmente el oxígeno se encuentra a una presión parcial de 100 mm Hg, correspondiendo esto a una saturación de hemoglobina de 95%. A presiones parciales de oxígeno menores (como en venas y capilares donde la presión de oxígeno es alrededor de 40 mm Hg), la hemoglobina adquiere un valor de saturación de 75%. Se han descrito diversos tipos de hemoglobina según la interacción de ésta con el oxígeno, el dióxido de carbono y el hierro: a) Oxihemoglobina: hemoglobina saturada completamente de oxígeno. b) Desoxihemoglobina: hemoglobina sin oxígeno. c) Metahemoglobina: es cuando el hierro de la hemoglobina se oxida (es decir pasa de Fe2+ a Fe3+), perdiendo la capacidad de transporte de oxígeno. Esta hemoglobina se produce por la introducción de ciertas sustancias en el torrente sanguíneo (sulfonamidas, cloratos, nitratos, nitritos, anilina, fenacetinas). d) Carboxihemoglobina: es la hemoglobina ligada al monóxido de carbono (no al oxígeno ni al dióxido de carbono). e) Sulfahemoglobina: resulta de la unión irreversible de la hemoglobina con medicamentos como la fenacetina o las sulfonamidas. Es una forma que no puede transportar el oxígeno. La única solución es esperar a que termine el ciclo de vida normal de los eritrocitos afectados. f) Carbaminohemoglobina: se forma cuando el dióxido de carbono reacciona con los grupos amino de la hemoglobina. La afinidad de la hemoglobina por el oxígeno puede afectarse de diversas maneras según los estímulos que actúen sobre ésta. Esta afinidad disminuye por un pH reducido, aumento de la concentración de dióxido de carbono, aumento de la temperatura o del 2,3-difosfo- A 4 2 0 0 1 2 3 4 Volumen (L) 8 B Volumen (L) una fase inicial de ascenso rápida, un flujo espiratorio pico muy disminuido, y una fase de descenso con una pendiente en línea recta corta (lo cual significa que la capacidad vital forzada se encuentra disminuida). En la curva de volumen-tiempo también se observan los volúmenes disminuidos (Figura 2.1.6). 6 4 2 0 0 1 2 3 4 5 6 Tiempo (s) Figura 2.1.6. Curva de flujo-volumen (A), y de volumen-tiempo (B) de un paciente con una neumopatía restrictiva. glicerato. La afinidad aumenta con la disminución del dióxido de carbono, baja temperatura o del 2,3-difosfoglicerato o elevaciones del pH. sÍnDRoMEs PlEuRoPulMonAREs En el Cuadro 2.1.1 se describen los principales síndromes pleuropulmonares. neumotórax Book 2.indb 143 neumonía Atelectasia (condensación) Derrame pleural Asma Normal Normal Hiperinsuflación y uso de músculos accesorios de la respiración Inspección Normal o distensión del lado afectado Normal Palpación Frémito ausente Frémito disminuido Frémito aumentado y desplazamiento de los ruidos cardiacos hacia el lado afectado Frémito disminuido y Expansión y frémito desplazamiento de los disminuidos ruidos cardiacos hacia el hemitórax contralateral Percusión Timpanismo Matidez Matidez Matidez Timpanismo Auscultación Murmullo vesicular ausente Murmullo vesicular ausente Estertores crepitantes Murmullo vesicular ausente Espiración prolongada y sibilancias sección 2 | Neumología cuadro 2.1.1. Síndromes pleuropulmonares más frecuentes 3/2/15 2:47 PM 144 2. Neumonía adquirida en la comunidad INTRODUCCIÓN La mayor parte de las NAC queda sin aislamiento microbiológico, de ahí la importancia de iniciar el manejo con una terapia empírica dirigida al tomar en cuenta comorbilidades, antecedentes de exposición de riesgo y/o laborales, estrato de edad y antecedente de hospitalización o uso de antibiótico previos de cada paciente. Hasta 31% de los cuadros de neumonía puede ser secundario a un agente viral; la influenza es el agente más frecuente. Una definición general de la neumonía adquirida en la comunidad (NAC) puede ser aquella infección aguda del parénquima pulmonar producida por microorganismos adquiridos fuera del hospital; sin embargo, para poder catalogar una neumonía secundaria a microorganismos de la comunidad el paciente debe ser excluido de algunos criterios que lo pondrían en riesgo de una infección por microorganismos atípicos y/o resistentes. Para poder definir una NAC es necesario que: ésta inicie dentro de las primeras 48 h posteriores a un ingreso hospitalario; si el paciente llega a requerir intubación la neumonía deberá estar presente antes de las 48 h posteriores a la intubación (también en este caso al tomar en cuenta el criterio de un ingreso hospitalario de menos de 48 h de evolución); el paciente no haya estado hospitalizado por más de 48 h en los últimos 90 días; no sea residente de un asilo o albergue; no haya recibido manejo antibiótico intravenoso, quimioterapia o curación de heridas en fechas recientes (en los últimos 30 días); o que en la actualidad no se encuentre en hemodiálisis (específicamente en ámbito hospitalario o en clínica de hemodiálisis). Si el individuo presenta alguno de estos criterios, la neumonía se puede definir como asociada con cuidados de la salud, tema que se trata en el Capítulo 2.3. En la actualidad la neumonía todavía es un problema importante de salud en el mundo, ya que según las estadísticas de la OMS de 2011 fue la tercer causa de muerte (detrás de la cardiopatía isquémica y el evento vascular cerebral isquémico), con 6.7% de las defunciones totales (esto se puede modificar según el estrato socioeconómico y la población). La incidencia global varía, con un promedio que va de 8 a 15 por cada 1 000 personas/año de los cuales entre 22 y 42% requiere manejo hospitalario (10% de éstos en unidades de terapia intensiva). En México en el año 2010 la neumonía se reportó en el lugar 16 dentro de las causas de enfermedad y en el lugar 9 de las causas de mortalidad; se observó una tendencia en la que por arriba de los 50 años de edad la incidencia de NAC es 5 veces mayor en comparación del estrato comprendido entre las edades de 5 a 49 años de edad. Por lo anterior se puede inferir que existe una relación lineal entre la edad y la incidencia, ya que en mayores de 65 años de edad es 7 veces más frecuente al comparar contra los sujetos de 50 años de edad. Guía EXARMED ETIOLOGÍA Y FISIOPATOGENIA Book 2.indb 144 Dentro de la etiología aún persiste Streptococcus pneumoniae como el agente más frecuente, el cual se identifica de 5 a 55% de las veces según la serie; por lo general causa hasta dos terceras partes de las NAC con bacteriemia. En la actualidad se cuenta con medios sofisticados para la detección microbiológica de muchas variedades de infección, sin embargo aún existe un porcentaje muy grande que queda sin aislamiento (hasta 20 a 70% de los casos). Por lo anterior, siempre será muy importante conocer los factores de riesgo, las comorbilidades, los riesgos ocupacionales y el estrato de edad del paciente para tomar la mejor decisión en cuanto a la sospecha etiológica y elegir el antibiótico empírico que tenga una mayor posibilidad de cubrir el cuadro infeccioso que se presenta. Algunos ejemplos clásicos que se deben tomar en cuenta (pero que lamentablemente tampoco son una regla) son: Kebsiella pneumoniae se relaciona con pacientes diabéticos, abuso de alcohol y EPOC, anaerobios en consumo crónico de alcohol, Chlamydophila en contacto con aves, Staphylococcus aureus en diabéticos y posterior a episodios de influenza, y Pseudomonas aeruginosa se relaciona con comorbilidades que afectan el parénquima pulmonar que ocasiona bronquiectasias o fibrosis (Cuadro 2.2.1). Cerca de hasta 10 a 31% de las NAC pueden ser ocasionadas por un agente viral, de los cuales el más frecuente es la influenza. La fisiopatogenia del cuadro de neumonía tiene varios fundamentos, aunque uno de los más estudiados es el que se relaciona con una primoinfección con influenza que causa cambios que favorecen una sobreinfección bacteriana que origina un cuadro de neumonía. En estudios epidemiológicos se ha visto que la vacunación contra influenza no sólo disminuye la incidencia de cuadros tipo influenza, sino también los de neumonía, por lo cual siempre es importante preguntarse si el paciente está vacunado; de lo contrario deberá ser vacunado a su egreso hospitalario. CUADRO CLÍNICO El cuadro clínico puede ser algo típico y muy sugerente, como un paciente con mal estado general, fiebre, taquicardia, taquipnea, tos con o sin expectoración, todo asociado con una exploración física sugerente de NAC con disminución de ruidos respiratorios y/o estertores. Sin embargo hay que considerar que una alta proporción de los pacientes se presenta con signos y síntomas muy inespecíficos que van desde malestar general con cefalea, mialgias, náusea, vómito y diarrea en cuadros secundarios a agentes atípicos y viral, hasta faltar todos los síntomas y signos conocidos en pacientes ancianos o con muchas comorbilidades (con desgaste), incluso sin antecedente de fiebre, cuyo diagnóstico muchas veces se confirma por estudios de imagen, por lo regular tomografía de tórax. Los síntomas suelen ser agudos (menos de 1 semana de evolución) con tos asociada o no con expectoración, disnea, dolor torácico tipo pleurítico relacionado con un cuadro de síndrome de respuesta inflamatoria sistémica. El diagnóstico realizado sólo con el cuadro clínico y la exploración física es muy difícil, ya que las condiciones en que se debe presentar el paciente son muy específicas. Para poder escuchar estertores el foco neumónico debe estar cerca de la pared torácica; por ejemplo, los pacientes que buscan atención médica sólo por tos por lo regular tendrían un valor predictivo positivo para NAC bajo (cerca de 5%), sin embargo si se escuchan estertores la posibilidad diagnóstica podría aumentar pero sólo hasta 10% (valor que aún es insignificante para poder hacer un diagnóstico acertado sin más datos de apoyo); por el contrario, la posibilidad de NAC disminuye a 3% si no se escuchan estertores. Existen muchos síntomas y signos que se pueden buscar para guiarse hasta realizar el diagnóstico, sin embargo lo más adecuado siempre es combinar todos estos datos para poder aumentar la sensibilidad diagnóstica. Por ejemplo, existen criterios (puntaje de Heckerling) en los que se incluyen cinco variables (temperatura > 37.8 °C, frecuencia cardiaca > 100 lpm, estertores, dis- 3/2/15 2:47 PM 145 Cuadro 2.2.1. Condiciones clínicas asociadas con algunas causas de agentes causales de NAC Agente etiológico relacionado Alcoholismo Streptococcus pneumoniae anaerobios de la cavidad oral, Klebsiella pneumoniae, Acinetobacter sp, Mycobacterium tuberculosis EPOC y/o tabaquismo Haemophilus influenzae, Psuedomona aeruginosa, Legionella sp, S. pneumoniae, Moraxella catarrhalis, Chlamydophila pneumoniae Aspiración Enteropatógenos gramnegativos Absceso pulmonar S. aureus metilresistente adquirido en la comunidad, hongos, M. tuberculosis, micobacterias no TB Exposición a heces de murciélago o aves Histoplasma capsulatum Exposición a aves Chlamydophila psittaci, influenza aviar Exposición a conejos Francisella tularensis Exposición a animales de granja o gatos Coxiella burnetti (fiebre Q) Infección por VIH (temprana) S. pneumoniae, H. influenzae, M. tuberculosis Infección por VIH (tardía) Los listados para infección por VIH (temprana) más Pneumocystis jirovecii, Cryptococcus, Histoplasma, Aspergillus, micobacteria no TB, P. aeruginosa Estancia en un hotel o crucero en las últimas 2 semanas Legionella sp Viaje o residencia en el suroeste de Estados Unidos Coccidioides sp, Hantavirus Bronquiectasias P. aeruginosa, Burkholderia cepacia, S. aureus Uso de drogas intravenosas S. aureus, anaerobios, M. tuberculosis Obstrucción endobronquial Anaerobios, S. pneumoniae, H. influenzae, S. aureus minución del murmullo vesicular y ausencia de asma), donde cada variable presente equivale a 1 punto; si se obtienen 4 a 5 puntos tiene una sensibilidad de 38 a 41%, una especificidad de 92 a 97% y una probabilidad de momios (likelihood ratio, LR) de 8.2 para que los hallazgos sean secundarios a neumonía (al comparar a un paciente con 0 a 1 puntos, se tiene sensibilidad de 7 a 29%, especificidad de 33 a 65% y LR de 0.3). Hay que tomar en cuenta que muchas veces no se observan los signos clásicos de una neumonía, ya que los descritos en los textos de medicina clásicos se encuentran en pacientes con una neumonía que pudiera llevar varios días de evolución, pues los signos van apareciendo al acompañar la evolución del cuadro infeccioso. Un diagnóstico de neumonía se realiza guiado por los antecedentes más el cuadro clínico, pero siempre (que sea posible) confirmado por un estudio de imagen. Esta es la razón por la que en pacientes que no se presentan con un cuadro “florido” y datos que sugieran neumonía, pero tienen comorbilidades de riesgo, estrato de edad de riesgo o simplemente por estación de año relacionada con cuadros de infección de vías respiratorias, es preferible solicitar un estudio radiológico a fin de poder sustentar que no se trata de un cuadro neumónico, y en casos que persista la duda realizar una nueva revisión del paciente en 24 a 48 h. DIAGNÓSTICO Se puede realizar un diagnóstico presuntivo en el caso de un cuadro clínico sugerente, si es que no se cuenta con un estudio radiológico de apoyo; sin embargo, para poder realizar un diagnóstico definitivo (o por lo menos que tenga más sustento) es necesario obtener una imagen radiológica consistente en un infiltrado asociado con la clínica compatible con infección de vías respiratorias bajas con o sin el apoyo de un aislamiento microbiológico. Book 2.indb 145 En la actualidad en el manejo de cualquier tipo de infección se considera necesaria la toma de cultivos para lograr un aislamiento microbiológico. Para identificar a los pacientes que se pueden beneficiar de realizar una toma de cultivos de manera más dirigida, la American Thoracic Society (ATS) y la Infectious Diseases Society of America (IDSA) realizaron un conjunto de indicaciones como apoyo para la toma de decisiones. Por ejemplo, consideran necesario la toma de hemocultivos en pacientes con manejo intrahospitalario, leucopenia, consumo crónico de alcohol, enfermedad crónica hepática, asplenia, imágenes cavitarias en radiografía de tórax, antígenos contra neumococo positivos y presencia de derrame pleural; realizar toracocentesis en caso de derrame pleural y aspirado endotraqueal en caso de intubación orotraqueal. HEMOCULTIvOS El rendimiento va de 5 a 33%; en promedio hay un aislamiento microbiológico en menos de 20% de los casos. Los aislamientos más frecuentes se deben a S. pneumoniae (ya que es el más asociado con las bacteriemias), que llegan hasta a 60% de los aislamientos (sensibilidad para S. pneumoniae de 25%). Aunque se cuenta con rendimientos bajos, siempre es importante tomar hemocultivos para intentar lograr el aislamiento microbiológico. Las recomendaciones actuales son que siempre se debe realizar toma de hemocultivos en los pacientes hospitalizados con diagnóstico de NAC, a comparación de los pacientes con manejo ambulatorio en los que no se requiere. La utilidad también radica en que la presencia de bacteriemia en neumonía es un indicador de gravedad y afecta el pronóstico de forma negativa. EXPECTORACIÓN-CULTIvO El rendimiento diagnóstico varía según la serie que se estudie; éste va desde 34 a 86%. Para que una El diagnóstico de neumonía se realiza con los antecedentes más el cuadro clínico y se confirma con un estudio de imagen. Una indicación absoluta es la toma de hemocultivos en pacientes con neumonía que requieren hospitalización. Recordar que S. pneumoniae es el agente que más se asocia con bacteriemia por lo que es el que más veces se llega a aislar. Sección 2 | Neumología Condición 3/2/15 2:47 PM 146 Una muestra de esputo considerada adecuada es aquella que contiene menos de 10 células epiteliales y más de 25 neutrófilos por campo de 10 aumentos. El uso de las escalas de gravedad en neumonía son herramientas para apoyar la decisión de tratamiento; nunca tomarse como criterio definitivo y aislado para decidir si se requiere manejo hospitalario o ambulatorio. Guía EXARMED C: confusión; U: urea; BUN > 20 mg/dL; R: frec. respiratoria > 30 rpm; B: presión sistólica < 90 mm Hg o diastólica < 60 mm Hg, 65: ≥ 65 años de edad. S: presión sistólica; M: infiltrados multilobares; A: albúmina < 3.5; R: frec. respiratoria; T: taquicardia > 125 lpm; C: confusión; O: desaturación/ hipoxemia; P: pH arterial < 7.35. Book 2.indb 146 muestra se considere como buena para cultivo deberá tener menos de 10 células epiteliales y > 25 neutrófilos por campo de 10 aumentos. La tinción de Gram tiene una sensibilidad de 10%, y de manera ideal se deberá tomar previo al inicio de los antibióticos y procesarse no más de 2 h posteriores a su toma. Antígenos urinarios Hoy en día los antígenos que se buscan de manera intencional son contra S. pneumoniae y Legionella pneumophila (serogrupo 1). La sensibilidad varía de 65 a 80% para S. pneumoniae y es de 74% para Legionella; el tratamiento empírico en el caso de la NAC cubre de forma adecuada una infección por S. pneumoniae y Legionella (betalactámico + macrólido), lo cual hace que el solicitar este estudio sea controversial; no obstante, aunque no es un requisito en el abordaje, siempre se debe intentar un aislamiento microbiológico con el fin de mejorar la epidemiología local y el manejo de NAC futuras en la población (claramente este precepto se aplica en todos los cultivos que se soliciten). Para ambos antígenos urinarios se tiene una gran especificidad cuando son positivos, sin embargo tienen una sensibilidad muy baja, lo cual traduce que en el caso de ser negativos no excluye una infección por estos agentes. Para tenerlo en consideración, se ha visto que los antígenos urinarios son más sensibles al compararlos contra el estudio de Gram y el cultivo de expectoración (muy útiles si el paciente no expectora). Broncoscopia y lavado broncoalveolar Reservados para pacientes graves que no responden o en pacientes inmunosuprimidos con sospecha de infección por atípicos, oportunistas u hongos; cuentan con una sensibilidad de 49%. La detección microbiológica de agentes atípicos como Mycoplasma pneumoniae, Chlamydia pneumoniae e influenza no es necesaria en casos de NAC leve o moderado por su dificultad para detección por técnicas de reacción en cadena de la polimerasa; su búsqueda intencionada sólo se considera necesaria en casos no respondedores al manejo inicial, que contiene cobertura empírica para agentes atípicos y por lo general tiene desenlaces favorables (excepto influenza que requiere la sospecha diagnóstica para agregar un manejo antiviral, depende de la situación epidemiológica específica de cada centro para incluir su cobertura en el manejo empírico inicial). Marcadores de inflamación A través del tiempo se ha intentado desarrollar un marcador que ayude a la toma de decisiones en cuanto a poder establecer si un paciente tiene una infección bacteriana. Los que más se han estudiado son la procalcitonina y la proteína c reactiva (PCR). La procalcitonina es útil para poder guiar la sospecha clínica hacia una NAC bacteriana (por lo general un corte > 0.25 ug/L), sin embargo habrá que considerar que no se trata de un marcador agudo, pues aumenta posterior a 6 h de infección, por lo que puede cambiar con mediciones seriadas. En la actualidad la procalcitonina y la PCR son apoyos al diagnóstico, no componentes esenciales para realizarlo, y su utilidad actual radica en que valores elevados se han relacionado con un peor pronóstico por asociarse con cuadros más graves; por ejemplo, una PCR < 100 mg/L al ingreso se relaciona con menor mortalidad y bajo riesgo de requerir ventilación mecánica a 30 días y una falta de disminución de la misma de 50% al cuarto día de tratamiento se vincula con un mal pronóstico. Radiografía de tórax posteroanterior y lateral Como ya se mencionó, la evidencia radiológica es necesaria para poder establecer el diagnóstico de neumonía. En caso de que la sospecha sea grande y se obtenga una placa normal, se puede optar por dos opciones: iniciar tratamiento empírico y realizar una nueva placa a las 24 a 48 h o realizar una tomografía de tórax en ese momento para documentar algún infiltrado sugerente de proceso infeccioso. Algunos patrones radiológicos pueden sugerir el agente causal, pero ningún patrón es específico de un agente; por ejemplo, S. pneumoniae es el que con más frecuencia ocasiona una consolidación lobar, y la neumonía con un patrón intersticial orienta más a una etiología por atípicos como Mycoplasma o vírica. TRATAMIENTO Para decidir el manejo es necesario determinar el riesgo del paciente con las múltiples herramientas con las que se cuenta, ya que con éstas se podrá tener un dato importante extra con el que será posible sustentar la decisión de un tratamiento ambulatorio o la necesidad de hospitalizar a un paciente, y en dado caso decidir si requiere hospitalización en un servicio de terapia intensiva o no. Hay varias escalas, como el índice de severidad de neumonía (PSI), CURB-65, CRB-65, SMART-COP y otras; al contar con todas éstas, lo importante es saber para qué situaciones sirve cada una y cuál es la que mejor se adecúa a las características del paciente. • Índice de severidad de neumonía (PSI): herramienta pronóstica que define la severidad de la NAC con base en la predicción de mortalidad a los 30 días al clasificar a los pacientes en cinco diferentes clases mediante hasta 20 variables estandarizadas. La mortalidad aumenta junto con la clase, que va desde 0.4% en la clase I hasta 31% en la clase V. Una consideración al utilizar esta herramienta es que no toma en cuenta las condiciones sociales del paciente (red de apoyo, que en realidad siga las indicaciones) y el estado de inmunidad del paciente, lo que con facilidad puede cambiar la decisión de hospitalizar o no a un paciente. Se puede considerar la toma de decisión de la siguiente forma: PSI clases I y II manejo ambulatorio, clase III probable hospitalización corta y clases IV/V por lo general hospitalización necesaria. • CURB-65 y CRB-65: escalas que no se han validado en gran medida, como sí es el caso de la PSI; sin embargo se ha observado que cuentan con una buena correlación en cuanto a gravedad y mortalidad en la decisión de manejo ambulatorio versus intrahospitalario. Son escalas rápidas de implementar, por lo que se consideran útiles para la valoración inicial en el servicio de urgencias. • SMART-COP: esta escala es de utilidad en pacientes que ya están ingresados para poder calcular el riesgo de requerir apoyo ventilatorio invasivo y apoyo vasopresor. Sin tomar en cuenta la escala que se decida usar, hay que considerar que en varios estudios se ha notado que la hipoxemia y/o la desaturación son un factor predictivo independiente para mortalidad y morbilidad en pacientes con NAC, por lo que habrá que valorar el ingreso hospitalario en dicha situación. Las escalas antes mencionada si bien no son las únicas, sí se consideran como las más usadas. 3/2/15 2:47 PM 147 Una vez que se decidió dar manejo intrahospitalario, lo siguiente es determinar si el paciente cuenta con algún criterio de gravedad para que su manejo se lleve a cabo en un área de cuidados intensivos, lo que se puede definir como la presencia de un criterio mayor o tres criterios menores (Cuadro 2.2.2). Cuadro 2.2.2. Criterios de gravedad en NAC Criterios menores • • • • • • • • • • • • • • • • Frecuencia respiratoria ≥ 30 rpm (o uso de ventilación mecánica no invasiva) PaO2/FiO2 ≤ 250 (o uso de ventilación mecánica no invasiva) Infiltrados multilobares Confusión/desorientación Uremia (BUN ≥ 20 mg/dL) Leucopenia < 4 000 células/mm3 (como resultado de un proceso infeccioso) Trombocitopenia < 100 000 plaq/mm Hipotermia (< 36 °C) Hipotensión que requiere fluidoterapia agresiva Hipoglucemia (en paciente no diabético) Síndrome de abstinencia por alcohol Hiponatriemia Cirrosis Asplenia Acidosis metabólica no explicable Hiperlactatemia Criterios mayores • • Ventilación mecánica invasiva Choque séptico con requerimiento de vasopresores La aplicación de la primer dosis de antibiótico de forma ideal deberá ser posterior a la toma de cultivos y dentro de las primeras 8 h desde el diagnóstico de NAC (disminuye la probabilidad de muerte y estancia hospitalaria); sin embargo si la toma de cultivos no se puede realizar por alguna situación, es preferible iniciar el manejo en lugar de esperar a la toma de los mismos. El tratamiento inicial siempre será empírico; éste se debe determinar según la epidemiología local, el estrato de edad del paciente, las comorbilidades que presenta, los antecedentes de hospitalización, el uso de antibióticos y los aislamientos microbiológicos previos. La mayor parte de las veces el patógeno a cubrir de manera inicial es S. pneumoniae (Cuadro 2.2.3). Indicaciones para manejo combinado: • Enfermedadcrónica:cardiaca,respiratoria,hepática o renal • Diabetesmellitus • Alcoholismo • Asplenia • Inmunosupresión(porenfermedadomedicamento) • Presenciademalignidad • Usodeantibióticosenlosúltimos3meses • NACseveraconosincomorbilidades En México no es recomendable dar manejo inicial con fluoroquinolonas, ya que la prevalencia de tuberculosis es alta, y el uso de ésta sin descartar infección por tuberculosis puede ocasionar resistencia a antifímicos. La elección de la vía de administración (intravenosos o vía oral) depende de la biodisponibilidad del antibiótico, la tolerancia a la vía oral y las condiciones clínicas del paciente. Se debe hacer el cambio intravenoso a vía oral cuando el paciente presenta mejoría clínica en la sintomatología respiratoria, afebril las últimas 8 h, conteo de leucocitos normal o mejorado (disminución > 10% del valor de ingreso) y vía oral/absorción gas- Cuadro 2.2.3. Recomendaciones de manejo empírico según situación clínica Ambulatorio sin comorbilidades: monoterapia Betalactámicos o macrólidos (p. ej., amoxicilina 500 mg cada 8 h o claritromicina 500 mg cada 12 h) por 7 a 10 días *Alergia a betalactámicos: doxiciclina o aztreonam Ambulatorio con comorbilidades: manejo combinado 1) Betalactámicos + macrólidos (p. ej., amoxicilina-clavulanato + claritromicina) por 7 a 10 días 2) Fluoroquinolona respiratoria (p. ej., moxifloxacino o levofloxacino) Hospitalario (no UTI) Betalactámicos + macrólidos. En caso de alergia a betalactámicos se puede optar por fluoroquinolonas (levofloxacino 750 mg/día) pero se deberá descartar TB en lugares de alta prevalencia Hospitalario (UTI)/sin riesgo para Pseudomona Betalactámico + macrólido durante 7 a 10 días (se puede extender hasta 14 días por gravedad según respuesta al tratamiento) Hospitalario (UTI)/con riesgo para Pseudomona Agente antipseudomona y antineumococo (cefepime, ceftazidima, piperacilina/tazobactam, imipenem o meropenem) o terapia combinada con aminoglucósidos o fluoroquinolonas con acción antipseudomona (ciprofloxacino) durante 14 días • Sospecha de aspiración Amoxicilina/ácido clavulánico o moxifloxacino o ertapenam o clindamicina + cefalosporina de tercera generación por 14 días • Sospecha de S. aureus metilresistente Agregar vancomicina o linezolid al manejo antimicrobiano • Sospecha de patógeno productor de betalactamasa (BLEE) Carbapenémicos como primera opción *Si existe sospecha de un origen viral se puede iniciar manejo empírico con oseltamivir asociado con manejo antimicrobiano; en últimos estudios se ha visto un beneficio de hasta 5 días del inicio del cuadro infeccioso con disminución del tiempo de hospitalización y la propagación viral. Book 2.indb 147 Sección 2 | Neumología Situaciones especiales 3/2/15 2:47 PM 148 Falla al tratamiento Se presenta hasta en 10 a 25% de los casos; la mayoría de las veces se debe a diagnóstico inicial incorrecto, mala elección de antibiótico, dosis o duración inadecuada del mismo, infección grave o presencia de complicaciones locales o a distancia (derrame pleural, empiema, absceso). En caso de persistir con un cuadro clínico compatible con NAC, a pesar de tratamiento médico adecuado, está indicado realizar una nueva radiografía para poder descartar que exista una falla al tratamiento y progresión de la NAC. Las imágenes radiológicas pueden persistir hasta en 50% de los casos a las 4 semanas del tratamiento, por lo que se deben interpretar en el contexto clínico y no considerar falla al tratamiento con base sólo en la imagen. Si a las 6 semanas no hay aunque sea una resolución parcial de las imágenes radiológicas en un paciente asintomático, se deberán considerar diagnósticos alternos (p. ej., vasculitis, obstrucción endobronquial, otros). No es necesario repetir una radiografía de tórax en un paciente que tiene una respuesta clínica adecuada al tratamiento médico. Las indicaciones para realizar una tomografía de tórax en los pacientes con sospecha de NAC incluyen sospecha de una complicación (p. ej., empiema), o pacientes que no presentan una mejoría con el tratamiento adecuado o en los que se tiene una fuerte sospecha de neumonía, pero la radiografía de tórax fue inconclusa (hasta 27% de las radiografías de tórax sin evidencia de NAC cuenta con evidencia de neumonía mediante estudio de tomografía). PREVENCIÓN a) Vacuna contra neumococo (23 serotipos): eficacia de 75% para prevenir bacteriemia y meningitis por neumococo. Indicada en pacientes de 2 a 59 años de edad con factores de riesgo: asplenia, disfunción grave del bazo, enfermedad crónica renal, cardiaca, pulmonar o hepática, diabetes, inmunodeficiencia e inmunosupresión por VIH o residentes de centros de cuidado a largo plazo (asilos). Se debe aplicar en todo paciente ≥ 60 años de edad antes del egreso. Esquema: revacunación cada 5 años (puede aplicarse de manera concomitante a la de influenza, pero en sitios separados). No recomendado en embarazadas b) Vacuna contra influenza: indicada en sujetos de 6 meses a 49 años de edad con factores de riesgo: enfermedad crónica cardiaca, renal, neurológica y respiratoria (incluye asma), inmunosupresión, hemoglobinopatías, embarazo, diabetes, residentes de asilos. Se debe aplicar en todo paciente de 50 años de edad en adelante. Esquema: anual. Contraindicación: hipersensibilidad al huevo Considerar búsqueda intencionada de VIH en pacientes jóvenes con factores de riesgo y sin comorbilidades o uso de medicamentos que pudieran explicar inmunosupresión. Guía EXARMED Se puede realizar un diagnóstico de neumonía por medio de tomografía hasta en 27% de las radiografías de tórax en las que no se documentó neumonía por imagen. trointestinal adecuada. Respecto a la duración del tratamiento y la mortalidad, no se ha visto beneficio cuando el tratamiento ambulatorio tiene una duración menor o mayor a 7 días. En pacientes hospitalizados en general la duración del tratamiento será de 10 días, sin embargo lo más adecuado es llevar éste de la mano con la respuesta clínica de cada paciente. Si se asocia con riesgo para Pseudomonas, bacteriemia, o infección por Legionella o S. aureus, la duración se deberá extender hasta 14 días. Para considerar a un paciente apto para el egreso hospitalario se debe tener a un individuo hemodinámicamente estable, con tolerancia a la vía oral y afebril por un periodo de por lo menos 48 h. Book 2.indb 148 3/2/15 2:47 PM 149 3. Neumonía nosocomial epideMioLogÍa La neumonía nosocomial, la neumonía asociada con el ventilador y la neumonía relacionada con cuidados de la salud aún son causas importantes de morbilidad y mortalidad, a pesar de los avances en terapia antimicrobiana, los cuidados de soporte y las medidas preventivas. La incidencia de neumonía intrahospitalaria es de 15 casos por cada 1 000 admisiones hospitalarias. Ésta es la principal causa de muerte entre las infecciones adquiridas de forma intrahospitalaria, con un porcentaje de mortalidad estimado entre 22 a 60%. Así mismo, la neumonía intrahospitalaria representa más de 25% de las infecciones en la unidad de terapia intensiva y se relaciona con más de 50% de los antibióticos prescritos. La neumonía asociada con el ventilador ocurre en 9 a 27% de los pacientes intubados, y representa el mayor riesgo durante los primeros días. Ésta es 6 a 20 veces mayor a la reportada en pacientes no ventilados. La importancia de estas patologías recae en el riesgo incrementado de colonización e infección por organismos multidrogorresistentes, lo que representa un reto terapéutico y epidemiológico. deFiNicioNes NeUMoNÍa NosocoMiaL Neumonía que se diagnostica después de 48 h de la admisión hospitalaria. Se descartan los casos que requieren intubación y ventilación mecánica al momento de la admisión. Neumonía intrahospitalaria temprana Neumonía que ocurre durante los primeros 4 días de hospitalización. Por lo regular implica un mejor pronóstico y se asocia con bacterias sensibles a antibióticos. Neumonía intrahospitalaria tardía Neumonía que ocurre después de 5 días de hospitalización. Implica mayor mortalidad y se vincula más a menudo con microorganismos multidrogorresistentes. NeUMoNÍa asociada coN eL VeNtiLador Se refiere a la neumonía que ocurre después de 48 a 72 h del inicio de intubación orotraqueal y ventilación mecánica. NeUMoNÍa asociada coN cUidados de La saLUd Pacientes diagnosticados con neumonía con antecedente de hospitalización por 2 o más días dentro de los 90 días previos a la infección; residentes en asilos o lugares de cuidado a largo plazo; antecedente de antibióticos intravenosos, quimioterapia o tratamiento de heridas en los 30 días previos a la infección; o antecedente de hemodiálisis. etioLogÍa La neumonía intrahospitalaria, asociada con el ventilador o con cuidados de la salud puede ser causada por un amplio espectro de patógenos, suele ser polimicrobiana y en raras ocasiones se debe a virus u hongos en pacientes inmunocompetentes. Los patógenos más comunes incluyen bacilos aerobios gramnegativos como Book 2.indb 149 Pseudomonas aureginosa, Escherichia coli, Klebsiella pneumoniae y especies de Acinetobacter. Las infecciones por cocos grampositivos como Staphylococcus aureus, en particular S. aureus resistente a meticilina, cada vez presentan una mayor incidencia. P. aureginosa es el patógeno bacteriano multidrogorresistente que se asocia con más frecuencia a neumonía intrahospitalaria y neumonía asociada con el ventilador. Los pacientes con neumonía intrahospitalaria tardía y neumonía asociada con el ventilador tienen mayor riesgo de infecciones por organismos multidrogorresistentes que los pacientes con neumonía intrahospitalaria temprana y neumonía asociada con cuidados de la salud. El mayor riesgo de organismos multidrogorresistentes se vincula de manera directa con un mayor riesgo en mortalidad. En el Cuadro 2.3.1 se describen los factores de riesgo para la adquisición de patógenos multidrogorresistentes. El riesgo de infección por Legionella pneumophila ocurre en el contexto de agua colonizada o edificios en construcción. Los virus y hongos nosocomiales son causas raras en pacientes inmunocompetentes. Se han reportado brotes de influenza de forma esporádica. El virus herpes simple y el citomegalovirus pueden causar reactivación viral en pacientes intubados sin criterios habituales de inmunosupresión. Los pacientes con síndrome de insuficiencia respiratoria aguda y aquellos que reciben manejo con esteroides se encuentran en mayor riesgo. La colonización del tracto respiratorio inferior por especies de Candida afecta a 18 a 56% de pacientes intubados y se asocia con un riesgo incrementado de neumonía asociada con el ventilador de origen bacteriano, principalmente por P. aureginosa. La neumonía intrahospitalaria es aquella que se diagnostica 48 h después de la admisión. La neumonía asociada con el ventilador es la que se diagnostica 48 a 72 h después del inicio de la ventilación mecánica. La neumonía intrahospitalaria suele tener un origen polimicrobiano. P. aureginosa es el patógeno multidrogorresistente que con más frecuencia se vincula con neumonía intrahospitalaria y asociada con el ventilador. FisiopatoLogÍa La neumonía ocurre cuando los patógenos colonizan, persisten e invaden las vías respiratorias bajas y superan las defensas del huésped. Estas últimas pueden ser mecánicas como el epitelio ciliado y el moco; humorales que incluyen el sistema de anticuerpos y de complemento; y celulares que comprenden polimorfonucleares, macrófagos y linfocitos. Las fuentes de infección incluyen equipos médicos, aire, agua y fómites. La aspiración de patógenos por la orofaringe o la fuga de bacterias alrededor del tubo endotraqueal son las principales Las fuentes de infección incluyen equipos médicos, aire, agua y fómites. cuadro 2.3.1. Factores de riesgo para infección por microorganismos multidrogorresistentes Terapia antimicrobiana en los 90 días previos al diagnóstico Hospitalización actual por más de 5 días Alta frecuencia de resistencia a antibióticos en la comunidad o la unidad hospitalaria Presencia de factores de riesgo para neumonía asociada con cuidados de la salud • Hospitalización por más de 2 días en los 90 días precedentes • Residencia en asilos o lugares de cuidado a largo plazo • Terapia de infusión ambulatoria (incluidos antibióticos) • Diálisis crónica en los 30 días previos • Miembro de la familia con patógenos multidrogorresistentes Enfermedad o terapia asociada con inmunosupresión sección 2 | Neumología iNtrodUcciÓN 3/2/15 2:47 PM 150 La presencia de síntomas respiratorios, sepsis o desaturación de oxígeno sugiere el diagnóstico de neumonía. Debe realizarse hemocultivo en todos los pacientes con neumonía asociada con el ventilador. La medición de procalcitonina es útil para desescalamiento antibiótico. Guía EXARMED Una vez realizado el diagnóstico de neumonía no debe retrasarse el manejo antibiótico empírico. La elección del tratamiento antibiótico empírico depende del inicio de la neumonía y el riesgo para patógenos multidrogorresistentes. Book 2.indb 150 rutas de entrada de microorganismos en la tráquea. La presencia de biofilm infectado en el tubo endotraqueal con la embolización secundaria a vías respiratorias distales es uno de los factores patogénicos más importantes. El estómago y los senos paranasales se han descrito como reservorios potenciales para ciertas bacterias, aunque con menor frecuencia. Los factores de colonización asociados con el huésped y su tratamiento incluyen enfermedad de base, cirugía previa, exposición a antibióticos y otros fármacos, así como la exposición a dispositivos respiratorios invasivos. Factores de riesgo Los factores de riesgo para el desarrollo de neumonía nosocomial se dividen en factores modificables y no modificables. Los factores relacionados con el huésped son: género masculino, presencia de enfermedades pulmonares preexistentes y falla orgánica múltiple. La duración de la ventilación mecánica por más de 5 días y la presencia de una puntuación de APACHE II > 18 al momento de la hospitalización se han asociado de manera significativa con el diagnóstico de neumonía relacionada con el ventilador. Los factores de riesgo modificables se convierten en objetivos para mejorar el manejo en pacientes hospitalizados y crear estrategias de profilaxis. Factores de riesgo modificables La intubación mecánica incrementa el riesgo de neumonía de forma dramática, por lo que debe evitarse siempre que sea posible. El uso de ventilación mecánica no invasiva se ha estudiado en pacientes con exacerbaciones de enfermedad pulmonar obstructiva crónica e individuos inmunocomprometidos, y ofrece una alternativa con menor riesgo de infecciones nosocomiales. Otras alternativas que reducen el riesgo de neumonía asociada con el ventilador incluyen protocolos de secuencia de intubación rápida, protocolos de destete, mantenimiento de presión en el tubo endotraqueal > 20 cm H2O para evitar el paso de bacterias a vías respiratorias bajas, uso de sondas orotraqueales, aspiración continua de secreciones subglóticas, colocación del paciente con la cabecera a 45º y uso de dispositivos de alimentación enteral pospilórica. La modulación en la colonización es una maniobra que mediante la descolonización del tubo digestivo con antibióticos orales disminuye el riesgo de neumonía intrahospitalaria, sin embargo el uso de antibióticos por periodos prolongados de forma profiláctica se asocia con un incremento en el riesgo de infección por microorganismos multidrogorresistentes. El uso de profilaxis de úlceras gástricas por estrés con antagonistas de receptores de histamina H2 y antiácidos se vincula como factor de riesgo independiente para el desarrollo de neumonía intrahospitalaria en unidades de terapia intensiva. El antecedente de transfusiones múltiples y el descontrol glucémico son otros factores de riesgo relacionados con la neumonía intrahospitalaria en pacientes críticos. CUADRO CLÍNICO El diagnóstico de neumonía nosocomial se sospecha en un paciente con datos sugestivos de infección, como fiebre de inicio reciente, tos, esputo purulento, leucocitosis, aumento en la frecuencia respiratoria y desaturación arterial de oxígeno. Estos síntomas pueden aparecer de manera gradual o súbita. Los pacientes con neumonía asociada con el ventilador suelen ser incapaces de ofre- cer datos clínicos debido a que están sedados o a que su capacidad para comunicarse se ve alterada por el tubo endotraqueal o los tubos de nutrición enteral. A la exploración física los datos más relevantes son la presencia de fiebre, así como el aumento en el trabajo respiratorio y de las secreciones traqueobronquiales. A la auscultación los pacientes presentan estertores roncantes difusos y asimétricos debido a las secreciones que éstos son incapaces de movilizar. A menudo los estertores se acompañan de hallazgos locales como disminución en los ruidos respiratorios. Otros hallazgos comunes incluyen broncoespasmo, hemoptisis y anormalidades sistémicas como encefalopatía y sepsis. En pacientes bajo ventilación mecánica, el aumento en los requerimientos del parámetro del ventilador suele ser uno de los datos más tempranos que orientan al diagnóstico. DIAGNÓSTICO El diagnóstico de neumonía intrahospitalaria, asociada con el ventilador o con cuidados de la salud, al igual que en el caso de neumonía adquirida en la comunidad, requiere la presencia de datos clínicos compatibles con infección en el contexto de un infiltrado nuevo o progresión de inflitrados pulmonares mediante algún estudio de imagen. Las pruebas diagnósticas tienen dos objetivos: primero, definir si el paciente tiene neumonía como explicación de signos o síntomas de reciente inicio; y, más adelante, determinar el patógeno etiológico. El estudio inicial es la radiografía de tórax; cuando sea posible, como en el caso de pacientes no intubados, debe ser con proyección posteroanterior y lateral. El estudio de imagen permite además definir la severidad de la neumonía (multilobar o no) y la presencia de complicaciones como derrame pleural o cavitaciones. Ante la presencia de derrame pleural masivo o derrame pleural en el contexto de sepsis debe realizarse toracocentesis para descartar empiema o derrame pleural paraneumónico. El diagnóstico definitivo requiere un abordaje clínico. De acuerdo con la American Thoracic Society (ATS) y la Infectious Diseases Society of America (IDSA) se requiere la presencia de un nuevo infiltrado o la progresión del mismo más al menos dos de las tres características clínicas siguientes: fiebre > 38 ºC; leucocitosis o leucopenia; o secreciones purulentas. En este contexto no debe retrasarse el inicio de manejo antibiótico empírico. El diagnóstico de neumonía intrahospitalaria es complicado debido a que en este grupo de pacientes la presencia de infiltrados pulmonares en el contexto clínico de sospecha tiene una alta sensibilidad, pero una baja especificidad. En el Cuadro 2.3.2 se describen los diagnósticos diferenciales de neumonía intrahospitalaria. Todos los pacientes con sospecha de neumonía asociada con el ventilador deben ser hemocultivados, ya que la presencia de un cultivo positivo puede indicar el origen de la neumonía o la presencia de infecciones extrapulmonares. En todos los pacientes con neumonía intrahospitalaria deben obtenerse muestras de tracto respiratorio inferior antes de iniciar manejo antibiótico y antes de realizar cambios en el mismo. Las muestras incluyen aspirado endotraqueal o muestras de lavado o cepillado bronquioalveolar. La causa de la neumonía se define por cultivos semicuantitativos de muestras de aspirado endotraqueal o esputo con examinación microscópica inicial. La tinción 3/2/15 2:47 PM 151 cuadro 2.3.2. Diagnóstico diferencial de neumonía nosocomial diagnóstico diferencial características Traqueobronquitis • • • • Síndrome de insuficiencia respiratoria aguda • Infiltrados pulmonares bilaterales • Índice PaO2/FiO2 bajo • PEEP Insuficiencia cardiaca aguda • • • • • Infiltrados pulmonares bilaterales Antecedente de cardiopatía Síndrome coronario agudo (cambios electrocardiográficos, elevación de biomarcadores) En caso de derrame pleural, líquido de características de trasudado Ecocardiograma Sinusitis aguda • • • • Síntomas respiratorios Ausencia de infiltrados pulmonares Presencia de sonda nasoenteral Diagnóstico mediante tomografía de senos paranasales Hemorragia alveolar • • • • Enfermedades autoinmunitarias Descenso de hemoglobina Hemoptisis Infiltrados multilobares Tromboembolia pulmonar • • • • Trombosis venosa profunda Factores de riesgo (inmovilización, antecedente de cirugía, neoplasia) Disfunción ventricular derecha Diagnóstico mediante angiotomografía de arterias pulmonares Neoplasia • Factores de riesgo (tabaquismo, lesiones metastásicas) • Diagnóstico anatomopatológico Síntomas respiratorios Sepsis Aislamiento microbiológico en aspirado endotraqueal Ausencia de infiltrados en estudio de imagen trataMieNto Una vez que se realiza el diagnóstico de neumonía intrahospitalaria, asociada con el ventilador o Book 2.indb 151 cuidados de la salud, el inicio de manejo antibiótico empírico es imperativo. La decisión del esquema inicial se basa en la presencia o no de factores de riesgo para patógenos multidrogorresistentes (Cuadro 2.3.1) y de si se trata de una infección temprana o tardía. El espectro antibiótico, la dosis efectiva, los perfiles farmacocinéticos y los efectos adversos se deben revisar de manera constante por un comité especializado. La terapia antibiótica empírica inicial para pacientes con neumonía intrahospitalaria y asociada con el ventilador sin factores de riesgo para organismos multidrogorresistentes se resume en el Cuadro 2.3.3. En el Cuadro 2.3.4 se resume el manejo para pacientes con neumonía intrahospitalaria y asociada con el ventilador con factores de riesgo para organismos multidrogorresistentes. En este grupo se incluyen todos los pacientes que cumplen con la definición de neumonía asociada con cuidados de la salud. rUta Y dUraciÓN deL trataMieNto Para obtener un pronóstico adecuado, además del uso de antibióticos específicos se requiere asegurar dosis óptimas y rutas de administración correctas. Todos los pacientes con neumonía intrahospitalaria y asociada con el ventilador deben recibir terapia inicial intravenosa. La terapia combinada se recomienda para evitar la emergencia de resistencia para organismos gramnegativos como P. aureginosa. Esta terapia debe incluir diferentes clases de antibióticos para evitar antagonismo de los mecanismos terapéuticos. En pacientes con neumonía sin factores de riesgo para microorganismos multidrogorresistentes la monoterapia puede ser una El tratamiento inicial debe incluir antibióticos intravenosos. sección 2 | Neumología de Gram de leucocitos polimorfonucleares y macrófagos, así como la examinación de la morfología bacteriana, mejoran la eficacia diagnóstica. Por otro lado, la ausencia de bacterias o células inflamatorias en pacientes con cambios recientes en esquema antibiótico ofrece un fuerte valor predictivo negativo para la etiología bacteriana en pacientes con neumonía asociada con el ventilador; en este contexto la infección por Legionella o virus respiratorios es posible. Si el muestreo broncoscópico no está disponible de forma inmediata, la toma de muestras no broncoscópicas para estudios cualitativos puede ayudar a guiar las decisiones terapéuticas. Se ha evaluado la utilidad de diversos biomarcadores como herramientas complementarias. Éstos incluyen: la expresión en lavado bronquioalveolar del receptor soluble activado en células mieloides tipo 1 (sTREM-1) con resultados poco concluyentes; la proteína C reactiva de baja sensibilidad en pacientes críticos; la concentración en lavado bronquioalveolar de interleucina 1beta, interleucina 8, factor estimulante de colonia de granulocitos, y proteína inflamatoria de macrófagos 1-alfa, aún sin estudios que puedan validarlos; la medición de copeptina, factor auricular natriurético midregional y adromedulina con utilidad más pronóstica que diagnóstica; y, por último, la medición de procalcitonina que ha demostrado ser un excelente biomarcador de respuesta a tratamiento y una herramienta para desescalamiento antibiótico con un punto de corte de 0.5 ng/mL o disminución de 80% con respecto a nivel basal. 3/2/15 2:47 PM 152 Cuadro 2.3.3. Terapia antibiótica empírica inicial para neumonía intrahospitalaria temprana y asociada con el ventilador* Patógenos potenciales Antibiótico recomendado Streptococcus pneumoniae Haemophilus influenzae Staphylococcus aureus sensible a meticilina Bacilos gramnegativos sensibles • Escherichia coli • Klebsiella pneumoniae • Especies de Proteus • Serratia marcescens Ceftriaxona o Levofloxacino, moxifloxacino o ciprofloxacino o Ampicilina/sulbactam o Ertapenem *En pacientes sin factores de riesgo para microorganismos multidrogorresistentes de cualquier severidad. Cuadro 2.3.4. Terapia empírica inicial para neumonía intrahospitalaria tardía, asociada con el ventilador o vinculada con cuidados de la salud* Patógenos potenciales Terapia antibiótica combinada Patógenos listados en el Cuadro 2.3.3 y patógenos multidrogorresistentes • Pseudomonas aureginosa • Klebsiella pneumoniae productora de betalactamasas de espectro extendido • Especies de Acinetobacter • Staphylococcus aureus resistente a meticilina • Legionella pneumophila Cefalosporina antipseudomonas (cefepime, ceftazidima) o Carmapenémico antipseudomonas (imipenem, meropenem) o Betalactámico/inhibidor de betalactamasa (piperacilina/tazobactam) + fluoroquinolona antipseudomonas (ciprofloxacino, levofloxacino) o Aminoglucósido (amikacina, gentamicina, tobramicina) + linezolid o vancomicina *Pacientes con riesgo de patógenos multidrogorresistentes de cualquier severidad. Realizar desescalamiento una vez que se obtengan aislamientos microbiológicos. Guía EXARMED La falta de respuesta puede deberse a mala cobertura, diagnósticos diferenciales o presencia de complicaciones. Book 2.indb 152 alternativa efectiva que permite ahorrar recursos y evita la exposición innecesaria a antibióticos. La duración del tratamiento depende de la respuesta clínica y los aislamientos microbiológicos. En pacientes con adecuada respuesta al tratamiento empírico inicial y en quienes se descarte infección por P. aureginosa o especies de Acinetobacter el tratamiento por 7 días es efectivo y mejora el pronóstico. Tratamiento antibiótico específico para organismos multidrogorresistentes Si se documenta infección por P. aureginosa se recomienda terapia combinada debido a la alta prevalencia de resistencia con monoterapia. El esquema debe incluir betalactámicos antipseudomonas con aminoglucósidos o quinolonas antipseudomonas. El tratamiento para especies de Acinetobacter es complejo debido a la resistencia intrínseca de estas bacterias a muchas clases de antibióticos. Los carbapenémicos, ampicilina-sulbactam y las polimixinas suelen ser los fármacos preferidos. Las enterobacterias productoras de betalactamasas de espectro extendido por definición son resistentes a cefalosporinas, por lo que debe asegurarse el tratamiento con carbapenémicos. El manejo de infecciones por S. aureus resistente a meticilina debe incluir manejo con vancomicina o linezolid. Prestar atención a efectos nefrotóxicos de vancomicina y realizar determinación de niveles séricos en pacientes con riesgo de mayor toxicidad como aquellos con falla renal. Respuesta al tratamiento La terapia antibiótica empírica requiere modificaciones una vez que los resultados microbiológicos estén disponibles. Las terapias de desescalamiento antibiótico mejoran el pronóstico de los pacientes y evitan la emergencia de microorganismos multidrogorresistentes. Los parámetros para determinar respuesta al tratamiento incluyen el conteo de glóbulos blancos, la ausencia de fiebre y la mejoría en la saturación de oxígeno. Las radiografías de tórax seriadas tienen un valor limitado para definir la mejoría clínica; sin embargo el deterioro rápido, la presencia de progresión a infiltrados multilobares mayores a 50% en menos de 24 h, o la presencia de cavitaciones o derrame pleural implican un pronóstico desfavorable y requieren ajuste antibiótico. La evaluación de los pacientes que no responden al manejo antibiótico inicial debe encaminarse a descartar tres posibles causas de deterioro: 1) falta de cobertura de microorganismos, como en el caso de organismos multidrogorresistentes, virus o bacterias; 2) diagnóstico inadecuado, por lo que deberán descartarse atelectasias, embolia pulmonar, síndrome de insuficiencia respiratoria aguda, hemorragia pulmonar, enfermedad subyacente o neoplasias (Cuadro 2.3.2); y 3) complicaciones como empiema, abscesos pulmonares, infección por Clostridium difficile, infección oculta o fiebre por antibióticos. Tratamientos en estudio El estudio de antibióticos nuevos puede ofrecer una opción terapéutica en el contexto de organismos multidrogorresistentes. Éstos incluyen lipoglucopéptidos como dalbavancina, oritavancina y telavancina; cefalosporinas de nueva generación como ceftarolina y ceftobiprole o iclaprim, un inhibidor de reductasa; todos estos activos contra S. aureus resistente a me- 3/2/15 2:47 PM proNÓstico 153 El pronóstico de neumonía intrahospitalaria es sombrío a pesar de los avances en maniobras diagnósticas y terapéuticas. La emergencia de organismos multidrogorresistentes es la principal causa de la todavía elevada morbimortalidad. El uso de algoritmos clínicos basados en evidencia y de una constante evaluación por comités expertos enfocados a los datos epidemiológicos locales son las mejores herramientas para cambiar el panorama de esta enfermedad. sección 2 | Neumología ticilina. Para el tratamiento de bacilos gramnegativos multidrogorresistentes se ha descrito el uso de moléculas ahorradoras de carbapenémicos como temocilina y avibactam. El uso de anticuerpos monoclonales contra el sistema de secreción tipo III, un factor principal en la virulencia de P. aureginosa, reduce la incidencia de neumonía asociada con el ventilador en pacientes con colonización traqueal por P. aureginosa. Book 2.indb 153 3/2/15 2:47 PM 154 4. Asma Aún no existe una definición del asma aceptada de manera universal. Las características más importantes del asma son: obstrucción bronquial reversible, hiperreactividad e inflamación. En México se estima una prevalencia de asma entre 1.2 a 12.5%. Los factores de riesgo más importantes para la aparición del asma son la atopia y el antecedente de asma en la familia. Guía EXARMED Cuando el contacto de alguna partícula logra activar uno o más mecanismos de hipersensibilidad se desencadenará un proceso inflamatorio e hiperreactividad sobre la vía aérea cuya intensidad dependerá de los factores genéticos y ambientales de cada individuo en particular. Existen muchas clasificaciones para el asma, pero en particular se recomienda utilizar la que aparece en la GINA. Book 2.indb 154 INTRODUCCIÓN Definición El asma es una enfermedad reconocida desde hace muchos años, sin embargo su fisiopatología no está del todo dilucidada, y por ello aún no existe una definición completamente satisfactoria. Por el momento, la Iniciativa Global para el Asma (GINA, por sus siglas en inglés) ha decidido definir el asma como “un trastorno inflamatorio crónico de las vías aéreas en el cual participan muchas células y elementos celulares. La inflamación crónica está asociada con una hiperreactividad en las vías aéreas que condiciona episodios recurrentes de sibilancias, disnea, opresión torácica y tos, en particular durante la noche o temprano por la mañana. Estos episodios suelen estar vinculados a una obstrucción diseminada –pero variable– en la vía aérea que por lo regular es reversible de forma espontánea o a través del tratamiento”. Al igual que en esta definición, otras descripciones involucran tres elementos considerados como los más característicos de la enfermedad: inflamación, hiperreactividad y obstrucción bronquial reversible. Epidemiología Existen muchas publicaciones sobre la prevalencia de asma en diversos países; sin embargo la falta de una definición de la enfermedad aceptada de manera universal hace difícil que desde el punto de vista metodológico se puedan obtener conclusiones certeras. Por otra parte, numerosos estudios han mostrado una gran variabilidad de un país a otro (e incluso entre regiones de un mismo país) en la prevalencia de la enfermedad, tal vez debido a factores genéticos y ambientales. No obstante, hoy en día se estima que en el mundo existen cerca de 300 millones de individuos con esta enfermedad, con rangos entre 1 a 18% en los diversos países. El International Study of Asthma and Allergies in Childhood (ISAAC) ha determinado que las regiones de Norteamérica, Oceanía y América Latina tienen la prevalencia más alta. A nivel mundial a esta patología se le han atribuido 18 0000 muertes anuales. En México en el 2004 el asma se ubicó dentro de las primeras 20 causas de enfermedad a nivel nacional; 28.5% los casos ocurre en el grupo de edad de los 5 a 14 años. ETIOLOGÍA Y FISIOPATOGENIA Existen factores que influyen en el desarrollo del asma (genéticos), pero también algunos que desencadenan la expresión del asma (ambientales). Los factores de riesgo más importantes son la atopia (predisposición genética para producir más IgE) y el antecedente de asma en la familia. A pesar de la innegable influencia que los genes tienen sobre esta enfermedad, la genética no ha podido explicar una importante proporción de los casos de asma, y tampoco el por qué de la variabilidad de los patrones de asma en los diversos grupos poblacionales. Respecto a los factores ambientales, vale la pena mencionar las 10 causas reconocidas como las más frecuentes para predisponer y/o desencadenar el asma: infecciones virales (rinitis, sinusitis, laringotraqueitis); pelo y caspa de mascotas (perros, gatos, conejos, caballos); ácaros domésticos del polvo (en colchones, almohadas, alfombras, muebles); humo de tabaco o leña; pólenes, mohos; cambios en la temperatura y densidad ambiental; medicamentos (aspirina, betabloqueadores); sustancias químicas en aerosol (pinturas, desodorantes, perfumes); ejercicio extremo; y cambios emocionales. Como ya se ha mencionado, la fisiopatología del asma no está del todo dilucidada. Sin embargo los conocimientos inmunológicos actuales sirven para entender por qué existe una inflamación en la vía aérea en todo paciente con asma. En la actualidad se han abandonado muchos dogmas en el campo de la inmunología, por tal motivo, se recomienda ampliamente leer el capítulo ‘Trastornos de la inmunidad, alergias y reumatología’ perteneciente a la sección de Pediatría en este libro. De una forma muy resumida, la fisiopatología del asma es la siguiente: cuando el contacto de alguna partícula logra activar uno o más mecanismos de hipersensibilidad de la clasificación de Gell y Coombs, se desencadenará un proceso inflamatorio e hiperreactividad sobre la vía aérea, cuya intensidad dependerá de los factores genéticos y ambientales de cada individuo en particular. Con esta breve explicación los autores implican varias cosas: 1) la partícula desencadenante puede o no ser alergénica: en algunos pacientes asmáticos no se demuestra que las partículas típicamente consideradas como ‘alergénicas’ sean las responsables de la sintomatología; 2) no se sabe si el inicio del mecanismo de hipersensibilidad ocurre desde la etapa intrauterina, si es exclusiva de la etapa extrauterina o si es el resultado de una combinación entre ambas; 3) el contacto inicial de la partícula no necesariamente debe ser sobre la vía respiratoria; puede ocurrir a través del aparato gastrointestinal, in utero, tras la administración de fármacos (p. ej., hay estudios donde la aparición del asma se ha asociado con la administración de paracetamol), etc.; 4) es muy probable que existan casos de asma cuya fisiopatología involucre no sólo a uno, sino varios mecanismos de hipersensibilidad al mismo tiempo y de forma variable; eso explica que algunos pacientes mejoren mucho, de forma intermedia o de forma nula a través de la inmunoterapia (véase más adelante); 5) las manifestaciones clínicas resultantes de la inflamación en la vía aérea dependerán de uno o más mecanismos de hipersensibilidad subyacentes, pero además, de una combinación entre los factores genéticos predisponentes con el contacto ambiental que tenga cada persona, por ejemplo, un niño con ambos padres asmáticos que desarrolle un asma cuyo mecanismo de hipersensibilidad sea mediado por IgE, cuya partícula desencadenante sea el polen de un árbol en la ciudad de México, probablemente no desarrolle ninguna crisis de asma si se va a vivir a Baja California Sur. CLASIFICACIONES Se han realizado distintas y numerosas clasificaciones del asma, pero a pesar de que cada una de ellas considera aspectos importantes de la enfermedad, en este capítulo sólo se utilizará la clasificación basada en los niveles de control del asma que aparece en el documento más reciente publicado por la GINA (Cuadro 2.4.1). El objetivo del tratamiento en el asma debe ser alcanzar, y mantener, un control adecuado en el mayor tiempo posible. En este contexto, la gravedad del 3/2/15 2:47 PM 155 cuadro 2.4.1. Niveles de control del asma a. evaluación del control clínico actual (de preferencia en un lapso de 4 semanas) característica Controlada (todas las siguientes) Parcialmente controlada (cualquier medición presente) síntomas diurnos No (2 o menos/semana) Más de 2 veces/semana Limitación de actividades No Alguna síntomas nocturnos/despiertan paciente No Alguna Necesidad de medicamento de rescate No (2 o menos/semana) Más de 2 veces/semana Función pulmonar (FeM/ VeF1)‡ Normal Valor predictivo < 80% o mejor valor personal No controlada Tres o más características del asma parcialmente controlada*+ b. evaluación del riesgo futuro (riesgo de exacerbaciones, inestabilidad, rápida declinación en la función pulmonar, efectos adversos) características asociadas con el incremento en el riesgo de eventos adversos en el futuro incluyen: escaso control clínico, exacerbaciones frecuentes en el último año,* alguna admisión a la terapia intensiva debido al asma, VEF bajo, exposición a humo de tabaco, altas dosis de medicamentos. *Después de cualquier exacerbación se debe revisar bien el tratamiento para asegurarse que sea adecuado. + Por definición, cualquier exacerbación que se presente durante una semana hace que esa semana el paciente se clasifique como no controlado. ‡ Realizar pruebas de función pulmonar no se contempla en niños de 5 años o menores. Menores de 5 años - Rinosinusitis crónica - Reflujo gastroesofágico - Infecciones recurrentes del tracto respiratorio inferior - Fibrosis quística - Displasia broncopulmonar Es importante entender que las manifestaciones clínicas del asma son muy variables, a tal grado que en ocasiones la exploración física puede ser completamente normal; en otras, la única manifestación clínica es la presencia de tos crónica; también existe otra variante de asma cuya sintomatología clásica de sibilancias, disnea, opresión torácica y tos sólo aparece 5 o 10 min después de haber realizado un ejercicio físico (rara vez ocurre durante el ejercicio). A pesar de esta variabilidad, el hallazgo más frecuente en la exploración física consiste en sibilancias en la auscultación pulmonar. - Tuberculosis diagNÓstico Book 2.indb 155 La espirometría, a través de la determinación de la CVF y VEF1, es el método más recomendado para medir la función pulmonar. cuadro 2.4.2. Principales diagnósticos diferenciales de sibilancias cUadro cLÍNico Puede sospecharse tras el interrogatorio y la exploración física, pero es importante realizar diversas pruebas para confirmar la presunción diagnóstica, o bien, descartar diagnósticos diferenciales (Cuadro 2.4.2). En ocasiones no es posible llevar a cabo pruebas diagnósticas debido a la falta de cooperación del paciente (sobre todo en menores de cinco años), la carencia de recursos o una inadecuada infraestructura hospitalaria. Por ello, la presencia de una o más de las siguientes características clínicas debe despertar la sospecha del diagnóstico de asma: 1) tos o sibilancias que aparecen después de una actividad física; 2) eventos de tos nocturna no asociados con infecciones virales; 3) episodios Realizar pruebas diagnósticas no siempre es posible en los menores de cinco años, debido a la falta de cooperación. - Estrechamiento de la vía aérea debido a malformaciones congénitas - Aspiración de cuerpo extraño - Discinesia ciliar primaria - Inmunodeficiencias - Cardiopatías congénitas Mayores de 5 años y adultos - Síndrome de hiperventilación y ataque de pánico - Obstrucción de la vía aérea superior e inhalación de cuerpos extraños - Disfunción de cuerdas vocales - Otras formas de enfermedad obstructiva pulmonar, principalmente EPOC - Variantes no obstructivas de enfermedades pulmonares (p. ej., enfermedad pulmonar parenquimatosa difusa) - Enfermedades de origen no respiratorio (p. ej., insuficiencia cardiaca izquierda) No debe olvidarse que la presencia de cualquiera de estas enfermedades no descarta el diagnóstico de asma. frecuentes de sibilancias (más de una al mes) sin tomar en cuenta la época del año. sección 2 | Neumología asma no se determina por la frecuencia o intensidad de los síntomas, sino con base en la intensidad del tratamiento requerido para obtener un control adecuado de la enfermedad; por ejemplo, un asma severo es aquel que requiere el nivel 4 del esquema de tratamiento de GINA (véase más adelante), o aquel en donde a pesar de un tratamiento intenso no es posible obtener un control adecuado. Las manifestaciones clínicas del asma son muy variables, pero el hallazgo más frecuente es la sibilancia en la auscultación pulmonar 3/2/15 2:47 PM 156 El tratamiento farmacológico con frecuencia consiste en combinar broncodilatadores con antiinflamatorios; estos últimos son los más importantes. Para el manejo del asma se recomienda un esquema o modalidad de tratamiento escalonado. Diagnóstico de asma en menores de cinco años Es evidente que no todo niño con tos y/o sibilancias tiene asma. Por ello, a los niños menores de cinco años se les clasifica en uno de tres grupos según las sibilancias que presenten. Sibilancias transitorias tempranas Por lo regular existe el antecedente de prematurez y/o tabaquismo en los padres. Las sibilancias suelen desaparecer después de los tres años de edad. Sibilancias de inicio temprano persistentes La tos y/o las sibilancias están asociadas con infecciones respiratorias virales agudas. No existe antecedente de atopia en el niño o la familia. En la gran mayoría de los casos la sintomatología de estos pacientes persiste hasta los 12 años. Sibilancias de inicio tardío/asma La tos y/o las sibilancias no están asociadas con infecciones respiratorias virales agudas. Con frecuencia existe antecedente de atopia en el niño y/o la familia. La sintomatología suele persistir hasta la edad adulta. Diagnóstico de asma en niños mayores de cinco años y adultos Además del interrogatorio y exploración física se realizan mediciones de la función pulmonar para demostrar (en la mayoría de los casos) la presencia de una obstrucción variable y reversible en la vía aérea. Existen varios métodos disponibles para demostrar estas alteraciones en la vía aérea; los más aceptados son la espirometría y la determinación del flujo espiratorio máximo (FEM). Guía EXARMED Espirometría Es el método más recomendado. Las mediciones más importantes son la capacidad vital forzada (CVF) y la determinación del volumen espiratorio forzado en el primer segundo (VEF1). La CVF se refiere a la cantidad de aire que puede ser expulsado lo más rápido posible a partir de una posición pulmonar de máxima insuflación. El VEF1 es la cantidad de aire que puede ser expulsado lo más rápido posible en 1 s a partir de una posición pulmonar de máxima insuflación; por lo regular representa cerca de 80% de la CVF. Deben realizarse ecuaciones predictivas de forma individualizada para poder definir los parámetros normales, por lo que el rango normal de valores es amplio; también hay que tomar en cuenta que los valores predictivos son menos confiables en los menores de 20 años y en los mayores de 70. Debido a que existen muchas enfermedades pulmonares que pueden reportar un VEF1 disminuido, la determinación de la proporción VEF1/CVF es de suma utilidad. Por lo general esta proporción es mayor a 0.75 a 0.80, y probablemente mayor a 0.90 en los niños, por lo que cualquier valor menor a estos parámetros sugiere una obstrucción en las vías aéreas. Book 2.indb 156 Determinación del FEM La necesidad de contar con un instrumento de medición más simple, portátil y económico que el espirómetro condujo al desarrollo del flujómetro. Con él se determina el FEM, un índice funcional similar al VEF1. Se debe llevar un registro de las mediciones, las cuales con frecuencia se realizan por la mañana justo después de despertar y por la noche justo antes de dormir. Si el paciente está bajo tratamiento con broncodilatadores se recomienda que la medición se realice antes y después de su administración. El diagnóstico de asma se confirma al observar una diferencia de al menos 60 L/min (o 20%) en dos mediciones, o variaciones diurnas de más de 10%. Debe tenerse en cuenta que el flujómetro puede subestimar el grado de obstrucción en la vía aérea, y además debe utilizarse siguiendo las instrucciones de forma adecuada. TRATAMIENTO Es importante recordar que el asma básicamente es el resultado de un proceso inflamatorio sobre las vías aéreas, por lo tanto, a pesar de que el tratamiento farmacológico consiste en la combinación de broncodilatadores y antiinflamatorios, estos últimos son los más importantes en el tratamiento. Siempre que sea posible se recomienda utilizar medicamentos inhalados debido a su alta eficacia terapéutica: altas concentraciones del medicamento son liberadas de manera directa en las vías respiratorias con efectos terapéuticos potentes y pocos efectos sistémicos adversos. Los medicamentos con acción broncodilatadora tienen una gran importancia en las exacerbaciones agudas, pero su efecto terapéutico es transitorio y no produce ningún efecto antiinflamatorio, por lo que existen muchas posibilidades de que la exacerbación aguda del asma vuelva a presentarse una vez desaparecido su efecto farmacológico. El manejo prolongado del asma mediante medicamentos broncodilatadores solos tiene el riesgo de producir taquifilaxis de los receptores beta adrenérgicos bronquiales, por lo que es necesario administrar dosis más elevadas –y a intervalos más frecuentes– para conseguir el efecto broncodilatador. Se ha observado que en pacientes con taquifilaxis la administración de corticoesteroides, de forma oral o parenteral, restaura la sensibilidad de los receptores beta adrenérgicos bronquiales. En resumen –con algunas excepciones– el tratamiento del asma debe consistir en una combinación de medicamentos broncodilatadores con medicamentos antiinflamatorios (Figuras 2.4.1 y 2.4.2). Para el manejo del asma se recomienda un esquema o modalidad de tratamiento escalonado, por niveles, para clasificar el control del asma y guiar su tratamiento. El número y la frecuencia de los medicamentos se incrementa (sube de nivel) según aumente su necesidad, y disminuye (baja de nivel) cuando el asma está bajo control. Debido a que el objetivo del tratamiento es alcanzar el control del asma lo más pronto posible, en algunos casos puede administrarse un curso corto (siete a 10 días) de corticoesteroides orales para establecer un control rápido. Una vez cumplido el objetivo es necesario disminuir las dosis y/o el número de medicamentos al mínimo necesario para mantener el control. En caso de que no haya un control adecuado se deberá revisar la técnica de uso del medicamento del paciente, su aceptación y el apego al tratamiento (incluidos costos y efectos adversos), y si se están evitando los factores desencadenantes. Cuando no exista ningún problema con todos estos elementos, entonces se recomienda subir de nivel. Por lo general la mejoría debe alcanzarse dentro del primer mes de tratamiento. Una vez que el asma esté bajo control se aconseja revisar al paciente cada tres a seis meses. Cuando un individuo se ha mantenido bajo control por lo menos tres meses, se debe intentar reducir los medicamentos de forma gradual y escalonada. Es importante recordar que estas recomendaciones sólo son una guía de tratamiento; 3/2/15 2:47 PM 157 Nivel 3 Seleccionar uno o más Nivel 2 Seleccionar uno Nivel 1 • Educación del asma • Control ambiental Continuar la administración de agonistas β2 de acción rápida según sea necesario Administrar dosis bajas de CEI* Modificadores de leucotrienos* Administrar dosis bajas (al doble) de corticoesteroides inhalados Administrar dosis bajas de corticoesteroides inhalados junto con modificadores de leucotrienos Paciente controlado con agonistas β2 de acción rápida: continuar con los mismos medicamentos Paciente parcialmente controlado con agonistas β2 de acción rápida: considerar subir de nivel para conseguir el control Paciente no controlado/controlado con dosis bajas de corticoesteroides inhalados: subir de nivel hasta conseguir el control En caso de una exacerbación aguda, utilizar medicamentos agonistas β2 de acción rápida sin considerar el nivel de tratamiento en que se encuentre el paciente Figura 2.4.1. Manejo del asma según el control de los síntomas en niños ≤ 5 años de edad. Modificado de GINA Pocket guide for asthma management and prevention in children 5 years and younger (2009). La administración de glucocorticoides orales sólo debe utilizarse para las exacerbaciones agudas de asma. Los recuadros grises señalan el tratamiento más recomendado en cada nivel. Antes de subir de nivel primero se debe revisar la técnica de administración del inhalador, el apego al tratamiento (preferencias, costos) y además confirmar que los síntomas son debidos a asma. CEI, corticoesteroides inhalados. *Antagonistas de receptores o inhibidores de síntesis. Book 2.indb 157 MedicaMeNtos para eL asMa Los principales fármacos antiasmáticos son los antiinflamatorios y los broncodilatadores. Entre los primeros están los corticoesteroides, los antagonistas de receptores de leucotrienos y las cromonas. Entre los broncodilatadores se encuentran los agonistas beta2 de larga y corta duración, los anticolinérgicos y las metilxantinas. Otras formas de tratamiento son los anticuerpos monoclonales contra IgE y la inmunoterapia. epiNeFriNa Un broncodilatador muy conocido, con efectos similares a los agonistas beta2. Su uso común es en la anafilaxia aunque también se emplea en las crisis de asma, sobre todo si no se cuenta con adrenérgicos beta. aNtagoNistas de Los receptores de LeUcotrieNos Montelukast, zafirlukast y zileuton. El más empleado es montelukast que se administra por vía oral a partir de los dos años de edad. En pacientes < 5 años de edad los antagonistas de los leucotrienos proporcionan mejoría en la función pulmonar, así como disminución de las exacerbaciones y los síntomas de asma, por lo que se pueden asociar con corticoesteroides inhalados (CEI) (Figura 2.4.1). aNticoLiNérgicos Son broncodilatadores. Los genéricos son el bromuro de ipratropio y el bromuro de tiotropio. Actúan como antagonistas de los receptores muscarínicos, al impedir la unión de la acetilcolina a nivel de los receptores del músculo liso y del tejido glandular bronquial. Su mecanismo es doble, ya que producen broncodilatación y evitan la broncoconstricción de estímulos externos. Se trata de una alternativa de tratamiento inhalada para pacientes con intolerancia a agonistas beta2. aNticUerpos MoNocLoNaLes Algunos están dirigidos contra la inmunoglobulina E (anti-IgE) y otros contra el factor de necrosis tumoral sección 2 | Neumología como médicos, es necesario considerar los recursos locales y las circunstancias particulares del paciente para poder brindar un tratamiento personalizado. En la Figura 2.4.1 se encuentra una guía para el manejo del asma para pacientes de cinco años o menores, y en la Figura 2.4.2 se presenta la guía para aquéllos mayores de 5 años, adolescentes y adultos. Existen diversos dispositivos para aplicar medicamentos inhalados: inhaladores presurizados de dosis medida (IDM); inhaladores de dosis medida activados por la respiración; inhaladores de polvo seco; y nebulizadores. Los espaciadores (cámaras de retención) hacen que los inhaladores sean más fáciles de usar, además de que ayudan a reducir la absorción sistémica y los efectos colaterales de los corticoesteroides inhalados. El Colegio Mexicano de Alergia, Asma e Inmunología Pediátrica (COMAAIPE) tiene las siguientes recomendaciones respecto a los dispositivos de inhalación: 1) Los niños menores de dos años deben usar un nebulizador o un inhalador presurizado (IDM) con un espaciador con mascarilla. 2) Los niños de dos a cinco años de edad deben utilizar un inhalador presurizado IDM con un espaciador o, si es necesario, un nebulizador. 3) Para los pacientes que usan espaciador, éste debe ajustarse de forma adecuada al inhalador presurizado; el tamaño del espaciador debe incrementarse según el niño crezca e incremente su tamaño pulmonar. 4) Los pacientes ≥ 5 años de edad con dificultades para utilizar un inhalador IDM deben usarlo con un espaciador, o pueden usar un inhalador de dosis medida activado por la respiración, un inhalador de polvo seco o un nebulizador; hay que tomar en cuenta que los inhaladores de polvo seco requieren un esfuerzo inspiratorio que puede ser difícil de conseguir durante los ataques agudos y por niños < 5 años. 5) Los pacientes que estén sufriendo un ataque severo deben usar un IDM presurizado con un espaciador adecuado o –idealmente– un nebulizador. 3/2/15 2:47 PM 158 Nivel 5 Medicamentos del nivel 4 Nivel 3 Seleccionar uno y considerar: o más Nivel 3 Seleccionar uno Nivel 2 Seleccionar uno Nivel 1 • Educación del asma • Control ambiental Dosis bajas de CEI* Modificadores de leucotrienos* Dosis bajas de CEI junto con agonistas β2 de acción prolongada • Dosis intermedias o altas de CEI • Dosis bajas de CEI junto con modificadores de leucotrienos • Dosis bajas de CEI junto con teofilina de acción larga Dosis intermedia o alta de CEI junto con agonistas β2 de acción prolongada • Modificadores de leucotrienos • Teofilina de acción larga Dosis bajas de corticoesteroides orales Tratamiento antiIgE (inmunoterapia) Paciente controlado: seleccionar los medicamentos que controlen los síntomas a las dosis más bajas posibles Paciente parcialmente controlado: considerar subir de nivel para conseguir el control† Paciente no controlado: subir de nivel hasta conseguir el control† En caso de una exacerbación aguda, utilizar medicamentos agonistas β2 de acción rápida sin considerar el nivel de tratamiento en que se encuentre el paciente Figura 2.4.2. Manejo del asma según el control de los síntomas en niños > 5 años de edad, adolescentes y adultos. Modificado del GINA Report, Global Strategy for Asthma Management and Prevention. (Actualizado en dieciembre de 2011). Los recuadros grises señalan el tratamiento más recomendado en cada nivel. Otros medicamentos que pueden ser de utilidad son los anticolinérgicos y las teofilinas de acción corta. † Antes de subir de nivel primero se debe revisar la técnica de administración del inhalador, el apego al tratamiento (preferencias, costos), además de confirmar que los síntomas se deben al asma. CEI, corticoesteroides inhalados. *Antagonistas de receptores o inhibidores de síntesis. alfa (antiTNF-alfa). A pesar que los antiTNF-alfa han mostrado excelentes resultados en diversos ensayos clínicos, es importante que el lector revise la función antitumoral de esta citocina, y posteriormente revise el artículo realizado por Wenzel y cols. para entender por qué los autores aconsejan utilizar con extrema precaución los anticuerpos monoclonales anti-TNF-alfa. Agonistas beta2 de acción rápida Se utilizan en las exacerbaciones. Aparecen con los genéricos salbutamol, bitolterol, fenoterol, isoetarina, metaproterenol, piributerol y terbutalina. Son conocidos como beta adrenérgicos o simpaticomiméticos y actúan como broncodilatadores. Guía EXARMED Agonistas beta2 de acción larga Comparten con los CEI el primer lugar en el control de los síntomas. El salmeterol y el formoterol son los más empleados, sobre todo asociados con los CEI. Debido a que su inicio de acción puede ser lento, se debe tener cuidado al indicarlos como monoterapia. Existen formulaciones orales de clenbuterol, terbutalina y salbutamol. Book 2.indb 158 Corticoesteroides inhalados Los CEI de mayor uso son la beclometasona, la budesonida, la fluticasona y la mometasona. Tienen una curva dosis-respuesta relativamente plana, por lo que el efecto terapéutico aparece con dosis bajas. Una tercera parte de los pacientes necesita subir la dosis para conseguir el efecto terapéutico, lo que conlleva a incrementar reacciones secundarias. Entre los efectos secundarios es frecuente la candidosis oral, que se puede minimizar al emplear espaciadores. Cuando aparezca candidosis se tratará con antimicóticos orales. Los efectos adversos de los CEI concernientes a talla baja en niños son contradictorios, pero por lo general se circunscriben al primer año de tratamiento. Si el análisis se hace a largo plazo, no hay diferencias en la talla final alcanzada entre niños asmáticos que reciben CEI o placebo. En niños tratados de forma prolongada con fluticasona se ha reportado hipoglucemia debido a insuficiencia suprarrenal. Corticoesteroides sistémicos Los corticoesteroides sistémicos (CES) que se emplean por vía oral son prednisolona, prednisona, metilprednisolona y dexametasona; aquéllos que se usan por vía parenteral y durante las exacerbaciones son hidrocortisona, dexametasona y betametasona; esta última se ha utilizado con éxito por vía subcutánea, en las exacerbaciones, durante cuatro días. Siempre que sea posible se debe utilizar la dosis mínima, por el menor tiempo posible, por cualquiera de las vías. Cromonas Se utilizan en el asma por su efecto antiinflamatorio, al estabilizar la membrana de los mastocitos. Las presentaciones genéricas son el cromoglicato de sodio y el nedocromilo sódico. Tienen efectos supresores de células inflamatorias, como macrófagos, eosinófilos y monocitos. En general el efecto no se consigue de inmediato, por lo que se prefiere usarlos como preventivos. Se presentan en formulaciones orales e inhaladas. Su uso depende, fundamentalmente, de la edad del paciente. Cuando, durante el control de síntomas, el asma se exacerba, se adicionan los agonistas beta2 de acción rápida (Figuras 2.4.1 y 2.4.2). Teofilinas No deben utilizarse como primera línea en el tratamiento del asma, pues presentan muchos efectos secundarios. No obstante, hay pacientes de difícil control en quienes la teofilina es buena opción. En la actualidad se utilizan teofilinas de acción corta en caso de que los agonistas beta2 no estén disponibles o la respuesta a ellos sea mala. 3/2/15 2:47 PM Las teofilinas de acción prolongada actúan como broncodilatadores y antiinflamatorios. Sus efectos colaterales incluyen náusea, vómito, taquicardia, arritmias y convulsiones. Se pueden asociar con el tratamiento en pacientes > 5 años, adolescentes y adultos (Figura 2.4.2). 159 sección 2 | Neumología KetotiFeNo Se utiliza como estabilizador de membranas del mastocito; se suministra dos veces al día por lo menos durante tres meses. Su uso se ha generalizado como antihistamínico en dosis variadas. Sus resultados en muchos individuos asmáticos han sido buenos por su efecto antiinflamatorio durante largos periodos de tiempo. iNMUNoterapia Los alergenos del ambiente sensibilizan a las personas con predisposición a padecer enfermedades atópicas. Comprobada la sensibilización alergeno-específica, el único tratamiento potencialmente curativo es la inmunoterapia. Ésta consiste en la administración de dosis crecientes de la vacuna alergénica hasta llegar a una dosis de mantenimiento, donde el contacto con los alergenos no produzca la aparición de síntomas alérgicos. La inmunoterapia debe aplicarse de manera precoz en el curso de la enfermedad alérgica para prevenir la destrucción y la remodelación bronquial observada en el asma de larga evolución. La vía sublingual con extractos bien estandarizados resulta eficaz y segura desde edades muy tempranas de la vida. Book 2.indb 159 3/2/15 2:47 PM 160 5. Enfermedad pulmonar obstructiva crónica INTRODUCCIÓN La enfermedad pulmonar obstructiva crónica se define como la limitación persistente y progresiva del flujo aéreo. El principal factor de riesgo prevenible para adquirir neumopatía obstructiva crónica es el consumo de cigarrillo. El diagnóstico definitivo de neumopatía obstructiva crónica es únicamente espirométrico. Guía EXARMED La disnea se considera el síntoma cardinal de la neumopatía obstructiva crónica y la tos suele ser el primero en aparecer. Book 2.indb 160 La enfermedad pulmonar obstructiva crónica, en la actualidad llamada neumopatía obstructiva crónica, se define como la limitación persistente y progresiva de flujo aéreo que se asocia con una respuesta inflamatoria crónica originada por la respuesta del organismo a partículas inhaladas o gases; ésta es prevenible y tratable. Desde el punto de vista epidemiológico se sabe que la neumopatía obstructiva crónica afecta sobre todo a fumadores, hombres y mayores de 40 años de edad; en México su prevalencia estimada es de 7.8%. En relación con su mortalidad, la neumopatía obstructiva crónica es proporcional a la edad, aunque se ve afectada por otros estados patológicos crónicos como las enfermedades cardiovasculares y la diabetes mellitus. Se estima que para el 2020 la neumopatía obstructiva crónica será la tercera causa de muerte a nivel mundial. ETIOLOGÍA, FISIOPATOLOGÍA Y FACTORES DE RIESGO El principal factor de riesgo prevenible para adquirir la neumopatía obstructiva crónica es el consumo de cigarrillo, dentro de las causas genéticas, la deficiencia de alfa-1 antitripsina ha sido la más implicada, aunque se han relacionado otros genes (p. ej., MMP12). Otros factores de riesgo son el consumo de pipa, puros, marihuana, la exposición a combustión de biomasa y el propio envejecimiento, así como la exposición a factores que afecten el desarrollo y el crecimiento pulmonar (p. ej., exposición a humo de tabaco in utero o en la infancia); también se han relacionado algunas infecciones, entre las que destaca la tuberculosis como factor de riesgo y diagnóstico diferencial. Los cambios patológicos de la neumopatía obstructiva crónica incluyen modificaciones de las vías aéreas, el parénquima pulmonar y la vasculatura pulmonar, los cuales son afectados por un estado inflamatorio crónico, impulsado sobre todo por la activación crónica de linfocitos T CD8+, macrófagos y polimorfonucleares, lo que resulta en la destrucción del parénquima pulmonar (enfisema), la formación de fibrosis intersticial a nivel distal dentro del árbol respiratorio (bronquiolitis obstructiva) y el aumento en la producción del moco, ya sea por hipertrofia glandular, hiperplasia de células caliciformes o metaplasia de las mismas a regiones más distales donde no suelen encontrarse, lo que en último momento condiciona el atrapamiento aéreo (hiperinsuflación), la limitación al flujo, las alteraciones en el intercambio gaseoso (hipoxemia e hipercapnia), la hipersecreción de moco (bronquitis crónica) y la hipertensión pulmonar (resultado de la vasoconstricción arterial pulmonar debido a la hipoxia). Una de las teorías más aceptada en la génesis de la enfermedad es la hipótesis de la elastasa:antielastasa, que indica la pérdida del equilibrio entre la degradación y la inhibición de la destrucción de las fibras elásticas, en el que se favorece la primera, y conduce a los cambios patológicos y las manifestaciones clínicas de la enfermedad. Es importante reconocer que dicha inflamación crónica persiste a pesar del cese del consumo del tabaco; esto se explica por la generación de autoantígenos y la presencia persistente de algunos microorganismos. CUADRO CLÍNICO El diagnóstico clínico de la neumopatía obstructiva crónica se debe sospechar en todo paciente que presente disnea (por lo regular progresiva, que empeora con el ejercicio y es persistente), tos crónica (intermitente o latente, productiva o no) o producción de esputo (sin relación con la tos) y que cuenta con factores de riesgo para la enfermedad (p. ej., exposición a tabaco, combustión de biomasa). El diagnóstico definitivo de neumopatía obstructiva crónica sólo es espirométrico. La disnea se considera el síntoma cardinal de la neumopatía obstructiva crónica y la tos suele ser el primero en aparecer. Otras manifestaciones inespecíficas que pueden presentarse son sibilancias, fatiga, pérdida ponderal, anorexia, depresión y ansiedad. La exploración física rara vez contribuye al diagnóstico de la enfermedad, sin embargo algunos datos que pueden obtenerse son la presencia de cianosis, espiración prolongada con sibilancias espiratorias, signos de hiperinsuflación como el tórax en tonel, la hiperclaridad pulmonar y el empleo de músculos accesorios de la respiración. De manera clásica se describían dos variantes clínicas de la enfermedad: el “resoplador rosado” y el “obeso cianótico”. El primero caracteriza a pacientes con predominio de enfisema, que se muestran adelgazados, se les aprecia eritematosos y con uso de músculos accesorios al respirar; los segundos son pacientes con predominio de bronquitis crónica, que como su nombre lo indica tienden a ser obesos, abotagados y cianóticos. Si bien en la actualidad estas variantes no tienen validez son de utilidad para reconocer y sospechar el diagnóstico. ESTUDIOS El uso de radiografías de tórax está limitado en esta patología. Dentro de los cambios que pueden encontrarse son la presencia de horizontalización de arcos costales, el aumento de los espacios intercostales de forma simétrica, el aplanamiento de diafragmas, la disminución de la radioopacidad del parénquima pulmonar y la silueta cardiaca en forma de “gota”. El uso de técnicas de imagen avanzadas como la tomografía computada se utiliza sobre todo para valorar posibles candidatos a tratamiento quirúrgico. Vale la pena destacar que aquellos pacientes con neumopatía obstructiva crónica secundaria a tabaquismo suelen mostrar datos de enfisema de predominio en lóbulos pulmonares basales; en cambio aquellos con deficiencia de alfa-1 antitripsina por lo general presentan predominio en ápices o regiones superiores de lóbulos pulmonares inferiores. DIAGNÓSTICO Como ya se comentó, el diagnóstico de la neumopatía obstructiva crónica es espirométrico, por lo que en la realización de la espirometría posbroncodilatador se deberá cuantificar: 3/2/15 2:47 PM - La capacidad vital forzada (FVC): medición obtenida al cuantificar el volumen total exhalado posterior a una inspiración máxima - El volumen espiratorio máximo en el 1er segundo (FEV1): el volumen recolectado en el primer segundo durante la medición de la FVC - La capacidad vital (VC): volumen total cuantificado en la espiración posterior a una inspiración convencional La razón FEV1/FVC es la preferida, aunque también puede realizarse la medición de la razón FEV1/VC, donde para ambos el punto de corte y el criterio diagnóstico es un resultado ≤ 0.7. Es importante resaltar que el resultado siempre deberá ser el obtenido en la espirometría posbroncodilatador, para lo cual se administra una dosis de 400 mcg de un beta2-agonista (p. ej., salbutamol), 160 mcg de un anticolinérgico (bromuro de ipratropio), o ambos, y se deberá esperar al menos 15 min en caso de utilizarse el primero o 30 a 45 min para el segundo, a fin de cuantificar la FEV1. DIAGNÓSTICO DIFERENCIAL Los diagnósticos diferenciales y las características clínicas distintivas de ellos están englobados en el Cuadro 2.5.1. Cuadro 2.5.1. Principales diagnósticos diferenciales de la neumopatía obstructiva crónica y sus características clínicas Asma • • • • • Insuficiencia cardiaca congestiva • • • Tuberculosis • • • Se presenta más en la infancia La sintomatología empeora durante la mañana o al despertar Historia personal de atopia Historia familiar de asma Existe reversibilidad de los síntomas con el uso de broncodilatadores La radiografía de tórax puede mostrar remodelación cardiaca La espirometría muestra un patrón restrictivo Suele coexistir con otros síntomas de falla cardiaca (ingurgitación yugular, hepatomegalia, edema de miembros pélvicos, estertores bibasales, etc.) La radiografía de tórax puede mostrar infiltrados o cavitaciones Expectoración sanguinolenta Antecedente de exposición a pacientes con tuberculosis 161 CLASIFICACIONES SEvERIDAD DE LOS SÍNTOMAS Existen cuestionarios validados para estadificar la severidad de los síntomas en los pacientes con neumopatía obstructiva crónica, como el Modified British Medical Research Council (mMRC) o el COPD Assessment Test (CAT), que son los más usados. El primero sólo toma en cuenta a la disnea como parámetro clínico, y es de menor utilidad, mientras que el CAT además de estar validado en múltiples idiomas en el mundo toma en cuenta como parámetros a medir la disnea, la tos, la expectoración, la limitación física y la autoevaluación del paciente en relación con su enfermedad. Una razón FEV1/ FVC ≤ 0.7 es el criterio diagnóstico más aceptado para neumopatía obstructiva crónica. CLASIFICACIÓN GOLD La clasificación Global Initiative for Chronic Obstructive Lung Disease (GOLD) es la más utilizada para categorizar a los pacientes en un estadio leve, moderado, severo o muy severo; utiliza como parámetro la relación FEV1/FVC para el mismo. La utilidad de categorizar a un paciente según la escala GOLD radica en que puede predecir el riesgo de exacerbación y hospitalización anual, así como la mortalidad a 3 años (véase Cuadro 2.5.2). GRUPOS DE PACIENTES: CLASIFICACIONES COMbINADAS Al tomar en cuenta las clasificaciones ya descritas (mMRC, CAT y GOLD), se puede englobar a los paciente en cuatro grandes grupos (A, B, C y D; Figura 2.5.1). El uso de esta estrategia está encaminado a mejorar el tratamiento que se ofrece a los paciente (véase más adelante). TRATAMIENTO En la actualidad no existe algún tratamiento que modifique el deterioro de la función pulmonar, sin embargo se cuenta con múltiples herramientas para mejorar la sintomatología, reducir la severidad y la frecuencia de las exacerbaciones y mejorar tanto el estado de salud como la tolerancia del individuo al ejercicio. Las recomendaciones para el manejo de los pacientes con neumopatía obstructiva crónica incluye los siguientes. En la actualidad no existe algún tratamiento que modifique el deterioro de la función pulmonar. SUSPENSIÓN DEL hÁbITO TAbÁqUICO Esta es la intervención que más impacta sobre la historia natural de la enfermedad; dentro de las opciones para los pacientes se cuenta con: Criterio GOLD (criterios espirométricos) GOLD 1: leve (FEV1 ≥ 80% del predicho) GOLD 2: moderado (50% ≤ FEV1 < 80% del predicho) GOLD 3: grave (30% ≤ FEV1 < 50% del predicho) GOLD 4: muy grave (FEV1 < 30% del predicho) Exacerbaciones anuales hospitalización anual Mortalidad a 3 años ¿? ¿? ¿? 0.7 a 0.9 0.11 a 0.2 11% 1.1 a 1.3 0.25 a 0.3 15% 1.2 a 2.0 0.4 a 0.54 24% Adaptado de: Global Initiative for Chronic Obstructive Lung Disease, Global Strategy for the Diagnosis, Managment, and Prevention Of Chronic Obstructive Pulmonary Disease. Updated 2013. Book 2.indb 161 Sección 2 | Neumología Cuadro 2.5.2. Clasificación GOLD, riesgo de exacerbación, hospitalización y mortalidad 3/2/15 2:47 PM Clasificación Gold 4 (C) (D) (A) (B) ≥2 3 2 1 1 0 Número de exacerbaciones 162 mMRC 0 – 1 mMRC 0 – 1 CAT < 10 CAT ≥ 10 SÍNTOMAS Figura 2.5.1. Asociación entre sintomatología, escala GOLD y número de exacerbaciones Tomado de: Global Initiative for Chroic Obstructive Lung Disease, Global Strategy For The Diagnosis, Managment, And Prevention Of Chronic Obstructive Pulmonary Disease, Updated 2013. Guía EXARMED - Productos para el reemplazo de nicotina: o Se incluyen gomas de mascar, inhaladores, parches transdérmicos o tabletas sublinguales o La importancia de este grupo de productos radica en que aumenta el tiempo de abstinencia o Las contraindicaciones para el uso de estos productos son presentar angina inestable, úlcera péptica y algún evento isquémico tanto a nivel cardiaco como cerebral - Farmacoterapia adyuvante para dejar el cigarro: o Vareniclina, bupropión y nortriptilina; al igual que los productos de reemplazo, estos fármacos aumentan el tiempo de abstinencia de consumo de cigarro. Antes también se incluía a la clonidina, sin embargo debido sus efectos adversos ya no está aprobada Es importante destacar que el uso de farmacoterapia para el cese del tabaquismo no es suficiente, y siempre se deberá dar apoyo al paciente en cada consulta y dejar como opciones viables el uso de grupos de ayuda e información sobre daños y beneficios de dejar el hábito. Se propone una estrategia de cinco puntos para reconocer y apoyar a los paciente a dejar de fumar: 1. Preguntar de manera sistemática si el paciente fuma 2. Aconsejar siempre dejar el hábito 3. Preguntar si existe intención de dejar el hábito 4. Asistir al paciente a desarrollar un plan para dejar el tabaco 5. Agendar múltiples sesiones, presenciales o no, para dar seguimiento en relación con el cese o no del uso del tabaco Book 2.indb 162 Farmacoterapia de la neumopatía obstructiva crónica estable Se cuenta con broncodilatadores, corticoesteroides, inhibidores de la fosfodiesterasa-4, entre otros medicamentos. A continuación se muestran sus características generales y más adelante se ofrecen planes de tratamiento según el grupo al que el paciente pertenezca. Broncodilatadores Existen tres variedades importantes: beta-2 agonistas, anticolinérgicos y metilxantinas. • Beta-2 agonistas: funcionan al estimular los receptores beta-2 del músculo liso del árbol respiratorio y producir broncodilatación; existen de acción corta (4 a 6 h, p. ej., salbutamol) y acción larga (12 h o más, p. ej., salmeterol). No tienen efecto sobre la mortalidad o la progresión de la enfermedad, sin embargo se asocian con una menor tasa de hospitalización, en particular el salmeterol. Dentro de sus efectos adversos se puede presentar taquicardia sinusal, temblor e hipopotasiemia • Anticolinergicos: funcionan al bloquear los receptores muscarínicos, lo que impide que la acetilcolina los utilice; existen de acción corta (alrededor de 8 h, p. ej., bromuro de ipratropio) y acción larga (24 h o más, p. ej., bromuro de tiotropio). El bromuro de tiotropio reduce exacerbaciones y hospitalizaciones, al tiempo que mejora la sintomatología y el estado de salud. Dentro de sus efectos adversos, el más frecuente es la sequedad de boca y en ocasiones un sabor metálico; si se usan nebulizados con mascarilla facial puede precipitar la aparición de glaucoma agudo • Metilxantinas: la teofilina es el fármaco utilizado con más frecuencia en este grupo. Su uso queda muy limitado, ya que no muestra mejoría sobre los beta-2 agonistas ni los anticolinérgicos. Se ha comprobado que en combinación con salmeterol mejora las capacidades pulmonares más que el uso de cada uno por separado. Dentro de su efectos adversos se describen la aparición de arritmias (auriculares o ventriculares), convulsiones, cefalea, insomnio, náusea, pirosis, así como múltiples interacciones farmacológicas Los broncodilatadores antes referidos siempre se prefieren en combinación. La de primera elección es el uso de un beta-2 agonista de corta duración más un anticolinérgico, que muestra mejoría general de la sintomatología, además de no generar taquifilaxia. Al manejo previo puede agregarse teofilina, que muestra una discreta mejoría de los síntomas en algunos estudios. Corticoesteroides Su uso es limitado y siempre se deberán utilizar de forma inhalada, dado que las administraciones orales muestran efectos adversos sistémicos que no justifican su uso en la neumopatía obstructiva crónica. Los tres aprobados para su uso son beclometasona, budesonida y fluticasona. El uso regular de corticoesteroides inhalados mejora la sintomatología, la función pulmonar, la calidad de vida y reduce la frecuencia de las exacerbaciones, sobre todo en pacientes con una FEV1 < 60% de la predicha; sin embargo no modifican la progresión de la enfermedad o la mortalidad. Su uso se recomienda en combinación con broncodilatadores, sobre todo con aquellos de acción larga. Los efectos adversos de mayor relevancia son candidosis oral, ronquera, lesiones cutáneas y aumento en el riesgo de padecer neumonía. Inhibidores de la fosfodiesterasa-4 El objetivo de este grupo de fármacos es reducir la inflamación por medio de la inhibición en la destrucción del AMPc intracelular. Se administran de forma oral una vez al día y siempre en combinación con al menos un broncodilatador. El único recomendado según las guías actuales es el roflumilast, que reduce la intensidad de la sintomatología en exacerbaciones moderadas a severas. Dentro de sus efectos adversos se presentan náusea, hiporexia, dolor abdominal, diarrea, alteraciones del 3/2/15 2:47 PM 163 Otros tratamientos farmacológicos Vacunas Las vacunas recomendadas en pacientes con neumopatía obstructiva crónica son aquellas contra influenza estacional y neumococo; ambas producen mejores resultados en pacientes mayores de 65 años de edad. Sin embargo su uso no debe restringirse a ese grupo etario, sobre todo la segunda ha demostrado una reducción en la incidencia de neumonía adquirida en la comunidad en pacientes con FEV1 < 40%. Antibióticos Su uso queda restringido a exacerbaciones donde se documente infección; el uso rutinario como profilaxis no está indicado. No existen resultados de importancia estadística significativa que apoyen el uso de mucolíticos, inmunorreguladores, antitusígenos, vasodilatadores o narcóticos en los pacientes con neumopatía obstructiva crónica. TRATAMIENTO NO FARMACOLÓGICO: REhAbILITACIÓN PULMONAR Establecer un programa de rehabilitación pulmonar en los pacientes con neumopatía obstructiva crónica es recomendable; éste deberá incluir: ejercicio, cese del hábito tabáquico, apoyo nutricional y educación relacionada con su enfermedad. OTROS TRATAMIENTOS Oxigenoterapia El uso de oxígeno suplementario ha mostrado mejorar la supervivencia, sobre todo en aquellos pacientes con hipoxemia severa en reposo; el mismo se deberá utilizar por al menos 15 h al día. Las indicaciones más precisas para su uso son: - PaO2 < 55 mm Hg o SaO2 < 88%, con o sin hipercapnia; lo anterior confirmado en dos tomas en un lapso de al menos 3 semanas - PaO2 entre 55 y 60 mm Hg o SaO2 < 88% y evidencia de hipertensión pulmonar, datos de insuficiencia cardiaca o eritrocitosis (hematocrito > 55%) Soporte ventilatorio El uso de modalidades no invasivas de ventilación como el CPAP en casos de neumopatía obstructiva crónica severa, en paciente estables, ha mostrado beneficios en relación con la supervivencia y el riesgo de admisión hospitalaria. TRATAMIENTO qUIRÚRGICO Algunos manejos quirúrgicos que han mostrado beneficio en los pacientes con neumopatía obstructiva crónica son la reducción pulmonar y el trasplante. La cirugía de reducción pulmonar es importante sobre todo en los pacientes con deficiencia de alfa-1 antitripsina, o aquellos con enfisema de predominio en lóbulos superiores y una capacidad de ejercicio muy baja. La intención es resecar el tejido afectado, con lo que mejora la dinámica respiratoria del resto del parénquima, disminuye el uso de músculos accesorios de la respiración y mejoran los patrones de gases arteriales. El trasplante pulmonar se reserva para pacientes muy selectos. Dentro de los criterios para considerar Book 2.indb 163 a un paciente candidato son un índice BODE que exceda los cinco puntos, el manejo y las complicaciones de estos paciente, lo que queda fuera de los objetivos del presente capítulo. MANEjO INICIAL SEGÚN GRUPO DE RIESGO Como se describió en la primera sección de este capítulo, existen cuatro grandes grupos de pacientes; las recomendaciones para su manejo inicial son las siguientes: • GrupoA:pacientesconpocossíntomasybajoriesgo de exacerbaciones. Tratamiento de primera elección: broncodilatadores (beta-2 agonistas o anticolinérgicos) de acción corta por razón necesaria • GrupoB:pacientessintomáticosconbajoriesgode exacerbaciones. Tratamiento de primera elección: broncodilatadores (beta-2 agonistas o anticolinérgicos) de acción larga de forma continua y broncodilatadores de acción corta como terapia de rescate • Grupo C: pacientes poco sintomáticos pero con alto riesgo de exacerbaciones. Tratamiento de primera elección: combinación de esteroide inhalado con broncodilatador de acción larga (beta-2 agonistas o anticolinérgicos) y como rescate broncodilatadores de acción corta • GrupoD:pacientesmuysintomáticosyconaltoriesgo de exacerbaciones. Tratamiento de primera elección: combinación de esteroide inhalado con broncodilatador de acción larga (beta-2 agonistas y/o anticolinérgicos) y como rescate broncodilatadores de acción corta En todos los grupos el uso de xantinas puede complementar la terapéutica, y para el grupo D también se puede agregar carbocisteína. Se deberá tener en cuenta que siempre se preferirá el uso de broncodilatadores de acción larga sobre los de acción corta. El uso de beta-2 agonistas junto con anticolinérgicos, tanto de acción larga como corta, se deberá de considerar si la monoterapia con alguno no limita la sintomatología. No se recomienda la monoterapia con corticoesteroides inhalados; siempre deberán estar asociados con broncodilatadores. EXACERbACIÓN DE LA NEUMOPATÍA ObSTRUCTIvA CRÓNICA Una exacerbación de la neumopatía obstructiva crónica se define como un evento agudo que empeora la sintomatología del paciente, modifica su patrón cotidiano de tos, expectoración o cambios en las características de esta última, y siempre obliga a un cambio en el tratamiento habitual. La importancia de reconocer y tratar las exacerbaciones radica en que éstas afectan de forma negativa la calidad de vida del paciente, aceleran el deterioro de la función pulmonar y están asociadas con una mortalidad elevada, en particular en aquellos pacientes que requieren manejo avanzado de la vía aérea, pues reportan una mortalidad de hasta 40% y una mortalidad general a 3 años de hasta 49%. CAUSAS Las causas más comunes de exacerbación son las infecciones respiratorias, tanto virales como bacterianas. Otra causa menos frecuente es la contaminación del aire; sin embargo, hasta en una tercera parte de los pacientes no se logrará demostrar el origen de la exacerbación. FACTORES DE RIESGO La presencia de exacerbaciones frecuentes, definidas como dos o más en 1 año, es el mejor predictor para una nueva exacerbación. El uso de oxígeno suplementario ha mostrado mejorar la supervivencia. Una exacerbación de la neumopatía obstructiva crónica se define como un evento agudo que empeora la sintomatología del paciente, modifica su patrón cotidiano de tos, expectoración o cambios en las características de esta última, y siempre obliga a un cambio en el tratamiento habitual. La causa más común de exacerbación son las infecciones respiratorias, tanto virales como bacterianas. La presencia de exacerbaciones frecuentes, definidas como 2 o más en 1 año, es el mejor predictor de una nueva exacerbación. Sección 2 | Neumología sueño y cefalea. Sus contraindicaciones son la coexistencia de depresión o el uso concomitante de xantinas. 3/2/15 2:47 PM 164 Algunas condiciones que pueden imitar o agravar una exacerbación son la neumonía, el embolismo pulmonar, la insuficiencia cardiaca congestiva, las arritmias cardiacas, el neumotórax o el derrame pleural. Diagnóstico Éste es meramente clínico; se sospecha ante un cambio en el patrón de síntomas respiratorios del paciente, sobre todo en relación con disnea, tos, esputo y cambios en las características de este último. La realización de espirometría en las exacerbaciones no está indicado. Los tres grupos de medicamentos eje en las exacerbaciones son broncodilatadores, corticoesteroides y antibióticos. Guía EXARMED Los microorganismos bacterianos causales de exacerbaciones más comunes incluyen Haemophilus influenzae, Streptococcus pneumoniae y Moraxella catarrhalis. El tratamiento empírico inicial es a base de una aminopenicilina con/sin ácido clavulánico más un macrólido, o una tetraciclina. Book 2.indb 164 Abordaje Además de un adecuado interrogatorio y una exploración física oportuna, se deberá poner particular atención en los datos de gravedad de la enfermedad, como: uso de músculos accesorios, respiración paradójica, presencia o aumento de la cianosis central, presencia de edema periférico, inestabilidad hemodinámica y alteraciones en el estado de alerta. Algunos de los exámenes que se deberán solicitar de forma rutinaria para realizar un adecuado abordaje son: gasometría arterial en busca de hipoxemia o hipercapnia; radiografía de tórax para evidenciar o excluir otras patologías; electrocardiograma para diagnosticar trastornos cardiacos asociados; biometría hemática para valorar la existencia de hematocrito elevado, leucocitosis o anemia; química sanguínea en busca de alteraciones electrolíticas o hiperglucémicas, a menudo asociadas con las exacerbaciones; y realización de cultivos de esputo y antibiograma, indicados en caso de que el manejo inicial con antibioticoterapia empírica no muestre resultados favorables. Realizar una espirometría en las exacerbaciones no está indicado. Indicadores de manejo intra o extrahospitalario El 80% de las exacerbaciones puede tratarse de forma extrahospitalaria. Las indicaciones para lo contrario son: desarrollo súbito de disnea de reposo, neumopatía obstructiva crónica en estadios avanzados, presencia de signos de gravedad ya descritos, falla de respuesta al tratamiento ambulatorio, exacerbaciones frecuentes, edad avanzada y falta de red de apoyo social. Tratamiento Los objetivos del tratamiento son disminuir el impacto de la exacerbación sobre la enfermedad de base, así como prevenir la recurrencia. Los tres grupos de medicamentos eje en las exacerbaciones son los broncodilatadores, los corticoesteroides y los antibióticos. Broncodilatadores Se preferirán broncodilatadores de acción corta tipo beta-2 agonistas con o sin anticolinérgicos asociados. Como segunda línea de tratamiento se podrá considerar el uso de metilxantinas por vía intravenosa (teofilina o aminofilina). Corticoesteroides El uso de esteroides sistémicos en las exacerbaciones ha demostrado acortar el tiempo de recuperación, así como mejorar la función pulmonar y la hipoxemia. Se prefieren prednisona por vía oral o budesonida por vía inhalada, aunque no se cuenta con estudios para determinar la duración del tratamiento. Antibióticos El uso de antibióticos ha demostrado disminuir en 77% el riesgo de muerte a corto plazo, en 53% la falla al tratamiento y la producción de esputo purulento en 43%. En pacientes tratados de forma extrahospitalaria el uso de cultivos no está indicado, dado el tiempo que tardan los mismos en ofrecer resultados. Los marcadores como la procalcitonina III, específica de infecciones bacterianas, ofrecen resultados más prontos, pero dado su costo elevado aún no se utilizan de manera frecuente. Las indicaciones más aceptadas para el inicio de antibioticoterapia son aquellos pacientes con: esputo purulento, aumento en el volumen del esputo y/o aumento de la disnea; e individuos que requieren ventilación mecánica. Los microorganismos bacterianos causales de exacerbaciones más comunes incluyen Haemophilus influenzae, Streptococcus pneumoniae y Moraxella catarrhalis, aunque en pacientes clasificados como GOLD 3 y 4 Pseudomonas aeruginosa también se vuelve importante. Si bien el uso de antibióticos debe basarse en los patrones de resistencia locales, muchas veces no se cuenta con los mismos, por lo que el tratamiento empírico inicial es a base de una aminopenicilina con/sin ácido clavulánico, más un macrólido o una tetraciclina, bajo el entendido de que en cuanto se cuente con resultados de cultivos y antibiograma, el esquema deberá ser ajustado a los mismos. La duración recomendada del tratamiento antibiótico es de 5 a 10 días. Tratamiento adyuvante Otros puntos a considerar en el tratamiento de las exacerbaciones son un adecuado aporte de líquidos con atención a la administración de diuréticos, el uso de anticoagulantes, un adecuado aporte nutricional y el manejo de comorbilidades. Soporte respiratorio Oxigenoterapia: siempre se deberá utilizar oxígeno suplementario con el objetivos de mantener saturaciones arteriales de oxígeno entre 88 y 92%, evitando también la presencia de hipercapnia o acidosis. Soporte ventilatorio Es esencial reconocer a aquellos pacientes que ameritan cuidados intensivos con el uso de apoyo ventilatorio, ya sea en su modalidad no invasiva o invasiva. Las indicaciones para admisión en la unidad de cuidados intensivos se resumen en el Cuadro 2.5.3. Cuadro 2.5.3. Indicaciones de admisión a unidad de cuidados intensivos • • • • • Disnea grave que no responde al manejo inicial Cambios en el estado neurológico (confusión, letargo, coma) Persistencia o progresión de la hipoxemia (PaO2 < 40 mm Hg) y/o acidosis respiratoria (pH < 7.25) a pesar de utilizar oxígeno suplementario o ventilación no invasiva Necesidad de asistencia mecánica ventilatoria Inestabilidad hemodinámica – necesidad de vasopresores Adaptado de: Global Initiative for Chroic Obstructive Lung Disease, Global Strategy for the Diagnosis, Managment, and Prevention of Chronic Obstructive Pulmonary Disease, Updated 2013. 3/2/15 2:47 PM 165 Cuadro 2.5.4. Indicaciones para inicio de soporte mecánico ventilatorio invasivo y no invasivo No invasiva Invasiva Al menos una de las siguientes: • • • • • • Acidosis respiratoria (pH arterial ≤ 7.35 y/o PaCO2 ≥ 45 mm Hg) Disnea grave y fatiga de músculos respiratorios, aumento del trabajo para respirar, uso de músculos accesorios de la respiración, respiración paradójica o retracción intercostal • • • • • • Falla de tolerancia o mejoría con ventilación no invasiva Paro respiratorio o cardiaco Pausas respiratorias con pérdida de la conciencia Disminución del estado de alerta y agitación psicomotriz que no logra controlarse con sedación Aspiración masiva Mala mecánica de deglución Frecuencia cardiaca < 50 latidos por minuto con pérdida del estado de alerta Inestabilidad hemodinámica que no responde a líquidos o vasopresores Arritmias ventriculares Hipoxemia que pone en riesgo la vida en pacientes que no toleran la ventilación no invasiva Adaptado de: Global Initiative for Chroic Obstructive Lung Disease, Global Strategy for the Diagnosis, Managment, and Prevention Of Chronic Obstructive Pulmonary Disease, Updated 2013. Las indicaciones para ventilación mecánica no invasiva e invasiva se resumen en el Cuadro 2.5.4. EGRESO hOSPITALARIO Y SEGUIMIENTO Previo a su egreso, el paciente deberá comenzar su manejo con broncodilatadores de acción larga y corticoesteroides inhalados según se requiera. Los criterios de egreso hospitalario se resumen en el Cuadro 2.5.5. REINGRESO • • • • • • • Adecuado control con el uso de broncodilatadores de larga acción con/sin uso de corticoesteroides inhalados Uso de beta-2 agonistas de corta acción a intervalos mayores de 4 h El paciente es capaz de deambular en su habitación (si era posible previo al ingreso), y comer y dormir sin presentar disnea Estabilidad clínica y de gases arteriales por 12 a 24 h El paciente o su cuidador comprende el modo de empleo de sus medicamentos Se cuenta con red de apoyo social y elementos terapéuticos necesarios (p. ej., cuidador, oxígeno domiciliario, alimentos, medicamentos) Tanto el médico, como los familiares y el paciente consideran que este último puede continuar su manejo en casa Adaptado de: Global Initiative for Chroic Obstructive Lung Disease, Global Strategy for the Diagnosis, Managment, and Prevention of Chronic Obstructive Pulmonary Disease, Updated 2013. Sección 2 | Neumología El antecedente de ingreso hospitalario, uso de corticoesteroides orales, oxígeno suplementario por periodos largos, baja calidad de vida y sedentarismo son predictores de reingreso en pacientes con neumopatía obstructiva crónica. Cuadro 2.5.5. Requisitos para el egreso hospitalario Book 2.indb 165 3/2/15 2:47 PM 166 6. Neumopatías intersticiales difusas INTRODUCCIÓN Las enfermedades intersticiales se presentan con un patrón pulmonar restrictivo: capacidad vital forzada disminuida, la relación “capacidad vital forzada/volumen espirado forzado en el primer segundo” dentro de límites normales o aumentada y grados variables de volumen espirado forzado en el primer segundo. El diagnóstico diferencial deberá realizarse con neoplasias, infección por VIH, linfoma, tuberculosis y edema pulmonar crónico asociado a estenosis mitral. La fibrosis pulmonar idiopática es la neumopatía intersticial más frecuente. Es un grupo de enfermedades parenquimatosas del pulmón, con características funcionales similares y con afectación desde la inflamación hasta la fibrosis y comprenden más de 200 causas. Para su estudio se divide en cuatro grupos: 1. Las enfermedades intersticiales con causa etiológica conocida, como neumonitis por hipersensibilidad, como la asociada a exposición a aves o el pulmón del granjero, las asociadas a fármacos o a enfermedades reumáticas como lupus eritematoso sistémico o artritis reumatoide. 2. Las neumopatías intersticiales idiopáticas (Cuadro 2.6.1). 3. Las enfermedades granulomatosas como la sarcoidsis. 4. Otras (histiocitosis X, linfangioleimiomatosis y la proteinosis alveolar). Éstas se presentan con tos seca, disnea que se incrementa al ejercicio, en la espirometría se observa capacidad vital forzada disminuida, la relación “capacidad vital forzada/volumen espirado forzado en el primer segundo” dentro de límites normales o aumentada y grados variables de volumen espirado forzado en el primer segundo, es decir un patrón que sugiere restricción; además en la radiografía de tórax se observa disminución del volumen pulmonar y opacidades bilaterales difusas. La tomografía de alta resolución es de vital importancia ya que hay imágenes que pueden inclinar al Cuadro 2.6.1. Neumonías intersticiales idiopáticas Fibrosis pulmonar idiopática Neumonía intersticial no específica Neumonía organizada criptogénica Neumonía intersticial aguda Bronquiolitis respiratoria asociada a enfermedad pulmonar intersticial Neumonía intersticial descamativa Neumonía intersticial linfoidea clínico a una entidad u otra como se verá más adelante. Sin embargo en ocasiones para su diagnóstico preciso se requerirá de biopsia pulmonar y de un patólogo experimentado en este grupo de enfermedades. Pruebas adicionales son la caminata de 6 min, en la que se manifiesta hipoxemia. En la fibrobroncoscopia, el lavado bronquioalveolar es el dato más orientador y en algunos casos, como en la proteinosis, el aspecto microscópico también es diagnóstico o en la hemosiderosis pulmonar en la que se identificarán macrófagos cargados de hemosiderina. La acumulación de macrófagos con citoplasma color café puede tener tinciones para hierro positivas en la neumopatía intersticial descamativa, asociada fuertemente al hábito de fumar. Resumiendo, para el diagnóstico se precisa de conjuntar los datos de la historia clínica, pruebas de función respiratoria, imagen y patología. El diagnóstico diferencial deberá realizarse con neoplasias, infección por VIH, linfoma, tuberculosis y edema pulmonar crónico asociado a estenosis mitral. El tratamiento y el pronóstico son diferentes para cada una de ellas, nos limitaremos a describir brevemente a las dos más frecuentes. FIBROSIS PULMONAR IDIOPÁTICA Es la más frecuente de las neumopatías intersticiales, para el diagnóstico existen criterios mayores y menores (Cuadro 2.6.2), en la radiografía se observan opacidades reticulares y en panal de abeja, de predominio en la periférica y basal, así como disminución del tamaño de campos pulmonares. En la tomografía de alta resolución se pueden observar bronquiectasias de tracción, distorsión de la arquitectura y vidrio despulido. En la biopsia se observa alternancia de pulmón sano y zonas de inflamación y fibrosis, focos de fibroblastos. Fibrosis densa causando remodelación pulmonar con panal de abeja, pequeños acúmulos de fibroblastos y miofibroblastos alargados en forma de huso, de distribución subpleural y paraseptal. La enfermedad es rápidamente progresiva; promedio de supervivencia cinco años posterior al diagnóstico, aunque hay quienes progresan de manera rápida con supervivencia menor a un año. El tratamiento es Cuadro 2.6.2. Criterios de la ATS/ERS 2001 para el diagnóstico de fibrosis pulmonar idiopática en ausencia de biopsia pulmonar Criterios mayores Exclusión de otras causas conocidas de enfermedad pulmonar intersticial, como toxicidad por fármacos, exposición ambiental y enfermedades del tejido conectivo Pruebas de función respiratoria que sugieran restricción, deterioro en el intercambio gaseoso y disminución de la difusión de CO Opacidades reticulares bibasales con mínimo vidrio despulido en la tomografía de alta definición Biopsia transbronquial o lavado bronquioloalveolar no compatible con otro diagnóstico Criterios menores Guía EXARMED Edad > 50 años Book 2.indb 166 Disnea al ejercicio o de comienzo insidioso Más de tres meses con la enfermedad Estertores tipo “velcro” en región subescapular bilateral ATS: American Thoracic Society; ERS: European Respiratory Society. 3/2/15 2:47 PM 167 a base de prednisona 0.5 mg/kg/d y azatioprina dosis máxima 150 mg/d o ciclofosfamida 150 mg/d. Nuevos fármacos como pirfenidona e imatinibo, bosentan y sildenafil se han administrado como tratamiento de la hipertensión pulmonar secundaria. ALvEOLITIS ALÉRGICA EXTRÍNSECA Sección 2 | Neumología Puede ser de inicio agudo en 4 a 8 h. La fiebre, escalofríos, disnea, malestar general disminuyen gradualmente en 24 h, o subaguda semanas o meses después de exposición continua al factor desencadenante, frecuentemente aves, aunque se han identificado múltiples sustancias orgánicas que desencadenan una hipersensibilidad. En la radiografía hay imagen en vidrio despulido, consoli- dación alveolar, menos frecuente opacidades nodulares y reticulares. En formas crónicas puede haber panal de abejas y es más intenso en zonas media e inferior. En la tomografía de alta resolución se observa imagen en mosaico, parches de atrapamiento aéreo. En la biopsia neumonitis granulomatosa intersticial bronquiolocéntrica, infiltrado mononuclear, predominio de linfocitos, células plasmáticas y macrófagos. Sin necrosis central. A mayor cronicidad, grados variables de fibrosis y quistes. El tratamiento es con dosis altas de esteroides en la etapa aguda, metilprednisolona 1 g IV al día por tres días y mantenimiento con prednisona 1 mg/kg/d. El pronóstico es bueno aunque hay formas que progresan a la fibrosis y otras con crisis intermitentes. Book 2.indb 167 3/2/15 2:47 PM 168 7. Neumoconiosis INTRODUCCIÓN El 90% del consumo de asbesto es bajo la forma de asbesto blanco. Los productos en los que se encuentra el asbesto más comúnmente son: los materiales para pulir piedras preciosas, afiladores de piedra, resistencias de electrodomésticos, en algunos plásticos. El consumo de tabaco suele aumentar el riesgo de asbestosis, por alteración del sistema inmunitario. Guía EXARMED En la placa posteroanterior de tórax del paciente con asbestosis suelen observarse pequeñas opacidades irregulares que al principio de la enfermedad son de localización periférica y basal. Se ha descrito una hiperclaridad alrededor de la silueta cardiaca. En la asbestosis, en la tomografía de alta resolución pueden observarse desde las fases iniciales de la fibrosis, es decir, alteraciones inflamatorias como son vidrio despulido, hasta lesiones fibróticas, con engrosamiento de los septos interlobares. Book 2.indb 168 La neumoconiosis se define como la enfermedad pulmonar provocada por la acumulación de polvos minerales secundaria a la inhalación crónica de los mismos. Adquieren su nombre específico según el material con el que se haya estado en contacto. Por ejemplo: asbestosis traduce una enfermedad pulmonar por la exposición a asbesto, la silicosis provocada por el sílice, siderosis por la acumulación pulmonar de hierro, la antracosis es secundaria a la exposición de carbón. Se desconoce la cantidad precisa de personas expuestas a polvos minerales a nivel mundial, sin embargo se sabe que por lo menos más de 30% de esas personas, desafortunadamente, desarrollarán algún tipo de enfermedad relacionada. Los materiales que se han visto involucrados principalmente son el asbesto, el sílice, el carbón, el berilio, el hierro, etcétera. La respuesta tisular que provocan estos materiales depende de varios factores como son: • El tamaño y las propiedades de las partículas. • La intensidad y el tiempo de la exposición. • El estado inmunológico del paciente. El daño depende totalmente del equilibrio entre la inhalación y el aclaramiento ciliar del pulmón. La principal reacción causada por este tipo de materiales es la fibrosis pulmonar, sin embargo, hay una gama muy grande de las lesiones, como son placas pleurales y lesiones del parénquima pulmonar en parches, neumonitis y hasta obstrucción de las vías aéreas, dando como resultado enfermedad pulmonar obstructiva crónica. CLASIFICACIÓN RADIOGRÁFICA Debido a la gran variedad de patrones radiográficos, fue necesario establecer una clasificación internacional, la cual se estableció en 1992 por la International Labour Organization. La clasificación radiológica consiste en otorgar una letra a las opacidades observadas, según su tamaño, subdiviéndolas inicialmente en pequeñas o grandes opacidades. Opacidades pequeñas Opacidades nodulares: redondeadas de bordes bien definidos. Se otorga el tamaño según su diámetro: p: < 1.5 mm q: 1.5 a 3 mm r: > 3 mm Opacidades irregulares: bordes mal definidos, sin una forma específica. Se toman en cuenta las medidas hechas en las partes más anchas de la lesión: s: < 1.5 mm t: 1.5 a 3 mm u: > 3 mm Se califica también la profusión, es decir la cantidad de lesiones observadas en la Rx. 0: opacidades ausentes. 1: opacidades presentes pero en escaso número. 2: abundantes opacidades pequeñas y diseminadas en moderada cantidad que oscurecen parcialmente las marcas normales del pulmón. 3: opacidades pequeñas diseminadas en gran cantidad que oscurecen completamente las marcas normales pulmonares. Opacidades grandes Se clasifican en tres categorías diferentes, dependiendo de su tamaño. A: 1 a 5 cm de diámetro o varias opacidades de 1 cm cada una. B: 5 a 10 cm o varias lesiones que juntas tengan un tamaño equivalente menor al lóbulo superior derecho. C: > 10 cm o varias lesiones que juntas tengan un tamaño equivalente mayor al lóbulo superior derecho. Adicionalmente se les da un número del 1 al 3 según se observa la extensión en la radiografía lateral. 1: un cuarto. 2: de un cuarto a la mitad. 3: más de la mitad. También se gradúa la extensión del engrosamiento pleural: a: < 5 mm b: 5 a 10 mm c: > 10 mm ASBESTOSIS Introducción Hay tres tipos principales de asbesto que son: amosita, asbesto azul (cocidolite) y asbesto blanco (crisotilo), aunque se pueden encontrar otros tipos como: antofilite, termolite, actinolite. Las formas en las que se inhalan las fibras del asbesto son dos: anfibole y las serpentinas. El 90% del consumo de asbesto es bajo la forma de asbesto blanco. Éste es más soluble y tiende a fragmentarse más fácilmente. Fisiopatogenia La exposición al asbesto puede darse de forma directa, es decir, cuando se trabaja directamente con materiales o en lugares en los que exista una gran cantidad de asbesto. La exposición indirecta está considerada como la que resulta de vivir o trabajar en un lugar cercano a sitios de gran concentración de asbesto. Los productos en los que se encuentra el asbesto más comúnmente son: los materiales para pulir piedras preciosas, afiladores de piedra, resistencias de electrodomésticos, en algunos plásticos. La enfermedad debida a este material tiene tres formas principales de presentación que son: • Placas pleurales benignas hasta en 40%. • Enfermedad maligna, representada por el mesotelioma maligno hasta 20%. • Asbestosis como tal en 40%. El aclaramiento ciliar depende en gran medida del tamaño de partículas inhaladas. Éstas una vez que llegan a los espacios alveolares son fagocitadas por los macrófagos. Cuando las fibras tienen menos de 3 μm de diámetro los macrófagos pueden fagocitarlas fácilmente, sin embargo, si las fibras son de mayor tamaño pueden ser fagocitadas incompletamente aun cuando varios macrófagos estén involucrados. Este conjunto recibe el nombre de cuerpos de asbesto. Una vez que son las fibras fagocitadas, son transportadas, también por los macrófagos, hacia los ganglios y después a la pleura, donde suelen depositarse para for- 3/2/15 2:47 PM 169 CUADRO CLÍNICO Y DIAGNÓSTICO Para establecer el diagnóstico de asbestosis es necesario observar una relación clara entre exposición al asbesto y enfermedad pulmonar (fibrosis). El consumo de tabaco suele aumentar el riesgo de asbestosis, por alteración del sistema inmunitario. Las zonas principales de afección de la asbestosis son las inferiores y las regiones subpleurales. El primer síntoma que se reporta es la disnea, la cual se va haciendo progresiva. Posteriormente se agrega tos seca, pertinaz. Cuando el paciente es fumador la tos puede convertirse en productiva. A la exploración física suelen encontrarse inicialmente estertores crepitantes basales y, según sea el progreso de la enfermedad, se van haciendo ascendentes. En algunas ocasiones puede observarse hipocratismo. En la placa posteroanterior de tórax suelen observarse pequeñas opacidades irregulares que al principio de la enfermedad son de localización periférica y basal. Se ha descrito una hiperclaridad alrededor de la silueta cardiaca (Figura 2.7.1). En la tomografía de alta resolución pueden observarse desde las fases iniciales de la fibrosis, es decir, alteraciones inflamatorias como son vidrio despulido, hasta lesiones fibróticas con engrosamiento de los septos interlobares. Asimismo pueden hallarse algunas lesiones pleurales caracterizadas por placas en la pleura parietal, con engrosamiento de la pleura visceral en casi 100% de los casos. En estados avanzados puede encontrarse incluso panalización. El patrón funcional observado en los enfermos con asbestosis suele ser restrictivo, sin embargo, en los fumadores puede hallarse un componente obstructivo. La difusión de monóxido está disminuida sobre todo en los casos avanzados. El diagnóstico se hace consignando la historia de exposición al asbesto, sin embargo, este antecedente debe buscarse intencionalmente, ya que para el paciente podría no tener relación o la importancia debida. Debe correlacionar con manifestaciones clínicas, radiológicas y tomográficas. El diagnóstico no suele ser sencillo, sobre todo en las fases iniciales en las cuales puede recurrirse al lavado bronquioalveolar y, en casos específicos, hasta la biopsia pulmonar a cielo abierto. fundición, demolición o reparación de estructuras de concreto, taladrar piedras. FISIOPATOGENIA Las formas de la enfermedad por sílice son: silicosis aguda o sílicoproteinosis, silicosis acelerada, silicosis crónica y fibrosis progresiva masiva. La forma aguda es una forma en la cual se observan características histológicas de proteinosis. La silicosis acelerada es una forma de silicosis aguda, que se desarrolla en tres a siete años aproximadamente. La forma crónica es la más frecuente y está caracterizada por nódulos con un centro fibrótico, el cual está rodeado de parénquima con cúmulos de sílice que ha sido fagocitado por los macrófagos. Existe una forma más que es la complicada o también llamada fibrosis masiva progresiva. En ella se observan nódulos confluentes que se localizan principalmente en lóbulos superiores, que se relacionan con una pobre calidad de vida. En cuanto a la patogenia de la silicosis, al igual que en otras enfermedades exposicionales, la forma de presentación de la enfermedad depende en gran medida de la intensidad y tiempo de exposición, así como del tamaño de las partículas. La enfermedad por sílice tiene asociación con varias enfermedades más como: • Tuberculosis pulmonar, en la cual las lesiones nodulares pueden encontrarse cavitadas. Los pacientes que presentan enfermedad por sílice, son 20 a 30 veces más susceptibles ante Mycobacterium tuberculosis, así como para micobacterias no tuberculosas. • Artritisreumatoide,enlacualsepuedenencontrar nódulos reumatoideos concomitantemente con nódulos silicóticos. • Esclerodermia. • Lupuseritematososistémico. • Enfermedadrenalprogresiva.Sedesconocelacausa, sin embargo se han postulado la lesión directa y la glomerulonefritis mediada por inmunocomplejos. SILICOSIS INTRODUCCIÓN Es una enfermedad ocupacional provocada por inhalación de cristales de sílice, en la mayoría de las veces en sus formas de cuarzo, aunque también existen otras formas como son: crisobalite, tridimite. Las actividades que se relacionan como de riesgo para adquirir esta enfermedad son: la construcción, la Book 2.indb 169 Figura 2.7.1. Paciente que muestra lesiones de asbestosis. La silicosis se relaciona con una mayor susceptibilidad a tuberculosis, artritis reumatoide, esclerodermia, lupus y enfermedad renal progresiva. La silicosis se caracteriza radiológicamente por pequeñas opacidades redondeadas con distribución en la mayoría de los casos bilateralmente, de localización en lóbulos superiores. En la antracosis hay mayor susceptibilidad a presentar artritis reumatoide, y cuando se presentan ambas condiciones, se conoce como síndrome de Caplan. Sección 2 | Neumología mar posteriormente las placas pleurales. Sin embargo, los cuerpos de asbesto no siempre llegan a los ganglios y simplemente se acumulan de manera progresiva en espacios aéreos y en el intersticio. Las células afectadas liberan algunas sustancias proinflamatorias como citocinas, fibronectina y colágena, causando así migración de otras células de defensa y favorecen la proliferación de fibroblastos, provocando zonas de regeneración parenquimatosa. Observándose inicialmente como zonas de regeneración, luego estas zonas proliferan a lo largo del parénquima provocando la asbestosis, es decir la fibrosis pulmonar. 3/2/15 2:47 PM 170 Cuadro clínico y diagnóstico El síntoma principal es la disnea, la cual es progresiva. Raramente se encuentran otros síntomas o signos. En los fumadores se ha observado tos productiva. Radiológicamente se caracteriza por pequeñas opacidades redondeadas con distribución bilateral en la mayoría de los casos, de localización en lóbulos superiores. Puede haber crecimiento de adenopatías hiliares, las cuales pueden calcificarse en una forma característica, conocida como “cáscara de huevo”. En la tomografía se pueden observar lesiones en etapas tempranas (Figura 2.7.2). Funcionalmente la silicosis se comporta con limitación al flujo aéreo y con reducción de la capacidad de difusión. N E U MOCON IOSIS DE LOS TRABAJADOR ES DEL CARBÓN O ANTRACOSIS Introduccíón Esta es una enfermedad exposicional provocada por la inhalación crónica de carbón. Existen dos formas principales de antracosis: • La mácula o nódulo antracótico. • Fibrosis pulmonar masiva. La forma más común en la que se encuentra el carbón es conocida como antracite, que constituye hasta 93%. La forma menos común es el lignito. Se ha observado una relación importante entre el carbón y la exposición con sílice, encontrando en algunos casos enfermedades concomitantes. Fisiopatogenia Asimismo, hay relación con artritis reumatoide, aunque a diferencia de la silicosis, no se ha visto una susceptibilidad especialmente marcada para la tuberculosis pulmonar. A esta asociación se le conoce como síndrome de Caplan, en el cual debe haber un nódulo reumatoideo que en algunas ocasiones puede cavitarse debido a la necrosis central o bien puede calcificarse. Suele verse rodeada de parénquima que muestra datos de vasculitis y clínica de artritis reumatoide de base. No se ha establecido una relación causa-efecto entre la inhalación de polvo de carbón con el desarrollo de enfermedad reumatoidea. Sin embargo, ésta sí confiere una susceptibilidad incrementada en los que tienen exposición a carbón para desarrollar enfermedad pulmonar. Figura 2.7.2. Tomografía de alta resolución con lesiones de silicosis. Diagnóstico La mácula o mancha de carbón suele ser una lesión de menos de 5 cm que se puede observar principalmente en las regiones apicales. En ocasiones rodeada de parénquima que muestra enfisema centroacinar (Figura 2.7.3). CONCLUSIONES Guía EXARMED Figura 2.7.3. Laminilla que muestra acúmulos de carbón (antracosis). (Véase Atlas en color.) Existen tantas neumoconiosis como diversidad de polvos minerales. Continúan siendo una causa importante de morbimortalidad a nivel mundial con un impacto económico muy relevante. A pesar de que se han hecho intentos para prevenir la neumoconosis prevención, las industrias relacionadas con la construcción, con el procesamiento y uso de metales, y la explotación minera son los principales factores que impiden que las acciones preventivas no tengan un resultado positivo en los pacientes expuestos a estos polvos. Book 2.indb 170 3/2/15 2:47 PM 171 8. hipertensión arterial pulmonar ETIOLOGÍA Y FISIOPATOGENIA No está del todo claro si los diversos tipos de hipertensión arterial pulmonar tienen en común los procesos fisiopatológicos y patobiológicos que los caracterizan, sin embargo gracias a los esfuerzos de los investigadores durante estas últimas dos décadas se han demostrado tres factores trascendentales que incrementan las resistencias vasculares pulmonares: a) vasoconstricción sostenida, b) proliferación vascular pulmonar y c) trombosis in situ, condicionando así una arteriolopatía obstructiva que se describe en la histopatología de acuerdo con los criterios de Heath y Edwards y no serán revisados en este capítulo. En cuanto a las cau- Book 2.indb 171 sas se ha propuesto que hay una respuesta o agresión inicial inducida por un agente externo o por un proceso inicial conocido que en los antecedentes del paciente se ha establecido previamente, pudiéndose presentar en un individuo con predisposición genética. El avance en el entendimiento de los mecanismos tanto celulares como moleculares sugiere que la disfunción endotelial pulmonar juega un rol pivote y trascendental en dichos procesos fisiopatológicos, teniendo un claro imbalance entre las sustancias vasodilatadoras (óxido nítrico, prostaciclina o prostaglandina 1-2 y recientemente el péptido intestinal vasoactivo) y vasoconstrictoras (tromboxano A-2, endotelina-1, serotonina, así como sus transportadores y el factor de crecimiento derivado de células endoteliales). Recientemente se han descubierto las alteraciones genéticas que contribuyen a los procesos patobiológicos, sobre todo en pacientes con hipertensión arterial pulmonar familiar, encontrándose una alteración en los receptores que codifican para los factores transformadores de crecimiento tipo beta, los cuales regulan el crecimiento, movilización, y regulación de la angiogénesis y apoptosis celular. Por otro lado se ha descrito una alteración en los canales de potasio que se activan por voltaje que contribuyen al potencial de membrana del músculo liso vascular pulmonar, y que ante una regulación a la baja de dichos canales, el potasio permanece dentro de la célula, aumentando el potencial de despolarización del músculo liso y promoviendo una vasoconstricción sostenida. Se ha descrito que algunos fármacos anorexígenos (fenfluramina y fentermina) tienen el potencial de inhibir dichos canales, desarrollando hipertensión arterial pulmonar. Además de lo antes señalado, también se han propuesto teorías como un aumento en la respuesta inflamatoria en este tipo de pacientes, encontrándose citocinas inflamatorias altas, así como sustancias protrombóticas altas que podrían encajar en alguno de los tres mecanismos mencionados previamente (Cuadro 2.8.2). La hipertensión arterial pulmonar se define como una presión arterial pulmonar media mayor a 25 mm Hg en reposo o de 30 mm Hg durante el ejercicio, con la adición de una presión capilar pulmonar menor de 15 mm Hg. CUADRO CLÍNICO El síntoma que con mayor frecuencia y más tempranamente se presenta en los pacientes con hipertensión arterial pulmonar es la disnea progresiva al hacer es- Cuadro 2.8.1. Clasificación diagnóstica de la hipertensión arterial pulmonar 1. Hipertensión arterial pulmonar 1.1. Hipertensión arterial pulmonar idiopática (antes llamada primaria) a) Esporádica b) Familiar 1.2. Asociada con: a) Enfermedad de la colágena vascular b) Cortocircuito sistémico-pulmonar congénito (fenómeno de Eisenmenger) c) Hipertensión portal d) Infección por el VIH e) Fármacos o toxinas: I. Anorexígenos (fenfluramina y fentermina) II. Otras f) Hipertensión pulmonar persistente del recién nacido g) Otras VIH: virus de la inmunodeficiencia humana. Sección 2 | Neumología INTRODUCCIÓN La circulación pulmonar se encuentra situada estratégicamente con el fin de poder recibir la totalidad del gasto cardiaco, lo que no sólo permite el intercambio gaseoso, sino también el de realizar funciones metabólicas y vasoactivas importantes, además de ser un órgano extenso que se encarga de manejar volúmenes y bajas resistencias y presiones. Son muchas las condiciones patológicas que afectan a la circulación pulmonar, generando hipertensión pulmonar, uno de los grandes síndromes cardiocirculatorios que ha recibido mayor impacto en cuanto a las investigaciones desde el punto de vista fisiopatológico y terapéutico en la última década. Se define a la hipertensión arterial pulmonar como una entidad que afecta a la circulación arterial pulmonar a nivel de las pequeñas arterias y arteriolar, caracterizada por una proliferación fibromuscular y remodelación vascular endotelial; hemodinámicamente se define como una presión arterial pulmonar media mayor a 25 mm Hg en reposo o de 30 mm Hg durante el ejercicio, con la adición de una presión capilar pulmonar menor de 15 mm Hg. En 2003, el Tercer Congreso Mundial de Hipertensión Arterial Pulmonar celebrado en Venecia, Italia, propuso una nueva clasificación, en la cual el subgrupo de pacientes con hipertensión arterial pulmonar perteneció al Grupo I con respecto a los demás grupos de hipertensión pulmonar (Cuadro 2.8.1). Con respecto a la epidemiología se tiene que la sobrevida media en pacientes con hipertensión arterial pulmonar sin tratamiento es de 2.5 años, sin embargo hay que tomar en cuenta que cada subgrupo de pacientes con hipertensión arterial pulmonar va a variar en cuanto a la epidemiología, pero se tiene en general que la incidencia anual es de uno a dos casos por 1 000 000 en la población general, con una edad media de diagnóstico de 36 años, y una predominancia en el sexo femenino en cuanto a la hipertensión arterial pulmonar idiopática (primaria); sin embargo las incidencias de la hipertensión arterial pulmonar asociadas a otros procesos patológicos se encuentra poco estudiada, como por ejemplo en el caso de la asociación con el virus de la inmunodeficiencia humana o con la hipertensión portal. Los casos de hipertensión arterial pulmonar familiar representan 10% de todos los casos; la hipertensión arterial pulmonar asociada a síndrome o fenómeno de Eisenmenger (cortocircuito de derecha a izquierda) representa 30 a 35% de los casos, así como en 30 a 40% representan a la hipertensión arterial pulmonar idiopática (primaria). 3/2/15 2:47 PM 172 Cuadro 2.8.2. Mediadores químicos en la respuesta vascular pulmonar fisiopatogénica de la hipertensión arterial pulmonar Vasoconstricción Proliferación celular Trombosis in situ Aumento de tromboxano Aumento del factor Aumento A-2 de crecimiento de tromboxano A-2 vascular endotelial Disminución Disminución de prostaciclina Disminución de prostaciclina de prostaciclina Disminución de óxido Disminución de óxido nítrico Disminución de óxido nítriconítrico Aumento de endotelina-1 Aumento de endotelina-1 Aumento de serotonina Aumento de serotonina La hipertensión pulmonar se presenta principalmente con disnea progresiva, acompañada de fatiga, presíncope o síncope, edema de miembros inferiores así como dolor precordial secundario a isquemia del ventrículo derecho. Guía EXARMED A la auscultación cardiaca se puede identificar un segundo ruido en su componente pulmonar desdoblado o acentuado a pesar de maniobra de handgrip o de Valsalva, así como la presencia de galope sobre el precordio correspondiente al ventrículo derecho. Book 2.indb 172 Aumento de serotonina fuerzo. La disnea es inespecífica, generalmente tiene un tiempo de instalación hasta de dos años, llegando a ser queja principal por la cual los pacientes acuden al médico. Otros síntomas comunes incluyen la fatiga, presíncope o síncope, edema de miembros inferiores así como dolor precordial secundario a isquemia del ventrículo derecho. En la exploración física los hallazgos pueden variar dependiendo de la intensidad del padecimiento. Las venas yugulares internas en el cuello pueden presentar ondas a prominentes sugestivas de ingurgitación yugular y que se traducen fisopatológicamente en contracción auricular derecha por falla ventricular derecha crónica, así como presencia de ondas v sugerentes de regurgitación tricuspídea por insuficiencia tricuspídea funcional. A la auscultación cardiaca se puede identificar un segundo ruido en su componente pulmonar desdoblado o acentuado, y que dicho desdoblamiento se mantiene a pesar de maniobra de handgrip o de Valsalva, así como la presencia de galope sobre el precordio correspondiente al ventrículo derecho. En pacientes con hipertrofia ventricular derecha importante puede detectarse a la palpación levantamiento presistólico en el precordio. En la exploración periférica se pueden encontrar datos sugestivos de congestión venosa periférica, como edema de miembros inferiores. DIAGNÓSTICO Llevar a cabo una excelente historia y exploración clínicas, así como con estudios paraclínicos al alcance de cualquier consultorio como un electrocardiograma y una telerradiografía de tórax que sugiera el diagnóstico, marcará la pauta a seguir ante la sospecha diagnóstica de hipertensión arterial pulmonar, siguiendo un proceso diagnóstico ordenado que permita establecer la potencial causa de la hipertensión arterial pulmonar. El ecocardiograma transtorácico permite establecer si existe afección estructural (anatómica) valvular o miocárdica como probable causante, así como poder establecer la presencia de cortocircuitos de izquierda a derecha como la existencia de una comunicación interauricular o interventricular, la persistencia de conducto arterioso o la presencia de una ventana aortopulmonar. Junto con la telerradiografía de tórax, las pruebas de función respiratoria permiten establecer la presencia de alguna neumopatía ya sea tanto obstructiva como restrictiva que esté condicionando hipertensión arterial pulmonar; la polisomnografía está indicada en caso que se encontraran estigmas clínicos de apnea del sueño (somnolencia diurna excesiva, ronquidos característi- cos y eritrocitosis en la citometría hemática); el gammagrama pulmonar ventilatorio-perfusorio es un estudio clave en el cual se puede detectar la hipertensión arterial pulmonar tromboembólica crónica; la confirmación diagnóstica se puede detectar por medio de una angiografía pulmonar y con la tomografía helicoidal de alta resolución con el fin de establecer un tratamiento quirúrgico adecuado, siendo una de las pocas formas de hipertensión arterial pulmonar potencialmente curables; las pruebas serológicas específicas confirmarán la causa de la hipertensión arterial pulmonar en los casos de enfermedades de la colágena vascular así como en la infección por el virus de la inmunodeficiencia humana. El diagnóstico de la hipertensión arterial pulmonar idiopática se establece al excluir todas las formas asociadas. Finalmente el cateterismo de cavidades derechas es el paso final y más importante para poder confirmar el diagnóstico, y no sólo esto, sino también la extensión y el grado de reversibilidad de la hipertensión arterial pulmonar a través de un reto farmacológico agudo que se explicará brevemente. TRATAMIENTO Puesto que los procesos vasoconstrictores juegan un papel fundamental en la fisiopatogenia e historia natural de la hipertensión arterial pulmonar, el tratamiento con fármacos vasodilatadores se basa en tales procesos. Desafortunadamente no puede predecirse quién responderá sin deterioro a la administración de vasodilatadores orales, como son los antagonistas de los canales de calcio, sin embargo llevar a cabo un reto farmacológico agudo puede predecir qué subgrupo de pacientes puede tener una respuesta sostenida a dichos agente. Se define una prueba positiva cuando al administrar vasodilatadores endovenosos de acción corta como por ejemplo adenosina o epoprostenol (prostaglandina 1-2) existe una disminución de 10 mm Hg o mayor en la presión arterial pulmonar media o como un descenso en más de 25% de las resistencias vasculares pulmonares sin presentar variación en la presión arterial sistémica y sin una disminución del gasto cardiaco importante sin embargo estudios prospectivos de corte han demostrado que solamente de 7 a 10% responden a dicho reto. Los antagonistas de los canales de calcio han sido los que primero se estudiaron, al igual que la warfarina, dada la trascendencia del componente de trombosis in situ, mejorando la sobrevida de dichos pacientes, sobre todo en su forma idiopática, sin embargo sólo menos de 10% de pacientes responderá favorablemente a esta línea de medicamentos. En los últimos años se han estudiado diversos fármacos con propiedades tanto vasodilatadoras como antiproliferativas en el tratamiento de diversas formas de hipertensión arterial pulmonar, sobre todo en la idiopática, la asociada a cardiopatías congénitas y la asociada a lupus eritematoso sistémico. Los prostanoides son sustancias tanto vasodilatadoras como antiproliferativas, pudiéndose administrar por varias vías, epoprostenol intravenoso, el iloprost inhalado, el treprostinil subcutáneo y el beraprost en tableta, teniendo resultados favorables en ensayos clínicos, el mecanismo de acción radica en estimular la producción de AMP cíclico como segundo mensajero induciendo vasodilatación. Otro tipo de medicamentos incluyen los antagonistas de los receptores a endotelina tipo-1, como el bosentan y el sitaxsentan, y cuya elaboración fue pensada en tener una inhibición a dichos receptores que tienen 3/2/15 2:47 PM 173 una capacidad vasoconstrictora y proliferativa muy potente, ambos medicamentos administrados por vía oral. Como se ha demostrado científicamente, en pacientes con hipertensión arterial pulmonar existe un déficit relativo de óxido nítrico, por lo que los inhibidores de fosfodiesterasas tipo 5, al prolongar la vida media de los segundos mensajeros guanilato de monofosfato cíclico, prolongan el efecto vasodilatador y antiproliferativo del óxido nítrico en pacientes con hipertensión arterial pulmonar, como es el caso del sildenafil que ha sido recientemente aprobado por la Administración de fármacos y alimentos a nivel mundial, siendo uno de los fármacos de primera línea en el tratamiento por vía oral en esta entidad. PRONÓSTICO Sección 2 | Neumología El pronóstico es deletéreo y muy pobre si no se trata la hipertensión arterial pulmonar y sobre todo si no se atiende el problema de base que se tiene como causa de hipertensión arterial pulmonar con el objetivo de detectarla de manera temprana y teniendo una intervención certera en estadios tempranos de la enfermedad. En estudios observacionales se tiene una sobrevida de 2.5 años aproximadamente a partir del diagnóstico, en comparación de una supervivencia a cinco años de 75 a 85% en pacientes con tratamiento adecuado y adyuvante con combinación o sinergismo de fármacos con diferentes mecanismos de acción, representando una estrategia lógica en futuros ensayos clínicos multicéntricos prospectivos, siendo las variables hemodinámicas más importantes para establecer el pronóstico la presión media de la arteria pulmonar, la presión auricular derecha y el gasto cardiaco, así como una capacidad funcional con pobre tolerancia al ejercicio al momento de diagnosticar la enfermedad, teniendo la necesidad de llevar a cabo manejo paliativo como la septostomía interauricular e incluso la realización de trasplante pulmonar bilateral. Book 2.indb 173 3/2/15 2:47 PM 174 9. Tromboembolia pulmonar aguda INTRODUCCIÓN La trombosis venosa profunda y la tromboembolia pulmonar aguda forman parte de un mismo espectro clínico complejo llamado enfermedad tromboembólica venosa. Guía EXARMED La tríada de Virchow incluye: trauma vascular, estasis venosa y estado hipercoagulable o trombofílico. Book 2.indb 174 A pesar de los avances en el conocimiento médico, la tromboembolia pulmonar aguda sigue siendo un problema común, subdiagnosticada y frecuentemente fatal que afecta a la población general y en particular a los enfermos hospitalizados. La tromboembolia pulmonar aguda forma parte de un espectro complejo que se conoce con el nombre de enfermedad tromboembólica venosa, en el cual la trombosis venosa profunda forma parte de dicho espectro y al ocurrir un desprendimiento de trombo desde el sistema venoso profundo periférico llega a obstruir la circulación arterial pulmonar en diferentes grados. En el mundo occidental la incidencia de tromboembolia pulmonar aguda se estima en 0.5 por 1 000; corresponde a 5 a 10% de todas las muertes intrahospitalarias; la magnitud de este problema va en aumento, reflejándose en los estudios de necropsia, en donde se han encontrando incidencias constantes en lo que a la mortalidad respecta (15 a 17.5% en pacientes hospitalizados). FISIOPATOGENIA Y ETIOLOGÍA Hace más de 150 años, Virchow identificó tres factores de riesgo pivotes que han contribuido al desarrollo de trombosis venosa: a) disminución del flujo sanguíneo o estasis venosa; b) lesión o traumatismo vascular; c) estado hipercoagulable o trombofílico. Esta aseveración ha sido corroborada por diversos estudios, siendo hoy por hoy la base para la categorización de una gran lista de factores de riesgo individuales en donde cada uno de dichos factores encaja en uno o varios componentes de la tríada de Virchow. Las condiciones clínicas asociadas a los primeros dos componentes se pueden detectar al llevar a cabo una minuciosa historia clínica, como el antecedente de inmovilización prolongada. Otros factores de riesgo, como la obesidad y el llevar a cabo viajes de larga duración (trasatlánticos), se comportan como factores adicionales y pueden contribuir al desarrollo de tromboembolia pulmonar aguda en el contexto de la coexistencia de otros factores de riesgo. Siempre es importante considerar la presencia de más de un componente de la tríada de Virchow. Dentro de los estados hipercoagulables caben destacar a las trombofilias primarias (hereditarias), entre las que se encuentran las clásicas deficiencias de antitrombina, proteínas C y S, la mutación del factor V de Leiden (que origina resistencia a la proteína C) y la mutación del gen de la protrombina G20210A, en sus variantes homo y heterocigotas, entre otras. Estos trastornos han sido considerados como factores de riesgo independientes para el desarrollo de trombosis venosa. Dentro de las trombofilias adquiridas cabe mencionar la presencia del anticoagulante lúpico en el síndrome antifosfolipídico secundario a lupus eritematoso generalizado, mediadores liberados por células malignas en diversos adenocarcinomas (mama, ovario, páncreas, pulmón y tracto gastrointestinal). En embarazadas a término el riesgo de tromboembolia pulmonar aguda es cinco veces mayor, representando la principal causa de morbimortalidad en el último trimestre. Los anticonceptivos orales también incrementan la probabilidad de enfermedad tromboembólica venosa, siendo aparentemente los anticonceptivos de tercera generación (desogestrel, gestodene y proges- terona), en combinación con estrógenos a dosis bajas, los más trombogénicos. Este riesgo todavía es mucho mayor en presencia de una trombofilia primaria oculta, la cual puede llegar a expresarse clínicamente ante la ingesta crónica de dichos agentes. El comportamiento fisiopatológico y la gravedad de la tromboembolia pulmonar aguda se encuentran relacionados principalmente con la magnitud (tamaño) del trombo alojado en la circulación pulmonar, la presión media de la arteria pulmonar, el grado de hipoxemia, la frecuencia cardiaca, la presión arterial sistémica, y el estado cardiopulmonar previo del paciente (paciente previamente sano o no). En estadios tempranos puede encontrarse el gasto cardiaco normal o elevado, lo cual es resultado del aumento de la actividad simpática en respuesta a la hipoxemia (disminución en la relación ventilación/perfusión). Esto aumentará la precarga (curva de Frank-Starling), generando un gradiente de presión favorable para el ventrículo derecho, y así manteniéndose un gasto cardiaco casi normal. Por otro lado, el aumento en la presión ventricular derecha, así como en su radio, incrementa el estrés parietal de una manera significativa al grado de producirse isquemia subendocárdica ventricular derecha (Ley de Laplace), tanto por factores mecánicos como por el aumento en las demandas miocárdicas elevadas de oxígeno. En el caso de la tromboembolia pulmonar masiva, en pocas horas se produce una falla de los mecanismos compensatorios previamente mencionados. Primero se incrementa la presión arterial pulmonar produciendo secundariamente dilatación ventricular. El aumento en las dimensiones del ventrículo derecho causa un abombamiento del septum interventricular hacia el ventrículo izquierdo, afectando la distensibilidad de este último, especialmente durante el periodo de relajación, o diástole. Todo esto concluye en una disminución marcada en el volumen latido, con una respuesta cronotrópica compensatoria (para mantener el gasto cardiaco en niveles óptimos). La falla en los mecanismos compensatorios se manifiesta clínicamente como taquicardia sinusal y, finalmente, como hipotensión arterial sistémicaque llevará al paciente a la muerte en poco tiempo. CUADRO CLÍNICO Por el amplio espectro clínico de la tromboembolia pulmonar aguda, la estratificación y el diagnóstico no pueden establecerse con base en un único síntoma o signo, ni en la información proporcionada por una única prueba que evalúe el estado de la circulación arterial pulmonar. El diagnóstico requerirá de un alto grado de sospecha clínica, basándose principalmente en las siguientes características: a) uno o más factores de riesgo para el desarrollo de tromboembolia pulmonar (previamente descritos); b) comorbilidades (p. ej., cáncer); c) síntomas y signos clínicos (Cuadro 2.9.1); d) hallazgos paraclínicos, y e) demostración objetiva de la hipoxemia y trombosis. Sintomatología como disnea súbita sostenida, taquicardia sostenida, hipotensión arterial sistólica (menor de 100 mm Hg), síncope, dolor precordial anterior (simula el del infarto agudo al miocardio) o colapso cardiorrespiratorio se ha correlacionado con una obstrucción mayor a 30%. Los hallazgos clínicos que sugieren hipertensión arterial pulmonar grave (obs- 3/2/15 2:47 PM DIAGNÓSTICO Es un hecho que la historia clínica y la exploración física darán la pauta para elegir correctamente las herramientas diagnósticas de apoyo. El electrocardiograma proporcionará datos inespecíficos, siendo la taquicardia sinusal la alteración más frecuente; sin embargo, en pacientes sin cardiopatía previa tiene alta sensibilidad para identificar la dilatación aguda del ventrículo derecho: eje de QRS mayor a 90°, patrón S-I, Q-III, T-III y ondas T negativas profundas de V-1 a V-4. En la mayoría de los pacientes la radiografía del tórax es normal, aunque en un bajo porcentaje se encuentra oligoemia focal, elevación de uno o ambos hemidiafragmas, así como dilatación del tronco de la arteria pulmonar. La hipoxemia y la alcalosis respiratoria aguda (resultado de la taquipnea) son las alteraciones gasométricas que se presentan con más frecuencia ante un episodio tromboembólico aunque también es común observar un gradiente alveolo-arterial mayor de 20 mm Hg. El dímero D representa un producto de degradación de los puentes de fibrina, el cual se libera hacia la circulación ante la fibrinólisis endógena, y su medición en sangre se ha correlacionado con una alta sensibilidad (90 a 95%) y una baja especificidad (45 a 50%), así como un valor predictivo negativo de 99.6% (la ausencia de la elevación del dímero D prácticamente descartaría un episodio tromboembólico). El gammagrama ventilatorio-perfusorio representa el estudio inicial para el diagnóstico definitivo de tromboembolia pulmonar, ya que es capaz de demostrar defectos en su fase perfusoria de uno o más segmentos broncopulmonares. Se considerará un estudio de alta probabilidad cuando en la fase perfusoria existen dos o más segmentos afectados, ante una fase ventilatoria normal, logrando con esto una sensibilidad y especificidad bastante aceptables (85 a 90%). La angiografía pulmonar selectiva actualmente se mantiene como el estándar de oro para el diagnóstico definitivo de tromboembolia pulmonar aguda, con una sensibilidad y una especificidad de 98 y 95%, respectivamente. Es importante mencionar que este procedimiento no está exento de complicaciones, por lo que hoy en día se han investigado otros métodos de diagnóstico, como la tomografía computada helicoidal, que recientemente se han reportado con altas sensibilidades y especificidades para el diagnóstico (90 a 96%); otra herramienta que también ha sido ampliamente aceptada en la práctica clínica es el ecocardiograma transtorácico, el cual obtiene parámetros tanto directos como indirectos sugestivos de tromboembolia pulmonar aguda, con una sensibilidad y especificidad de 79 y 89%, respectivamente. En el Cuadro 2.9.2 se muestran los diagnósticos diferenciales en tromboembolia pulmonar aguda. Book 2.indb 175 175 TRATAMIENTO La heparina constituye la piedra angular y el estándar de oro para el tratamiento, teniendo como mecanismo de acción la unión con la antitrombina III e inhibiendo indirectamente a la trombina, previniendo la formación de trombo adicional y facilitando la fibrinólisis endógena. La heparina no fraccionada se administra por vía endovenosa de tres a cinco días iniciando con un bolo e infusión continua, la cual se ajusta dependiendo del tiempo parcial de tromboplastina activado y cuyo objetivo es tener de 1.5 a 2.5 veces lo normal de dicho tiempo de coagulación, con una frecuencia en la monitorización de cada 6 a 8 h. Hoy en día las heparinas de bajo peso molecular han demostrado ser igual de eficaces y seguras, ofreciendo algunas ventajas sobre la heparina no fraccionada, como una vida media más larga, una respuesta antitrombínica más predecible, sin necesidad de monitoreo estricto y menor riesgo de hemorragia. El tratamiento con acenocumarínicos (warfarina y acenocumarina disponibles en México) constituye el manejo a largo plazo por vía oral, el cual se inicia entre el primer y el segundo días después del inicio de la heparina. El mecanismo de acción depende de la inhibición de la carboxilación de los factores de coagulación II, VII, IX y X (factores vitamina K dependientes). Se deberá monitorizar al paciente con el International Normalized Ratio (Índice Internacional Normalizado, conocido como INR), cuya meta es entre 2 a 3, llevando a cabo el traslape con la heparina por dos a tres días, pudiendo discontinuar la heparina y seguir con el anticoagulante oral a largo plazo. El tiempo de tratamiento con acenocumarínicos dependerá del tipo de evento y la coexistencia de factores de riesgo, ya sean transitorios o permanentes. La terapia fibrinolítica con estreptocinasa, urocinasa o factor activador del plasminógeno recombinante está actualmente reservada e indicada sólo para pacientes con tromboembolia pulmonar aguda masiva y con datos clínicos de inestabilidad hemodinámica (hipotensión arterial, choque cardiogénico y disfunción ventricular derecha grave). Los tres agentes actúan con- El estándar de oro para el diagnóstico de la tromboembolia pulmonar aguda sigue siendo la angiografía pulmonar. La heparina representa el estándar de oro para el tratamiento inicial de la tromboembolia pulmonar aguda. La indicación principal para el uso de fibrinolíticos radica en los pacientes con episodio masivo que se encuentran con inestabilidad hemodinámica (taquicardia, hipotensión arterial y choque cardiogénico). Cuadro 2.9.1. Signos y síntomas más frecuentes en tromboembolia pulmonar aguda Síntomas Signos • Disneadeesfuerzo • Taquipnea • Síncope • Taquicardia • Dolorprecordial • Diaforesis • Diaforesis • Segundoruidopulmonaracentuadoogalopederecho • Tos • Hipotensiónarterialsistémica • Hemoptisis • Edemademiembrosinferiores Cuadro 2.9.2. Diagnósticos diferenciales en tromboembolia pulmonar aguda 1. Síndromes coronarios agudos 6. Disección aórtica 2. Neumonía 7. Hipertensión arterial pulmonar 3. Exacerbación de neuropatía obstructiva crónica 8. Neumotórax 4. Edema pulmonar 9. Costocondritis (síndrome de Tietze) 5. Taponamiento cardiaco 10. Fractura costal Sección 2 | Neumología trucción mayor a 30%) y falla ventricular derecha son principalmente el levantamiento del área paraesternal izquierda, el aumento en la intensidad del componente pulmonar del segundo ruido cardiaco o desdoblamiento fijo de éste, la presencia de un soplo sistólico cuya intensidad se incrementa al hacer una pausa inspiratoria forzada, un tercer ruido derecho y la presencia de plétora yugular. Ante una tromboembolia pulmonar menor (obstrucción menor a 30%) el paciente puede presentar únicamente disnea moderada, taquicardia transitoria, dolor pleural, tos, y en ocasiones esputo hemoptoico, así como con frote pleural. 3/2/15 2:47 PM 176 ª En pacientes quirúrgicos de riesgo tromboembólico elevado se debe utilizar heparina de bajo peso molecular como medida profiláctica. virtiendo directa o indirectamente el plasminógeno en plasmina, facilitando la lisis del émbolo por medio de la rotura de los enlaces cruzados de fibrina. Una complicación importante a considerar cuando se administran fibrinolíticos es la ocurrencia de hemorragia intracraneal, la cual se presenta en 1% de los casos. Otras alternativas terapéuticas incluyen la colocación de filtros de vena cava inferior en caso de contraindicación de anticoagulación o recurrencia de eventos a pesar de encontrarse con un INR adecuado, así como la embolectomía, quirúrgica o en sala de hemodinámica, como terapia de rescate. PREVENCIÓN La prevención incluye métodos mecánicos y farmacológicos. Métodos mecánicos La gran ventaja de estos métodos es que no aumentan el riesgo de sangrado. Son efectivos en pacientes con un riesgo quirúrgico moderado y pueden ser combinados con métodos farmacológicos en pacientes de alto riesgo. Las desventajas de estos métodos son: a) falta evidencia que demuestre su efectividad; b) algunos pacientes no toleran su uso; c) están contraindicados en procesos isquémicos de miembros inferiores. Compresión mecánica intermitente Se cree que actúa mediante el incremento del flujo sanguíneo en las venas de los miembros inferiores; otras teorías implican la liberación de sustancias fibrinolíticas liberadas por la compresión de las paredes venosas. Medias de compresión gradual Al comprimir de manera decreciente, desde la pantorrilla hacia la raíz del muslo, actúan incrementando el flujo sanguíneo. Métodos farmacológicos Heparina de bajo peso molecular Estas heparinas han demostrado gran efectividad en todos los estudios controlados, aun en los pacientes de alto riesgo. Las dos ventajas de este grupo de medicamentos son 1) se administran en una sola dosis diaria, y 2) tienen menor incidencia de sangrado. Pentasacáridos Son inhibidores selectivos del factor X activado de la cascada de la coagulación. Hay estudios que demuestran que una inyección subcutánea diaria de estas drogas produce una reducción de la flebotrombosis profunda, aun por encima de las heparinas de bajo peso molecular. Aún es necesaria más evidencia al respecto. Anticoagulantes orales La warfarina se ha utilizado y demostrado su efectividad en pacientes con riesgos mediano y alto de trombosis venosa profunda. Su principal desventaja es la necesidad de frecuentes controles de laboratorio. Antiplaquetarios Ácido acetilsalicílico, dipiridamol y ticlopidina han demostrado poca efectividad en cuanto a la prevención de la trombosis venosa profunda. PRONÓSTICO En la mayoría de los pacientes la resolución completa del émbolo se presenta en varias semanas. El pronóstico más grave es para los pacientes que se presentan con tromboembolia pulmonar y compromiso hemodinámico. La duración de la anticoagulación oral es trascendental y depende de la coexistencia de factores de riesgo (transitorios o permanentes). Este tratamiento se deberá individualizar no sólo en cuanto a duración, sino también en cuanto a intensidad, con el objetivo de poder prevenir recurrencias, e incluso el desarrollo de hipertensión arterial pulmonar persistente que conlleva a un estado tromboembólico crónico con recanalización y persistencia de los síntomas en 3.5 a 4% de los pacientes posterior a un evento agudo. Guía EXARMED Heparina no fraccionada subcutánea En dosis bajas (5 000 U cada 8 a 12 h). Es un método efectivo y seguro tanto en pacientes posquirúrgicos, como ambulatorios, reduciendo la incidencia de la trombosis venosa profunda y de la tromboembolia pulmonar, y por tanto, la mortalidad intrahospitalaria. Existe un aumento en la frecuencia de hematomas posquirúrgicos pero no de sangrado mayor o fatal. Las contraindicaciones incluyen: a) trastornos hemorrágicos previos, sangrado activo, lesiones potencialmente sangrantes (úlcera activa, várices esofágicas, hipertensión intensa, endocarditis). Ocurre trombocitopenia en 0.3% de los pacientes que reciben heparina no fraccionada de manera profiláctica. Book 2.indb 176 3/2/15 2:47 PM 177 10. Edema agudo de pulmón FISIOPATOGENIA Y ETIOLOGÍA Los mecanismos patogénicos responsables de la formación de edema pulmonar son: 1. Aumento de la presión hidrostática capilar: infarto agudo al miocardio, estenosis mitral, estenosis aórtica, exacerbación de falla ventricular izquierda por insuficiencia cardiaca crónica o miocardiopatía, emergencia hipertensiva, taquiarritmias o bradiarritmias. 2. Aumento de la permeabilidad capilar, síndrome de insuficiencia respiratoria aguda (SIRPA), lesión pulmonar aguda, inhalación de toxinas, pancreatitis aguda, aspiración de contenido gástrico, sepsis. 3. Disminución del drenaje linfático: carcinomatosis linfangítica. 4. Disminución de la presión intersticial: posterior a evacuación rápida de neumotórax o derrame pleural, hiperinsuflación pulmonar. 5. Disminución de la presión osmótica: hipoalbuminemia, insuficiencia renal o hepática, síndrome nefrótico. 6. Causa incierta: grandes alturas, edema pulmonar neurogénico por traumatismo craneoencefálico, heroína, tromboembolia pulmonar, eclampsia. La causa más común de edema agudo pulmonar es la cardiogénica, es decir por incremento en la presión hidrostática capilar pulmonar, conservando la integridad de la membrana alveolocapilar. En el pulmón normal el líquido se mueve continuamente a partir de los capilares pulmonares hacia el tejido conectivo yuxtacapilar, donde su flujo es limitado por las uniones estrechas que existen entre los neumocitos tipos I y II, evitando su paso al interior de los alveolos, y es desviado hacia el tejido conectivo perimicrovascular y peribroncovascular de donde es canalizado a los vasos linfáticos, los cuales al tener una presión hidrostática muy baja, así como uniones intercelulares muy amplias los hacen permeables a macromoléculas y proteínas siendo capaces de reabsorber el exceso de líquido del tejido conectivo adyacente. La ley de Starling gobierna la pérdida de líquido del capilar pulmonar, y en ésta se tratan aquellas presiones que mantienen el líquido dentro de los capilares: la presión hidrostática del intersticio pulmonar y la presión oncótica del capilar pulmonar en contra de las presiones que favorecen la pérdida de líquido capilar: presión oncótica del intersticio pulmonar y la presión hidrostática del capilar pulmonar. Aunque en condiciones normales hay un balance positivo discreto para las fuerzas que favorecen la salida de líquido de los capilares, los vasos linfáticos son capaces de remover el exceso de fluidos evitando la acumulación de los mismo; sin embargo cuando éstos se ven superados sobreviene edema pulmonar. La remoción de líquido del interior de los alveolos depende del transporte activo de sodio y cloro (bomba sodio-potasio-ATPasa) a través de canales iónicos y de aquaporinas en la membrana epi- Book 2.indb 177 telial alveolar. El edema agudo de pulmón tiene dos fases: la primera es una “fase intersticial” en la que el líquido se encuentra en el tejido conectivo que rodea en forma de manguito, a los espacios alveolares (alveolar, perimicrovascular y peribroncovascular) y es bombeado por los linfáticos hacia los ganglios hiliares y mediastinales. Sin embargo si la llegada de líquido sobrepasa la capacidad de absorción linfática la presión intersticial distiende las uniones intercelulares del epitelio alveolar y sobreviene la segunda “fase alveolar”. Además existe paso a través del espacio intersticial subpleural visceral a la cavidad pleural pudiendo condicionar derrame pleural. Una vez que el líquido comienza a acumularse en el tejido pulmonar intersticial aparece una serie de eventos que perpetúan el ciclo: el edema alveolar interfiere con el intercambio gaseoso y ocasiona hipoxemia a través de alteraciones en la relación ventilación/ perfusión, cortocircuitos y finalmente en la difusión, provocando un incremento en la producción de catecolaminas y por consiguiente un aumento de las resistencias vasculares sistémicas y la presión arterial, elevando asimismo la tensión de la pared del miocardio y la demanda de oxígeno y desencadenando isquemia miocárdica así como disfunción sistólica y diastólica. Además de la disminución del gasto cardiaco y el aumento en las presiones de llenado de las cavidades izquierdas y de nuevo la acumulación de líquido a nivel pulmonar. CUADRO CLÍNICO El síntoma crucial es la disnea que al inicio puede estar relacionada con el ejercicio y posteriormente progresar hasta ser de pequeños esfuerzos y en reposo. Puede acompañarse o ser precedida por disnea paroxística nocturna y ortopnea. Si el cuadro es grave suele presentarse cianosis, tos productiva con expectoración asalmonada, diaforesis e intolerancia al decúbito, ansiedad. Los signos frecuentes son un tercer ruido y ritmo de galope ventricular con una especificidad de 97% y sensibilidad de 51% para elevación de la presión telediastólica y disfunción del ventrículo izquierdo, taquicardia, taquipnea, hipoxemia PaO2 < 60 mm Hg, incremento del trabajo respiratorio con tiraje intercostal y uso de músculos accesorios de la respiración, puede haber soplo de estenosis o insuficiencia mitral, y si existe además insuficiencia cardiaca derecha se presenta ingurgitación yugular, hepatomegalia congestiva, reflujo hepatoyugular y edema maleolar. La auscultación pulmonar arroja estertores crepitantes en “marea ascendente”, de predominio subescapulares bilaterales. DIAGNÓSTICO Las enzimas cardiacas, incluyendo troponina I y mioglobina, deben ser solicitadas siempre junto con un electrocardiograma ya que una causa frecuente es un síndrome coronario agudo, aunque cabe señalar que las troponinas pueden elevarse en situaciones de sepsis intensa, insuficiencia renal crónica, tromboembolia pulmonar. Se deberán solicitar entre otros exámenes, electrolitos séricos, examen toxicológico, osmolaridad sérica, amilasa y lipasa en pacientes con causa incierta. Edema pulmonar se refiere a la acumulación excesiva de líquido fuera del compartimento vascular pulmonar y su paso hacia el espacio intersticial, alveolar y en última instancia pleural. La causa más común de edema agudo pulmonar es la cardiogénica, es decir por incremento en la presión hidrostática capilar pulmonar, conservando la integridad de la membrana alveolocapilar. La ley de Starling gobierna la pérdida de líquido del capilar pulmonar, y en ésta se tratan aquellas presiones que mantienen el líquido dentro y fuera de los capilares. El síntoma crucial es la disnea que en un inicio puede estar relacionada con el ejercicio y posteriormente progresar hasta ser de pequeños esfuerzos y en reposo. Puede acompañarse o ser precedida por disnea paroxística nocturna y ortopnea. Sección 2 | Neumología INTRODUCCIÓN Edema de pulmón se refiere a la acumulación excesiva de líquido fuera del compartimento vascular pulmonar y su paso hacia el espacio intersticial, alveolar y en última instancia pleural. 3/2/15 2:47 PM 178 Si el péptido natriurético cerebral es mayor de 500 pg/mL es muy probable que exista insuficiencia cardiaca y el edema pulmonar sea por lo tanto cardiogénico. La cateterización arterial pulmonar es el estándar de oro para determinar la causa del edema pulmonar. Origen cardiogénico si la presión es superior a 18 mm Hg o no cardiogénico si es inferior o igual a 18 mm Hg. Guía EXARMED El tratamiento debe estar enfocado a disminuir la precarga y poscarga con objeto de lograr una redistribución de líquido, no simplemente a provocar diuresis. El péptido natriurético cerebral es secretado por ambos ventrículos en respuesta a un incremento en la presión intraventricular o aumento de la tensión de la pared del miocardio. En pacientes con falla cardiaca el péptido natriurético cerebral correlaciona con la presión telediastólica del ventrículo izquierdo y la presión en cuña de la arteria pulmonar. Se ha acordado que una cifra sérica menor a 100 pg/mL indica poca probabilidad de insuficiencia cardiaca (valor predictivo negativo mayor a 90%), mientras que si es mayor de 500 pg/mL es muy probable que exista falla cardiaca. Las cifras entre 100 y 500 pg/mL pueden encontrarse en pacientes con sepsis, tromboembolia pulmonar, cor pulmonale e hipertensión pulmonar. Estudios de imagen Radiografía de tórax posteroanterior (telerradiografía de tórax): se consideran como signos de alto valor diagnóstico los siguientes: presencia o no de cardiomegalia, pedículo vascular normal o ensanchado (mayor a 17 mm en mujeres o 19 mm en hombres), redistribución del flujo pulmonar, distribución en alas de mariposa, puede existir derrame pleural derecho o bilateral, lineas B de Kerley, ausencia de broncograma aéreo (Figura 2.10.1). Ecocardiografía transtorácica bidimensional (eco Doppler): debe ser considerada como el estudio de elección no invasivo en pacientes con sospecha de falla ventricular, en quienes por medio de la historia clínica, la exploración física y la radiografía de tórax no se ha llegado al diagnóstico. Es importante mencionar que un ecocardiograma sin Doppler no excluye el origen cardiogénico ya que se requiere este método para descartar disfunción diastólica. Cateterización arterial pulmonar: es el estándar de oro para determinar la causa del edema pulmonar, y permite monitorizar las presiones de llenado cardiacas, el gasto cardiaco, y las resistencias vasculares sistémicas y pulmonares durante el tratamiento. Una presión de oclusión de la arteria pulmonar (presión en cuña pulmonar) igual o superior a 18 mm Hg indica edema pulmonar cardiogénico o por sobrecarga de volumen. La medición de la presion venosa Figura 2.10.1. Radiografía de tórax de paciente con edema agudo de pulmón. Book 2.indb 178 central no debe ser considerada como sustituto válido de la presión en cuña ya que la hipertensión arterial pulmonar aguda o crónica puede ocasionar falsos positivos. Diagnóstico diferencial El diagnóstico diferencial es con edema agudo pulmonar no cardiogénico, dentro del que figuran la lesión pulmonar aguda y el síndrome de insuficiencia respiratoria aguda, así como todas las causas de estos, el edema secundario a disminución de la presión oncótica capilar como las insuficiencias renal y hepática, causas menos comunes son la infiltración linfangítica por cáncer y el edema posterior a la extracción rápida de aire o líquido de la cavidad pleural. Se propone que si con la historia clínica, exploración física y exámenes de laboratorio no se puede llegar a un diagnóstico probable etiológico, se realice un ecocardiograma transtorácico que es menos invasivo. Sin embargo si se cuenta con el recurso se realice la medición de la presión en cuña pulmonar con un catéter de Swan-Ganz lo que puede dividir en dos grandes grupos al edema agudo pulmonar: de origen cardiogénico si la presión es superior a 18 mm Hg o no cardiogénico si es inferior o igual a 18 mm Hg. TRATAMIENTO Reducción de la precarga La reducción de la precarga disminuye el llenado de las cavidades derechas y la presión hidrostática capilar pulmonar mejorando la disnea. Los fármacos utilizados son: nitroglicerina, sulfato de morfina y diuréticos de asa, así como nesiritide (péptido natriurético beta). La nitroglicerina es superior que el furosemide y el sulfato de morfina para reducir la precarga. Existen vías de administración transdérmica, sublingual e intravenosa. La vía preferida es la intravenosa con una dosis inicial de 10 a 20 μg/min hasta 100 μg/min. Se desarrolla taquifilaxia después de las primeras 12 h. Se contraindica si existe hipotensión arterial, uso concomitante con inhibidores de fosfodiesterasa (sildenafil), en estenosis aórtica e hipertensión pulmonar. El sulfato de morfina aumenta la capacitancia venosa periférica no así la central, y se ha observado que incrementa las presiones de llenado derechas y reduce el índice cardiaco por un efecto directo depresor del miocardio. La reducción de la producción de catecolaminas reduce secundariamente la ansiedad, sin embargo se prefieren dosis bajas de benzodiazepinas que no inciden en depresión miocárdica y respiratoria. Los diuréticos de asa fueron usados por muchos años como la piedra angular del tratamiento ya que disminuyen la precarga al inhibir la reabsorción de sodio y agua en la rama ascendente del asa de Henle incrementando el volumen urinario, sin embargo los pacientes con edema pulmonar cardiogénico tienen un aumento de las resistencias vasculares sistémicas y de la poscarga con hipoperfusión renal por lo que los diuréticos de asa provocan diuresis hasta 45 a 120 min después de su administración. Por otra parte hasta 40% de los pacientes con edema pulmonar cardiogénico tiene euvolemia o hipovolemia que puede empeorar el desequilibrio hidroelectrolítico. Nesiritide es una forma recombinante de péptido natriurético beta, el cual se consideró como una alternativa de nitroglicerina en pacientes con falla ventricular izquierda y edema pulmonar. Esta sustancia se produce en el miocardio y modula la diuresis, natriuresis, ve- 3/2/15 2:47 PM 179 nodilatación y vasodilatación, sin embargo se ha observado que los pacientes con falla cardiaca y edema pulmonar no sintetizan adecuadamente el péptido natriurético por lo que se consideró su uso, con una reducción de la presión en cuña pulmonar y un aumento del índice cardiaco. En un estudio reciente se comparó nitroglicerina intravenosa vs. nesiritide intravenoso en el que existe disminución de la presión en cuña pulmonar durante las primeras 24 h de administración (8.2 mm Hg con nesiritide y 6.3 mm Hg con nitroglicerina). Sin embargo otro estudio concluyó que los pacientes con edema agudo pulmonar cardiogénico que recibieron nesiritide tuvieron una elevación de creatinina sérica más significativa que aquellos sin tratamiento. Por lo anterior nesiritide está indicado en pacientes en quienes esté contraindicada la administración de nitroglicerina, o en aquellos que desarrollen taquifilaxia y requieran el medicamento por tiempo prolongado. VENTILACIÓN MECáNICA No invasiva La BiPAP (presión positiva binivel en la vía aérea) y la CPAP (presión positiva en la vía aérea continua) han demostrado reducir la necesidad de ventilación invasiva en pacientes con edema agudo pulmonar, así como los días de estancia en cuidados críticos. Invasiva La decisión de intubación debe ser clínica, no se deben esperar imágenes radiológicas como: hipoxemia, falta de respuesta a la ventilación no invasiva, alteraciones del estado de alerta, y choque cardiogénico. El edema agudo pulmonar de origen cardiogénico es una condición que pone en riesgo la vida, y alcanza una mortalidad de 15 a 20%, por lo que requiere un diagnóstico y tratamiento urgentes. PRONÓSTICO Los factores predictores de mortalidad en edema agudo pulmonar son: la necesidad de asistencia mecánica ventilatoria invasiva, la disfunción valvular aguda, la necesidad de soporte inotrópico, elevación de marcadores de lesión miocárdica, la presencia de disritmias o isquemia en el electrocardiograma, edad avanzada, falla renal, hipotensión, uso de digoxina, dolor torácico y anemia. El edema agudo pulmonar de origen cardiogénico es una condición que pone en riesgo la vida y alcanza una mortalidad de 15 a 20%, por lo que requiere un diagnóstico y tratamiento urgentes. El tratamiento debe estar enfocado a disminuir la precarga y poscarga con objeto de lograr una redistribución de líquido, no simplemente a provocar diuresis. El fármaco más efectivo en reducir la precarga y seguro continúa siendo la nitroglicerina, no así el péptido natriurético B que requiere más estudios para que su uso rutinario sea seguro. La combinación de medicamentos que disminuyan pre y poscarga, como nitroglicerina e inhibidores de la enzima convertidora de angiotensina, es más efectiva que la monoterapia. Sección 2 | Neumología REDUCCIÓN DE LA POSCARGA Debido a que los pacientes con edema pulmonar cardiogénico tienen una elevación de la resistencia vascular sistémica y depresión del gasto cardiaco, se benefician de la reducción en la poscarga con vasodilatadores como nitroglicerina, nitroprusiato, hidralazina, o inhibidores de la enzima convertidora de angiotensina disminuyen la poscarga y también la precarga, el llenado de las cavidades derechas, la presión en cuña pulmonar, y se ha demostrado que al mejorar el gasto cardiaco disminuyen la tasa de asistencia mecánica ventilatoria, el ingreso a la sala de cuidados intensivos y los días de estancia hospitalaria. Los inotrópicos (catecolaminas inhibidores de fosfodiesterasa) están indicados en pacientes con una función miocárdica deprimida, hipotensión arterial e intolerancia a agentes que reduzcan la precarga y poscarga. El levosimendan, un sensibilizador de calcio, es una alternativa de dobutamina y se sabe que mejora el gasto cardiaco y la presión en cuña pulmonar; disminuye además la mortalidad por edema pulmonar cardiogénico a 180 días. Book 2.indb 179 3/2/15 2:47 PM 180 11. Síndrome de insuficiencia respiratoria aguda El síndrome de insuficiencia respiratoria aguda es el desarrollo súbito de los síntomas, opacidades bilaterales alveolares o en parches, ausencia de insuficiencia cardiaca izquierda expresada por una presión capilar pulmonar menor a 18 mm Hg y una relación entre la presión arterial de oxígeno y la fracción inspirada de oxígeno menor a 200. INTRODUCCIÓN El síndrome de insuficiencia respiratoria aguda (SIRA), antes llamado síndrome de dificultad respiratoria progresiva del adulto (SIRPA) fue descrito por Ashbaugh y Petty en 1967 en una serie de pacientes con disnea, hipoxemia refractaria al tratamiento, disminución de la complianza pulmonar, e infiltrados pulmonares difusos en la radiografía de tórax. La definición establecida desde 1994 por el Consenso Americano-Europeo incluye el desarrollo súbito de los síntomas, opacidades bilaterales alveolares o en parches, ausencia de insuficiencia cardiaca izquierda expresada por una presión capilar pulmonar menor a 18 mm Hg y una relación entre la presión arterial de oxígeno y la fracción inspirada de oxígeno menor a 200 (PaO2/ FiO2 = < 200) que la diferencia de la lesión pulmonar aguda, en la cual la relación es mayor de 200 y menor de 300. La incidencia anual del SIRA se estima en 150 000 casos por año o 75 casos por cada 100 000 habitantes en Estados Unidos, y la mortalidad de los pacientes con SIRA se reporta como extremadamente alta hasta en 40 a 50%. FISIOPATOGENIA Y ETIOLOGÍA La mortalidad de los pacientes con SIRA se reporta como extremadamente alta hasta en 40 a 50%. Se describen tres fases patológicas: fase exudativa, fibroproliferativa y de resolución. Los principales mecanismos de hipoxemia son la desigualdad ventilaciónperfusión y los cortocircuitos intrapulmonares. Las causas más comunes de SIRA se pueden dividir en aquellas que producen lesión pulmonar directa y las que lo hacen de manera indirecta. En Norteamérica y Europa la primera causa de SIRA es sepsis (incluyendo neumonía), particularmente choque séptico con endotoxinas (lipopolisacáridos) circulantes, y la primera causa de sepsis grave y choque séptico es la neumonía (Cuadro 2.11.1). La aspiración de contenido gástrico se asocia a SIRA hasta en 40%, y en los pacientes politraumatizados el SIRA se relaciona con varios factores como transfusiones repetidas, fracturas múltiples de huesos largos y contusión pulmonar. La sobredosis de fármacos sobre todo con fines suicidas incluye ácido acetilsalicílico, barbitúricos, narcóticos y antidepresivos; entre los gases tóxicos destacan el dióxido de nitrógeno, el dióxido de azufre, amoniaco y oxígeno a altas concentraciones (> 40%). Se reconoce también que en la pancreatitis aguda el SIRA se asocia cuando existe insuficiencia hepática, cetoacidosis o uremia. El SIRA se caracteriza por una lesión inflamatoria aguda de los pulmones con alteración de la membrana alveolocapilar en un periodo máximo de 72 h posterior al evento desencadenante, y se describen tres fases patológicas: fase exudativa, fibroproliferativa y de resolución. Cuadro 2.11.1. Causas de síndrome de insuficiencia respiratoria aguda Lesión pulmonar directa Lesión pulmonar indirecta Guía EXARMED NeumoníaSepsis Aspiración de contenido gástrico Traumatismo grave Contusión pulmonar Sobredosis de drogas Ahogamiento Pancreatitis aguda Inhalación de gases tóxicos Transfusión de sangre Edema pulmonar postrasplante o embolectomía Book 2.indb 180 Fase exudativa: se desarrolla en los primeros cuatro a siete días de la agresión, existe congestión de los capilares pulmonares, edema intersticial y alveolar, así como la presencia de membranas hialinas a lo largo de los ductos alveolares ricos en fibrina y proteínas. Fase fibroproliferativa: típicamente ocupa la segunda y tercera semanas, sin embargo existe evidencia de que puede iniciar simultáneamente con la fase exudativa y sobreponerse. El edema pulmonar es sustituido por inflamación y proliferación fibroblástica en el intersticio y alveolos, y además se observa una hiperplasia de los neumocitos tipo II que reemplazan a los tipo I. Si no existe resolución del proceso se lleva a cabo remodelación del tejido pulmonar por colágeno y fibrosis pulmonar, que cuando aparece precozmente suele ser reversible; sin embargo puede evolucionar hacia una fibrosis pulmonar irreversible. Fase de recuperación: la recuperación de la función pulmonar cercana a la normalidad es hasta seis meses a un año posterior al evento en el mejor de los casos. Estos cambios son el resultado de una intensa reacción inflamatoria pulmonar en la que los neutrófilos desempeñan un papel importante. Cuando se realiza un lavado broncoalveolar 80% de las células recuperadas son neutrófilos, además intervienen una serie de mediadores de inflamación entre los que destacan el factor inhibidor de macrófagos, interleucina 8, factor de necrosis tumoral alfa, mediadores plasmáticos de ciclooxigenasa, lipooxigenasa, liberación de radicales libres de oxígeno así como la activación del complemento y los factores de coagulación. Todo lo anterior ocasiona lesion temprana de las células endoteliales y epiteliales de la barrera alveolocapilar con aumento de la permeabilidad capilar e inundación de los espacios alveolares con líquido proteináceo. CUADRO CLÍNiCO El cuadro clínico se instaura en corto tiempo, generalmente menos de 24 h con deterioro progresivo de la función respiratoria, presentando disnea hasta el reposo, hipoxemia grave (PaO2 < 50 mm Hg) refractaria a la oxigenoterapia, alcalosis respiratoria, taquipnea, cianosis. Dependiendo de la causa del SIRA existen otras manifestaciones como fiebre, tos, expectoración y dolor torácico si el origen es infeccioso, antecedente de ingesta de depresores del sistema nervioso central y pérdida del estado de alerta con aspiración de contenido gástrico. El dolor abdominal orienta hacia una posible pancreatitis. Sea cual sea la causa de SIRA una complicación que ensombrece el pronóstico es la falla orgánica múltiple que incrementa la mortalidad por encima de 50%. La insuficiencia cardiaca secundaria a SIRA es de bajo gasto con disritmias, la falla renal se reconoce por oliguria y elevación de azoados y la falla gastrointestinal por hemorragia digestiva, íleo y pancreatitis; la falla hepática es poco frecuente pero se asocia a una elevada mortalidad. El pulmón del paciente con SIRA se torna rígido, disminuye su distensibilidad secundario al edema y exudado alveolares, hay una desigualdad en la relación ventilación y perfusión, así como cortocircuitos intrapulmonares superiores a 50% (principales mecanismos de hipoxemia en SIRA). Por el contrario la presión arterial de dióxido de 3/2/15 2:47 PM DIAGNÓSTICO DIAGNÓSTICO POR IMAGEN Radiológicamente existe una etapa temprana en la cual existen opacidades alveolares o en parches, diseminadas y bilaterales, en ocasiones con broncograma aéreo, sin cardiomegalia o aumento del diámetro de las ramas de la arteria pulmonar (diferencia radiológica del edema pulmonar secundario a falla cardiaca) y una etapa avanzada en la que puede haber patrón reticular de predominio basal bilateral con trazos fibróticos e incluso con imágenes de panal de abeja cuando la fibrosis pulmonar es irreversible. En la tomografía de tórax se aprecia aumento de las densidades por ocupación alveolar y atelectasias de predominio en zonas de decúbito; en la fase fibroproliferativa se puede encontrar un patrón reticular y fibrosis pulmonar (Figura 2.11.1). Para realizar el diagnóstico de SIRA se requieren por lo menos dos de los siguientes criterios: 1. Inicio agudo o súbito de la sintomatología. 2. Opacidades pulmonares alveolares o en parches difusas bilaterales. 3. Hipoxemia PaO2 < 60 mm Hg y relación PaO2/FiO2 < 200. 4. Presión capilar pulmonar < 18 mm Hg o ausencia de signos de hipertensión auricular izquierda en caso de no poder medir la presión en cuña pulmonar. DIAGNÓSTICO DIFERENCIAL El principal diagnóstico diferencial del SIRA es con lesión pulmonar aguda (relación PaO2/FiO2 > 200 < 300) y con edema agudo pulmonar de origen cardiogénico. Existen otros “imitadores” de SIRA como son: neumonitis intersticial aguda (Hamman y Rich), neumonía eosinófila aguda, neumonía de organización criptogénica (anteriormente BOOP), hemorragia alveolar difusa y alveolitis alérgica extrínseca aguda. TRATAMIENTO El tratamiento de los pacientes con SIRA se divide en medidas generales o de soporte, tratamiento farmacológico y ventilación mecánica invasiva. Medidas generales: el principal reto es el tratamiento de la enfermedad que ha desencadenado el SIRA (sepsis, trauma, pancreatitis, etc.). En cuanto al manejo del edema pulmonar se aconseja la administración conservadora de fluidos y fármacos vasoactivos (dopamina, norepinefrina) con el fin de alcanzar la presión de enclavamiento lo más baja posible compatible con un adecuado gasto cardiaco que asegure la perfusión de órganos vitales. En pacientes con hipoproteinemia y SIRA se puede intentar la administración de albúmina y diuréticos de asa (furosemide) aunque no se ha reportado que disminuya la mortalidad. El soporte nutricional se prefiere en lo posible por medio de una sonda enteral, ya que se conocen ventajas sobre la alimentación parenteral como el menor costo y la disminución de translocación bacteriana intestinal; es importante señalar que los complementos inmunomoduladores, bajos en carbohidratos y ricos en lípidos, así como los ácidos grasos omega 3 (siempre que se evite la sobrealimentación), pueden mejorar el estado nutricional produciendo un menor cociente respiratorio y acortando la dependencia de la ventilación mecánica invasiva. Book 2.indb 181 TRATAMIENTO FARMACOLÓGICO Hasta hoy no existe ningún fármaco que haya demostrado disminuir la mortalidad del SIRA. La administración de surfactante pulmonar no tiene beneficio para SIRA en adultos. Aun cuando el óxido nítrico mejora la oxigenación y el desequilibrio entre la ventilación-perfusión de los pacientes con lesión pulmonar aguda no muestra mejoría sostenida en pacientes con SIRA después de 48 h de aplicación. Los corticoesteroides que prometían tener un efecto en las fases exudativa y fibroproliferativa no demostraron reducir la mortalidad y sí incrementaron la neuromiopatía sobre todo en pacientes tratados con agentes relajantes neuromusculares. Por lo tanto no se recomienda su uso rutinario excepto en pacientes con fibrosis pulmonar temprana, y en aquellos que por su estado crítico desarrollen insuficiencia adrenal. Fármacos en estudio: proteína C activada, factor estimulador de colonias granulocito-macrófago, y beta agonistas adrenérgicos en aerosol (salbutamol y salmeterol). VENTILACIÓN MECáNICA INVASIVA Es el tratamiento de elección de los pacientes con SIRA independientemente de la causa del mismo. El volumen corriente bajo (< 6 mL/kg de peso ideal) y el mantenimiento de una presión meseta o “plateau” < 30 cm H2O en lo posible son las únicas maniobras que han demostrado mejorar la tasa de mortalidad de los pacientes con SIRA. Otras maniobras como la presión positiva al final de la espiración (PEEP), las maniobras de reclutamiento alveolar o la posición en pronación se utilizan como terapia de rescate para mejorar la hipoxemia en situaciones particulares pero no mejoran la mortalidad del grueso de la población con SIRA. PRONÓSTICO La mortalidad del SIRA se encuentra entre 40 y 60% de los pacientes y la mayoría se debe a choque séptico y falla orgánica múltiple y no a insuficiencia respiratoria. Los factores identificados de mal pronóstico son: edad avanzada, hepatopatía crónica, insuficiencia renal y cardiaca, y sepsis grave. La sobrevida de los pacientes trae como consecuencia restricción leve en la función pulmonar, alteración de la difusión del monóxido de carbono y alteraciones gasométricas durante el ejercicio. 181 Existen otros “imitadores” de SIRA como son: neumonitis intersticial aguda (Hamman y Rich), neumonía eosinófila aguda, neumonía de organización criptogénica (anteriormente BOOP), hemorragia alveolar difusa y alveolitis alérgica extrínseca aguda. Hasta hoy no existe ningún fármaco que haya demostrado disminuir la mortalidad del SIRA. El volumen corriente bajo (< 6 mL/kg de peso ideal) y el mantenimiento de una presión meseta o “plateau” < 30 cm H2O en lo posible son las únicas maniobras que han demostrado mejorar la tasa de mortalidad de los pacientes con SIRA. Figura 2.11.1. Tomografíadetóraxdeunhombrede30añosconSIRAsecundario a neumonía por Streptococcus pneumoniae. Sección 2 | Neumología carbono es típicamente baja (promedio 20 mm Hg) aun cuando se desarrolle una hipoxemia grave. 3/2/15 2:47 PM 182 12. Fibrosis quística y bronquiectasias FIBROSIS QUÍSTICA ª La fibrosis quística es una enfermedad multisistémica que se transmite de forma autosómica recesiva, y es la enfermedad hereditaria letal más frecuente en la raza blanca. ª La impacción fecal por meconio es un dato sugerente de fibrosis quística. Guía EXARMED Las bronquiectasias en la fibrosis quística son infectadas generalmente por Haemophilus influenzae, Staphylococcus aureus o Pseudomonas aeruginosa, indicando un mal pronóstico. Book 2.indb 182 Introducción “Los niños que saben a sal, seguramente morirán”, rezaba un dicho del folklore europeo, refiriéndose seguramente a los primeros reconocimientos de la fibrosis quística. Ésta fue descrita como entidad en 1938, cuando la patóloga Andersen encontró tapones de moco en los conductos pancreáticos de niños muertos por desnutrición, por lo que le llamó fibrosis quística del páncreas. Posteriormente se le llamó mucoviscidosis o enfermedad fibroquística. Actualmente su término adecuado es fibrosis quística (FQ). Ésta es una enfermedad multisistémica, que se transmite de forma autosómica recesiva, y es la enfermedad hereditaria letal más frecuente en la raza blanca. Afecta a niños, y en forma creciente a adultos, ya que la sobrevida de los pacientes con FQ ha mejorado tanto, que el promedio de vida para 2005 es de 36.5 años; esto se influencia de la mutación específica encontrada, el diagnóstico precoz, mejor conocimiento de la enfermedad y mejor manejo por medio de un equipo multidisciplinario. Fisiopatogenia y etiología La fibrosis quística es causada por mutaciones en el gen que codifica una proteína, llamada reguladora de conductancia transmembrana de la fibrosis quística (CFTR, por sus siglas en inglés). El gen, situado en el brazo corto del cromosoma 7, se aisló en 1989, y hasta ahora se han encontrado más de 1 500 mutaciones que se han dividido en cinco categorías basadas en el tipo de defecto; 1, 2 y 3 se asocian a enfermedad más grave, en las mutaciones de clase 4 y 5 hay enfermedad pulmonar y pancreática más leve. La mutación predominante es una deleción 3-bp que elimina la fenilalanina de CFTR en la posición 508, por lo que se llamó mutación ΔF508. La proteína CFTR es un péptido de cadena sencilla que contiene 1 480 aminoácidos; es una glucoproteína transportadora de membrana dependiente del adenosín-monofosfato-cíclico y es responsable de una de las vías de transporte de iones cloro en las células epiteliales. Se localiza en la membrana apical de muchos tipos de epitelio, como vías aéreas, glándulas submucosas del tracto gastrointestinal, hígado, vías biliares y páncreas. El resultado final de las mutaciones es la imposibilidad de transportar cloruro en las células epiteliales, principalmente en las antes mencionadas, ocasionando la disfunción de glándulas sudoríparas, aparato respiratorio, páncreas, aparato reproductor masculino y sistema hepatobiliar. Cuadro clínico La FQ en su forma clásica se manifiesta por enfermedad pulmonar obstructiva crónica, insuficiencia pancreática exocrina (malabsorción), elevación del cloro en sudor, e infertilidad en varones por azoospermia obstructiva. Existe una gran variabilidad en relación con la edad de inicio y el ritmo individual de progresión de la enfermedad. Íleo meconial En 10 a 15% de los pacientes, la mayoría con insuficiencia pancreática. Puede ser la primera manifestación de la enfermedad. Malabsorción intestinal El 80 a 85% de los pacientes tiene insuficiencia pancreática exocrina. Las manifestaciones clínicas de la alteración pancreática se deben a la pérdida de la función de ácinos y conductos, se reduce la secreción de agua, bicarbonato y enzimas, dando lugar a una mala digestión de grasas y proteínas. Se manifiesta por deposiciones abundantes, fétidas y de características grasas. La mayor parte de los pacientes la presenta, pero su ausencia no descarta el diagnóstico. En casos graves puede haber prolapso rectal, indicador de malnutrición grave. Por otra parte, una complicación importante es la pancreatitis, que se presenta en torno a 15% de los pacientes. Obstrucción intestinal distal Manifestada por estreñimiento, vómito, dolores abdominales, cólicos recurrentes y masa fecal palpable en fosa iliaca o en flanco derecho. Enfermedad hepática El hígado es afectado en varias formas. Muchos de los pacientes desarrollarán algún tipo de alteración hepática, incluyendo elevación de transaminasas, esteatosis hepática, enfermedad de la vía biliar. La más frecuente es la segunda, encontrándose en 20 a 60% de los pacientes. Un pequeño número de pacientes desarrollará franca cirrosis, hipertensión portal e hiperesplenismo. Enfermedad pulmonar La enfermedad pulmonar es la primera causa de morbilidad y mortalidad en la FQ. Es caracterizada por ciclos progresivos de infección e inflamación que terminan en falla respiratoria. Al nacimiento los pulmones de los pacientes con FQ son casi normales, y este hecho resalta la importancia de un diagnóstico y tratamiento tempranos. Las primeras manifestaciones en menores de un año de edad son accesos de tos seca, taquipnea persistente y aumento del diámetro AP del tórax, en ocasiones broncoespasmo por lo que se confunde con bronquiolitis con pobre respuesta al tratamiento. La tos es el síntoma constante con secreciones mucosas a purulentas. En estadios avanzados pueden demostrarse bronquiectasias, que después pueden ser colonizadas con Haemophilus influenzae, Staphylococcus aureus o Pseudomonas aeruginosa lo cual se relaciona a un más rápido deterioro clínico. El hongo que con más frecuencia coloniza a estos pacientes es Candida sp. en 50 a 70% aunque se puede considerar comensal. Por otra parte, la afectación de las vías respiratorias altas también puede observarse; en 15% de los casos hay poliposis nasal que se observa hacia la adolescencia; la sinusitis se presenta en 10% de los niños y 24% de los pacientes adultos. Aparato reproductor El 95% de los hombres no es fértil, por azoospermia, en mujeres puede haber retraso puberal y disminución de la fertilidad por menor hidratación del moco cervical. Diabetes mellitus Por alteración del páncreas exocrino y endocrino. Secundaria a fibrosis pancreática y reemplazo de tejido 3/2/15 2:47 PM 183 Glándulas sudoríparas Los pacientes con FQ eliminan cuatro veces más sodio en sudor que sujetos sanos. Es importante recomendar incremento de sal de 1 a 4 g en épocas de mucho calor, estrés, vómito o diarrea. DIAGnóSTICO Inicia con la sospecha clínica en pacientes con enfermedad crónica sinopulmonar, alteraciones gastrointestinales y nutricionales, síndrome de pérdida de sal, azoospermia obstructiva, historia de FQ en hermanos. Se puede resumir en los criterios reportados en el Cuadro 2.12.1. La prueba de sudor es una buena herramienta diagnóstica y debe realizarse ante sospecha. La confirmación diagnóstica se basa en cifras elevadas de cloro en el sudor (> 60 mEq) obtenidas por el clásico test de Gibson y Cooke, valores entre 40 y 60 mEq de sodio se consideran dudosos, en tal caso, debe repetirse y de continuar dentro de ese rango hay indicación de estudio genético. Para el diagnóstico neonatal se puede utilizar la medición de tripsina inmunorreactiva (TIR), la cual se basa en el hecho de que en etapas tempranas esta proteína se encuentra anormalmente elevada por la obstrucción de los conductos pancreáticos. Tiene una sensibilidad de 85.7% y una especificidad de 99.6%, que mejora con el uso de un análisis de ácido desoxirribonucleico en busca de las mutaciones. Por otra parte es importante, una vez que se tiene el diagnóstico, evaluar el compromiso de la enfermedad; algunos puntos importantes son: a) Radiografía de tórax. Es un examen fundamental en los cuadros agudos y en la evaluación clínica del paciente estable. Debe efectuarse al ingreso, una vez al año y cada vez que se sospeche un cuadro de descompensación clínica. Desde el inicio se evalúan datos de obstrucción de la vía aérea que ocasionan datos de atrapamiento aéreo, posteriormente para evaluar la posibilidad de bronquiectasias (Figura 2.12.1). b) Función pulmonar: • Espirometría. Debe efectuarse a partir de los cinco a seis años de edad y cada seis meses. Esto permite evaluar la progresión de la enfermedad pulmonar, la efectividad del tratamiento y pesquisa precoz de descompensaciones subclínicas. • Volúmenes pulmonares. Deberá realizarse en forma anual, dependiendo del resultado de la espirometría. Permite una mejor evaluación de la mecánica pulmonar. c) Estudio de saturación arterial diurna y gases arteriales. Para evaluar la necesidad de oxigenoterapia domiciliaria. Además puede ayudar ante la sospecha de una exacerbación aguda. d) Estudio bacteriológico. Debe tomarse muestra de expectoración espontánea del paciente o inducida por suero fisiológico hipertónico a 6% y apoyo del kinesiólogo, y su objetivo es buscar gérmenes patógenos en secreción bronquial. Se debe tomar cada tres meses en pacientes estables o cada vez que se presente una descompensación. Si existe duda sobre la muestra o el germen encontrado, se debe repetir. Book 2.indb 183 Cuadro 2.12.1. Criterios diagnósticos de la fibrosis quística Datos clínicos - Uno o más rasgos fenotípicos característicos o - Historia de FQ en hermano o primo hermano o - Tamizaje neonatal positivo, más Evidencia de disfunción de la CFTR demostrada por - Concentración de cloro en sudor elevada en dos o más ocasiones - Identificación de dos o más mutaciones causales de la enfermedad - Diferencia de potencial nasal anormal FQ: fibrosis quística; CFTR: proteína reguladora de la conductancia transmembranal de la fibrosis quística. e) Estudio de síndrome de malabsorción y función digestiva. La esteatorrea se puede evaluar con prueba de van den Kalmer, o con esteatócrito ácido que es una prueba semicuantitativa. f) Evaluación nutricional. Antropometría (peso, talla, perímetro braquial, pliegue tricipital), hemograma, proteinemia, prealbúmina e idealmente medición de nivel plasmático de vitaminas. g) Exámenes generales frente a la sospecha de infección aguda. Biometría hemática, adenovirus, etcétera. La prueba de sudor es una buena herramienta diagnóstica y debe realizarse ante sospecha. La confirmación diagnóstica se basa en cifras elevadas de cloro en el sudor (> 60 mEq). TRATAMIEnTO Los objetivos del tratamiento son la prevención y tratamiento de la enfermedad respiratoria, desnutrición y otras complicaciones, así como el cuidado de la salud mental. Los pilares del tratamiento respiratorio son: - Medidas de prevención, administrando todas las inmunizaciones, incluyendo la antigripal cada año. - Inhaloterapia con broncodilatadores y antibióticos, entre los que se enumeran tobramicina, amikacina y gentamicina, mucolíticos como la acetilcisteína, y una parte fundamental es la fisioterapia respiratoria. - Manejo de antibióticos y antiinflamatorios bajo indicaciones bien establecidas, durante exacerbaciones infecciosas y situaciones de hiperreactividad bronquial. ª El manejo terapéutico de la fibrosis quística comprende a la nutrición, prevención de infecciones, inhaloterapia, y manejo de exacerbaciones inflamatorias (antibióticos y antiinflamatorios). Figura 2.12.1. Radiografía de tórax digital PA de paciente femenino con fibrosis quística en la que se observan múltiples imágenes areolares que corresponden a bronquiectasias. Sección 2 | Neumología normal por tejido graso. Incidencia de 20% en estos pacientes, es más frecuente en la adolescencia. Es conveniente la investigación rutinaria a partir de los 10 años, se observará hipoinsulinemia e hipoglucagonemia. 3/2/15 2:47 PM 184 Las bronquiectasias son distorsiones y dilataciones de los bronquios de carácter irreversible causadas por la destrucción de las paredes bronquiales. En lo que respecta a la malabsorción es indispensable la suplementación enzimática para conseguir las mínimas pérdidas fecales de grasas, vitaminas, proteínas y ácidos biliares. Por tanto, la dosificación debe ser individualizada. Deben agregarse al manejo también vitaminas liposolubles, principalmente A y E. El aspecto nutricional es crucial, por lo que se recomienda el uso de 120 a 140% del contenido energético diario. Actualmente se evalúan estudios acerca de terapias basadas en células madre para la corrección de defectos en el epitelio de la vía aérea en pacientes con FQ. Pronóstico La evolución de la enfermedad es muy variable de acuerdo con su heterogénea presentación clínica; el pronóstico está marcado en especial por el compromiso de la función respiratoria. La edad en que se produce la colonización por Pseudomonas aeruginosa es un elemento muy importante, ya que el daño del parénquima pulmonar se correlaciona en forma estrecha con los mecanismos inflamatorios desencadenados por la infección. Los pacientes con suficiencia pancreática presentan un mejor pronóstico a largo plazo. En Norteamérica y Europa la sobrevida promedio es superior a los 35 años. En Latinoamérica es variable pero está dentro de la segunda década de la vida. La mejoría en las expectativas de vida en esa región en los últimos 30 años han sido importantes, considerándose anteriormente un promedio de vida de 20 años en este tipo de pacientes. Con las intervenciones actualmente propuestas mejores métodos de diagnóstico que detectan sujetos portadores con pobre penetran- cia se pretende mejorar aún más las expectativas actuales. La visión de terapias dirigidas al defecto básico y terapias génicas son razones para ser optimistas en pacientes portadores de FQ. BRONQUIECTASIAS Introducción Las bronquiectasias son distorsiones y dilataciones de los bronquios de carácter irreversible causadas por la destrucción de las paredes bronquiales; son permanentes y no deben considerarse como tales las dilataciones bronquiales reversibles de una neumonía aguda, traqueobronquitis o atelectasias que se resuelven progresivamente hasta en tres o cuatro meses. Las bronquiectasias debidas a una infección recurrente o infección grave en pacientes sin una causa aparente han llegado a ser menos comunes con el incremento de las inmunizaciones y antibióticos actuales. En los últimos años ha resurgido el interés por esta enfermedad por la mayor capacidad diagnóstica disponible en la actualidad y la identificación de un número significativo de enfermedades asociadas a bronquiectasias. Fisiopatogenia y etiología Muchos casos de bronquiectasias resultan de daño bronquial permanente después de una infección respiratoria a temprana edad. En pacientes con tuberculosis u otras enfermedades fibrosantes pulmonares la tracción de las vías aéreas superiores que ejerce el tejido fibrótico distorsiona su estructura llevando a infección recurrente y bronquiectasias por tracción. En 50% de los casos se pueden Guía EXARMED Cuadro 2.12.2. Etiologías de la fibrosis quística Book 2.indb 184 Etiología Ejemplos Congénita • Defectos de la pared bronquial (síndrome de Mounier-Kuhn, síndrome de Williams-Campbell) • Secuestro pulmonar • Síndrome de Kartagener Anomalías de la respuesta inmune • Panhipogammaglobulinemia • Déficit selectivo de las inmunoglobulinas • Infección por VIH Exacerbación de la respuesta inmune • Aspergilosis broncopulmonar alérgica • Postrasplante (pulmonar, médula ósea) Alteraciones de la eliminación de moco • Fibrosis quística • Discinesia ciliar primaria y secundaria • Síndrome de Young Neumonitis posinflamatorias • Inhalación de gases tóxicos • Aspiración de contenido gástrico Obstrucción mecánica • Intrínseca (cuerpo extraño, tumor, cicatriz) • Extrínseca (masa, adenopatías) Posinfecciosa • • • • Viral (sarampión, bronquiolitis obliterante unilateral) Bacteriana (micobacterias, tos ferina) Hongos Protozoos Otras entidades asociadas • • • • • • • • • Enfermedades de la colágena (artritis reumatoide, síndrome de Marfan) Vasculitis Deficiencia de alfa-1-antitripsina Enfermedad inflamatoria intestinal Enfermedad celiaca Síndrome de uñas amarillas Linfedema primario Neoplasias (leucemias) Sarcoidosis 3/2/15 2:47 PM 185 ClASIFICACIOnES Tradicionalmente, de acuerdo con características radiológicas y anatomopatológicas, se les ha clasificado en tres patrones básicos: - Cilíndricas: dilatación relativamente uniforme del árbol traqueobronquial. - Varicosas: constricciones superpuestas a un patrón cilíndrico. - Quísticas o saculares: dilatación progresiva de la vía aérea que adquiere una forma de balón. CUADRO ClÍnICO Pueden ser totalmente asintomáticas, lo más frecuente es que se refiera tos crónica (75%), expectoración mucopurulenta diaria de cantidad significativa, disnea, la mitad se queja de dolor pleurítico. Las infecciones respiratorias frecuentes, algunas veces con sibilancias, son comunes en estos pacientes y pueden ir desde cuadros febriles inespecíficos hasta verdaderos procesos neumónicos. La mayoría de los pacientes tiene alteraciones en la exploración física, como estertores gruesos en 75% de los casos, sibilancias, y en menos de 5% de los pacientes se puede observar bronquiectasia. DIAGnóSTICO Se basa en la demostración de la anormalidad anatómica del árbol bronquial. El abordaje debe comprender tres fases: - Identificación de las bronquiectasias como la causa de la enfermedad que se presenta. - Identificación de la causa. - Documentar la gravedad de la enfermedad y la repercusión funcional. La primera se debe hacer inicialmente con una radiografía de tórax; en algunos casos sólo se demuestra el incremento inespecífico de la trama vascular, atelectasias u opacidades irregulares. De buen valor diagnóstico es la imagen en “rieles de tranvía” que refleja el engrosamiento de las paredes y la fibrosis peribronquial. La tomografía computada de alta resolución es el mejor método diagnóstico actualmente (Figura 2.12.2). La búsqueda de la causa en la mitad de los casos no revelará nada más, sin embargo siempre deben buscarse causas que son potencialmente manejables y que tienen repercusión a otro nivel. Entre las herramientas diagnósticas que ayudan a determinar la gravedad de la enfermedad se encuentran: Book 2.indb 185 - - Cuestionarios de calidad de vida. Pruebas de función respiratoria. En estadios iniciales se muestran normales, pero el hallazgo habitual es un patrón obstructivo. En 40% de los casos hay cierto grado de reversibilidad. Gram y cultivo de expectoración. Para detectar colonización e infección en un daño estructural establecido y que perpetúe el agente lesivo. TRATAMIEnTO Se encamina a mejorar la aclaración mucociliar y al control de las exacerbaciones agudas y de la respuesta inflamatoria. Las secreciones respiratorias frecuentemente se expulsan con dificultad, por tanto la fisioterapia es una parte esencial del manejo. Los agentes mucolíticos como acetilcisteína, salina hipertónica y DNA-asa pueden ser benéficos, este último solamente demostrado en fibrosis quística. Los antimicrobianos son la principal herramienta para su prevención y tratamiento. La elección del agente debe ser siempre hecha una vez que ya se han tomado cultivos cuando se sospecha de una exacerbación. Se debe siempre tratar de cubrir H. influenzae y S. pneumoniae en casos leves incrementando la cobertura en casos graves para agentes como Pseudomonas aeruginosa con manejo intravenoso con cefalosporina antiseudomona y un aminoglucósido. La cirugía sólo se contempla en casos de lesiones localizadas. Las bronquiectasias pueden ser totalmente asintomáticas, pero lo más frecuente es que se refiera tos crónica (75%), expectoración mucopurulenta diaria de cantidad significativa, disnea; la mitad se queja de dolor pleurítico. ª Las bronquiectasias infectadas por Pseudomonas aeruginosa se deben manejar intravenosamente con una cefalosporina antiseudomona y un aminoglucósido. pROnóSTICO Actualmente la supervivencia ha mejorado, en 1969 se mencionaban tasas de supervivencia en promedio de 12 años y ahora en 32 años en general la expectativa de vida es buena para la mayoría de los pacientes un factor de mal pronóstico es la infección por seudomonas. Figura 2.12.2. Imagen tomográfica de alta resolución de paciente femenino con fibrosispulmonar,conáreasdenódulosconfluentes,engrosamientosseptalesy bronquiectasias por tracción. Sección 2 | Neumología llegar a considerar idiopáticos, En el Cuadro 2.12.2 se listan algunas causas de bronquiectasias, así como algunas enfermedades asociadas. Independientemente de la causa, el resultado final es una dilatación anormal e irreversible de las vías aéreas, principalmente bronquios y a veces incluso hasta de bronquiolos (bronquioloectasias). Desde un punto de vista microscópico la vía aérea se caracteriza por un infiltrado inflamatorio mononuclear con linfocitos CD4 activados, células presentadoras de antígenos y macrófagos maduros. También se observa reclutamiento intenso de neutrófilos a la luz bronquial. En su patogenia juega un papel importante la colonización e infección que realiza un círculo vicioso de inflamación y daño. 3/2/15 2:47 PM 186 13. Cáncer broncopulmonar INTRODUCCIÓN ª El cáncer broncogénico de células no pequeñas ocupa 80% de los cánceres pulmonares y abarca los subtipos: adenocarcinoma (60%), escamoso o epidermoide (30%), y el carcinoma indiferenciado de células grandes (< 10%). Guía EXARMED Se ha observado que el uso de hookah aumenta el riesgo de padecer cáncer pulmonar en 5.83 (IC 95%, 3.95 a 8.60), p < 0.0001. De igual manera se ha asociado con mayor frecuencia con carcinoma broncogénico. Se calcula que a nivel mundial al año se consumen lo equivalente a 900 cigarros por persona. En México se estima que existen más de 16 millones de fumadores, de los cuales 45% tendrá la posibilidad de padecer alguna enfermedad respiratoria a los 10 años. Book 2.indb 186 El cáncer pulmonar ocupa el primer lugar de mortalidad de todos los tipos de cáncer en el mundo occidental. En 2006 causó la muerte de 158 000 norteamericanos, más que la que ocasionaron los cánceres de próstata, mama, colon y recto juntos. En México la tasa de mortalidad por cáncer pulmonar es de 125.2 por cada 100 000 hombres y 48.8 por cada 100 000 mujeres. Es más frecuente en el varón, entre la quinta y la séptima décadas de la vida, y el principal agente carcinogénico relacionado con esta neoplasia es el tabaco. El proceso de carcinogénesis se basa en la acumulación de alteraciones en genes esenciales para el crecimiento y división celular. A pesar de los avances en los tratamientos (quimioterapia, radioterapia y cirugía) la sobrevida a cinco años en estadios avanzados apenas alcanza menos de 15%. FACTORES DE RIESGO Definitivamente el principal factor de riesgo es el tabaquismo; está ligado en 90% de los casos en el sexo femenino y en 70% en el sexo masculino. Varios estudios han mostrado una relación entre el consumo y el número de cigarrillos consumidos por día, así como por el inicio y tiempo de consumo; esto nos da el índice tabáquico que se calcula con la siguiente formula: Número de cigarros fumados al día × años de consumo 20 donde 20 corresponde al número de cigarros que contiene una cajetilla. Cuando el índice tiene un valor igual o superior a 20 paquetes/año se considera como factor de incremento del riesgo para el desarrollo del cáncer pulmonar. El tabaquismo pasivo también es considerado como factor de riesgo para el desarrollo de cáncer, entre mayor intensidad y duración, mayor será la relación. Además del tabaco, en mucho menor porcentaje, existe una asociación segura entre la exposición ocupacional a otras sustancias (asbesto, arsénico, níquel, berilio, radiación ionizante y radón) y aparición de cáncer de pulmón. FISIOPATOGENIA El tabaco induce cualesquiera de los grupos histológicos más frecuentes, existiendo una fuerte asociación con los carcinomas escamosos y los indiferenciados de células pequeñas. El humo del tabaco contiene alrededor de 4 800 compuestos diferentes, 60 de estos son considerados cancerígenos, ya que reaccionan con el ácido desoxirribonucleico (DNA) humano formando complejos con las bases nitrogenadas, lo que ocasiona que durante la replicación del DNA se introduzcan errores en la copia, dando lugar a mutaciones. Dentro de las sustancias cancerígenas del tabaco se encuentran los hidrocarburos aromáticos policíclicos, el más estudiado es el benzopireno, el cual inducirá una mutación puntual con el cambio de guanina por timina (transversión). Otro cancerígeno identificado son las nitrosaminas, estas sustancias median reacciones de alquilación del DNA. Hasta en 50% de los cánceres de células no pequeñas y aproximadamente en 90% de los cánceres de células pequeñas se encuentran mutaciones en el gen p53; éste es un gen supresor de tumores que está localizado en el brazo corto del cromosoma 17, codifica una fosfoproteína nuclear de 53 kD que le da su nombre. Esta fosfoproteína actúa como un factor regulador transcripcional. El p53 juega un importante rol ya que mantiene la integridad del genoma, debido a que la pérdida de la función del p53 permite la sobrevida de elementos celulares genéticamente dañados que conducirán a la transformación celular tumoral. De entre los oncogenes, el ras es el más estudiado, el K-ras está presente aproximadamente en 30% de los carcinomas no microcíticos pulmonares, su presencia se relaciona con un peor pronóstico de la enfermedad. Los oncogenes myc se detectan en 18 a 24% de los carcinomas microcíticos. El protooncogén c-erb-B1, codifica el factor de crecimiento epidérmico, siendo un factor de mal pronóstico para el carcinoma epidermoide de pulmón. NEOPLASIAS PULMONARES PRIMARIAS Las neoplasias pulmonares se pueden dividir en procesos benignos y malignos, estos últimos de mayor relevancia, ya que cerca de 95% de los casos de tumores pulmonares son malignos. Con fines de estudio el nódulo pulmonar solitario se mencionará por separado. Neoplasias pulmonares benignas Las neoplasias pulmonares benignas representan de 2 a 5% de todos los tumores pulmonares primarios. El hamartoma es el tumor benigno más frecuente, seguido de otros que por su rareza sólo serán mencionados: tumores epiteliales, tumores mesenquimatosos, tumores de origen mixto como teratomas, y otras enfermedades, como endometriosis. En general suelen ser asintomáticos, pero cuando dan síntomas, estos dependen de la localización. Cuando son intratraqueales pueden ocasionar tos, estridor, disnea o incluso hasta hemoptisis. Los tumores endobronquiales causarán obstrucción bronquial, neumonía, neumonitis e hiperinsuflación posobstructiva. Cuando son intraparenquimatosos, sin importar su tamaño, la gran mayoría son asintomáticos, observándose como hallazgos incidentales en una radiografía de tórax como nódulos pulmonares solitarios y de estos entre 5 a 10% son hamartomas, los cuales presentan calcificaciones en palomitas de maíz como característica específica. El hamartoma es una masa formada de cartílago, tejido conectivo, grasa, músculo liso y epitelio respiratorio, deriva del mesénquina peribronquial, por lo que se ha propuesto un nombre alternativo: mesenquimoma, también se ha llamado hamartocondroma, hamartoma condromatoso, adenocondroma y fibroadenoma de pulmón. Neoplasias pulmonares malignas El cáncer pulmonar se divide en dos grandes grupos, según la apariencia de las células ante el microscopio: 1) cáncer broncogénico de células pequeñas y 2) cáncer broncogénico de células no pequeñas. El cáncer broncogénico de células pequeñas representa 20% de los cánceres pulmonares y se puede encontrar algunos subtipos histológicos como el carcinoma de células pequeñas, carcinoma mixto de células pequeñas y grandes y carcinoma combinado de células pequeñas. 3/2/15 2:47 PM 187 Cáncer broncogénico de células pequeñas Es un tumor muy agresivo de localización central, suele ser de crecimiento rápido en comparación con todos los demás tipos de tumores pulmonares, con supervivencia a partir del momento del diagnóstico de sólo dos a cuatro meses sin tratamiento. Tiene mayor tendencia a estar ampliamente diseminado cuando se diagnostica, pero es mucho más sensible a la quimioterapia y la irradiación. Existen varios subtipos: • Carcinoma de células pequeñas (cáncer de células en grano de avena). • Carcinoma combinado de células pequeñas y células grandes. • Carcinoma combinado de células pequeñas (combinadas con componentes escamosos, glandulares o ambos). Cáncer broncogénico de células no pequeñas Es un agregado heterogéneo de al menos tres histologías distintas de cáncer de pulmón, incluyendo el carcinoma epidermoide o escamoso, el adenocarcinoma y el carcinoma de células grandes. Adenocarcinoma pulmonar El adenocarcinoma es ahora el subtipo histológico predominante en muchos países (60%), anteriormente era Book 2.indb 187 el epidermoide. La Organización Mundial de la Salud lo clasifica en acinares, sólidos, papilares y bronquioloalveolares. Deriva del epitelio de los bronquios distales y de las glándulas mucosas, por lo que tiende a ser periférico. Puede confundirse con un mesotelioma, siendo necesaria la tinción con el antígeno carcinoembrionario, característica del adenocarcinoma que ayuda al diagnóstico diferencial. El empleo de la inmunohistoquímica es una herramienta valiosa que permite distinguir el adenocarcinoma primario de pulmón de otras localizaciones, por ejemplo el TTF-1 es una proteína de regulación nuclear que se expresa de forma selectiva en regiones restringidas del cerebro fetal (diencéfalo), en las células epiteliales de origen tiroideo y pulmonar, con una alta frecuencia de expresión en el adenocarcinoma, mientras que en el carcinoma epidermoide y de células grandes no muestra expresión o en muy baja frecuencia. Los carcinomas bronquioalveolares son un subtipo de adenocarcinoma que se originan a partir de los bronquiolos y alvéolos terminales Cáncer escamoso o epidermoide Deriva del epitelio superficial de los bronquios. Suele ser de localización central y con tendencia a la exfoliación. Se comporta como un tumor de crecimiento lento, por lo que se asocia a un buen pronóstico. Carcinoma de células grandes Los carcinomas de células grandes son tumores indiferenciados, es la variedad menos frecuente y de peor pronóstico, representan entre 10 a 15% de los tumores de pulmón. Histológicamente se caracteriza por la presencia de células con citoplasma y núcleo grandes, y por la disposición de éstas en trabéculas. Tiene dos variedades: el carcinoma de células claras y el carcinoma de células gigantes. CUADRO ClÍnICO Puede ser muy variado, pasando desde los casos asintomáticos (10%) hasta encontrar cuadros muy floridos. Algunos pacientes suelen presentar síntomas inespecíficos como fatiga, anorexia, pérdida de peso o bien síntomas asociados al tumor como la tos, que es el síntoma más comúnmente descrito, ésta puede ser seca o acompañada de expectoración escasa y mucosa, o bien mucopurulenta cuando existe infección o hemoptisis por sangrado del tumor, que suele ser en escasa cantidad. Otro síntoma muy frecuente es el dolor torácico. La disnea es un síntoma frecuente, y puede ser secundaria a una atelectasia, derrame pleural o parálisis del hemidiafragma por invasión del nervio frénico. En ocasiones se encuentran algunas manifestaciones por compresión de las estructuras torácicas como el síndrome de Horner, parálisis del nervio frénico, síndrome de vena cava superior, tumor de Pancoast, parálisis laríngea del nervio laríngeo recurrente. Casi todas las neoplasias son capaces de invadir a la pleura, sin embargo el carcinoma pulmonar es el más común y de ellos el adenocarcinoma es el más frecuente, ocurriendo hasta en 50% de los casos. En un tercio de los pacientes se pueden presentar síntomas secundarios a metástasis a distancia. Los sitios más comunes de metástasis a distancia por cáncer de pulmón son: huesos, hígado, glándulas suprarrenales, ganglios retroperitoneales, cerebro, médula espinal, ganglios linfáticos y piel. Síndromes paraneoplásicos. Aproximadamente 10% de los pacientes con cáncer pulmonar desarrolla síntomas sistémicos relacionados a síndromes paraneoplásicos. ª El tumor de Pancoast clínicamente puede dar lugar a un dolor localizado en el hombro de características radiculares, irradiado a lo largo del brazo y parestesias, como consecuencia de la infiltración del plexo braquial, y por lo tanto, se acompaña también de atrofia muscular distal del miembro ipsolateral y dolor escapular con irradiación al hombro y al codo. ª Para el diagnóstico se considerará el cuadro clínico, hallazgos radiográficos y la realización de tomografía y/o resonancia magnética y finalmente la punción transtorácica. La base del tratamiento del cáncer broncogénico de células pequeñas es la quimioterapia, asociada a radioterapia. Los tumores más comunes que afectan el parénquima pulmonar son el cáncer de mama, cáncer de próstata, tumores gastrointestinales, cáncer de riñón, melanoma, sarcomas, linfomas y leucemias, tumores de células germinales y rara vez cáncer de ovario. Sección 2 | Neumología El cáncer broncogénico de células no pequeñas ocupa 80% de los cánceres pulmonares y abarca los subtipos: adenocarcinoma (60%), escamoso o epidermoide (30%), y el carcinoma indiferenciado de células grandes (< 10%). Por su localización pueden originarse en zonas periféricas o centrales del pulmón. El de localización central está en relación aparente con un bronquio principal; el epidermoide y el tumor de células pequeñas tienden a ser centrales. El adenocarcinoma y los tumores de celulas grandes suelen ser periféricos. Los carcinomas que se localizan en el surco pulmonar superior producen un cuadro clínico característico denominado tumor de Pancoast, que es una forma de presentación del carcinoma de pulmón. Es un tumor habitualmente bien localizado, que se sitúa a nivel del vértice pulmonar, por encima de la impronta que deja en el pulmón la arteria subclavia (tumor del sulcus). Tiene una evolución lenta, tendencia a infiltrar los linfáticos subpleurales y, por contigüidad las raíces nerviosas del octavo nervio cervical y del segundo y tercer dorsales, así como la cadena simpática y estructuras óseas. La etiología del síndrome de Pancoast es neoplásica en la mayoría de las ocasiones, constituyendo el carcinoma broncogénico la causa más habitual. El tumor de Pancoast clínicamente puede dar lugar a un dolor localizado en el hombro de características radiculares, irradiado a lo largo del brazo y parestesias, como consecuencia de la infiltración del plexo braquial. A la exploración física destaca la presencia de síndrome de Horner, debilidad y atrofia de los músculos intrínsecos. Radiológicamente se manifiesta como una opacidad o engrosamiento unilateral localizado en el vértice pulmonar. El diagnóstico es en ocasiones difícil, ya que erróneamente puede ser confundido y enviar al paciente a terapia de rehabilitación; para el diagnóstico se considerará el cuadro clínico, hallazgos radiográficos y la realización de tomografía y/o resonancia magnética y finalmente la punción transtorácica. Conocer la causa mediante biopsia bronquial es fundamental, ya que hasta en menos de 5% de los casos el síndrome de Pancoast es secundario a un proceso infeccioso, lo que modificará drásticamente el tratamiento. 3/2/15 2:47 PM 188 Cuadro 2.13.1. Clasificación tumor-ganglio-metástasis (TNM) Tumor primario (T) Tx: Tumor que ha sido detectado por presencia de células malignas en la secreción bronquial, pero no se visualiza en las radiografías ni en la broncoscopia o tumor que no puede ser evaluado. T0: Cuando no hay evidencia de tumor primario. Tis: Carcinoma in situ. T1: Tumor de 3 cm o menos de diámetro, rodeado de pulmón o pleura visceral, sin evidencia de invasión a un bronquio lobar en la broncoscopia. T2: Tumor mayor de 3 cm de diámetro o de cualquier tamaño cuando invade la pleura visceral o un bronquio principal o se asocia con atelectasia o neumonitis obstructiva que se extiende al hilio pero que no afecta todo el pulmón. En la broncoscopia la invasión proximal debe extenderse a más de 2 cm de la carina. T3: Tumor de cualquier tamaño con extensión directa a pared torácica, diafragma, pleura mediastinal o pericardio parietal o cuando se extiende a menos de 2 cm de la carina sin invadirla, o cuando se asocia con atelectasia o neumonitis obstructiva de todo el pulmón. T4: Tumor de cualquier tamaño con invasión del corazón, grandes vasos, tráquea, esófago, cuerpo vertebral, carina, cuando se acompaña de un derrame pleural maligno o cuando existen nódulos tumorales satélites en el mismo lóbulo. Compromiso ganglionar (N) NX:Los ganglios regionales no son evaluables N0: No hay metástasis demostrables a ganglios linfáticos. N1: Metástasis a ganglios intrapulmonares, peribronquiales o hiliares ipsolaterales. N2: Metástasis a ganglios mediastinales ipsolaterales o a los de la subcarina. N3: Metástasis a ganglios contralaterales o a supraclaviculares o escalenos ipsolaterales o contralaterales. Metástasis (M) MX:No puede evaluarse la presencia de metástasis. M0:No hay metástasis conocidas a distancia. M1:Hay metástasis distantes, incluyendo a otro lóbulo pulmonar ipsolateral o contralateral. En el cáncer metastásico las posibilidades de cura en los demás casos son mínimas, dejando sólo opciones paliativas de tratamiento. Son producidos por la liberación de sustancias bioactivas producidas por el tumor o en respuesta al tumor. De los más comunes son el síndrome de hipercalciemia, síndrome de secreción inadecuada de hormona antidiurética y el síndrome de Cushing. Clasificación tumor-gangliometástasis (TNM) y estadios clínicos Como en la mayoría de los cánceres, el estadio del cáncer broncogénico de células no pequeñas se clasifica utilizando el sistema tumor-ganglio-metástasis. El cáncer broncogénico de células pequeñas, no es posible clasificarlo de esta manera, ya que tiende a estar diseminado en el momento del diagnóstico. Una vez que se ha evaluado al paciente con cáncer broncogénico de células no pequeñas de acuerdo con el sistema TNM (Cuadro Guía EXARMED Cuadro 2.13.2. Clasificación por estadios del cáncer broncogénico de células no pequeñas Estadio 0 T1S N0 M0 Estadio IA T1 N0 M0 Estadio IB T2 N0 M0 Estadio IIA T1 N1 M0 Estadio IIB T2 T3 N1 N0 M0 M0 Estadio IIIA T1 T2 T3 N2 N2 N1, N2 M0 M0 M0 Estadio IIIB Cualquier T T4 N3 Cualquier N M0 M0 Estadio IV Cualquier T Cualquier N M1 Book 2.indb 188 2.13.1), el estadio de la enfermedad puede deducirse según se muestra en el Cuadro 2.13.2. Los tumores pequeños sin indicios de metástasis (estadio IA, IB y IIA), tienen tasas de supervivencia a cinco años relativamente altas, mientras tumores más grandes con una participación nodular o metastásica (IIIB y IV) presentan un peor diagnóstico. Tratamiento El tratamiento de los cánceres de pulmón varía de forma sustancial según la histología que presenten. A grandes razgos en el carcinoma no microcítico los tratamientos locales como la cirugía y la radioterapia son potencialmente curativos en estadios precoces. En etapas avanzadas las opciones terapéuticas son la radioterapia y la quimioterapia que producen una importante paliación de los síntomas. La base del tratamiento del cáncer broncogénico de células pequeñas es la quimioterapia, asociada a radioterapia. CÁNCER PULMONAR METASTÁSICO El pulmón es un sitio muy frecuente para la implantación de metástasis de tumores pulmonares y extrapulmonares, hasta 30 a 40% de los cánceres producirán metástasis a pulmón. Los tumores más comunes que afectan el parénquima pulmonar son el cáncer de mama, cáncer de próstata, tumores gastrointestinales, cáncer del riñón, melanoma, sarcomas, linfomas y leucemias, tumores de células germinales y rara vez el cáncer de ovario. Las vías para el desarrollo de metástasis son la hematógena, la linfática y por contigüidad. La enfermedad metastásica por vía hematógena es común, puesto que el gasto cardiaco entero fluye a través de los pulmones. Las células del tumor primario pueden llegar al pulmón por vía linfática, generalmente por compromiso 3/2/15 2:47 PM 189 ganglionar y flujo linfático retrógrado, originando una linfangiosis carcinomatosa difusa en el tejido pulmonar. Estas formas de diseminación explican que la enfermedad metastásica pueda manifestarse en la radiografía de tórax básicamente por dos tipos de imágenes: a) Nódulos o masas, generalmente múltiples de tamaño variable y b) imágenes reticulonodulares difusas. El cáncer metastásico produce una gran variedad de síntomas, debidos a la localización de la lesión, por ejemplo es posible encontrar hemoptisis por erosión de la mucosa, estridor por obstrucción de la vía aérea, disnea por colapso lobar o segmentario, dolor infiltrativo y/o derrame cuando hay lesiones en pleura o simplemente tos. Por desgracia en la gran mayoría de los casos, excepto por los tumores de células germinales que con tratamiento pueden alcanzar una tasa de sobrevida a cinco años de entre 50 a 80%, las posibilidades de cura en los demás casos son mínimas, dejando sólo opciones paliativas de tratamiento. nóDUlO pUlMOnAR SOlITARIO El nódulo pulmonar solitario es una imagen radiológica de aumento de densidad, en general esférica, circundada por parénquima pulmonar normal, sin otras alteraciones pulmonares y cuyo diámetro mayor no supere los 3 cm. Al estudiar a un paciente con un nódulo pulmonar solitario se debe tomar en cuenta la edad del paciente, el tamaño del nódulo, sus márgenes, y el antecedente de tabaquismo. Sección 2 | Neumología El nódulo pulmonar solitario es una imagen radiológica de aumento de densidad, en general esférica, completamente circundada por parénquima pulmonar normal, sin otras alteraciones pulmonares (atelectasia, neumonitis posobstructiva, adenomegalias hiliares o mediastinales) y cuyo diámetro mayor no supere los 3 m. Se presenta aproximadamente en uno de cada 500 estudios radiológicos realizados en adultos. La importancia de los nódulos pulmonares radica en la posibilidad de establecer un diagnóstico temprano, ya que 50 a 60% de los nódulos corresponde a lesiones benignas, de las cuales 80% son procesos inflamatorios como granulomas asociados a tuberculosis o enfermedades micóticas. El otro 40 a 50% de los casos resultan ser malignos, y 75% de estos son carcinomas broncogénicos, y en caso de medir menos de 3 cm de diámetro (estadio I) se obtiene una sobrevida mayor de 80% a los cinco años de la resección. Algunos factores que nos hacen pensar que estas lesiones sean malignas son la edad del paciente; en menores de 35 años la probabilidad de que un nódulo sea maligno es baja (< 3 a 1%); por arriba de los 50 años la probabilidad de malignidad es de 63%. El tamaño de la lesión también es importante, en lesiones con diámetro mayor de 3 cm la probabilidad de malignidad llega ser de 93%, por debajo de este diámetro 42% resulta ser maligno y nódulos que miden menos de 1 cm son malignos en < 15% de los casos. Los márgenes del nódulo mal definidos (espiculados o lobulados) también sugieren malignidad. Y no olvidar el antecedente de tabaquismo, el cual incrementa la posibilidad de malignidad cuando está presente. Mientras no se demuestre lo contrario, resulta aconsejable considerar maligno todo nódulo pulmonar solitario en pacientes de riesgo. Book 2.indb 189 3/2/15 2:47 PM 190 14. Sarcoidosis pulmonar INTRODUCCIÓN La sarcoidosis es una enfermedad multisistémica de etiología desconocida que habitualmente afecta el tracto respiratorio y se caracteriza por la formación de granulomas inmunes en los sitios afectados. La sarcoidosis pulmonar es más frecuente en países de clima templado y en la población negra americana, es rara en Sudamérica, Centroamérica y África, también es rara en niños; más de 70% de los casos ocurre en personas entre 20 y 45 años y 30% se presenta después de los 50 años de edad. La causa y patogenia de la sarcoidosis continúan siendo desconocidas, sin embargo múltiples investigaciones han establecido que es una enfermedad granulomatosa resultante de una reacción inmune mediada por células no controlada. Guía EXARMED La tos crónica seca es el síntoma respiratorio más frecuente en la sarcoidosis. Book 2.indb 190 La sarcoidosis es una enfermedad multisistémica de causa desconocida que habitualmente afecta el tracto respiratorio y se caracteriza por la formación de granulomas inmunes en los sitios afectados. Existen diversas hipótesis para explicar su causa que se expondrán en este capítulo. Entre 30 y 60% de los pacientes se encuentran asintomáticos, se evidencia alteración en las radiografías de más de 90% de los pacientes con sarcoidosis. De manera primaria afecta a los pulmones y al sistema linfático predominantemente en ganglios hiliomediastinales. El diagnóstico se confirma por hallazgos histopatológicos de granulomas no caseificantes en los órganos comprometidos. Su evolución puede presentar resolución espontánea en 12 a 36 meses, o puede provocar fibrosis pulmonar en casos crónicos o presentarse en otros órganos incluyendo corazón, sistema nervioso central y ocular. Los corticoides sistémicos son el plan terapéutico principal sobre todo en estadios II y III, los corticoides inhalados son un aspecto a definir hasta el momento y se utilizan en las formas leves especialmente en los pacientes que presentan tos e hiperreactividad bronquial. La sarcoidosis pulmonar es más frecuente en países de clima templado y en la población negra americana, es rara en Sudamérica, Centroamérica y África, también es rara en niños; más de 70% de los casos ocurre en personas entre 20 y 45 años y 30% se presenta después de los 50 años de edad. Se han reportado casos de formas familiares pero no se ha identificado un defecto genético específico, el antígeno principal de histocompatibilidad HLA-B8 se ha asociado con cuadros de curso benigno mientras que el HLA-B12 se presenta en cuadros de curso crónico y progresivo. FISIOPATOGENIA Y ETIOLOGÍA La causa y la patogenia de la sarcoidosis continúan siendo desconocidas, sin embargo múltiples investigaciones han establecido que la sarcoidosis es una enfermedad granulomatosa resultante de una reacción inmune mediada por células no controlada, caracterizada por la presencia de granulomas típicos en los sitios afectados. Los granulomas de la sarcoidosis están formados de células epitelioides, así llamadas por su parecido con las células epiteliales en la microscopia óptica y linfocitos T; las células epitelioides representan formas activadas de macrófagos. Los granulomas inmunes son estructuras complejas, típicamente compuestas de un folículo central hecho de células epitelioides y linfocitos T rodeados por un anillo de fibroblastos y un área periférica rica en linfocitos. Los linfocitos T CD4+ predominan dentro del folículo mientras que linfocitos T CD8+ y linfocitos B están presentes en la periferia. Pueden persistir por varios meses o años pero usualmente se resuelven resultando pequeñas áreas cicatrizales. Los granulomas inmunes se forman como respuesta a un antígeno no identificado todavía, la existencia de variaciones estacionales en la presentación de la sarcoidosis y la relación geográfica y ocupacional sugieren un factor ambiental como probable causa por lo que se han relacionado agentes infecciosos (micobacterias y en menor medida bacterias gramnegativas como la Yersinia enterocolitica), agentes inorgánicos como berilio, zirconio, aluminio y partículas orgánicas que son fagocitadas por macrófagos actuando como antígenos. Se ha propuesto que hay una predisposición genética relacionada con el sistema HLA alelos clase II, de los cuales se ha reportado que confieren susceptibilidad: HLA-DR3, 5, 8, 9, 11, 12, 14, 15, 17, HLA-DPB1, HLADQB1 y los que se han detectado como protectores son HLA-DR1 y DR4, recientemente se ha considerado que también hay influencia de alelos clase I quizá más pronunciada que los antes mencionados. También se ha sugerido que polimorfismos de codificación de los genes de IL-1α, TNF-α, receptores de quimosinas 2 y 5, enzima convertidora de angiotensina, receptor de vitamina D y proteína natural resistente-asociada a macrófagos (NRAMP gen) pueden jugar un rol en la susceptibilidad para sarcoidosis. Existen variantes raras reportadas de sarcoidosis como granulomas sarcoidales necrosantes y sarcoidosis nodular. CUADRO CLÍNICO Las manifestaciones clínicas se presentan aproximadamente en 50% de los pacientes siendo el resto identificados por hallazgos incidentales en radiografías de tórax en pacientes asintomáticos. Cuando se presentan, los síntomas más frecuentes incluyen: a) Síntomas respiratorios. b) Síntomas de localización extratorácica. c) Síntomas constitucionales. d) Eritema nodoso. La tos crónica seca es el síntoma respiratorio más frecuente, la disnea es rara y se asocia con lesiones fibróticas pulmonares. Los síntomas constitucionales aparecen en 33% de los pacientes e incluyen astenia, adinamia, pérdida de peso, fiebre que suele ser de bajo grado aunque puede llegar a temperaturas de 39 a 40 ºC; es una causa frecuente de fiebre de origen desconocido. Los estertores crepitantes están presentes en menos de 20% de los casos. Otras manifestaciones torácicas menos frecuentes son la broncoestenosis generalmente por compresión extrínseca de las adenomegalias hiliares o por distorsión bronquial, aspergillosis pulmonar, principalmente aspergiloma que se desarrolla en los espacios quísticos con predominio en lóbulos superiores, sarcoidosis nodular y angeítis sarcoidea necrosante y granulomatosis, lesiones cavitarias primarias, enfisema buloso, compromiso vascular pulmonar (la hipertensión pulmonar ocurre en 1 a 4% de los pacientes), síndrome de vena cava superior y compromiso pleural de tipo derrame o quilotórax. Las manifestraciones extrapulmonares en vía aérea superior son obstrucción nasal, rinitis serosa, dolor en senos faciales, anosmia y perforación del tabique nasal; en el sistema cardiovascular puede presentarse compromiso del sistema de conducción con arritmias y muerte súbita; la afección ocular característica es la uveítis, puede presentarse afección de la conjuntiva, esclerótica, retina y cristalino provocando cataratas o glaucoma. También puede presentarse queratoconjuntivitis y compromiso de la glándula lacrimal; la enfermedad cutánea se caracteriza por eritema nodoso (marcador de sarcoidosis aguda) y lupus pernio (forma crónica de sarcoidosis) con evo- 3/2/15 2:47 PM 191 DIAGnóSTICO El diagnóstico de sarcoidosis requiere tres criterios: a) Presentación clínico-radiográfica típica. b) Demostración histológica de granulomas no caseosos en biopsias. c) Exclusión de otros diagnósticos. Los estudios que se realizan para apoyar el diagnóstico son los siguientes: Radiografía de tórax: presenta adenopatías hiliares bilaterales en 50 a 85% de los casos, infiltrados del parénquima pulmonar con o sin adenopatías hiliares en 25 a 50% bilaterales y simétricos y comprometen los lóbulos superiores, particularmente segmentos apicales y posteriores; las más frecuentes son opacidades reticulonodulares o las opacidades alveolares confluentes con consolidación o nódulos pulmonares circunscritos; en etapas avanzadas, pulmón en panal, distorsión de la arquitectura pulmonar, reducción volumétrica de lóbulos superiores, ascenso hiliar con retracción. El aumento de tamaño de ganglios linfáticos hiliares bilaterales en pacientes asintomáticos con exploración física normal y exámenes de rutina normales se presenta en 95% de sarcoidosis. Los estadios que se han propuesto para decisión terapéutica y pronóstico son: Estadio 0: radiografia normal. Estadio I: adenopatías hiliares bilaterales sin compromiso pulmonar. Estadio II: adenopatías hiliares bilaterales más infiltrados pulmonares. Estadio III: infiltrados pulmonares sin adenopatías hiliares. Estadio IV: fibrosis extensa con distorsión o bulas (Cuadro 2.14.1). Tomografía computada: opacidades nodulares y micronodulares (< 3 mm de diámetro) a lo largo de las bandas peribroncovasculares; hallazgos menos frecuentes son: opacidades nodulares confluentes con broncograma aéreo, opacidades en vidrio deslustrado, nódulos centrales y subpleurales; las anomalías parenquimatosas predominan en lóbulos superiores. La biopsia transbronquial es uno de los procedimientos más recomendados solamente si existen alteraciones endoscópicas; es positiva en 50 a 60% de pacientes que no tienen evidencias radiográficas de enfermedad parenquimatosa; en pacientes con radiografía patológica la positividad se incrementa a 85 a 90%. El lavado bronquioalveolar debe ser usado de manera rutinaria para excluir otros diagnósticos, en sarcoidosis los hallazgos que se reportan son: incremento del número de linfocitos T auxiliadores (CD4) y de la relación CD4/CD8 (> 3.5 diagnóstico de sarcoidosis con especificidad de 94%), aumen- Book 2.indb 191 to de los macrófagos alveolares activados y la presencia de linfocinas y marcadores bioquímicos. Las pruebas de función pulmonar muestran un patrón restrictivo con reducción de los volúmenes pulmonares, capacidad vital y capacidad pulmonar total. Las alteraciones obstructivas están presentes en 33% de los pacientes con compromiso parenquimatoso pulmonar; la reducción de la difusión de monóxido de carbono es menos marcada en relación con el descenso de la capacidad vital. La hipoxemia en reposo es de aparición tardía y puede observarse en etapas avanzadas. TRATAMIEnTO El tratamiento está indicado en pacientes sintomáticos o en aquellos con disfunción pulmonar significativa con curso progresivo, infiltrados parenquimatosos persistentes o progresivos en la radiografía de tórax, alteración de la función pulmonar moderada o grave y síntomas crónicos por más de un año. Puede ser categorizado en seis fases diferentes: 1) Inicio de corticoides a dosis plenas (30 a 40 mg de prednisona por día o 1 mg/kg/día). 2) Descenso gradual hasta alcanzar mínima dosis de mantenimiento (iniciar descenso entre la segunda y sexta semanas, debe ser gradual completándose en uno a tres meses). 3) Mantenimiento con dosis bajas de corticoesteroides (10 a 15 mg de prednisona por día o dosis de 0.25 mg/kg/día de seis meses a un año) 4) Descenso de corticoides hasta suspenderse (se recomienda descenso cada dos semanas, se prolonga entre seis semanas a tres meses). 5) Monitorización luego de suspensión de corticoides (vigilar síntomas pulmonares y espirometría, 20% de recaídas ocurre luego de un año y 10% a los dos años de suspendido el tratamiento). 6) Reinstalar dosis altas de corticoides si se produce recaída (idéntico al tratamiento inicial con dosis alta de corticoides durante dos a seis semanas seguido de descenso por fases). En caso de dosis de mantenimiento para evitar recaída de sarcoidosis pulmonar mayor de 20 mg de prednisona por día se indica tratamiento alternativo con medicamentos antiinflamatorios. Los corticoides inhalados pueden tener efecto cuando predomina la tos, inflamación endobronquial e hiperreactividad bronquial; no hay evidencia de que funcione en enfermedad pulmonar moderada a grave. Otros tratamiento son: metotrexato (10 a 20 mg una vez por semana) en pacientes que no responden a la prednisona o que presentan efectos secundarios a los corticoides. Azatioprina (100 a 200 mg/día), ciclofosfamida y clorambucil han sido utilizados pero con datos limitados. Con el trasplante pulmonar se ha propuesto que los pacientes Cuadro 2.14.1. Estadios radiográficos de sarcoidosis Estadio radiográfico de tórax Adenopatías Afección parenquimatosa Estadio 0 Ausentes Ausente Estadio I Presentes Ausente Estadio II Presentes Presente Estadio III Ausentes Presente sin fibrosis EstadioIV Ausentes Presenteconfibrosis Sección 2 | Neumología lución más tórpida; otras manifestaciones son nódulos subcutáneos, placas similares a la psoriasis, alopecia, lesiones hipo o hiperpigmentadas y vasculitis leucocitoclástica; en el aparato locomotor puede presentarse como poliartritis migratoria asociada a fiebre, eritema nodoso y adenopatías hiliares, episodios simples o recurrentes de artritis poliarticular o monoarticular sin dejar deformaciones o artritis persistente; la afección renal es asintomática, las causas más comunes son hipercalciemia o nefrocalcinosis; en el sistema nervioso las manifestaciones características son la paresia facial y la meningitis, la más común es la mononeuritis múltiple, los pares craneales comprometidos son el segundo y el séptimo; la afección hepática y gastrointestinal puede presentarse como colestasis intrahepática, hipertensión portal, masas sarcoidóticas pancreáticas y afección a glándulas salivales menores se ha reportado en 60% de las biopsias. 3/2/15 2:47 PM 192 sometidos al mismo requieren tratamiento indefinido con inmunosupresores (corticoides, ciclosporina A) y pueden limitar la intensidad de los procesos granulomatosos. PRONÓSTICO Guía EXARMED Se han propuesto marcadores de actividad como el recuento diferencial de linfocitos en el lavado bronquioalveolar, prueba de rastreo con galio y la determinación de los niveles séricos de enzima convertidora de angiotensina como marcadores de actividad, sin embargo no se ha comprobado que sean seguros en predecir el pronóstico, la respuesta al tratamiento ni la presencia ni intensidad de la inflamación. Entre 30 a 70% de los pacientes no requieren tratamiento por presentar remisión espontánea, se da ge- neralmente en los primeros seis meses luego del diagnóstico y se han reportado hasta en un periodo de dos a cinco años. La probabilidad de remisión varía dependiendo del estadio: Estadio I: 60 a 80% de remisión clínica espontánea, radiográfica 55 a 90%. Estadio II: 50 a 70% de remisión clínica con medicación, radiográfica 40 a 70%. Estadio III: < 30% de remisión clínica, radiográfica 10 a 20%. Estadio IV: nula remisión clínica. Radiográfica 0%. El predictor más marcado de mortalidad que se ha reportado es la elevación de la presión de la aurícula derecha que refleja la disfunción del ventrículo derecho. Book 2.indb 192 3/2/15 2:47 PM 193 15. Patología de pleura IntRoDUccIón EMBRIoLogíA y AnAtoMíA DE LA PLEURA Los vertebrados están formados por tres cuerpos primarios mesodérmicos: 1) la cavidad pleural; 2) la cavidad pericárdica, y 3) la cavidad peritoneal. Estos distintos espacios forman desde etapa temprana a la cavidad celómica en la embriogénesis. La pleura está dividida en una capa de células mesoteliales, una de tejido conectivo submesotelial, una elástica superficial, una de tejido conectivo subpleural abundante en vasos sanguíneos, nervios y linfáticos, y finalmente, una capa fibroelástica profunda. La porción parietal de la pleura presenta estomas, que son agujeros de 2 a 10 µm que comunican al espacio pleural El espacio pleural (espacio entre la pleura parietal y la visceral) es virtual y mide 10 a 20 µm de ancho entre el mesotelio de la pleura visceral y el de la parietal. La pleura visceral recubre la superficie del pulmón, a excepción de la región hiliar, mientras que la pleura parietal reviste la superficie interna de la caja torácica, mediastino y diafragma. Las cavidades pleurales derecha e izquierda están separadas en los humanos; sin embargo, pueden estar muy cerca o adheridas en la porción caudal del tórax por delante o por detrás del corazón en raras ocasiones. La pleura costal está irrigada por ramas de las arterias intercostales y torácica interna; la pleura mediastinal se irriga por ramas de la arteria bronquial, diafragmática superior, torácica interna y arterias mediastinales, y su drenaje venoso lo forman las venas bronquiales; la pleura diafragmática está irrigada por la arteria torácica interna, la aorta torácica abdominal y la arteria celiaca, mientras que su drenaje venoso está dado por la vena cava inferior y el tronco braquiocefálico. cisuras pleurales Las cisuras son hendiduras que se extienden desde la superficie externa del pulmón hasta el seno del parénquima pulmonar y están revestidas por una capa de pleura, la cual se continúa con la pleura visceral sobre la parte convexa o las superficies mediastínica o diafragmática del pulmón. Cada cisura puede extenderse de 1 a 2 cm en el interior del pulmón o llegar hasta el hilio, situación que delimitará un lóbulo o segmento pulmonar. Las cisuras mayores (oblicuas) separan en el pulmón derecho al lóbulo superior del medio e inferior, mientras que en el pulmón izquierdo separa al lóbulo superior del inferior. En el pulmón derecho también existe una cisura menor (transversa), la cual separa el segmento anterior del lóbulo superior derecho del lóbulo medio, y transcurre en un plano horizontal a nivel de la cuarta costilla anterior. Líquido pleural El líquido pleural se forma a partir de los vasos sistémicos de las membranas pleurales. Es líquido intersticial de los microvasos sistémicos pleurales, cuya concentración proteica es cercana 15% de la plasmática. El líquido pleural existe en una cantidad de 0.1 a 0.2 mL/kg, con una tasa de recambio de 11% en 1 h (0.01 mL/kg/h). La formación del líquido pleural depende de la ecuación de Starling (Cuadro 2.15.1). La presión negativa (subatmosférica) que existe en la cavidad pleural favorece el movimiento del líquido capilar parietal hacia el espacio pleural. La absorción del líquido pleural es igual a la tasa de formación (0.01 mL/kg/h), pero puede incrementarse hasta 0.28 mL/kg/h debido al drenaje por los estomas linfáticos de la pleura parietal, favorecidos por los movimientos respiratorios. RADIoLogíA PLEURAL Radiografía simple de tórax La superficie pleural diafragmática y mediastínica normal no es visible en la radiografía de tórax. Un aumento del espesor en la convexidad del pulmón puede ser visible aunque ésta sea leve (1 a 2 mm), debido a la mayor densidad de las costillas cercanas. El síndrome de las uñas amarillas es una enfermedad rara, caracterizada por la tríada siguiente: anomalías de las uñas, linfedema primario y manifestaciones pleuropulmonares. Un trasudado se define como aquel derrame pleural producido por factores sistémicos que producen alteraciones en la formación (aumento) y/o en la reabsorción (disminución) del líquido pleural. Un exudado es originado por factores locales que perturban la formación y absorción del líquido pleural. tomografía computada En este estudio de gabinete tampoco se puede visualizar la pleura diafragmática y del mediastino. Con la De acuerdo con la ecuación de Starling, el movimiento del fluido depende de seis variables: 1. Presión hidrostática capilar (Pc). 2. Presión hidrostática intersticial (Pi). 3. Coeficiente de reflexión (R), un valor que es índice de la eficacia de la pared capilar para impedir el paso de proteínas y que, en condiciones normales, se admite que es igual a 1, lo que significa que es totalmente impermeable a las mismas y en situaciones patológicas inferior a 1, hasta alcanzar el valor 0 cuando puede ser atravesado por ellas sin dificultad. 4. Presión oncótica capilar (ϖc ). 5. Presión oncótica intersticial (ϖi ). 6. Coeficiente de filtración (Kf ), expresa la permeabilidad de la pared capilar para los líquidos. Todas las presiones son medidas en milímetros de mercurio (mm Hg), y el coeficiente de filtración se mide en milímetros por minuto por milímetros de mercurio (ml · min-1 · mm Hg-1). La ecuación de Starling se describe de la siguiente manera: Q = Kf ([Pc − Pi ] − R [TTc − TTi ]) La solución a la ecuación es el flujo de agua desde los capilares al intersticio (Q ). Si es positiva el flujo tenderá a dejar el capilar (filtración). Si es negativo el flujo tenderá a entrar al capilar (absorción). Esta ecuación tiene un importante número de implicaciones fisiológicas, especialmente cuando los procesos patológicos alteran de forma considerable una o más de estas variables. Book 2.indb 193 sección 2 | Neumología cuadro 2.15.1. Ecuación de Starling 3/2/15 2:47 PM 194 La presencia de un pH < 7.20 en el líquido de derrame pleural indica la necesidad de colocar un drenaje pleural La presencia de aumento de líquido estéril en la cavidad pleural secundario a un proceso reactivo infeccioso pulmonar se considera como un derrame paraneumónico complicado tomografía de alta resolución se puede ver una línea de atenuación tisular blanda de 1 a 2 mm entre el pulmón y la pared torácica y entre los bordes internos de las costillas en los espacios intercostales (la pleura visceral), el líquido pleural, la pleura parietal, la fascia endotorácica y la porción interna del músculo intercostal. DERRAME PLEURAL Introducción El derrame pleural se define como la acumulación patológica de líquido en el espacio pleural; es el resultado de un desequilibrio entre la formación y la reabsorción de líquido a este nivel. La mayoría de las veces se produce por enfermedad pleural o pulmonar, pero es una manifestación frecuente de enfermedades sistémicas. Fisiopatogenia y etiología El derrame pleural es resultado de diferentes situaciones patológicas; se acumula líquido por los siguientes mecanismos: a) Trastorno en alguna de las variables de la ecuación de Starling (Cuadro 2.15.1), por ejemplo, en la presión hidrostática y/u osmótica. b) Trasudación líquida desde la pleura visceral por edema intersticial pulmonar. c) Líquido procedente de abdomen (p. ej., ascitis). d) Enfermedad que afecta directamente a la pleura, aumentando su permeabilidad (p. ej., cáncer). e) Pérdida de continuidad de la superficie pleural. Otras causas de acumulación pueden ser secundarias a incompetencia linfática parietal, como en los siguientes casos: a) Dificultad de drenaje linfático (p. ej., fallo del ventrículo derecho y síndrome de vena cava superior). b) Obstrucción de los canales linfáticos (p. ej., linfangitis). c) Alteración linfática primaria (p. ej., linfangiectasias o síndrome de uñas amarillas ). Cuadro clínico El síntoma más frecuente es el dolor torácico tipo pleurítico asociado a los movimientos respiratorios, principalmente en los derrames de causa infecciosa. Este dolor es ocasionado por la fricción entre ambas pleuras y disminuye conforme es mayor la acumulación de líquido. La disnea aparece cuando más de la mitad del hemitórax se encuentra ocupado por el derrame, llegando a progresar hasta disnea en reposo e insuficiencia respiratoria. La exploración física muestra abolición del murmullo vesicular en la zona del derrame, matidez a la percusión y pérdida de transmisión en las vibraciones vocales. Diagnóstico La sospecha clínica debe confirmarse con una radiografía de tórax, la cual demostrará aumento de la opacidad radiológica en las zonas declive del tórax que se delimita en su nivel superior por una línea nítida, mayor en la región axilar, y de contorno cóncavo (curva de Damoisseau). Cuando el derrame es masivo puede ocupar todo el hemotórax con rechazo de estructuras mediotorácicas. Si a pesar de que el derrame ocupa todo un hemitórax no hay desplazamiento contralateral de las estructuras mediastinales, puede ser que el derrame se encuentre asociado con atelectasias. En los derrames escasos sólo se observa la ausencia del seno costofrénico lateral y el seno costofrénico posterior. Toracocentesis La obtención de líquido pleural por punción transtorácica tiene un alto valor diagnóstico; el aspecto macroscópico, químico, citológico y bacteriológico orienta hacia la causa específica. El primer paso en la evaluación del derrame pleural es la determinación del tipo de éste: 1) trasudado, o 2) exudado. Una vez definido el tipo de derrame pleural, se procederá con otros estudios diagnósticos. Un trasudado se define como aquel derrame pleural originado por factores sistémicos que producen alteraciones en la formación (aumento) y/o en la reabsorción (disminución) del líquido pleural. Las principales causas de este tipo de derrame es la insuficiencia cardiaca, embolia pulmonar y cirrosis. Un exudado es originado por factores locales que perturban la formación y absorción del líquido pleural. Las principales causas de los exudados pleurales son la neumonía bacteriana, neoplasias malignas, infecciones virales, y embolia pulmonar. Los exudados y los trasudados se pueden distinguir por los criterios de Light, los cuales se describen en el Cuadro 2.15.2. Las diferentes causa según el tipo de derrame pleural se encuentran en el Cuadro 2.15.3. El aspecto macroscópico de los trasudados suele tener color amarillo pajizo. Por otro lado, los exudados tienen un color amarillo intenso en caso de infección; el líquido hemático sugiere neoplasia o tromboembolia; el aspecto lechoso corresponde a un quilotórax o linfoma; los empiemas con líquidos purulentos sugieren infección, principalmente por anaerobios. Otros estudios de utilidad son la medición del pH pleural, triglicéridos, amilasa, adenosina desaminasa. La amilasa en el líquido pleural hace sospechar rotura esofágica y enfermedad pancreática. Los niveles elevados de adenosina-desaminasa (enzima proveniente de Guía EXARMED Cuadro 2.15.2. Diferenciación entre exudado y trasudado pleural (criterios de Light) Book 2.indb 194 Los exudados cuentan con uno o más de los siguientes criterios, mientras que los trasudados no cuentan con ninguno a) Índice de proteínas en el líquido pleural/proteínas séricas > 0.5. b) Índice de deshidrogenasa láctica en el líquido pleural/deshidrogenasa láctica en el suero > 0.6. c) El nivel de deshidrogenasa láctica en el líquido pleural es más de dos tercios el límite superior de normalidad en el suero d) Si se cumplen los criterios en a), b) y/o c), pero aun así se sospecha la presencia de trasudado, entonces se medirá la concentración de albúmina en suero y en el líquido pleural. Si la diferencia es > 1.2 g/dL, se ignorarán los criterios en a), b) y c), y se considerará que el paciente padece de un trasudado. En caso de que el paciente tenga un exudado, se deberán solicitar adicionalmente los siguientes estudios en líquido pleural: a) glucosa, b) citología y citometría, c) cultivos y tinción de Gram. 3/2/15 2:47 PM 195 los linfocitos activados) aumentan las sospechas de derrame tuberculoso; si los niveles son menores a 40 U/L se puede descartar la posibilidad de tuberculosis; niveles entre 40 y 70 U/L sugieren tuberculosis; y niveles por arriba de 70 U/L confirman el diagnóstico de tuberculosis. Es importante recordar que la adenosinadesaminasa puede elevarse en otras situaciones como empiemas y artritis reumatoide (generalmente niveles entre 40 y 70 U/L). En el caso de sospecha de tuberculosis también se puede utilizar la tinción de Ziehl, a pesar de que ésta es poco sensible pero muy específica. En el caso de sospecha de infiltración tumoral de la pleura el estudio citológico adquiere gran importancia. Se considera que éste es positivo en 50% de los casos, y si se realiza en tres días diferentes puede serlo hasta en 80%. Los derrames paraneumónicos tienen cifras de leucocitos > 10 000/mm3. Una linfocitosis del líquido pleural por encima de 50% de la celularidad suele corresponder a derrame pleural tuberculoso, linfoma o derrame neoplásico. La biopsia pleural percutánea se indica en caso de sospecha de tuberculosis o neoplasia. tRAtAMIEnto Las opciones terapéuticas para el paciente que se presenta con un derrame pleural dependen del tipo y la gravedad del derrame. Se puede utilizar una escala de graduación de intensidad propuesta por el American College of Chest Physician, la cual toma en cuentan la anatomía del espacio pleural, la microbiología, y el contenido químico (Cuadro 2.15.4). El mismo panel de expertos propuso seis modalidades de tratamiento para el derrame pleural. 1) No drenaje. 2) Toracocentesis terapéutica. 3) Tubo de toracostomía. 4) Terapia fibrinolítica a través de un tubo de toracostomía. 5) Cirugía toracoscópica videoasistida (requiere colocación de tubo de toracostomía posteriormente). 6) Cirugía abierta. EMPIEMA PLEURAL y DERRAME PLEURAL coMPLIcADo IntRoDUccIón El empiema es la presencia de una colección supurada en una cavidad pleural, secundaria a neumonía, inter- vención quirúrgica, traumatismo, foco infeccioso (mediastínico cervical, abdominal o de la columna cervical, y en pocas ocasiones por vía hematógena). FIsIoPAtogEnIA y EtIoLogíA Existen diferentes fuentes de infección que culminan en empiema, las cuales se mencionan a continuación. Empiema postraumático. Este empiema es debido a la inoculación directa de microorganismos; se ve favorecido por la acumulación de sangre o líquido en la cavidad pleural. Empiema posquirúrgico. Es secundario a la inoculación directa posterior a la manipulación del tórax (p. ej., biopsia pleural, toracoscopia, drenaje pleural). cuadro 2.15.3. Etiología de los derrames pleurales Derrame pleural de tipo trasudado 1) Insuficiencia cardiaca. 2) Cirrosis. 3) Embolia pulmonar. 4) Síndrome nefrótico. 5) Diálisis peritoneal. 6) Síndrome de obstrucción de la vena cava superior. 7) Mixedema. Derrame pleural de tipo exudado 1) Neoplasias (metastásicas o primarias [mesotelioma]). 2) Infecciones (bacterias, tuberculosis, virus, parásitos, hongos). 3) Embolia pulmonar. 4) Enfermedad gastrointestinal (p. ej., rotura esofágica, pancreatitis, absceso intraabdominal, hernia diafragmática). 5) Enfermedades de la colágena. 6) Posterior a cirugía de revascularización cardiaca. 7) Asbestosis. 8) Sarcoidosis. 9) Uremia. 10) Síndrome de Meig. 11) Síndrome de las uñas amarillas. 12) Fármacos (nitrofurantoína, dantroleno, metisergida, bromocriptina, amiodarona). 13) Radioterapia. 14) Traumatismos. 15) Quilotórax. 16) Otros (pericarditis, síndrome de hiperestimulación ovárica, síndrome de lesión poscardiaca). Anatomía del espacio pleural Microbiología Química (pH) categoría Riesgo de pronóstico adverso Indicación de drenaje Derrame mínimo (< 10 mm en la radiografía en decúbito lateral) y Resultados de la tinción de Gram y cultivos desconocidos pH desconocido 1 Muy bajo No Derrame pequeño a moderado (< ½ hemitórax) y Resultados de la tinción de Gram y cultivos negativos ≥ 7.20 2 Bajo No Derrame grande (≥ ½ hemitórax); pleura engrosada o loculada o Tinción de Gram o cultivos positivos < 7.20 3 Moderado Sí − 4 Alto Sí Presencia de pus Si no es posible obtener el pH del líquido pleural, se puede utilizar la glucosa, cuyo valor correspondiente al del pH es de 60 mg/dL. Book 2.indb 195 sección 2 | Neumología cuadro 2.15.4. Categorización de riesgos del paciente con derrame pleural 3/2/15 2:47 PM 196 Guía EXARMED Los microorganismos causantes del empiema son en general Streptococcus milleri, Streptococcus pneumoniae, Staphylococcus aureus y Haemophilus influenzae, con un 10% de casos causados por anaerobios. Cap15_16 Neumologia.indd 196 Empiema secundario a focos infecciosos contiguos. La fuente de infección puede ser una mediastinitis, pericarditis, perforación esofágica, infección cervical, absceso hepático (es más frecuente que el absceso hepático ocasione un derrame pleural reactivo inflamatorio, en vez de diseminación de la infección hacia la pleura). También puede ser secundario a una infección a distancia que se transmite por vía hematógena, aunque esto no es lo más frecuente. En el desarrollo del empiema existen tres fases reconocidas: 1) la fase exudativa; 2) la fase fibrinopurulenta, y 3) la fase organizada. 1) En la fase exudativa se inicia la producción de interleucinas (p. ej., la interleucina 8) y factor alfa de necrosis tumoral los cuales son responsables del aumento de la permeabilidad de la pleura visceral y acumulación de líquido pleural estéril. El líquido en esta fase es un exudado con presencia de niveles normales de glucosa y pH. En caso de infección pulmonar a esta fase se le considera como un derrame paraneumónico no complicado. Si el empiema es tratado en este momento el paciente tendrá excelente pronóstico. 2) En la segunda fase, o también llamada fibrinopurulenta, existe invasión bacteriana del espacio pleural, con acumulación de mayor cantidad de líquido con bacterias y restos celulares. En esta etapa se acumula fibrina entre las dos pleuras, con tendencia hacia la loculación con formación de membranas, y consecuentemente dificultad en el drenaje adecuado del empiema. El proceso de formación de fibrina se ve influenciado por el acceso de factores de la coagulación desde el suero sanguíneo. Conforme la infección progresa, la invasión bacteriana promueve la migración de neutrófilos, incrementándose la inflamación y la respuesta metabólica. El pH y la glucosa disminuyen progresivamente y la deshidrogenasa láctica aumenta. Es posible que el pulmón pueda expandir con drenaje. 3) En la tercera fase, o estado de organización, comienza la aparición de fibroblastos dentro del exudado, produciéndose una membrana no elástica (“caparazón que atrapa al pulmón”). En este momento el pulmón es restringido durante su expansión, llevando al paciente a un estado alterado de intercambio gaseoso, y propensión de sobreinfecciones. A partir de este momento el pronóstico del paciente es variable; algunos pacientes curarán espontáneamente con resolución completa del cuadro, mientras que otros progresarán a una forma crónica de restricción pulmonar. En este último caso, es posible que drene líquido de manera espontánea a través de la pared torácica (empiem necesitatis) o hacia el pulmón (fístula broncopleural). El tratamiento de estos pacientes es a base de decorticación pulmonar. Cuadro clínico Los pacientes con infección pleural se presentan con mayor frecuencia con la sintomatología del cuadro primario del proceso infeccioso, es decir, una neumonía: tos, fiebre, esputo purulento y disnea. El dolor pleurítico (lo cual indica afección de la pleura parietal) no debe considerarse como un síntoma universal, y su ausencia no excluye la posibilidad de infección pleural. La infección por anaerobios suele presentarse de una manera indolente con pérdida de peso, anorexia y malestar general. Las infecciones pleurales se deben sospechar en los pacientes con neumonía resistente a tratamiento antibiótico. En ellos se deberá realizar inmediatamente una evaluación clínica y radiológica completa. Se deberán evaluar los factores de riesgo para empiema, como alcoholismo, mala higiene oral y broncoaspiración de secreciones. Diagnóstico Toracocentesis Al igual que el líquido pleural de los derrames paraneumónicos, el del empiema se considera un exudado. En caso de que los criterios de Light indiquen la presencia de un trasudado se deberán considerar otros diagnósticos. La presencia de predominio de linfocitos (en vez del típico de neutrófilos en el empiema) debe hacer sospechar la posibilidad de neoplasias malignas y tuberculosis. El aspecto del líquido aspirado será amarillo purulento con un alto grado de viscosidad. Si el paciente se encuentra en una fase fibrinopurulenta avanzada, o en organización, es probable que no se pueda aspirar una gran cantidad de líquido. Radiografía de tórax En las radiografías de tórax se observa colección de líquido en las regiones en declive del espacio pleural, opacando el ángulo costofrénico. Se requieren aproximadamente 75 mL de líquido para “borrar” el ángulo costofrénico posterior en una radiografía lateral de tórax. En una radiografía posteroanterior de tórax se requieren 200 mL de líquido para opacificar el ángulo costofrénico lateral. Si se han llegado a formar loculaciones se pueden observar opacidades en regiones diferentes a las de declive. Se debe recordar que el diagnóstico de empiema no se hace estrictamente en los hallazgos radiográficos, sino que será necesario complementar la información con tomografía computada y toracocentesis. Tomografía computada La tomografía computada es el estudio de imagen de elección para evaluar la posibilidad de empiema. El empiema típico frecuentemente se presenta de forma lenticular. La presencia de burbujas de gas dentro del espacio pleural sugiere el diagnóstico de empiema. En la ventana pulmonar se puede demostrar una neumonía adyacente a la zona de la colección pleural. En la ventana de tejidos blandos se pueden demostrar algunas causas del empiema, como la rotura esofágica o alguna complicación de la cirugía mediastinal. Diagnósticos diferenciales Los diagnósticos diferenciales más importantes a considerar en pacientes con sospecha de empiema es la embolia pulmonar asociada a un infarto pulmonar, la pleuritis tuberculosa, la pleuritis reumatoidea, la pleuritis lúpica, la neoplasia pulmonar y el derrame pleural secundario a pancreatitis. Tratamiento El tratamiento de los pacientes con empiema depende del reconocimiento oportuno de esta condición, el uso adecuado de antibióticos, drenaje pleural, y cuidados generales (p. ej., nutrición). Nutrición Los pacientes con diagnóstico de empiema se encuentran en un grave estado catabólico, y por lo tanto, se deben atender adecuadamente las necesidades nutricionales. 3/3/15 8:29 AM Drenaje intercostal cerrado Como consenso general se ha establecido que la presencia franca de pus en el espacio pleural requiere un drenaje pleural. Se recomienda la instauración de drenaje en caso de que los resultados de la toracocentesis fuesen positivos o si el pH fuera menor a 7.20. El resto de los derrames (pH > 7.20 y sin evidencia de infección), por lo general se resuelven sólo con tratamiento antibiótico. Otros criterios que se han utilizado para decidir la colocación de drenaje pleural es un nivel de glucosa < 60 mg/dL o un nivel de deshidrogenasa láctica > 600 UI/dL. El indicio más importante para decidir el retiro del drenaje pleural es la respuesta clínica del paciente, y en el momento en que el líquido drenado sea menor a 150 mL/día. Fibrinolíticos intrapleurales Aquellos pacientes que progresan hacia la fase fibrinopurulenta probablemente también desarrollarán múltiples loculaciones, las cuales evitarán el adecuado drenaje percutáneo de líquido pleural (probable causa de falla en el tratamiento médico). Por esta razón se ha propuesto el uso de fibrinolíticos con la finalidad de deshacer los puentes de fibrina que se forman en estos pacientes. Hasta el momento la evidencia acerca de la utilidad de los fibrinolíticos intrapleurales no ha sido alentadora, pues no reduce la mortalidad ni la necesidad de cirugía. Actualmente se encuentra en estudio la utilidad de la desoxirribonucleasa, con la finalidad de disminuir la viscosidad del líquido de empiema abundante en ácido desoxirribonucleico. tratamiento quirúrgico La terapia médica llega a fallar hasta en 30% de los pacientes con empiema, los cuales son frecuentemente referidos a tratamiento quirúrgico. En general se acepta que aquellos pacientes sin mejoría clínica ni radiográfica después de siete días de tratamiento estándar deben ser considerados para cirugía. Book 2.indb 197 197 tUMoREs PLEURALEs Los tumores pleurales pueden ser divididos en: 1) metastásicos; 2) sarcomas; 3) enfermedades linfoproliferativas, y 4) mesoteliomas. En esta revisión sólo se describen los mesoteliomas. MEsotELIoMAs El mesotelioma es una neoplasia maligna altamente letal y resistente a la mayoría de las terapias actuales. Esta neoplasia se encuentra altamente ligada con la exposición a asbesto y la radioterapia torácica. La asbestosis se puede dividir en dos grupos conocidos como anfíbolas y serpentinas. El primer grupo es el que tiene una actividad tumorigénica bien establecida. Uno de los más grandes problemas de la asbestosis como factor de riesgo para la presentación de mesotelioma es el mínimo contacto temporal requerido para la eventual inducción del mesotelioma, a pesar de que el periodo de latencia puede ser mayor a 30 años. El mesotelioma es una enfermedad de ancianos, generalmente entre 50 y 60 años. Los pacientes se presentan con un derrame pleural unilateral, dolor torácico y disnea. Al examen radiológico se puede evidenciar datos de asbestosis, principalmente la presencia de placas pleurales de asbesto. El tumor es de crecimiento lento, manifestándose clínicamente una vez que ha encapsulado al pulmón, mediastino y la pared torácica. El diagnóstico de mesotelioma es uno de los más difíciles de realizar por parte del patólogo, principalmente debido a que todas las formas de este tumor pueden traslaparse con condiciones reactivas de la pleura. Por esta razón se debe tratar de obtener biopsias pleurales de suficiente tamaño para garantizar un diagnóstico definitivo, y esto se realiza mediante toracoscopia o toma de biopsia pleural a cielo abierto. Existen varias opciones terapéuticas, incluyendo la cirugía radical, quimioterapia, y radiación, pero ninguna ha demostrado ser más efectiva que el tratamiento sintomático. Se recomienda que el dolor torácico sea tratado con opioides, y que la disnea se trate con oxígeno y opioides. El tratamiento antibiótico empírico del empiema es mediante una cefalosporina de segunda generación (p. ej., cefuroxima) o una aminopenicilina con un inhibidor de betalactamasas y cobertura anaerobia (p. ej. metronidazol). El mesotelioma está altamente relacionado con la exposición previa de asbesto. nEUMotóRAX EsPontÁnEo IntRoDUccIón Lo referente al neumotórax traumático se tratará en la sección de traumatología, mientras que a continuación sólo se tratará el tema referente al neumotórax espontáneo. Los neumotórax espontáneos se pueden dividir en primarios (en pacientes sin enfermedad pulmonar previamente conocida) y secundarios (pacientes con enfermedad pulmonar previamente conocida). FActoREs DE RIEsgo y EtIoLogíA El neumotórax espontáneo primario afecta a los hombres más comúnmente que las mujeres, apareciendo con más frecuencia durante la tercera década de edad, y rara vez después de los 40 años de edad. Generalmente ocurre durante el reposo. Por lo regular son pacientes más altos y delgados que la población general. Existe bastante especulación acerca del origen de esta entidad patológica, y la teoría más aceptada es que esta condición resulta de bulas enfisematosas subpleurales que llegan a romperse. sección 2 | Neumología Antibióticos A todos los pacientes con sospecha de una infección pleural se les debe administrar antibióticos. Cuando sea posible, la elección de los antibióticos se hará con base en los resultados de los estudios microbiológicos pleurales y sanguíneos, sin retrasar la instauración del tratamiento por esperar estos resultados. Entonces, se recomienda iniciar con un esquema empírico antibiótico, hasta que se obtengan los resultados microbiológicos. En un empiema secundario a una infección adquirida en la comunidad, los microorganismos más frecuentes son Streptococcus milleri, Streptococcus pneumoniae, Staphylococcus aureus y Haemophilus influenzae, con 10% de casos causados por anaerobios. Por estas razones un esquema frecuentemente utilizado es el uso de una cefalosporina de segunda generación (p. ej., cefuroxima) o una aminopenicilina con un inhibidor de betalactamasas y cobertura anaerobia (p. ej., metronidazol). En pacientes alérgicos a las penicilinas o cefalosporinas se puede utilizar ciprofloxacina en combinación con clindamicina. En pacientes con infección por Staphylococcus aureus resistentes a meticilina se puede utilizar una combinación de carbapenemes (p. ej., meropenem) y algún antibiótico específico para este organismo (p. ej., vancomicina). En general, se recomienda un tratamiento de al menos tres semanas de duración, de las cuales por lo menos una es de administración intravenosa. 3/2/15 2:47 PM 198 El neumotórax espontáneo secundario es más común después de los 40 años de edad, con un alto índice de recurrencia. La enfermedad subyacente más frecuentemente involucrada es la enfermedad pulmonar obstructiva crónica, y otras causas varían desde infecciones hasta neoplasias malignas. Es frecuente que ocurra en individuos con infección por el virus de la inmunodeficiencia adquirida posterior a infección por Pneumocystis jirovecii. Tratamiento El tratamiento del neumotórax se dirige a la eliminación de la colección de aire intrapleural, así como a la prevención de ataques recurrentes. El tratamiento se basa en la administración de oxígeno, observación y aspiración del aire intrapleural. Guía EXARMED Cuadro clínico La presentación clínica más común es la presencia de dolor pleurítico ipsolateral acompañado de disnea. La mayoría de los episodios ocurre mientras el paciente se encuentra en reposo. A la exploración física el hallazgo más común es la taquicardia, y secundariamente, disminución de los movimientos respiratorios de la pared torácica, hiperresonancia a la percusión, disminución del frémito vocal y de la intensidad de los ruidos respiratorios del lado afectado. Diagnóstico Debido a la falta de especificidad de los signos y síntomas asociados con el neumotórax, el diagnóstico definitivo requiere un alto índice de sospecha y una radiografía de tórax. En una radiografía de tórax con el paciente de pie se podrá identificar una línea correspondiente a la pleura visceral. Se puede solicitar una radiografía en espiración, a pesar de que no aumenta la sensibilidad del estudio, ni se encuentra recomendado actualmente. El diagnóstico diferencial más importante, sobre todo en pacientes con enfisema pulmonar, es un quiste de aire de pared delgado o una bula gigante, los cuales requerirán de tomografía computada para encontrarse. Book 2.indb 198 3/2/15 2:47 PM 16. Patología de mediastino cLAsIFIcAcIón AnAtóMIcA Se han realizado múltiples clasificaciones del mediastino con la finalidad de diferenciar las masas que se presentan con mayor frecuencia en cada una de sus divisiones. La clasificación tradicional consiste en dividir el mediastino en cuatro compartimentos: superior, anterior, medio y posterior. La clasificación de Felson I divide el mediastino a través de dos planos imaginarios: el primero con dirección vertical se origina en el diafragma, por detrás del corazón y delante de la tráquea, terminando en el cuello (éste separa el espacio anterior del medio); y el segundo plano también vertical pasa 1cm por detrás de los bordes anteriores de las vértebras torácicas y separa el espacio medio del posterior. La clasificación de Heitzman (1977) se basa en límites anatómicos en los que los arcos aórticos y de la vena ácigos sirven para dividir el mediastino en siete compartimentos: inicia con un plano coronal que pasa por delante de la aorta ascendente y vena cava superior, limitando un compartimento anterior. Ade- P A M Figura 2.16.1. Clasificación de mediastino de Felson: A: anterior, M: medio, P: posterior. Book 2.indb 199 más con cinco espacios con proyección axial: el superior denominado opérculo torácico, los intermedios llamados espacio supraácigos y espacio supraaórtico, los inferiores nominados espacio infraácigos y espacio infraaórtico, y los hilios. En esta revisión se utiliza la clasificación de Felson para fines prácticos por ser la más sencilla de todas (Figura 2.16.1). contEnIDos MEDIAstInALEs Cada una de las zonas del mediastino contiene estructuras anatómicas de gran importancia clínica, lo que nos sirve para hacer un diagnóstico diferencial dirigido cuando nos enfrentamos a una masa mediastínica, por lo que las describiremos a continuación. Mediastino anterosuperior: tráquea, ganglios linfáticos, arco aórtico y sus grandes vasos, venas innominadas y timo. Mediastino medio: corazón, pericardio, ganglios linfáticos, hilios pulmonares, vena cava superior, nervios frénicos y vagos. Mediastino posterior: esófago, aorta descendente, vena ácigos, conducto torácico, ganglios linfáticos, nervios vagos y cadena simpática. De acuerdo con las estructuras presentes en cada uno de los compartimentos del mediastino, se puede diagnosticar las masas más frecuentes, de la siguiente manera (Cuadro 2.16.1): En este capítulo se revisa los principales trastornos, principalmente las lesiones ocupantes de espacio, que se presentan en el mediastino. cuadro 2.16.1. Clasificación de masas según su localización en el mediastino Mediastino anterior Timoma Tumores de células germinales Teratomas Seminomas Tumores no seminomatosos Linfoma Enfermedad de Hodgkin Linfoma No Hodgkin Tumores tiroideos Tumores paratiroideos Lipoma Carcinoma Linfangioma Aneurismas aórticos Mediastino medio Linfoma Quistes (entéricos, broncogénicos, pericárdicos, metastásicos) Granulomas sistémicos Adenopatías inflamatorias Mediastino posterior Tumores neurogénicos Quistes (broncogénicos, entéricos) Xantogranulomas Hernias diafragmáticas Meningocele Abscesos paravertebrales Lesiones esofágicas sección 2 | Neumología IntRoDUccIón La palabra mediastino proviene del latín (estar en medio). Es un espacio anatómico situado entre el pulmón derecho y el izquierdo, por detrás del esternón y por delante de las vértebras (desde T1 hasta L1); limitado a los lados por la pleura parietal medial; arriba por el opérculo torácico y por el diafragma como límite inferior, que lo separa del abdomen. Tiene forma de pirámide truncada, con vértice superior y base inferior. El mediastino representa casi una quinta parte del espacio de la caja torácica y mide aproximadamente en el adulto, 15 a 20 cm de alto, con un ancho de 4 a 5 cm y un diámetro anteroposterior de 12 a 16 cm. 199 3/2/15 2:47 PM 200 La clasificación de Felson divide el mediastino en anterior, medio y posterior. El síndrome de Claude Bernard-Horner se caracteriza por ptosis palpebral, anhidrosis ipsolateral, enoftalmia y miosis. Los timomas son las neoplasias más comunes en el mediastino anterior, representan 20% de todas las masas mediastinales anteriores en el adulto. LESIONES OCUPANTES DE MEDIASTINO Las manifestaciones clínicas son muy variadas, incluso pueden ser asintomáticas y aparecer como hallazgos incidentales en la radiografía de tórax. Cuando están presentes, los síntomas producidos por masas mediastinales dependen del tamaño y localización, siendo las más comunes las causadas por compresión de estructuras adyacentes, como el síndrome de vena cava superior, caracterizado por ingurgitación yugular, circulación colateral y edema en esclavina. También es frecuente la compresión de vías respiratorias (tos, disnea) o nerviosa. La compresión de ganglios y nervios simpáticos (ramas sexta cervical y primera torácica del simpático) produce síndrome de Claude Bernard-Horner caracterizado por ptosis palpebral, anhidrosis ipsolateral, enoftalmía y miosis. Los síndromes sistémicos se caracterizan por acción a distancia de sustancias producidas en el mediastino (hipercalciemia en tumores de paratiroides, ginecomastia en tumores de células germinales, miastenia grave e hipogammaglobulinemia en tumores del timo). Por otra parte, la presencia de marcadores tumorales puede orientarnos hacia algún diagnóstico, como por ejemplo: anticuerpos antirreceptor de acetilcolina, elevados en miastenia grave y linfoma; alfafetoproteína, en tumores germinales no seminomatosos; fracción beta de gonadotropina coriónica, en tumores germinales no seminomatosos (coriocarcinoma). Masas del mediastino anterior El síndrome de Good es una inmunodeficiencia por déficit de anticuerpos asociada a timoma, generalmente benigno. Timoma Los timomas son las neoplasias más comunes en el mediastino anterior, representan 20% de las masas mediastinales anteriores en adultos, son raras en niños. Es un tumor benigno o de bajo grado de malignidad del epitelio tímico, frecuentemente asociado a una población variable de células T inmaduras pero no neoplásicas. La mayoría son tumores sólidos, aunque pueden tener áreas necróticas, quísticas o hemorrágicas. Se clasifican basándose en el predominio celular en linfocítico, epitelial o células fusiformes (células en huso). La clasificación clínica de Masaoka (1984) se basa en el grado de invasión del tumor a través de la cápsula hacia tejidos subyacentes, siendo éste un predictor independiente de sobrevida (Cuadro 2.16.2). Cuadro clínico Puede ocurrir como hallazgo incidental en una radiografía de tórax. Los síntomas más comunes son dolor torácico, tos o disnea, debido a compresión o invasión del tumor. Las metástasis son poco frecuentes. La imagen radiográfica típica es una masa lobulada, bien definida en el mediastino anterosuperior (anterior a la raíz aórtica). La tomografía computada de tórax muestra una masa de tejido blando, encapsulada, bien definida y en algunas ocasiones con necrosis o hemorragia. Se pueden desarrollar síndromes paratímicos, como por ejemplo, la miastenia grave, hipogammaglobulinemia (10%) y aplasia pura de glóbulos rojos (5%). También se asocia a enfermedades autoinmunes como lupus eritematoso sistémico, miocarditis y polimiositis. La miastenia grave es más frecuente en mujeres y se caracteriza por debilidad muscular (diplopía, ptosis, disfagia, debilidad y fatiga) así como debilidad generalizada con falla respiratoria. La incidencia de la miastenia grave aumenta con la edad, tanto para hombres como para mujeres. De 30 a 50% de los pacientes con timoma presentan miastenia grave, mientras que sólo 10 a 15% de aquellos con miastenia grave presentan timoma. Se desarrolla por autoanticuerpos contra la unión neuromuscular, por lo que se deben medir los niveles séricos del anticuerpo contra el receptor de acetilcolina en todos los pacientes en los que se sospeche timoma para descartar miastenia grave. La prueba de Tensilon es diagnóstica, aunque no siempre es positiva. La electromiografía de fibra única es sensible y específica. El síndrome de Good es una inmunodeficiencia por déficit de anticuerpos asociada a timoma, generalmente benigno. Se presenta en pacientes alrededor de los 40 años, ocurriendo primero el timoma y posteriormente el síndrome. Se sugiere que se produce por un bloqueo temprano en la diferenciación de los linfocitos B a nivel de la célula madre pluripotencial. Las manifestaciones clínicas más importantes son las infecciones recurrentes (sinusitis e infecciones pulmonares); también son frecuentes las diarreas crónicas y alteraciones hematológicas. Diagnóstico y tratamiento El diagnóstico de timoma se realiza por medio de examen de tejido, tomado por biopsia por aspiración con aguja fina o excisión quirúrgica. La resección quirúrgica es el tratamiento de elección. En la enfermedad localmente invasiva o metastásica, o en tumores inoperables, la quimioterapia y radioterapia adyuvantes pueden ser de utilidad. El timoma responde generalmente a quimioterapia (cisplatino, doxorrubicina, ciclofosfamida y prednisona). Los signos de mal pronóstico son: tamaño del tumor mayor de 10 cm, edad menor de 30 años, compresión vascular o traqueal, histología epitelial o mixta y presencia de síndrome paratímico hematológico. Cuadro 2.16.2. Clasificación de Masaoka para timoma Tasa de sobrevida EstadioGrado de invasión a cinco años Guía EXARMED Book 2.indb 200 1 Encapsulación macroscópica completa sin invasión capsular microscópica 96 a 100% 2 Invasión hacia tejido graso circundante o pleura mediastinal macroscópicamente o invasión hacia la cápsula microscópicamente 86 a 95% 3 Invasión macroscópica hacia órganos vecinos 56 a 69% 4a Diseminación pleural o pericárdica 11 a 50% 4b Metástasis linfáticas o hematógenas 3/2/15 2:47 PM Teratomas Son neoplasias compuestas por una mezcla de tejidos que derivan de dos o las tres capas embrionarias (endodermo, mesodermo y ectodermo). Los teratomas benignos son los tumores embrionarios mediastínicos más comunes. En los teratomas maduros son frecuentes la presencia de piel y anexos epidérmicos, tejido bronquial, mucosa gastrointestinal, grasa, músculo liso, cartílago y hueso. Tienen el potencial de transformación maligna (rabdomiosarcoma, adenocarcinoma, leucemias). Además, los tejidos que lo constituyen tienen la misma arquitectura que los adultos. Los teratomas inmaduros son sólidos y suelen invadir las estructuras adyacentes. Son frecuentes las áreas de necrosis y hemorragias. Están constituidos por tejido de las tres capas germinales en distintos estadios evolutivos, desde el embriónico al fetal. Los tejidos más frecuentemente observados son de origen endodérmico y ectodérmico. Radiológicamente se aprecian como masas bien definidas, redondas o lobuladas, pueden estar calcificadas por presencia de material dentario o de hueso (20 a 40%) y usualmente se extienden hacia un lado de la línea media. La resección quirúrgica completa es el tratamiento de elección, la quimioterapia adyuvante puede ser útil después de una resección subtotal. Seminomas Representan 25 a 50% de los tumores de células germinales malignos. Son más frecuentes en hombres y su edad de presentación más común es entre los 20 y 40 años. Los síntomas más frecuentes son disnea, dolor retroesternal, tos, fiebre, ginecomastia y pérdida de peso. Pueden presentar síndrome de vena cava superior por compresión del tumor. En la radiografía de tórax se observa una masa grande (bulky), homogénea y lobulada, con atenuación homogénea. Se puede extender hacia ambos lados del mediastino. Los seminomas son sensibles a radiación. En pacientes con enfermedad localmente avanzada, se incluye la quimioterapia seguida por resección de tumor residual. Su sobrevida a cinco años es de 86%. Tumores no seminomas Son tumores malignos con predominio en hombres jóvenes; y pueden estar asociados a malignidades hematológicas y a síndrome de Klinefelter. Generalmente son sintomáti- Book 2.indb 201 201 cos. Tienen elevación de hormonas como la alfafetoproteína (carcinoma embrionario) y β gonadotropina coriónica. En la radiografía de tórax se evidencia una masa grande, irregular, y se presentan áreas de necrosis y hemorragias; generalmente invade pulmón. El tratamiento se basa en quimioterapia con bleomicina, etopósido y cisplatino. Los pacientes con enfermedad residual deben ser sometidos a resección quirúrgica. Tienen mal pronóstico, con una sobrevida a cinco años de 48%. Bocio mediastinal Su incidencia es baja (1 a 15%); son masas de crecimiento lento, por lo regular se reconocen incidentalmente en la radiografía de tórax y suelen ser eutiroideos. Se pueden dividir en tres grupos: cervicotorácicos que inician en área cervical y penetran en el tórax (bocios blongeant o buzos), son los más frecuentes (85%); bocios mediastínicos sin bocio cervical y bocios aberrantes, que son poco frecuentes y pueden ubicarse en cualquier posición del mediastino. La sintomatología que predomina, cuando está presente, se debe a compresión traqueal (disnea, estridor), compresión venosa y esofágica (disfagia). Radiológicamente son tumores encapsulados, lobulados y heterogéneos. En la tomografía de tórax se observa continuidad de la tiroides desde el espacio cervical hasta el mediastino. El tratamiento es quirúrgico ya que se puede desarrollar enfermedad maligna en algunos pacientes. El mediastino es el sitio extragonadal más frecuente de los tumores de células germinales y representa 15% de las masas del mediastino anterior. Los teratomas están compuestos por una mezcla de tejidos que derivan de dos o las tres capas embrionarias (endodermo, mesodermo y ectodermo). Pueden ser maduros o inmaduros. Linfoma primario mediastinal Comprende cerca de 10% de los linfomas del mediastino. El más común es la enfermedad de Hodgkin (50 a 70%), mientras que el No Hodgkin ocupa 15 a 25%. Su presentación tiene una distribución bimodal con un pico en la juventud y después de los 50 años. En mujeres es más común en la tercera década de la vida, mientras que para los hombres no hay prevalencia por edades. El linfoma Hodgkin se divide en cuatro tipos: esclerosis nodular, predominio linfocítico, celularidad mixta y depleción linfocítica, siendo más común el subtipo de esclerosis nodular en más de 50%. La sintomatología incluye fiebre, sudación nocturna, pérdida de peso (síntomas B), asociada a síntomas por compresión de estructuras vecinas (tos, disnea, dolor torácico, síndrome de vena cava superior). La radiografía de tórax muestra nódulos paratraqueales y prevasculares aumentados de tamaño o una masa mediastínica proveniente de mediastino. Los hallazgos de mal pronóstico para linfoma de Hodgkin son: albúmina menor de 4 g/dL, hemoglobina menor de 10.5 g/dL, sexo masculino, estadio IV, mayores de 45 años, leucocitosis mayor de 15 000 celulas/µL, linfocitos menores de 600/µL. Linfoma no Hodgkin Los subtipos más comunes en el mediastino son el linfoma linfoblástico y linfoma B de células grandes, que se presentan a la edad de 28 y 35 años, respectivamente. El linfoma No Hodgkin es más frecuente en hombres, con edad promedio de más de 55 años. Los principales síntomas son tos y disnea, pero puede presentarse síndrome de vena cava superior, obstrucción traqueal, taponamiento cardiaco y compromiso de médula ósea con células blásticas. Hay mayor compromiso de nódulos mediastinales medios y posteriores que los anteriores. sección 2 | Neumología tumores de células germinales Son derivados de células germinales primitivas que no migraron completamente durante el desarrollo embriológico. Ocurren más frecuentemente en las gónadas y son relativamente raros en otros sitios, como glándula pineal, neurohipófisis y retroperitoneo. El mediastino es el sitio extragonadal más frecuente de estos tumores y representa 15% de las masas de mediastino anterior. Los teratomas maduros ocupan 60 a 70% de los casos, seguidos por los seminomas; los no seminomatosos son relativamente raros. Ocurren principalmente en hombres durante la segunda a cuarta décadas de la vida. Se clasifican en tres grupos: • Teratomas benignos. • Seminomas. • Tumores embrionarios (teratomas malignos o no seminomas) que se subclasifican en coriocarcinomas, carcinomas del saco embrionario, carcinomas embrionarios y teratocarcinomas. 3/2/15 2:47 PM 202 Los quistes mediastinales representan 15 a 20% de las masas del mediastino medio. Los más frecuentes son los quistes entéricos (50 a 70%), seguidos de los broncogénicos (7 a 15%). Los tumores neurogénicos representan 12 a 21% de todas las masas mediastinales. Se derivan de tejido de la cresta neural. La mayoría proviene de los nervios intercostales o de la cadena simpática y son benignos en origen. Guía EXARMED La mediastinitis es un proceso infeccioso o inflamatorio en el mediastino, puede o no acompañarse de neumomediastino. Book 2.indb 202 El linfoma B de células grandes es un linfoma extraganglionar, agresivo, que se origina a partir de precursores B del timo. Tiene un patrón de crecimiento difuso, con bandas de fibrosis. Su patrón inmunohistoquímico se caracteriza por ser CD21 negativo. Predomina en el sexo femenino en la cuarta década de la vida. El tratamiento depende del estado, subtipo histológico y extensión de la enfermedad, principalmente con quimioterapia, en algunos casos radioterapia y trasplante de médula ósea. Masas del mediastino medio Quistes mediastinales Son lesiones redondas, bien delimitadas, de contenido líquido y forrado con epitelio. Representan 15 a 20% de las masas del mediastino medio. Los más comunes son los quistes entéricos (50 a 70%), seguidos por los broncogénicos (7 a 15%). Cuadro clínico Los principales síntomas son tos, disnea, fiebre, expectoración purulenta y dolor torácico. En la radiografía de tórax se observan como masas redondas, bien definidas. En la tomografía de tórax tienen densidad líquida (− 20 a + 20 UH), pero algunos se manifiestan como masas sólidas. Otros se comunican con el árbol traqueobronquial y se observa un nivel hidroaéreo en su interior. No realzan con contraste. Diagnóstico y tratamiento En la radiografía de tórax se observan masas redondas u ovales, bien definidas; la localización puede sugerir un diagnóstico. En la tomografía de tórax se puede observar algunas características en los quistes benignos: masa redonda u oval, bien definida, con una pared que refuerza con medio de contraste, con atenuación homogénea en rangos de agua (0 a 20 UH), sin refuerzo en el contenido del quiste y sin infiltración a estructuras mediastinales adyacentes. Los quistes entéricos provienen del intestino anterior, recubiertos por epitelio escamoso o entérico y pueden contener tejido gástrico o esofágico. La mayoría no produce síntomas, pero cuando los presentan, son principalmente respiratorios, y generalmente se diagnostican en pacientes menores de un año. En la radiografía de tórax pueden estar calcificados. El tratamiento definitivo es la resección completa. Los quistes broncogénicos son yemas pulmonares ectópicas con estrecha conexión con el árbol traqueobronquial, pero sin tejido mesenquimatoso pulmonar. Se originan durante la quinta y séptima semanas de gestación. Están revestidos por epitelio columnar ciliado de tipo bronquial y son más frecuentes en el lado derecho. Se ubican a lo largo de la tráquea cerca de la carina principal o hilio entre la vía aérea y el esófago. Pueden tener transformación maligna. Representan 14 a 22% de todas las malformaciones pulmonares y 10% de las masas mediastinales. Se clasifican en parenquimatosos, que son más frecuentes en lóbulos inferiores y mediastinales (86%), de los cuales los más comunes son los pericarinales (52%), seguidos de paratraqueales (19%). El tratamiento es quirúrgico. Los quistes pericárdicos son quistes mesoteliales que se producen por persistencia de los recesos parietales durante la embriogénesis. La mayoría son congénitos y asintomá- ticos, que se identifican hacia la cuarta década de la vida. Radiológicamente son masas en forma de gota que colindan con el corazón, la pared anterior de tórax y el diafragma. Son más comunes en el ángulo cardiofrénico derecho (70%) y en el ángulo cardiofrénico izquierdo (22%). El tratamiento definitivo es la resección quirúrgica completa. Linfangiomas Los linfangiomas son anormalidades congénitas raras de los vasos linfáticos. Se presentan principalmente como masas solitarias. Se encuentran en la región cervical 75% de las veces, pero se pueden extender hacia el mediastino en 10%, asociadas a quilotórax y hemangiomas. La mayoría se identifican en niños menores de dos años, aunque se pueden identificar en adultos, sobre todo si son mediastinales. En la radiografía de tórax se observan lesiones quísticas, lobuladas cerca del corazón. El tratamiento es quirúrgico, aunque en casos de quilotórax puede ser necesaria radioterapia. Masas del mediastino posterior Tumores neurogénicos Representan 12 a 21% de todas las masas mediastinales. Se derivan de tejido de la cresta neural. La mayoría proviene de los nervios intercostales o de la cadena simpática y son benignos en origen. Son asintomáticos, aunque pueden producir síntomas neurológicos por compresión. Tumores de la vaina nerviosa Comprenden cerca de 40 a 65% de las masas mediastinales neurogénicas. Son tumores benignos, de crecimiento lento y en su mayoría asintomáticos. Los representantes de este grupo son neurilemomas y schwannomas (75%) que son tumores encapsulados, duros, compuestos por células de Schwann, a diferencia de los neurofibromas, que son tumores no encapsulados, suaves y se asocian a la neurofibromatosis de von Recklinghausen. Radiológicamente se observan masas esféricas, lobuladas, adyacentes a la columna vertebral, pudiendo causar deformación y erosión de los cuerpos ventrales. El tratamiento de elección es la resección quirúrgica, siendo las principales complicaciones posoperatorias el síndrome de Horner, lesión en el nervio laríngeo recurrente, paraplejía y simpatectomía parcial. Tumores malignos de la vaina nerviosa Afectan por igual a hombres y mujeres, sobre todo en la tercera década de la vida y se asocian a neurofibromatosis. Los principales representantes de este grupo son los neurofibromas malignos, schwannomas malignos y fibrosarcomas neurogénicos. El tratamiento es quirúrgico, pero en casos de irresecabilidad, la quimioterapia y radioterapia son útiles. Los neuroblastomas se presentan principalmente en niños (menores de cinco años), son muy agresivos. Se presentan como lesiones no encapsuladas, con necrosis, hemorragia o degeneración quística. Los síntomas principales son dolor, déficit neurológico, síndrome de Horner, ataxia y disnea. Pueden producir sustancias vasoactivas que causan hipertensión, bochornos y diarrea. Radiológicamente se presentan como masas elongadas, paraespinales calcificadas en 80% de las veces y pueden producir daño óseo. El tratamiento depende del estadio 3/2/15 2:47 PM 203 en que se encuentre y consiste en quimioterapia posoperatoria y radiación. Los factores de mal pronóstico son los tumores de gran tamaño, origen extratorácico, tipo histológico pobremente diferenciado, estadio avanzado, y mayor edad de presentación. Además de los tumores mediastinales descritos previamente, es importante recordar las lesiones de origen infecciosos que se presentan en el mediastino, como los abscesos y las mediastinitis agudas y crónicas. ABscEsos MEDIAstInALEs Son poco frecuentes, tienen alto riesgo de mortalidad y se relacionan con procedimientos quirúrgicos, como la esternotomía media, perforación esofágica o diseminación de un foco infeccioso adyacente. Radiológicamente se observan como masas de baja atenuación con contenido líquido, puede contener un nivel hidroaéreo. El tratamiento es el drenaje y tratamiento antibiótico. a actinomicosis, sífilis y a infecciones por Wuchereria bancrofti. La causa más conocida de fibrosis mediastinal es el uso de metisergida para la cefalea vascular, la cual puede revertir al suspender la droga. Otras causas no infecciosas incluyen sarcoidosis y silicosis. La mediastinitis granulomatosa suele ser asintomática y encontrarse incidentalmente; la radiografía muestra una masa localizada, principalmente en el área paratraqueal derecha, en contraste con la fibrosis mediastinal que suele dar síntomas en la mayoría de los casos (tos, disnea, hemoptisis, dolor torácico) debido a invasión de estructuras vecinas por la masa calcificada; puede comprometer estructuras vasculares (obstrucción de vena cava superior), esófago o vías aéreas. En la radiografía se observa engrosamiento de la parte superior del mediastino con características variables. En algunos casos se requiere exploración quirúrgica y remoción del tejido inflamatorio o fibrótico para disminuir el daño a tejidos vecinos. nEUMoMEDIAstIno Se refiere a la presencia de un proceso infeccioso o inflamatorio en el mediastino, puede o no acompañarse de neumomediastino. Se puede originar en las estructuras que componen el mediastino disecando las estructuras adyacentes o por continuidad desde infecciones cervicales y orales. Se clasifican en agudas y crónicas. La mediastinitis aguda es una enfermedad grave, cuya causa pueden ser: infecciones intratorácicas (pulmón, pleura, pericardio) o extratorácicas (espacio retrofaríngeo, abscesos dentales, pancreatitis), infecciones mediastinales primarias (inhalación de ántrax), como consecuencia de cirugía cardiaca y perforación de esófago o vías aéreas por diversas causas. Se presenta súbitamente, con escalofríos, fiebre alta, mal estado general y dolor torácico. Al examen físico puede haber dolor en el esternón, crepitación y el característico pero inconstante signo de Hamman (sonido crujiente que se escucha en la pared anterior del tórax durante la sístole cardiaca). La mediastinitis crónica se clasifica en granulomatosa y fibrosis mediastinal y es el resultado de inflamaciones crónicas, siendo las más frecuentes tuberculosis e histoplasmosis, aunque se han reportado casos debidos Se define como aire en el mediastino no acompañado de enfermedad inflamatoria o infecciosa (también se conoce como enfisema mediastinal) y es primordialmente una complicación de la ventilación mecánica (barotrauma), aunque también puede ocurrir espontáneamente o secundario a trauma torácico o asma. El neumomediastino ocurre principalmente por rotura alveolar microscópica, así como por escape de aire de la vía aérea superior o gastrointestinal. Se presenta con dolor subesternal que empeora con los movimientos respiratorios y cambios de posición. También puede presentarse con disnea, disfagia, enfisema subcutáneo y disfonía con voz de “papa caliente”. El tratamiento depende de la causa primaria. El síndrome de Hamman, descrito en 1939, es una alteración benigna rara, que consiste en neumomediastino espontáneo sin causa conocida. Se sugiere que los mecanismos son la tos intensa o espiración con glotis cerrada (maniobra de Valsalva), vómitos y esfuerzo físico. Afecta principalmente a hombres jóvenes y embarazadas. Es una enfermedad autolimitada con resolución espontánea entre tres y 15 días. sección 2 | Neumología MEDIAstInItIs El neumomediastino se define como aire en el mediastino no acompañado de enfermedad inflamatoria o infecciosa (también se conoce como enfisema mediastinal) y es primordialmente una complicación de la ventilación mecánica (barotrauma). Book 2.indb 203 3/2/15 2:47 PM 204 17. Patología diafragmática INTRODUCCIÓN Es un conjunto de afecciones del diafragma que incluye trastornos estructurales y funcionales del mismo, de causa heterogénea, ya sea primaria o secundaria a diversas enfermedades extrapulmonares (Cuadro 2.17.1). PARÁLISIS DIAFRAGMÁTICA Introducción Ocurre cuando se interrumpe la transmisión de señales nerviosas que transcurren a través del nervio frénico. Su frecuencia global se desconoce, siendo mayor en el posoperatorio de ciertos eventos quirúrgicos (deri- Cuadro 2.17.1. Etiología de enfermedades diafragmáticas Primarias Secundarias • Trastornos funcionales • Restricción funcional - Parálisis diafragmática Obesidad • Unilateral Ascitis • Bilateral EPOC • Trastornos estructurales Neumonía - Hernia del hiato esofágico Infarto pulmonar - Hernia congénita Pleuritis • Hernia de Bochdalek Fracturas costales • Hernia de Morgagni Absceso subfrénico - Hernia postraumática Colecistitis aguda - Eventración Peritonitis - Neoplasia Neoplasia (hígado, peritoneo, pulmón, pleura) Cuadro 2.17.2. Causa de parálisis diafragmática unilateral Guía EXARMED Unilateral • Neoplasias - • Idiopática - • Manipulación o sección quirúrgica • Daño térmico - • Manipulación/estiramiento cervical - Quiropraxis - Lesiones transparto - Punción venosa cervical - Espondiloartropatía a nivel cervical • Compresión por ganglios mediastínicos • Neuritis braquial • Herpes zoster • Mononeuritis múltiple • Diabetes mellitus (neuropatía) • Esclerosis sistémica Book 2.indb 204 Pulmonares Infecciones virales Derivación aortocoronaria vación coronaria, corrección de conducto arterioso), o postraumatismo torácico/abdominal. Parálisis diafragmática unilateral Fisiopatogenia y etiología La más frecuente es la causa neoplásica por invasión o compresión del nervio en algún punto a lo largo de su trayecto; dicha causa ocupa 90% de los casos, siendo las neoplasias pulmonares las más frecuentes; le siguen en frecuencia los tumores mediastinales, linfomas. En 5 a 8% de los casos, la causa es desconocida o idiopática, siendo más frecuente en hombres y en el hemidiafragma derecho; en ésta se ha postulado que algunas infecciones virales podrían explicar la lesión frénica, provocando una neuritis aguda infecciosa, o produciéndose como consecuencia de la acción directa de una neurotoxina viral. Causas menos frecuentes son las producidas por lesión durante eventos quirúrgicos generalmente cardiológicos (cirugía coronaria en adultos, ligadura del conducto arterioso) en la que la manipulación o disección con electrocauterio de áreas adyacentes al nervio, o el uso de sustancias frías para inducir hipotermia cardiaca, pueden lesionar el nervio frénico en su trayecto torácico. Por otro lado, existen reportes de lesiones producidas durante manipulación cervical (p. ej., masaje por quiropráctico); de igual manera puede haber lesiones por sobredistensión o elongación por tracción cervical en algunos recién nacidos durante el parto. Los traumatismos torácicos o abdominales (cerrados) son una causa relativamente frecuente de parálisis unilateral, con lesión del nervio frénico mayormente a nivel cervical, pero también torácico, pudiendo no ser diagnosticados en un inicio y ser un hallazgo casual en valoraciones médicas subsecuentes (Cuadro 2.17.2). Cuadro clínico Los datos clínicos son poco específicos, y dependen de la causa subyacente de lesión frénica, además de la velocidad con que se instauró la parálisis, o de si hay enfermedad pulmonar subyacente. El síntoma más frecuente es disnea de esfuerzo o en decúbito supino. Hay que investigar antecedentes como cirugías recientes, traumatismo torácico o abdominal, manipulaciones cervicales (quiropraxis, punciones, etc.). A la inspección, los movimientos respiratorios y la excursión diafragmática pueden estar disminuidos, ausentes, o puede existir un hundimiento abdominal inspiratorio del lado afectado (por la presión negativa transmitida torácica); otros hallazgos son taquipnea y uso de músculos accesorios de la respiración. En la palpación es importante la detección de adenopatías cervicales; a la percusión puede haber matidez en el sitio afectado; a la auscultación, los ruidos respiratorios ipsolaterales generalmente están disminuidos. Diagnóstico Pruebas de gabinete. La radiología en proyección posteroanterior y lateral muestra elevación diafragmática del hemitórax afectado, con más de dos espacios intercostales de diferencia entre ambos hemidiafragmas; se pueden hacer proyecciones en inspiración y espiración, en las que si no hay diferencia en la posición del hemidiafragma afectado, puede hacerse un diagnóstico presuntivo de parálisis. En la fluoroscopia puede observarse elevación diafragmática con cúpula acentuada, ausencia del movimiento diafragmático, movimiento paradó- 3/2/15 2:47 PM 205 Diagnóstico diferencial Se debe hacer con derrame pleural, haciendo la diferenciación con una radiografía tangencial, en la cual, de ser líquido se observará que correrá a lo largo del hemitórax afectado, y de ser parálisis la imagen se observará igual; otro es la atelectasia del lóbulo inferior derecho, frecuente en el periodo posoperatorio; otro es la eventración diafragmática, la cual es imposible diferenciar radiológicamente de la parálisis diafragmática y varios autores utilizan los términos indistintamente. Tratamiento Depende de la afección funcional del paciente; ésta se da en mayor grado en niños, quienes no cuentan con compensación adecuada mediante los músculos accesorios Cuadro 2.17.3. Causasdeparálisisdiafragmáticabilateral Bilateral Cuadriplejía Lesióntérmicadelnerviofrénico Cirugíadiscalcervical Lesióntransparto Traumatismocerrado Esclerosismúltiple Idiopática Siringomielia SíndromedeGuillain-Barré Esclerosislateralamiotrófica Miasteniagrave Polimiositis Book 2.indb 205 de la respiración. En adultos, puede cursar asintomática, pero cuando hay restricción y repercusión ventilatoria, puede recurrirse a la ventilación mecánica no invasiva, al uso de O2 suplementario. En pacientes jóvenes y niños mayores de dos años la plicatura diafragmática puede mejorar la mecánica respiratoria, con estabilización del tórax y mediastino, incluso con incremento en los volúmenes y flujos pulmonares. No se recomienda esta técnica en recién nacidos por incremento en la mortalidad. Pronóstico En adultos el pronóstico es favorable en la mayoría de los casos, incluso con recuperación casi total de la función después de 12 meses, sobre todo en los casos en que no hubo daño estructural del nervio. PARÁLISIS DIAFRAGMÁTICA BILATERAL Introducción Ocurre menos frecuentemente que la unilateral, y también se produce por daño del nervio frénico pero en puntos de afección bilateral, de tal manera que ambos tipos de parálisis comparten las mismas causas, que en esta última son predominantemente sistémicas. La causa más frecuente de la parálisis diafragmática unilateral es neoplásica por invasión o compresión del nervio en algún punto a lo largo de su trayecto. La prueba diagnóstica definitiva de la disfunción frénica es la técnica de estimulación transcutánea del nervio frénico cervical. Fisiopatogenia y etiología También puede producirse por lesión durante cirugía cardiaca (por lesión térmica), en el transparto por lesión cervical, pero las causas más frecuentes son las enfermedades sistémicas como miopatías (polimiositis), trastornos neurológicos como síndrome de Guillain-Barré, esclerosis sistémica, y postraumatismos cerrados (aunque es mucho más frecuente la afección unilateral izquierda) (Cuadro 2.17.-3). Cuadro clínico La historia clínica guía el protocolo de estudio de una elevación diafragmática bilateral; hay que buscar intencionadamente enfermedades sistémicas previas o síntomas/signos sugestivos de las mismas (enfermedades autoinmunes, neurológicas), enfermedad hepática avanzada (ascitis, derrame pleural), técnica radiológica deficiente (ante esto se podría repetir la placa o tomar una proyección lateral), antecedentes heredofamiliares, infecciones virales, entre otros datos. Clínicamente se evidencian los mismos hallazgos que en la forma unilateral, sin embargo, es más frecuente el movimiento paradójico abdominal (bilateral) hacia adentro en la espiración (por presión negativa que ejerce el hemidiafragma al elevarse en ambas fases de la respiración). Es muy importante complementar con la exploración neurológica. Diagnóstico Se valoran los mismos estudios que en la afección unilateral. Es más frecuente que en la fluoroscopia se den falsos negativos por contracción compensatoria de los músculos espiratorios abdominales. La técnica de estimulación del nervio frénico cervical (previamente descrita) puede mostrar ausencia o, más frecuentemente, latencias prolongadas en forma bilateral, lo cual implica desmielinización importante del mismo. Los trastornos funcionales son los mismos que en la unilateral, pero se presentan con mayor frecuencia la dificultad/insuficiencia respiratoria, e hipercapnia. Diagnóstico diferencial El derrame pleural bilateral, la ascitis, la obesidad y las alteraciones en la técnica radiológica (placa tomada durante espiración) son varias causas de elevación de ambos hemidiafragmas. Sección 2 | Neumología jico durante la prueba de olfateo (es positivo si hay elevación mayor de 2 cm del hemidiafragma durante la inspiración y es un signo altamente confiable), así como bamboleo mediastinal durante los movimientos respiratorios. Otro estudio de utilidad y de fácil acceso es el ultrasonido, en el que se observa ausencia de movimiento del hemidiafragma afectado y su utilidad puede ser equivalente a la fluoroscopia. En las pruebas de función respiratoria (espirometría) puede haber datos sugestivos de restricción pulmonar (volumen espirado forzado en el primer segundo y capacidad vital forzada disminuida con relación capacidad vital forzada/ volumen espirado forzado en el primer segundo normal) o capacidad pulmonar total disminuida así como capacidad vital disminuida en la pletismografía. La gasometría arterial es poco útil en estos casos, pudiendo demostrar hipoxemia leve; en general es suficiente la medición de oximetría de pulso en decúbito y en posición supina, así como la prueba de caminata, en la que puede haber disminución de la saturación de oxígeno posesfuerzo. La prueba diagnóstica definitiva de la disfunción frénica es la técnica de estimulación transcutánea del nervio frénico cervical, mediante electrodos con los que se aplica un voltaje de estimulación al hemidiafragma lesionado, que se va incrementando progresivamente y se miden sus potenciales de acción con electrodos en la región torácica posterolateral del lado afectado; el diagnóstico se confirma cuando se muestra un potencial de acción ausente o con una latencia prolongada; su ventaja es que puede ser utilizado en pacientes bajo ventilación mecánica, por ejemplo, en el posoperatorio en el que se dificulta hacer diagnóstico diferencial sólo mediante los hallazgos radiológicos. 3/2/15 2:47 PM 206 La eventración diafragmática es la elevación de una parte o la totalidad del hemidiafragma, sin alteración en la solución de continuidad ni de los medios de fijación diafragmáticos a la pared torácica. La eventración diafragmática la mayoría de las veces es asintomática, y por pruebas de función respiratoria puede encontrarse restricción leve. Tratamiento Depende de la afección funcional respiratoria (restricción pulmonar), y en términos generales, los lineamientos de tratamiento son los mismos que para la parálisis unilateral. radiología torácicos por alguna otra razón. La mayoría de las veces es asintomática, y por pruebas de función respiratoria puede encontrarse restricción leve. Es muy raro que sea bilateral (a menos que se trate de una condición adquirida). Pronóstico Debido a la naturaleza frecuentemente irreversible y progresiva de varias de sus causas, así como a que en este caso no hay compensación del hemidiafragma contralateral, el pronóstico es menos favorable para la función que en la afección unilateral. Tratamiento No requiere tratamiento; en las condiciones adquiridas el tratamiento depende de la causa. EVENTRACIÓN DIAFRAGMÁTICA Introducción Es el paso de órganos o tejido del abdomen a través de una disrupción de la continuidad diafragmática, producidos por traumatismos torácicos o abdominales, ya sea contusos o penetrantes. En los traumatismos contusos, una complicación relativamente frecuente es la hernia diafragmática, que sucede en 0.5 hasta 6% de los casos, y ocurren en su mayoría del lado izquierdo, quizá por un cierto grado de protección hepática al hemidiafragma derecho. Las hernias postraumáticas por mecanismo penetrante son más frecuentes en el hemidiafragma izquierdo (pudiendo explicarse por qué los agresores en su mayoría son diestros), ocurriendo en 10 a 15% de los casos. Las heridas de bala pueden lesionar a cualquier nivel del diafragma, aunque producen orificios pequeños con sacos herniarios igualmente pequeños, pero con un número mayor de órganos lesionados. Introducción Es la elevación de una parte o la totalidad del hemidiafragma, sin alteración en la solución de continuidad ni de los medios de fijación diafragmáticos a la pared torácica. Radiológicamente es indistinguible de la parálisis diafragmática unilateral, por lo que es frecuente que se usen estos términos en forma indistinta en la práctica médica. No se conoce la incidencia exacta de este padecimiento, pero la información disponible al respecto, coincide en que es una situación clínica rara, que ocurre predominantemente en hombres y que es más frecuente (ocho a 10 veces más) en el lado izquierdo. En la década de 1950 Chin y Lynn publicaron una gran serie (5 000 pacientes) de hallazgos radiológicos, y sólo encontraron 32 pacientes con esta afección. Fisiopatogenia y etiología En un sentido purista, la eventración verdadera es de causa congénita, aún no bien definida pero que involucra un desarrollo anormal del músculo estriado sobre la membrana pleuroperitoneal (en etapa embrionaria), sufriendo una muscularización incompleta. Sin embargo, varios autores aceptan el origen adquirido, en el que puede haber lesión o no del nervio frénico, y que finalmente tiene los mismos mecanismos fisiopatogénicos, causas, apariencia radiológica y las mismas repercusiones ventilatorias que la parálisis diafragmática de cualquier causa de las ya comentadas (Cuadro 2.17.4). Macroscópicamente, la eventración verdadera se caracteriza por una zona del hemidiafragma adelgazada, membranosa, con una porción periférica muscular; en este sentido, el cirujano podría diferenciar la eventración de origen congénito, ya que en la parálisis diafragmática el músculo conserva su apariencia muscular completa (sin adelgazamientos); sin embargo, en casos muy crónicos de parálisis frénica, el diafragma puede sufrir cierta atrofia, lo cual puede hacer su apariencia similar a un hemidiafragma con eventración verdadera. Diagnóstico La eventración puede ser completa o parcial; la mayoría de las veces el hallazgo es casual cuando se solicitan estudios de Guía EXARMED Cuadro 2.17.4. Clasificación de eventración diafragmática EVENTRACIÓN VERDADERA ADQUIRIDA Con lesión frénica Sin lesión frénica COMPLETA PARCIAL Congénita Congénita Book 2.indb 206 HERNIA DIAFRAGMÁTICA TRAUMÁTICA Diagnóstico Es importante investigar el antecedente de traumatismo, sobre todo contuso, en el cual puede haber un retraso en el diagnóstico por un curso subclínico; si en un trauma penetrante, la herida se encuentra a nivel o por debajo del 4º a 5º espacio intercostal, y por arriba de la doceava costilla, la sospecha de lesión diafragmática debe ser alta; en ocasiones, el saco herniario (que puede contener el bazo, lóbulo hepático izquierdo, ángulo esplénico del colon, riñón izquierdo) puede sufrir un vólvulo e incluso incarcerarse, dando un cuadro confuso de dolor torácico intenso y abdomen agudo; otros datos clínicos son disnea, falla respiratoria, hemodinámica, ruidos abdominales en tórax, ruidos respiratorios disminuidos uni o bilaterales, e incluso, salida de material biliar, gástrico o intestinal por sonda endopleural; se puede emplear la radiografía de tórax o tomografía de tórax (alcanzando apenas una sensibilidad diagnóstica de 50%); en la radiografía de tórax puede observarse una opacidad torácica, predominantemente izquierda, redondeada, en ocasiones con presencia de niveles hidroaéreos, o haustras y gas, dependiendo de la estructura herniada. El ultrasonido no es útil por la presencia de gas. Otros procedimientos diagnósticos son lavado peritoneal, y el mayor rendimiento diagnóstico lo ofrece la laparotomía/toracotomía exploradora. Tratamiento En general es quirúrgico, con reparación de la rotura diafragmática, ya sea vía abdominal, o en casos más complejos, vía transtorácica. Pronóstico Depende de la gravedad de la lesión diafragmática y la comorbilidad asociada (hasta 40% lesión de cabeza y cuello, y la mayor parte de lesiones asociadas son abdominales, hasta 80%). En general la mortalidad en trauma cerrado puede ser hasta 45%, y en penetrante (no por bala) hasta 30%. 3/2/15 2:47 PM 207 HERNIA HIATAL Es el paso del estómago y/o tejido abdominal a través del hiato esofágico. Es un padecimiento muy frecuente, cuya causa tiene una asociación no muy clara con factores congénitos de laxitud del hiato esofágico y del ligamento frenoesofágico, pero sí una evidente asociación a factores adquiridos que favorecen un incremento de la presión intraabdominal (obesidad, embarazo, tos crónica en asma, enfermedad pulmonar obstructiva crónica, bronquiectasias). Hay varios tipos de hernia hiatal, en términos generales se clasifica en hernias de deslizamiento y paraesofágicas; cuando el estómago se hernia, hay riesgo de incarceración, vólvulo. El diagnóstico se sospecha por datos de dispepsia importante (regurgitación, pirosis, disfagia, disfonía, broncoaspiración) que no ceden con manejo médico antiácido. La radiografía de tórax puede mostrar una radiolucidez redondeada media y posterior, que puede tener un nivel hidroaéreo; se recomienda toma de radiografía lateral en estos casos. Su tratamiento es quirúrgico. Su pronóstico es favorable, aunque en el posquirúrgico se incrementa el riesgo de complicaciones, y puede recurrir. HERNIAS CONGÉNITAS Las principales son la hernia de Bochdalek y la de Morgagni. Ambas se producen por fallas en el cierre embrionario de la membrana pleuroperitoneal, a nivel paraesternal anterior (en la hernia de Morgagni), y posterolateral (en la de Bochdalek). En la Figura 2.17.1 se esquematizan las localizaciones anatómicas de las mismas. En general, la hernia de Bochdalek produce hernias más grandes, que pueden comprometer la vida del recién nacido, sobre todo si se acompañan de hipoplasia pulmonar y otras anomalías congénitas; en estos casos la mortalidad es muy alta; es más frecuente (80%) en el lado izquierdo. Puede verse en la edad adulta, aunque en general son defectos pequeños, pero las estructuras herniadas pueden incarcerarse y dar un cuadro de abdomen agudo; la reparación generalmente es transabdominal. La hernia de Morgagni también puede verse en el adulto, pero en general como un hallazgo casual en un examen radiológico torácico por otra causa; se observa como una masa a nivel paracardiaco, en el espacio pericardiofrénico derecho; en ocasiones puede confundirse con un quiste pericárdico. Generalmente es asintomática. Su tratamiento es quirúrgico, con pronóstico favorable en casos asintomáticos, siendo peor el pronóstico en los casos de incarceración, vólvulo e incluso perforación. DERRAME SUBPULMONAR Éste es una causa de elevación diafragmática, con mayor frecuencia unilateral, que puede confundirse con una parálisis diafragmática, entre otros diagnósticos diferenciales. Se puede reconocer por la lateralización de la cúpula diafragmática, y en el caso de ser izquierdo, por un incremento (mayor de 2 cm) del espacio entre el hemidiafragma y la cámara gástrica. Además, puede haber borramiento del ángulo costofrénico, así como poca o nula visualización de vasos pulmonares en sus zonas declive. Se puede realizar una radiografía tangencial para el diagnóstico diferencial, en cuyo caso, el líquido correrá a lo largo del hemitórax afectado. Las hernias congénitas se producen por fallas en el cierre embrionario de la membrana pleuroperitoneal, a nivel paraesternal anterior (en la hernia de Morgagni), y posterolateral (en la de Bochdalek). NEOPLASIAS DIAFRAGMÁTICAS Su frecuencia es muy baja, siendo más frecuente que sean tumores metastásicos al diafragma, generalmente de estructuras adyacentes (pleural, pulmón, etc.). Los tumores primarios son de origen mesenquimatoso, al igual que el hemidiafragma. Son raros, y los más frecuentes son benignos, como quistes broncogénicos, mesenquimatosos (casi 20% de los casos), lipomas (aproximadamente 10%) y con menos frecuencia neurilemomas, neurofibromas (menos de 5%). De los tumores malignos primarios del diafragma se pueden mencionar a los leiomiosarcomas, fibromiosarcomas y sarcomas, igualmente frecuentes del lado izquierdo o derecho. El tratamiento es quirúrgico en las formas benignas, y en forma individualizada con cirugía, quimio o radioterapia en los casos malignos (malignidad variable). Los tumores metastásicos más frecuentes al hemidiafragma son el pulmonar, en general en estadios muy avanzados (T4), pleural (mesotelioma), metástasis hepáticas, carcinomatosis peritoneal, entre otros. HerniadeMorgagni Hernia traumática HerniadeBochdalek HerniadeMorgagni Herniahiatal Herniatraumática Vistafrontal Figura 2.17.1. Tiposdeherniasdiafragmáticasenesquemafrontaleinferior. Book 2.indb 207 HerniadeBochdalek Vistainferior Sección 2 | Neumología Herniahiatal 3/2/15 2:47 PM 208 LECTURA RECOMENDADA Sección 2: Neumología 1. Generalidades del aparato respiratorio Bourbon JR, Rieutort M. Pulmonary surfactant; biochemistry, physiology, and pathology. News Physiol Sci. 1987;2:129. Carbonara S, Monno L, Longo B, Angarano G. Community-acquired pneumonia. Curr Opin Pulm Med. 2009 May;15(3):261-73. Fisher JT, Sant’Ambrogio G. Airway and lung receptors and their reflex effects in the newborn. Pediatr Pulmonol. 1985;1:112-26. Foster RE. Introduction to respiratory physiology. Annu Rev Physiol. 1987;49:555. Green M, Moxham J. The respiratory muscles. Clin Sci. 1985;68:1. Laszio G. Pulmonary function: a guide for clinicians. New York, Cambridge Univ Press, 1994. Martinez R, Reyes S, Lorenzo MJ, Menendez R. Impact of guidelines on outcome: the evidence. Semin Respir Crit Care Med. 2009 Apr;30(2):172-8. Review. Rahn H. The relationship between thorax and lung: A review. SAM-TR-70-5. Tech Rep SAM-TR. 1970;1:1-14. Richardson PD, Granger DN, Taylor AE. Capillary filtration coefficient: the technique and its application to the small intestine. Cardiovasc Res. 1979 Oct;13(10):547-61. Weibel ER. Gas exchange: large surface and thin barrier determine pulmonary diffusing capacity. Minerva Anestesiol. 1999;65:377-82. Weibel ER. Morphological basis of alveolar-capillary gas exchange. Physiol Rev. 1973;53:419-95. Welte T. Community-acquired pneumonia. Internist (Berl). 2009 Mar;50(3):331-9. Wunderink RG. Adjunctive therapy in community-acquired pneumonia. Semin Respir Crit Care Med. 2009 Apr;30(2):146-53. Review. Guía EXARMED 2. Neumonía adquirida en la comunidad Book 2.indb 208 Báez-Saldaña R. Neumonía adquirida en la comunidad y calidad de la atención médica. Neumol Cir Torax. 2013;72 (Supl 1). Chalmers JD, Singanayagam A, Hill AT. C-reactive protein is an independent predictor of severity in community-acquired pneumonia. Am J Med. 2008;121:219-225. Consenso Nacional de uso de antimicrobianos en la neumonía adquirida en la comunidad. Neumología y Cirugía de Tórax. 2004;63:67-78. Dirección General de Epidemiología, Secretaría de Salud, México. Panorama Epidemiológico y Estadístico de la mortalidad en México 2010. (http://www.epidemiologia.salud.gob.mx/ doctos/infoepid/publicaciones/2012/A_Morta_%202010_FINAL_Junio%202012.pdf) Gupta D, Agarwal R, Aggarwal AN, Singh N, Mishra N, et al; Pneumonia Guidelines Working Group. Guidelines for diagnosis and management of community- and hospital-acquired pneumonia in adults: Joint ICS/NCCP(I) recommendations. Lung India. 2012 Jul-Sep; 29 (Suppl 2): S27-S62. Mandell LA, Wunderink RG, et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults. IDSA/ATS Guidelines for CAP in Adults. CID. 2007:44 (Suppl 2). McGee S. Evidence-based physical diagnosis. 2nd ed. Saunders, Elsevier; 2007. Norma Oficial Mexicana NOM-036-SSA2-2002. Prevención y control de enfermedades. Aplicación de vacunas, toxoides, sueros, antitoxinas e inmunoglobulinas en el humano. Sistema Nacional de Información en Salud. http://sinais.salud.gob. mx/mortalidad/ Wilson ME, et al. Oseltamivir for influenza, even after 48 hours of symptoms? Lancet Infect Dis. 2013 Nov 22. 3. Neumonía nosocomial American Thoracic Society and Infectious Diseases Societ of America. Guidelines for the management of adults with hospitalacquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med. 2005;171:388-416. Attridge RT, Frei CR. Health care-associated pneumonia: an evidence-based review. The American Journal of Medicine. 2011;124:689-97. Barbier F, Andremont A, Wolff M, Bouadma L. Hospital-acquired pneumonia and ventilator associated pneumonia: recent advances in epidemiology and management. Curr Opin Pulm Med. 2013;19:216-28. Craven DE, Palladino R, McQuillen DP. Healthcare-associated pneumonia in adults: management principles to improve outcomes. Infect Dis Clin North Am. 2004;18(4):939. Joseph NM, Sistla S, Dutta TK, Badhe AS, Parija SC. Ventilatorassociated pneumonia: a review. European Journal of Internal Medicine. 2010;21:360-8. Maruyama T, Fujisawa T, Okuno M, Toyoshima H, Tsutsui K, Maeda H, et al. A new strategy for healthcare-associated pneumonia: a 2-year prospective multicenter cohort study using risk factors for multidrug-resistant pathogens to select initial empiric therapy. Clin Infect Dis. 2013;57(10):1373-83. 4. Asma Busse WW, Morgan WJ, Taggart V, Togias A. Asthma outcomes workshop: overview. J Allergy Clin Immunol [Internet]. 2012;129(3):S1-8. COMPEDIA. Guías de diagnóstico y tratamiento de enfermedades alérgicas. Asma infantil. http://compedia.org.mx/archivos/normas/asma_infantil.pdf Cuevas-Castillejos H. Asma. https://www.facebook.com/paginapediatips Cuevas-Castillejos H. Asma. http://www.slideshare.net/ drcuevashector/asma-13265629 Global Strategy for Asthma Management and Prevention. GINA Report. 2011. http://www.ginasthma.org/uploads/users/ files/GINA_Report2011_May4.pdf Gutiérrez-Delgado RI, Barraza-Villarreal A, Escamilla-Núñez MC, Solano-González M, Moreno-Macías H, Romieu I. Food consumption and asthma in school children in Cuernavaca, Morelos, Mexico. Salud Publica Mex. 2009;51(3):202-11. Holgate ST. The acetaminophen enigma in asthma. Am J Respir Crit Care Med [Internet]. 2011;183(2):147-8. Holgate ST. Trials and tribulations in targeting allergic pathways with biologics in asthma. http://www.southampton.ac.uk/ medicine/allergy Krishnan JA, Lemanske RF, Canino GJ, Elward KS, Kattan M, et al. Asthma outcomes: symptoms. J Allergy Clin Immunol [Internet]. 2012;129(3):S124-35. Lai CK, Beasley R, Crane J, Foliaki S, Shah J, et al. Global variation in the prevalence and severity of asthma symptoms: phase three of the International Study of Asthma and Allergies in Childhood (ISAAC). Thorax [Internet]. 2009;64(6):476-83. Pauwels R. Bronchial adrenergic receptors and asthma. Tachyphylaxis and its prevention. Allerg Immunol (Paris) [Internet]. 1988;20(7):261-5. 3/2/15 2:47 PM 209 5. Enfermedad pulmonar obstructiva crónica Niewoehner DE. Clinical practice. Outpatient managment of severe COPD, N Eng J Med. 2010 Apr 15;362:1407-16. Qaseem A, Wilt TJ, Weinberger SE, Hanania NA, et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society. Ann Intern Med. 2011 Aug 2;155(3):179-91. Secretaria de Salud. Diagnóstico y tratamiento de la enfermedad pulmonar obstructiva. México: 2009. Sutherland ER, Cherniack RM. Management of chronic obstructive pulmonary disease. N Engl J Med. 2004 Jun 24;350(26):2689-97. Vestbo J, Hurd SS, Agustí AG, Jones PW, Vogelmeier C, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. American Journal of Respiratory and Critical Care Medicine. Am J Respir Crit Care Med. 2013 Feb 15;187(4):347-65. Wenzel RP, Fowler AA, Edmond MB. Antibiotic prevention of acute exacerbations of COPD, N Eng J Med. 2012 July 26; 367(4):340-7. 6. Neumopatías intersticiales difusas Afshar K, Sharma OP. Interstitial lung disease: trials and tribulations. Curr Opin Pulm Med. 2008 Sep;14(5):427-33. Review. American Thoracic Society, European Respiratory Society. American Thoracic Society/European Respiratory Society International Multidisciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias: this joint statement of the American Thoracic Society (ATS), and the European Respiratory Society (ERS) was adopted by the ATS board of directors, June 2001 and by the ERS Executive Committee, June 2001. Am J Respir Crit Care Med. 2002;165:277-304. Craig ED, Jay HR. Treatment of idiopathic pulmonary fibrosis. Semin Respir Crit Care Med. 2006;27:668-76. Book 2.indb 209 Corvol H, Flamein F, Epaud R, Clement A, Guillot L. Lung alveolar epithelium and interstitial lung disease. Int J Biochem Cell Biol. 2009 Aug-Sep;41(8-9):1643-51. Review. Morgenthau AS, Padilla ML. Spectrum of fibrosing diffuse parenchymal lung disease. Mt Sinai J Med. 2009 Feb;76(1):2- 23. Review. Selman M, Navarro C, Gaxiola M. Fibrosis pulmonar idiopática: en busca de un tratamiento eficaz. Arch Bronconeumol. 2005;41(S5):15-20. Selman M. Hypersensitivity pneumonitis: a multifaceted deceiving disorder. Clin Chest Med. 2004;25:531-47. Vega-Miranda A, Ruiz-López VM. Avances recientes en el conocimiento fisiopatológico de la fibrosis pulmonar idiopática. Rev Inst Nal Enf Resp Méx. 2009;22(3):190-7. Zamora A, Marmai C, Wolters P, Gaxiola M, Navarro C. Enfermedad pulmonar intersticial en esclerosis sistémica progresiva. Neumo y Cir Tórax. 2006;65(S3):4-14. 7. Neumoconiosis Akira M. Imaging of occupational and environmental lung diseases. Clin Chest Med. 2008 Mar;29(1):117-31, vi. Review. Bargagli E, Olivieri C, Bennett D, Prasse A, Muller-Quernheim J, Rottoli P. Oxidative stress in the pathogenesis of diffuse lung diseases: a review. Respir Med. 2009 May 21. Bates DV, et al. Prevention of occupational lung disease. Task Force on Research and Education for the Prevention and Control of Respiratory Disease. Chest. 1992;102:257-76. Camp P, Dimich-Ward H, Kennedy S. Woman and occupational lung disease: sex differences and gender influences on research and disease outcomes. Clin Chest Med. 2004;25:269-79. Fontenot AP, Amicosante M. Metal-induced diffuse lung disease. Semin Respir Crit Care Med. 2008 Dec;29(6):662-9. Review. García-López MP, Barrera-Rodríguez R. Mesotelioma maligno: descripción clínica y radiológica de 45 casos con y sin exposición a asbestos. Salud Púb Méx. 2000;42:511-9. Greillier L, Astoul P. Mesothelioma and asbestos-related pleural diseases. Respiration. 2008;76(1):1-15. Review. Hsiu-Nien S, et al. Outcomes of coal’s worker pneumoconiosis with acute respiratory failure. Chest. 2004;125:1052-8. López-Rojas P, Nava-Larraguivel R, Salinas-Tovar S, SantosCelis R, Marín-Cotoñieto IA, Méndez-Vargas MM. Neumoconiosis en trabajadores expuestos a polvos inorgánicos. Rev Méd IMSS. 2008;46(2):163-70. Mason. Murray & Nadel’s Textbook of Respiratory Medicine. 4th ed. Philadelphia: WB Saunders; 2005. Ross M, Murray J. Occupational respiratory disease in mining. Occupational Medicine. 2004;54:304-10. 8. Hipertensión arterial pulmonar Blaukovitsch M, Zabel P, Hauber HP. Vasoproliferation and antiproliferative treatment options in pulmonary arterial hypertension. Recent Pat Cardiovasc Drug Discov. 2009 Jun;4(2):142-9. Burger CD. Pulmonary hypertension in COPD: a review and consideration of the role of arterial vasodilators. COPD. 2009 Apr;6(2):137-44. Farber HW, Loscalzo J. Pulmonary arterial hypertension. N Engl J Med. 2004;351:1655-65. Galie N, Torbicki A, Barst R, et al. Guidelines on diagnosis and treatment of pulmonary arterial hypertension. The Task Force on Diagnosis and Treatment of Pulmonary Arterial Hypertension of the European Society of Cardiology. Eur Heart J. 2004;25:2243-78. Humbert M. Update in pulmonary hypertension 2008. Am J Respir Crit Care Med. 2009 Apr 15;179(8):650-6. Review. McLaughlin VV, et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the Ameri- Sección 2 | Neumología Pearce N. Genetics, environment and asthma. ISAAC Symposium. Mérida 2009 http://isaac.auckland.ac.nz/resources/ Merida-2009-Pearce.pdf Pocket guide for asthma management and prevention in children 5 years and younger. GINA. 2009 http://www.ginasthma.org/guidelines-pocket-guide-for-asthma-managementand-prevention-in.html Rand CS, Wright RJ, Cabana MD, Foggs MB, Halterman JS, et al. Mediators of asthma outcomes. J Allergy Clin Immunol [Internet]. 2012;129(3):S136-41. Rodriguez-Santos O. El asma bronquial en el niño y adolescente en la atención primaria de salud. http://www.cursosparamedicos.com/newsite/temarios/alergologia_03.asp Rodríguez Santos O. Inmunoterapia sublingual en rinitis alérgica y asma en niños de dos a cinco años sensibilizados con ácaros. Revista Alergia México. 2008;55(2):71-75. Sánchez J, Ramírez R, Diez S, Sus S, Echenique A, et al. Omalizumab beyond asthma. Allergol Immunopathol (Madr). 2012. doi:10.1016/j.aller.2011.09.011 Tepper RS, Wise RS, Covar R, Irvin CG, Kercsmar CM, et al. Asthma outcomes: pulmonary physiology. J Allergy Clin Immunol [Internet]. 2012;129(3):S65-87. Wenzel SE, Barnes PJ, Bleecker ER, Bousquet J, Busse W, et al. A randomized, double-blind, placebo-controlled study of tumor necrosis factor-alpha blockade in severe persistent asthma. Am J Respir Crit Care Med [Internet]. 2009;179(7):549-58. 3/2/15 2:47 PM 210 can College of Cardiology Foundation. J Am Coll Cardiol. 2009 Apr 28;53(17):1573-619. Morales-Blanhir JE. Clasificación clínica de la hipertensión pulmonar. Rev Inst Nal Enf Resp Méx. 2004;17(1):S10-S16. Palmer MJ. Leads for the treatment of pulmonary hypertension. Expert Opin Ther Pat. 2009 May;19(5):575-92. Porres-Aguilar M, Porres-Muñoz M. Progresos en el tratamiento farmacológico de la hipertensión arterial pulmonar. Med Int Méx. 2004;20:208-20. Pulido ZT. ¿Qué es lo nuevo en el tratamiento de la hipertensión arterial pulmonar? Arch Cardiol Méx. 2003;73:S121-4. Rivera-Rosales RM. Histopatología y fisiopatogenia de la hipertensión pulmonar. Rev Inst Nal Enf Resp Méx. 2004;17(S1):17-27. Rubin LJ, Badesch DB. Evaluation and treatment of pulmonary arterial hypertension. Ann Intern Med. 2005;143: 282-92. Rubin LJ. Pulmonary arterial hypertension. Proc Am Thorac Soc. 2006;3:111-5. Sandoval-Zárate J. Hipertensión arterial pulmonar. Arch Cardiol Méx. 2006;76:S69-S75. Sánchez-Mecatil MA, Morales-Blanhir JE. Nuevas estrategias en el tratamiento médico de la hipertensión pulmonar. Rev Inst Nal Enf Resp Méx. 2004;17(1):S52-S61. Guía EXARMED 9. Tromboembolia pulmonar aguda Book 2.indb 210 Alguire PC, Epstein PE. Pulmonary vascular disease. MKSAP-14. Pulmonary and critical care medicine. American College of Physicians. 2006:41-5. Carrier M, et al. VIDAS D-dimer in combination with clinical pretest probability to rule out pulmonary embolism. A systematic review of management outcome studies. Thromb Haemost. 2009 May;101(5):886-92. Review. Fedullo PF, Tapson VF. The evaluation of suspected pulmonary embolism. N Engl J Med. 2003;349:1247-56. Guías y recomendaciones del Capítulo de Circulación Pulmonar de la Sociedad Mexicana de Cardiología. Diagnóstico, estratificación y tratamiento de la tromboembolia pulmonar aguda. Arch Cardiol Mex. 2004;(supl 3):S547-85. Jerjes-Sánchez C, Ramírez-Rivera A. Tromboembolia pulmonar. Recomendaciones terapéuticas de las guías clínicas de la Sociedad Mexicana de Cardiología. Arch Cardiol Méx. 2007;77(S4):202-6. Lozano SFS, Areitio-Aurtena BA. Quality of life and venous thromboembolic disease. Med Clin (Barc). 2008 Nov;131(suppl 2):37-41. Review. Poul H, Kessler P. Thrombophilic states: their relevance in prevention and treatment of venous thromboembolism. Vnitr Lek. 2009 Mar;55(3):242-52. Review. Porres-Aguilar M, Porres-Munoz M. Tromboembolia pulmonar. Med Int Méx. 2003;19(2):89-105. Pulido TR, Gotes J, Porres M. Anticoagulación en tromboembolia pulmonar. En: Sandoval-Zárate J, González-Chávez A, Conde-Mercado JM (ed). Cuidados intensivos en el paciente con tromboembolia pulmonar aguda. México: Editorial Prado; 2006:115-32. Rey MA, Bron C, Haesler E, Mazzolai L. Treatment and prevention of venous thromboembolic disease: what’s new? Rev Med Suisse. 2009 Feb 4;5(189):316-20. Sandoval J, Gómez A, Palomar A, Cueto G, Martínez-Guerra ML, Santos E. Hipertensión arterial pulmonar crónica secundaria a tromboembolia pulmonar no resuelta. Caracterización clínica, hemodinámica y sobrevida. Neumo y Cir Tórax. 2003;63(3):83-91. Santo-Martínez LE, Uriona-Villarroel JE, Exaire-Rodríguez JE, Mendoza D, Martínez-Guerra ML, Pulido T. Tromboembolia pulmonar masiva, trombo en tránsito y disfunción ventricular derecha. Arch Cardiol Méx. 2007;77:44-53. Task Force on Pulmonary Embolism, European Society of Cardiology. Guidelines on diagnosis and management of acute pulmonary embolism. Eur Heart J. 2000;21:1301-36. 10. Edema agudo de pulmón Ammann P, Fehr T, Minder EI, Gunter C, Bertel O. Elevation of troponin I in sepsis and septic shock. Intensive Care Med. 2001;27:965-9. Annane D, Sebille V, Charpentier C, et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA. 2002;288:862-71. Arlati S, Brenna S, Prencipe L, et al. Myocardial necrosis in ICU patients with acute non-cardiac disease: a prospective study. Intensive Care Med. 2000;26:31-7. Bernard GR, Vincent JL, Laterre PF, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med. 2001;344:699-709. Graham SP, Vetrovec GW. Comparison of angiographic findings and demographic variables in patients with coronary artery disease presenting with acute pulmonary edema versus those presenting with chest pain. Am J Cardiol. 1991;68:1614-8. Jessup M, Brozena S. Heart failure. N Engl J Med. 2003; 348:2007-18. Kazanegra R, Cheng V, García A, et al. A rapid test for B-type natriuretic peptide correlates with falling wedge pressures in patients treated for decompensated heart failure: a pilot study. J Card Fail. 2001;7:21-9. Krishnaswamy P, Lubien E, Clopton P, et al. Utility of B-natriuretic peptide levels in identifying patients with left ventricular systolic or diastolic dysfunction. Am J Med. 2001;111:274-9. Lucas R, Verin AD, Black SM, Catravas JD. Regulators of endothelial and epithelial barrier integrity and function in acute lung injury. Biochem Pharmacol. 2009 Jun 15;77(12):1763-72. Review. Maeder M, Ammann P, Rickli H, Diethelm M. Elevation of B type natriuretic peptide levels in acute respiratory distress syndrome. Swiss Med Wkly. 2003;133:515-8. Maisel AS, Krishnaswamy P, Nowak RM, et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med. 2002;347:161-7. Maisel AS, Koon J, Krishnaswamy P, et al. Utility of B-natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med. 2002;347:161-7. Maisel AS, Koon J, Krishnaswamy P, et al. Utility of Bnatriuretic peptide as a rapid, point-of-care test for screening patients undergoing echocardiography to determine left ventricular dysfunction. Am Heart J. 2001;141:367-74. Marcus GM, Gerber IL, McKeown BH, et al. Association between phonocardiographic third and fourth heart sounds and objetive measures of left ventricular function. JAMA. 2005;11;293(18):2238-44. Matthay MA, Folkesson HG, Clerici C. Lung epithelial fluid transport and the resolution of pulmonary edema. Physiol Rev. 2002;82:569-600. Mehta S, Al-Hashim AH, Keenan SP. Noninvasive ventilation in patients with acute cardiogenic pulmonary edema. Respir Care. 2009 Feb;54(2):186-95; discussion 195-7. Omland T, Aakvaag A, Bonarjee VV, et al. Plasma brain natriuretic peptide as an indicator of left ventricular systolic function and long-term survival after acute myocardial infarction: comparison with plasma atrial natriuretic peptide and N-terminal proatrial natriuretic peptide. Circulation. 1996;93:1963-9. 3/2/15 2:47 PM 11. Síndrome de insuficiencia respiratoria aguda Andrews CP, Coalson JJ, Smith JJ, et al. Diagnosis of nosocomial bacterial pneumonia in acute, diffuse lung injury. Chest. 1981;80:254-8. Bernard MS, Artigas A, Brigham KL, et al. Report on the American-European Consensus Conference on acute respiratory distress syndrome: definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med. 1994;149:818-24. Brower RG, Ware LB, Berthiaume Y, Matthay MA. Treatment of ARDS. Chest. 2001;120;1347-67. Cabrera-Rayo A, Carrera-Sánchez M, Méndez-Reyes R. Efecto de la posición decúbito prono en el intercambio gaseoso de pacientes con síndrome de insuficiencia respiratoria aguda. Rev Asoc Mex Med Crít y Ter Int. 2002;16(1):16-22. Carrillo-Esper R, Contreras-Domínguez V. Reclutamiento alveolar y decúbito prono para el manejo del síndrome de insuficiencia respiratoria. Med Int Méx. 2005;21:60-8. Chastre J, Trouillet JL, Vuagnat A, et al. Nosocomial pneumonia in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 1998;157:1165-72. Delclaux C, Roupie E, Blot F, et al. Lower respiratory tract colonization and infection during severe acute respiratory distress syndrome. Am J Respir Crit Care Med. 1997;156:1092-8. Fabregas N, Torres A, El-Ebiary M, et al. Histopathologic and microbiologic aspects of ventilator-associated pneumonia. Anesthesiology. 1996;84:760-71. Fagon JY, Chastre J, Domart Y, et al. Nosocomial pneumonia in patients receiving continuous mechanical ventilation: Book 2.indb 211 prospective analysis of 52 episodes with use of a protected specimen brush and quantitative culture techniques. Am Rev Respir Dis. 1989;139:877-84. Fagon JY, Chastre J, Vuagnat JL, et al. Nosocomial pneumonia and mortality among patients in intensive care units. JAMA. 1996;275:866-9. Fernández-Móndejar E, Gordo-Vidal F. Síndrome de distrés respiratorio agudo. Med Intensiva. 2006;30:149-150. Hemptinne Q, Remmelink M, Brimioulle S, Salmon I, Vincent JL. ARDS: a clinicopathological confrontation. Chest. 2009 Apr;135(4):944-9. Johanson WG, Seidenfeld JJ, Gómez P, et al. Bacteriologic diagnosis of nosocomial pneumonia following prolonged mechanical ventilation. Am Rev Respir Dis. 1988;137:259-64. Knaus WA, Draper EA, Wagner DP, et al. APACHE II a severity of disease classification system. Crit Care Med. 1985;13:818-29. Knaus WA, Wagner DP. Multiple systems organ failure: epidemiology and prognosis. Crit Care Clin. 1989;5:521-32. Lennette EH, Bullows A, Hausler WJ, et al. Manual of clinical microbiology, 4th ed. Washington, DC: American Society of Microbiology; 1985. Markowicz P, Wolf M, Djedaini K, et al. Multicenter prospective study of ventilator-associated pneumonia during acute respiratory distress syndrome: incidence, prognosis and risk factors. Am J Respir Crit Care Med. 2000;161:1942-8. Marquette CH, Herengt F, Mathieu D, et al. Diagnosis of pneumonia in mechanically ventilated patients: repeatability of the protected specimen brush. Am Rev Respir Dis. 1993;147:211-4. Martin TR, Pistorese BP, Hudson LD, et al. The function of lung and blood neutrophils in patients with the adult respiratory distress syndrome: implication for the pathogenesis of lung infections. Am Rev Respir Dis. 1991;144:254-62. Meduri GU, Reddy RC, Stanley T, et al. Pneumonia in acute respiratory distress syndrome: a prospective evaluation of bilateral bronchoscopic sampling. Am J Respir Crit Care Med. 1998;158:870-5. Montgomery AB, Stager MA, Carrico CJ, et al. Causes of mortality in patients with adult respiratory distress syndrome. Am Rev Respir Dis. 1985;132:485-9. Murray JF, Matthay MA, Luce JM, et al. An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis. 1988;138:720-3. Pugin J, Auckenthaler R, Mili N, et al. Diagnosis of ventilator associated pneumonia by bacteriologic analysis of bronchoscopic and non-bronchoscopic “blind” bronchoalveolar lavage fluid. Am Rev Respir Dis. 1991;143:1121-9. Seidenfeld JJ, Pohl DF, Bell RC, et al. Incidence, site, and outcome of infections in patients with adult respiratory distress syndrome. Am Rev Respir Dis. 1986;134:12-16. Sixt SU, Adamzik M, Peters J. ARDS-pulmonary repair and therapeutic options. Anaesthesiol Intensivmed Notfallmed Schmerzther. 2009 Apr;44(4):258-66. Epub 2009 Apr 14. Souweine B, Veber B, Bedos JP, et al. Diagnostic accuracy of protected specimen brush and bronchoalveolar lavage in nosocomial pneumonia: impact of previous antimicrobial treatments. Crit Care Med. 1998;26:236-44. Sutherland KR, Steinberg PS, Maunder RJ, et al. Pulmonary infection during the acute respiratory distress syndrome. Am J Respir Crit Care Med. 1995;152:550-6. Tang BM, Craig JC, Eslick GD, Seppelt I, McLean AS. Use of corticosteroids in acute lung injury and acute respiratory Sección 2 | Neumología 211 Patel R, Bushnell DL, Sobotka PA. Implications of an audible third heart sound in evaluating cardiac function. West J Med. 1993;158:606-9. Rihal CS, Davis KB, Kennedy JW, Gersh BJ. The utility of clinical, electrocardiographic, and roentgenographic variables in the prediction of left ventricular function. Am J Cardiol. 1995;75:220-3. Shah PM, Gramiak R, Kramer DH, Yu PN. Determinants of atrial (S4) and ventricular (S3) gallop sounds in primary myocardial disease. N Engl J Med. 1968;278:753-8. Sibbald WJ, Cunningham DR, Chin DN. Non-cardiac or cardiac pulmonary edema? A practical approach to clinical differentiation in critically ill patients. Chest. 1983;84:452-61. Silver MA, Maisel A, Yancy CW, et al. BNP Consensus Panel 2004: a clinical approach for the diagnostic, prognostic, screening, treatment monitoring, and therapeutic roles of natriuretic peptides in cardiovascular diseases. Congest Heart Fail. 2004;10(5 suppl 3):1-30. Errata en: Congest Heart Fail. 2005;11(2):102. Sosnowski MA. Review article: lack of effect of opiates in the treatment of acute cardiogenic pulmonary edema. Emerg Med Australas. 2008 Oct;20(5):384-90. Review. Spies C, Haude V, Fitzner R, et al. Serum cardiac troponin T as a prognostic marker in early sepsis. Chest. 1998;113:1055-63. Staub NC. Pulmonary edema. Physiol Rev. 1974;54:678-811. Tung RH, Garcia C, Morss AM, et al. Utility of B-type natriuretic peptide for the evaluation of intensive care unit shock. Crit Care Med. 2004;32:1643-7. ver Elst KM, Spapen HD, Nguyen DN, Garbar C, Huyghens LP, Gorus FK. Cardiac troponins I and T are biological markers of left ventricular dysfunction in septic shock. Clin Chem. 2000;46:650-7. Ware LB, Matthay MA. The acute respiratory distress syndrome. N Engl J Med. 2000;342:1334-49. 3/2/15 2:47 PM 212 distress syndrome: a systematic review and meta-analysis. Crit Care Med. 2009 May;37(5):1594-603. Trouillet JL, Chastre J, Vuagnat A, et al. Ventilator -associated pneumonia caused by potentially drug- resistant bacteria. Am Rev Respir Dis. 1998;157:531-539. Tsushima K, King LS, Aggarwal NR, De Gorordo A, D’Alessio FR, Kubo K. Acute lung injury review. Intern Med. 2009;48(9):621-30. Wimberley LL, Falling J, Bartlett JG. A fiberoptic bronchoscopy technique to obtain uncontaminated lower airway secretions for bacterial culture. Am Rev Respir Dis. 1979;119:337-43. 12. Fibrosis quística y bronquiectasias Boucher RC, et al. Mason: Murray and Nadel’s Textbook of respiratory medicine. 4th ed. Philadelphia: WB Saunders; 2005. Geller DE, Rubin BK. Respiratory care and cystic fibrosis. Respir Care. 2009 Jun;54(6):796-800. Gutiérrez-Zúñiga CP, Zúñiga-Vázquez G, Vargas MH. Evaluación de la terapia respiratoria domiciliaria proporcionada a niños con fibrosis quística. Neumo y Cir de Tórax. 2000;59(3):82-7. Javidan-Nejad C, Bhalla S. Bronchiectasis. Radiol Clin North Am. 2009 Mar;47(2):289-306. Morrisey B. Pathogenesis of bronchiectasis. Clin Chest Med. 2007;28:289-96. Orlandi RR, Wiggins RH. Radiological sinonasal findings in adults with cystic fibrosis. Am J Rhinol Allergy. 2009 MayJun;23(3):307-11. Orozo L, Chávez M, Saldaña Y, Velázquez R, Carnevale A, González-del Ángel A, et al. Fibrosis quística: la frontera del conocimiento molecular y sus aplicaciones clínicas. Rev Invest Clín. 2006;58(2):139-52. O’Sullivan BP, Freedman SD. Cystic fibrosis. Lancet. 2009 May 30;373(9678):1891-904. Ratjen FA. Cystic fibrosis: pathogenesis and future treatment strategies. Respir Care. 2009 May;54(5):595-605. Rosen MJ. Chronic cough due to bronchiectasis: ACCP evidence-based clinical practice Guidelines. Chest. 2006;129:122-31. Sánchez ID, et al. Consenso Nacional de Fibrosis Quística. Rev Chil Pediatr. 2001;72(4). Segal E, et al. Consenso Argentino de Fibrosis Quística. Arch Argent Pediatr. 1999;97:188. Strausbaugh SD, et al. Cystic fibrosis: a review of epidemiology and pathobiology. Clin Chest Med. 2007; 28:279-88. Sueblinvong V, et al. Novel therapies for the treatment of cystic fibrosis. Clin Chest Med. 2007;361:79. Vázquez-Alcántara KJ, Alejandre-García A, Sancho-Figueroa MC. Descripción clínica de pacientes con fibrosis quística en el Instituto Nacional de Enfermedades Respiratorias 1995-2008. Rev Inst Nal Enf Resp Méx. 2009; 22(2):84-91. Guía EXARMED 13. Cáncer broncopulmonar Book 2.indb 212 Alva LLF, Corcho VA, García-Sancho FC, Salazar FM, et al. Epidemiología del cáncer pulmonar en México; hallazgos por imagen. Rev Inst Nal Enf Resp Méx. 2003;16(4):197-204. American Cancer Society. Statistics for 2006. Disponible en: http://www.cancer.org/docroot/stt/ stt_0.asp Boffetta P, Agudo A, Ahrens W, Benhamou E, Benhamou S, Darby SC, et al. Multicenter case-control study of exposure to environmental tobacco smoke and lung cancer in Europe. J Natl Cancer Inst. 1998;90:1440-50. Centers for Disease Control and Prevention. The health consequences of smoking. A report of the surgeon general. 2004. Disponible en http://www.cdc.gov/tobacco/sgr/ sgr_2004/index. htm DeMarini, DM. Genotoxicity of tobacco smoke and tobacco smoke condensate: a review. Mutation Research. 2004;567:447-74. Felson B. Pulmonary nodules and cysts. Chest Roentgenology. Philadelphia: WB Saunders; 1973:314-29. Hyer JD, Silvestri G. Diagnosis and staging of lung cancer. Clin Chest Med. 2000;1:95-106. Ioachimescu O, Corlan E. New data in staging and prognosis of bronchopulmonary carcinoma. Part II: volumetric analysis of pulmonary nodules. Pneumology. 2008 OctDec;57(4):209-14, 216-20. Koul PA, Hajni MR, Sheikh MA, Khan UH, Shah A, Khan Y, et al. Hookah smoking and lung cancer in the Kashmir valley of the Indian subcontinent. Asian Pac J Cancer Prev. 2011;12:519-24. Koutras P, Urschel HJ Jr, Paulson DL. Hamartoma of the lung. J Thorac Cardiovasc Surg. 1997;61:768-76. Mahler B. Tumor markers used in diagnosis and monitoring of primary bronchopulmonary carcinoma. Pneumologic. 2008 JulSep;57(3):175-7. Medina-Morales F, Salazar-Flores M. Frecuencia y patrón cambiante del cáncer pulmonar en México. Salud Púb Méx. 2000;42:333-6. Mountain CF. Revisions in the International System For Staging Lung Cancer. Chest. 1997;111:1710-17. Park BJ, Louie O, Altorki N. Staging and the surgical management of lung cancer. Radiol Clin North Am. 2000;38:545-61. Pfeiffer GP, Denissenkov MF, Olivier M, Tretyakova N, Hecht SS, Hainaut P. Tobacco smoke carcinogens, DNA damage and p53 mutations in smoking-associated cancers. Oncogene. 2002;21(48):7435-51. Pinchot SN, Holen K, Sippel RS, Chen H. Carcinoid tumors. Oncologist. 2008 Dec;13(12):1255-69. Epub 2008 Dec 17. Registro Histopatológico de Neoplasias Malignas, Dirección General de Epidemiología, Secretaría de Salud, 2003. Disponible en: http://www. salud.gob.mx Stupp R, Monnerat C, Turrisi AT, et al. Small cell lung cancer: state of the art and future perspectives. Lung Cancer. 2004;45:105-17. Urdapilleta-Herrera EC, Sansores RH, Ramírez-Venegas A, Méndez-Guerra M, Lara-Rivas AG, Guzmán-Barragán SA, et al. Anxiety and depression in Mexican smokers, and their relationship with the severity of addiction. Salud Publica Mex. 2010;52 (Suppl 2):S120-8. Varela-Lema L, Fernandez-Villar A, Ruano-Ravina A. Effectiveness and safety of endobronchial ultrasound-transbronchial needle aspiration: a systematic review. Eur Respir J. 2009 May;33(5):1156-64. Vigianno RW, Swensen SJ, Rosenow EC III. Evaluation and management of solitary and multiple pulmonary nodules. Clin Chest Med. 1992;13:83-95. Villalba-Caloca J, Martínez-Heredero R. Frecuencia del carcinoma broncopulmonar en pacientes fumadores y no fumadores diagnosticados en el Instituto Nacional de Enfermedades Respiratorias en el año 2001. Rev Inst Nal Enf Resp Méx. 2004;17(1):27-34. Warner KE. The Framework Convention on Tobacco Control: opportunities and issues. Salud Publica Mex. 2008;50(Suppl 3):S283-91. Wu AH, Fontham ET, Reynolds P, Greenberg RS, Buffler P, Liff J, et al. Family history of cancer and risk of lung cancer among lifetime nonsmoking women in the United States. Am J Epidemiol. 1996;143:535-42. 14. Sarcoidosis pulmonar Arcosoy S. Characteristics and outcomes of patients with sarcoidosis listed for lung transplantation. Chest. 2001;120(3):873-80. 3/2/15 2:47 PM 213 15. Patología de pleura Agrawal V, Doelken P, Sahn SA. Pleural fluid analysis in chylous pleural effusion. Chest. 2008 Jun;133(6):1436-41. Book 2.indb 213 American Thoracic Society. Management of malignant pleural effusions. Am J Respir Crit Care Med. 2000;162:1987-2001. Antunes G, Neville E. Management of malignant pleural effusions. Thorax. 2000;55:981-3. Cicero-Sabido R, Páramo-Arroyo RF, Navarro-Reynoso FP, Pimentel-Ugarte L. Procedimientos quirúrgicos en 156 casos de derrame pleural. Resultados inmediatos. Cir Ciruj. 2006;74:409-14. Colice GL, Curtis A, Deslauriers J, et al. Medical and surgical treatment of parapneumonic effusions: an evidence-based guideline. Chest. 2000;118:1158-71. [Erratum, Chest 2001;119:319.] Gonlugur TE, Gonlugur U. Transudates in malignancy: still a role for pleural fluid. Ann Acad Med Singapore. 2008 Sep;37(9):760-3. Ibarra-Pérez C. Pleurodesis en derrame pleural maligno. Rev Inst Nal Enf Resp Méx. 2005;18(2):123-31. Jiménez Castro D, Pérez-Rodríguez E, Díaz-Nuevo G, Fogue L, Light RW. Determining the optimal number of specimens to obtain with needle biopsy of the pleura. Respir Med. 2002;96:14-7. Light RW. Pleural diseases. 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2001. López-Segundo E, Salazar-Lezama MA. Métodos diagnósticos en el derrame pleural maligno. Revisión de casos de 1992 al 2000. Rev Inst Nal Enf Resp Méx. 2003;16(2):70-3. Maskell NA, Butland RJA. British Thoracic Society Pleural Disease Group. BTS Guidelines for the investigation of an unilateral pleural effusion in adults. Thorax. 2003;58(suppl II):ii8-ii17. Mountain CF. Revisions in the International System for Staging Lung Cancer. Chest. 1997; 111:1710-7. Pneumatikos I, Bouros D. Pleural effusions in critically ill patients. Respiration. 2008;76(3):241-8. Richard W. Pleural diseases. Light, 4a ed. Baltimore: Lippincott Williams and Wilkins; 2001. Rodríguez-Panadero F, López-Mejías J. Low glucose and pH levels in malignant pleural effusions: diagnostic significance and prognostic value in respect to pleurodesis. Am Rev Respir Dis. 1989;139:663-7. Romero S, Candela A, Martin C, Hernández L, Trigo C, Gil J. Evaluation of different criteria for the separation of pleural transudates from exudates. Chest. 1993;104:399-404. Sahn SA. Pleural disease related to malignancies. Eur Respir J. 1997;10:1907-13. Vorobiof DA, Mafafo K. Malignant pleural mesothelioma: medical treatment update. Clin Lung Cancer. 2009 Mar;10(2):112-7. 16. Patología de mediastino Al-Mufarrej F, Badar J, Gharagozloo F, Tempesta B, Strother E, Margolis M. Spontaneous pneumomediastinum: diagnostic and therapeutic interventions. J Cardiothorac Surg. 2008 Nov 3;3:59. Chaganti RS, Rodriguez E, Mathew S. Origin of adult male mediastinal germ-cell tumors. Lancet. 1994;343:1130-2. Choe KS, Salama JK. Advances in radiotherapy for tumors involving the mediastinum. Thorac Surg Clin. 2009 Feb;19(1):133-41. Cohen A, Thompson L, Edwards F, Bellamy R. Primary cyst and tumors of the mediastinum. Ann Thorac Surg. 1999;51:378-86. Date H. Diagnostic strategies for mediastinal tumors and cysts. Thorac Surg Clin. 2009 Feb;19(1):29-35. Duwe BV, Sterman DH, Musani AI. Tumors of the mediastinum. Chest. 2005;128:2893- 2909. Ibarra-Pérez C, Kelly-García J. Tumores del mediastino. Oncología del tórax. México: UNAM, PUIS, Coordinación de la Vinculación, MA. Porrua; 1999:109-40. Sección 2 | Neumología ATS/ERS/WASOG Committee. Statement on sarcoidosis. Am J Respir Crit Care Med. 1999;160:736-55. Baughman RP, Lower EE, Drent M. Inhibitors of tumor necrosis factor (TNF) in sarcoidosis: who, what, and how to use them. Sarcoidosis Vasc Diffuse Lung Dis. 2008 Dec;25(2):76-89. Baughman RP, Teirstein AS, Judson MA, Rossman MD, Yeagen H Jr, Bresnitz EA, et al. Case Control Etiologic Study of Sarcoidosis (ACCESS) research group. Clinical characteristics of patient in a case control study of sarcoidosis. Am J. Respir Crit Care Med. 2001;164:1885-89. Chapman JT, Mehta AC. Bronchoscopy in sarcoidosis: diagnostic and therapeutic interventions. Curr Opin Pulm Med. 2003 Sep;9(5):402-7. Cilt C. Diagnosis of sarcoidosis. Pneumology. 2005 JanMar;54(1):15-21. Fraser R, Pare P. Enfermedades pulmonares de origen desconocido. En: Sinopsis de enfermedades del tórax. 2a ed. Philadelphia: Lippincott Williams & Wilkins. 1996:828-44. Gal AA, Koss MN. The patology of sarcoidosis. Curr Opin Pulm Med. 2002 Sep;8(5):545-51. Hillerdal G, Nou E, Osterman K, Schmekel B. Sarcoidosis: epidemiology and prognosis. Am Rev Respir Dis. 1984;130:29-32. Judson M. An approach to the treatment of pulmonary sarcoidosis with corticosteroids: the six phases of treatment. Chest. 1999;115(4):1158-65. Lynch J, Kazerooni E, Gay S. Pulmonary sarcoidosis. CI Chest Med. 1997;18(4):755-85. Lynch J. Enfermedad pulmonar intersticial. Sarcoidosis. En: MKSAP Medicina pulmonar y cuidados intensivos. 2a ed. 2001:31-7. Mihailovic-Vucinic V, Zugic V, Videnovic-Ivanov J. New observations on pulmonary function changes in sarcoidosis. Curr Opin Pulm Med. 2003 Sep;9(5):436-41. Müller-Quernheim J, Schürmann M, Hofmann S, Gaede KI, Fischer A, Prasse A, et al. Genetics of sarcoidosis: a key to understanding its pathogenesis. Pneumologic. 2009 Mar;63(3):166-75. Murray J, Nadel J. Textbook of respiratory medicine. En: Infiltrative and interstitial lung diseases. Sarcoidosis. 3rd ed. 2000:1717-32. Mussetti A, Vignoli L, Curbelo P, Meerovich E. Sarcoidosis pulmonar. Neumología y Cirugía de Tórax. 2006;65(S3):S36-46. Newman LS, Rose CS, Maier LA. Sarcoidosis. N Engl J Med. 1997;336:1224-34. Nunes H, Soler P, Valeyre D. Pulmonary sarcoidosis. Allergy. 2005;60:565-82. Prasse A, Muller-Quernheim J. Sarcoidosis Internist (Berl). 2009 May;50(5):581-90. Schurmann M. Angiotensin-converting enzyme gene polymorphisms in patients with pulmonary sarcoidosis: impact on disease severity. Am J Pharmacogenomics. 2003; 3(4):233-43. Schwarz M, King T. Sarcoidosis. En: Interstitial lung disease. 2003;14:332-86. Selman M. Sarcoidosis. En: Neumopatías intersticiales difusas. 1996;9:143-58. Torralba KD, Quismorio FP Jr. Sarcoidosis and the rheumatologist. Curr Opin Rheumatol. 2009 Jan;21(1):62-70. Valeyre D, Uzunhan Y, Bouvry D, Naccache JM, Nunes H. Up-to-date in pulmonary and extrapulmonary sarcoidosis. Acta Clin Belg. 2008 Nov-Dec;63(6):408-13. 3/2/15 2:47 PM 214 Wholley B, Urschel J, Antrowiak J, Takita H. Primary tumors of the mediastinum. J of Surg Oncology. 1999;70:95-9. 17. Patología diafragmática Chin EF, Lynn RB. Surgery of the eventration of the diaphragm. J Thorac Surg. 1956;32. Chughtai T, Ali S, Sharkey P, Lins M, Rizoli S. Update on managing diaphragmatic rupture in blunt trauma: a review of 208 consecutive cases. Can J Surg. 2009 Jun;52(3):177-81. Colvin J, Bower C, Dickinson JE. Outcomes of congenital diaphragmatic hernia: a population-based study in Western Australia. Pediatrics. 2005;116:356-63. Darroch-Moores. Chest Surgery Clinics of North America. Edit Saunders. 1998;8(2). de Buys Roessingh AS, Dinh-Xuan AT. Congenital diaphragmatic hernia: current status and review of the literature. Eur J Pediatr. 2009 Apr;168(4):393-406. Ibáñez-Fuentes JR, Nieto-Ocampo AE, Bermúdez-Jiménez A, Olivares-Aguirre A. Hernia de Bochdalek en el adulto. Gac Méd Méx. 2003;139(1):69-72. Mullinix AJ, Foley WD. Multidetector computed tomography and blunt thoracoabdominal trauma. J Comput Assist Tomogr. 2004;28:S20-27. Olivares-Becerra JJ, Farías-Llamas OA, Candelas-del Toro O, Medrano-Muñoz F, Fuentes-Orozco C, González-Ojeda A. Hernia diafragmática traumática. Cir Ciruj. 2006;74:415-23. Quintana-González JI, Carbajo M, Rodríguez J. Parálisis diafragmática unilateral tratada con éxito mediante plicatura diafragmática. Arch of Bronchoneum. 2001;37(9). Sánchez-Astudillo P, Criales JL. Eventración diafragmática. Presentación de un caso. Gac Méd Méx. 2004;140(3):353-4. Schram DJ, Vosik W, Cantral D. Diaphragmatic Paralysis Following Cervical Chiropractic Manipulation: Case report and review. Chest. 2001;119:638-40. Taylor GA, Atalabi OM, Estroff JA. Imaging of congenital diaphragmatic hernias. Pediatr Radiol. 2009 Jan;39(1):1-16. Guía EXARMED Feung MY, Gasser B, Gangi A, et al. Imaging of cystic masses of the mediastinum. RadioGraphics. 2002;22:S79-S93. Fraser RS, Pare JAP, Fraser RG, et al. Sinopsis de enfermedades del tórax. 2ª ed. Lippincott Williams & Wilkins; 1999:1-22. Goodman LR. Felson: Principios de radiología torácica. 2ª ed. México: McGraw Hill Interamericana; 2000:163-80. Ibarra-Pérez C, Kelly-García J, Fernández-Corzo MA. Guía diagnóstico-terpéutica: tumores y masas del mediastino. Rev Inst Nal Enf Resp Méx. 2001;14(3):172-7. Langwieler T, Steffani K, Bogoevski, Mann O, Izbici J. Spontaneous pneumomediastinum. Ann Thorac Surg. 2004;78:711-3. Moore EH. Mediastinal tumors. Radiologic evaluation of mediastinal masses. Chest Surg Clin North Am. 1992; 2:1-22. Murray JF, Nadel JA. Textbook of respiratory medicine. Pneumomediastinum and mediastinitis. 3rd ed. Philadelphia: WB Saunders; 2000:2095-121. Navarro-Reynoso FP, Lorenzo-Silva JM. Tratamiento quirúrgico de los tumores gigantes del mediastino. Gac Méd Méx. 2001;137(2):117-26. Reed JC. Radiología torácica. Patrones radiológicos y diagnóstico diferencial. Madrid: Ed. Doyma; 1985;48-80. Santillán-Doherty P. Tumores mediastinales. Rev Invest Clín. 2006;58(3):245-53. St-Georges R, Deslauries J, Duranceau A, et al. Clinical spectrum of bronchogenic cysts of the mediastinum and lung in adults. Ann Thorac Surg. 1991;52:6-13. Strollo DC, Rosado-de-Christenson ML, Jett JR, et al. Primary mediastinal tumors: Part 1. Tumors of the anterior mediastinum. Chest. 1997;112:511. Tomaszek S, Wigle DA, Keshavjee S, Fischer S. Thymomas: review of current clinical practice. Ann Thorac Surg. 2009 Jun;87(6):1973-80. Ueno T, et al. Spectrum of germ cell tumors: from head to toe. RadioGraphics. 2004;24:387-404. Book 2.indb 214 3/2/15 2:47 PM