Remodulin 1 Remodulin 2,5 Remodulin 5 Remodulin 10
Anuncio
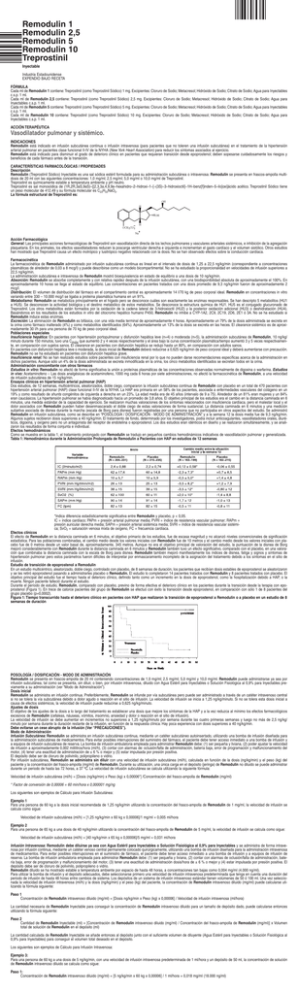
0756 0756 Remodulin 1 Remodulin 2,5 Remodulin 5 Remodulin 10 Treprostinil Inyectable Industria Estadounidense EXPENDIO BAJO RECETA FÓRMULA Cada ml de Remodulin 1 contiene: Treprostinil (como Treprostinil Sódico) 1 mg. Excipientes: Cloruro de Sodio; Metacresol; Hidróxido de Sodio; Citrato de Sodio; Agua para Inyectables c.s.p. 1 ml. Cada ml de Remodulin 2,5 contiene: Treprostinil (como Treprostinil Sódico) 2,5 mg. Excipientes: Cloruro de Sodio; Metacresol; Hidróxido de Sodio; Citrato de Sodio; Agua para Inyectables c.s.p. 1 ml. Cada ml de Remodulin 5 contiene: Treprostinil (como Treprostinil Sódico) 5 mg. Excipientes: Cloruro de Sodio; Metacresol; Hidróxido de Sodio; Citrato de Sodio; Agua para Inyectables c.s.p. 1 ml. Cada ml de Remodulin 10 contiene: Treprostinil (como Treprostinil Sódico) 10 mg. Excipientes: Cloruro de Sodio; Metacresol; Hidróxido de Sodio; Citrato de Sodio; Agua para Inyectables c.s.p. 1 ml. ACCIÓN TERAPÉUTICA Vasodilatador pulmonar y sistémico. INDICACIONES Remodulin está indicado en infusión subcutánea continua o infusión intravenosa (para pacientes que no toleren una infusión subcutánea) en el tratamiento de la hipertensión arterial pulmonar en pacientes clase funcional II-IV de la NYHA (New York Heart Association) para reducir los síntomas asociados al ejercicio. Remodulin está indicado para disminuir el grado de deterioro clínico en pacientes que requieran transición desde epoprostenol; deben sopesarse cuidadosamente los riesgos y beneficios de cada fármaco antes de la transición. CARACTERÍSTICAS FARMACOLÓGICAS / PROPIEDADES Descripción Remodulin (Treprostinil Sódico) Inyectable es una sal sódica estéril formulada para su administración subcutánea o intravenosa. Remodulin se presenta en frascos-ampolla multidosis de 20 ml con las siguientes concentraciones: 1,0 mg/ml; 2,5 mg/ml; 5,0 mg/ml o 10,0 mg/ml de Treprostinil. Treprostinil es químicamente estable a temperatura ambiente y pH neutro. Treprostinil es sal monosódica de (1R,2R,3aS,9aS)–[[2,3,3a,4,9,9a–hexahidro–2–hidroxi–1–[–(3S)–3–hidroxioctil]–1H–benz[f]inden–5–ilo]oxi]ácido acético. Treprostinil Sódico tiene un peso molecular de 412,49 y su fórmula molecular es C23H33NaO5. La fórmula estructural de Treprostinil es: Acción Farmacológica General: Las principales acciones farmacológicas de Treprostinil son vasodilatación directa de los lechos pulmonares y vasculares arteriales sistémicos, e inhibición de la agregación plaquetaria. En los animales, los efectos vasodilatadores reducen la poscarga ventricular derecha e izquierda e incrementan el gasto cardíaco y el volumen sistólico. Otros estudios han mostrado que Treprostinil causa un efecto inotrópico y lusitrópico negativo relacionado con la dosis. No se han observado efectos sobre la conducción cardíaca. Farmacocinética La farmacocinética de Remodulin administrado por infusión subcutánea continua es lineal en el intervalo de dosis de 1,25 a 22,5 ng/kg/min (correspondiente a concentraciones plasmáticas de alrededor de 0,03 a 8 mcg/l) y puede describirse como un modelo bicompartimental. No se ha estudiado la proporcionalidad en velocidades de infusión superiores a 22,5 ng/kg/min. La administración subcutánea e intravenosa de Remodulin mostró bioequivalencia en estado de equilibrio a una dosis de 10 ng/kg/min. Absorción: Remodulin se absorbe completamente y con relativa rapidez después de la infusión subcutánea, con una biodisponibilidad absoluta de aproximadamente el 100%. En aproximadamente 10 horas se llega al estado de equilibrio. Las concentraciones en pacientes tratados con una dosis promedio de 9,3 ng/kg/min fueron de aproximadamente 2 mcg/l. Distribución: El volumen de distribución del fármaco en el compartimento central es aproximadamente 14 l/70 kg de peso corporal ideal. Remodulin en concentraciones in vitro variando entre 330 – 10.000 mcg/l se ligaba a proteína plasmática humana en un 91%. Metabolismo: Remodulin se metaboliza principalmente en el hígado pero se desconoce cuáles son exactamente las enzimas responsables. Se han descripto 5 metabolitos (HU1 a HU5). Se desconocen la actividad biológica y el destino metabólico de estos metabolitos. Se desconoce la estructura química de HU1. HU5 es el conjugado glucuronado de Treprostinil. Los otros metabolitos están formados por la oxidación de la cadena lateral de 3-hidroxioctil (HU2) y la posterior oxidación adicional (HU3) o deshidratación (HU4). Basándonos en los resultados de los estudios in vitro del citocromo hepático humano P450, Remodulin no inhibe a CYP-1A2, 2C9, 2C19, 2D6, 2E1 ó 3A. No se ha estudiado si Remodulin induce estas enzimas. Excreción: La eliminación de Remodulin es bifásica, con una vida media terminal de aproximadamente 4 horas. Aproximadamente un 79% de la dosis administrada se excreta en la orina como fármaco inalterado (4%) y como metabolitos identificados (64%). Aproximadamente un 13% de la dosis se excreta en las heces. El clearance sistémico es de aproximadamente 30 l/h para una persona de 70 kg de peso corporal ideal. Poblaciones especiales Insuficiencia hepática: En pacientes con hipertensión portopulmonar y disfunción hepática leve (n=4) o moderada (n=5), la administración subcutánea de Remodulin, 10 ng/kg/ minuto durante 150 minutos, tuvo una Cmáx que aumentó 2 y 4 veces respectivamente y el área bajo la curva concentración plasmática/tiempo aumentó 3 y 5 veces respectivamente, en comparación con sujetos sanos. El clearance en pacientes con disfunción hepática se redujo hasta un 80%, en comparación con adultos sanos. En pacientes con disfunción hepática leve o moderada, la dosis inicial de Remodulin deberá reducirse a 0,625 ng/kg/min de peso corporal ideal y deberá aumentarse con precaución. Remodulin no se ha estudiado en pacientes con disfunción hepática grave. Insuficiencia renal: No se han realizado estudios sobre pacientes con insuficiencia renal por lo que no pueden darse recomendaciones específicas acerca de la administración en dichos pacientes. Aunque sólo un 4% de la dosis administrada se excreta inmodificada en la orina, los cinco metabolitos identificados se excretan todos en la orina. Administración concomitante con otros fármacos Estudios in vitro: Remodulin no afectó de forma significativa la unión a proteínas plasmáticas de las concentraciones observadas normalmente de digoxina o warfarina. Estudios in vivo: Acetaminofeno – Las dosis analgésicas de acetaminofeno, 1000 mg cada 6 horas por siete administraciones, no afectó la farmacocinética de Remodulin, a una velocidad de infusión subcutánea de 15 ng/kg/min. Ensayos clínicos en hipertensión arterial pulmonar (HAP) Dos estudios, de 12 semanas, multicéntricos, aleatorizados, doble ciego, compararon la infusión subcutánea continua de Remodulin con placebo en un total de 470 pacientes con hipertensión arterial pulmonar (HAP) clase funcional II-IV de la NYHA. La HAP era primaria en un 58% de los pacientes, asociada a enfermedades vasculares del colágeno en un 19% y como resultado de shunts congénitos de izquierda a derecha en un 23%. La edad media era de 45 años (intervalo de 9 a 75). Alrededor de un 81% eran mujeres y un 84% eran caucásicos. La hipertensión pulmonar se había diagnosticado hacía un promedio de 3,8 años. El objetivo principal de los estudios era el cambio en la distancia caminada en 6 minutos, una medida estándar de la capacidad de ejercicio. Se realizaron muchas valoraciones de los síntomas relacionados con insuficiencia cardíaca, pero el malestar local y el dolor asociados con Remodulin pueden haber desenmascarado el doble ciego de estas valoraciones de forma sustancial. La distancia caminada en 6 minutos y una medición subjetiva asociada de disnea durante la marcha (escala de Borg para disnea) fueron registradas por una persona que no participaba en otros aspectos del estudio. Se administró Remodulin en infusión subcutánea, como se describe en “Posología / Dosificación - Modo de Administración” y a la semana 12 la dosis media fue de 9,3 ng/kg/min. Algunos sujetos recibieron dosis superiores a 40 ng/kg/min. El tratamiento de fondo, determinado por los investigadores, podía incluir anticoagulantes, vasodilatadores orales, diuréticos, digoxina, y oxígeno pero no un antagonista del receptor de endotelina o epoprostenol. Los dos estudios eran idénticos en diseño y se realizaron simultáneamente, y se analizaron los resultados de forma conjunta e individual. Efectos hemodinámicos Como se muestra en la tabla 1, el tratamiento prolongado con Remodulin se tradujo en pequeños cambios hemodinámicos indicativos de vasodilatación pulmonar y generalizada. Tabla 1: Hemodinámica durante la Administración Prolongada de Remodulin a Pacientes con HAP en estudios de 12 semanas *Indica diferencia estadísticamente significativa entre Remodulin y placebo, p < 0,05. IC = índice cardíaco; PAPm = presión arterial pulmonar media; PVRI = índice de resistencia vascular pulmonar; RAPm = presión auricular derecha media; SAPm = presión arterial sistémica media; SVRI = índice de resistencia vascular sistémica; SvO2 = saturación venosa mixta de oxígeno, FC = frecuencia cardíaca. Efectos clínicos El efecto de Remodulin en la distancia caminada en 6 minutos, el objetivo primario de los estudios, fue de escasa magnitud y no alcanzó niveles convencionales de significación estadística. Para las poblaciones combinadas, el cambio medio desde los valores iniciales con Remodulin fue de 10 metros y el cambio medio desde los valores iniciales con placebo fue de 0 metros desde un valor basal de, aproximadamente, 345 metros. Aunque no era el objetivo principal de valoración del estudio, la puntuación de la disnea de Borg mejoró considerablemente con Remodulin durante la distancia caminada en 6 minutos y Remodulin también tuvo un efecto significativo, comparado con el placebo, en una valoración que combinaba la distancia caminada con la escala de Borg para disnea. Remodulin también mejoró manifiestamente los índices de disnea, fatiga y signos y síntomas de hipertensión pulmonar pero estos parámetros fueron difíciles de interpretar por enmascaramiento incompleto de la asignación del tratamiento debido a los síntomas en el sitio de infusión. Estudio de transición de epoprostenol a Remodulin En un estudio multicéntrico, aleatorizado, doble ciego, controlado con placebo, de 8 semanas de duración, los pacientes que recibían dosis estables de epoprostenol se aleatorizaron y se les retiró epoprostenol pasando a administrarles placebo o Remodulin. El estudio lo completaron 14 pacientes tratados con Remodulin y 8 pacientes tratados con placebo. El objetivo principal del estudio fue el tiempo hasta el deterioro clínico, definido tanto como un incremento en la dosis de epoprostenol, como la hospitalización debido a HAP, o la muerte. Ningún paciente falleció durante el estudio. Durante el período de estudio, Remodulin, comparado con placebo, previno de forma efectiva el deterioro clínico en los pacientes durante la transición desde la terapia con epoprostenol (Figura 1). En trece de catorce pacientes del grupo de Remodulin se efectuó con éxito la transición desde epoprostenol, en comparación con sólo 1 de 8 pacientes del grupo placebo (p=0,0002). Figura 1: Tiempo transcurrido hasta el deterioro clínico en pacientes con HAP que realizaron la transición de epoprostenol a Remodulin o a placebo en un estudio de 8 semanas de duración POSOLOGÍA / DOSIFICACIÓN - MODO DE ADMINISTRACIÓN Remodulin se presenta en frascos-ampolla de 20 ml conteniendo concentraciones de 1,0 mg/ml; 2,5 mg/ml; 5,0 mg/ml y 10,0 mg/ml. Remodulin puede administrarse ya sea por infusión subcutánea, tal como se presenta, sin diluir, o bien, por infusión intravenosa, diluido con Agua Estéril para Inyectables o Solución Fisiológica al 0,9% para Inyectables previamente a su administración (ver “Modo de Administración”). Dosis inicial Remodulin se administra en infusión continua. Preferiblemente, Remodulin se infunde por vía subcutánea pero puede ser administrado a través de un catéter intravenoso central si no se tolera la vía subcutánea debido a dolor agudo o reacción en el sitio de infusión. La velocidad de infusión se inicia a 1,25 ng/kg/minuto. Si no se tolera esta dosis inicial a causa de efectos sistémicos, la velocidad de infusión puede reducirse a 0,625 ng/kg/minuto. Ajustes de dosis El objetivo de los ajustes de la dosis a lo largo del tratamiento es establecer una dosis que mejore los síntomas de la HAP y a la vez reduzca al mínimo los efectos farmacológicos excesivos de Remodulin (cefaleas, náuseas, vómitos, insomnio, ansiedad y dolor o reacción en el sitio de infusión). La velocidad de infusión se debe aumentar en incrementos no superiores a 1,25 ng/kg/minuto por semana durante las cuatro primeras semanas y luego no más de 2,5 ng/kg/ minuto por semana durante la duración restante de la infusión, en función de la respuesta clínica. Hay poca experiencia con dosis superiores a 40 ng/kg/min. Debe evitarse un cese abrupto de la infusión (Ver “PRECAUCIONES”). Modo de Administración Infusión Subcutánea: Remodulin se administra en infusión subcutánea continua, mediante un catéter subcutáneo autoinsertado, utilizando una bomba de infusión diseñada para la administración subcutánea de medicamentos. Para evitar posibles interrupciones del suministro del fármaco, el paciente debe tener acceso inmediato a una bomba de infusión y a equipos de infusión subcutánea de reserva. La bomba de infusión ambulatoria empleada para administrar Remodulin debe: (1) ser pequeña y liviana, (2) poder ajustar la velocidad de infusión a aproximadamente 0,002 mililitros/hora (ml/h), (3) contar con alarmas de: oclusión/falta de administración, batería baja, error de programación y malfuncionamiento del motor, (4) tener una exactitud de administración de ± 6 % o mejor y (5) estar impulsada por presión positiva. El depósito debe ser de cloruro de polivinilo, polipropileno o vidrio. Por infusión subcutánea, Remodulin se administra sin diluir con una velocidad de infusión subcutánea (ml/h), calculada en función de la dosis (ng/kg/min) y el peso (kg) del paciente y la concentración del frasco-ampolla (mg/ml) de Remodulin. Durante su utilización, una única carga en el depósito (jeringa) de Remodulin no diluido se puede administrar durante un periodo de hasta las 72 horas, a 37 ºC. La velocidad de infusión subcutánea se calcula utilizando la siguiente fórmula: Velocidad de infusión subcutánea (ml/h) = [Dosis (ng/kg/min) x Peso (kg) x 0,00006*] /Concentración del frasco-ampolla de Remodulin (mg/ml) * Factor de conversión de 0,00006 = 60 min/hora x 0,000001 mg/ng Los siguientes son ejemplos de Cálculo para Infusión Subcutánea: Ejemplo 1 Para una persona de 60 kg a la dosis inicial recomendada de 1,25 ng/kg/min utilizando la concentración del frasco-ampolla de Remodulin de 1 mg/ml, la velocidad de infusión se calcula como sigue: Velocidad de infusión subcutánea (ml/h) = [1,25 ng/kg/min x 60 kg x 0,00006]/1 mg/ml = 0,005 ml/hora Ejemplo 2 Para una persona de 65 kg a una dosis de 40 ng/kg/min utilizando la concentración del frasco-ampolla de Remodulin de 5 mg/ml, la velocidad de infusión se calcula como sigue: Velocidad de infusión subcutánea (ml/h) = [40 ng/kg/min x 65 kg x 0,00006]/5 mg/ml = 0,031 ml/hora Infusión Intravenosa: Remodulin debe diluirse ya sea con Agua Estéril para Inyectables o Solución Fisiológica al 0,9% para Inyectables y se administra de forma intravenosa por infusión continua, mediante un catéter venoso central permanente colocado quirúrgicamente, utilizando una bomba de infusión diseñada para la administración intravenosa de medicamentos. Para evitar posibles interrupciones en el suministro de fármaco, el paciente debe tener acceso inmediato a una bomba de infusión y a equipos de infusión de reserva. La bomba de infusión ambulatoria empleada para administrar Remodulin debe: (1) ser pequeña y liviana, (2) contar con alarmas de oclusión/falta de administración, batería baja, error de programación y malfuncionamiento del motor, (3) tener una exactitud de administración dosis/hora de ± 6 % o mejor y (4) estar impulsada por presión positiva. El depósito debe ser de cloruro de polivinilo, polipropileno o vidrio. Remodulin diluido se ha mostrado estable a temperatura ambiente por espacio de hasta 48 horas, a concentraciones tan bajas como 0,004 mg/ml (4.000 ng/ml). Para utilizar la bomba de infusión y el depósito adecuados, debe seleccionarse primero una velocidad de infusión intravenosa predeterminada que tenga en cuenta una duración del periodo de infusión de hasta 48 horas entre cambios de sistema. Los depósitos de un sistema de infusión intravenoso estándar tienen volúmenes de 50 ó 100 ml. Una vez seleccionada la velocidad de infusión intravenosa (ml/h) y la dosis (ng/kg/min) y el peso (kg) del paciente, la concentración de Remodulin intravenoso diluido (mg/ml) puede calcularse utilizando la fórmula siguiente: Paso 1 Concentración de Remodulin intravenoso diluido (mg/ml) = [Dosis ng/kg/min x Peso (kg) x 0,00006] / Velocidad de infusión intravenosa (ml/hora) La cantidad necesaria de Remodulin Inyectable para conseguir la concentración de Remodulin intravenoso diluido para un tamaño de depósito dado, puede calcularse entonces utilizando la fórmula siguiente: Paso 2 Cantidad de Remodulin Inyectable (ml) = [Concentración de Remodulin intravenoso diluido (mg/ml) / Concentración del frasco-ampolla de Remodulin (mg/ml)] x Volumen total de solución de Remodulin en el depósito (ml) La cantidad calculada de Remodulin Inyectable se añade entonces al depósito junto con el suficiente volumen de diluyente (Agua Estéril para Inyectables o Solución Fisiológica al 0,9% para Inyectables) para conseguir el volumen total deseado en el depósito. Los siguientes son ejemplos de Cálculo para Infusión Intravenosa: Ejemplo 3: Para una persona de 60 kg a una dosis de 5 ng/kg/min, con una velocidad de infusión intravenosa predeterminada de 1 ml/hora y un depósito de 50 ml, la concentración de solución de Remodulin intravenoso diluido se calcula como sigue: Paso 1: Concentración de Remodulin intravenoso diluido (mg/ml) = [5 ng/kg/min x 60 kg x 0,00006] / 1 ml/hora = 0,018 mg/ml (18.000 ng/ml) La cantidad de Remodulin Inyectable (utilizando una concentración del frasco-ampolla de 1 mg/ml) que se necesita para un total de concentración de Remodulin diluido de 0,018 mg/ml y un volumen total de 50 ml se calcula como sigue: 0756 Paso 2 Cantidad de Remodulin Inyectable (ml) = [0,018 mg/ml / 1 mg/ml] x 50 ml = 0,9 ml La concentración de Remodulin intravenoso diluido para la persona en el Ejemplo 3 se prepara por lo tanto añadiendo 0,9 ml de Remodulin Inyectable de 1 mg/ml a un depósito adecuado junto con el suficiente volumen de diluyente para conseguir un volumen total de 50 ml en el depósito. La velocidad de flujo de la bomba para este ejemplo se fija en 1 ml/ hora. Ejemplo 4: Para una persona de 75 kg a una dosis de 30 ng/kg/min, con una velocidad de infusión intravenosa predeterminada de 2 ml/hora y un depósito de 100 ml, la concentración de solución de Remodulin intravenoso diluido se calcula como sigue: Paso 1: Concentración de Remodulin intravenoso diluido (mg/ml) = [30 ng/kg/min x 75 kg x 0,00006] / 2 ml/hora = 0,0675 mg/ml (67.500 ng/ml) La cantidad de Remodulin Inyectable (utilizando una concentración del frasco-ampolla de 2,5 mg/ml) que se necesita para un total de concentración de Remodulin diluido de 0,0675 mg/ml y un volumen total de 100 ml se calcula como sigue: Paso 2 Cantidad de Remodulin Inyectable (ml) = [0,0675 mg/ml / 2,5 mg/ml] x 100 ml = 2,7 ml La Concentración de Remodulin intravenoso diluido para la persona en el Ejemplo 4 se prepara por lo tanto añadiendo 2,7 ml de Remodulin Inyectable de 2,5 mg/ml a un depósito adecuado junto con el suficiente volumen de diluyente para conseguir un volumen total de 100 ml en el depósito. La velocidad de flujo de la bomba para este ejemplo se fija en 2 ml/hora. En pacientes que requieren transición de epoprostenol a Remodulin La transición de epoprostenol a Remodulin se completa iniciando la infusión de Remodulin e incrementándola, mientras que de forma simultánea se reduce la dosis intravenosa de epoprostenol. La transición a Remodulin se realizará en un centro hospitalario con vigilancia constante de la respuesta del paciente (por ej.: distancia caminada y signos y síntomas de progresión de la enfermedad). Durante la transición, se recomienda iniciar el tratamiento con Remodulin a una dosis del 10% de la dosis de epoprostenol administrada en ese momento, y luego aumentarla en forma escalonada a medida que la dosis de epoprostenol se disminuye (Ver la tabla 2 para las dosis de transición recomendadas). Las dosis a administrar a los pacientes deben titularse en forma individual según lo permita la transición de epoprostenol a Remodulin, mientras se sopesa el efecto adverso de la acción limitante de las prostaciclinas. La exacerbación de los síntomas de HAP en el paciente debe tratarse en primer lugar con un incremento en la dosis de Remodulin. Los efectos adversos, normalmente asociados con prostaciclinas y análogos de las prostaciclinas, deben tratarse inicialmente con dosis decrecientes de epoprostenol. Tabla 2: Dosis de transición recomendadas para el cambio Paso Dosis de Remodulin Dosis de epoprostenol 1 Inalterada 10% de la dosis inicial de epoprostenol 2 80% de la dosis inicial de epoprostenol 30% de la dosis inicial de epoprostenol 3 60% de la dosis inicial de epoprostenol 50% de la dosis inicial de epoprostenol 4 40% de la dosis inicial de epoprostenol 70% de la dosis inicial de epoprostenol 5 20% de la dosis inicial de epoprostenol 90% de la dosis inicial de epoprostenol 6 5% de la dosis inicial de epoprostenol 110% de la dosis inicial de epoprostenol 7 0 110% de la dosis inicial de epoprostenol + incrementos adicionales del 5-10%, en caso necesario CONTRAINDICACIONES Remodulin está contraindicado en pacientes con hipersensibilidad conocida al fármaco o a compuestos estructuralmente relacionados. ADVERTENCIAS Remodulin sólo está indicado para empleo subcutáneo o intravenoso. PRECAUCIONES Generales Remodulin sólo debe ser utilizado por médicos con experiencia en el diagnóstico y el tratamiento de la HAP. Remodulin es un potente vasodilatador pulmonar y sistémico. El inicio del tratamiento con Remodulin debe realizarse en un entorno con personal adecuado e instrumental para el control fisiológico y cuidados de emergencia. El tratamiento con Remodulin puede utilizarse durante períodos prolongados y se debe considerar meticulosamente la capacidad del paciente para administrarse Remodulin y para los cuidados de un sistema de infusión. La dosis deberá incrementarse ante la falta de mejoría o ante el empeoramiento de los síntomas y deberá reducirse ante efectos farmacológicos excesivos o síntomas inaceptables en el sitio de infusión (ver “POSOLOGÍA / DOSIFICACIÓN - MODO DE ADMINISTRACIÓN”). La suspensión brusca o grandes reducciones repentinas de la dosis de Remodulin pueden provocar el empeoramiento de los síntomas de HAP y deberían evitarse. Información para los pacientes Los pacientes que vayan a recibir Remodulin deben conocer la siguiente información: Remodulin se infunde, mediante una bomba de infusión, de forma continua a través de un catéter subcutáneo o un catéter venoso central permanente colocado quirúrgicamente. El tratamiento con Remodulin será necesario durante períodos prolongados, posiblemente años, y se debe considerar meticulosamente la capacidad del paciente de aceptar, colocar y cuidar un catéter subcutáneo y de utilizar una bomba de infusión. Para reducir el riesgo de infección, en la preparación y administración de Remodulin debe utilizarse una técnica aséptica. Además, los pacientes deben conocer que el tratamiento posterior de la enfermedad puede requerir el inicio de un tratamiento alternativo con prostaciclina intravenosa (epoprostenol). Interacciones medicamentosas La reducción de la tensión arterial causada por Remodulin puede verse empeorada por fármacos que alteran por sí mismos la tensión arterial como diuréticos, agentes hipotensores u otros vasodilatadores. Dado que Remodulin inhibe la agregación de las plaquetas, hay también una posibilidad de incremento del riesgo de hemorragia, especialmente entre pacientes que mantienen tratamientos anticoagulantes. Durante los ensayos clínicos, Remodulin se utilizó concomitantemente con anticoagulantes, diuréticos, glucósidos cardíacos, antagonistas del calcio, analgésicos, antipiréticos, antiinflamatorios no esteroideos, opioides, corticoides y otras medicaciones. Remodulin no se ha estudiado en forma conjuntamente con epoprostenol o bosentan. Efecto de otros fármacos sobre Remodulin Estudios in vivo: Acetaminofeno – Las dosis analgésicas de acetaminofeno, 1000 mg cada 6 horas por siete administraciones, no afectó la farmacocinética de Remodulin, a una velocidad de infusión subcutánea de 15 ng/kg/min. Efecto de Remodulin sobre otros fármacos Estudios in vitro: Remodulin no afectó de forma significativa la unión a proteínas plasmáticas de concentraciones normalmente observadas de digoxina o warfarina. Estudios in vivo: Warfarina – Remodulin no afecta la farmacocinética o farmacodinámica de la warfarina. La farmacocinética de R- y S- warfarina y la medida internacional del grado de la coagulabilidad sanguínea (INR - International Normalized Ratio = Razón Internacional Normalizada o RIN) en sujetos sanos a los que se suministró una dosis única de 25 mg de warfarina no se vieron afectados por la infusión subcutánea continua de Remodulin a una velocidad de infusión de 10 ng/kg/min. Alteración hepática y renal Debe tenerse cuidado en pacientes con alteraciones hepáticas o renales (Ver “Poblaciones especiales”). Carcinogénesis, mutagénesis, alteración de la fertilidad No se han realizado estudios a largo plazo para evaluar el potencial carcinogénico de Treprostinil. Los estudios de mutagenicidad in vitro e in vivo no mostraron efectos mutagénicos o clastogénicos de Treprostinil. Treprostinil Sódico no afectó la fertilidad o el rendimiento reproductor de ratas machos o hembras a las que se suministraron infusiones subcutáneas continuas a velocidades de hasta 450 ng de Treprostinil/kg/min [alrededor de 59 veces la velocidad de infusión inicial recomendada en humanos (1,25 ng/kg/min) y aproximadamente 8 veces la velocidad promedio (9,3 ng/kg/min) obtenida en ensayos clínicos, basado en ng/m2]. En este estudio, a los machos se les administraron las dosis desde 10 semanas antes del apareamiento y durante las dos semanas del periodo de celo. A las hembras se les administró desde 2 semanas antes del apareamiento hasta el día 6 de la gestación. Embarazo En ratas gestantes, la infusión subcutánea continua de Treprostinil Sódico durante el período de organogénesis y desarrollo final del embarazo, a velocidades tan altas como 900 ng de Treprostinil/kg/min (alrededor de 117 veces la velocidad de infusión inicial en humanos, basado en ng/m2 y alrededor de 16 veces la velocidad promedio obtenida en ensayos clínicos) no proporcionó evidencias de daño en el feto. En conejas gestantes, los efectos de infusión subcutánea continua de Treprostinil durante la organogénesis se limitaron a un aumento en la incidencia de variaciones en el esqueleto del feto (costilla completa bilateral o costilla rudimentaria derecha en la lumbar 1) asociado con toxicidad maternal (reducción en el peso corporal y consumo de alimento) a una velocidad de infusión de 150 ng de Treprostinil/kg/min (alrededor de 41 veces la velocidad de infusión inicial en humanos, basado en ng/m2 y 5 veces la velocidad promedio obtenida en ensayos clínicos). En ratas, la infusión subcutánea continua de Treprostinil desde la implantación hasta el final de la lactancia, a velocidad de hasta 450 ng de Treprostinil/kg/min, no afectó el crecimiento ni el desarrollo de las crías. Dado que los estudios en reproducción animal no siempre son pronóstico de la respuesta humana, Remodulin debería utilizarse durante el embarazo sólo si es manifiestamente necesario. Parto En los animales estudiados no se observaron efectos en el parto relacionados con el tratamiento con Treprostinil Sódico. Se desconoce el efecto de Treprostinil Sódico en humanos durante el parto. Lactancia materna Se desconoce si Treprostinil se excreta en la leche materna y si se absorbe sistémicamente tras la ingestión. Como muchos fármacos se excretan en la leche materna, Remodulin se debe administrar con precaución a las mujeres lactantes. Empleo pediátrico No se ha establecido la seguridad ni la eficacia en los pacientes pediátricos. Los estudios clínicos de Remodulin no incluyeron un número suficiente de pacientes de ≤16 años de edad para determinar si responden de manera distinta que los pacientes de mayor edad. En general, la selección de la dosis debe ser prudente. Empleo geriátrico Los estudios clínicos de Remodulin no incluyeron a un número suficiente de pacientes de 65 o más años de edad para determinar si responden de manera distinta que los pacientes más jóvenes. En general, la selección de la dosis para un paciente anciano debe ser prudente, reflejando la mayor frecuencia de disminución de la función hepática, renal o cardíaca y de enfermedad o tratamiento medicamentoso concomitante. REACCIONES ADVERSAS Los pacientes que recibieron Remodulin como infusión subcutánea informaron de un amplio abanico de reacciones adversas, muchas relacionadas posiblemente con la enfermedad subyacente (disnea, fatiga, dolor torácico, insuficiencia ventricular derecha y palidez). Durante los ensayos clínicos con infusión subcutánea de Remodulin, el dolor y la reacción en el sitio de infusión fueron las reacciones adversas más comunes entre los que fueron tratados con Remodulin. La reacción en el sitio de infusión se definió como cualquier reacción adversa local diferente al dolor o al sangrado/hematoma en el sitio de infusión e incluía síntomas como eritema, induración o exantema. Las reacciones en el sitio de infusión eran a veces serias y podían conducir al cese del tratamiento. Tabla 3: Porcentaje de sujetos que informaron de reacciones adversas en el sitio de infusión * basado en prescripciones de narcóticos, no en uso real ** los fármacos utilizados para tratar el dolor en el sitio de infusión no se distinguieron de los utilizados para tratar reacciones en el sitio. Otras reacciones adversas incluyeron diarrea, dolor mandibular, edema, vasodilatación y náuseas, y son generalmente consideradas como relacionadas con los efectos farmacológicos de Remodulin, administrado tanto por vía subcutánea como por vía intravenosa. Reacciones Adversas durante la administración prolongada La tabla 4 detalla las reacciones adversas que aparecieron con una incidencia de al menos un 3% y fueron más frecuentes en pacientes tratados con Remodulin que con placebo en estudios controlados en HAP. Tabla 4: Reacciones Adversas en Estudios Controlados de Pacientes con HAP, Presentes con una Incidencia de al Menos 3% y más Comunes en Remodulin que en Placebo Se incluyen todas las reacciones adversas reportadas (al menos 3%) excepto aquellas demasiado generales para ser informativas y aquellas no atribuibles al uso del fármaco, porque estaban asociadas al proceso que se estaba tratando o porque son muy comunes en la población tratada. Reacciones Adversas atribuibles al sistema de administración del fármacoNo existen informes de infección relacionados con el sistema de administración del fármaco en ensayos controlados de Remodulin administrado de forma subcutánea. Se notificaron 187 complicaciones del sistema de infusión en el 28 % de los pacientes (23% Remodulin, 33 % placebo); 173 (93 %) estuvieron relacionados con la bomba y 14 (7 %) con el equipo de infusión. Ocho de estos pacientes (4 Remodulin, 4 Placebo) informaron de reacciones adversas leves resultantes de complicaciones del sistema de infusión. Las reacciones adversas causadas por problemas con los sistemas de administración estuvieron clásicamente relacionadas ya fuera con síntomas de exceso de Remodulin (por ejemplo, náuseas) o con reaparición de los síntomas de HAP (por ejemplo, disnea). Las reacciones se resolvieron generalmente corrigiendo los problemas de la bomba del sistema de administración o del equipo de infusión, como por ejemplo sustituyendo la jeringa o la pila, reprogramando la bomba, o enderezando la línea de infusión retorcida. Los eventos adversos causados por problemas del sistema de administración no dieron lugar a inestabilidad clínica ni a un rápido deterioro. No existen estudios clínicos controlados con Remodulin administrado de forma intravenosa. Entre los sujetos (n=38) tratados durante 12 semanas en un estudio abierto, 2 pacientes padecieron infecciones del catéter o sepsis. Otras reacciones potencialmente relacionadas con el modo de infusión incluyeron edema del brazo, parestesias, hematoma y dolor. SOBREDOSIFICACIÓN Los signos y síntomas de sobredosis con Remodulin durante los ensayos clínicos son aumento en intensidad de los efectos farmacológicos limitantes de la dosis e incluyen rubor, cefalea, hipotensión, náuseas, vómitos y diarrea. La mayoría de los episodios fueron autolimitados y se resolvieron al reducir o suprimir la administración de Remodulin. En los ensayos clínicos controlados, siete pacientes recibieron cierto grado de sobredosis y durante el tratamiento abierto de seguimiento, otros siete pacientes recibieron una sobredosis; estos eventos se debieron a la administración accidental de una inyección intravenosa rápida de Remodulin, errores en la velocidad de administración programada en la bomba y a la prescripción de una dosis incorrecta. Solo en dos casos el exceso de administración de Remodulin produjo una alteración hemodinámica sustancial (hipotensión, amenaza de síncope). A un paciente pediátrico se le administraron accidentalmente 7,5 mg de Remodulin mediante un catéter venoso central. Los síntomas fueron rubor, cefalea, náuseas, vómitos, hipotensión y actividad epileptiforme con pérdida de la consciencia durante varios minutos. Posteriormente, el paciente se recuperó. Ante la eventualidad de una sobredosificación o ingestión accidental concurrir al Hospital más cercano o comunicarse con un Centro de Toxicología: • Hospital de Niños Ricardo Gutiérrez, Tel.: (011) 4962-6666/2247, • Hospital Pedro de Elizalde (ex Casa Cuna), Tel.: (011) 4300-2115, • Hospital Nacional Prof. Dr. Alejandro Posadas, Tel.: (011) 4654-6648 / 4658-7777. PRESENTACIÓN Remodulin se presenta en frascos-ampolla multidosis de 20 ml en las siguientes concentraciones de Treprostinil de 1,0 mg/ml; 2,5 mg/ml; 5,0 mg/ml y 10,0 mg/ml, en forma de soluciones estériles en agua para inyección, acondicionadas individualmente en un envase. Cada ml contiene Treprostinil Sódico equivalente a 1,0 mg/ml; 2,5 mg/ml; 5,0 mg/ml ó 10,0 mg/ml de Treprostinil. Los frascos-ampolla no abiertos de Remodulin son estables hasta la fecha indicada cuando se conservan entre 15 y 25 °C. Durante el uso, cada depósito individual (jeringa) de Remodulin no diluido puede ser administrado hasta 72 horas a 37 ºC. La solución de Remodulin diluido puede administrase hasta 48 horas a 37 ºC cuando se diluye a concentraciones tan bajas como 0,004 mg/ml en Agua Estéril para Inyección o Cloruro Sódico Inyectable al 0,9%. Cada frasco-ampolla individual de Remodulin deberá usarse dentro de un periodo no mayor de 30 días a partir del inicio de su utilización. Los medicamentos parenterales deben ser inspeccionados visualmente antes de su administración en busca de partículas y alteraciones del color, siempre que la solución y el envase lo permitan. Si aparece cualquiera de ellos, no se debe administrar Remodulin. • Envase conteniendo un frasco-ampolla de 20 ml conteniendo Treprostinil Sódico equivalente a 1,0 mg de Treprostinil por ml. • Envase conteniendo un frasco-ampolla de 20 ml conteniendo Treprostinil Sódico equivalente a 2,5 mg de Treprostinil por ml. • Envase conteniendo un frasco-ampolla de 20 ml conteniendo Treprostinil Sódico equivalente a 5,0 mg de Treprostinil por ml. • Envase conteniendo un frasco-ampolla de 20 ml conteniendo Treprostinil Sódico equivalente a 10,0 mg de Treprostinil por ml. Conservar el producto a una temperatura no mayor de 25 oC. No conservar en heladera. AL IGUAL QUE TODO MEDICAMENTO, REMODULIN DEBE SER MANTENIDO FUERA DEL ALCANCE DE LOS NIÑOS. Licenciadora: United Therapeutics Corporation, USA. Bajo Licencia de: Grupo Ferrer International S.A. Fabricado en: 927 South Curry Pike, Bloomington, IN 47403, USA. Importado, Acondicionado y Distribuido por: Laboratorios Bagó S.A. Ética al Servicio de la Salud Administración: Bernardo de Irigoyen Nro. 248 (C1072AAF) Ciudad Autónoma de Bs. As. Tel.: (011) 4344‑2000/19. Director Técnico: Juan Manuel Apella. Farmacéutico. Calle 4 Nro. 1429 (B1904CIA) La Plata. Pcia. de Buenos Aires. Tel.: (0221) 425‑9550/54. 960 082 B Especialidad Medicinal autorizada por el Ministerio de Salud. Certificado Nro. 52.150. Prospecto aprobado por la A.N.M.A.T. Disp. Nro. 7200/06.









