manual de uso - Masterlabor.com
Anuncio

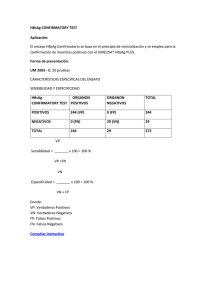
MANUAL DE USO Ensayo rápido para la detección cualitativa del antígeno de superficie de Hepatitis B (HBsAg) en suero o plasma. Solamente.para uso profesional de diagnóstico in vitro 9. RECOGIDA Y ALMACENAMIENTO DE MUESTRAS 1. USO PREVISTO La prueba rápida en casete HBVTOP®, es un inmunoanálisis cromatográfico rápido para la detección cualitativa del antígeno de superficie de Hepatitis B en suero o plasma. 2. SUMARIO La hepatitis viral es una enfermedad sistémica que afecta principalmente al hígado. La mayoría de los casos de hepatitis viral aguda, están causados por el virus de la Hepatitis A, el virus de la hepatitis B (HBV) y el virus de la Hepatitis C. El antígeno complejo encontrado en la superficie del VHB se llama HBsAg. Denominaciones anteriores incluyen el Antígeno Australia o Antígeno Au. La presencia de HBsAg en suero o plasma es indicativa de una infección de Hepatitis B activa, ya sea aguda o crónica. En una típica infección de Hepatitis B, el HBsAg se detectará entre 2 y 4 semanas antes de que el nivel de ALT se vuelva anormal y entre 3 y 5 semanas antes de la aparición de síntomas o ictericia. La prueba rápida en casete HBVTOP® es un ensayo para detectar cualitativamente la presencia de HBsAg en muestras de suero o plasma. La prueba utiliza una combinación de anticuerpos monoclonales y policlonales para detectar selectivamente niveles elevados de HBsAg en suero o plasma. ● La prueba rápida en casete HBVTOP® se puede realizar con suero o plasma. ● Separar el suero o plasma de la sangre lo antes posible para evitar hemólisis. Utilizar sólo muestras claras no hemolizadas. ● La prueba se debe realizar inmediatamente después de la recogida. No dejar las muestras a temperatura ambiente durante períodos prolongados. Las muestras de suero y plasma se pueden almacenar entre 2 y 8°C hasta 3 días. Para almacenamientos prolongados, las muestras se deben mantener por debajo de -20°C. ● Levar las muestras a temperatura ambiente antes de la prueba. Las muestras congeladas se deben descongelar completamente y mezclar bien antes de la prueba. Las muestras no se deben congelar repetidamente. ● Si las muestras se van a enviar, deben embalarse en cumplimiento con las normativas locales que se aplican al transporte de agentes etiológicos. 10. PROCEDIMIENTO 1. 2. 3. PRINCIPIO DE LA PRUEBA La prueba rápida en casete HBVTOP® es un inmunoensayo sándwich cualitativo, en fase sólida de doble locus, para la detección de HBsAg en suero o plasma. La membrana se encuentra tapizada con anticuerpos anti-HBsAg en la zona de la Línea de Test del casete. Durante la prueba, la muestra de suero o plasma reacciona con las partículas recubiertas con anticuerpos anti-HBsAg. La mezcla migra a lo largo de la membrana cromatográficamente por acción capilar para reaccionar con los anticuerpos anti-HBsAg fijados en la membrana y generar una línea de color. La presencia de esta línea coloreada en la región de prueba indica un resultado positivo, mientras que su ausencia indica un resultado negativo. Como control de procedimiento, siempre deberá aparecer una línea coloreada en la región de la Línea de Control, indicando que se ha agregado el volumen apropiado de la muestra y que se ha producido la migración en la membrana. 3. Retirar el dispositivo de test de la bolsita de aluminio sellada y utilizarlo lo antes posible. Se obtendrán mejores resultados si el ensayo se realiza inmediatamente después de abrir la bolsa de aluminio. Para muestras de suero o Plasma: Sostener el gotero en posición vertical y transferir 3 gotas de suero o plasma (aproximadamente 120 µL) al pocillo de muestra del dispositivo de ensayo e iniciar el temporizador. Ver la ilustración inferior. Esperar a que aparezca la línea coloreada. El resultado se debe leer en 15~30 minutos. No interpretar resultados después de 30 minutos. 3 gotas de suero/plasma 4. REACTIVOS El dispositivo de prueba contiene partículas con anti-HBsAg y anti-HBsAg fijado en la membrana. 5. MATERIALES SUMINISTRADOS ● Dispositivos de ensayo ● Goteros ● Manual de uso 11. INTERPRETACIÓN DE RESULTADOS POSITIVO: 6. MATERIALES NECESARIOS NO PROVISTOS ● Contenedores de recogida de muestra ● Centrífuga ● Cronómetro 7. CONSERVACIÓN Y ESTABILIDAD Almacenar los envases a temperatura ambiente o refrigerados entre 2 y 30° C. Los dispositivos son estables hasta la fecha de caducidad impresa en la bolsa sellada. Los casetes deben permanecer en la bolsa sellada hasta su uso. NO CONGELAR. No usar después de la fecha de caducidad. NEGATIVO: Aparece una línea coloreada en la Zona Control (C). No aparece ninguna línea coloreada aparente en la Zona Test (T). 8. PRECAUCIONES Por favor, leer toda la información de este folleto antes de realizar el ensayo. ● Solamente para uso profesional de diagnóstico in vitro. No utilizar después de la fecha de caducidad. ● La prueba debe permanecer en la bolsa sellada hasta su uso. ● Todas las muestras se deben considerar potencialmente peligrosas y manejarse igualmente como agente infeccioso. ● Los casetes usados, se deben desechar según la normativa local. * Aparecen dos líneas de color diferentes. Debe aparecer una línea coloreada en la Zona Control (C) y otra línea coloreada en la Zona Test (T). * Nota: La intensidad del color en la zona de la línea Test (T) variará dependiendo de la concentración de HBsAg presente en la muestra. Por lo tanto, cualquier tono de color en la zona Test (T) se debe considerar positivo. NO VÁLIDO: La línea Control no aparece. Las razones más probables de fallo en la línea control, son un volumen de muestra insuficiente o técnicas procesales incorrectas. Se debe revisar el procedimiento y repetir la prueba con un nuevo casete de ensayo. Si el problema persiste, deje de utilizar el kit de inmediato y póngase en contacto con su distribuidor local. MANUAL DE USO 12. CONTROL DE CALIDAD ● El test incluye un control del procedimiento. Una línea de color que aparece en la Zona Control (C) es el control interno del procedimiento. Se confirman el volumen de muestra suficiente y técnica procesal correcta. ● Con el kit no se suministran sueros de control; Sin embargo, se recomienda el uso de un control positivo (de 10ng/ml de HBsAg) y de un control negativo (de 0 ng/ml de HBsAg) como una buena práctica de laboratorio para confirmar el procedimiento del ensayo y verificar el rendimiento adecuado de la prueba. 13. LIMITACIONES DEL ENSAYO 1 2 3 4 La prueba rápida en casete HBVTOP® es solamente para uso profesional de diagnóstico in vitro. El ensayo se debe utilizar para la detección de HBsAg en las muestras de suero o plasma. A través de esta prueba cualitativa, no se pueden determinar valores cuantitativos ni concentraciones de HBsAg La prueba rápida en casete HBVTOP® solamente indica la presencia de HBsAg en la muestra y no se debe utilizar como criterio único para el diagnóstico de la infección viral de Hepatitis B. Como con cualquier prueba diagnóstica, se deben evaluar todos los resultados junto con otras evidencias clínicás disponibles para el médico. La prueba rápida en casete HBVTOP® no puede detectar menos de 1 PEI ng/ml de HBsAg en las muestras. Si el test es negativo y persisten los síntomas clínicos, se sugiere realizar pruebas de seguimiento adicionales usando otros métodos clínicos. Un resultado negativo en cualquier momento no excluye la posibilidad de infección de Hepatitis B. ► Reactividad cruzada La prueba rápida en casete HBVTOP® (suero/plasma) se ha ensayado con muestras positivas para HAMA, factor reumatoide (RF), HAV, sífilis, VIH, Helicobacter pylori, Mononucleosis infecciosa, CMV, rubéola, HCV, HEV y toxoplasmosis. Los resultados no mostraron ninguna reactividad cruzada. ► Substancias interferentes La prueba rápida en casete HBVTOP® (suero/plasma) se ha probado para evaluar la posible interferencia de muestras visiblemente hemolizadas y lipémicas. No se observó ninguna interferencia. Además, no se observó ninguna interferencia en muestras conteniendo hasta 2.000 mg/dL de hemoglobina, 1.000 mg/dL de bilirrubina y 2.000 mg/dL de albúmina sérica humana. 16. BIBLIOGRAFÍA 1. Blumberg, B.S. The Discovery of Australian Antigen and its relation to viral hepatitis. Vitro. 1971; 7: 223 SÍMBOLOS Pictogramas Significado Atención, ver instrucciones de uso 14. VALORES ESPERADOS Solo para diagnóstico in vitro La prueba rápida en casete HBVTOP® (suero/plasma) se ha comparado con uno de los principales ensayos comercial HBsAg EIA. La correlación entre estos dos sistemas es del 98%. 30° C 15. PRESTACIONES DEL ENSAYO 2° C Conservar entre 2 y 30 °C ► Sensibilidad La prueba rápida en casete HBVTOP® (suero/plasma) se ha probado con un panel de sensibilidad que va desde 0 hasta 300 ng/ml. Los 10 subtipos de HBsAg ofrecieron resultados positivos con el Kit. La prueba puede detectar 1PEI ng/ml de HBsAg en suero o plasma. Pruebas por kit ► Especificidad Los anticuerpos utilizados para la prueba rápida en casete HBVTOP® (suero/plasma) se desarrollaron contra la totalidad del antígeno aislado del virus de la Hepatitis B. También se probó la especificidad de la prueba rápida en casete HBVTOP® (suero/plasma) con cepas de laboratorio de Hepatitis A y Hepatitis C. Todos ellos dieron resultados negativos. Número de lote METODO Resultados HBVTOP® Positivo Negativo Resultados Totales INMUNOENZIMÁTICO Positivo Negativo 413 7 2 1.593 415 1.600 Caducidad Fabricante No reutilizable Resultados Totales 420 1.595 2.015 Código Sensibilidad relativa: 99.5% (95%IC*: 98.3%-100%) Especificidad relativa: 99.6% (95%IC*: 99.1%-99.8%) Precisión: 99.6% (95%IC*: 99.2%-99.8%) *Intervalos de Confianza ► Precisión Intra-ensayo: La precisión intraensayo se determinó mediante el uso de 15 repeticiones de tres muestras que contienen 0 ng/ml, 1 ng/ml y 5 ng/ml de HBsAg. Los valores negativos y positivos fueron correctamente identificado el 98% de las veces. Inter-ensayo: La precisión interensayo se determinó mediante el uso de las mismas tres muestras de 0 ng/ml, 1 ng/ml y 5 ng/ml de HBsAg en 15 ensayos independientes. Se evaluaron tres lotes diferentes de HBVTOP® durante un período de 3 meses usando muestras negativas, positivas bajas y positivas altas. Las muestras se identificaron correctamente el 98% de las veces. Directiva 98/79/CE Versión 2 –22/10/2013 ALLDIAG Fabricante 8, rue Ettoré Bugatti – CS 28006 67038 STRASBOURG Cedex - FRANCE Tél. : 03 88 78 80 88 - Fax : 03 88 78 76 78 www.alldiag.com – info@alldiag.com