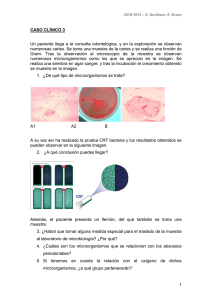
TESIS GERARDO Y MALU - Universidad Nacional de la
Anuncio

UNIVERSIDAD NACIONAL DE LA AMAZONÍA PERUANA FACULTAD DE FARMACIA Y BIOQUÍMICA “CALIDAD MICROBIOLÓGICA DE LA CORTEZA DE Cariniana decandra DUCKE (CINTA CASPI) USADA COMO INSUMO DE BEBIDAS HIDROALCOHÓLICAS DE USO ETNOTERAPÉUTICO EN LORETO” TESIS PARA OPTAR EL TÍTULO PROFESIONAL DE: QUÍMICO FARMACÉUTICO PRESENTADO POR: Bach. BARDALES CHÁVEZ, Gerardo Daniel. Bach. SUÁREZ SAAVEDRA, Malú Mabel. ASESORES: Q.F. SOSA AMAY, Frida Enriqueta Mgr. Q.F. NONATO RAMÍREZ Luis Domingo, Dr. IQUITOS- PERÚ 2015 1 “Calidad microbiológica de la corteza de Cariniana decandra Ducke (cinta caspi) usada como insumo de bebidas hidroalcohólicas de uso etnoterapéutico en Loreto” RESUMEN El presente estudio, tuvo como objetivo determinar la calidad microbiológica de la corteza Cariniana decandra Ducke (cinta caspi) usada como insumo de bebidas hidroalcohólicas de uso etnoterapéutico en Loreto. Se recolectaron muestras de cortezas, de ambos lados de la carretera Zungarococha –Llanchama desde el Km 4.7 al Km 11.4 en los caseríos Puerto Almendra y Nina Rumí, que luego de ser acondicionadas y conservadas en forma pulverizada, se sometieron a las pruebas de límites microbianos establecidos por la Farmacopea de los Estados Unidos (USP 35). Los resultados determinaron ausencia de Staphylococcus aureus y Salmonella spp en todas las muestras de la especie. De los 6 árboles muestreados de Cariniana decandra Ducke (cinta caspi), las muestras de cortezas del árbol 1, 3 y 4 son aceptadas como materia prima vegetal bioactiva por presentar los parámetros de calidad microbiológica exigidos por la Farmacopea USP 35 y adoptados por la DIGEMID de Perú. Palabras claves: Calidad microbiológica, recuento de aerobios mesófilos totales, plantas medicinales, Staphylococcus aureus, Pseudomona aeruginosa, Escherichia coli, Salmonella spp. 2 "Microbiological quality bark Cariniana decandra Ducke (tape caspi) used as input-alcoholic drinks etnoterapéutico use in Loreto" SUMMARY The present study aimed to determine the microbiological quality of the crust Cariniana decandra Ducke (caspi tape) used as input-alcoholic drinks etnoterapéutico use in Loreto. Samples of bark, on both sides of the road were collected Zungarococha -Llanchama from km 4.7 to km 11.4 in the villages Puerto Almendra and Nina Rumi, who after being upgraded and preserved in powdered form were subjected to microbial limits testing established by the US Pharmacopoeia (USP 35) .The results showed absence of Staphylococcus aureus and Salmonella spp in all samples of the species. 6 sampled trees Cariniana decandra Ducke (caspi tape), samples of bark of the tree 1, 3 and 4 are accepted as plant material bioactive to present the parameters of microbiological quality required by the Pharmacopoeia USP 35 and adopted by the DIGEMID of Peru. Keywords: Microbiological quality, total count of mesophilic aerobic, medicinal plants, Staphylococcus aureus, Pseudomonas aeruginosa, Escherichia coli, Salmonella spp. 3 DEDICATORIA A mi Dios, Quién supo guiarme por el buen camino, darme fuerzas para seguir adelante y no desmayar, enseñándome a encarar las adversidades y nunca desfallecer en el intento. A mis padres, Gonzalo y Estrella, por sus apoyo, consejos, amor y ayuda en los momentos difíciles. Me han dado todo lo que soy como persona para conseguir mis objetivos. A mi hermano Pedro por estar siempre presente, acompañándome a lo largo de mi carrera. A Gerardo quien ha sido y es mi motivación, inspiración y felicidad. A todos mis amigos que estuvieron siempre a lo largo de nuestra vida estudiantil; a ellos que siempre tuvieron una palabra de aliento en los momentos difíciles y que han sido incentivos de nuestras vidas. A Dios todo poderoso, Por ser mí guía, mi fortaleza y mi salvación en todos los momentos de mi vida. A mis padres María y Gerardo por el apoyo incondicional y enseñarme todo en la vida. A mis hermanos, familiares y amigos qué de una u otra forma me apoyaron durante mi formación profesional. A Malu, por estar conmigo en cada momento de mis días. 4 AGRADECIMIENTO Primero antes que nada, damos gracias a Dios, por estar con nosotros en cada momento de nuestras vidas, por fortalecernos, iluminarnos y acompañarnos durante todo el periodo de nuestro estudio. Al, Blgo. Pedro Marcelino Adrianzen Julca y al Ing. José David Urquiza Muñoz jefe del Laboratorio de Suelos- CIRNA – UNAP (Centro de Investigación de Recursos Naturales de la Amazonía) quien nos brindó la facilidad del ambiente necesario para la realización del presente trabajo de investigación. Un agradecimiento especial a la Q.F Frida Enriqueta Sosa Amay, Mgr. por la asesoría, paciencia, apoyo profesional, por aconsejarnos siempre, por ser nuestra mentora y amiga a la vez. Un agradecimiento especial al Q.F Luis Domingo Nonato Ramírez, Dr. por la asesoría y por sus sabios consejos durante la realización del proyecto. A los queridos catedráticos por transmitirnos sus diversos conocimientos y encaminarnos por el camino correcto para ser profesionales competentes capaces de afrontar los retos de la vida. 5 ÍNDICE DE CONTENIDO Introducción………………...…...……..…………………………………. Objetivos………………………………………………………………….. CAPÍTULO I 1. Marco teórico………………….………………………………………… 1.1. Antecedentes………………………………………………………… 1.2. Marco conceptual………..…………………..………………………. 1.2.1. Clasificación y descripción botánica de la especie…………….. 1.3. Calidad microbiológica……………………………….……………... 1.3.1. Métodos de identificación bacteriana.…………………………. 1.3.2. Bacilos entéricos………………………………………………... 1.3.3. Escherichia coli…………………………………………………. 1.3.4. Salmonella spp………………………………………………….. 1.3.5. Pseudomona aeruginosa……………………………………….. 1.3.6. Staphylococcus aureus…………………………………………. 1.3.7. Hongos…………………………………………………………… 1.3.7.1. Tipos de Hongos…………………………………………….. 1.4. Etnomedicina……………………………………………………….. 1.5. Bioseguridad………………………………………………………... 1.6. Medios de cultivo microbiológico………………………………….. 1.6.1. Condiciones generales para el cultivo de microorganismos…… 1.6.2. Tipos Básicos de medios de cultivo……………………………. 1.7. Definiciones Operacionales………………………………………… 1.7.1. Variable de estudio……………………………………………… 1.7.2. Indicadores………………………………………………………. 1.8. Operacionalizacion de variable…………………………………….. CAPÍTULO II 2. Metodología…...……..……………………...…………………………… 2.1. Tipo de Investigación.………………………………………………. 2.2. Diseño de la investigación………………………………………….. 2.3. Población y muestra……………………………...…….................. 2.3.1. Población……………………………………….……………...... 2.3.2. Muestra………………………………………….………………. 2.3.3. Criterios de inclusión y exclusión……………………………… 2.4. Técnicas e instrumentos. Pág. 9 11 12 12 12 16 16 17 17 19 20 22 24 25 27 28 30 31 39 40 42 49 49 49 50 51 51 51 51 51 51 51 51 52 6 2.4.1. Materiales e instrumentos…….………………………….............. 2.5. Procedimiento de Recolección de datos...…………………………… 2.5.1. Investigación etnobotánica…………..…………………………… 2.6. Investigación de patógenos………………………………….….......... 2.7. Análisis e interpretación de los datos………………………………… CAPÍTULO III 3. Resultados………………………………………………………………… 4. Discusión...……………………………………………………….….......... 5. Conclusiones…………………………………………….…………........... 6. Recomendaciones……….…………………………..…………………….. 7. Bibliografía………………………………………………………………... 8. Anexos…………………………………………………………………….. 52 53 53 53 60 61 61 64 66 68 69 74 INDICE DE TABLAS TABLA 1. Recuento total más probable por el método en tubos múltiples… Pág. 55 TABLA 2. Criterio de aceptación para la calidad microbiológica de hongos y levaduras…………………………………………………………………. 56 TABLA 3. Características morfológicas de Staphylococcus aureus en medio Agar selectivo…………………………………………………….….. 57 TABLA 4. Características morfológicas de Pseudomona aeruginosa en medio Agar selectivo y de diagnóstico………………………………………. 57 TABLA 5. Características morfológicas de salmonella spp. En medio Agar selectivo……………………………………………………………………… 58 TABLA 6. Características morfológicas de Escherichia coli en medio Agar MacConkey………………………………………………………………….. 59 TABLA 7. Características de resultados de pruebas bioquímicas para, Salmonella spp y E. coli……………………………………………………... 60 TABLA 8.Parámetros de límites microbianos según farmacopea USP para ingredientes y productos botánicos…………………………………………. 60 TABLA 9.Determinación de microorganismos aerobios mesófilos en Cariniana decandra………………………………………………………………… 61 7 TABLA 10. Determinación de hongos y levaduras combinados en Cariniana decandra…………………………………………………………………. 61 TABLA 11. Determinación de hongos y levaduras combinados en Cariniana decandra………………………………………………………………… 62 TABLA 12. Determinación de Staphylococcus aureus en Cariniana decandra……………………………………………………………………………… 62 TABLA 13. Determinación de Pseudomona aeruginosa en Cariniana decandra…………………………………………………………………………....... 63 TABLA 14. Determinación de Salmonella spp. En Cariniana decandra………………………………………………………………..................... TABLA 15. Determinación de Escherichia coli en Cariniana decandra...................................................................................................... 63 64 ÍNDICE DE ANEXOS ANEXO 1: Determinación de Patógenos: Recuento Total De Aerobios Mesófilos (NMP). 74 ANEXO 2: Prueba para Staphylococcus aureus y Pseudomonas aeruginosa 75 ANEXO 3: Prueba para determinar la ausencia de Salmonella spp. 75 ANEXO 4: Prueba para determinar la ausencia de Escherichia coli. 76 ANEXO 5: Recuento total combinado de Hongos y Levaduras. 76 ANEXO 6: Pruebas de Identificación para bacterias aisladas en corteza de 77 Cariniana decandra (cinta caspi). ANEXO 7: Pruebas de Identificación para bacterias aisladas en corteza de 78 Cariniana decandra (cinta caspi). ANEXO 8: Certificación de la Planta en Investigación. 85 ANEXO 9: Mapa con los puntos de colecta de la especie Cariniana 86 decandra (cinta caspi) en el área de intervención del estudio. 8 INTRODUCCIÓN La organización mundial de la salud ha mencionado que la medicina tradicional cumple un papel importante en el mantenimiento y conservación de la salud, así como en la prevención, diagnóstico y tratamiento de la enfermedad, en base a conocimientos teóricos, habilidades y prácticas, creencias y experiencias inherentes a las diferentes culturas, ya sean explicables o no; por ello ha recomendado introducir recursos medicinales tradicionales, sobre bases de “seguridad, eficacia y calidad” en los sistemas de salud, por lo cual requieren desarrollar investigaciones básicas que permitan disponer del respaldo científico necesario para su uso como recurso terapéutico o como insumo (1). Esta investigación contribuye a conocer la calidad microbiológica de la corteza de Cariniana decandra Ducke (cinta caspi) usada como insumo de bebidas hidroalcohólicas de uso etnoterapéutico en Loreto, de gran demanda en el mercado local por sus propiedades curativas. La calidad microbiológica que debe tener un producto, abarca dos puntos de vista: sanitario y comercial. El aspecto comercial implica pasos ordenados dentro de la cadena de producción, donde se pueden presentar inconvenientes que dan como resultado, un producto con características distintas a las deseadas tanto para el consumidor como para la empresa. La garantía de esta calidad se basa en el control de la presencia y multiplicación de los microorganismos en el nicho ecológico peculiar constituido por el sustrato que proporciona el producto y por el tipo de ambiente en que se conserva o mantiene (2). En muchos países de Latinoamérica se usan productos de plantas medicinales y preparaciones fitofarmacéuticas, donde mencionan los criterios establecidos para determinar la autenticidad, pureza y calidad de las materias primas. Los países de menor desarrollo, necesitan mayor control sanitario para garantizar que los productos sean de calidad (3). En el Perú y más aún en la región Loreto la cadena de distribución y comercialización de plantas de uso medicinal se desarrolla en condiciones poco sanitarias, los insumos vegetales no pasan por un control de calidad, ya que su utilización artesanal es empírica, por lo que no hay estudios que garanticen la 9 seguridad, eficacia y calidad (4) de los productos preparados a partir de insumos vegetales. La población de Loreto utiliza aproximadamente 500 plantas medicinales, 134 de ellas en forma comercial en el Pasaje Paquito de Iquitos (5) . Estas plantas, en forma desecada contribuyen al cuidado de la salud y a la generación de ingresos económicos en el poblador amazónico. De estas plantas actualmente son más utilizadas 19 especies vegetales con valor comercial, el potencial de la comercialización de plantas medicinales es todavía muy grande, pero el manejo no adecuado actual de estos recursos naturales puede llevar a una situación crítica (5). La corteza de Cariniana decandra Ducke (cinta caspi, tahuari) (6), es una especie que crece en forma silvestre en el bosque primario no inundable, ocasionalmente en bosques húmedos de “bajial”, sobre suelos casi siempre arcillosos o arcillo arenosos (7) , es muy requerida por la población loretana como parte de preparados hidroalcohólicos como ejemplo: “Levántate lázaro”, “Siete veces sin sacar”. La norma peruana dada por el Ministerio de Salud, en la Ley 29459, capítulo tres para insumos vegetales de productos de uso terapéutico denomina entre otros análisis la determinación de contaminantes microbianos, a fin de establecer la calidad microbiológica de los insumos vegetales bioactivos (8), por lo que el presente estudio tuvo como objetivo determinar la calidad microbiológica de la corteza de Cariniana decandra Ducke (cinta caspi) usada como insumo de bebidas hidroalcohólicas de uso etnoterapéutico en Loreto.” 10 OBJETIVOS Objetivo General. Determinar la calidad microbiológica de la corteza de Cariniana decandra Ducke (cinta caspi) usada como insumo de bebidas hidroalcohólicas de uso etnoterapéutico en Loreto. Objetivos Específicos. Determinar el recuento de microorganismos aerobios mesófilos en la corteza de la especie de uso medicinal Cariniana decandra Ducke (cinta caspi) en Loreto. Determinar la presencia/ausencia de Enterobacterias: Escherichia coli y, Salmonella spp, en la corteza de la especie de uso medicinal Cariniana decandra Ducke (cinta caspi) en Loreto. Determinar la presencia/ausencia de Pseudomona aeruginosa, en la corteza de la especie de uso medicinal Cariniana decandra Ducke (cinta caspi) en Loreto. Determinar la presencia/ausencia de Staphylococcus aureus en la corteza de la especie de uso medicinal Cariniana decandra Ducke (cinta caspi) en Loreto. Determinar el recuento de levaduras y hongos en la corteza de la especie de uso medicinal Cariniana decandra Ducke (cinta caspi) en Loreto. 11 CAPITULO I MARCO TEÓRICO 1.1 ANTECEDENTES Los estudios Cury G, Tomazello M. (2011), realizaron el estudio morfoanatómica y la correcta identificación de las plantas medicinales de la especie Lecythidaceae y Fabaceae que son esenciales para el control de calidad de los medicamentos a base de hierbas. En este trabajo se caracterizó la anatomía de la madera con el fin de identificar seis especies arbóreas con potencial medicinal. Las muestras de madera fueron extraídos por el método no destructivo de la corteza de los árboles de las especie estudiadas que se desarrollan en las áreas de conservación. En el laboratorio se procesaron las muestras de madera para el análisis microscópico de la madera, aplicando las metodologías para los estudios de anatomía. Los resultados mostraron que el parénquima axial fue el parámetro anatómico más eficaz para la distinción de las especies a través del análisis de su madera (9). Janovik V, Boligon A, Bandeira B, Athayde M. (2011), determinaron el potencial antioxidante de Cariniana domestica usando el ensayo de DPPH, se midieron los fenólicos totales usando Ciocalteau folin y flavonoides totales utilizando cloruro de aluminio. Se realizó un análisis de HPLC / DAD usando el sistema de gradiente. Las hojas de C. domestica exhiben alta actividad antioxidante, así como un gran contenido de compuestos fenólicos y flavonoides. El IC 50 obtenido con el ensayo DPPH varió de fenoles totales y contenido de flavonoides, la especie C. domestica exhibió un alto potencial antioxidante, siendo acetato de etilo la fracción más activa. Varios compuestos fenólicos bioactivos fueron identificados y cuantificados en esta fracción (10). Costa D, Alves E, et al. (2011), determinaron la actividad antifúngica de Anadenanthera colubrina, Artemisia annua, Cariniana estrellensis y Ficus carica frente al hongo Alternaria alternata que afecta los frutos de tangor murcott, probaron extractos de plantas a partir de hojas, cortezas, flores y tallos, in vitro e in vivo, que proporcionan un método alternativo para controlar esta enfermedad cuyo control se 12 basa en fungicidas químicos, los resultados obtenidos indicaron que el extracto más prometedor se obtuvo de Anadenanthera colubrina, que redujo la enfermedad en las frutas de tangor murcott a los niveles obtenidos con fungicidas comerciales. Artemisia annua, Cariniana estrellensis y Ficus carica presentaron moderada actividad antifúngica in vitro (11). Santos E, et al. (2010), evaluaron la actividad antiinflamatoria, antinociceptiva y efectos antipiréticos del extracto metanólico de corteza Cariniana rubra (EMCR) utilizando animales de experimentación. La actividad antiinflamatoria de EMCR fue probado en carragenina de rata y el edema de pata inducido por dextrano. Las actividades antinociceptivos y antipiréticas fueron evaluados utilizando ácido acético, formalina y pruebas de placa caliente en ratones, así como pirexia inducida por levadura de cerveza en ratas. El extracto inhibe la carragenina y edema inducido por dextrano, lo que causa la reducción del volumen de exudado y de la migración de leucocitos en la pleuresía inducida por carragenina y de la permeabilidad vascular inducida por el aumento de ácido acético. El EMCR inhibe la nocicepción en el retorcimiento inducido por ácido acético y en la segunda fase del ensayo de formalina, y la disminución de la temperatura rectal. Fue, sin embargo, inactivo contra la nocicepción térmica. Se puede presumir que EMCR causó su efecto mediante la inhibición de la liberación y / o acción de mediadores inflamatorios diferentes (12). Cruz P. (2009), realizó el estudio de control de calidad microbiológico del gel antimicótico de Matricaria chamomilla (Manzanilla), Aristiguietia glutinosa (Matico) y Ambrosia arborescens (Marco), nos indican que utilizaron los métodos microbiológicos establecidos por la USP 28, dando como resultado para el recuento total de mesófilos aeróbicos, levaduras y hongos ningún tipo de crecimiento microbiológico en el producto (13). Inchaustegui R, et al (2008), evaluaron la eficacia del extracto acuoso liofilizado de la corteza de Cariniana decandra Ducke (cachimbo) bajo el sistema terapéutico de fitomedicamentos en microdosis, vía intramuscular. El estudio comparó dos tipos de tratamiento: 1 convencional constituido por fármacos bronco dilatadores beta 13 adrenérgicos y esteroides; 2, fitoterapéutico, constituido por el extracto acuoso liofilizado de la corteza de Cariniana decandra Ducke (cachimbo). La eficacia clínica se evaluó por el número de episodios de crisis asmática que presentaron los pacientes durante y al final del tratamiento. Se ingresaron un total de 40 voluntarios, agrupados en dos tratamientos: convencional (20 sujetos) y fitoterapéutico (20 sujetos). El tiempo de evaluación de la eficacia fue de 30 días posteriores a la aplicación de la primera dosis de los tratamientos. Conclusión. El tratamiento fitoterapéutico demostró superior eficacia frente al tratamiento convencional, al disminuir el número de los episodios de crisis asmática (14). Scott A, Chi-Hua T, Chi-Chih W, Bodil C, Arne A (2007), confirmaron que la Lecythidaceae comprende una familia pantropical mejor conocido por las semillas comestibles de la castaña (Bertholletia excelsa) y el árbol bala de cañón (Couroupita guianensis), que se planta como una curiosidad botánica en jardines subtropicales y tropicales. En Además, las especies de la familia son a menudo entre los más comunes en los bosques neotropicales, especialmente en la cuenca del Amazonas, pero concluyen que Cariniana, Lecythis y Eschweilera no son monoyphyletic. Debido a que la posición de la monotípico Bertholletia excelsa en relación con los otros géneros zygomorphic (15). Ramalho P. (2003), confirmó que las utilidades de la Cariniana estrellensis de uso terapéutico son numerosos, incluyendo en la medicina popular en forma de té, es un poderoso astringente desinfectante y tiene gran poder y por lo tanto se recomienda para las inflamaciones de las mucosas y faringitis. También es útil en el tratamiento de la diarrea, dolor de garganta y lavados vaginales (16). Nina E. (2001), realizó el tamizaje fitoquímico de la corteza de Cariniana decandra, lo cual evidencio la presencia de los siguientes metabolitos secundarios: alcaloides, cumarinas, azúcares reductores, saponinas, fenoles y taninos, flavonoides, principios amargos y astringentes, además de glicósidos (17). Nonato L, Ríos F. (2001), realizaron estudios farmacológicos y toxicológicos de la corteza de Cariniana decandra en ratones albinos machos y hembras, inoculando el extracto liofilizado de esta corteza, obtuvieron una DL50 mayor a 2000 mgkg-1; 14 aplicando 100 mgkg-1 del liofilizado durante 30 días, se incrementó los niveles de creatinina, fosfatasa alcalina y linfocitos, manteniéndose normales los niveles de glucosa, colesterol, triglicéridos y hematocrito respecto al basal (18). Cerruti T. (2001), determino las principales características anatómicas de la Cariniana decandra que está definido por una conformación arbórea alcanzando más de 40m de altura; hojas simples alternas; inflorescencia con flores sésiles de corola amarillenta; frutos pixidios con opérculos cónicos y semillas aladas (19). Babilonia C. (2001), realizó el estudio de control de calidad microbiológico del tahuari y capirona, analizando contaminantes como mohos, levaduras, hongos y bacterias, en los resultados hay presencia de estos contaminantes en la raíz y tallo de tahuari y hojas de capirona. Sin embargo afirma que se encuentran dentro del rango permisible aceptado por la Organización Mundial de la salud para el consumo humano (20). Betancourt J, Ríos F, Inchaustegui R, Nina E, Cerruti T, Villacrés J. (2000), determinaron el potencial genotóxico del extracto acuoso liofilizado de las plantas medicinales de la amazonia peruana (Mutingia calabura, Dioscorea bulbifera, Uncaria tomentosa, Dracontium loretense, Mansoa alliacea, Cariniana decandra, y Bixa orellana), por medio de los ensayos in vivo (inducción de micronúcleos en medula ósea de ratón y anomalías de la cabeza del espermatozoides de ratón), administrándose los extractos por vía oral. Los resultados mostraron ausencia de citoxicidad y de genotoxicidad de los extractos evaluados en el ensayo de inducción de micronúcleos en medula ósea de ratón Dioscorea bulbifera, Mansoa alliacea, Cariniana decandra mostraron disminución significativa del porcentaje de micro núcleos en los eritrocitos policromáticos, como indicadora de una posible actividad antimutagenica, los extractos evaluados en el ensayo de cellas germinales no mostraron actividad citotóxica ni genotóxica (21). Ramírez L. (1999), realizó el estudio de control de calidad microbiológico de Aspidosperma nitidum Benth “remo caspi” y Kclusia rosea Jacq. “renaquilla”. Analizando contaminantes como mohos, levaduras, hongos y bacterias, en los 15 resultados no se ha podido observar infestación alguna en la obtención de extractivos por el método de maceración en solución hidroalcohólicas (22). 1.2. MARCO CONCEPTUAL. 1.2.1 CLASIFICACIÓN Y DESCRIPCIÓN BOTÁNICA DE LA ESPECIE. Cariniana decandra Ducke (cinta caspi) Reino Plantae División Magnoliophyta Clase Magnoliopsida Orden Ericales Familia Lecythidaceae Género Cariniana Especie decandra Nombre Científico Cariniana decandra Ducke Nombres comunes: cinta caspi, papelillo caspi, cachimbo, cachimbo caspi, cerú, tahuari (6,7). a) Descripción botánica: Árbol dominante; altura total 35 m.; altura comercial 25 m. y Dap 0.80 m. Base tenuemente abultada. Fuste recto, cilíndrico, algunas veces de sección cuadrada; corteza externa levemente fisurada, ritidoma leñoso, desprendible en placas rectangulares; la corteza interna se desprende en láminas largas y delgadas. Ramita terminal orbicular; hojas simples y alternas. Inflorescencia: panículas terminales. Fruto: pixidio alargado en forma de cachimbo. Semillas pequeñas con prolongación membranosa (7). b) Distribución: Esta especie crece en la amazonía de Perú y Brasil. En el Perú se le encuentra en el Departamento de Loreto (7). 16 c) Datos ambientales: Bosque primario no inundable, ocasionalmente en bosques húmedos de “bajial”, sobre suelos casi siempre arcillosos o arcillo arenosos, de topografía plana a ondulada (7). d) Compuestos presentes: Alcaloides, cumarinas, azúcares reductores, saponinas, fenoles y taninos, flavonoides, principios amargos y astringentes, además de glicósidos (17). e) Usos y propiedades terapéuticas: Tiene propiedades Asmáticas, antimutagenica, antifúngica, astringente, antiinflamatoria y es usado en caso de diarreas (11, 12, 14, 16). 1.3. CALIDAD MICROBIOLÓGICA. La calidad microbiológica es un elemento de evaluación de la satisfacción de los requisitos microbiológicos que debe tener un producto, tanto desde el punto de vista sanitario como comercial. Para alcanzar la calidad microbiológica es necesario aplicar pasos ordenados a través de la cadena de producción. A lo largo de esa cadena pueden presentar inconvenientes que pueden llevar a obtener un producto que tengan características muy distintas a las esperadas. Por esa razón, para garantizar la calidad es importante tener en cuenta que este se basara en el control de la presencia y multiplicación de los microorganismos ya que factores como el sustrato proporcionado como el producto, el tipo de ambiente, temperatura, humedad relativa entre oros pueden ocasionar su presencia (2). 1.3.1. Métodos de identificación bacteriana. Actualmente, la identificación bacteriana se realiza por medio de métodos convencionales, basados en las características fenotípicas, puesto que su realización y coste los hace más asequibles. Los métodos genotípicos suelen reservarse para las bacterias que no se pueden identificar con métodos convencionales. Los esquemas tradicionales de identificación fenotípica bacteriana se basan en las características observables de las bacterias, como su morfología, desarrollo, y propiedades bioquímicas y metabólicas. El cultivo, 17 cuando es factible, continua siendo el método diagnóstico de elección; permite el aislamiento del microorganismo implicado, su identificación, el estudio de sensibilidad a los antimicrobianos y facilita la aplicación de marcadores epidemiológicos. En el cultivo es esencial la correcta elección del medio de crecimiento y las condiciones de incubación. En el proceso de identificación bacteriana tradicional, la experiencia del microbiólogo es fundamental para la elección de una prueba o varias pruebas de forma secuencial, en función de la fiabilidad de las mismas, del género o de la especie bacteriana que se pretende identificar, del origen del aislado bacteriano, así como del coste de las mismas. Los laboratorios deben elaborar y realizar un proceso de identificación normalizado en su actividad diaria, que utilice de forma secuencial o simultánea un conjunto de pruebas cuyo propósito final sea la identificación del microorganismo a nivel de género y especie y que incluya la mayoría de las bacterias desde el punto de vista infeccioso (23). 1.3.1.1. Identificación. a) Características microscópicas: El estudio microscópico en fresco y tras tinción revela la forma, la manera de agruparse, la estructura de las células y su tamaño. Las tinciones son el primer paso, y ocasionalmente el único, para la identificación bacteriana. Las tinciones más utilizadas e imprescindibles son la del azul de metileno y la de Gram. La tinción de Gram es, a menudo, la primera y única herramienta de la que nos servimos para hacer un diagnóstico provisional en el proceso de identificación de la mayoría de las bacterias teniendo en cuenta también el tipo de muestra y el diagnóstico presuntivo del proceso infeccioso (23). b) Características macroscópicas: La morfología de las colonias es fundamental en la identificación preliminar y para la diferenciación de los microorganismos. Para la observación morfológica es preferible examinar colonias de cultivos frescos crecidas en medios no selectivos. En este paso de la identificación es muy importante el 18 aislamiento de las bacterias en cultivo puro ya que esta deberá estar compuesta por un solo tipo de microorganismos y procederá de una única célula. Las colonias de una única especie, cuando crecen en medios específicos y bajo condiciones idóneas se describen por sus características de tamaño, forma, consistencia, y a veces por su color. El tamaño de las colonias bacterianas es generalmente uniforme entre una misma especie. Por ejemplo, las colonias de estreptococos tienen un tamaño más pequeño que las de los estafilococos y las enterobacterias. La forma está determinada por los bordes y el grosor de la colonia. El borde puede ser liso o rugoso e irregular; la colonia, abultada o plana. La textura de la colonia es también importante. Puede variar desde seca a viscosa, con superficie lisa o granular. Algunos microorganismos producen una colonia pigmentada, lo que puede ser de ayuda en el proceso de identificación (ejemplo: Pseudomonas aeruginosa (pigmento verde), Serratia marcescens (pigmento rojo) aunque en una misma especie puede haber cepas no pigmentadas (23). c) Hemolisis. Algunas bacterias producen hemolisinas que causan la lisis de los hematíes en medios que contienen sangre. Esta hemolisis puede ser beta (zona clara alrededor de la colonia) o alfa (halo de color verdoso alrededor de la colonia) (23). 1.3.2. Bacilos entéricos. La familia Enterobacteriaceae constituye un grupo grande y heterogéneo de bacterias gramnegativas. Reciben su nombre por la localización habitual como saprofitos en el tubo digestivo, aunque se trata de gérmenes ubicuos, encontrándose de forma universal en el suelo, el agua y la vegetación, así como formando parte de la flora intestinal normal de muchos animales además del hombre (24). Los miembros de la familia Enterobacteriaceae son microorganismos con forma de bastón, por lo general de 1-3 μm de largo y 0,5 μm de diámetro (24). 19 Se caracterizan, desde el punto de vista microbiológico por ser bacterias no esporulados con crecimiento en aerobiosis y anaerobiosis ósea, son anaerobios facultativos; que reducen los nitratos a nitritos salvo algunas excepciones; que fermentan la glucosa con o sin formación de gas; muestran negatividad a la prueba de la oxidasa; no aumenta su crecimiento en un medio hipertónico y pueden ser móviles, dependiendo de la presencia o no de flagelos perítricos, o inmóviles. Son organismos gram negativos que poseen una membrana interna (citoplasmática), una cubierta de peptidoglicano que la rodea, y una compleja membrana externa (pared celular) que comprende la cápsula y que contiene lipopolisacáridos y porinas (canales para la penetración de antibióticos y nutrientes). Poseen además una serie de factores de virulencia que son esenciales para la producción de los diferentes síndromes clínicos (24). La familia Enterobacteriaceae consta de varios géneros: Escherichia, Shigella, Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Morganella, Providencia, Salmonella, Yersinia, Edwardsiella, Citrobacter (25). 1.3.3. Escherichia coli: Escherichia coli es el microorganismo de vida libre que mejor se ha estudiado. Estas bacterias pueden ser móviles (la mayoría) o inmóviles, la mayor parte de ellas fermentan la lactosa y son capaces de producir indol a partir de triptófano (24) . Clasificación: a) Escherichia coli enterotoxígeno. Es una de las causas más frecuentes de deshidratación por diarrea en niños de menos de dos años y es la principal causa de la diarrea del viajero, que en general se desarrolla en un individuo por lo demás sano proveniente de un país industrializado que visita regiones tropicales o subtropicales caracterizadas por condiciones de higiene deficientes. En general, los síntomas tienden a ser leves, con diarrea acuosa. Ocasionalmente los síntomas pueden ser más graves, con fiebre, escalofríos y vómitos. La entero toxina estimula la secreción masiva de 20 líquido por las células mucosas. Se supone que la ausencia de gastroenteritis entre los residentes adultos de áreas asociadas a la diarrea del viajero se debe a su exposición previa a estos antígenos de colonización y al desarrollo de una inmunidad humoral apropiada (24). b) Escherichia coli enteropatógeno. Es una causa importante de diarrea en neonatos en los países subdesarrollados, causando enfermedad muy raramente en adultos en el mundo desarrollado. Producen una lesión típica en la mucosa, con la formación de microcolonias y la pérdida de las microvellosidades adyacentes. La patogenia incluye tres pasos: a) adherencia de los microorganismos a los enterocitos; b) inducción de una señal de transducción en los enterocitos y c) desarrollo de adherencia íntima con los enterocitos. Clínicamente se caracteriza por producir diarrea acuosa con más o menos fiebre o vómitos. El diagnóstico de infecciones por E. coli entero patógena (ECEP) radica en la detección de los genes codificadores de los factores de virulencia específicos mediante el uso de sondas de ADN o PCR. Para su prevención son diversos los estudios que han demostrado el importante papel de la lactancia materna en los primeros seis meses de vida (24). c) Escherichia coli enterohemorrágica y otras cepas de Escherichia coli productoras de toxina Shiga. Estas cepas producen toxinas de tipo Shiga (también denominadas vero toxinas) que consisten en citotoxinas que inducen la muerte de la célula huésped. Las cepas que producen toxinas Shiga pueden causar enfermedad de grado variable como diarrea acuosa, diarrea sanguinolenta, colitis hemorrágica, síndrome hemolítico urémico (SHU) y muerte. Entre las cepas de E. coli que generan toxinas Shiga (ECTS), aquellas que comparten con las cepas de ECEP la capacidad para provocar el efecto de fijación y borramiento codificado por la isla de patogenicidad LEE se conocen como E. coli entero hemorrágicas (ECEH). Las cepas de ECEH, sobre todo las que pertenecen al serotipo O157:H7, han sido responsables 21 de grandes brotes de infección con tasas más elevadas de complicaciones. La ausencia frecuente de fiebre y la aparición de hematoquecia franca pueden hacer que se consideren diagnósticos no infecciosos como la enfermedad inflamatoria intestinal. El SHU es una complicación grave que se ha descrito asociada con algunos brotes de estas cepas (serotipo O157:H7), apareciendo en un 5-10% de personas durante los brotes de ECEH (24). d) Escherichia coli enteroagregativo. Debe su nombre a la capacidad para agregarse en el cultivo en medio celular. Puede considerarse una verdadera infección emergente. Los estudios han relacionado las cepas de E. coli enteroagregativa (ECEA) con diarrea aguda y crónica en los países en vías de desarrollo y diarrea aguda en países desarrollados. Se ha descrito de forma excepcional como causa de diarrea del viajero y, con mayor frecuencia, de diarrea persistente en sujetos infectados por el virus de la inmunodeficiencia humana (VIH). La confirmación diagnóstica requiere que se realicen ensayos de adhesión en cultivos tisulares. Es difícil asegurar que una cepa de ECEA aislada en un paciente con diarrea sea la causa del cuadro, porque también se encuentran en pacientes asintomáticos (24). 1.3.4. Salmonella spp. Salmonella, en el ámbito mundial, está asociada con mucha frecuencia a las enfermedades diarreicas, las cuales continúan siendo una de las causas más importantes de morbilidad y mortalidad sobre todo en lactantes, niños y ancianos. Se ha estimado que en Asia, África y Latinoamérica, dependiendo de factores socioeconómicos y nutricionales, la probabilidad de que un niño muera por enfermedad diarreica antes de los 7 años pueda llegar al 50% (26). a) Morfología. Los microorganismos del género Salmonella son bacilos, Gram negativos, anaerobios facultativos, pertenecientes a la familia Enterobacteriaceae. Su tamaño oscila de 0,3 a 1 um x 1,0 a 6,0 um. Son móviles debido a la 22 presencia de flagelos perítricos, a excepción de S. gallinarum y S. pullorum. Salmonella (26). b) Clasificación: Se describen dos especies: S. entérica y S. bongori, donde la primera a su vez se subdivide en seis subespecies: entérica, salamae, arizonae, diarizonea, houtenae e indica; Salmonella entérica subespecie entérica representa 99% de los serotipos aislados, siendo estos últimos determinados por los antígenos somáticos (O), flagelares (H) y capsulares o de superficie (Vi). Es así como se describen más de 2500 serotipos o serovares de este género (Ejemplo: Salmonella entérica subespecie entérica serotipo enteritidis o su abreviatura científicamente aceptada, Salmonella enteritidis) (27). c) Modo de trasmisión: La vía de transmisión es la fecal-oral, a través de aguas contaminadas no higienizadas, alimentos manipulados por portadores, ingestión de crustáceos contaminados o vegetales regados con aguas contaminadas (27) . d) Sintomatología clínica: La salmonelosis se presenta en términos generales, dentro de dos espectros clínicos: el primero, la fiebre entérica más conocida como fiebre tifoidea, caracterizada por ser un cuadro febril sistémico cuyos agentes etiológicos son S. typhi y S. paratyphi. A los 10 días de evolución de la enfermedad pueden aparecer hemorragias y perforación intestinal. El segundo, la gastroenteritis, caracterizada por síntomas como dolor abdominal, malestar general, vómito, diarrea y en algunos casos fiebre, frecuentemente relacionado a previo consumo de alimentos contaminados de origen animal, es importante tener en cuenta que en los pacientes adultos inmunocomprometidos con infección por Salmonella no tifoidea, existe mayor mortalidad relacionada con bacteriemia recurrente (28). 23 1.3.5. Pseudomona aeruginosa Constituye uno de los microorganismos más importantes y problemáticos en las bacteriemias por gramnegativos, causante del 10% a 20% de ellas. Se presenta con más frecuencia en pacientes inmunodeprimidos con largos periodos de hospitalización, sometidos a diversas manipulaciones, con antecedentes de infecciones graves y uso previo de antibióticos de amplio espectro. Produce una mortalidad del 30% al 40%, fundamentalmente en las primeras 24 a 48 horas de su inicio, sobre todo en relación con el foco pulmonar y el tratamiento antimicrobiano inadecuado (29). a) Identificación: Pseudomonas aeruginosa es un bacilo Gram negativo, no fermentador, que se comporta básicamente como un patógeno nosocomial oportunista. Sus mínimos requerimientos nutricionales, su tolerancia a una amplia variedad de condiciones físicas y su resistencia intrínseca a un gran número de antibióticos, explican su papel ecológico como un importante y eficaz patógeno intrahospitalario. Aunque se ha detectado como parte de la flora normal corporal, rara vez causa enfermedad en individuos sanos (30) . b) Patogenia: En la mayoría de los casos, la infección comienza con alguna alteración de los mecanismos de defensa del huésped; esto puede involucrar la disrupción en la integridad de barreras físicas como catéteres urinarios, catéteres intravenosos, quemaduras extensas de piel o tubos endotraqueales que facilitan la colonización bacteriana. Por otro lado, hay otras situaciones específicas del huésped que comprometen los mecanismos de defensa específicos, tales como la neutropenia, la inmunosupresión iatrogénica o adquirida y las patologías que cursan con deterioro del sistema inmunológico como cáncer, desnutrición y diabetes, que también son factores de riesgo para la infección (30). 24 c) Manifestaciones clínicas: Puede provocar infecciones graves como: neumonía, infecciones del tracto urinario y bacteriemia. Estas infecciones suelen ser difíciles de tratar debido a la resistencia intrínseca que presenta P. aeruginosa y a su extraordinaria capacidad de adquirir mecanismos de resistencia (31). 1.3.6. Staphylococcus aureus Son cocos Gram positivos, catalasa positiva y el diamino ácido en el peptidoglicano es la L-lisina; posee numerosos factores de virulencia, puede convivir con el huésped humano formando parte de su flora normal sin causar ningún daño, pueden ser de forma endógena (32). a) Morfología Se trata de cocos Gram positivos que poseen tendencia a agruparse en racimos. Tienen una forma esférica y un diámetro de alrededor de una micra (32). b) Patogenia S. aureus produce infecciones de dos maneras: 1. En forma directa, por invasión y posterior destrucción tisular local (proceso supurado), o luego de haberse diseminado por vía sanguínea (32). 2. A través de efectos de toxinas (32). Infecciones por invasión: Este tipo de infecciones puede estar producido tanto por cepas de S. aureus residentes como no residentes. El primer paso de la infección es la adherencia y colonización de las células del huésped. Se describen tres tipos de adherencia. Por un lado, la adherencia a las células de la mucosa nasal mediada por los ácidos teicoicos y también es importante la adherencia a la mucina de la mucosa nasofaríngea. Por otro, la adherencia a piel traumatizada o pequeñas disrupciones de piel, así como también a objetos extraños y estructuras subendoteliales. Además de infecciones de piel y partes 25 blandas, S. aureus puede producir infecciones invasivas como neumonía, osteomielitis, bursitis, artritis y otras (32). Infecciones por acción de toxinas: Estas infecciones están causadas por la liberación al medio de sustancias tóxicas, que pueden ejercer su acción a cierta distancia del foco infeccioso (32). Síndrome de piel escaldada: se debe a la producción de la toxina exfoliativa en un foco, que luego pasa al torrente sanguíneo, pudiendo diseminarse hasta regiones alejadas del foco donde no es posible aislar ningún germen. Esta toxina produce la formación de ampollas y la subsiguiente descamación de láminas epidérmicas, que puede estar localizada en una región o estar diseminada por todo el cuerpo. Se presenta con mayor frecuencia en recién nacidos y niños pequeños (31). Síndrome del shock tóxico: es un cuadro grave que en el pasado se ha observado asociado a la utilización de tampones vaginales por parte de mujeres jóvenes. El microorganismo prolifera en el tampón contaminado y produce la toxina del shock tóxico. El cuadro clínico está caracterizado por fiebre, hipotensión, exantema cutáneo en manos y pies, grados variables de vómitos, diarrea, falla renal, cefalea y conjuntivitis. Evoluciona al shock grave en 48 horas. También se asocia a heridas traumáticas o quirúrgicas (32). Intoxicaciones alimentarias: se producen por la contaminación de alimentos, que suelen ser de elevado contenido en proteínas e hidratos de carbono como pasteles, helados y salsas, y con pH superior a 5, que permitirán un rápido crecimiento bacteriano. La mala refrigeración y conservación hacen que el microorganismo prolifere, y si es una cepa productora de enterotoxina termoestable, la libera en cantidad suficiente como para producir intoxicación. El tiempo de incubación es corto (1 a 6 horas) y los síntomas son vómitos y diarrea de hasta 2 26 días de duración, en general sin fiebre, siendo normalmente de rápida recuperación. Este proceso sólo requiere hidratación y no necesita de tratamiento antibiótico (32). 1.3.7. Hongos. Son microorganismos eucarióticos que pueden ser tanto unicelulares como pluricelulares, y cuyas células se asocian formando cuerpos filamentosos llamados hifas; el conjunto de estas hifas se denomina micelio. En la asociación de estos filamentos a veces se producen falsos tejidos. Los hongos, al carecer de clorofila, no realizan la fotosíntesis, por lo cual su alimentación es heterótrofa. La nutrición la realizan de la siguiente forma: Segregan al exterior enzimas digestivas y una vez digeridos, los alimentos son absorbidos (digestión externa). Los hongos se clasifican en tres grupos dependiendo del tipo de alimento que consuman: Saprófitos: se encargan de descomponer la materia orgánica. Parásitos: se alimentan de los líquidos del interior de otro ser vivo. Simbiontes: se asocian con otros seres vivos para favorecerse mutuamente (33). También podemos clasificar los hongos según el tipo de hifas y de esporas: a) Ficomicetes u hongos inferiores: Presentan hifas sin membranas plasmáticas que separan sus células. Por ejemplo moho del pan Ascomicetos: Es el grupo más amplio que forman los hongos. Presentan hifas (septadas) con membranas plasmáticas que separan sus células. Sus esporas se forman en el interior de células especiales denominadas ascas, o formando conidios. Pueden ser unicelulares como las levaduras o pluricelulares como el Penicillium que es el productor de la "penicilina" (33). b) Basidiomicetos: Son hongos pluricelulares. Presentan hifas septadas y sus esporas se forman en el exterior de unas células especiales denominadas basidios. Las setas que derivan de estas esporas pueden ser comestibles, como el champiñón o setas venenosas como la canaleja o el boleto de Satanás (33). 27 1.3.7.1 Tipos de hongos: a) Levaduras: En microbiología se llama levadura a “todos los hongos con predominio de una fase unicelular en su ciclo de vida”. De esta forma, las levaduras son hongos unicelulares microscópicos y filamentosos, que pueden aparecer aislados o unidos unos a otros formando pequeñas cadenas o filamentos. Las levaduras son organismos anaerobios facultativos; en presencia de oxígeno, estos organismos son capaces de transformar los azúcares en dióxido de carbono, agua, cierta cantidad de levadura y energía, creciendo rápidamente (respiración). En cambio, en ausencia de oxígeno, estos organismos son capaces de transformar los azúcares en dióxido de carbono y alcohol, obteniendo energía y creciendo lentamente (fermentación). En cuanto a la reproducción de las levaduras, puede ser sexual, por gemación, o asexual, por ascosporas. Muchas levaduras siguen un ciclo de reproducción en el cual se van alternando los tipos de reproducción: dos células haploides, que actúan como lamentos se unen creando una célula diploide, la cual es capaz, por mitosis, de reproducirse creando individuos genéticamente iguales a ella. En determinadas condiciones, una de estas células diploides, por meiosis, origina células haploides, que actuarán de nuevo como gametos (de cada célula diploide se obtienen cuatro gametos), cerrando el ciclo. Las levaduras que no son capaces de recorrer el ciclo completo pertenecen al género Cándida (33). Se tiene constancia del uso de las levaduras desde el año 10000 a.C, cuando se utilizaban para elaborar vinos. De aquella fecha en adelante, muchas civilizaciones han utilizado estos microorganismos para elaborar productos alimenticios, pan, vino, cerveza, productos de gastronomía. En la actualidad existen algunos productos que sustituyen a la levadura biológica, como es la levadura química, que nos proporciona resultados de forma más inmediata, aunque la levadura biológica se sigue utilizando (33). b) Hongos mucosos: Este grupo abarca a una serie de microorganismos pertenecientes a los protoctistas y que a pesar de ser hongos comparten una 28 serie de características con los protozoos. Durante su vida se presentan de distinta forma: Al principio como amebas, después como masas gelatinosas y por último con un cuerpo fructífero. Se alimentan de materia en descomposición o de bacterias y otros microorganismos mediante fagocitosis. Los hongos mucosos pueden clasificarse en dos grupos principales: Los acelulares (Myxogastrea), que no se presentan formando células independientes sino más bien una masa celular con un gran número de núcleos rodeados por una membrana externa. Los celulares (Dyctiostelia) formando organismos independientes que solo se unen bajo condiciones adversas (33). c) Setas: se les llama setas a los cuerpos fructíferos de unos hongos pluricelulares filamentosos, los hongos pertenecientes al grupo Basidiomycetes. Estos hongos producen unas esporas sexuales haploides que crecen en forma de micelio en un ambiente adecuado, pero no producirán cuerpos fructíferos hasta que no se les unan otros micelios haploides. Cuando dos micelios haploides se unen, crecen formando una hifa diploide dicariótica, y aparecen los cuerpos fructíferos o setas (33). d) Hongos filamentosos: Los hongos filamentosos también son llamados micelares y representan el más típico crecimiento de los hongos microscópicos. Son los típicos mohos que suelen aparecer en las frutas, queso, pan viejo y en medios de cultivo sólidos. Estos hongos forman colonias algodonosas o pulvurentas muy características. Forman filamentos que se denominan hifas que se entrecruzan desordenadamente dando lugar a estructuras más complejas denominadas micelio. En otros hongos las hifas se entrecruzan con una cierta organización pero nunca llegar a formar una estructura compacta (33). Los hongos filamentosos se dividen en inferiores y superiores según las características de sus hifas: Los hongos inferiores están formados por hifas 29 anchas (5-10 µm) y forman mohos mientras que los hongos superiores están formados por hifas finas (0.5-5 µm ) y forman además de mohos las setas que tienen tamaño macroscópico y pueden ser venenosas o comestibles. A partir de estos micelios algunas hifas formarán conidios que son las hifas aéreas. Los conidios son esporas asexuales de fuertes pigmentos como negro, marrón o amarillo. Estas esporas germinan para dar nuevas hifas. Los hongos filamentosos son los responsables de muchas alergias además de contaminar muchos alimentos (33). 1.4. Etnomedicina. La etnomedicina como disciplina del conocimiento científico, está basada, en la relación interactiva del ser humano con las plantas, adquiriendo saberes que va acumulando en el trascurso del tiempo, sin dejar de considerar su relación con el medio ambiente, en el caso particular de la Amazonía peruana, estos elementos han evolucionado en un contexto de aprendizaje y desarrollo vivencial, causado por la cultura, cosmovisión y necesidades propias de su subsistencia (34). Tenemos como ejemplo lo que ocurre en la sociedad amazónica y peruana en general, hasta la fecha, primera década del siglo XXI, aún mantiene vivo el conocimiento tradicional, referido al uso de las plantas medicinales, muy arraigado y aplicado en los pueblos indígenas, así como en la sociedad mestiza. Durante los últimos 70 años, los científicos del mundo han retomado su interés en los recursos naturales y la población mundial ha incrementado su utilización (34) . En el Perú poseemos especies vegetales amazónicas que han sido estudiadas tanto por investigadores peruanos como extranjeros, contribuyendo al incremento de los conocimientos científicos, tecnológicos e industriales en aplicación a nuestra gran riqueza vegetal (34). El uso de plantas medicinales para aliviar o sanar ciertas afecciones, ha sido importante porque: Es una práctica tradicional, que destaca en las poblaciones de bajos recursos económicos inicialmente, pero ahora con las características de ser muy útiles ha dejado de ser una moda para ser una opción de salud, 30 permite un acercamiento entre el paciente su médico y su familia, tiene bajos costos, permite que se valide a nuestros ancestros que nos trasmitieron sus conocimientos y dejaron como legado sus prácticas, legitimando el conocimiento tradicional, muchas veces es hereditaria y permite involucrar a la sociedad en su conjunto en las prácticas (34). El conocimiento tradicional amazónico, es transmitido de generación a generación a hombres y mujeres de la Amazonía, al igual que de otras regiones del mundo, que han acumulado saberes para curarse. La historia de nuestras plantas medicinales no sería tal, sin la participación, manejo y usos de sus pobladores. Es conocido que ciertas especies amazónicas han sido utilizadas desde hace siglos así tenemos por ejemplo, que: En las expediciones del siglo XVIII, sobresale el viaje del científico alemán Alexander von Humboldt y del botánico Aimée Bonpland, quienes realizaron un viaje a América del Sur, a la zona de confluencia de las cuencas del río Orinoco y Amazonas en el año 1800, donde hicieron observaciones acerca del uso que daban los indígenas al achiote (34) . 1.5. Bioseguridad. Los profesionales del laboratorio están expuestos a una variedad de riesgos a su salud relacionados con su trabajo. Como ejemplo, se encuentran aquéllos derivados del manejo de material infeccioso, radiación, compuestos tóxicos y químicos e inflamables. En el caso particular del material biológico-infeccioso, el peligro surge de la posibilidad de exponerse a agentes patógenos e infectarse por dicha exposición. En laboratorios de diagnóstico clínico, de investigación, industriales, de patología clínica, de producción de biológicos, de enseñanza, u otros donde se lleguen a manejar patógenos aislados o muestras que los contengan, los profesionales del laboratorio debemos prestar especial cuidado en las medidas que tomamos para prevenir un accidente (35). 1.5.1 Identificación de los grupos de riesgo a) Grupo de riesgo 1 (GR1): Agentes no asociados con enfermedades en humanos adultos saludables ni en animales (nulo o bajo riesgo al individuo 31 o la comunidad). Ejemplo: Bacillus subtilis, Bacillus licheniformis, ciertas cepas de Escherichia coli (35). b) Grupo de riesgo 2 (GR2): Agentes asociados con enfermedades humanas raramente serias para las cuales siempre hay medidas preventivas y/o terapéuticas disponibles. El riesgo de diseminación de la infección es limitado (riesgo individual moderado, bajo riesgo a la comunidad). Ejemplo: Campylobacter jejuni, Helicobacter pylori, Neisseria gonorrhoeae, Blastomyces dermatitidis, Coccidia, Toxoplasma gondii, Adenovirus, Papovavirus (35). c) Grupo de riesgo 3 (GR3): Agentes asociados con enfermedades humanas serias o letales para las cuales podrían estar disponibles medidas preventivas y/o terapéuticas. El contagio entre individuos infectados es poco común (alto riesgo individual, bajo riesgo a la comunidad). Ejemplo: Coxiella burnetii, Mycobacterium tuberculosis, VIH, virus de la fiebre amarilla, virus del oeste del Nilo, bacterias multirresistentes como Staphylococcus aureus resistente a meticilina (MRSA) y Streptococcus pyogenes resistente a eritromicina (SPRE) (35). d) Grupo de riesgo 4 (GR4): Agentes causantes de enfermedades humanas serias o letales para las cuales no hay medidas preventivas y/o terapéuticas disponibles. El contagio entre individuos infectados se da fácilmente (alto riesgo individual, alto riesgo a la comunidad). Ejemplo: virus del Ébola, Marburg, Lassa (35). 1.5.2 Niveles de bioseguridad en los laboratorios A partir de la definición de los grupos de riesgo se generó la clasificación de los laboratorios en cuatro niveles de bioseguridad en función de (i) la infectividad del patógeno, (ii) la severidad de la enfermedad causada, (iii) el grado de transmisibilidad, (iv) el origen del agente (exótico o no) y, (v) la naturaleza del trabajo llevado a cabo en el inmueble (35). 32 Cada nivel de bioseguridad refleja el tipo de prácticas microbiológicas, el tipo de equipo y las medidas de seguridad tomadas en ese laboratorio en particular. En general, se procura lograr un ambiente de trabajo seguro para el personal y para las personas ajenas al laboratorio, incluyendo las que se encuentran fuera de las instalaciones (35). De acuerdo al CDC, los cuatro niveles de bioseguridad son los siguientes: a) Nivel 1 (BSL-1): prácticas, equipo y medidas adecuadas para el nivel de enseñanza. El trabajo se realiza con cepas definidas y caracterizadas de microorganismos que no causen enfermedad en humanos adultos sanos. No se necesita el uso de equipo especial de protección, con el equipo básico es suficiente (35). b) Nivel 2 (BSL-2): prácticas, equipo y medidas adecuadas para laboratorios de análisis, diagnóstico o patología clínica donde se manejen microorganismos de riesgo moderado que están presentes en la comunidad y se encuentran asociados a enfermedades humanas de severidad variable (35) . c) Nivel 3 (BSL-3): prácticas, equipo y medidas adecuadas para laboratorios de análisis/diagnóstico clínico e investigación donde manejen agentes conocidos o no conocidos que potencialmente puedan transmitirse por aerosol o salpicaduras y, que puedan causar una infección potencialmente letal (35). d) Nivel 4 (BSL-4): prácticas, equipo y medidas adecuadas para laboratorios de análisis/diagnóstico clínico e investigación que involucren la manipulación de agentes exóticos peligrosos que representen un gran riesgo por causar enfermedades letales, que puedan transmitirse vía aerosol y, para los cuales no haya vacuna ni terapia conocida. De los cuatro niveles mencionados, en los últimos dos se manejan agentes patógenos considerados como potencialmente peligrosos por las posibilidades que existen del surgimiento de un subtipo pandémico o por haber dado origen a 33 una epidemia no controlada (patógenos emergentes y reemergentes respectivamente) (35). Los laboratorios de bioseguridad nivel 3 y 4 son herramientas esenciales en la investigación por brindar la posibilidad de aislar, cultivar y preservar estos microorganismos en su estado activo (35). 1.5.3 Implementación de las políticas en los laboratorios Los cuatro niveles de bioseguridad implican medidas particulares para cubrir estas necesidades. Además de ello, existen normas básicas de bioseguridad que todo laboratorio debe seguir sin importar el tipo de patógeno que maneje. Como se puede ver, la bioseguridad es un tema que compete a todas las personas que realicen actividades dentro de un laboratorio (35). a) Diseño de un manual de bioseguridad para eliminar o minimizar la exposición laboral a patógenos, el cual debe estar a disposición de cada persona del laboratorio. Este manual debe ser revisado anualmente por el supervisor o director del laboratorio para hacer los cambios pertinentes al sistema de bioseguridad (35). b) Identificación de sitios, tareas y procedimientos en los que podría ocurrir una exposición ocupacional (35). c) Control de prácticas laborales: • Lavarse las manos al quitarse el equipo de protección personal y después del contacto con sangre u otro material potencialmente infeccioso (35). • No doblar, quitar o tapar de nuevo jeringas. Esta medida es muy importante, ya que la mayoría de los accidentes laborales ocurren al tapar de nuevo la aguja de la jeringa recién utilizada (35). • No ingerir alimentos ni bebidas, no fumar, no aplicarse cosméticos ni manipular lentes de contacto en áreas de trabajo (35). 34 • No guardar comida ni bebidas en refrigeradores, cuartos fríos, congeladores, gabinetes o anaqueles donde se encuentre material potencialmente infeccioso (35). • No pipetear con la boca. (35). d) Equipo de protección personal. • Varía de acuerdo al tipo de laboratorio. Debe utilizarse de forma obligada si se va a trabajar con material potencialmente infeccioso. Incluye: guantes, batas, máscaras, lentes y cubre bocas, ente otros • Los guantes desechables no deben lavarse o descontaminarse para su reutilización • Utilizar guantes siempre que se entre en contacto con sangre o material biológico-infeccioso (35). e) Limpieza: el área y equipo de trabajo debe mantenerse siempre limpio y descontaminado (34). • La Environmental Protection Agency de los Estados Unidos provee una lista de los desinfectantes adecuados para evitar la contaminación por bacterias o virus. Los ejemplos más comunes son etanol, hipoclorito de sodio, formaldehido, peróxido de hidrógeno y desinfectantes modernos de amplio espectro (35). f) Etiquetado de equipo y material: el símbolo de bioseguridad debe ser utilizado para identificar contenedores de desechos, refrigeradores y congeladores que contengan material potencialmente infeccioso (35). g) Información y entrenamiento del personal: las personas que realicen cualquier actividad en un laboratorio deben estar informadas del nivel de bioseguridad al que pertenece, de los patógenos que maneja y del riesgo que corre al encontrarse allí. Además, debe estar entrenada para responder ante cualquier contingencia (35). 35 1.5.4 Descontaminación: La descontaminación es uno de los principios fundamentales de la Bioseguridad”. Se refiere por un lado, a la esterilización o destrucción completa de todos los microorganismos incluyendo las esporas bacterianas y, por otro lado, a la desinfección o destrucción y eliminación de tipos precisos de microorganismos (36). Es responsabilidad del Director del Laboratorio asegurar que todos los miembros del personal del Laboratorio sean capacitados sobre el tema y, a su vez, es responsabilidad de los miembros del personal de utilizar de manera eficaz los procedimientos y productos de descontaminación cualquiera que sea su uso (36). a) Autoclave. Los desechos infecciosos de laboratorio (Placas de Petri, pipetas, tubos de cultivos, material de vidrio, etc.) pueden ser eficazmente descontaminados utilizando una autoclave con vapor directo o con una autoclave con extracción de aire. Este último sistema permite resolver los problemas de bolsillos de aire que se forman en las autoclaves de vapor directo debido al movimiento del aire por gravedad. La eficiencia de descontaminación depende de varios factores de carga, que influencian la temperatura efectiva a la cual el material está sometido y el tiempo de contacto. El embalaje es también un factor determinante a la hora de favorecer la libre circulación del vapor. La autoclave pueden llevar sobrecarga y el apilamiento en la al fracaso del proceso de descontaminación. Lo ideal es agregar un indicador biológico como por ejemplo una cantidad conocida de esporas (36). b) Desinfección química. Los desinfectantes químicos son útiles para descontaminar las superficies y los aparatos que no pueden ser esterilizados en autoclave. También son útiles para limpiar las salpicaduras de 36 materias infecciosas, las salas y las unidades de hospedaje de animales (36). La selección del desinfectante depende de la resistencia de los microorganismos manipulados. Los microorganismos más sensibles son las bacterias vegetativas, los hongos y los virus encapsulados. Las micobacterias y los virus no-encapsulados son menos sensibles; las esporas bacterianas y los quistes de protozoarios son generalmente los más resistentes (36). Los peligros para la salud que representan los desinfectantes químicos, así como, la facilidad de manejo, estabilidad y compatibilidad con los materiales a desinfectar son factores importantes que deben considerarse para elegir el desinfectante adecuado. Si bien existen numerosos productos en el mercado, los compuestos activos pertenecen a un número limitado de familias químicas. Para elegir un desinfectante cabe entender la posibilidad y límites de cada una de estas familias: hipocloritos, compuestos de amonio cuaternario, compuestos fenólicos, yodados y alcohol (36). c) Incineración. La incineración ha sido desde siempre el método favorito de eliminación de carcasas de animales y de desechos patológicos. En la mayoría de los casos, los desechos que deben ser incinerados tienen que ser embalados adecuadamente y de acuerdo a la normativa para que sean retirados de los laboratorios por las empresas certificadas que se encuentran operando en nuestro país. La responsabilidad de nuestros laboratorios recae entonces, por un lado, en el almacenamiento cuidadoso dentro de un congelador, de uso exclusivo, a -20° C, hasta que el material biológico sea retirado por la empresa contratada. Para aquellos centros o laboratorios que disponen de un incinerador, cabe resaltar que la eficiencia de la incineración depende de la calidad conceptual de los aparatos, del tiempo y de la temperatura de incineración, de las turbulencias 37 y del aire necesario para una oxidación completa. Es importante constatar que las emisiones producidas por la incineración tienen que adecuarse a las normas ambientales vigentes en cuanto a emisión de partículas y contaminantes químicos (36). 1.5.4.1 Normas específicas para el manejo de agentes químicos de riesgo. a) Almacenamiento y transporte de sustancias químicas. El laboratorio no debe ser un lugar de almacenamiento de substancias químicas, sólo deben permanecer aquellas que serán usadas con mayor frecuencia y en volúmenes pequeños. Grandes volúmenes deben ser almacenados en lugares o edificios destinados especialmente para ese fin (36). La recepción, almacenamiento y distribución de substancias químicas de alto riesgo (inflamables, reactivos, tóxicos), debe efectuarse en un lugar “ad-hoc” que cumpla con los requisitos de aislamiento, ventilación y acceso controlado, y a cargo de personal técnicamente calificado (36). Dentro del recinto de bodega, se deben destinar áreas especiales para productos químicos sólidos, líquidos y gaseosos, tomando en consideración el riesgo que representan (36) . Cada área debe estar equipada con estanterías metálicas, para almacenar los reactivos, de altura no superior a 2,5 mts, con una distancia del suelo mínima de 20 cms y separados a 60 cms de la pared. Las substancias químicas deben almacenarse en sus envases unitarios originales, sellados y con sus 38 etiquetas originales. Deben entregarse sellados al usuario y en ningún caso deben fraccionarse en la bodega (36). Cada Unidad debe mantener un listado actualizado de las substancias químicas de riesgo que en ella se manipulan y las correspondientes fichas de Bioseguridad química. Donde se incluya los siguientes antecedentes: nombre comercial, formula química, compuesto activo, cantidad tipo de riesgo más probable almacenada, (36) . El transporte de substancias químicas desde la bodega a los laboratorios se debe efectuar en carros adecuados, tomando las precauciones necesarias para evitar el derrame de ellas (36). Las substancias químicas de alto riesgo que ingresan a los laboratorios son de responsabilidad del personal técnico calificado, quien debe tomar las medidas anteriormente señaladas para su almacenamiento y uso (36). 1.6. Medios de cultivo microbiológico. Uno de los sistemas más importantes para la identificación de microorganismos es observar su crecimiento en sustancias alimenticias artificiales preparadas en el laboratorio. El material alimenticio en el que crecen los microorganismos es el Medio de Cultivo y el crecimiento de los microorganismos es el Cultivo. Se han preparado más de 10.000 medios de cultivo diferentes (37). Para que las bacterias crezcan adecuadamente en un medio de cultivo artificial debe reunir una serie de condiciones como son: temperatura, grado de humedad y presión de oxígeno adecuado, así como un grado correcto de acidez o alcalinidad. Un medio de cultivo debe contener los nutrientes y factores de crecimiento necesarios y debe estar exento de todo microorganismo contaminante (37). 39 1.6.1 Condiciones generales para el cultivo de microorganismos a) Disponibilidad de nutrientes adecuados Un medio de cultivo adecuado para la investigación microbiológica ha de contener, como mínimo, carbono, nitrógeno, azufre, fósforo y sales inorgánicas (37). En muchos casos serán necesarias ciertas vitaminas y otra sustancia inductora del crecimiento. Siempre han de estar presentes las sustancias adecuadas para ejercer de donantes o captadores de electrones para las reacciones químicas que tengan lugar (37). b) Consistencia adecuada del medio Partiendo de un medio líquido podemos modificar su consistencia añadiendo productos como albúmina, gelatina o agar, con lo que obtendríamos medios en estado semisólido o sólido. Los medios solidificados con gelatina tienen el gran inconveniente de que muchos microorganismos no se desarrollan adecuadamente a temperaturas inferiores al punto de fusión de este solidificante y de que otros tienen la capacidad de licuarla (37). c) Presencia (o ausencia) de oxígeno y otros gases Gran cantidad de bacterias pueden crecer en una atmósfera con tensión de oxígeno normal. Algunas pueden obtener el oxígeno directamente de variados sustratos. Pero los microorganismos anaerobios estrictos sólo se desarrollarán adecuadamente en una atmósfera sin oxígeno ambiental. En un punto intermedio, los microorganismos microaerófilos crecen mejor en condiciones atmosféricas parcialmente anaerobias (tensión de oxígeno muy reducida), mientras los anaerobios facultativos tienen un metabolismo capaz de adaptarse a cualquiera de las citadas condiciones (37). d) Condiciones adecuadas de humedad Un nivel mínimo de humedad, tanto en el medio como en la atmósfera, es imprescindible para un buen desarrollo de las células vegetativas microbianas en los cultivos. Hay que prever el mantenimiento de estas 40 condiciones mínimas en las estufas de cultivo a 35-37ºC proporcionando una fuente adecuada de agua que mantenga la humedad necesaria para el crecimiento de los cultivos y evitar así que se deseque el medio (37). e) Luz ambiental La mayoría de los microorganismos crecen mucho mejor en la oscuridad que en presencia de luz solar. Hay excepciones evidentes como sería el caso de los microorganismos fotosintéticos (37). f) pH La concentración de iones hidrógeno es muy importante para el crecimiento de los microorganismos. La mayoría de ellos se desarrollan mejor en medios con un pH neutro, aunque los hay que requieren medios más o menos ácidos. No se debe olvidar que la presencia de ácidos o bases en cantidades que no impiden el crecimiento bacteriano pueden sin embargo inhibirlo o incluso alterar sus procesos metabólicos normales (37). g) Temperatura Los microorganismos mesófilos crecen de forma óptima a temperaturas entre 15 y 43ºC. Otros como los psicrófilos crecen a 0ºC y los termófilos a 80ºC o incluso a temperaturas superiores (hipertemófilos). En líneas generales, los patógenos humanos crecen en rangos de temperatura mucho más cortos, alrededor de 37ºC, y los saprofítos tienen rangos más amplios (37) . h) Esterilidad del medio Todos los medios de cultivo han de estar perfectamente estériles para evitar la aparición de formas de vida que puedan alterar, enmascarar o incluso impedir el crecimiento microbiano normal del o de los especímenes inoculados en dichos medios. El sistema clásico para esterilizar los medios de cultivo es el autoclave (que utiliza vapor de agua a presión como agente esterilizante) (37). 41 1.6.2 Tipos básicos de medios de cultivo a) Medios de cultivo: Sólido y Líquido Una forma muy útil de poder aislar, identificar y conservar los microorganismos es mediante el uso de medios de cultivo, inicialmente ideados por Pasteur (que como ya sabemos se considera el padre de la microbiología), quien se dio cuenta que los microorganismos podían crecer en soluciones que tuvieran azúcar y una fuente de nitrógeno. De ese tiempo hasta acá, ha pasado mucha agua debajo del puente y actualmente existen medios muy especializados para microorganismos muy exigentes. La forma más sencilla de clasificar los medios de cultivo es por su consistencia, entonces aparecen los medios de cultivo sólidos y los medios de cultivo líquidos o también llamados caldos (37). b) Medios semisólidos Se preparan a partir de los medios líquidos, agregando a éstos un agente solidificante en una proporción menor que para preparar medios sólidos. Uno de sus usos es la investigación de la movilidad de las bacterias (37). c) Medios comunes Son aquellos que poseen los componentes mínimos para que pueda producirse el crecimiento de bacterias que no necesiten requerimientos especiales. El medio más conocido de este grupo es el agar nutritivo o agar común, que resulta de la adición de agar al caldo nutritivo. Otros representantes de este grupo son el agar tripticase de soja, el agar Columbia, (37) . d) Medios de enriquecimiento Son aquellos que, además de las sustancias nutritivas normales, incorporan una serie de factores indispensables para el crecimiento de microorganismos exigentes. Este enriquecimiento se hace por adición de sangre u otros productos biológicos (sangre, suero, leche, huevo, bilis, etc.) que aportan dichos factores. En ocasiones es posible añadir suplementos artificiales a los enriquecimiento del mismo (p. ej. Polivitex, Isovitalex, etc.). El gonococo, 42 por ejemplo, necesita cistina y cisteína para su crecimiento. Estas sustancias son aportadas por la sangre calentada adicionada al medio de cultivo (agar chocolate) (37). e) Medios selectivos Son medios utilizados para favorecer el crecimiento de ciertas bacterias contenidas en una población poli microbiana. El fundamento de estos medios consiste en facilitar nutricionalmente el crecimiento de una población microbiana específica. Un ejemplo de medio selectivo es el caldo selenito, que se utiliza para favorecer el crecimiento de salmonellas y frenar el del resto de Enterobacterias (37). f) Medios inhibidores Cuando las sustancias añadidas a un medio selectivo impiden total de una población microbiana, se denomina inhibidor. Los medios inhibidores podrían considerarse como una variante más restrictiva de los medios selectivos. Los medios inhibidores se consiguen habitualmente por adición de sustancias antimicrobianas o de cualquier otra que inhiba completamente el desarrollo de una población determinada. Un medio inhibidor es el MacConkey que permite el crecimiento de los gérmenes Gram negativos e impide el crecimiento de los Gram positivos (37). g) Medios diferenciales Se utilizan para poner en evidencia características bioquímicas que ayuden a diferenciar géneros o especies. La adición de un azúcar fermentable o un sustrato metabolizable se utilizan para este fin. El medio MacConkey es un medio diferencial porque permite distinguir los gérmenes que fermentan la lactosa de aquellos que no lo hacen. También lo son el C.L.E.D. (lactosa +/lactosa hemólisis), el SS (que es doblemente diferencial) (37). h) Medios de identificación Son los destinados a comprobar alguna cualidad específica que puede servirnos para reconocer la identidad de un microorganismo. Estos medios han de poseer los elementos necesarios para asegurar el crecimiento de los 43 microorganismos, el sustrato específico que vaya a ser metabolizado y el indicador que nos muestre el resultado. El agar Kligler, el medio de Simmons y en general, cualquier medio al que se le haya añadido un elemento diferencial de un microorganismo, son medios utilizados en identificación (37). 1.6.3 Actualmente están apareciendo en el mercado una gran cantidad de medios como: Medios de multiplicación Sirven para obtener una gran cantidad de células a partir de un microorganismo ya aislado. Se emplean en la obtención de vacunas, en la investigación y en la industria. Los medios más adecuados para la multiplicación suelen ser líquidos. El caldo-infusión cerebro-corazón (BHI) (37) . Medios de conservación Se utilizan para conservar una cepa que, por diversas razones nos interese mantener. Fundamentalmente se utilizan como controles de calidad de las pruebas y reactivos utilizados (37). En el laboratorio se pueden conservar las cepas de tres formas: a) haciendo pases periódicos de placa a placa, b) mediante liofilización de una suspensión bacteriana, y c) congelando las cepas en leche descremada estéril al 0,1% (37). Medios de transporte Se usan para el transporte de muestras clínicas que no pueden sembrarse inmediatamente. Su utilización debe hacerse introduciendo la torunda con la que se obtuvo la muestra en el interior del medio (generalmente en un tubo). Son ejemplos típicos de este grupo los medios de Stuart Amies, Cary-Blair, (37) . 44 1.6.4 Medios de cultivos comunes. Son los más corrientemente utilizados, y aunque no vamos a enumerarlos todos, sí son los más conocidos en un laboratorio de Microbiología (37). a) Agar nutritivo: El Agar nutritivo es un medio de cultivo usado normalmente como rutina para todo tipo de bacteria. Es muy útil porque permanece solido incluso a relativas altas temperaturas. Además, el crecimiento bacteriano en este agar lo hace en la superficie, por lo que se distinguen mejor las colonias pequeñas (37). En un caldo de nutrientes, la bacteria crece en el líquido, y aparece como una sustancia espesa, con colonias difícilmente observables. El agar nutritivo contiene normalmente (w/v). • 0.5 % Peptona • 0.3 % extracto de carne/extracto de levadura • 1.5 % agar • 0.5% NaCl • Agua destilada • pH casi neutro (6.8) a 25 °C (37). b) Agar sangre Es un medio enriquecido que se utiliza además para la investigación de los diversos tipos de hemólisis (α, ß ó gamma). Se utiliza para el crecimiento de estreptococos. Para la preparación del agar sangre se puede utilizar el agar nutritivo enriquecido con cloruro sódico o un preparado enriquecido con otras sustancias como Columbia o el tripticase de soja. La adición de sangre a un medio de cultivo no proporciona las sustancias que están en el interior de los hematíes, pero sí puede añadir factores inhibidores del crecimiento bacteriano presentes 45 en el suero. Este es un inconveniente que puede solucionarse calentando la sangre para romper los eritrocitos y para que se destruyan las sustancias inhibidoras, que son termolábiles. La sangre utilizada como aditivo a estos medios suele ser sangre de carnero diluida al 5%, pero en algunas ocasiones es necesario utilizar sangre de otras especies (caballo, conejo, humana), pues facilitan las reacciones hemolíticas o contienen determinados factores de enriquecimiento o no poseen sustancias inhibidoras del crecimiento de determinados gérmenes (37). c) Agar S.S: Medio de cultivo utilizado para el aislamiento de Salmonella spp. y de algunas especies de Shigella spp. A partir de heces, alimentos y otros materiales en los cuales se sospeche su presencia (37). Es un medio de cultivo selectivo y diferencial. La selectividad, está dada por la sales biliares y el verde brillante, que inhiben el desarrollo de bacterias Gram positivas, de la mayoría de los coliformes y el desarrollo invasor del Proteus spp. Es diferencial debido a la fermentación de la lactosa, y a la formación de ácido sulfhídrico a partir del tiosulfato de sodio (37). Los pocos microorganismos fermentadores de lactosa capaces de desarrollar, acidifican el medio haciendo virar al rojo el indicador de pH, obteniéndose colonias rosadas o rojas sobre un fondo rojizo. Salmonella, Shigella y otros microorganismos no fermentadores de lactosa, crecen bien en el medio de cultivo, y producen colonias transparentes (37). La producción de ácido sulfhídrico se evidencia como colonias con centro negro debido a la formación de sulfuro de hierro (37). Para aumentar la selectividad, se recomienda incubar previamente la muestra en Selenito caldo (B02-120-05) (37). d) Agar Tripticase de soja: 46 Es un medio utilizado para el crecimiento de gérmenes exigentes, como Brucella, Neisseria o Streptococcus. Es un medio muy enriquecido, pero no es diferencial. Caldo tioglicolato con resazurina: Es un medio recomendado para controles de esterilidad. Permite el cultivo de aerobios, anaerobios y microaerófilos. Tiene un bajo potencial redox que al aumentar, se manifiesta por un color rosa del medio (37). e) Agar Manitol salado o siglas en inglés MSA (Manitol salt agar): Es un medio de cultivo que se utiliza normalmente en microbiología. Permite el crecimiento de un determinado grupo de bacterias mientras que inhibe el crecimiento de otras. Este medio es importante en el laboratorio clínico debido a que es capaz de distinguir los microorganismos patogénicos en un corto periodo de tiempo. Contiene una alta concentración (~7.5%-10%) de sal (NaCl), haciéndolo selectivo para Staphylococcus (y „Micrococcaceae) debido a que el nivel de NaCl es inhibitorio para la mayoría de las bacterias. Además contiene manitol y un indicador de PH; rojo de fenol. Coagulase-positive Staphylococcus produce colonias amarillas con zonas amarillas, mientras que coagulasenegative Staphylococcus produce colonias rojas o ligeramente rosadas sin cambio alguno al medio. Si un organismo es capaz de fermentar el manitol, un subproducto ácido es creado que hace que el rojo de fenol cambie a amarillo. Se usa para el aislamiento selectivo de colonias de Staphylococcus sospechosas de ser patógenas (37). f) Agar Baird-Parker: Permite el crecimiento de estafilococos coagulasa positivos, a la vez que los diferencia del resto (37). g) Agar Kligler: El agar medio de Kligler (TSI, Triple Sugar Iron) es un medio diferencial que puede ayudarnos a distinguir entre especies de enterobacterias de acuerdo a su capacidad (o falta de ella) para: 47 Metabolizar lactosa, sacarosa o ambas Producir acido mediante fermentación Producir gas durante la fermentación Generar ácido sulfhídrico Los componentes del medio y sus funciones a) Rojo fenol Un indicador de pH. En medios ácidos (debajo de 6.8) se torna amarillo. En medios alcalinos (arriba de 8.2) se torna rojo. b) 1,0% de lactosa y 1,0% de sacarosa Su fermentación produce una gran cantidad de ácidos. c) 0,1% de glucosa Su fermentación produce una pequeña cantidad de ácidos. d) Sulfato ferroso (FeSO4) Nos permite averiguar si la bacteria pueden producir H2S (ácido sulfhídrico) (37). h) Agar Cetrimida: Medio de cultivo selectivo para el aislamiento de Pseudomonas aeruginosa a partir de diversas muestras. La cetrimida (Bromuro de cetiltrimetilamonio) inhibe el crecimiento de las bacterias debido a su acción como un compuesto cuaternario de amonio. La base de Agar Cetrimida promueve la producción de piocianina y fluoresceina que se observan con luz ultravioleta en los cultivos de Pseudomonas aeruginosa, lo que puede considerarse como prueba presuntiva para su identificación. Posteriormente se puede realizar la prueba de oxidasa. Sembrar la muestra de ensayo en la superficie del medio de cultivo por estría cruzada. Incubar 24 – 48 h a 35ºC (37). 48 1.7 DEFINICIONES OPERACIONALES 1.7.1 Variable de Estudio Calidad Microbiológica de la corteza de la Cariniana decandra (cinta caspi). 1.7.2 Indicadores: Recuento de Aerobios mesófilos Recuento de hongos y levaduras Presencia/ausencia de Escherichia coli Presencia/ausencia de Staphylococcus aureus Presencia/ausencia de Pseudomona aeruginosa Presencia/ausencia de Salmonella spp. 49 1.8. OPERACIONALIZACIÓN DE VARIABLE VARIABLE DE INVESTIGACIÓN Calidad Microbiológica DEFINICIÓN CONCEPTUAL Es un elemento de evaluación de la satisfacción de los requisitos microbiológicos, es necesario aplicar pasos ordenados a través de la cadena de producción, empezando por los insumos. DEFINICIÓN OPERACIONAL Se realizó teniendo en INDICADOR INDICE Recuento Aerobios mesófilos. cuenta los parámetros establecidos control de por el NMP de ESCALA microorganismos escalar viables límites y UCF/gr de muestra escalar Escherichia Presencia/ausencia nominal de Presencia/ausencia nominal Identificación de Pseudomona Presencia/ausencia nominal Presencia/ausencia nominal Recuento de hongos levaduras microbianos según la Farmacopea USP 35 para materias primas utilizadas en coli productos de origen botánicos. Identificación de Identificación Staphylococcus aureus aeruginosa Identificación de Salmonella spp. 50 CAPITULO II METODÓLOGÍA 2.1 Tipo de Investigación: El estudio es de tipo Descriptivo, Prospectivo. Descriptivo: Porque el estudio describirá en forma clara y detallada presencia o ausencia de microorganismos patógenos y contaminantes. Prospectivo: Porque en el registro de información se tomara en cuenta los hechos a partir del inicio de la fecha de estudio. 2.2 Diseño de la investigación: El estudio se realizó aplicando los ensayos de limite microbiano establecidas por la farmacopea USP 35, respectivamente; conteniendo el recuento de microorganismos mesófilos aerobios, levaduras, hongos y pruebas de ausencia/presencia para microorganismos patógenos como: Escherichia coli, Salmonella spp, Pseudomona aeruginosa, Staphylococcus aureus. 2.3 Población y muestra. 2.3.1. Población Vegetal: La población estuvo constituida por la especie botánica Cariniana decandra (cinta caspi), que crecen a ambos lados de la carretera Zungarococha –Llanchama desde el Km 4.7 al Km 11.4. 2.3.2. Muestra Vegetal: Estuvo constituida por la Corteza de Cariniana decandra (cinta caspi), de uso terapéutico en la ciudad de Iquitos se recolectó por la técnica de muestreo por conveniencia. 2.3.3. Criterios de inclusión y exclusión. a) Criterios de inclusión: Especies vegetales seleccionadas en buen estado, en estadio adulto y georeferenciadas. b) Criterios de exclusión: Otras especies vegetales de uso medicinal no seleccionadas para este estudio. 51 2.4 Técnicas e Instrumentos Técnicas Determinación de Aerobios Mesófilos: Técnica de NMP o tubos múltiples Determinación de hongos y levaduras: Recuento en placas Determinación de microorganismos patógenos: Prueba para Staphylococcus aureus y Pseudomonas aeruginosa, Prueba para determinar la ausencia de Salmonella spp y Escherichia coli. Medios de cultivo: Caldo Lactosado, Agar Manitol Salado, Agar Cetrimida, Agar Mac Conkey, Agar Bismuto Sulfito, Caldo Tripticasa Soya (TSB), Caldo Selenito Cistina, Buffer fosfato pH 7,2. Diluyente: Solución Amortiguadora de fosfatos (buffer fosfato pH. 7,2) 2.4.1 Materiales e Instrumentos: Vidrio: matraz de 250ml, 100ml y 50 ml; probeta graduada de 100 ml y 50 ml; vaso de precipitado 100 ml, tubos de ensayo con tapas de jebe, placas petri, pipetas lineales de 10ml y 1ml, varilla de vidrio. Plástico y metal: Asa bacteriológica de punta, Asa bacteriológica de aro, gradilla, micropipeta, mechero de bunsen Reactivos: Buffer Fosfato pH 7.2, Caldo Tripticasa Soya (TSB), Caldo Lactosado, Caldo Selenito Cistina, Agar MacConkey, Agar Bismuto Sulfito, Agar Manitol Salado, Agar Cetrimida, Agar Saboraud. Equipos: Incubadora, baño maría, termostato, refrigeradora, balanza analítica, autoclave, agitador de tubos, centrifuga. 52 2.5 Procedimientos de Recolección de Datos. 2.5.1 Investigación etnobotánica A. Recolección: La especie Cariniana decandra (cinta caspi), de uso terapéutico, se recolectó, a ambos lados de la carretera Zungarococha – Llanchama desde el Km 4.7 al Km 11.4. B. Selección: Una vez realizada la recolección de la muestra se procedió a hacer el acondicionamiento de la materia vegetal con el objetivo de realizar una separación de las partes deterioradas y evitar que se mezcle con otras especies. C. Identificación taxonómica: La planta medicinal seleccionada, se llevó al Herbario de la Universidad Nacional de la Amazonía Peruana para su identificación Taxonómica. D. Caracterización macromorfológica: Se llevó a cabo analizando los siguientes caracteres: Forma, textura, superficie, peculiaridades, color, olor, condición y dimensiones; los cuales serán contrastados con las bibliografías correspondientes. 2.6 Investigación de patógenos 2.6.1 Determinación de Aerobios Mesófilos Método en tubos múltiples. Primero se preparó el macerado inicial; para ello se disolvió 10 g de la muestra medidos con exactitud, en Solución Amortiguadora de Fosfato de pH 7.2, para obtener 100mL. y se homogenizó en el Stomacher durante 2 minutos. Así se consiguió el macerado inicial. 53 En cada uno de 14 tubos de tamaño similar, se colocó 4.5 mL del medio Caldo Tripticasa Soya (TSB). Se distribuyó 12 de los tubos en cuatro grupos de tres tubos cada uno. Se procedió a pipetear 0.5 mL de la solución o suspensión de la muestra y se transfirió a cada uno de los tres tubos de un grupo (“100”) y a un cuarto tubo (A) y se mezcló. Se procedió a pipetear 0.5 mL del tubo A y se transfirió al tubo restante (B), no incluido en un grupo y se mezcló. Estos dos tubos contienen 100 mg (o 100 ul) y 10 mL (o 10ul) de la muestra, respectivamente. Se procedió a pipetear 0.5mL del tubo A y se transfirió a cada uno de los tres tubos del segundo grupo (“10”) y se pipeteó 0.5mL del tubo B y se transfirió a cada tubo del tercer grupo (“1”). Se Desechó el contenido no utilizado de los tubos A y B. Se Cerró bien y se incubó todos los tubos. Una vez transcurrido el periodo de incubación 24 h, se examinó los tubos para verificar el crecimiento de los microorganismos: los tres tubos de control se mantendrán transparentes y los resultados observados en los tubos que contenían la muestra, se interpretó según la siguiente tabla, se indicó el número más probable de microorganismos por g o por mL de muestra. 54 Tabla 1.-Recuento total más Probable por el Método en Tubos Múltiple. (Farmacopea USP 35 pp. 62) Combinaciones observadas de Numero de Tubos que Evidencian Crecimiento en cada grupo Número más probable de microorganismos por g o por mL Nº de mg (o mL) de muestra por tubo 100 10 1 (100 ul) (10ul) (1ul) 3 3 3 >1100 3 3 2 1100 3 3 1 500 3 3 0 200 3 2 3 290 3 2 2 210 3 2 1 150 3 2 0 90 3 1 3 160 3 1 2 120 3 1 1 70 3 1 0 40 3 0 3 95 3 0 2 60 3 0 1 40 3 0 0 23 55 2.6.2 Determinación de hongos y levaduras Primero se preparó el macerado inicial; para ello se disolvió 10 g de la muestra medidos con exactitud, en Solución Amortiguadora de Fosfato de pH 7,2, para obtener 100mL. y se homogenizó en el Stomacher durante 2 minutos. Así conseguimos el macerado inicial. Se Añadió 0.5 mL del macerado inicial en un tubo que contenga 4.5 mL de buffer fosfato pH 7,2 se homogenizó usando un agitador excéntrico de tubos de ensayo durante 20 segundos o agitando manualmente 25 veces en 7 segundos con movimientos ascendentes y descendentes formando un ángulo de abertura aproximado de 60º entre brazo y antebrazo. Se Repitió la operación anterior transfiriendo 0.5 de la dilución a otro tubo con 4.5 mL de buffer fosfato pH 7,2. Se procedió a pipetear 1 mL y se transfirió a dos placas Petri estériles por cada nivel de dilución. Se Agregó de inmediato a cada placa de 15 a 20 mL de medio Agar Dextrosa papa o Agar sabouraud, previamente fundido y enfriado aproximadamente 45º. Se Cubrió las placas Petri, se mezcló la muestra con agar inclinando ligeramente o rotando suavemente las placas y se dejó que el contenido se solidifique a temperatura ambiente. Se Invirtió las placas Petri e incubar a 25 o 28ºC hasta la aparición de colonias (aproximadamente 5 a 8 días) Tabla 2. Criterio de aceptación para la calidad microbiológica de hongos y levaduras, éste se interpreta de la siguiente manera: (FARMACOPEA USP 35 pp. 63) Criterio de aceptación para la calidad microbiológica de hongos y levaduras 101 ucf: recuento máximo aceptable: 20 102 ucf: recuento máximo aceptable: 200 103 ucf: recuento máximo aceptable: 2000 y así sucesivamente. 56 2.6.3 Determinación de Microorganismos Patógenos. 2.6.3.1 Prueba para Staphylococcus aureus y Pseudomonas aeruginosa. Del macerado inicial se sacó 10 gr y se agregó el Medio Caldo Tripticasa Soya (TSB) a la muestra, se mezcló y se procedió a incubar. Se examinó el medio para verificar el crecimiento y si hubo crecimiento, se utilizó un bucle de inoculación para realizar estrías con una porción del medio sobre la superficie del medio Agar Vogel Johnson (o Medio Agar de Baird-Parker o Medio Manitol-Agar Salado) y del Medio Cetrimide, cada uno de ellos se colocó en placas de Petri. Se Cubrió las placas, se invirtió y se incubó. Si al examinarlas, ninguna de las placas contiene colonias con las características enumeradas en las siguientes tablas, para los medios utilizados, entonces la muestra de prueba cumplirá con los requisitos de ausencia de Staphylococcus aureus y Pseudomonas aeruginosa. Tabla 3. Características morfológicas de Staphylococcus aureus en Medio Agar Selectivo. Medio Selectivo Morfología colonias características de las Medio Agar de Tinción de Gram Cocos positivos Negro, rodeado de una zona amarilla Baird Parker (en grupos) Tabla 4. Características Morfológicas de Pseudomona aeruginosa Medio Agar Selectivo y de Diagnostico. Medio Selectivo Morfología Fluorescencia característica de en Luz UV las colonias Prueba de Tinción Oxidasa de Gram Medio Agar Cetrimide Generalmente verdoso Positivo Verdoso Bastones negativos 57 2.6.3.2 Prueba para determinar la ausencia de Salmonella spp y Escherichia coli. Se agregó a la muestra que está contenida en un vaso adecuado, un volumen de Medio Liquido de Lactosa para obtener 100 mL y se incubó. Se examinó el medio para verificar el crecimiento, y si presentó crecimiento, se mezcló y agitó suavemente. Se procedió a pipetear porciones de 1 mL y se transfirió a tubos que contengan respectivamente 10 mL de Medio Líquido de Selenito-Cistina, se mezcló e incubó durante 12 a 24 horas. (Se conservó el remanente del medio Líquido de Lactosa). a) Prueba para determinar la ausencia de Salmonella spp. Por medio de un bucle de inoculación se hizo estrías de los medios SelenitoCistina sobre la superficie del Medio Agar Verde Brillante, del Medio Agar con Sulfito de Bismuto contenidos en placas de Petri. Se cubrió las placas, luego se invirtió e incubó. Si al examinar las placas, ninguna de las colonias se ajusta a la descripción que aparece en la siguiente tabla, nuestra muestra entonces cumplió con los requisitos, de la prueba para determinar la ausencia del genero Salmonella. Tabla 5. Características Morfológicas de Salmonella spp en medio Agar Selectivo Medio Selectivo Morfología características de las colonias Medio Agar con Sulfito de Bismuto Puntos de color negro o verde brillante b) Prueba para determinar la ausencia de Escherichia coli. Con ayuda de un bucle de inoculación, se hizo estrías con una porción del Medio Líquido de Lactosa restante sobre la superficie del medio Agar Mac Conkey. 58 Se cubrió las placas, se invirtió e incubó. Si al examinar las placas, y ninguna de las colonias se ajusta a la descripción que aparece en la siguiente tabla para este medio, la muestra cumplió con los requisitos de la prueba para determinar la ausencia de Escherichia coli. Tabla 6. Características Morfológicas de Escherichia coli en Medio Agar Mac Conkey. Tinción Gram Morfología características de las colonias Cocos negativos De color rojo ladrillo, pueden tener una zona (cocos-bacilos) de bilis precipitada alrededor 2.6.3.3 Pruebas bioquímicas complementarias. Se realizó pruebas bioquímicas complementarias para confirmar los microorganismos presentes en las colonias de, Salmonella spp y Escherichia coli. Siguiendo el procedimiento. Se transfirió las colonias sospechosas que fueron aisladas mediante un alambre de inoculación en tubos que contengan agar triple-azúcar-hierro, agar lisina hierro, citrato de Simmons y SIM (azufre, indol, movilidad), para el primero se inoculó por picadura hasta el fondo y estría en la superficie (pico de flauta), para el segundo se procedió de la misma manera, para el tercero se inoculó con una estría en la superficie del pico de flauta y el ultimo por picadura vertical. 59 Tabla 7. Características de resultados de pruebas bioquímicas para, Salmonella spp y E. coli. MEDIO Salmonella E. Coli TSI K/A A/A LIA K/K K/K C.S A/A = reacción acido sobre acido, K/A = reacción alcalino sobre acido, K/K = reacción alcalino sobre alcalino 2.7. Análisis e interpretación de los datos. Procesamiento de la información. El análisis e interpretación de los datos se realizó siguiendo en cuenta los parámetros establecidos por el control de límites microbianos según la Farmacopea USP 35 para materias primas utilizadas en productos de origen botánicos, el cual expresa el NMP para el control de aerobios mesófilos y ufc/gr para el recuento total de hongos y levaduras; así como también la de determinar la presencia o ausencia de patógenos como Pseudomona aeruginosa, Staphylococcus aureus, Salmonella spp, y Escherichia coli. Tabla 8. Parámetros de límites microbianos según farmacopea USP 35 para ingredientes y productos botánicos Indicadores microbiológicos Limites microbianos requeridos Microorganismos aerobios totales ≤1100 NMP Hongos y levaduras <103UFC/g Staphylococcus aureus Ausente Pseudomona aeruginosa Ausente Salmonella spp. Ausente Escherichia coli Ausente 60 Todos los resultados son procesados en una base de datos en el programa Excel 2010 y luego serán analizados en el programa SPSS 21. Haciendo usos de una estadística descriptiva presentados en tablas y gráficos, y según sea el caso las medidas de posición central: Media Aritmética, Desviación Estándar y Coeficiente de Variabilidad. CAPITULO III 3. RESULTADOS Tabla 9. Determinación de microorganismos aerobios mesófilos en Cariniana decandra. Nº de árbol Procedencia Coordenadas X 1 2 3 4 5 6 Nina Rumí Nina Rumi Nina Rumi Nina Rumi Puerto Almendra Puerto Almendra 0680196 0680394 0680196 0680353 0680196 0680201 Y 9575569 9575560 9575573 9575386 9575416 9575425 NMP microorganismos por g o por mL. órgano de la planta Corteza 1100 >1100 500 1100 >1100 500 Según la tabla 9, para la determinación de aerobios mesófilos en Cariniana decandra. se observó que de las 6 muestras de cortezas, las muestras 1, 3, 4 y 6 pasan la prueba por estar dentro del límite permitido (<103), de las 6 muestras de corteza, las muestras 2 y 5 no pasan la prueba por haber superado el límite permitido(<103). Tabla 10. Determinación de hongos y levaduras combinados en Cariniana decandra. Nº de árbol Procedencia Coordenadas X 1 2 3 Nina Rumí Nina Rumi Nina Rumi 0680196 0680394 0680196 UFC/gr de muestra Y órgano de la planta Corteza 9575569 9575560 9575573 100 2x102 100 61 4 5 6 Nina Rumi Puerto Almendra Puerto Almendra 0680353 0680196 0680201 9575386 9575416 9575425 1.5x102 2x102 1.6 x102 Según la tabla 10, para la determinación de hongos y levaduras combinados en Cariniana decandra se observó que las 6 muestras de cortezas, pasan la prueba por estar por debajo del límite permitido <103ufc/g. Tabla 11. Determinación de hongos y levaduras combinados en Cariniana decandra. Nº de árbol Procedencia Coordenadas X 1 2 3 4 5 6 Nina Rumí Nina Rumi Nina Rumi Nina Rumi Puerto Almendra Puerto Almendra 0680196 0680394 0680196 0680353 0680196 0680201 UFC/gr de muestra Y 9575569 9575560 9575573 9575386 9575416 9575425 órgano de la planta Corteza Aceptada Aceptada Aceptada Aceptada Aceptada Aceptada Según la tabla 11, para la determinación de hongos y levaduras combinados en Cariniana decandra se observó que las 6 muestras de cortezas son aceptadas por estar por debajo del límite permitido <103ufc/g. Tabla 12. Determinación de Staphylococcus aureus en Cariniana decandra. Staphylococcus aureus Nº de árbol Procedencia Coordenadas X 1 2 3 4 5 6 Nina Rumí Nina Rumi Nina Rumi Nina Rumi Puerto Almendra Puerto Almendra 0680196 0680394 0680196 0680353 0680196 0680201 UFC/gr de muestra Y 9575569 9575560 9575573 9575386 9575416 9575425 órgano de la planta Corteza Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia 62 Según la tabla 12, para la determinación de Staphylococcus aureus en Cariniana decandra se observó que las 6 muestras corteza pasan la prueba por encontrarse el microorganismo ausente. Tabla 13. Determinación Pseudomona aeruginosa en Cariniana decandra. Pseudomona aeruginosa Nº de árbol Procedencia Coordenadas X 1 2 3 4 5 6 Nina Rumí Nina Rumí Nina Rumí Nina Rumí Puerto Almendra Puerto Almendra 0680196 0680394 0680196 0680353 0680196 0680201 UFC/gr de muestra Y 9575569 9575560 9575573 9575386 9575416 9575425 órgano de la planta Corteza Ausencia Presencia Ausencia Ausencia Presencia Presencia Según la tabla 13, para la determinación de Pseudomona aeruginosa en Cariniana decandra se observó que de las 6 muestras de cortezas las muestras 1, 3, y 4 pasan la prueba por encontrarse el microorganismo ausente, mientras que de las muestras 2, 5 y 6 no pasan la prueba por encontrarse presencia del microorganismo. Tabla 14. Determinación de Salmonella spp en Cariniana decandra. Salmonella spp. Nº de árbol Procedencia Coordenadas X 1 2 3 4 5 6 Nina Rumí Nina Rumí Nina Rumí Nina Rumí Puerto Almendra Puerto Almendra 0680196 0680394 0680196 0680353 0680196 0680201 UFC/gr de muestra Y 9575569 9575560 9575573 9575386 9575416 9575425 órgano de la planta Corteza Ausencia Ausencia Ausencia Ausencia Ausencia Ausencia 63 Según la tabla 14, para la determinación de Salmonella spp en Cariniana decandra se observó que las 6 muestras de corteza pasan la prueba por encontrarse el microorganismo ausente. Tabla 15. Determinación de Escherichia coli en Cariniana decandra. Escherichia coli Nº de árbol Procedencia Coordenadas X 1 2 3 4 5 6 Nina Rumí Nina Rumí Nina Rumí Nina Rumí Puerto Almendra Puerto Almendra 0680196 0680394 0680196 0680353 0680196 0680201 UFC/gr de muestra Y 9575569 9575560 9575573 9575386 9575416 9575425 órgano de la planta Corteza Ausencia Presencia Ausencia Ausencia Presencia Presencia Según la tabla 15, para la determinación de Escherichia coli en Cariniana decandra se observó que las muestras 1, 3 y 4 de corteza pasan la prueba por encontrarse el microorganismo ausente; de las 6 muestras de corteza las muestras 2, 5 y 6 no pasan la prueba por encontrarse presencia del microorganismo. 4. DISCUSION DE LOS RESULTADOS La calidad microbiológica es un elemento de evaluación de la satisfacción de los requisitos microbiológicos que debe tener un producto, el control microbiológico se basa en la presencia y multiplicación de microorganismos, utilizando parámetros (recuento de: mesófilos aerobios, hongos, levaduras, coliformes totales y fecales), son parámetros que controlan la calidad sanitaria tanto de la materia prima como del producto terminado (2). Autores que analizaron drogas vegetales determinaron la calidad microbiológica de las mismas: Cruz (13) analizó Matricaria chamomilla (Manzanilla), Aristiguietia glutinosa (Matico) y Ambrosia arborescens (Marco) dando como resultado para el recuento total de mesófilos aeróbicos, levaduras y hongos ningún tipo de crecimiento 64 microbiológico en el producto. En el presente estudio se encontró que en Cariniana decandra (cinta caspi) solo 4 muestras de cortezas están dentro del rango del límite permitido, hay que recalcar que las especies presentes podrían ser especies bacterianas propias de la microflora de la planta. En el análisis de hongos y levaduras, tal como se puede observar en la tabla 10 muestran que Cariniana decandra (cinta caspi), no presenta un elevado recuento de estos microorganismos, y se ajusta al límite permitido por la farmacopea USP 35, estos resultados podrían deberse a lo que afirma el investigador Costa (11) quien indica que Cariniana estrellensis presenta moderada actividad antifúngica in vitro. Los resultados del análisis para determinar Staphylococcus aureus y Salmonella spp, muestran ausencia de estos patógenos como se puede observar en los cuadros de Cariniana decandra (cinta caspi), esto se ajusta a los requerimientos establecidos por la farmacopea USP 35. Los resultados de Cariniana decandra para determinar los microorganismos que nos sirven de indicadores para patógenos que deben estar ausentes en esta prueba, (Staphylococcus, Pseudomona, Salmonella y E. coli) como se puede observar estos microorganismos están presentes al menos en una de las muestras a excepción de Staphylococcus aureus y Salmonella spp (tablas 12, 13, 14,). Por otro lado (Ramírez), estudió la solución hidroalcohólica de Aspidosperma nitidum Benth “remo caspi” que pertenece a la misma clase del cinta caspi, y no encontró presencia de coliformes, esto podría deberse que al estar en una solución hidroalcólica esto actuaría como un inhibidor o bactericida. La presencia de Escherichia coli y Pseudomona aeruginosa en algunas muestras de corteza de Cariniana decandra, nos da un indicativo de que estas muestras no están aptas para ser usadas como insumo de productos vegetales. A pesar de que se tuvo 65 especial cuidado en la recolección, selección, transporte y acondicionamiento de estas muestras, estos procesos no garantizan una buena calidad microbiológica por lo que el producto pierde calidad en la cadena de producción, ya que existe el desconocimiento de buenas prácticas de recolección para plantas medicinales y carencia de normas técnicas nacionales. Por otro lado es relevante lo que afirma Vila (38) que las plantas medicinales para ser incorporados al sistema de salud y ser empleados deben reunir tres características que son: calidad, eficacia y seguridad; para asegurar su calidad, deben cumplir con las Buenas Prácticas de Almacenamiento y Recolección (BPA/R), Buenas Prácticas de Manufactura (BPM), Buenas Prácticas de Almacenamiento (BPA) y las Buenas Prácticas de Dispensación (BPD). Antes de su comercialización y uso deben realizarse un control de calidad fisicoquímico, microbiológico, toxicológico. 5. CONCLUSIONES De los 6 árboles muestreados de Cariniana decandra se determinó para aerobios mesófilos totales que las muestras 1, 3, 4 y 6 de corteza pasan la prueba por estar por debajo del límite permitido (≤1100NMP/g), y las muestras 2 y 5 de corteza no pasan la prueba por superar el límite máximo permitido (>1100NMP/g) (tabla 9). De los 6 árboles muestreados de Cariniana decandra, se determinó para hongos y levaduras que las 6 muestras de corteza pasan la prueba por estar por debajo del límite permitido <103ufc/g. (tabla 10). De los 6 árboles muestreados de Cariniana decandra, se determinó ausencia de Staphylococcus aureus en las 6 muestras de corteza de la especie (tabla 12). De los 6 árboles muestreados de Cariniana decandra, se determinó presencia de Pseudomona aeruginosa en la muestra 2, 5 y 6 de corteza. Todas las muestras contaminadas con Pseudomona aeruginosa no calificaron como materia prima vegetal bioactiva (tabla 13). De los 6 árboles muestreados de Cariniana decandra, se determinó ausencia de Salmonella spp en las 6 muestras de corteza de la especie (tabla 14). 66 De los 6 árboles muestreados de Cariniana decandra, se determinó presencia de Escherichia coli en la muestra 2, 5, 6 y no pasan la prueba. Todas las muestras contaminadas con Escherichia coli no calificaron como materia prima vegetal bioactiva (tabla 15). En la determinación de la calidad microbiológica de la especie de uso etnoterapéutico tradicional, las muestras de cortezas del árbol 1, 3 y 4 de Cariniana decandra, son aceptados como materia prima vegetal bioactiva porque presentaron parámetros de calidad microbiológica exigidos por la Farmacopea USP 35 y adoptados por la DIGEMID de Perú. 67 6. RECOMENDACIONES Realizar estrategias que involucren la educación de la población que trabaja en la comercialización, en la recolección, almacenamiento, manejo, limpieza y manipulación de esta planta y otras plantas medicinales en la ciudad de Iquitos. Realizar normas básicas de bioseguridad en el laboratorio, a la hora de manipular las muestras para evitar la contaminación y que influya en los resultados obtenidos. Socializar los resultados a los extractores habituales de plantas medicinales de uso en salud, a fin de dar a conocer sobre posibles contaminantes microbiológicos, que causan daños en la salud de la población consumidora. Seguir con estudios que amplíen estos resultados y que permita que esta planta medicinal sea aceptada como materia prima vegetal bioactiva de uso en salud. Realizar estudios de calidad microbiológica a los preparados hidroalcohólicas que se expenden y se elaboran a partir de la corteza de esta especie vegetal y de otras especies en la ciudad de Iquitos. 68 7. BIBLIOGRAFIA 1. Carballo-Abreu L, Rodríguez-Guerra Y., Arteaga-Crespo Y., Cadme M., Toledo, S. Fitoquímica de especies forestales con uso medicinal en comunidades del parque nacional Viñales- Cuba VI Simposio Internacional Sobre Manejo Sostenible de Recursos Forestales. 2010. p: 2 2. Torres M. Análisis microbiológico de materias primas utilizadas en elaboración de productos naturales en una industria colombiana [Tesis]. Bogotá: Universidad Pontificia Javeriana. Facultad de Ciencias; 2006. 3. VIII Curso Internacional De Tecnología Fitofarmacéuticas “Profesor Nikolai Sharapin”. Argentina; 26 de julio al 6 de agosto de 2010. Argentina: Facultad de Ciencias Bioquímicas y Farmacéuticas – UNR; 2010. 4. Mejía K, Rengifo E. Plantas Medicinales de Uso Popular en la Amazonía Peruana. 1ª ed Lima: Agencia Española de Cooperación Internacional; 2000.p. 194. 5. Galy S, Rengifo E, Hay YO. Factores de la organización del mercado de las plantas medicinales en Iquitos - Amazonía Peruana. Revista Folia Amazónica IIAP. 2000; 11(1-2):139. 6. Instituto de Investigaciones de la Amazonia Peruana. Prospección y evaluación de sustancias bioactivos y productos naturales. Bases de Plantas medicinales. Iquitos: Andina; 2010.p. 38. 7. Baluarte J, Arostegui A. Identificación y descripción de diecinueve especies forestales del bosque húmedo tropical (bh-t) colonia Angamos (Rio Yavarí) y Jenaro herrera. Rev. Folia Amazónica IIAP. 1990; 2: 55. 69 8. Ley de los productos farmacéuticos, dispositivos médicos y productos sanitarios. Ley 29459 /2009 26 de noviembre. Normas legales 406565. (1611-2009). 9. Cury G, Tomazello M. Caracterização e descrição da estrutura anatômica do lenho de seis espécies arbóreas com potencial medicinal. Revista brasilera Plantas Medicinales. 2011; 13(3):2-4. 10. Janovik V, Boligon A, Bandeira B, Athayde M. HPLC/DAD Analysis, Determination of Total Phenolic and Flavonoid Contents and Antioxidant Activity from the Leaves of Cariniana domestica (Mart) Miers. Rev. Journal of Phytochemistry. 2011; 5(4):209-215. 11. Costa D, Alves E, Barbosa R, Ferreira D, Soares J, Carvalho D, Samia T. Plant extract to control Alternaria alternata in Murcott tangor fruits. Rev. Iberoam Micol. 2011; 28(4):173-178. 12. Santos E, Lima J, Noldin V, Valdircechinel F, Rao V, Lima E, SchumedaHirschmann G, Sousa P, Martins D. Anti-inflammatory, antinociceptive and antipyreticeffectsofmethanolextract of Cariniana rubra stem bark in animal models. Rev. Annals of the Brazilian Academy of Sciences. 2010; 83(2):557566. 13. Cruz P. Elaboración y control de calidad del gel antimicótico de Matricaria chamomilla (Manzanilla), Aristiguietia glutinosa (Matico) y Ambrosia arborescens (Marco) para Neo-Fármaco [Tesis]. Riobamba: Escuela Superior Politécnica de Chimborazo. Facultad de Ciencias escuela de Farmacia y Bioquímica; 2009. 14. Inchaustegui R, Chian J, Cerruti T, Nina E, Chian J, Gorriti A, Gutiérrez M. Asma: Eficacia clínica del extracto liofilizado de la corteza de Cariniana decandra Ducke (cachimbo) en pacientes crónicos. Revista Biosalud. 2008; 1: 1-8. 70 15. Scott A, Chi-Hua T, Chi-Chih W, Bodil C, Arne A. Evolution of lecythidaceae with an emphasis on the circumscription of Neotropical genera: information from combined ndhf and trnl-f sequence data. Rev. American Journal of Botany. 2007; 94(3): 289–301. 16. Ramalho P. Jequitiba Branco: taxonomía y nomenclatura. Revista MvzCórdoba. 2003; 1: 1-13. 17. Nina E. Tamizaje fitoquímico de la Corteza de Cariniana decandra. Informe IMET-ESSALUD. Iquitos, Perú; 2001. 18. Nonato L, Ríos F. Evaluación Toxicológica aguda y a dosis repetida del extracto liofilizado de Cariniana decandra en ratones albinos. Informe IMET-ESSALUD. Iquitos, Perú; 2001. 19. Cerrutti T. Contribución a la botánica de la Cariniana decandra Ducke (Lecythidaceae). Informe IMET-ESSALUD. Iquitos, Perú; 2001 20. Babilonia C. Caracterización Fisicoquímica de los extractos acuosos de Calicophyllum sprueanun (Benth) “capirona” y Tabebuia heteropoda “tahuari” para el uso medicinal [Tesis]. Iquitos: Universidad Nacional de la Amazonia Peruana. Facultad de Forestales; 2001. 21. Betancourt J, Ríos F, Inchaustegui R, Nina E, Cerruti T, Villacrés J. Evaluación mutagénica de plantas medicinales de la Amazonia Peruana. En: Congreso científicas: IX Congreso de Farmacia y Bioquímica. Lima; Instituto de Medicina Tradicional, Perú; 2001.p. 54. 22. Ramírez L. Obtención y análisis preliminar de los extractivos de corteza del fuste de Aspidosperma nitidum Benth “remo caspi” y Kclusia rosea Jacq. “renaquilla” de uso medicinal en Iquitos [Tesis]. Iquitos: Universidad Nacional de la Amazonia Peruana. Facultad de Forestales; 1999. 71 23. Fernández A, García C, Sáez J, Valdezate S. Métodos de identificación bacteriana en el laboratorio de microbiología. En: Cercenado E, Cantón R, editores. Procedimientos en Microbiología Clínica. España: Sociedad Española; 2010. p. 3-5 24. Puerta A, Mateos F. Enterobacterias. Revista Medicine. 2010;10(51):26-31. 25. Galí Z. Enterobacterias. Antibioticoterapia. 1a ed. Lima: Apua Editores; 2010. 26. Parra M, Durango J, Máttar S. Microbiología, patogénesis, epidemiología, clínica y diagnóstico de las infecciones producidas por salmonella. Revista Mvz-Córdoba. 2002;7(2):187-200. 27. Méndez IL, Badillo C, Ortiz GA, Faccini A. Caracterización microbiológica de Salmonella en alimentos de venta callejera en un sector universitario de Bogotá, Colombia. Julio a octubre de 2010. Revista médicas uis. 2011; 24:26-33. 28. Jurado R, Arenas C, Doblas A, Rivero A, Cisneros J. Fiebre tifoidea y otras infecciones por salmonellas. Revista Medicine. 2010; 10(52):497-501. 29. Gómez J, Alcántara M, Simarro E, Martínez B, Ruiz J, Guerra B, et al. Bacteriemias por Pseudomonas aeruginosa: epidemiología, clínica y tratamiento. Rev. Esp Quimioterap. 2002;15(4):360-365 30. Gómez CA, Leal AL, Pérez MJ, Navarrete ML. Mecanismos de resistencia en pseudomonas aeruginosa. Rev Fac Med Univ Nac Colomb. 2005; 53(1):28– 29. 31. Piersigilli A, Enrico M, Bongiovanni E, Bilbao E, Martínez G, Ledesma E. Aislados clínicos de Pseudomonas aeruginosa productores de β-lactamasa de espectro extendido en un centro privado de Córdoba. Rev Chil Infect. 2009; 26(4): 331-335. 72 32. Seija V. Género Staphylococcus. En. Carballal J, editor. Etiopatogenia microbiológica. España: Médica Panamericana; 2008. p. 257 – 264. 33. Maguilla E, Prado M, Amodeo C, Ortiz L, López M. Introducción microbiológica. 2ª ed. Madrid: Sm; 2009. 34. Rengifo E. Contribución de la etnomedicina - Plantas medicinales a la salud de la población en la Amazonía. Instituto de Investigaciones para la Amazonía peruana – IIAP. 2011. p.26–27. 35. Lara H, Ayala NV, Rodríguez C. Bioseguridad en el laboratorio: medidas importantes para el trabajo seguro. Revista bioquimia. 2008; 33(2):59-70. 36. Allende M, Bono M, Echeverría M, Guiliani N, Gysling K, Handford M. et al. Manual de normas de bioseguridad. 2da ed. Chile: Fondecyt – Conicyt; 2008. 37. Casado C; Torrico G; Medina M. Medios de cultivo en un laboratorio de microbiología. 1ra ed. Lima: Interamericana; 2012. 38. Vila G. Análisis del uso de plantas medicinales en mercados de abastos del distrito de Ventanilla-Callao [Tesis]. Lima: Universidad Nacional Mayor de San Marcos. Facultad de Farmacia y Bioquímica: 2007. 73 8. ANEXOS Anexo 1. Determinación de Patógenos: Recuento Total De Aerobios Mesófilos (NMP) 10g 90ml Buffer fosfato pH 7.2 0.5ml 4.5ml TSB A 4.5ml TSB 0.5ml B 4.5ml TSB Incubar: 35°C x 24-48h Lectura: Tabla NMP CONTROL 1 2 3 74 Anexo 2. Prueba para Staphylococcus aureus y Pseudomonas aeruginosa 100g 10 01 10g 90ml TSB 35°C x 24h 1asa 1asa Manitol Salado 35°C x 24h Cetrimide Anexo 3. Prueba para determinar la ausencia de Salmonella spp 100g 10g 90ml Caldo lactosado 35°C x 24h 1ml Caldo Selenito-cistina 12 x24h/35°C 1 asa Agar Bismuto Sulfito 75 Anexo 4. Prueba para determinar la ausencia de Escherichia coli. 100g 10g 90ml caldo lactosado35°C x 24h 1asa MacConkey Incubar x 24h a 30-35°C Anexo 5. Recuento total combinado de Hongos y Levaduras. 10g 90ml Buffer fosfato pH 7.2 0.5ml 4.5mlBuffer 4.5mlBuffer 1ml 18ml de agar Sabouraud 18ml de agar Sabouraud Sabouraud Dextrosa Dextrosa Incubar durante 5 a 7 días a una temperatura de 20º a 25º 76 Anexo 6. Pruebas de Identificación para bacterias aisladas en corteza de Cariniana decandra (cinta caspi). Staphylococcus aureus Nº de árbol 1 2 3 4 5 6 Procedencia Nina Rumí Nina Rumí Nina Rumí Nina Rumí Puerto Almendra Puerto Almendra Coordenadas COAGULASA (+) X Y 0680196 0680394 0680196 0680353 0680196 0680201 9575569 9575560 9575573 9575386 9575416 9575425 órgano de la planta Corteza (-) (-) (-) (-) (-) (-) 77 Anexo 7. Pruebas de Identificación para bacterias aisladas en corteza de Cariniana decandra (cinta caspi). Nº de árbol Procedencia AGAR BISMUTO SULFITO AGAR MC CONKEY Salmonella spp. Escherichia coli TSI LIA CS SIM TSI LIA CS SIM 1 Nina Rumí K/A (-)(-) K/K (+) (-) (-) (-) A/A (-)(-) K/K (+) (-) (+) (+) 2 Nina Rumí K/A (+)(-) K/K (+) (-) (+) (+) A/A (+)(-) K/K (+) (-) (-) (-) 3 Nina Rumí A/A (+)(-) K/K (-) (-) (-) (+) K/A (+)(-) K/K (+) (-) (-) (-) 4 Nina Rumí K/K (-)(-) K/A (-) (-) (+) (-) K/A (+)(-) K/K (+) (-) (-) (-) 5 Puerto Almendra A/A (+)(-) K/K (-) (-) (-) (-) A/A (+)(-) K/K (+) (-) (+) (-) 6 Puerto Almendra A/A (+)(-) K/K (-) (-) (-) (+) A/A (+)(-) K/K (+) (-) (-) (-) 78 RECOLECCION DE LAS MUESTRAS 79 PROCESAMIENTO DE LAS MUESTRAS 80 MACERADO INICIAL DE LAS MUESTRAS DILUCIONES PARA EL ENSAYO DEL NUMERO MAS PROBABLE (NMP) CRECIMIENTO DE COLONIAS PARA EL RECUENTO COMBINADO DE HONGOS Y LEVADURAS 81 CRECIMIENTO DE Pseudomona Aeruginosa EN AGAR CETRIMIDE AUSENCIA DE Salmonella spp EN AGAR SULFITO DE BISMUTO CRECIMIENTO DE Escherichia Coli EN AGAR MACCONKEY 82 AUSENCIA DE Staphylococcus aureus EN MANITOL SALADO Y PRUEBA DE LA COAGULASA PRUEBAS BIOQUIMICAS (TSI, LIA, CITRATO Y SIM) REALIZADAS A LAS COLONIAS SOSPECHOSAS 83 TÉCNICA DE NUMERO MAS PROBABLE (NMP) LECTURA DE PLACAS 84 Anexo 8. Certificación de la Planta en Investigación. 85 Anexo 9. Mapa con los puntos de colecta de la especie Cariniana decandra (cinta caspi) en el área de intervención del estudio. 86