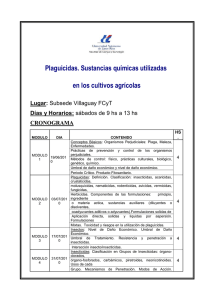
Para más información, haga clic aqui para descargar el archivo
Anuncio

Mecanismo de acción del herbicida y su relación con la resistencia de malezas a herbicidas JOSÉ CLAUDIONIR CARVALHO1 RAMIRO F. LOPEZ OVEJERO2 PEDRO J. CHRISTOFFOLETI3 1. Introducción Elusode herbicidases la prácticadominante enel control de malezas. Laselección delas poblaciones de malezasresistentesa los herbicidassurgiócon mayor intensidada partir delos años 80, con el desarrollode productos altamente eficientesyselectivos, aunquesensibles al problemade la resistencia,comolosinhibidores de la ALS y la ACCasa. Elmecanismo de acciónes laforma específica en queun herbicidainterfieresignificativamenteenun procesobiológico particular(Kissmann, 2003). A continuación se discutenlosmecanismosdeacción de los herbicidasque presentan medio y alto riesgo de selección debiotipos resistentes. GRUPOA -Inhibidores de la síntesisde lípidos(Inhibidores de la ACCasa) Losariloxifenoxipropionatoyciclohexanodionas son dos grupos deherbicidas químicosutilizados para el control degramíneas anualesy perennes encondicionesde post-emergencia. Estos herbicidasse recomiendan generalmentepara los cultivosque pertenecen ala clasedelas dicotiledóneas(Vidal yFleck, 1997; Christoffoleti, 2001). Presentan como mecanismo de acciónlainhibición de laACCasa(acetil-CoAcarboxilasa), que esuna de lasenzimas responsables de lasíntesis de ácidos grasos.La enzimaactúaenla etapa inicial dela síntesis deácidosgrasos, que sonconstituyentes delos lípidosque se producenen las membranas celularesy 1 Eng. Agr., Dr., Departamento de Pesquisa e Desenvolvimento da Dow AgroSciences, Vice-Presidente Educacional da Associação Brasileira de Ação a Resistência de Plantas a Herbicidas (HRAC-BR) . E-mail: claudionir@dow.com Professor Associado, Universidade de São Paulo, Escola Superior de Agricultura “Luiz de Queiroz” (USP/ESALQ), Departamento de Produção Vegetal, Área de Biologia e Manejo de Plantas Daninhas; Endereço: USP/ESALQ – Dep. Produção Vegetal – Caixa Postal 09 – CEP 13.418-900 – Piracicaba – SP; e-mail: pjchrist@esalq.usp.br. 2 Eng. Agr., M.Sc., Doutorando do Curso de Agronomia, Área de Concentração Fitotecnia, da Universidade de São Paulo, Escola Superior de Agricultura “Luiz de Queiroz” (USP/ESALQ), Departamento de Produção Vegetal. E-mail: rfloveje@esalq.usp.br organelas. Estos lípidosregulanla permeabilidadselectiva(Kissmann, 2003). Los herbicidasde este grupo soninhibidoresno competitivosy reversibles dela enzimaACCasa(Merotto yVidal, 2001). Los herbicidasde este grupopueden desarrollarresistencia cruzada, pero estono siempre sucede. Por ejemplo, productostales comosethoxydimytepraloxidimhandemostradoresistencia cruzada. Por lo tanto, el grupo deberíaser subdividido enA1yA2 (Kissmann, 2003). En el mundo, fueron encontrados32biotipos resistentesa este grupode herbicidas(Weed Science, 2003). GrupoB-inhibidores de laacetolactato sintasa(ALS) Según Christoffoleti (1997), los herbicidas inhibidores de la acetolactato sintasa (ALS) o la acetohydroxyacid sinthase (AHAS) pertenecen a diferentes grupos químicos, entre ellos las sulfonilureas,imidazolinas y triazolopirimidinas, y los pirimidiloxitiobenzoatos. Estos herbicidas tienen como un mecanismo de acción la inhibición de la síntesis de aminoácidos alifáticos de la cadena lateral: valina, leucinae isoleucina(Trezzi yVidal, 2001). Lavía biosintética deestos tres aminoácidos presentanen común el uso deuna enzima llamadaALS, que participa en la fase inicial delproceso metabólico, catalizando unareacción de condensación(Christoffoleti, 2001). Losherbicidas inhibidores dela ALSimpiden que esta reacción de condensaciónacontezca provocando, en consecuencia, el bloqueo dela producción delos aminoácidosvalina, leucinae isoleucina. Cuandoel herbicidaestá presentedentro de la céluladeuna planta susceptible, hay unainhibición no competitivapor el herbicidacon el sustrato, de tal manera que nose produceformación delacetolactatoindispensablepara que las demás reacciones prosigan para la formaciónde los aminoácidos.La paralizaciónen la síntesis deaminoácidosda lugar auna interrupciónde la división celulary a ladetencióndel crecimiento (Kissmann, 2003). Unbiotipo de malezaes resistentea los inhibidores deALSdebido auna alteraciónen el gen responsablepara la codificación deesta enzima(Shaner, 1991). En el mundo, fueron encontrados79biotipos resistentesa este grupode herbicidas(Weed Science, 2003). GRUPOCHerbicidas inhibidores del fotosistema II Los herbicidas actualmente en uso y que presentan mecanismo de acción de inhibición de la fotosíntesis pertenecen a tres principales grupos químicos: triazinas, ureas sustituidas y uracilo. El sitio de acción de estos herbicidas es en la membrana del cloroplasto, donde se desarrolla la fase luminosa de la fotosíntesis, más específicamente en el transporte de electrones (Christoffoleti, 1997). Una planta es susceptible a los herbicidas inhibidores de la fotosíntesis si el herbicida se acopla al compuesto Qb, componente del sistema fotosintético y, así, impide el transporte de electrones hasta la plastoquinona. De esa forma, no existe la producción de ATP, pues el transporte de electrones es interrumpido, así como la producción de NADPH2. Ya en una maleza resistente hay un proceso de mutación en el compuesto Qb, de manera que el herbicida no consigue acoplarse al compuesto, impidiendo el transporte de electrones. Por lo tanto, una planta resistente a herbicidas inhibidores de la fotosíntesis consigue efectuar el transporte de electrones en la fase luminosa de la fotosíntesis, incluso en presencia del herbicida (Christoffoleti, 1997). En el mundo, fueron encontrados 64 biotipos resistentes al Grupo C1, 20 al Grupo C2 y 1 al Grupo C3 (Weed Science, 2003). El mecanismo de acción de ureas sustituidas es el mismo del grupo de las triazinas / triazinonas; sin embargo, el sitio de acción en el Qb compuesto es diferente, por lo que generalmente no hay resistencia cruzada entre ellos (Christoffoleti, 2001). GrupoD-Inhibidoresdel fotosistemaI (formación de radicales libres) Losherbicidasparaquat ydiquatsonherbicidas del tipo bipiridilos, que presentan como sitio de acción el fotosistema I, en la fase luminosade la fotosíntesis, por lo tanto, en lamembranadelos cloroplastos. Cuandoel electrónes transferido dela ferrodoxina al NADPse presenta la acción delos herbicidasbipiridilos. Dado que los cationes de estosherbicidasson muy fuertes, desvíanel electróndestinadoalNADP para el herbicida, reduciendo el mismo(serían utilizadospara reducirel NADP aNADPH2). El herbicidaenestado reducidoes inestable, de manera que vuelve a suestado normal,reducido, cediendo el electróna una moléculadeO2. La molécula deO2juntamente conel electrón cedido por elparaquatreducido, es llamadoradical libre(superóxido). Elsuperóxidorápidamente se condensaconuna molécula de agua,para formarH2O2(agua oxigenada). El agua oxigenada es un potente destructor de membrana, a través de la peroxidación de lípidos(Christoffoleti, 1997). GRUPO E -inhibidoresProtox(inhibidores de la formación detetrapirol) LaProtoxestá presente enla rutade la síntesisde la clorofilaycitocromos, también llamadala rutadesíntesis deporfirinasoTetrapirroles(Merotto yVidal, 2001). El mecanismodeacción de los herbicidasinhibidores dela protoxse basa en la inhibicióndela reaccióndetransformaciónde la protoporfirinaenprotoporfirinogeno. Esta reacciónes catalizada por laprotoporfirinogenooxidasa(PROTOX). Con la inhibiciónde esta enzima, presente enel cloroplasto, hay una acumulacióndeprotoporfirinogenoque se desplaza del cloroplastoal citoplasmay en contactocon el oxígeno,en presenciade luz, forman radicales libresy provoca la peroxidaciónde los lípidos de las membranas. Hasta este momento solo se hadetectadounbiotipo de malezaresistenteaestos herbicidasen la agricultura, por lo tanto, la probabilidad de selecciónesrestringida(Weed Science, 2003). Grupo F-inhibidores dela biosíntesis decarotenosHerbicidas Losherbicidasdeeste grupoprovocanla inhibición de lasíntesis de los carotenoides, con posteriorgeneración deestrés oxidativo, que destruyelas membranas celulares, lo que conduce ala muertede las plantas(Kruse, 2001). El caroteno esun pigmentode las plantasresponsable, entre otras funciones, de proteger a la clorofila de lafoto-oxidación; por lo tanto, lasplantassusceptiblestienen los síntomasdel albinismo("blanqueamiento") de los tejidosfotosintéticos. En cuanto a laposibilidad de desarrollode biotiposresistentes esnecesario dividirlosherbicidas coneste modo de acciónen tres grupos: a)los inhibidores dediterpenos(clomazoneGrupoF3) b) inhibidores de la enzimahidroxifenilpiruvatodioxigenasa(isoxaflutole GrupoF2)yc) inhibidores dela fitoenodesaturasa(norflurazón, GrupoF1) (Christoffoleti et al. 2001). En el mundo, fueron encontrados dos biotipos resistentesa este grupode herbicidas(Weed Science, 2003). GrupoG -Inhibidores de laEPSPs(glifosato) El primersíntoma observadodespués del tratamiento conglifosatoesla inhibición del crecimiento, seguido dela clorosisdelos tejidos tratados. Elmecanismo de acciónes la inhibición dela biosíntesis deaminoácidosaromáticos(fenilalanina, tirosinaytriptófano) a través de la inhibición delaenzimaEPSPs(5-sintasa enolpiruvinilshikimate-3-fosfato) en la vía deshikimato. Sobreel motivodela apariciónde malezasresistentes al glifosatoexisten muchas dudas, pero lo quese sabe esque la acumulación deshikimatono se produceyasí, al parecer, la EPSPnose inhibe. La teoríaactualmenteaceptada es quelas malezasresistentes al glifosatono mueven al sitio de acciónen el cloroplasto. Es difícil que se produzca la aparición demalezas resistentesal glifosato; hasta ahora se informasólo cuatrobiotipos(Weed Science, 2003). GRUPO K1 - Los herbicidas que inhiben la formación de microtúbulos Pendimethalin y trifluralina son herbicidas utilizados en los cultivos que presentancomo mecanismo de acción la inhibición de la división celular, impidiendo la polimerización de los microtúbulos durante la formación del huso en la división celular. Los microtúbulos son responsables del movimiento de los cromosomas durante la división celular (Vidal y Fleck, 2001). Durante el proceso de la mitosis (profase y metafase) existe la formación del huso en la división cromosómica, para que en la anafase se produzca una separación cromosómica del proceso de división celular. Esta huso de la división celular está formado a partir de una proteína llamada tubulina (Christoffoleti, 2001). En el mundo, fueron encontrados 10 biotipos resistentes a este grupo de herbicidas (Weed Science, 2003). 5. Clasificación de los herbicidas (véase la Tabla 1 al final del texto) Hay muchos criterios para agrupar los herbicidas; el más utilizado es de acuerdo con el mecanismo de acción. Las tablas agrupan productos con mecanismo de acción similar. Estos son útiles para la selección de diferentes herbicidas. Bibliografía Christoffoleti, PJ resistencia de las malezas a los herbicidas. En: I Simposio y WEED HERBICIDE, Golden - MS, EMBRAPA, 1997, p. 75-94. Christoffoleti, PJ; CORTEZ, MG; MONQUEIRO, PA. Bases de la resistencia de malezas a herbicidas. En: III Seminario Nacional sobre Gestión y Control de Malezas en No-Hasta 2001, Passo Fundo, RS. Resumen de las conferencias. Editorial Pueblo Norte, Passo Fundo, RS. p.39-53, 2001. Kissmann, KG resistencia de las malezas a los herbicidas. Disponible: http://www.hracbr.com.br/arquivos/texto_reisitencia_herbicidas.doc. 01/05/2003. Kruse, inhibidores de la síntesis de carotenoides ND. Herbicidologia / Vidal, RA, Merotto Jr., A. (Eds.), Porto Alegre: 2001. p.113 - 122. Merotto Jr., A.; VIDAL, AR protox herbicidas inhibidores. Herbicidologia / Vidal, RA, Merotto Jr., A. (Eds.), Porto Alegre: 2001. p.69 - 86. Shaner, DL mecanismos de resistencia a acetolactato sintasa / inhibidores de la acetohidroxiácido sintasa. En: Caseley, JC; Cussans, GW, ATKIN, RK resistencia a los herbicidas en las malezas y los cultivos. Oxford: Butterworth-Heinemann, 1991. p.2743. Trezzi, MM; VIDAL, AR herbicidas inhibidores de ALS. Herbicidologia / Vidal, RA, Merotto Jr, A. (Eds.), Porto Alegre: 2001. p. 25-36. VIDAL, R. A.; FLECK, N.G. Herbicidas: mecanismos de acción y la resistencia de las plantas. Porto Alegre: Palotti, 1997. 165p. VIDAL, R. A.; FLECK, N.G. Los inhibidores de crecimiento de los brotes. Herbicidologia / Vidal, RA, Merotto Jr, A. (Eds.), Porto Alegre: 2001. p.123 - 130. VIDAL, R. A.; FLECK, N.G. La inhibición de la polimerización de tubulina. Herbicidologia / Vidal, RA, Merotto Jr, A. (Eds.), Porto Alegre: 2001. p.131 - 137. VIDAL, R. A.; Merotto Jr, A. Inhibidores ACCasa. Herbicidologia / Vidal, RA, Merotto Jr, A. (Eds.), Porto Alegre: 2001. p.15 - 24. Weed Science. Encuesta internacional de malezas resistentes a los herbicidas. Disponible: http://www.weedscience.org/in.asp. 01/05/2003. Tabla 1. Mecanismo de acción de los principales grupos químicos de herbicidas comercializados en Brasil (adaptado de CARH, 2001). Inhibidores ACCasa (acetil CoAcarboxilasa). Grupo A Ariloxifenoxipropiônicos: quizalofop-p-etilo, propaquizafop, fluozifop-p-butilo, haloxifopp-metilo, clodinafop de propargilo, cyalofop-butilo, diclofop-metilo, fenoxaprop-p-etilo. Ciclohexanodionas: butroxidimAlloxydim, clefoxidim, cletodim, tralkoxydim, tepraloxydin, sethoxydim, cicloxydim. Inhibidores de ALS (acetohidroxiácidosintase). Grupo B Sulfonilureas: chlorimuron-etilo, etoxysulfuron, metsulfurón metilo, Flazasulfurón, pirasulfuron-etilo, halosulfuron, nicosulfuron, oxasulfurón, foramsulfuronyodosulfurón. Imidazolinona: imazamox, imazetapir, imazapic, imazaquin, imazapyr. Triazolopirimidina: flumetsulamdiclosulan, chloransulan-metilo. Pirimidiloxibenzoatos: piritiobac en sodio, sodio-bispiribac. Inhibidores de la fotosíntesis (fotosistema II). Grupo C C1: triazinas: atrazina, ametrina, simazina, cianazina, prometrina. Triazinonas: METRIBUZIN, hexazinone. Grupo C2: Ureas sustituida: diurón, linurón y tebuthiuron. Amidas: propanil. C3: Benzotiadiazoles: Bentazone Los inhibidores de la fotosíntesis (fotosistema I). Grupo D Bipiridiluns: Paraquat y diquat Inhibidores de protox (PPO) (oxidasa Protoporfirinogen). Grupo E Difenil: sodio acifluorfeno, oxifluorfen, diclofop-metilo, fomesafen, lactofen. Ftalimidas: fumiclorac-pentilo, flumioxazina. Oxadiazoles: oxadiazon. Triazolinona, sulfentrazona, Carfentrazona, azefendim. Inhibidores de la biosíntesis caroteno (PDS). Grupo F Grupo F1: piridazinona: norflurazona. Grupo F2: IsoxazolIsoxaflutolTricetonas: mesotriona. Grupo F3: Isoxazolidinona: clomazona. EPSP de inhibidor. Grupo G Los derivados de glicina: glifosato y sulfosato. Los inhibidores de la GS (glutamina sintetasa). Grupo H Ácidos fosfínicos: glufosinato. La inhibición de la formación de los microtúbulos. K1 Grupo Dinitroanilinas: trifluralin, pendimenthalin, orizalina. Piridazinas: ditiopir, tiazopir. Ácidos benzoico: DCPA. Los inhibidores de la división celular. Grupo K3 Cloroacetamidas: alaclor, metolaclor, acetoclor, butaclor y dimethanamid. Acetamidas: napropamida y difenamid. Auxinas sintéticas. El Grupo Ácidos fenoxi acético: 2,4-D, MCPA. Ácidos benzoico: Dicamba. Piridinas: Quinclorac; ftalimidas: fluroxipyr, triclopyr, picloran. Desconocido. Grupo Z Organoarsenicais: MSMA, Otros Notas: 1. Cada familia química de los herbicidas puede contener uno o varios herbicidas diferentes. Es importante que en el momento de la selección del herbicida se identifica que la familia química herbicida pertenece, y por lo tanto el mecanismo de acción. 2. Algunos grupos / subgrupos que no se incluyeron en la lista, ya que no hay productos comercializados en Brasil, por ejemplo K2 y L. Agr., El doctor del Departamento deInvestigación y Desarrollo deDowAgroSciences, Vice-Presidente de la Asociación deEducaciónAcciónPlantResistencia aHerbicidas (CARH-BR). E-mail: claudionir@dow.com Profesor Asociadode la Universidad deSãoPaulo, EscolaSuperior de Agricultura"Luiz de Queiroz" (USP/ESALQ), Departamento de Producción Vegetal, Biología y Gestiónde Malezas; Dirección:USP /ESALQ-Dep.Producción Vegetal-Buzón09- CEP13418-900Piracicaba-SP,e-mail: pjchrist@esalq.usp.br. Agr., M.Sc., Ph.D. Cursode Agronomía, Crop ScienceÁrea de Concentraciónde la Universidad deSãoPaulo, EscolaSuperior de Agricultura"Luiz de Queiroz" (USP/ESALQ), Departamento de Producción Vegetal. E-mail: rfloveje@esalq.usp.br