PLANIFICACIÓN CURRICULAR DOCENTE: Anays Mata Mayo
Anuncio
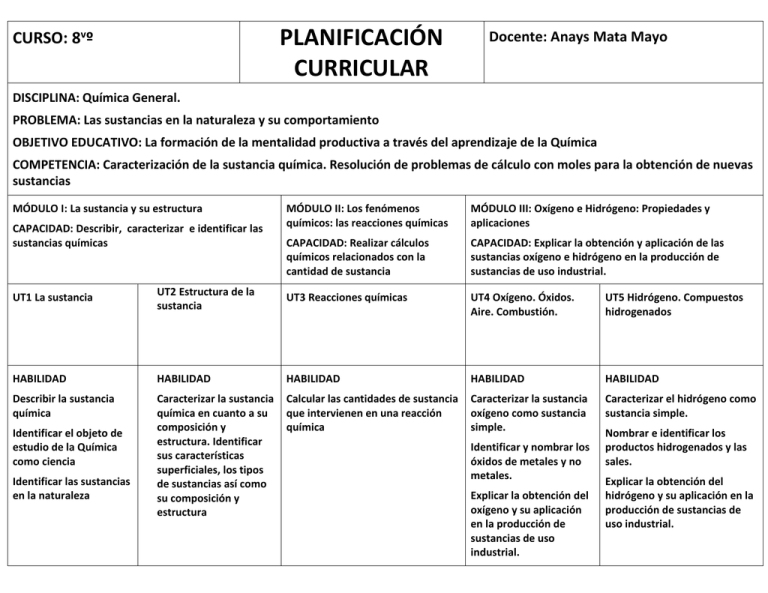
PLANIFICACIÓN CURRICULAR CURSO: 8vº Docente: Anays Mata Mayo DISCIPLINA: Química General. PROBLEMA: Las sustancias en la naturaleza y su comportamiento OBJETIVO EDUCATIVO: La formación de la mentalidad productiva a través del aprendizaje de la Química COMPETENCIA: Caracterización de la sustancia química. Resolución de problemas de cálculo con moles para la obtención de nuevas sustancias MÓDULO I: La sustancia y su estructura CAPACIDAD: Describir, caracterizar e identificar las sustancias químicas MÓDULO II: Los fenómenos químicos: las reacciones químicas MÓDULO III: Oxígeno e Hidrógeno: Propiedades y aplicaciones CAPACIDAD: Realizar cálculos químicos relacionados con la cantidad de sustancia CAPACIDAD: Explicar la obtención y aplicación de las sustancias oxígeno e hidrógeno en la producción de sustancias de uso industrial. UT1 La sustancia UT2 Estructura de la sustancia UT3 Reacciones químicas UT4 Oxígeno. Óxidos. Aire. Combustión. UT5 Hidrógeno. Compuestos hidrogenados HABILIDAD HABILIDAD HABILIDAD HABILIDAD HABILIDAD Describir la sustancia química Caracterizar la sustancia química en cuanto a su composición y estructura. Identificar sus características superficiales, los tipos de sustancias así como su composición y estructura Calcular las cantidades de sustancia que intervienen en una reacción química Caracterizar la sustancia oxígeno como sustancia simple. Caracterizar el hidrógeno como sustancia simple. Identificar el objeto de estudio de la Química como ciencia Identificar las sustancias en la naturaleza Identificar y nombrar los óxidos de metales y no metales. Explicar la obtención del oxígeno y su aplicación en la producción de sustancias de uso industrial. Nombrar e identificar los productos hidrogenados y las sales. Explicar la obtención del hidrógeno y su aplicación en la producción de sustancias de uso industrial. CONTENIDO CONTENIDO CONTENIDO CONTENIDO CONTENIDO Los fenómenos y el objeto de la Química Teoría atómico molecular. Manifestaciones de las reacciones químicas y condiciones para que estas ocurran Oxígeno. Estado natural. Hidrógeno. Propiedades físicas y estado natural. Sustancias en la naturaleza: Agua, Aire y Suelos Las moléculas. Los átomos. Partículas que componen el átomo. El agua: estados de agregación e importancia. Elementos químicos y símbolos químicos. El aire. Contaminación Magnitud Masa atómica. Los suelos: fuente de recursos minerales Las sustancias y sus características: propiedades y magnitudes Las sustancias puras y las mezclas Sustancias simples y compuestas. Fórmulas de las sustancias. Masa molecular. Metales y no metales. Las mezclas mecánicas y las disoluciones Magnitud Valencia. Composición de las fórmulas según la valencia. Separación de los componentes de las mezclas y las disoluciones Composición constante de las sustancias. Composición centesimal. Fenómenos físicos y químicos FECHA: Abril 2012 Formación de un cuerpo sólido Desprendimiento de un cuerpo gaseoso Cambio de coloración Desprendimiento o absorción de energía Tipos de reacciones químicas. Descomposición y combinación. Ley de conservación de la masa. La ecuación química. Mol. Número de Avogadro. Cálculo con moles. Cálculos químicos. Obtención del oxígeno en el laboratorio y en la industria. Catalizadores. Propiedades físicas y químicas del oxígeno. Aplicaciones en la medicina y en la industria. Ozono. Ecuaciones termoquímicas. Óxidos. Clasificación y nomenclatura. Aire. Composición. Propiedades de los gases. Propiedades del aire y los gases. Las leyes de los gases. Combustión. Obtención del hidrógeno en el laboratorio. Propiedades químicas del hidrógeno. Reacción de sustitución. Propiedades químicas del agua. Reacción con óxidos y metales activos. Hidróxidos. Composición. Clasificación y nomenclatura. Propiedades y aplicaciones en la medicina, fabricación de jabones y otras ramas de la industria. Ácidos. Obtención por reacción de los óxidos de no metales con el agua. Estructura y propiedades. Nomenclatura y clasificación. Aplicaciones. Reacción de neutralización. Reacción de intercambio. Disoluciones. El agua. Estructura y propiedades del agua. El agua como disolvente. Sustancias solubles y no solubles. Electrólisis del agua. Sales. Obtención en el laboratorio. Nomenclatura. FECHA: Agosto 2012 FECHA: Noviembre 2012 CURSO: 9nº 2012 PLANIFICACIÓN CURRICULAR DOCENTE: Anays Mata Mayo DISCIPLINA: Química General. PROBLEMA: Las sustancias químicas y sus transformaciones. COMPETENCIA: Nombrar y escribir un compuesto químico y realizar los cálculos estequiométricos en una reacción química MÓDULO: I MÓDULO: II MÓDULO: III CAPACIDAD: Nombrar y simbolizar los elementos químicos, ubicarlos en la tabla periódica y predecir sus propiedades químicas a partir de su estructura. CAPACIDAD: Realizar cálculos químicos asociados a la estructura de la sustancia. CAPACIDAD: Realizar cálculos estequiométricos en reacciones químicas. UT1 Enlace Químico. Nomenclatura y propiedades de las sustancias compuestas UT2 Cálculos químicos UT3 Reacciones químicas y cálculos estequiométricos HABILIDAD HABILIDAD HABILIDAD Realizar cálculos químicos asociados a la estructura de la sustancia. Representar las reacciones químicas a través de las ecuaciones Predecir las propiedades químicas a partir de la ubicación en la Tabla periódica Identificar el tipo de enlace a partir de la ubicación de los elementos en la tabla periódica Identificar los tipos de reacciones Balancear las ecuaciones Predecir las propiedades y comportamiento químico de las sustancias compuestas Calcular la cantidad de sustancia que se transforma en una reacción química expresada en cantidad de sustancia, masa y volumen. Representar mediante los diferentes modelos el enlace químico Nombrar los compuestos químicos CONTENIDO CONTENIDO CONTENIDO Generalidades de los enlaces químicos Cálculos químicos. Reacciones químicas. Tipos. Configuración electrónica de los átomos del enlace Concepto de mol. Número de Avogadro. Ecuaciones químicas. Símbolos de Lewis. Regla del octeto. Regla del dueto Masa atómica y masa molecular. Igualación de ecuaciones. Enlace iónico. Elementos que forman enlaces iónicos. Estructura y propiedades de los compuestos con enlace iónico Fórmula empírica y global. Pureza. Composición porcentual de las sustancias. Cálculos estequiométricos mol-mol. Enlace covalente. Tipos de enlaces covalentes. Enlace covalente simple. Enlace covalente doble. Enlace covalente triple. Elementos que forman enlaces covalentes. Propiedades de los compuestos covalentes. Masa molar. Cálculos gramo-mol. Volumen molar. Cálculos litro-mol. Reactivo limitante. Rendimiento. Polaridad y geometría de las moléculas. Enlace metálico. Propiedades de los metales. Interacciones moleculares. Atracciones dipolodipolo. Las Fuerzas de London. Enlace por puente de hidrógeno. Número de oxidación. Nomenclatura de los compuestos inorgánicos Nomenclatura de las sustancias simples Nomenclatura de los compuestos binarios. Compuestos del oxígeno. Compuestos del hidrógeno. Sales binarias. Nomenclatura de los compuestos ternarios. Hidróxidos, Oxácidos, Oxisales. Nomenclatura de los compuestos cuaternarios. Sales ácidas. Sales básicas FECHA: Febrero-Abril 2012 FECHA: Mayo-Agosto 2012 FECHA: Septiembre-Noviembre 2012 PLANIFICACIÓN CURRICULAR DOCENTE: Anays Mata Mayo DISCIPLINA: Química General. PROBLEMA: El equilibrio de los electrolitos débiles y solubles, fuertes y solubles y equilibrio Redox COMPETENCIA: Realizar cálculos y análisis químico correspondientes al equilibrio químico iónico, así como predecir el comportamiento de reacciones químicas REDOX espontáneas y no espontáneas para relacionar las propiedades químicas de los compuestos inorgánicos con sus aplicaciones en nuestro diario vivir. MÓDULO: I MÓDULO: II MÓDULO: I CAPACIDAD: Realizar cálculos químicos del equilibrio iónico de una reacción química de disolución y precipitación. CAPACIDAD: Predecir el comportamiento de reacciones químicas REDOX espontáneas y no espontáneas teniendo en cuenta los potenciales normales de electrodo CAPACIDAD: Caracterizar los compuestos a partir de la estructura de sus elementos para relacionar sus propiedades con sus aplicaciones en la vida cotidiana UT1 Equilibrio iónico UT 2 Electroquímica UT3 Química Inorgánica HABILIDAD HABILIDAD HABILIDAD Calcular la concentración en el equilibrio a partir de la constante de equilibrio para electrolitos débiles y solubles y fuertes y solubles Explicar el comportamiento de una reacción REDOX, de la pila galvánica y la electrolisis a partir del potencial de electrodo en condiciones normales tipo. Caracterizar los elementos químicos a partir de su estructura atómica para Cálculo del pH de una disolución de un electrolito débil y soluble Identificar el comportamiento de un indicador ante diferentes disoluciones CONTENIDO CONTENIDO CONTENIDO Electrolitos. Teoría de los ácidos y bases. Reacciones de oxidación Reducción. Producto de solubilidad. Kps. Pilas Galvánicas. Estructura del sistema periódico. Tabla periódica. Constante de ionización del agua. Electrolisis. Clases de elementos Cálculo de pH Potenciales normales de reducción. Propiedades de los metales. Estructuras. Cálculo de la fem de una pila. Elementos nitrogenados Cálculo del potencial en procesos Redox. Los calcógenos. Predicción de reacciones Redox. Elementos Carbonoides. Elementos térreos. Gases Nobles. FECHA: Febrero-Abril 2012 FECHA: Mayo-Agosto 2012 FECHA: Septiembre-Noviembre 2012

