Química Orgánica - Colegio AntilMawida
Anuncio

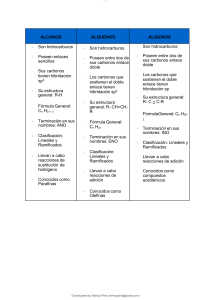
Colegio AntilMawida Departamento de Ciencias Naturales Profesora:Karina Oñate Fuentes Subsector Química Plan Común Química Orgánica Nombre del/la alumno/a Unidad Nº 3 Núcleos temáticos de la Guía Características del Carbono Hidrocarburos Grupos funcionales orgánicos Objetivosde la Guía Conocer y comprender nociones básicas de química orgánica Aprendizaje Esperado Identificar las propiedades del carbono (C) que hacen posible la formación de enlaces muy fuertes, poco reactivos entre sí y con el hidrogeno (H), pudiendo generar una amplia gama de moléculas, muchas de ellas de cadena larga Valorar el papel de los compuestos orgánicos en la vida diaria desde un punto de vista químico, social y Medioambiental. Química Orgánica Características del átomo de carbono: El carbono constituye el 0,027 % de la corteza terrestre, por lo que no es un elemento abundante. Como carbono elemental existe en cuatro formas alotrópicas cristalinas: grafito, diamante, fullereno y nanotubos de carbono. Otras formas con poca cristalinidad son el carbón vegetal, el carbón coque y el carbón negro de humo. El gran número y diversidad de los compuestos orgánicos se explica por las características especiales que tiene el átomo de carbono: su electronegatividad y la tetravalencia. A. Electronegatividad. El carbono se ubica dentro de la tabla periódica en el grupo 14 (IV A) y en el período 2, con una electronegatividad intermedia de 2,5 según la escala de Pauling. El átomo de carbono es capaz de unirse con otro átomo de C y con elementos como hidrógeno, oxígeno y nitrógeno principalmente. Al unirse no gana ni pierde electrones, sino que los comparte, formando enlaces covalentes. B. Tetravalencia. El número atómico del carbono es seis (Z = 6) y, como estudiaste el año anterior, su configuración electrónica es 1s2 2s2 2p2. Para que el carbono alcance su estabilidad dentro de los compuestos orgánicos debe estar unido a través de cuatro enlaces covalentes. La tetravalencia se debe a la cercanía energética existente entre los orbitales atómicos 2s y 2p, lo que facilita la migración de un electrón del orbital 2s al orbital 2p, permitiendo así la formación de los cuatro enlaces. Para lograr una mayor estabilidad y también explicar la forma de las moléculas se introduce el concepto de hibridación. Esta consiste en la combinación de los orbitales atómicos (OA) debido a la promoción de un electrón del orbital 2s a un orbital 2p, tal como muestra el siguiente esquema: 1 Este fenómeno se puede explicar utilizando la teoría de enlace de valencia. En esta se forman los orbitales híbridos, que corresponden a la mezcla ocombinación de orbitales; en el caso del átomo de C se combinan susorbitales 2s y 2p, generando el mismo número de orbitales, pero idénticos entre sí. Según esto, el átomo de carbono posee tres tipos de hibridación: a. hibridación sp3: el átomo de C forma 4 enlaces simples. b. hibridación sp2: el átomo de C forma 2 enlaces simples y 1 enlace doble. c. hibridación sp: el átomo de C forma 1 enlace simple y un enlace triple. Los Hidrocarburos: Los hidrocarburos son compuestos formados por carbono e hidrogeno,constituyentes básicos de los compuestos orgánicos. Entre las propiedades físicas generales de estos compuestos están: serinsolubles en agua y menos densos que ella, ser combustibles y en sumayoría explosivos, especialmente los de menor masa molecular. Estos se clasifican, según el tipo de enlace entre los carbonos participantes,como saturados e insaturados, y según su estructura molecular, comoalifáticos, alicíclicos y aromáticos, los que también están subdivididos, talcomo lo muestra el siguiente cuadro resumen. El nombre de los hidrocarburos, depende del número de carbonos presentesen la cadena principal, asignándole, según corresponda, prefijos griegos denumeración y la terminación característica de cada compuesto. Prefijos griegos de numeración: 2 Hidrocarburos alifáticos: Son hidrocarburos de cadena abierta, que pueden presentar enlaces simples dobles o triples entre los carbonos de la cadena. Hidrocarburos alicíclicos: corresponden aalcanos, alquenos y alquinos, formando ciclos o cadenas cerradas. Hidrocarburos aromáticos: son aquellos que incluyen en su estructura un hidrocarburo en particular llamado benceno, cuya fórmula molecular es C6H6. La estructura cíclica que posee este compuesto presenta seis carbonos unidos a través de enlaces covalentes alternados: tres simples y tres dobles. El benceno puede representarse a través de dos estructuras de Lewis equivalentes, llamadas estructuras resonantes (figura 2), que muestran cómo los seis electrones provenientes de los enlaces dobles están en constante movimiento dentro del anillo. En la actualidad se representa al benceno a través de un hexágono con un círculo inscrito (figura 3), lo que nos indica que los electrones están distribuidos de manera uniforme dentro del anillo denominado híbrido resonante. 3 Nomenclatura de los compuestos orgánicos: 1. Identificar la cadena más larga que incluya todos los enlaces dobles y/o triples si corresponde. 2. Numerar los carbonos de la cadena principal dejando con la numeración más baja posible de acuerdo a la prioridad: En. Doble > En. Triple.> Radicales alquilo. 3. Asignar nombre a radicales alquilo señalando el carbono en que se encuentran 4. Asignar el nombre a la cadena principal. 4 Grupos Funcionales Orgánicos Los compuestos orgánicos, además de carbono e hidrógeno, pueden tener otros átomos o grupos que les proporcionan propiedades características. A estos grupos se les conoce como grupos funcionales. Loa grupos funcionales más comunes son: ácido carboxílico, éster, amida, aldehído, cetona, alcohol, amina, éter y haluro. En la tabla siguiente se muestra la fórmula de estos grupos y el sufijo por el cual se nombra. La letra R señala una cadena hidrocarbonada. 5 Para nombrar un compuesto que tiene alguno de los grupos funcionales descritos, se siguen las mismas reglas IUPAC dadas para alquenos y alquinos; sólo es necesario tener en cuenta el sufijo asignado al grupo funcional que tiene la molécula. a) Alcoholes: Resultan de hidrocarburos (alcanos, alquenos, alquinos) en los cuales se ha reemplazado un H por OH (hidroxilo). Tienen fórmula general del tipo R-OH Se nombran igual que los hidrocarburos que los originan, pero con terminación ol Ejemplo: CH3-CH2-OH Etanol b) Aldehídos: Resultan de un hidrocarburo en los cuales se ha cambiado un – CH3 por un grupo . Su fórmula general es R-CHO. Se nombrar igual que el hidrocarburo que los origina, pero con terminación al Ejemplo: CH3-CHO Etanal c) Ácidos Carboxílicos: Resultan de cambiar en un aldehído, el H por un grupo hidroxilo, resultando grupo que recibe el nombre de carboxilo. Su fórmula general es R- COOH. Estos compuestos se nombran con el prefijo que corresponde al número de carbonos y la terminación oico. Para esto se incluye, al contar los carbonos, el que forma al grupo Carboxilo. Ejemplo: CH3-COOH ácido etanoico o ácido acético conocido comúnmente como vinagre. d) Éteres: Resultan del reemplazo del H del OH de un alcohol, por un radical cualquiera, resultando R-O-R’. Se nombran los radicas R y R’ en orden alfabético, seguido de la palabra éter. Ejemplo: CH3- O- CH2-CH3 Etil-metiléter e) Cetonas: Resultan de del reemplazo de un H de un aldehído por un radical cualquiera, resultando R-CO-R’. El grupo se llama carbonilo. Se nombran siguiendo la misma regla de los éteres, seguidos de la palabra cetona. Ejemplo CH3- CO-CH3 Dimetilcetona 6 f) Ésteres: Resultan del el reemplazo de un H de un grupo carboxilo por un radical cualquiera. Es el equivalente a una sal orgánica. Su fórmula general es R-COO-R’ Se nombran haciendo terminar al ácido que los origina en ato y el radical en ilo g) Aminas: Resultan de reemplazar un H en un hidrocarburo por un grupo NH2. Su fórmula general es R- NH2. Para nombrarlos se usa el prefijo que corresponde según el número de carbonos terminados en il, seguido de la palabra amina. Ejemplo: CH3-NH2metilamina h) Amidas: Resultan de cambiar el H de un grupo aldehído por un grupo amino (-NH2), resultando R-CO-NH2 Su nombre es dado por el prefijo que indica el número de carbonos incluyendo el C del grupo amida, seguido por la terminación amida. Ejemplo: CH3-CO-NH2etanamida Actividades 7 8 9