Investigación Biomédica con muestras biológicas de origen humano
Anuncio

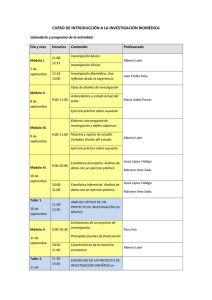
Investigación Biomédica con muestras biológicas de origen humano Biobanc Isabel Novoa Coordinadora del Biobanco Hospital Universitario Vall d’Hebron, Barcelona Luz Mª Vilca Curso Biobanco HUVH Vocal del Comité Ético de Investigación Clínica del HUVH Barcelona 14 Mayo de 2013 1 Evaluación de proyectos de investigación y colecciones de muestras biológicas de origen humano: el consentimiento informado y solicitud de evaluación al CEIC 2 Taller práctico sobre los requisitos para evaluación de un proyecto de investigación con muestras biológicas. 3 Bases de datos de muestras biológicas: recomendaciones generales 4 Envío de muestras biológicas: empaquetamiento y autorizaciones de importación-exportación 1 Evaluación de proyectos de investigación y colecciones de muestras biológicas de origen humano: el consentimiento informado y solicitud de evaluación al CEIC Investigación Biomédica: • Ley 14/2007 • Real Decreto 1716/2011 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Ámbito de aplicación Las investigaciones relacionadas con la salud humana que impliquen procedimientos invasivos. La donación y utilización de ovocitos, espermatozoides, preembriones, embriones y fetos humanos o de sus células, tejidos u órganos con fines de investigación biomédica y sus posibles aplicaciones clínicas. El tratamiento de muestras biológicas El almacenamiento y movimiento de muestras biológicas Los biobancos 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Principios y garantías de la investigación biomédica La salud, el interés y el bienestar del ser humano deben prevalecer por encima del interés de la sociedad o de la ciencia. Se debe asegurar la protección de la dignidad e identidad del ser humano, garantizándose el respeto a la integridad y a sus demás derechos y libertades fundamentales. Se debe garantizar la confidencialidad en el tratamiento de los datos de carácter personal y de las muestras biológicas, en especial en la realización de análisis genéticos. La autorización y desarrollo de cualquier proyecto de investigación sobre seres humanos o su material biológico requerirá el previo y preceptivo informe favorable del Comité de Ética de la Investigación. La investigación se desarrollará de acuerdo con el principio de precaución para prevenir y evitar riesgos para la vida y la salud. 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Requerimientos de la investigación biomédica El sujeto fuente/donante participante de un proyecto de investigación biomédica debe ser informado y debe prestar su consentimiento para dicho estudio (documento de consentimiento informado). La donación es gratuita e implica renuncia por parte del donante a derechos de naturaleza económica o de otro tipo sobre los resultados de la investigación. Garantizar la protección de datos personales y garantías de confidencialidad. Garantizar la trazabilidad de cualquier material biológico de origen humano con registros de cada paso desde la recolección de la muestra biológica, procesamiento, almacenamiento hasta la distribución para uso en proyectos de investigación. 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Evaluación de un proyecto de investigación Para llevar a cabo una investigación con muestras biológicas de origen humano será preciso, en todo caso, el informe favorable de los Comités de Ética de la Investigación del establecimiento en cuyas instalaciones se vayan a utilizar las muestras o, en su defecto, del Comité al que esté adscrito el centro para el que preste servicios el responsable de la investigación. Ponderar el balance de riesgos y beneficios anticipados dimanantes del estudio. Ponderar los aspectos metodológicos, éticos y legales del proyecto de investigación. Se recomienda que esté constituido por expertos en el campo del derecho, la medicina, la ética y la teología. 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Consentimiento informado Es obligatorio informar y solicitar el consentimiento al sujeto fuente/donante para la obtención y uso de la muestra en investigación biomédica 1 COMITÉ ÉTICO DE INVESTIGACIÓN CLÍNICA | Documentación CEIC Procedimiento Procedimiento sin recogida de muestras Procedimiento con recogida de muestras Muestra biológica Proyecto Investigación biomédica Hoja de información/Consen timiento informado 1 COMITÉ ÉTICO DE INVESTIGACIÓN CLÍNICA | Información y contacto CEIC HUVH Página web: www.vhir.org 1 LEY DE INVESTIGACIÓN BIOMÉDICA |Hoja de información al paciente/ Consentimiento informado: anónimas o codificadas Hoja de información/Consenti miento informado Muestras Muestrasbiológicas biológicasde deorigen origenhumano humanocon confines finesde deinvestigación investigaciónbiomédica biomédica Muestras Muestrasanónimas anónimas Muestras Muestrascodificadas codificadas 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Clasificación de muestras y datos Las muestras y datos se clasifican según el vínculo con la identidad del donante : identificada Requisitos investigación biomédica: Mortadelo Ibañez Garantizar la protección de datos personales y garantías de confidencialidad. codificada Anonimizar o disociar 2011/1 anónima 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Muestras y datos codificados Definición (artículo 3, Ley de Investigación Biomédica) Dato codificado: dato no asociado a una persona identificada por haberse sustituido o desligado la información que identifica a esa persona utilizando un código que permita la operación inversa. Muestra biológica codificada o reversiblemente disociado: muestra no asociada a una persona identificada o identificable por haberse sustituido o desligado la información que identifica a esa persona utilizando un código que permita la operación inversa. Nombre Apellido Código Muestra Patología Mortadelo Ibañez 2011/1 sangre control Filemón Ibañez 2011/2 sangre control Base de datos con datos de carácter personal Mortadelo Ibañez 2011/1 codificada 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Muestras y datos anónimos Definición (artículo 3, Ley de Investigación Biomédica) Dato anónimo: dato registrado sin un nexo con una persona identificada o identificable. Muestra biológica no identificable o anónima: muestra recogida sin un nexo con una persona identificada o identificable de la que, consiguientemente, no se conoce la procedencia y es imposible trazar el origen. Nombre Apellido Código Muestra Patología 2011/1 sangre control 2011/2 sangre control Base de datos SIN datos de carácter personal 2011/1 anónima 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Hoja de información al paciente/ Consentimiento informado Investigación Procedimiento de obtención muestra Finalidad de la investigación 2011/1 Identidad del responsable codificada Lugar de realización del análisis Destino de la muestras tras finalizar el estudio Compromiso del investigador Descripción del procedimiento para la obtención de las muestras del paciente/donante Posibles inconvenientes/riesgos del proceso de obtención de las muestras Beneficios previsibles de los resultados de la investigación Derechos del paciente/donante Garantías de protección de datos y confidencialidad Derecho a no participar en el estudio, sin perjuicio alguno Codificación de las muestras Derecho de revocación del consentimiento y destrucción de las muestras Posibilidad de informar al paciente/donante de los resultados obtenidos del estudio Garantía de acceso a la información cuando un menor alcance la mayoría de edad artículo 59, Ley 14/2007; artículo 23, Real Decreto 1716/2011 Derecho a conocer los datos genéticos a partir de las muestras donadas Posibilidad de obtener información relativa a su salud (advertencia de implicaciones paciente y familiares) Posibilidad de incluir alguna restricción sobre el uso de la muestra 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Hoja de información al paciente/ Consentimiento informado Investigación Procedimiento de obtención muestra Finalidad de la investigación 2011/1 Identidad del responsable anónima Descripción del procedimiento para la obtención de las muestras del paciente/donante Posibles inconvenientes/riesgos del proceso de obtención de las muestras Beneficios previsibles de los resultados de la investigación Compromiso del investigador Derechos del paciente/donante Derecho a no participar en el estudio, sin perjuicio alguno artículo 59, Ley 14/2007; artículo 23, Real Decreto 1716/2011 Posibilidad de incluir alguna restricción sobre el uso de la muestra 1 REAL DECRETO DE INVESTIGACIÓN BIOMÉDICA |Muestras de proyectos concretos, de colecciones o de biobancos Muestras Muestrasbiológicas biológicasde deorigen origenhumano humanocon confines finesde deinvestigación investigaciónbiomédica biomédica Muestras Muestrasde deproyectos proyectos concretos concretos • para proyecto concreto Biobanco Biobanco Colecciones Colecciones • para finalidad amplia • para línea de investigación: finalidad concreta Real Decreto 1716/2011 1 REAL DECRETO DE INVESTIGACIÓN BIOMÉDICA |Cesión de muestras a proyectos de investigación Muestras Muestrasbiológicas biológicasde deorigen origenhumano humanocon confines finesde deinvestigación investigaciónbiomédica biomédica Muestras Muestrasde deproyectos proyectos concretos concretos • No Biobanco Biobanco Colecciones Colecciones • Necesario volver a pedir consentimiento al donante • Si se pueden ceder muestras previo informe favorable de comité ético y científico Real Decreto 1716/2011: página 128435 y artículo 34 1 REAL DECRETO DE INVESTIGACIÓN BIOMÉDICA |Registro institucional, Registro Nacional de Biobancos Muestras Muestrasbiológicas biológicasde deorigen origenhumano humanocon confines finesde deinvestigación investigaciónbiomédica biomédica Muestras Muestrasde deproyectos proyectos concretos concretos • Obligación de comunicar su existencia al establecimiento en cuyas instalaciones se conserven Colecciones Colecciones • Obligación de comunicar su existencia al establecimiento en cuyas instalaciones se conserven • Deben registrarse en el Registro Nacional de Biobancos (ISCIII): plazo 2 meses tras la constitución de la colección Biobanco Biobanco • Solicitar autorización a organismo competente de Comunidad Autónoma 2-junio-2012 • Deben registrarse en el Registro Nacional de Biobancos (ISCIII) Real Decreto 1716/2011: artículo 28 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Registro Nacional de Biobancos Acceso y consulta via web - Biobancos: este registro recoge los datos de autorizaciones, de constitución y funcionamiento, modificaciones, resoluciones de revocación de la autorización o cierre, e información de los biobancos y su actividad. - Colecciones: este registro recoge información de las colecciones de muestras biológicas de origen humano con fines de investigación biomédica. 1 LEY DE INVESTIGACIÓN BIOMÉDICA | Registro Nacional de Biobancos