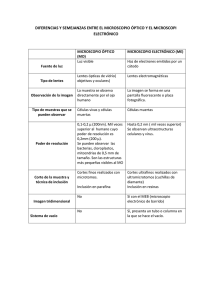
ADRIANAVARGAS_Titulacion 2014 - Biblioteca, FES-C
Anuncio

UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE ESTUDIOS SUPERIORES CUAUTITLÁN ACERCAMIENTO AL MÉTODO DE ELABORACIÓN DE LAMINILLAS HISTOLÓGICAS PERMANENTES (MANUAL DE TRABAJO). ACTIVIDAD DE APOYO A LA DOCENCIA QUE PARA OBTENER EL TÍTULO DE: INGENIERA AGRÍCOLA PRESENTA: ADRIANA VARGAS HERNÁNDEZ ASESOR: DRA. MARÍA DEL ROCÍO AZCÁRRAGA ROSETTE COASESOR: M. C. MARÍA PATRICIA JÁQUEZ RÍOS CUAUTITLÁN IZCALLI, ESTADO DE MÉXICO, 2014 DEDICADO: A MI HIJO Diego, por enseñarme lo más importante en la vida: el amor incondicional. A MIS PADRES Patricia y Alberto, por guiarme en el camino de la vida. A MIS HERMANOS Alberto, Miguel, Osvaldo y Eduardo; por su respaldo en tiempos difíciles. “Es muy común recordar que alguien nos debe agradecimiento, pero es más común no pensar en quienes le debemos nuestra propia gratitud". Johann Wolfgang Goethe AGRADECIMIENTOS Agradezco a la Universidad Nacional Autónoma de México, por brindarme la oportunidad de formar parte de ésta Máxima Casa de Estudios. A la Directora de la Tesis Dra. María del Rocío Azcárraga Rosette, por haberme dedicado su valioso tiempo y apoyo, para poder concluir el presente trabajo. A la M. en C. María Patricia Jáquez Ríos, por su apoyo en el proceso. “Las ciencias tienen raíces amargas, pero muy dulces frutos.” Aristóteles. INDICE INTRODUCCIÓN ........................................................................................................................ 1 ANTECEDENTES. ...................................................................................................................... 2 Reglamento de laboratorio. .................................................................................................... 2 El microscopio. ........................................................................................................................ 3 Técnicas histológicas. ............................................................................................................. 4 Tejidos vegetales. ................................................................................................................... 6 OBJETIVOS: ............................................................................................................................... 8 METODOLOGÍA.......................................................................................................................... 9 1. RECOLECTA ................................................................................................................. 10 1.1 Materiales ........................................................................................................................ 11 1.2 Procedimiento. ................................................................................................................ 11 a. Hoja. ............................................................................................................................... 11 b. Tallo. ............................................................................................................................... 11 c. Raíces. ........................................................................................................................... 12 d. Órganos florales. ........................................................................................................... 12 e. Frutos. ............................................................................................................................ 12 f. Material patológico. ........................................................................................................ 12 g. Planta completa (herbácea). ........................................................................................ 12 2. SUBDIVISIÓN DEL MATERIAL ................................................................................... 13 2.1 Materiales. ....................................................................................................................... 14 2.2 Procedimiento. ................................................................................................................ 14 a. Hojas. ............................................................................................................................. 14 b. Peciolos y tallos leñosos. ............................................................................................. 14 c. Tallos leñosos. ............................................................................................................... 14 d. Madera. .......................................................................................................................... 14 e. Ápices de tallo. .............................................................................................................. 15 f. Raíces. ............................................................................................................................ 15 g. Órganos florales y embrión: ......................................................................................... 15 h. Frutos y semillas: .......................................................................................................... 15 i. Semillas. .......................................................................................................................... 15 3. FIJACIÓN .......................................................................................................................... 16 3.1 Características de los fijadores:..................................................................................... 17 3.2 Fijadores comúnmente utilizados: ................................................................................. 18 3.3 Materiales. ....................................................................................................................... 19 3.4 Procedimiento. ................................................................................................................ 19 4. DESHIDRATACIÓN .......................................................................................................... 21 4.1 Materiales ........................................................................................................................ 22 4.2 Procedimiento ................................................................................................................. 22 5. INFILTRACIÓN ................................................................................................................. 24 5.1 Materiales. ....................................................................................................................... 25 5.2 Procedimiento. ................................................................................................................ 25 6. INCLUSIÓN ....................................................................................................................... 26 6.1 Materiales. ....................................................................................................................... 27 6.2 Procedimiento. ................................................................................................................ 27 7. CORTE............................................................................................................................... 28 7.1 Materiales ........................................................................................................................ 30 7.2 Procedimiento. ................................................................................................................ 30 8. TINCIÓN ............................................................................................................................ 32 8.1 Preparación de colorantes. ............................................................................................ 33 8.2 Materiales. ....................................................................................................................... 35 8.3 Procedimiento. ................................................................................................................ 35 8.4 Preparación del carrusel. ............................................................................................... 35 9. MONTAJE.......................................................................................................................... 37 9.1 Materiales ........................................................................................................................ 38 9.2 Procedimiento. ................................................................................................................ 38 10. LIMPIEZA Y ETIQUETADO ........................................................................................... 39 10.1Materiales ....................................................................................................................... 40 10.2 Procedimiento ............................................................................................................... 40 11. ACTIVIDAD DE APOYO A LA DOCENCIA...................................................................... 42 FASES DEL DESARROLLO DEL MÉTODO DE ELABORACIÓN DE LAMINILLAS. .... 45 11.1 Obtención de información. Fase 1. ............................................................................. 46 11.2 Adiestramiento y desarrollo de habilidades. Fase 2. ................................................. 47 11.3 Obtención de material didáctico. Fase 3 ................................................................. 48 a. Recolecta. ...................................................................................................................... 48 b. Subdivisión del material. ............................................................................................... 51 c. Fijación. .......................................................................................................................... 52 d. Deshidratación............................................................................................................... 53 e. Infiltración. ...................................................................................................................... 54 f. Inclusión. ......................................................................................................................... 55 g. Corte. .............................................................................................................................. 56 h. Tinción. ........................................................................................................................... 58 i. Montaje. ........................................................................................................................... 59 j. Revisión al microscopio. ................................................................................................ 59 k. Limpieza y Etiquetado. .................................................................................................. 60 11.4 Contribución. ................................................................................................................. 63 DISCUSIÓN ............................................................................................................................... 65 CONCLUSIONES. .................................................................................................................... 66 GLOSARIO ................................................................................................................................ 67 BIBLIOGRAFÍA ......................................................................................................................... 77 Bibliografía Impresa. ............................................................................................................. 77 Bibliografía Electrónica. ........................................................................................................ 78 INTRODUCCIÓN El trabajo de apoyo a la docencia está contenido en dos partes, la primera fue la producción de laminillas histológicas permanentes, utilizadas en las prácticas de laboratorio de la asignatura de Anatomía y Organografía Vegetal; y la segunda se refiere a la elaboración de un Manual de Trabajo, que describe la metodología utilizada en éste laboratorio para la obtención de dichas laminillas. La estrategia para el desarrollo de la actividad de apoyo a la docencia se conformó de tres fases fundamentales, que permiten apreciar la evolución del proceso. Inicia con la recopilación de información, donde se adquieren los conocimientos necesarios y se desarrollan las habilidades que nos permiten la generación de material didáctico (laminillas histológicas permanentes). Las “laminillas”, son el material de trabajo fundamental para la asignatura de Anatomía y Organografía Vegetal, por lo tanto están en continuo uso y desgaste, así que es necesario con frecuencia generar material, que permita a los alumnos obtener los conocimientos adecuados. El objetivo principal del Manual de Trabajo es el de servir como guía para la elaboración de laminillas permanentes, si bien, ya mencionamos que las laminillas son utilizadas en las prácticas de laboratorio, los alumnos no desarrollan la metodología para su elaboración; por tanto, éste Manual brinda la información necesaria para aquellos que deseen realizar laminillas histológicas permanentes; independiente a su finalidad, ya que éstas pueden incrementar el acervo del material del laboratorio o ser fuente de información para realizar investigación. El manual, describe detalladamente los materiales necesarios para la realización de cada técnica, se desarrolla paso a paso; a partir de la forma correcta de colectar la planta, hacer adecuadamente los cortes, la apropiada fijación y deshidratación del material; la inmersión e inclusión eficientes, los cortes pertinentes, la preparación óptima de colorantes para la tinción, un adecuado montaje y, finalmente la limpieza y etiquetado de las laminillas. En cuanto al aspecto económico, la metodología para la elaboración de laminillas histológicas permanentes es costosa, debido al tipo de reactivos y material que requiere. Por lo tanto es necesario hacer énfasis en que se deben aprovechar los recursos que se tienen al alcance y utilizarlos de manera eficiente. 1 ANTECEDENTES. Etimológicamente la palabra histología proviene del griego “ Histos” que significa tejidos y “Logos” que significa estudio o ciencia; la Histología, estudia las regularidades sobre la estructura de la materia viva en los diferentes niveles organizativos. (Caballero, 2012.) El concepto de tejido fue introducido en el lenguaje de la Biología por Marie Francois Xavier Bichat, un destacado anatomista y fisiólogo francés (1771-1802); quien escribió una obra sobre los tejidos del organismo en la cual nombró más de veinte. En cuanto a los métodos utilizados para la obtención de cortes, al principio se emplearon simples navajas, pero las secciones conseguidas eran muy gruesas e irregulares. Gabriel Gustav Valentín había ideado, en 1838, cuchillos con hojas paralelas ajustables. El primer micrótomo con precisión mecánica fue inventado por Wilhelm His (1866). Con posterioridad sirvió de modelo el diseñado por Richard Thoma (1881). Los colorantes habían sido empleados de manera ocasional desde la época de Leeuwenhoek, pero el fundador de las técnicas de coloración histológicas fue Joseph Von Gerlach (1820-1896). El origen de la moderna Histología se encuentra en la primera mitad del siglo XIX, principalmente en Anatomía General de Henle (1841), que integró la teoría celular con la noción de tejido procedente de Bichat. (Caballero, 2012). Reglamento de laboratorio. Sandoval, (2005). La realización de lamillas histológicas permanentes, requiere de la utilización de instalaciones de laboratorio, por lo tanto es necesario que se apliquen determinadas reglas. Todo laboratorio se debe regir por una serie de normas, bajo las que se establece la funcionalidad y seguridad del mismo, como un espacio de enseñanza, trabajo e investigación. La elaboración de las laminillas histológicas se realiza en el laboratorio de Botánica. Para dicho laboratorio se presentan las siguientes normas: 1. Usar bata blanca de algodón. 2. Mantener orden, tranquilidad y limpieza dentro del laboratorio. 2 3. No fumar. 4. Quedan prohibidos encendedores o artefactos que puedan causar un incendio. 5. Evitar la inhalación de vapores de los reactivos. 6. Manejo de reactivos dentro de la campana de extracción y con sumo cuidado. 7. Usar los reactivos adecuadamente y solo lo necesario. 8. En caso de derrame, no limpiar el reactivo sin antes saber su toxicidad y avisar al responsable del laboratorio. 9. No arrojar a la tarja parafina u otra sustancia solida o solidificable. 10. Consultar el manual de uso de los aparatos. 11. Manejar con mucho cuidado las navajas y el micrótomo. 12. Apagar el microscopio después de usarlo. 13. No colocar preparaciones frescas sobre la platina del microscopio, ni limpiar los lentes con xileno u otra sustancia abrasiva. 14. No consumir alimentos durante la jornada de trabajo. 15. Terminada la jornada de trabajo, lavar y ordenar el lugar y utensilios. El microscopio. De acuerdo a Strasburger et. al., (1997); para la elaboración de laminillas histológicas permanentes, es necesario hacer uso de un invento muy útil en la actualidad, el microscopio, ya que se tienen que observar, para después seleccionar las que son de mejor calidad y utilidad. El invento del microscopio propició una revolución en el estudio de organismos o estructuras que no se pueden observan a simple vista, esto constituye un obstáculo para el estudio de las estructuras internas de la célula y es por esto que es necesario el empleo de equipos que aumenten la resolución. Existen dos tipos básicos de microscopios: electrónico y óptico. El primero permite un gran poder de resolución, lográndose observar características ultra estructurales, mientras que el segundo, con menor poder de resolución, ofrece gran versatilidad en cuanto a modos de observar los tejidos: fluorescencia, contraste de fase, polarización o contraste de interferencia diferencial. La posibilidad cercanos, se microscopios, empleada en de un sistema óptico de distinguir por separado dos puntos muy denomina poder de resolución. El poder de resolución en los está en relación inversa con la longitud de onda de la radiación la fuente de iluminación. La resolución del microscopio óptico 3 aumenta y alcanza su límite cuando se utiliza como fuente de iluminación la luz ultravioleta, producto de su pequeña longitud de onda. Así es que el microscopio óptico fue perfeccionándose hasta llegar a los modelos actuales, que pueden alcanzar hasta 0.2 μm de resolución. A mediados del siglo XX, se inventó un microscopio que utiliza como fuente de iluminación los electrones, realizándose estudios más detallados de la célula y los elementos subcelulares, moleculares y atómicos. Puede alcanzar valores resolutivos mucho mayores que el alcanzado por los microscopios ópticos. El límite de poder de resolución del microscopio electrónico es de 0.2 nm. Técnicas histológicas. Montuenga (2009), menciona que para estudiar la estructura de las células, tejidos y órganos que constituyen los organismos pluricelulares, el hombre además del microscopio, ha desarrollado diversos métodos y técnicas, perfeccionando los instrumentos necesarios para conocer con mayor profundidad la morfología y función de los diferentes niveles de organización de la materia. Es importante conocer, antes de estudiar la estructura y la composición de las células y los tejidos, algunos métodos, técnicas e instrumentos de los que se dispone para llegar a estos conocimientos. Al observar una estructura al microscopio óptico o al electrónico, la luz o los electrones atraviesan la muestra, dando lugar a la formación de imágenes que son ampliadas por las lentes del microscopio. Para esto es necesario que los objetos examinados sean lo suficientemente delgados, para que la luz o los electrones los atraviesen. En el caso de la microscopía óptica las muestras deben tener un grosor de 5-8 μm aproximadamente, y para microscopía electrónica, valores entre 20 y 40 nm. Es necesario, por tanto, cortar el material que ha de ser estudiado en "lascas" muy finas. Para lograr cortes tan finos y características propias para poder ser observados, se tiene que realizar ciertos procesos que incluyen las técnicas histológicas. Para Sandoval (2005), al dar inicio al manejo de las técnicas histológicas, es necesario plantearse cuál es el enfoque de estudio que se realizará, que tipo y que parte de la planta se va a utilizar, así como en donde se distribuye, cual es su hábitat; en qué momento del día se va a realizar la recolecta y el número de muestras que se tomarán, ya que las técnicas para el estudio del material vegetal 4 dependen de la naturaleza del mismo, del uso que se les dará a las preparaciones, y de la facilidad del equipo, reactivos y tiempo. Se denomina técnica histológica al conjunto de procedimientos aplicados a un material biológico (animal o vegetal) con la finalidad de prepararlo y conferirle las condiciones óptimas para poder observar, examinar y analizar sus componentes morfo-anatómicos a través de los diferentes tipos de microscopios. El proceso histológico es un método y una serie de técnicas utilizadas para poder estudiar las características morfo-anatómicas de los tejidos. Hay diversos caminos para estudiar los tejidos, es decir, series de técnicas que se utilizan dependiendo de la característica que deseemos observar. El proceso histológico inicia con la obtención del tejido objeto de estudio. En el caso de los tejidos vegetales se toman muestras de los distintos órganos que componen el cuerpo de la planta, habitualmente fijadas con soluciones líquidas que contienen sustancias denominadas fijadores, las cuales mantienen las estructuras celulares y moleculares en su estructura inicial durante el procesamiento posterior. También se puede fijar las moléculas de los tejidos por congelación rápida. Fijar un tejido es como si hiciésemos una fotografía del tejido que se mantendrá hasta su observación. Sin embargo, el uso de fijadores o medios de inclusión afectan en ocasiones las características tisulares que queremos observar y por tanto tenemos que recurrir a la congelación para endurecer el tejido para después poder obtener secciones del mismo. Tras la fijación se procede a incluir el tejido para posteriormente obtener secciones. Cuanto más delgada queramos que sea nuestra sección más tenemos que endurecer nuestra muestra. Esto se consigue sumergiendo el tejido con sustancias líquidas que posteriormente polimerizarán (resinas) o se volverán consistentes (ceras). También se puede conseguir el mismo efecto mediante congelación rápida. Los medios de inclusión son normalmente no hidrosolubles por lo que tenemos que sustituir el agua de los tejidos por solventes orgánicos liposolubles y posteriormente añadir el medio de inclusión. Después de la inclusión o la congelación se procede a cortar los tejidos. Existen diferentes aparatos de corte que permiten conseguir secciones ultra-finas (del orden de nanómetros), finas (de 0.5 a 2 µm), semi-finas (de 3 a 10 µm) y gruesas (mayores a 10 µm). Estas secciones hay que procesarlas para poder observarlas, aunque ciertos tipos de microscopía, por ejemplo con contraste de fase, permiten observar tejidos sin teñir. Normalmente las secciones se tiñen con colorantes que son hidrosolubles, por lo que hay que eliminar el medio de inclusión para que los colorantes puedan unirse al tejido (Montuenga, 2009 y Sandoval, 2005). 5 Tejidos vegetales. El presente Manual de Trabajo, está orientado a especies vegetales objeto de nuestro estudio, constituidas por diversas células eucariotas que cumplen diferentes funciones, ya sea como células vivas o muertas; las células vivas son las encargadas del crecimiento de la planta, la fotosíntesis, la respiración, el almacenamiento de sustancias y la reparación de daños, entre otras; las células muertas, proporcionan resistencia y soporte a la planta, ya que presentan paredes celulares engrosadas y lignificadas, además de formar vasos conductores para transportar la savia. La diversidad celular y complejidad de los diferentes tejidos propicia la variedad anatómica entre los diversos grupos taxonómicos (Flores, 1999). Para Esau, (2006), los tejidos celulares de interés son grandes grupos: clasificados en dos -Tejidos Embrionarios o Meristemáticos: a. Tejidos meristemáticos primarios. Responsables del crecimiento del embrión en la semilla y del crecimiento de elongación de la planta. Se encuentra en las yemas del tallo, tanto en el ápice como en las axilas de hojas o ramas, y en la raíz. b. Tejidos meristemáticos secundarios. Son células procedentes de otras células adultas que recuperan temporalmente su capacidad de reproducirse. Responsables del crecimiento y engrosamiento en la planta y de formar nuevos vasos conductores. -Permanentes o definitivos: Están compuestos por células diferenciadas, que pueden recuperar su capacidad totipotencial temporalmente para responder a agresiones mecánicas del ambiente. Se encuentran en diferentes tipos de tejidos y en todas partes de la planta. Meristemos primarios. Son aquellos que no presentan diferenciación en sus células, éstas se encuentran en constante división celular, es decir en mitosis y, dan origen a nuevos tejidos. La zona de meristemo primario consta de Protodermis, la cual desarrolla el tejido epidérmico y; Meristemo fundamental, de donde se desarrollan los tejidos de sostén (parénquima, colénquima y esclerénquima). Epidermis. Capa más externa en hojas, verticilos florales, frutos, semillas, tallos, raíces de crecimiento primario. 6 Peridermis. Forma la corteza externa de raíces y tallos de una determinada edad (en general superior a un año). Formado por varias capas de células muertas, las más superficiales forman el súber o corcho, de paredes gruesas y llenas de aire. En algunas zonas del tallo presenta unas perforaciones, denominadas lenticelas para permitir el intercambio gaseoso con el exterior. Meristema fundamental. Da origen a tejidos de sostén que constituyen el esqueleto de la planta y están formados por células de paredes gruesas y lignificadas. Comunican a la planta solidez, forma determinada y resistencia, y la mantienen erguida, si bien le permiten gran elasticidad. Tejidos de Conducción. Tienen la función de conducir savia a todas las partes de la planta, están compuestos por: Xilema. Conduce la savia bruta desde las raíces a las hojas y el tallo donde se realiza la fotosíntesis. Está compuesto por células muertas de forma cilíndrica o alargada (tráqueas o traqueídas) con tabiques de separación perforados o ausentes que forman tubos continuos llamados vasos. Floema o vasos liberianos: distribuyen la savia elaborada desde las hojas a toda la planta. Está formado por células vivas, carentes de núcleo, separadas por tabiques transversales perforados. Junto a cada célula cribosa hay una célula acompañante parenquimática, que se encarga del mantenimiento de la célula cribosa. Las plantas están formadas por los mismos tejidos pero la forma en cómo están organizados varía, haciendo diferencias estructurales. Dada la importancia estructural de los tejidos vegetales y la diversidad de ellos, en la asignatura de Anatomía y Organografía Vegetal, así como en estudios anatómicos en general, se estudia la estructura interna de la planta a nivel celular e involucra el seccionado de tejidos y órganos; con la finalidad de conocer la disposición de los tejidos en los órganos de las plantas y, analizar como coordinan su funcionamiento. En este sentido la aplicación de las Técnicas Histológicas aplicadas el estudio de la Anatomía e Histología Vegetal en general, nos permiten conocer las especificidades y constitución de los tejidos y célula vegetal, siendo las preparaciones histológicas permanentes la base del material didáctico de la enseñanza a través de las prácticas de la asignatura de Anatomía y Organografía Vegetal, y fundamentales para investigación sobre aspectos anatómicos, debido a que a partir del procesamiento de los órganos vegetales se obtienen muestras significativas para el estudio de las diversas especies (Paniagua, 2002). 7 OBJETIVOS: Obtener laminillas histológicas permanentes, que incrementen el acervo de la colección, utilizadas para la enseñanza de la Anatomía y Organografía Vegetal, a los alumnos de la carrera de Ingeniería Agrícola de la FES Cuautitlán. Elaborar un Manual de Trabajo que describa el método desarrollado en la obtención de las laminillas histológicas permanentes, para ser utilizado como guía en el proceso. 8 Metodología • Obtencion del material biológico. • Selección y corte del material biológico. • Preservación del material para su posterior observación. • Remoción del agua contenida en los tejidos. 1. RECOLECTA 2. SUBDIVISIÓN DEL MATERIAL 3. FIJACIÓN 4. DESHIDRATACIÓN. • Remplazo gradual del solvente con el medio de inclusión. • Pasar a moldes las piezas de tejido para su solidificacion (Bloques). • Obtención de piezas delgadas formando un listón. • Tincion de estructuras celulares para facilitar su observación 5. INFILTRACIÓN. 6. INCLUSIÓN. 7. CORTE 8. TINCIÓN • Aplicacion del medio de montaje y cubreobjetos. 9. MONTAJE. • Eliminación del medio de montaje. • Descripción del tejido y técnicas utilizadas. 10. LIMPIEZA. 11. ETIQUETADO. 9 1. RECOLECTA 10 1. Recolecta del material. Es el proceso mediante el cual se seleccionará el material biológico requerido para su estudio. Sandoval (2005), hace referencia que, previo a la recolecta es importante saber los datos de la planta: Determinación botánica de las especies. Distribución geográfica. Hábitat Forma de vida. Características fenotípicas. Saber cuál va a ser la finalidad y propósito. Justificación, si es para enseñanza o investigación. Para Curtis (1986), de preferencia se seleccionan estructuras completamente sanas y desarrolladas, teniendo cuidado de no dañar los tejidos, recolectar pequeñas fracciones de órganos y estructuras vegetales que deben ser material fresco. Es necesario realizar un trabajo cuidadoso al momento de tomar el material de interés, ya que de esto dependerá la preservación de la estructura. 1.1 Materiales Papel periódico. Se utilizan hojas individuales. Tijeras para podar. Con suficiente filo. Libreta de campo. Para anotar los datos del ecosistema. Bolígrafo. Tinta permanente. Cámara fotográfica. Para obtener imágenes de la planta y hábitat. Pala de jardinería. Para extraer raíces. Recipiente plástico. Para llevar agua corriente. Bolsas plásticas. 1.2 Procedimiento. a. Hoja. Cortar desde el peciolo y evitar arrancarla. Guardar de inmediato en un papel húmedo o de ser necesario en un recipiente con agua o cámara húmeda. b. Tallo. Cortar trozos regulares de preferencia de la base, la parte media y el ápice; colocarlos en un recipiente con agua o en papel periódico humedecido dentro del refrigerador. 11 c. Raíces. Es necesario excavar alrededor de la planta y humedecer el suelo, extraer cuidadosamente la raíz, después limpiar con una brocha suave y remover las partículas de tierra, envolver las raíces en papel húmedo y conservar en lugar fresco o frío. d. Órganos florales. Remover con sumo cuidado las flores por debajo del peciolo o la inflorescencia. Se envuelven con papel húmedo y se guardan en un recipiente cerrado en un lugar fresco. Si es necesario para su estudio se colectan flores en distintos estados de desarrollo, con o sin polinización. e. Frutos. Se hace de la misma forma en que se describió anteriormente para los órganos florales. f. Material patológico. Es necesario recolectar material sano y enfermo, para hacer una comparación entre los tejidos. Es importante evitar que el material se maltrate y de ser posible procesar la muestra de inmediato para evitar el desarrollo de patógenos secundarios. g. Planta completa (herbácea). Se requiere escavar alrededor de la planta para evitar que su raíz se maltrate, extraer con cuidado del suelo y colocarla en un recipiente con agua o en su defecto en una bolsa plástica con agua para su posterior procesamiento. Datos de campo. En la libreta de campo se debe anotar lo siguiente: Localidad, fecha, hábitat, altitud, nombre común, breve descripción de la planta, datos del colector (Curtis, 1986; Sandoval, 2005). 12 2. SUBDIVISIÓN DEL MATERIAL 13 2. Subdivisión del material. Es la división de los órganos y tejidos en porciones pequeñas. Su finalidad es que el fijador alcance las células internas del tejido Después de la recolecta, antes de procesar el material biológico es necesario lavarlo con agua corriente, y así retirar los restos de polvo, esporas, plagas y desechos que no correspondan a la naturaleza del mismo (Sandoval, 2005). 2.1 Materiales. Tabla para cortar Bisturí o navaja de rasurar nueva. Agujas de disección. Papel absorbente (sanitas). Agua corriente. Sierra o serrucho. 2.2 Procedimiento a. Hojas. Sobre la tabla en papel húmedo se coloca la hoja y se hacen cortes con una navaja nueva sin presionar. La hoja se divide en tres partes y se utiliza la parte media, los cortes son de aproximadamente 0.5 cm x 0.5 cm, en hojas angostas y de 1.0 cm x 0.5 cm en hojas anchas, se debe obtener con nervadura central. Se pueden obtener también la parte del ápice o borde. b. Peciolos y tallos leñosos. Sobre la tabla y el papel húmedo se subdividen en cilindros de 0.5 cm de longitud, tanto de nudos como de entrenudos. En tallos mayores a 1cm se debe dividir en cortes más pequeños o cortes radiales. c. Tallos leñosos. Se cortan en pedazos de 1.5 cm de longitud con una sierra fina. d. Madera. Se cortan y subdividen en tres secciones: transversal, radial y tangencial, con ayuda de un serrucho, sierra o sierra fina. La madera debe ser humedecida previamente. 14 e. Ápices de tallo. Las hojas deben ser removidas para exponer el ápice, sobre la tabla con el periódico húmedo se corta sin presionar con una navaja nueva y se hace un corte de aproximadamente 1cm. f. Raíces. Se debe utilizar material fresco, se corta sobre el papel húmedo con una navaja de afeitar nueva y sin presión, ya que es un órgano muy fibroso. Para obtener ápices de raíz se cortan trozos menores a 4 ó 5 mm de longitud. g. Órganos florales y embrión: -Anteras y ovarios. Se cortan sobre papel húmedo en porciones transversales no mayores a 2 mm. -Ovarios maduros. Se cortan longitudinalmente, para observar los lóculos y estudiar la embriogénesis. -Pétalos y sépalos. Cortar sobre el papel húmedo cubos de aproximadamente 1 cm, se obtiene de la base, parte media, ápice y borde. -Flores pequeñas. Se pueden cortar en tres partes de manera transversal. h. Frutos y semillas: -Frutos jóvenes. Se cortan longitudinalmente, para observar los lóculos y estudiar la embriogénesis. -Frutos mayores a 1cm. Se seleccionan trozos de las regiones por estudiar. i. Semillas. Se cortan longitudinalmente en rebanadas delgadas que contengan las partes esenciales del embrión (Curtis, 1986; Sandoval, 2005.). 15 3. FIJACIÓN 16 3. Fijación. Todos los tejidos, cuando se extraen del organismo o el organismo muere, sufren dos tipos de procesos degenerativos: autolisis (acción de enzimas intracelulares, es decir, auto-digestión) y putrefacción (acción bacteriana). Fijar un tejido es preservar sus características morfológicas y moleculares lo más parecidas posibles a las que poseía en estado vivo. Los fijadores deben proteger frente a ataques bacterianos, evitar autolisis, insolubilizar elementos solubles que se quieren estudiar, evitar distorsiones y retracciones tisulares, penetrar y modificar el tejido para poder llevar a cabo tinciones específicas posteriores (Montuenga, 2009). Para elegir un buen fijador se debe de tomar en cuenta lo siguiente: Fragilidad y contenido de agua del material. Tamaño de la muestra. Método de inclusión. Tipo de estructura que será fijada. Tinción que se va a utilizar. Heterogeneidad del tejido. Permeabilidad de las membranas. Propósito de estudio. 3.1 Características de los fijadores: Velocidad de penetración. El proceso de fijación debe ser rápido, por lo tanto la velocidad de difusión de la sustancia fijadora en los tejidos es un factor determinante. Velocidad de fijación. Condiciona el tiempo que debe permanecer el tejido en contacto con el fijador. Endurecimiento. Los fijadores generalmente endurecen los tejidos, lo cual depende del tipo de fijador y del tiempo que el tejido haya estado expuesto a él. Ósmosis y pH. Es indispensable evitar cambios de volumen en las células producidos por una osmolaridad del fijador diferente a la del tejido. Por tanto, hay que equilibrar la osmolaridad de las soluciones fijadoras y la de los tejidos a fijar. Efecto mordiente. Modificar químicamente a ciertas estructuras celulares para que posteriormente puedan unirse a ellas los colorantes. 17 Artefactos. Los procesos de fijación pueden acarrear alteraciones tisulares como variaciones morfológicas, cristalización de compuestos, desplazamiento de sustancias, etcétera. La elección de un buen fijador evita lagunas, agujeros y desgarres del tejido. La fijación se realiza inmediatamente después de que el material biológico ha sido subdividido (Curtis, 1986; Sandoval, 2005). 3.2 Fijadores comúnmente utilizados: Coagulantes: Principalmente alcoholes como etanol; acido pícrico, cloruro de mercurio y trióxido de cromo. No coagulantes: Son formaldehido, trióxido de osmio, bicromato potásico y el acido acético. Mezclas: Existen más de 2000 fórmulas publicadas. o FAA (Formaldehido/ácido acético/ alcohol/agua) Etanol 96% 50 ml Ácido acético glacial 5 ml Formaldehido 37-40% 10 ml Agua 35 ml Buen fijador para tallos, raíces, hojas y estructuras de consistencia dura. El material se conserva por mucho tiempo. El material se fija en 24 hrs. y se debe lavar con agua corriente. o Fijador con ácido crómico. Trióxido de cromo 0.7 gr. Ácido acético glacial 0.5 ml Agua destilada 100 ml Su penetración es lenta, muy útil en ápices de tallo y raíz; ovario y gametofitos. Los tejidos se sumergen toda la noche y se enjuagan a al día siguiente. o Fijador tipo Craf Solución A Trióxido de cromo Ácido acético glacial Agua destilada 18 1 gr 7 ml 92 ml Sol B. Formaldehido 37-40 % Agua destilada 30 ml 70 ml Se mezclan partes iguales de ambas soluciones justo antes de fijar. Adecuado para tejidos suaves y duros. Los tejidos se sumergen de 12 a 24 hrs., después se lavan con alcohol etílico al 70% 3 veces por 15 min cada uno. o Mezcla de Zirkle. Agua 400 ml Dicromato de potasio 2.5 gr Dicromato de amonio 2.5 gr Sulfato cúprico 2 gr Apropiado para microscopia fotónica, para observar mitocondrias y estructuras relacionadas. Los tejidos se sumergen de 24 a 48 hrs. Y se lavan varias veces con agua (Sandoval, 2005). 3.3 Materiales. Material biológico subdividido. Frascos con tapa (para el material biológico) Fijador o mezcla fijadora Frasco con tapa (Para solución de reúso) Etiquetas Lápiz Coladera pequeña (5 cm diámetro) Pinzas Agua corriente/ alcohol 3.4 Procedimiento. Después de que el material ha sido dividido se introduce de inmediato en el frasco y se le agrega el fijador y se deja actuar por el tiempo requerido según el tipo de fijador. Se etiquetan los frascos escribiendo el nombre de la planta procesada y la parte del órgano que se encuentra en fijación, fecha y hora de fijación. 19 El material biológico, se enjuaga con agua corriente o alcohol según el fijador usado con ayuda de una coladera pequeña; ya que si el fijador es a base de agua y se enjuaga con alcohol o viceversa, da como resultado células atrofiadas; debido al gradiente hídrico. El fijador que contenía el material se deposita en un frasco con fijador de reúso. Se enjuaga el frasco y se e depositan los trozos de material en el mismo frasco para seguir con el proceso. En la bitácora se anota la especie que se ha procesado, la parte de la planta que está en fijación, así como la hora y la fecha en que fue fijada, además del tipo de fijador y; la hora y fecha en que debe ser enjuagado (Curtis,1986; Sandoval, 2005). 20 4. DESHIDRATACIÓN 21 4. Deshidratación. Proceso por el cual se elimina al máximo, de manera gradual, el agua contenida en los tejidos vegetales previamente fijados. 4.1 Materiales 10 frascos de 1 lt con tapa 4 frascos de 500 ml. Alcohol 96% Alcohol absoluto Agua destilada 2 vasos de precipitado Calculadora Lápiz y papel. 4.2 Procedimiento En las soluciones de los alcoholes para la deshidratación de los tejidos se utiliza alcohol de 96% para la dilución. Tabla 1. Cálculo % de alcohol. Alcohol 1000ml alcohol ---- 96% x=? ---- 30% Agua destilada 1000ml total – 312.5 ml alcohol= x x = 687.5 ml Agua destilada x= 312.5 ml alcohol 96% En un vaso de precipitados se colocan: 312.5 ml de Alcohol 96% 687.5 ml de Agua destilada Se agitan y se colocan en un frasco de 1 lt con tapa, se etiqueta con la leyenda “Alcohol limpio 30%”. *Esto se hace para cada uno de los alcoholes. 22 Tabla 2. Preparar 1lt de alcohol Alcohol 96% Agua destilada 30% 312.5 ml 50% 521 ml 70% 729 ml 96% 1000 ml 687.5 ml 479 ml 271 ml No 100% 1000 ml alcohol absoluto No Nota: Los otros cinco frascos se etiquetan con la leyenda: “Alcohol de reúso”. Los otros dos frascos se utilizarán para la solución de reuso. Una vez enjuagadas las piezas ya fijadas, se deben introducir por dos horas en el alcohol de 30%, si son hojas y estructuras florales o suaves; y cuatro si son tallos, raíces o estructuras duras. De esta forma se hace para cada cambio de alcohol, en 50%, 70%, 96% y 100%, respectivamente. Posteriormente las piezas de material se introducen en la solución de cloroformo por una hora para cada uno. Preparación de la soluciones Alcohol/Cloroformo (200 ml) (Sandoval, 2005). Tabla 3. Calculo Alcohol absoluto Cloroformo de la solución de Cloroformo. Alcohol 2: Cloroformo 1 133 ml Alcohol 1: Cloroformo 2 67 ml Cloroformo absoluto No 67 ml 133 ml 200 ml 23 5. INFILTRACIÓN 24 5. Infiltración. Es el proceso mediante la cual se propicia que penetre de manera gradual un material solidificable a un tejido ya sea deshidratado o no, con el propósito de brindarle firmeza, facilitando los cortes en secciones delgadas y uniformes. 5.1 Materiales. Cortes de material biológico deshidratado Parafina o Paraplast Termómetro Estufa Etiquetas 5.2 Procedimiento. Infiltración en parafina o paraplast. Para realizar la infiltración es necesario precalentar el material de infiltración deseado por lo menos 24 horas antes de su uso. Después de que se han deshidratado los tejidos, se coloca una porción de parafina dentro del frasco e inmediatamente se lleva a la estufa de 58 a 60°C durante tres días (Sandoval, 2005). 25 6. INCLUSIÓN 26 6. Inclusión. Es el método más común de endurecer el tejido y consiste en infiltrar la muestra con sustancias líquidas que tras un proceso de polimerización y enfriamiento se solidifican, sin afectar a las características del tejido. Con ello se consigue obtener cortes delgados (desde decenas de µm a nm según el medio de inclusión) sin que el tejido se rompa o se deteriore. Además son un buen método de preservar las muestras durante largos periodos de tiempo. Existen diferentes sustancias o medios de inclusión dependiendo del grosor del corte y de la técnica que necesitemos realizar. Cuando se quieren hacer secciones para su observación con el microscopio óptico los medios de inclusión más frecuentemente usados son la parafina o la celoidina, mientras que si vamos a realizar observaciones con el microscopio electrónico la inclusión se realiza con resinas, principalmente de tipo acrílicas (Montuenga, 2009). 6.1Materiales. Papel bond o encerado (el necesario) Material de inclusión precalentado Etiquetas Pinzas Agujas de disección 6.2 Procedimiento. Elaboración de moldes. En papel bond, trazar rectángulos de aproximadamente 6 cm x 3 cm y recortarlos. Se tienen que dividir en tres partes a lo largo y ancho. Hacer un doblez diagonal y doblar los extremos largos sobre los angostos, dejando las pestañas dobladas hacia afuera. De esta manera se forma un cubo, en donde se puede colocar y orientar la muestra. Se hacen etiquetas, indicando el nombre científico y la parte del órgano de la planta. Dentro del cubo se coloca parafina líquida; con ayuda de las pinzas, se sumerge la etiqueta y se pega en la parte superior interior del cubo. Con la muestra infiltrada por completo, se vierte parafina líquida en un molde, se introduce la muestra con ayuda de unas pinzas al fondo de caja con una aguja de disección se coloca según la orientación deseada de corte y se deja solidificar a temperatura ambiente. La orientación de las muestras es fundamental para la obtención de buenos cortes (Sandoval, 2005). 27 7. CORTE 28 7. Corte. La microtomía es la técnica utilizada para cortar secciones de tejidos que incluidos o no, tienen la suficiente dureza y que aun después del corte conservan sus detalles estructurales para su identificación en el microscopio. En el corte se debe evitar la desorganización de los tejidos sin alterar sus características originales. Los aparatos mecánicos para hacer secciones de un grosor de micrómetros se denominan micrótomos y existen diferentes tipos según el grosor que queramos conseguir en nuestras secciones, el medio de inclusión en el que se encuentre el tejido o si se ha endurecido por congelación o por inclusión. Los micrótomos más usados son: a. Microtomo para parafina: Se utiliza principalmente para material incluido en parafina y se obtienen secciones de 5 a 20 µm de grosor, para observar con el microscopio óptico. b. Vibratomo: Corta material no incluido, aunque sí fijado o duro, en secciones de 30 a centenares de µm de grosor, para observar con el microscopio óptico. c. Microtomo de congelación: Con él se consiguen secciones de 30 a unas 100 µm de material congelado para su observación con el microscopio óptico. d. Criostato: Consigue secciones a partir de material congelado y se obtienen grosores de 10 a 40 µm, para observar con el microscopio óptico. e. Ultramicrotomo: Con él se corta material incluido en resinas y se obtienen secciones del orden de nanómetros de grosor, para observar con el microscopio electrónico de transmisión. f. Ultracriotomo: Su uso no está muy extendido pero se suele emplear cuando se necesitan secciones del orden de nanómetro de material que no se debe incluir, para observar con el microscopio electrónico de transmisión. Los aparatos de corte más usados tradicionalmente para estudiar las características generales de los tejidos y de las células son el micrótomo para material incluido en parafina para observaciones con el microscopio óptico y el ultra micrótomo para observaciones con el microscopio electrónico de transmisión. El criostato se usa frecuentemente en microscopía óptica por el ahorro de tiempo que supone ya que no necesita incluir el tejido, incluso se puede cortar material no fijado. 29 7.1 Materiales Microtomo Cubos de material incluidos. Cámara de flotación Termómetro Platina Pinzas, pincel y agujas de disección. Grenetina Xileno Portaobjetos Pluma con punta de diamante Bitácora 7.2 Procedimiento. Para comenzar con la técnica de corte se recomienda usar el microtomo de rotación. Desmoldar el bloque de parafina y rebanar una parte de esta hasta quede en forma de pirámide, es decir más ancha abajo que de arriba. De esta forma se logrará obtener listones, que son tiras de finas de cortes. En el micrótomo se tiene que ajustar el grosor deseado, se ajusta y asegura la navaja, después se coloca el cubo de madera en la porta muestras. Quitar el seguro de la manivela y hacer avanzar la muestra con la manivela. En el proceso de corte debemos mantener limpia la navaja con ayuda de una gasa y un poco de xilol. La muestra se devasta hasta llegar a la orientación deseada de la muestra. Se irán formando los listones y que serán recogidos con la aguja de disección, pincel o pinzas. En el baño de flotación se coloca un poco de grenetina y dejar que se disuelva, posteriormente se colocan los tejidos para que se extiendan. Se colocan los listones en el baño de flotación. Con un portaobjetos se pescan los listones de preferencia se hacen listones de 3 cortes. Con mucho cuidado se colocan en el portaobjetos dejando libre un extremo del portaobjetos. Se debe tener mucho cuidado con las burbujas que se formen en 30 el agua y deshacerlas antes de colocar los listones, pues estas impedirán que el listón quede bien adherido al portaobjetos y no se podrán ver al microscopio. Se colocan sobre la platina y se dejan secar. Se marcan con bolígrafo punta diamante y en la bitácora se anota el número de la muestra, a que planta y tejido pertenece (Sandoval, 2005). Figura 1. Corte en micrótomo. 31 8. TINCIÓN 32 8. Tinción. Reacción de los tejidos con diversos colorantes. Su función principal es la de teñir los diferentes componentes celulares de una muestra para facilitar su análisis y observación en el microscopio. a. Básicos: tiñen la parte básica del tejido, mientras que la parte ácida es incolora. Tienen apetencia por sustancias ácidas del tejido como el ADN o ciertos componentes de la matriz extracelular como los glucosaminoglucanos. Así, ponen de manifiesto el núcleo y el ARN, sobre todo el ARNr presente en los ribosomas por ser muy abundante, así como ciertas matrices extracelulares ricas en componentes ácidos. Ejemplos de colorantes básicos son: tionina, safranina, azul de toluidina, azul de metileno o hematoxilina b. Ácidos: son sales con el anión coloreado y la base incolora. Tienen apetencia por sustancias básicas, sobre todo estructuras proteicas localizadas en el citoplasma celular y también el colágeno de la matriz extracelular. Ejemplos de colorantes ácidos son: fucsina ácida, verde rápido, naranja G o eosina. c. Neutros: poseen una porción ácida y otra básica, ambas con capacidad para aportar color. Por tanto un mismo colorante puede teñir tanto las partes básicas como las ácidas de los tejidos. Por ejemplo, el eosinato de azul de metileno. d. Indiferentes: realmente no se unen a elementos de los tejidos por afinidad química sino porque se disuelven en ellos. Por ejemplo, el colorante Sudán se disuelve en los lípidos y por tanto teñirá a las gotas de lípidos, especialmente en los adipocitos (Cornejo et al., 2003). Los colorantes más usados son: safranina “O”, fucsina básica, verde rápido, verde rápido FCF, hematoxilina, orange G, azul de anilina, azul de toluidina, azul de metileno, azul de lactofenol y azul niágara (Sandoval, 2005). 8.1 Preparación de colorantes. • Safranina “O” con Metilcelosolve. Safranina “O” 1 gr Metilcelosolve 50 ml Alcohol 96% 25 ml Acetato de sodio 1 gr Formaldehido al 37% 2 ml Disolver la safranina en el metilcelosolve y agregar los reactivos en el orden marcado: se mezcla y filtra la solución (Cornejo et al., 2003 y Gaviño et al., 1975). 33 Es importante mencionar que, la utilización safranina elaborada a base de metilcelosolve, es la que da mejor resultados , ya que el color que brinda es nítido y se fija perfectamente al tejido. Sandoval (2005), menciona los colorantes abajo descritos, que son específicos para teñir tejidos vegetales. • Safranina “O” Safranina O Alcohol 96% Agua 0.25 gr 10 cc 100 cc Agregar los reactivos en el orden marcado: Se mezcla y filtra la solución. • Verde rápido FCF o Solución A Verde rápido Alcohol etílico absoluto Metilcelosolve 4 gr 75 ml 25 ml Se disuelve el colorante en el alcohol y se agrega el metilcelosolve. o Solución B Alcohol etílico absoluto Aceite de clavo 25 ml 75 ml Mezclar ambas soluciones y filtrar la solución al final. • Azul de toluidina O o Formula 1 Azul de toluidina O 50 mg Solución amortiguadora pH 4.4 100 ml o Formula 2 Azul de toluidina O 50 mg Agua destilada 100 ml o Formula 3 Azul de toluidina O 50 mg Ácido bórico 1 gr Agua destilada 100 ml Preparar una solución de bórax al 1% y agregarlo al azul de toluidina, mezclar y filtrar. Se disuelve el azul de toluidina en el buffer, en el agua destilada o ácido bórico, según el proceso seleccionado, se filtra en todos los casos. 34 Se recomienda prepara la cantidad mínima necesaria pues con el tiempo el efecto tintóreo disminuye. Almacenar en frasco ámbar. 8.2 Materiales. Estufa Listones secos en portaobjetos Canastillas de vidrio 15 Cajas de Coplin 0.5 lt xileno 0.5 lt alcohol absoluto 0.5Lt alcohol 96% 0.5 Lt alcohol 70% 0.5 Lt alcohol 50% 0.5 Lt alcohol 30% 0.5 Lt safranina 0.5 azul de toluidina 0.5 verde rápido 0.5 Lt aceite de clavo 50 cm hilo cáñamo Reloj o cronometro Pinzas 2 recipientes plásticos de 1lt Agua destilada 8.3 Procedimiento. Se colocan las laminillas en las canastillas de manera que queden todas en la misma dirección. Cortar un trozo de hilo cáñamo aprox. 10 cm y sujetarlo alrededor de la parte de la rejilla en dirección a la cara de los cortes. Se colocan dentro de la estufa de 65° a 70°C por 15 minutos, esto facilita la dilución de la parafina que se encuentra en el tejido. 8.4 Montaje del carrusel. En cada caja de Coplin se coloca un reactivo en el orden siguiente: Caja 1. 0.5 lt xileno absoluto Caja 2. 0.5 lt xileno absoluto Caja 3. 0.5 lt alcohol absoluto Caja 4. 0.5 lt alcohol absoluto l Caja 5. 0.5 lt alcohol 96% Caja 6. 0.5 lt alcohol 70% Caja 7. 0.5 lt alcohol 50% Caja 8. 0.5 lt alcohol 30% Caja 9 y 10. 0.5 lt safranina Caja 11. 0.5 lt azul de toluidina 35 Caja 12. 0.5 lt verde rápido Caja 13. 0.5 lt aceite de clavo Recipiente plástico1. 1 lt agua destilada Recipiente plástico 2. 1 lt agua destilada Todas las cajas se etiquetan de acuerdo a su contenido. Pasados 15 minutos las laminillas se extraen de la estufa y corren por el carrusel, en el siguiente orden y tiempo: Reactivo Tiempo Hidratación Xileno 1 Xileno 2 Alcohol absoluto 1 Alcohol absoluto 2 Alcohol 96% Alcohol 70% Alcohol 50% Alcohol 30% 3 minutos 3 minutos 2 minutos 1 minuto 2 minutos 2 minutos 2 minutos 2 minutos Tinción *Safranina Azul de toluidina 24 horas o 30 minutos (dependiendo) 3 minutos Enjuague Agua destilada 3 minutos Deshidratación Alcohol 30% Alcohol 50% Alcohol 70% Alcohol 96% 30 segundos 30 segundos 30 segundos 30 segundos **Contratinción Verde rápido Aceite de clavo Alcohol absoluto 2 Xileno 2 1 minuto 1 minuto 30 segundos 30 segundos *Si la safranina se prepara con metilcelosolve solo se calienta en una parrilla por 30 minutos y si es por el otro método se deja sumergida por 24 hrs (Cornejo et al., 2003; Gaviño et al., 1975). La contratinción solo se usa para la coloración safranina-verde rápido, cuando se tiñe con azul de toluidina se llega hasta el alcohol absoluto y se pasa a xileno para su montaje (Sandoval, 2005). 36 9. MONTAJE 37 9. Montaje. Es el proceso mediante el cual las laminillas van a ser protegidas con cubreobjetos y selladas con resina sintética, para así proveerlas de resistencia y protección a los tejidos. 9.1 Materiales Laminillas. Resina sintética Agitador de vidrio Cubreobjetos Papel de reúso Aguja de disección Cartón 9.2 Procedimiento. En el lugar de trabajo se cubre con hojas recicladas para evitar manchar la superficie y poder manipular la resina. Inmediatamente después de haber teñido las laminillas se procede a su montaje. Se toma una laminilla y con el agitador se le colocan una o dos gotas de resina y encima se coloca el cubreobjetos. Con una aguja de disección se presiona sobre éste para liberar todas las burbujas posibles que se encuentren entre la resina. Con sumo cuidado se quita el exceso de resina y la preparación se coloca sobre un cartón cubierto con papel de reúso. Dejar secar por una semana. • La resina debe ser preparada con una semana de anticipación pues debemos evitar que tenga burbujas. Elaboración de resina. La resina que se usa en el laboratorio es la sintética comercial diluida al 75%, es decir que por cada tres partes de resina se utiliza una de xileno (Sandoval, 2005). Sustancia Volumen Relación Resina 75 cc 3 Xileno 25 cc 1 38 10. LIMPIEZA Y ETIQUETADO 39 10. Limpieza y etiquetado. Es el proceso por el cual se van a retirar los restos de resina seca que se encuentran en la laminilla para que esté completamente limpia y presentable y, que se pueda utilizar como material didáctico. 10.1 Materiales Microscopio. Laminillas Gasa Navaja Xileno Alcohol 96% reúso Hojas de reúso Etiquetas para laminillas Tijeras Pegamento liquido Pincel 10.2 Procedimiento Para comenzar con este proceso, es necesario seleccionar las laminillas que estén en mejor estado, es decir, en el microscopio, se revisan una a una, para ver la tinción (que el colorante haya teñido el tejido de acuerdo a la técnica que se utilizó), corte (que este completo o tenga secciones en donde se pueda apreciar su estructura), la posición (tangencial, transversal o longitudinal) y el tipo de órgano (hoja, flor, fruto, tallo o raíz). Limpieza. Tomar las laminillas, una a una (es necesario que estén completamente secas), y con una navaja se retira el exceso de resina, haciendo un raspado leve en la superficie, la parte posterior y en el contorno. Con una gasa humedecida en xileno, se procede a limpiar la laminilla con un suave frote tanto en la superficie como en la parte de atrás, después de dejan secar sobre una superficie. Después con otra gasa humedecida en alcohol de 96% se hace la misma operación sobre la laminilla (Sandoval, 2005). Para finalizar con una gasa se limpia y se frota para que queden sin residuos. 40 Etiquetado. Las etiquetas se elaboran en el programa de Microsoft Office Word, en una plantilla con los siguientes datos: • • • • • Logotipo de la UNAM Nombre del espécimen Nombre del órgano Tipo de corte Tipo de tinción Ejemplo: Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Azul de toluidina Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Azul de toluidina Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Azul de toluidina Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Azul de toluidina Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Azul de toluidina Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Azul de toluidina Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Safran –Verde R. Datura stramonium Raíz madura C. longitudinal Azul de toluidina Se imprimen y cortan una a una y posteriormente se pegan con pegamento líquido con ayuda de un pincel. Se colocan en las cajas contenedoras de laminillas histológicas para que puedan ser utilizadas. 41 11. ACTIVIDAD DE APOYO A LA DOCENCIA 42 11. Actividad de apoyo a la docencia. Consistió en el aprendizaje, desarrollo y realización de las técnicas utilizadas para la elaboración de laminillas histológicas permanentes, con el fin de aumentar el acervo de material didáctico en el laboratorio. Su importancia está relacionada con el ámbito de la enseñanza y la investigación, pues por medio de éstas se logra obtener información real, comprobable y útil para la generación de nuevos conocimientos. Dicho proceso se considera una herramienta versátil, ya que permite hacer una observación profunda del material en estudio, además de que se puede aplicar en diferentes campos de la investigación como por ejemplo: A. Propagación in vitro: Es necesario saber cómo están estructuradas las células de las plantas y cómo es que dan origen a los tejidos que constituirán nuevos órganos vegetales. En el reporte nombrado ESTUDIOS HISTOLOGICOS DE LA FORMACION DE ORGANOS in vitro DE Mussaenda erythrophylla SCHUM Y THONN, "Rosea". NORCA MOGOLLÓN DE LUCENA; MARÍA GÍL DE SERPA. Se reporta que en la fase iniciación se observó la formación de un brote principal como consecuencia del crecimiento y desarrollo del explante y de manera inconsistente, uno o dos brotes laterales a partir de yemas axilares. En la fase de multiplicación hubo desarrollo de brotes normales y adventicios. Estos últimos procedieron de áreas meristemáticas originadas por diferenciación del tejido de callo localizado en la base del explante. Posteriormente, mediante procesos de diferenciación y organización, dieron origen a los primordios de yema. En la fase de rizogénesis, los iniciales de raíz se originaron del procambium, y en los días sucesivos se diferenciaron en primordios y luego en raíces con sistema vascular propio. B. Fisiología vegetal: Es necesario estudiar la forma en que funcionan las plantas, así pues, es importante estudiar su composición celular y tisular. En el estudio titulado: IDENTIFICACIÓN HISTOLÓGICA Y ULTRAESTRUCTURAL DE PLANTAS C4 Y CAM. ADELA OLMEDILLA ARNAL, JUAN DE DIOS ALCHÉ RAMÍREZ y MARÍA ISABEL RODRÍGUEZ GARCÍA. 43 Se realizó para averiguar el tipo de metabolismo fotosintético que presentan distintas plantas vasculares de una localidad y, mostrar la gran adaptabilidad de éstas al medio donde habitan. C. Fitopatología: Es importante conocer cuáles son los tipos de alteraciones tisulares que los diferentes organismos fitopatógenos causan a las plantas. Como se puede ver en el ESTUDIO HISTOLOGICO DE AGALLAS INDUCIDAS POR ARTROPODOS EN ALGUNAS ESPECIES DE COMPOSITAE. EUCARIZ VILLAZÓN DE PINZÓN. Se analizan las alteraciones en los tejidos de las hojas con agallas de tres especies de Compositae. Este estudio fue realizado mediante cortes histológicos (secciones transversales) de las hojas, con el fin de determinar los cambios morfológicos de las células atrofiadas con relación a los tejidos que constituyen el órgano sano de la planta. Se observó un aumento desmesurado en el número de capas celulares del parénquima esponjoso (hiperplasia, las cuales se disponen principalmente alrededor de la cavidad larvaria para formar el tejido que servirá de alimento al parásito. D. Enseñanza: En el proceso de enseñanza aprendizaje, no se debe escatimar en los recursos o medios didácticos utilizados para el aprendizaje de una asignatura, ya que este debe cumplir con las exigencias que implica obtener un aprendizaje significativo, y despertar habilidades y destrezas en la formación del estudiante. En el MANUAL DE HISTOLOGIA, ESTRATEGIA DIDÁCTICA EN LA ENSEÑANZA PARA EL NIVEL SUPERIOR. Q.B.P. ELSA MARIA TAMEZ CANTU. Se menciona que en la primera fase de su elaboración se realizaron una serie de laminillas histológicas permanentes mediante la aplicación técnicas histológicas. Después se seleccionaron los mejores cortes histológicos correlacionados con el desarrollo de los de las necesidades específicas del programa de estudio. Teniendo en cuenta lo anterior, es importante que la técnica de preparación de laminillas histológicas se dé a conocer de manera detallada y fácil de entender. Por este motivo se realizó el presente Manual de Técnica de elaboración de laminillas histológicas permanentes y apoyar de esta manera a la asignatura en la enseñanza-aprendizaje de los alumnos. 44 FASES DEL DESARROLLO DEL MÉTODO DE ELABORACIÓN DE LAMINILLAS. Fase 1. Obtencion de información Fase 2. Adiestramiento y desarrollo de habilidades. Fase 3. Obtención de material diadactico. 45 11.1 Obtención de información. Fase 1. Inició el día 20 de junio del 2013, me di a la tarea de buscar información relacionada con el tema, primero con textos que tratan los temas de anatomía y organografía vegetal, el uso del microscopio, el correcto uso del laboratorio, y manejo de los reactivos. Posteriormente se leyó, analizó y discriminó la información durante la semanas del 24 al 28 de Junio del 2013 y del 22 al 31 de Julio del 2013. En la semana siguiente, en el laboratorio; realicé inventarios del material que disponía el laboratorio, de las estructuras que se tenían infiltradas ó ya incluidas en parafina, con el propósito de identificar cuales se tienen infiltradas o incluidas para saber qué tipo de órganos se necesitan procesar. Con fecha del 12 de Agosto, se inició la recolecta de los ejemplares botánicos con los que se realizó el trabajo de la elaboración de laminillas, la especie de la cual se realizaron, recibe el nombre de Toloache (Datura stramonium). Las muestras fueron colectadas tanto de un área verde del Instituto Politécnico Nacional en Zacatenco, así como en el Jardín Botánico de la Facultad de Estudios Superiores Cuautitlán. Datura stramonium es una planta la cual no ha sido estudiada a profundidad, podemos encontrar información acerca de su descripción botánica y usos tradicionales medicinales, pero un estudio detallado a nivel histológico todavía no está reportado. Es por ésta razón que se decidió utilizar la especie, ya que con las laminillas obtenidas, se apoyó a un estudio de investigación. Foto 1. Recopilación de información. 46 11.2 Adiestramiento y desarrollo de habilidades. Fase 2. En esta fase el estudiante da inició al conocimiento práctico de las técnicas histológicas, se debe tener cuidado en cuanto a la preparación de soluciones, ya que si no preparas adecuadamente cualquiera de ellas, ya sea el fijador o los alcoholes, los tejidos pueden colapsar, y todo el trabajo no servirá de nada y no te puedes dar cuenta de hasta el final. También se debe revisar la temperatura de la estufa, pues si es muy elevada pueden quemar los tejidos. Observar que al momento de que dejes los tejidos en la cámara de flotación, no tenga burbujas, pues estas ocasionarán que el tejido no se pueda ver bajo el microscopio. Tienes que recordar filtrar los colorantes, pues los desechos impiden que sean visibles los tejidos. Al momento de montar se debe evitar que la resina tenga burbujas, pues también impide la buena observación en el microscopio. Foto 2. Adiestramiento. 47 En la última semana de Agosto se realizaron las actividades siguientes: 1) Preparación del carrusel de deshidratación: a) Solución Fijadora (FAA). b) Soluciones de alcohol (30%, 50%, 70, 96% y 100%). c) Soluciones alcohol/cloroformo (2:1, 1:2 y cloroformo absoluto). 2) Recolecta del material biológico 3) Subdivisión del material. 4) Fijación. 5) Deshidratación. 6) Infiltración. 7) Inclusión. 8) Corte. 9) Tinción. 10) Montaje (Sandoval, 2005). Estas etapas se desarrollan y explican a detalle en la fase siguiente. 11.3 Obtención de material didáctico. Fase 3 En esta etapa se describe la metodología aplicada para la obtención de laminillas de Datura stramonium, pues fue el trabajo que se realizó durante estas meses y que justifican el presente escrito. a. Recolecta. En esta etapa se debe definir que espécimen vegetal va a ser colectado y cuál es el objeto de estudio. Selección de herramientas de trabajo. Selección de material biológico (Hoja, tallo, raíz, flor, fruto o planta completa). Anotar en la bitácora los datos importantes del lugar de colecta y de la planta (Curtis ,1986; Sandoval, 2005). 48 Foto 3. Ejemplar Datura stramonium L. Fpoototo Foto 4, Ejemplificación de recolecta en planta de malvón. 49 Foto 4. Recolecta de material biológico. 50 b. Subdivisión del material. Lavado del material biológico con agua corriente en el laboratorio, para retirar cualquier tipo de residuo orgánico o inorgánico. Obtención de cortes pequeños con ayuda de un bisturí y una tabla para cortar (en caso de tejidos suaves). Las hojas se cortan en tres partes tanto a lo largo como a lo ancho, para obtener la nervadura central, el peciolo y el ápice de la misma. Los tallos se cortan transversal y longitudinalmente, en un espesor aproximado de 1.5 cm. Las raíces se cortan de forma similar a los tallos. En el caso de las flores debemos exponer los órganos sexuales, es conveniente colocar los ovarios y las anteras con filamentos, además de la corola y el cáliz. En los frutos se deben hacer cortes de los carpelos en caso de que sean muy grandes. Para las semillas depende del tamaño, pueden hacerse cortes tanto transversal como longitudinal (Curtis, 1986). Foto 5. Subdivisión del material. 51 c. Fijación. Inmediatamente después de que son cortados los órganos e deben sumergir en la solución de FAA, para evitar la autolisis. Se deja el tejido en un frasco con tapa en solución fijadora (FAA) por 24 horas. Se retira la solución fijadora y se enjuagan con agua corriente (Sandoval, 2005). Foto 6. Fijación. 52 d. Deshidratación. Los tejidos se trasfieren a una solución de alcohol de 30% por dos horas en caso de tejido suave y cuatro horas para tejidos más duros. Se etiquetan los frascos. Se retira el alcohol y se pasa a la siguiente concentración. Finalmente se colocan en la soluciones de cloroformo hasta llegar al absoluto, por dos o cuatro horas según sea el caso. Se retira y recicla la solución (Sandoval, 2005). Foto 7. Deshidratación. 53 e. Infiltración. Se precalienta la parafina o paraplast (material de infiltración) por 24 horas a 60°C. Se retira el alcohol y se agrega el material de infiltración. Se llevan a la estufa por tres días a 60°C para que el material de infiltración penetre los tejidos (Sandoval, 2005). Foto 8. Infiltración. 54 f. Inclusión. Se elaboran cubos de papel, doblando en secciones de tres por largo y ancho, después se dobla en diagonal y se forma el cubo con pequeñas pestañas que se doblan hacia afuera. Se hacen etiquetas a mano con lápiz, en forma de tiras delgadas. Se coloca el material biológico dentro del cubo. Se agrega parafina derretida y se coloca la etiqueta con ayuda de unas pizas, alrededor del cubo. Se dejan enfriar a temperatura ambiente y después se pasan al refrigerador por un día y, después se desmoldan (Sandoval, 2005). Foto 9. Inclusión. 55 g. Corte. Se comienza a visualizar las partes que componen un micrótomo. Se prepara la cámara de flotación agregando agua corriente y grenetina químicamente pura. Se conecta la platina para el secado del tejido. Se coloca un cubo de parafina y se hace rotar. Comienza el corte del listón. Se colocan tres tejidos en listón en la cámara de flotación. Se pescan con un portaobjetos y se colocan sobre la platina (Sandoval, 2005). Foto 10. Corte. 56 Foto 11. Corte. 57 h. Tinción. Se prepara el carrusel para la tinción, con alcoholes de (30, 50, 70, 96 y 100%), xileno absoluto, colorantes (Safranina, verde rápido, azul de toluidina), agua destilada y, aceite de clavo que se colocan en cajas de Coplin. Las laminillas se colocan en las rejillas de las cajas de Coplin y se meten en la estufa durante 15 minutos. Se coloca hojas de papel reciclado sobre la mesa. Se inicia la rehidratación de los tejidos pasándolos por xileno absoluto, alcohol absoluto, hasta llegar al alcohol 30% por minuto y medio en cada caso; después se pasan al colorante durante otro minuto y se enjuagan durante dos minutos. Se pasa por el alcohol del 30% hasta llegar a alcohol absoluto por 30 segundos cada uno, si se trata de la coloración safranina verde rápido, se pasa al colorante verde rápido por un minuto y después por aceite de clavo; finalmente se dejan en xileno para su montaje. En caso de utilizar azul de toluidina, se sigue el proceso de deshidratación hasta alcohol absoluto y después se pasa a xileno para su montaje (Sandoval, 2005). Foto 12. Tinción. 58 i. Montaje. Se preparó previamente la resina sintética con la cual se sellan las laminillas. Con cuidado se sacan las laminillas del xileno y se coloca una cantidad de resina sobre el tejido ya teñido. Se coloca un cubreobjetos sobre la resina y con cuidado con ayuda de una aguja de disección se expulsan las burbujas. Se colocan sobre los cartones para que se sequen (Sandoval, 2005). Foto 13. Montaje. j. Revisión al microscopio. Después de que las laminillas están secas, se hace una selección de las mejores, es decir, se examinan en el microscopio una a una, para ver como quedo el corte, tinción y posición del tejido. Entonces se desechan las que no están en buenas condiciones. 59 k. Limpieza y Etiquetado. Una propuesta para el etiquetado es la siguiente: las etiquetas se realizan en Word office, con una plantilla previamente elaborada. Puede llevar el escudo de alguna institución o no, pero si deben llevar los datos más representativos de la planta, como aparecen en el ejemplo. Se utiliza una navaja para retirar la resina seca que se encuentra en los alrededores de la laminilla. Con un lienzo y un poco de xileno se quitan los restos de resina. Con un lienzo seco se limpian por completo. Las etiquetas se recortan y se pegan con pegamento líquido y un pincel en la parte que no es ocupada por el tejido y el cubreobjetos. Para finalizar la laminillas se colocan en cajas portadoras de laminillas para ser utilizadas por los alumnos de la carrera de Ingeniería agrícola. Figura 2. Etiqueta para laminilla permanente Datura stramonium Raíz C. longitudinal Azul de toluidina 60 Foto 14. Limpieza. Foto 15. Etiquetado. 61 Foto 16. Guardado de laminillas. 62 11.4 Contribución. Como parte de la actividad de apoyo a la docencia se realizaron laminillas permanentes de la planta Datura stramonium L., que sirvieron como apoyo para el reporte de investigación: “Contribución al estudio de Datura stramonium L.” en el XXXVI Congreso Nacional de Histología, realizado en la ciudad de Cuernavaca Morelos del 16 al 18 de Octubre del 2013 y a su vez en el XIX Congreso mexicano de Botánica, llevado a cabo en Tuxtla Gutierrez, Chiapas; del 20 al 25 de Octubre del 2013. Foto 17. Cartel: XIX Congreso mexicano de Botánica. 63 Foto 18. Cartel: Contribución al Estudio Anatómico de Datura stramonium L. 64 DISCUSIÓN. Es importante mencionar que la actividad de apoyo a la docencia, si bien es un trabajo que relativamente es corto, en tiempo, permite que el alumno se familiarice con las actividades que se realizan en laboratorio, me refiero, en cuanto la estructura, tiempos y forma de llevar la metodología. Los materiales con los que se cuenta podrían no ser los más adecuados, pero se tienen que utilizar los que están a nuestro alcance e implementar diversos recursos para realizar las actividades; un ejemplo claro se encuentra en la técnica de inclusión, ya que para llevarla a cabo, es necesario la realización de cubos de papel, y ¡qué mencionar de los frascos de café reciclados, para montar el carrusel de alcoholes¡ es de lo que se dispone. Debo señalar que la navaja del micrótomo, no tiene el filo adecuado y esto interfiere en la calidad de los cortes, al obtenerlos deformados y rotos. Durante la etapa de la colecta, no contaba con cámara fotográfica, lo que obstaculizó su documentación, debido a que Datura Stramonium es una planta anual, no tuve el tiempo suficiente. Existen diversas técnicas para la elaboración de laminillas histológicas permanentes, dependiendo el tipo de organismo que deseemos procesar (animal o vegetal), en este caso específico nos inclinamos por especies vegetales. Entonces de toda esa gama de posibilidades, se puede elegir cual aplicar, así, en el Manual de trabajo presento las técnicas que se utilizan comúnmente en el laboratorio de Anatomía y Organografía Vegeta. Después de haber concluido el trabajo y revisar todo el proceso realizado, me doy cuenta de que como todo ser humano cometo errores, pero que cada error deja un aprendizaje; que tenemos limitaciones en cuanto al material necesario y que como todo nuevo conocimiento adquirido requiere de tiempo, dedicación y esfuerzo para su completa aplicación, pero esto se ve reflejado cuando te das cuenta que lo has dominado. 65 CONCLUSIONES. Al término de la actividad de apoyo a la docencia, se cumplieron los objetivos planteados, ya que se produjeron nuevas laminillas útiles para las prácticas de laboratorio en la asignatura y se obtuvo el Manual de Trabajo, que será utilizado como guía para aquellas personas interesadas en elaborar material de este tipo. Para la realización de la técnica de tinción, se obtuvo mejores resultados al utilizar el colorante safranina “O”, pero preparada con metilcelosolve. Al revisar las laminillas en el microscopio, se vio que el tejido tuvo un color rojo profundo, es decir, no se decoloró al ser sometido a la deshidratación y rehidratación en alcoholes; en comparación con el colorante safranina “O” que no lo contiene metilcelosolve. Los cortes de hoja, flor y fruto, fueron mejores, debido a que son estructuras más suaves que tallo y raíz, pues estas últimas, son más fibrosas, por lo tanto más difíciles de cortar, sobre todo, en las condiciones de la navaja del micrótomo. Por otra parte, se apoyó a la investigación “Contribución al estudio de Datura stramonium L.” en el XXXVI Congreso Nacional de Histología y a su vez en el XIX Congreso mexicano de Botánica. 66 GLOSARIO 67 Angiosperma: Planta que tiene semillas en los ovarios. Consideradas como plantas superiores con flores. Angulado: Se refiere a la apariencia de que tiene el tallo en ángulo, no redondeado. Antera: Parte de la flor localizado en el estambre, es una bolsa donde están encerrados los granos de polen. Apical: Cuando se refiere a una célula, es la parte que está en contacto con una superficie libre o una cavidad interna del organismo. Las células que tienen partes apicales y basales se dice que son polarizadas puesto que ambas partes realizan funciones celulares diferentes. Axonomorfa: Raíz formada por una estructura principal más gruesa y otras que salen de la principal más delgadas. Caliptra: (ver cofia). Cáliz: Es el verticilo externo en las flores con perianto heteroclamídeo, es decir, con dos clases de piezas. Se compone de sépalos, que son antófilos estériles, generalmente verdes y de consistencia herbácea. Tiene función protectora. Cambium vascular: Es un meristemo secundario. A partir de él se originan los tejidos conductores secundarios: xilema y floema. El xilema se formará a en la parte interna y el floema en el externo de este meristemo. Esta disposición es gracias a las divisiones periclinales de sus células. Cambium suberoso:(o felógeno) Meristemo secundario que se encuentra internamente a la corteza de los tallos secundarios. Forma un cilindro o placas de células que se disponen a lo largo del tallo. Las divisiones mitóticas de sus células son periclinales y originan hacia el exterior súber o corteza y hacia el interior la felodermis. Carpelo: Son hojas modificadas que forman la parte reproductiva femenina de la flor de las plantas angiospermas. Son la unidad básica del gineceo. Por su carácter de hojas portadoras de megásporas (o macrósporas), las células por cuya multiplicación se forma el gametofito femenino, El conjunto de los carpelos de una flor constituye el gineceo (parte femenina de la planta). Los carpelos pueden aparecer soldados, formando un gineceo único, o permanecer separados, asentado cada uno en el receptáculo, formando otros tantos gineceos independientes. Catafilos: Hojas modificadas y reducidas que generalmente protegen a las yemas de la planta que se hallan en reposo, particularmente en órganos subterráneos de reserva como bulbos y rizomas. A menudo presentan forma de escamas y no presentan clorofila ya que no tienen como función la de realizar la fotosíntesis. Celulosa: Uno de los principales componentes de las paredes celulares de las células vegetales, responsable del sostén de las partes aéreas de las plantas. Hace a las paredes celulares impermeables al agua. La celulosa es un polisacárido compuesto por unidades de glucosa que forman enlaces beta-1-4, formando estructuras lineales. Estas hebras de monosocáridos establecen enlaces eléctricos entre ellas hasta formar una estructura compacta denominada fibrillas de celulosa, que gracias a otros glúcidos como la hemicelulosa y las pectinas forman las denominadas fibras de celulosa. La orientación de las fibrillas de celulosa en la pared celular condiciona la dirección del crecimiento de la célula vegetal y por tanto el de los órganos de la planta. 68 Célula colenquimática: Célula que forma el colénquima de las plantas. Presenta una gruesa pared celular primaria caracterizada por engrosamientos distribuidos de manera desigual y esto confiere al tejido gran fuerza de tensión y resistencia al estrés mecánico. Son capaces de reanudar una actividad meristemática gracias a que sus paredes celulares son primarias y no lignificadas, a pesar de su grosor. Célula meristemáticas: Tipo celular indiferenciado que se encuentra en los meristemos de las plantas. Su misión en los meristemos permanentes es doble, producir células que se diferencien y pasen a formar parte de nuevos tejidos, con lo que se produce el crecimiento de la planta, y producir nuevas células meristemáticas para mantener una reserva de células indiferenciadas. Célula parenquimática: Son las denominadas células fundamentales de las plantas y las que, junto con las meristemáticas, muestran un menor grado de diferenciación. Sus principales funciones son la fotosíntesis y servir de almacenes de reserva. Tienen capacidad de desdiferenciarse y diferenciarse en otros tipos celulares de la planta. La mayoría tienen una pared celular primaria, aunque algunas presentan una pared secundaria muy delgada. Clorénquima: Ver parénquima clorofílico. Cofia: Capa de células especializadas que envuelve y protege al meristemo primario apical radical. Está formada por células meristemáticas que segregan glucosaminoglicanos como lubricante. Colénquima: Tejido vegetal de sostén formado por células vivas que aparece normalmente en tallos y hojas en crecimiento, no está presente en las raíces. Las células que lo forman tienen forma alargada y presentan paredes celulares primarias con engrosamientos irregulares. Es un tejido que aporta flexibilidad a la planta gracias a que sus células poseen paredes celulares resistentes a la deformación. Se localiza normalmente próximo a la epidermis. Hay cuatro tipos de colénquima clasificados según el engrosamiento de las paredes celulares: angular, tangencial, lagunar y anular. Colénquima anular: Tejido colenquimático cuyas células presentan las paredes celulares engrosadas de manera homogénea. Colénquima angular: Tejido colenquimático cuyas células poseen engrosamientos únicamente en los ángulos entre las células adyacentes. Las células están dispuestas de manera compacta y no hay espacios intercelulares. Se suele encontrar justo debajo de la epidermis. A veces se le denomina hipodermis. Colénquima lagunar: Tejido colenquimático que destaca porque sus células dejan espacios intercelulares grandes, los engrosamientos de la pared celular aparecen delimitando estos espacios. Colénquima laminar: (o colénquima tangencial). Tejido colenquimático con células que presentan engrosamientos en las porciones paralelas a la superficie del órgano de la planta donde se encuentran. Por ejemplo, en el tallo son paralelas a la superficie de éste. Entre sus células hay espacios sin pared celular, aunque no tan grandes como en el lagunar. Corola: Parte de la flor formada por pétalos (piezas coloreadas), su función es atraer a los animales portadores de polen. 69 Cotiledón: Primeras hojas del embrión. Las plantas se clasifican de acuerdo al número de coltiledones en: monocotiledóneas y dicotiledóneas. Crecimiento primario: Es el primer tipo de crecimiento que experimenta la planta cuando inicia su desarrollo. Se realiza gracias a la actividad de los meristemos primarios y así la planta crece mayoritariamente en longitud. Algunas plantas sólo presentan este tipo de crecimiento. Crecimiento secundario: Es exclusivo de determinados grupos de plantas, principalmente leñosas, que desarrollan un crecimiento en grosor. Este tipo de crecimiento se debe a la actividad de los meristemos secundarios. Cutina: Es un complejo molecular que forma la mayor parte de la cutícula de la epidermis de flores, frutos, hojas y tallos con crecimiento primario. Cubre la parte más externa de las paredes celulares donde aparece. El grosor, composición y disposición de la cutina depende del tipo de órgano. La cutina está compuesta por ácidos grasos de cadena larga unidos por enlaces tipo éster. Su principal misión es limitar el flujo de agua y gases entre la planta y su medio externo. Cutícula: Capa hidrofóbica formada por ceras y cutina, siendo esta última su componente principal, se deposita en las paredes más externas de las células epidérmicas de las partes aéreas de las plantas, en los tricomas y en las células acompañantes de los estomas. Su principal misión es evitar la pérdida de agua, su grosor es mayor en las plantas de zonas áridas, evita que las superficies de las plantas se humedezcan, además de protegerlas frente a patógenos. Dicotiledóneas: Plantas que presentan dos hojas embrionarias o cotiledones sólo durante la germinación de la semilla y que posteriormente desaparecen. Tienen una raíz principal con ramas laterales Embrión: Planta en miniatura en estado de vida latente o letargo. Se forma generalmente como consecuencia de la fecundación de la oósfera. La doble fecundación de las angiospermas da lugar al desarrollo del embrión y del endospermo, el cual es el tejido nutricio del embrión durante la germinación. Endospermo: Tejido de la semilla que sirve como fuente de reserva al embrión de las plantas. Se origina a partir de las células que hay en el saco embrionario, aunque por un proceso diferente en angiospermas y gimmnospermas. Entrenudo: La porción de tallo que se encuentra entre dos nudos. Epidermis: Capa de células que separa el medio interno de las plantas del externo. Está formada generalmente por una sola capa de células. Normalmente es una capa transparente ya que sus células suelen carecer de cloroplastos. Su principal misión es la de protección, no sólo frente a daños mecánicos sino de manera muy importante frente a la desecación. Para ello, en las zonas aéreas, la superficie externa de la epidermis presenta modificaciones de su pared celular por depósitos de cutina y ceras, formando así la cutícula. Ambas sustancias impiden la transpiración desde los tejidos internos. En estos casos los estomas son los encargados de regular el flujo de agua entre los tejidos y el aire. La epidermis de las raíces carece de cutícula y de estomas, ya que su principal misión es absorber agua y sales minerales disueltas. Únicamente en las zonas maduras, donde ya no hay absorción, se deposita cutina en la porción externa de las células epidérmicas. Otras modificaciones epidérmicas son la presencia de tricomas en las partes aéreas y pelos radicales en las subterráneas. En los órganos de la planta que presentan crecimiento de tipo secundario la epidermis es sustituida por la peridermis. 70 Esclerénquima: Tejido de sostén de las plantas cuyas células tienen paredes gruesas y lignificadas cuando son maduras, por tanto son células muertas. Su papel de sostén es importante en estructuras de la planta que han dejado de alargarse, a las cuales les aporta elasticidad. Aunque puede encontrarse tanto en estructuras con crecimiento primario como secundario, su papel es más importante en las segundas. Es abundante en los tallos, hojas y raíces. Está formado por dos tipos de células: fibras y esclereidas. Estambre: Hojas modificadas parte de la flor que tiene como función llevar las anteras. Estigma: Parte superior del carpelo en forma de receptáculo para recoger polen. Estilo: Parte estrechada del carpelo en forma de tubo conductor hacia el ovario. Estomas: Poros de la planta localizados en el envés de la hoja para el intercambio gaseoso. Endocarpio: Parte más interna del fruto. Entrenudos: Espacios situados entre los nudos. Epicarpio: Parte más externa del fruto. Felógeno: ver cambium vascular. Floema:Tejido vivo de las plantas vasculares especializado en la conducción de moléculas orgánicas disueltas, principalmente producidas en las partes verdes, hacia todas las células de la planta. A este tejido también se le llama líber o tejido criboso. Hay dos tipos de floema, el primario y el secundario. El floema primario se origina a partir del meristemo procambium y pasa por un estado inicial denominado protofloema y otro más tardío denominado metafloema. En plantas con crecimiento secundario se origina el floema secundario a partir del meristemo cambium vascular. Está formado por varios tipos celulares: elementos conductores como las células cribosas y los tubos cribosos y elementos no conductores como las células parenquimáticas, las células acompañantes y las fibras de esclerénquima. Flor: Estructura reproductiva característica de las plantas llamadas espermatofita o fanerógama. La función de una flor es producir semillas a través de la reproducción sexual. Fotosíntesis: Proceso bioquímico por el que se fija CO2 gaseoso a moléculas orgánicas utilizando la energía de la luz. En las plantas son los cloroplastos quienes realizan la fotosíntesis, gracias a una compleja cadena de proteínas localizadas la membrana tilacoidal. Fruto: Ovario maduro que resguarda las semillas para asegurar su dispersión. Gamopélata: Hace referencia al tipo de flor que tiene los pétalos soldados total o parcialmente. Gamopsépala: Tipo de flor que tiene unido el cáliz total o parcialmente. Gimnosperma: Plantas cuyas semillas no están encerradas en el ovario. Hemicelulosa: Polímero de azúcares diversos que aparece en la pared celular de las células de las plantas. No adopta una estructura cristalina, como ocurre con la celulosa, sino amorfa, y el número de azúcares en cada molécula de hemicelulosa es mucho menor que en la celulosa. Su misión, junto con las pectinas, es cementar y dar consistencia a las fibras de celulosa de las paredes vegetales. 71 Histología: Parte de la ciencia que estudia los tejidos de los organismos. Hoja: Órgano vegetativo, generalmente aplanado de las plantas vasculares, especializado principalmente para realizar la fotosíntesis. Lámina media: (referido a la pared celular). También llamada sustancia intercelular, es la capa más externa de la pared celular de las células de las plantas y es compartida por células adyacentes. Es la primera capa en generarse durante la citocinesis o división citoplasmática de las células. Tiene un aspecto amorfo y es rica en sustancias pécticas, sales de calcio de ácidos pécticos. Permite la difusión del agua a su través. Si se degrada la lámina media las células no podrían permanecer unidas. Lignina: Es una molécula compleja y grande que aparece en las paredes celulares secundarias de las células vegetales y cuya misión es aportar rigidez a la pared celular mediante el establecimiento de conexiones covalentes con la hemicelulosa. Debido a su carácter hidrofóbico también favorece la conducción de agua por parte de las células que la poseen, fundamentalmente xilema, ya que hace a la pared celular poco permeable al agua. Meristemo: Conjunto de células indiferenciadas que aparece en las plantas. A partir de estas células se van a formar los diferentes tejidos de una planta. Existen diversos tipos de meristemos: a) primarios, responsables del crecimiento en longitud de la planta y se encuentran en los extremos de ramas y raíces; así como en los entrenudos; y b) secundarios, responsables del crecimiento en grosor de las plantas, aparecen a lo largo del tallo y raíz con crecimiento secundario. Meristemo apical: Grupo de células indiferenciadas que se encuentra en el ápice de los tallos y raíces. Es el responsable del crecimiento primario de las plantas. En el tallo da lugar a la epidermis y tejido fundamental, a partir del cual se originan el resto de tipos celulares de la parte aérea. En la raíz da lugar a los tejidos que producen el crecimiento primario. Meristemo intercalar: Es un tipo de meristemo responsable del crecimiento en longitud de las plantas. Se localiza entre tejidos no meristemáticos, principalmente en los entrenudos del tallo y en vaina de las monocotiledóneas. Meristemo fundamental: Es la parte de los meristemos apicales primarios que está parcialmente diferenciada para originar los tejidos fundamentales de la planta, como el parénquima, colénquima y esclerénquima. Meristemo lateral: Ver meristemo secundario. Meristemo primario: Es responsable del crecimiento en longitud de la planta. Si se encuentra en los entrenudos se les denomina intercalares y si están en los extremos de las ramas o de las raíces se les llama apicales. Si está en los ápices de las ramas se denomina meristemo apical caulinar y si está en los de las raíces meristemo apical radical. Principalmente hay tres tipos de meristemos apicales: la protodermis, el procambium y el meristemo fundamental. Meristemo secundario: O meristemo lateral. Es un tipo de meristemo que produce el crecimiento en grosor de las plantas. No está presente en todas las plantas como en algunas herbáceas ni en órganos como las hojas. Hay dos tipos de meristemos secundarios: el cambium vascular y el cambium suberoso. Mesocarpo: Parte media y más gruesa en la mayoría de los frutos. 72 Mesófilo: Tejido parenquimático que se encuentra en las hojas, ocupa el espacio entre la epidermis del haz la epidermis del envés. Mayoritariamente está formado por parénquima clorofílico. Nudo: Son los lugares del tallo de la planta donde se encuentran unidas las hojas o crecen las ramas laterales. Órgano: Tejido o conjunto de tejidos que se organizan para formar una estructura diferenciada, la cual lleva a cabo una función concreta en el organismo. Ovario: Es la parte más amplia del carpelo y donde se encuentran los óvulos que han de ser fecundados por el polen. Pared celular: Es un conjunto de moléculas que rodea a todas las células de las plantas (también la de los hongos y levaduras). La pared celular de las plantas se puede considerar como una matrix extracelular muy especializada, puesto que la producen las propias células de las plantas, aunque con características diferentes a la de los animales. Todas las paredes celulares tienen una capa producida conjuntamente por células vecinas denominada lámina media. Interiormente a ella se encuentra la pared celular primaria. Estas dos capas las poseen todas las células vegetales, mientras que en algunas aparece una tercera capa, próxima a la membrana plasmática, denominada pared celular secundaria. El principal componente de la pared celular es la celulosa, pero también abundan la hemicelulosa, glucoproteínas, pectinas, etc. La lignina abunda en la pared celular secundaria, mientras que en paredes celulares especializadas pueden encontrarse otras moléculas como la suberina o la cutina. Las misiones de la pared celular son variadas, pero destacan la adhesión entre células, armazón de soporte de las células, órganos y, en definitiva, de todo el cuerpo de la planta, controla, además, la forma celular, la presión osmótica, actúa como centro de señalización durante la diferenciación y el crecimiento, sirve como medio de comunicación entre células. Pared celular primaria: Es una capa de la pared celular de las células de las plantas que se encuentra a ambos lados de la lámina media y, cuando existe, externamente a la pared celular secundaria. Pared celular secundaria: Es una capa de la pared celular de algunas células de la plantas. Se localiza entre la membrana plasmática y la pared celular primaria y, por tanto, cuando está presente, siempre es la última capa en aparecer. Es más gruesa y más resistente que las otras capas de la pared celular y se deposita cuando la célula ha dejado de crecer. Está formada sobre todo por celulosa, hemicelulosa e incorpora también lignina, que aporta gran rigidez. La pared celular secundaria es el principal componente de la madera Parénquima: Es un tejido que realiza numerosas funciones, las cuales dependen del órgano donde se encuentren. En las hojas realiza la fotosíntesis, en raíces y frutos sirve de almacén, etcétera. En cada uno de ellos el parénquima recibe nombres diferentes como parénquima clorofílico, de reserva, aerífero, etcétera. Está formado por un tipo de células que generalmente presenta una pared celular primaria poco engrosada. Las células parenquimáticas tienen la capacidad de desdiferenciarse y convertirse en otros tipos celulares de la planta, por tanto pueden tener capacidad meristemática. Parénquima acuífero: es un tejido vegetal característico de las plantas que viven en climas secos, denominadas plantas xerófitas. Las células parenquimáticas almacenan agua y son grandes, de paredes delgadas y con una gran vacuola donde se acumula el agua. En el citoplasma o en la 73 vacuola hay mucílagos, conjunto de sustancias que aumentan la capacidad de absorción y retención de agua. Parénquima aerífero: es un tejido vegetal que presenta numerosos espacios entre sus células, los cuales permiten la conducción de gases. Aparece tanto en raíces, como en tallos y hojas de plantas que habitan ambientes acuáticos o encharcados. Permite mantener un nivel suficiente de oxígeno entre sus células en condiciones de bajo nivel de oxígeno. Parénquima clorofílico: es un tejido vegetal especializado en realizar fotosíntesis debido a que sus células poseen una gran cantidad de cloroplastos. Se suele encontrar bajo la epidermis de las hojas, donde la luz incide más fuertemente. Pero también aparece en tallos y ramas verdes de algunas plantas. Parénquima de reserva: es un tipo de parénquima, cuyas células están especializadas en almacenar sustancias de reserva. Estas pueden ser proteínas, lípidos o azúcares, los cuales están disueltos en sus citoplasmas o formando agregados como el almidón. Peciolo: Es la parte de la hoja que une al limbo a la rama, en él transitan los vasos conductores. Pectina: son polisacáridos que aparecen abundantemente en la pared celular primaria y en la lámina media de la pared celular de las células de las plantas. Por sus características moleculares permiten, en combinación con el agua, formar geles, lo que ayuda a la difusión de moléculas disueltas en agua entre células vecinas. Las pectinas están ausentes de la pared celular secundaria. Pedúnculo: ramita o rabillo que sostiene una inflorescencia o un fruto tras su fecundación.Posee la estructura de un tallo y es responsable de la sustentación y conducción de savia a las flores. Se conecta con el raquis de la inflorescencia en la base y es el cáliz del ápice. Raramente presenta ramificaciones o estructuras de origen foliar. En su ausencia, las flores son sésiles. Una compresión o cambios en la consistencia del pedicelo pueden influir en las características reproductivas de las flores. Pelos absorbentes: Filamentos diminutos que cubren la raíz y su función es la de absorber agua y las sales minerales del suelo. Perianto: es una estructura floral que corresponde a la envoltura que rodea a los órganos sexuales; constituye la parte no reproductiva de la flor. Está formada por dos tipos de piezas: La corola, formada por los pétalos que son las piezas coloreadas de las flores. Su función es atraer a los animales polinizadores. El cáliz, la parte verde de la flor, tiene una consistencia más fuerte que la corola y sus piezas se denominan sépalos. En ocasiones los pétalos y los sépalos tienen el mismo color, en este caso se denominan tépalos. Peridermis: Tejido que protege externamente al tallo y a las raíces con crecimiento secundario, donde finalmente reemplaza a la epidermis. Se forma una vez que comienza la diferenciación del xilema y floema secundarios. Se origina a partir del cambium suberoso y está formada por tres que capas: felodermis, felógeno o cambium suberoso y súber o corcho. Pétalo: Es un antófilo que forma parte de la corola de una flor. Es la parte interior del perianto, el cual comprende las partes estériles de una flor. En una flor "típica" los pétalos son llamativos y coloreados, y rodean las partes reproductivas. El número de pétalos en una flor es indicativo de la clasificación de la planta: dicotiledóneas, que típicamente tienen cuatro o cinco pétalos; y 74 monocotiledóneas, que tienen tres o algún múltiplo de tres pétalos. La función principal de los pétalos o de la corola es la de atraer los polinizadores. Plantas vasculares: son aquellas plantas que poseen un tejido capaz de conducir sustancias es decir, tienen un tejido vascular formado por xilema y floema. Polen: Producto reproductor masculino incluido en la antera del estambre. Polinización: Es el paso del polen desde el aparato masculino de las plantas al aparato femenino. Primordio foliar: Grupo de células derivadas del meristemo apical que por diferenciación darán lugar a los distintos tipos de células y de tejidos de una hoja. Procambium: Parte del meristemo primario apical encargado de formar el sistema vascular primario: xilema y floema primarios. Protodermis: Es una capa de células meristemáticas de los meristemos primarios apicales y que tienen como objetivo convertirse en células epidérmicas. Pubescente: Que está cubierto de pelos suaves y blanquecinos. Raíz: Órgano y parte esencial de la planta que tiene como funciones principales la de sujetar la planta al suelo, succionar el agua y las sales minerales. Receptáculo: Estructura que soporta las partes de la flor y protege los óvulos. Ritidoma: Es una capa de células de corcho muertas, desde unos milímetros de espesor, hasta unos 50 cm, que se desarrollan al exterior del cambium de corcho. Secreción: Conjunto de sustancias liberadas por las células glandulares. Semilla: Son óvulos maduros de los que nacen nuevas plantas. Sépalo: Es la pieza floral que forma el cáliz de una flor de una planta angiosperma. Los sépalos son los que envuelven a las otras piezas florales en las primeras fases de desarrollo. Súber: Es una sustancia que forma parte de la corteza de los tallos secundarios, donde sustituye a la epidermis. El cambium suberoso produce el súber hacia el exterior. En algunos árboles el súber está muy desarrollado y suele desprenderse con el crecimiento en grosor del tronco. El súber es una de las capas del ritidoma. Suberina: Polímero presente en la pared celular de algunas células de las plantas vasculares. En concreto aparece en la endodermis de las raíces, en la peridermis de tallos y raíces con crecimiento secundario. También aparece en el tejido de cicatrización de heridas, en algunos tejidos que sufren abscisión y en la exodermis de las raíces de angiospermas. La suberina está formada por ácidos grasos de cadena larga unidos por enlaces tipo éster, que a diferencia de la cutina, se depositan en la parte interna de la pared primaria. Es un componente que confiere hidrofobicidad a las paredes celulares y por tanto impide el intercambio de agua y gases entre la planta y el medio exterior. También parece estar implicada en evitar la entrada de patógenos. Tabicación anticlinal: división celular en las plantas en las que el plano de división, aquel que separa a las dos células hijas, es perpendicular a la superficie externa del órgano de la planta, por ejemplo, la superficie de un tallo. Puede ser radial o transversal. La primera es paralela al eje de la 75 planta y la segunda es perpendicular a éste. La división anticlinal transversal favorece el crecimiento en longitud del cuerpo de la planta. Tabicación periclinal: división celular en las plantas en las que el plano de división, aquel que separa a las dos células hijas, es paralelo a la superficie externa del órgano de la planta, por ejemplo, la superficie de un tallo. Permite el crecimiento en grosor del cuerpo de la planta. Tálamo: Parte del eje floral en forma de copa. Tallo: Parte importante de la planta que tiene como finalidad sostener las flores y las hojas a una altura determinada del suelo y transportar la savia desde las raíces a las partes superiores de la planta. Tejido: Del latín texere = tejer. Conjunto de células que tienen características comunes, que cooperan para llevar a cabo una o varias funciones en un órgano y por tanto en un organismo. Yema: es un órgano complejo de las plantas que se forma habitualmente en la axila de las hojas formado por un meristemo apical, (células con capacidad de división), a modo de botón escamoso (catáfilos) que darán lugar a hojas y flores. Xilema: es un tejido de las plantas vasculares especializado en la conducción de agua y sales minerales, aunque también algunas moléculas orgánicas, desde la raíz al resto de la planta. Se denomina también leño y puesto que es el principal componente de la madera. Hay dos tipos de xilema, el primario y el secundario. El xilema primario se origina a partir del procambium y pasa por un estado inicial denominado protoxilema y otro más tardío denominado metaxilema. En las plantas con crecimiento secundario se origina el xilema secundario a partir del meristemo cambium vascular. Está formado por cuatro tipos celulares: dos conductores, traqueidas y elementos de los vasos, y dos no conductores, células parenquimáticas y fibras de esclerénquima. Basado en el diccionario botánico de Font Quer, (1979). 76 BIBLIOGRAFÍA Bibliografía Impresa. Azcárraga R. y P. Jácquez. 2005. Manual de prácticas de Anatomía y Organografía Vegetal. México D. F.: Universidad Nacional Autónoma de México. 239 p. Cornejo M.; G. Garrido y E. Salinas. 2003. Manual de colorantes para laboratorios de ciencias básicas. UNAM, Facultad de Estudios Superiores Cuautitlán. 91 p. Curtis J. 1986. Microtécnica Vegetal. Editorial Trillas. México D. F. 107 p. Esau K. 2006. Anatomía Vegetal. Editorial Omega. Barcelona, España. 614 p. Flores E. 1999. La planta: estructura y función. Cartago, Costa Rica: Asociación de Editoriales. 367 p. Font Quer, P. 1979. Diccionario de Botánica. Editorial Labor. Barcelona. 1244 pp. Gaviño G.; C. Juárez y H. Figueroa. 1975. Técnicas Biológicas Selectas de Laboratorio y de Campo. Editorial Limusa. México, 251 p. Montuenga L.; F. Esteban.; y A. Calvo. 2009. Técnicas en Histología y Biología celular. Editorial Masson. Barcelona, España. 408 p. Olvera C. y J. Ceja. 2006. Manual de anatomía vegetal. México D. F. 113 p. Paniagua,R.; M. Nistal, P. Sesma, M. Alvarez- Uria, B. Fraile, R. Andón, F. S. Sáes, M. P. De Miguel. 2002. Citología e Histología Vegetal y Animal: Biología de las Células y Tejidos. Editoral McGraw-Hill / Interamericana de España, S.A. España. 994 p. Sandoval E. 2005. Técnicas Aplicadas al Estudio de la Anatomía Vegetal. México D. F. Instituto de Biología, Universidad Nacional Autónoma de México. 278 p. Santamarina M., J. Roselló. y F. García. 2009. Atlas de Anatomía Vegetal. Editorial Universidad Politécnica de Valencia. España. 106 p. Strasburger E.; F. Nol, H. Schenck y A. Schimper. 1997. Tratado de Botánica. Editorial Marín. Barcelona, España. 1070 p. 77 Bibliografía Electrónica. Caballero J. (2012). Apuntes para la historia de la docencia Histología en Cuba. Siglos XVII al XX. Revista Electrónica de las Ciencias Médicas en Cienfuegos. 10 (4): p.p. 55-68. Recuperado desde: http://www.redalyc.org/articulo.oa?id=180024356011 Mogollón N. y María G. (1992). Estudios Histológicos de la Formación de Órganos in Vitro de Mussaenda, (Schum y Thonn), “Rosea”. Agronomía Tropical. 42(5-6): p.p. 285-298. Recuperado desde: http://sian.inia.gob.ve/repositorio/revistas_ci/Agronomia%20Tropical/at4256/Arti/m ogollon_n2.htm Olmedilla A., Juan de Dios A. y María I. R. (2010). Identificación Histológica y estructural de Plantas C4 y CAM. En Consejo superior de Investigaciones Científicas, C4 y CAM: Características generales y uso en programas de desarrollo de tierras áridas y semiáridas: (p.p. 107-114). España. Recuperado http://biblioteca.universia.net/html_bura/ficha/params/title/identificaciondesde: histologica-ultraestructural-plantas-c4-cam/id/54477592.html Tamez E. (1999). Manual de Histología Didáctica en la Enseñanza para el nivel superior, tesis de maestría, México: Universidad Autónoma de Nuevo León, citado el 11-02-2014, disponible en internet: http://cdigital.dgb.uanl.mx/te/1020126444/1020126444.PDF Villazón E. (1989). Estudio Histológico de Agallas Inducidas por Artrópodos en Algunas Especies de Compositae. Acta Biológica Colombiana. 1. (5): (p.p. 81-89). Recuperado desde: http://www.revistas.unal.edu.co/index.php/actabiol/article/viewFile/21984/42648 78