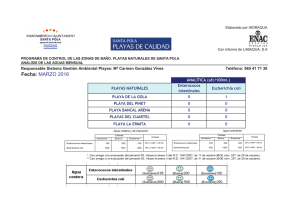
Tesis de Doctorado Tortugas Marinas
Anuncio

CENTRO DE INVESTIGACIONES MARINAS UNIVERSIDAD DE LA HABANA Estrategia reproductiva de la tortuga verde, Chelonia mydas, (Testudines, Cheloniidae) y su impacto en la estructura genética de áreas de anidación del occidente del archipiélago cubano Tesis presentada en opción al grado científico de Doctor en Ciencias Biológicas. Autora: M.C. Julia Azanza Ricardo Tutores: Dra. Georgina Espinosa López (Fac. Biología) Dra. María Elena Ibarra Martín (CIM) Dr. Ken Oyama Nakagawa (CIECO, UNAM) Asesores: Dr. Gaspar González Sansón (CIM) Dr. F. Alberto Abreu Grobois (ICMYL, UNAM) Dr. Omar Chassin Noria (Univ. Michoacana) La Habana 2009 CENTRO DE INVESTIGACIONES MARINAS UNIVERSIDAD DE LA HABANA Estrategia reproductiva de la tortuga verde, Chelonia mydas, (Testudines, Cheloniidae) y su impacto en la estructura genética de áreas de anidación del occidente del archipiélago cubano Tesis presentada en opción al grado científico de Doctor en Ciencias Biológicas. Autora: M.C. Julia Azanza Ricardo Tutores: Dra. Georgina Espinosa López (Fac. Biología) Dra. María Elena Ibarra Martín (CIM) Dr. Ken Oyama Nakagawa (CIECO, UNAM) Asesores: Dr. Gaspar González Sansón (CIM) Dr. F. Alberto Abreu Grobois (ICMYL, UNAM) Dr. Omar Chassin Noria (Univ. Michoacana) La Habana 2009 Registro de la Propiedad Intelectual No. 462-2009 A mi mayor tesoro: mi familia AGRADECIMIENTOS A la Dra. María Elena Ibarra, mi guía y fuente de inspiración, por plantar en mí la semilla de la conservación de las tortugas marinas. A la Dra. Georgina Espinosa, mi tutora por tantos años, por enseñarme y mantener mi interés en el maravilloso mundo de la genética. Al Dr. Gaspar González, por prender la chispa, por su sabiduría y valiosa contribución al desarrollo de esta tesis y a Consuelo, siempre estimulando mi trabajo. A los 1585 participantes en el Proyecto Universitario para el estudio y conservación de las tortugas marinas en Cuba, muchas gracias por su esfuerzo, por soportar tantas noches de jejenes para poder reunir 11 años de valiosa información. A los doctores Ken Oyama Nakagawa, Alberto Abreu Grobois y Omar Chassin Noria, por asesorarme y abrirme las puertas de sus laboratorios y de su conocimiento. A los doctores Vicente Berovides y Dennis Dennis, por el tiempo dedicado a revisar exhaustivamente este extenso documento y por sus valiosas correcciones. Al consejo científico del CIM, particularmente a los doctores Erik García y Aymée Robainas, por sus sugerencias para el perfeccionamiento del documento de tesis. A Fernando Bretos, David Guggenheim, Karen Eckert y Marydelle Donelly, por apoyar las investigaciones del Proyecto Universitario a lo largo de estos años. Al Programa de Doctorado UNAM-UH y a la TWAS por su apoyo financiero para las estancias de investigación que realicé en México. A mi madre, que siempre le da a mis trabajos un toque personal, por su eterna preocupación por los despistes de su hija, por su amor, por su educación, por estar siempre presente. A mi hermana, por todo lo que tiene que sufrir conmigo, por su paciencia y su cariño. A mi padre, que siempre está listo para correr cuando lo necesito, gracias también por su paciencia y por todo su apoyo. A Luis Omar, Paparry, por su compañía y apoyo durante estos tres años, especialmente durante el fatigante trabajo de campo. A Victor, Doña Lolis, Ingrid y María de los Ángeles por su apoyo invaluable durante las largas horas de trabajo en el laboratorio. Al doctor Mario Oliva, por su preocupación y horas dedicadas a hacer posible mi estancia en México. Al Doctor Félix Moncada, Erick Escobar y Gonzalo Nodarse por encaminarme en el estudio de las tortugas marinas. A Gonzalo Nodarse, Yosvani Medina, Ariel Ruiz, Niurka y Damir Hernández por la colecta de parte de las muestras analizadas en esta tesis. A Yeleine, Ríos, César, Dámaso y Laimy, mis dedicados estudiantes, que aportaron tanto a los resultados que se presentan hoy. A Daylín, Iván, Yarelys y Yosvani, que en su momento también contribuyeron al estudio de las tortugas marinas de Guanahacabibes. A René y a Ramiro por su contribución material para poder imprimir y encuadernar la tesis. A Sergio Romero, por su amistad y por su ayuda con la tesis. A Yamilé, Patricia y Tanita, por sus consejos y su amistad. A Yuriem, Melba y Elaine, por sus sonrisas. Al resto de mi familia por su preocupación constante sobre mis avances (Naty, Tere, Tulio, abuela Ñeñe, mis tíos Ada, Roberto y Blanquita y mis primos Yami y Reinier). A los que alumbraron mi camino. A los que me han ayudado de una forma o de otra a culminar este trabajo. A todos, Muchas gracias de corazón INDICE pág. INTRODUCCIÓN ..................................................................................................................... 1 1. REVISIÓN BIBLIOGRÁFICA. .............................................................................................. 6 1.1. Clasificación taxonómica .................................................................................................... 6 1.2. Descripción de la especie ................................................................................................... 6 1.3. Distribución, estado de conservación y peligros actuales. ................................................... 6 1.4. Estrategia reproductiva. ...................................................................................................... 8 1.4.1. Ciclos de reproducción ................................................................................................... 8 1.4.2. Migración......................................................................................................................... 9 1.4.3. Emergencias .................................................................................................................10 1.4.4. Rendimiento reproductivo ..............................................................................................11 1.4.5. Etología de la anidación ................................................................................................11 1.5. Marcación ........................................................................................................................ 14 1.6. Factores que influyen en el éxito reproductivo de tortugas marinas. .................................. 14 1.6.1. Características de las playas de anidación..................................................................... 15 1.6.2. Mareas ..........................................................................................................................16 1.6.3. La Luna .........................................................................................................................17 1.6.4. Ciclones .......................................................................................................................18 1.6.5. Temperatura .................................................................................................................19 1.6.6. Humedad.......................................................................................................................20 1.6.7. Precipitaciones ..............................................................................................................21 1.7. Marcadores genéticos en estudios poblacionales. ............................................................ 21 1.7.1. El ADN mitocondrial. Usos y limitaciones .......................................................................22 1.7.2. Uso de loci microsatélites ..............................................................................................24 1.8. Definición de las unidades para el manejo ........................................................................28 2. MATERIALES Y MÉTODOS. ..............................................................................................30 2.1. Área de estudio. ............................................................................................................... 30 2.2. Obtención de datos ecológicos. ........................................................................................ 31 2.2.1. Caracterización morfométrica de las hembras................................................................32 2.2.2. Conducta y éxito reproductivo........................................................................................32 2.2.3. Factores abióticos .........................................................................................................33 2.3. Análisis de los datos ecológicos. ...................................................................................... 34 2.4. Obtención del material biológico para los estudios genéticos. ........................................... 35 2.5. Procesamiento de las muestras. ....................................................................................... 36 2.5.1. Extracción del ADN total ................................................................................................36 2.5.2. Amplificación del ADN mediante la técnica del P.C.R ....................................................37 2.6. Detección de la presencia de ADN total, productos de P.C.R. y sus alelos........................ 38 2.6.1. Electroforesis en geles de agarosa ................................................................................38 2.6.2. Secuenciación y alineamiento del ADNmt ......................................................................39 2.6.3. Secuenciación y determinación de los alelos en loci microsatélite ..................................39 2.7. Análisis de los datos genéticos ........................................................................................ 39 2.7.1. Diversidad genética .......................................................................................................39 2.7.2. Equilibrio de Hardy-Weinberg y desequilibrio de ligamiento ...........................................39 2.7.3. Diferenciación y flujo génico ..........................................................................................40 2.7.4. Neutralidad ....................................................................................................................41 2.7.5. Tamaño poblacional ......................................................................................................41 3. RESULTADOS ...................................................................................................................43 3.1. Estrategia reproductiva de C. mydas y factores que la afectan.......................................... 43 3.1.1. Influencia del ambiente en la selección del sitio de anidación......................................... 43 3.1.2. Efecto de los eventos meteorológicos en la anidación.................................................... 49 3.2. Estacionalidad de las anidaciones ....................................................................................53 3.2.1. Anual .............................................................................................................................53 3.2.2. Durante la temporada reproductiva ................................................................................55 3.2.3. Durante la noche ...........................................................................................................60 3.3. Características de las hembras anidadadoras. .................................................................. 62 3.4. Fidelidad de la anidación. ................................................................................................. 66 3.5. Características genéticas de las poblaciones. ................................................................... 68 3.6. Diferenciación genética. ................................................................................................... 72 3.7. Tamaño efectivo de las poblaciones. ................................................................................ 76 4. DISCUSIÓN ........................................................................................................................77 4.1. Selección de las playas de anidación................................................................................ 77 4.2. Estacionalidad. ................................................................................................................. 82 4.3. Características de las hembras anidadoras. ..................................................................... 86 4.4. Consecuencias de la filopatría y fidelidad al sitio de anidación en la estructuración genética de las poblaciones. ................................................................................................................. 90 4.5. Tamaño efectivo de las poblaciones. ................................................................................ 97 4.6. Definición de las unidades de conservación. ..................................................................... 98 5. CONCLUSIONES .............................................................................................................100 6. RECOMENDACIONES .....................................................................................................102 REFERENCIAS BIBLIOGRÁFICAS .....................................................................................103 ANEXOS...............................................................................................................................122 AUTOBIOGRAFÍA.................................................................................................................132 SÍNTESIS La tortuga verde (C. mydas) se caracteriza por una elevada fidelidad al sitio de anidación. Si los factores ambientales influyen en la estrategia reproductiva de las hembras de C. mydas su efecto determinará la existencia de diferencias genéticas entre áreas de anidación a escala microgeográfica y el tamaño de las colonias de anidación. Por este motivo en el presente trabajo se determina el impacto de factores ambientales en la estrategia reproductiva de las hembras de C. mydas que anidan en el suroccidente de Cuba y determinar la estructura genética y tamaño efectivo de las colonias de anidación para definir unidades de manejo adecuadas para la región. Los resultados obtenidos demuestran que las playas con mayores niveles de anidación fueron las de grano grueso, alta energía, con una pendiente cercana a los 6o, con presencia de una línea de vegetación secundaria de Trinax radiata y que no presentan barrera de arrecifes que limiten el acceso de las hembras. La temporada de reproductiva de las hembras de C. mydas que anidan en Guanahacabibes está determinada por una temperatura atmosférica óptima entre 27,5 y 28,5oC. La temperatura también ha determinado una mayor producción de hembras en los nidos. Las salidas de las hembras a las playas se produce principalmente en presencia de la luna y aprovechando el efecto transportador del llenante de la marea. Los ciclones afectan considerablemente la supervivencia de los nidos y, por ende, la producción de crías de C. mydas y la estrategia reproductiva de las hembras anidadoras al alterar las características de las playas. El ciclo reproductivo de las tortugas verdes está relacionado con la frecuencia de remigración de las hembras, sin embargo, los intervalos de remigración varían en función del ambiente y la capacidad reproductiva de la hembra más que por su genotipo por lo cual no se observan diferencias genéticas a lo largo de los años analizados. Las diferencias detectadas entre años la composición de marcas físicas es el resultado del reclutamiento de nuevas hembras y el efecto de la remigración. Las áreas de anidación de Guanahacabibes se diferencian en su composición de marcas físicas. Desde el punto de vista genético también se detecta esta diferenciación dentro de Guanahacabibes y, a mayor escala, entre las colonias de anidación del suroccidente de Cuba. La distribución geográfica particular de las colonias de anidación del suroccidente de Cuba en función de los patrones de corrientes y su accesibilidad, unida a las características de las playas, contribuyen a esta diferenciación y el elevado endemismo haplotípico encontrado. Las estimaciones del tamaño efectivo de las poblaciones mediante los marcadores moleculares, al igual que los censos, indican tamaños poblacionales pequeños, con la excepción de Cayo Largo, lo cual se ajusta a lo esperado en poblaciones que han sufrido una contracción crítica de su tamaño histórico comprobado con los dos marcadores moleculares. No obstante, las actuales tendencias de la anidación, al menos en Guanahacabibes, indican una gradual recuperación de las poblaciones. 1 INTRODUCCIÓN A pesar de su comportamiento migratorio y las potencialidades para la mezcla de poblaciones, la tortuga verde (C. mydas) muestra elevados niveles de separación genética a nivel del ADNmt en un conglomerado de sitios de anidación. Dos características significativas de su ciclo de vida contribuyen a ello: la fidelidad al sitio de anidación y la filopatría. La combinación de estos rasgos da lugar a la localización del mismo agregado genético de hembras de una generación a la siguiente (Reece et al., 2005). La identificación de unidades de manejo es fundamental para entender la dinámica de crecimiento poblacional, la dinámica poblacional y los cambios microevolutivos. Sin embargo, su identificación implica grandes retos. Los agregados reproductivos de tortugas marinas suelen agrupar varias colonias dentro de una región mientras que las áreas de alimentación y desarrollo comprenden mezclas de tortugas de diferentes agregados genéticamente diferentes (Chaloupka y Musick, 1997). Ahora es posible distinguir unidades de manejo en los hábitat de reproducción, forrajeo y desarrollo usando programas de marcación-recaptura que combinen marcadores genéticos específicos para cada agregado con la marcación física de los individuos (Velez et al., 2008; Bolker et al., 2007; Bass et al., 2006; Moncada et al., 2006). En algunas instancias aún la marcación de unas pocas tortugas, particularmente en playas de anidación donde nunca se han realizado, puede proporcionar conocimiento valioso sobre las migraciones, localización de zonas de alimentación y tamaño poblacional (Balaz, 2000). No obstante, los programas de manejo para especies amenazadas y para poblaciones ecológica o comercialmente importantes deberían incluir el seguimiento genético (por ejemplo el seguimiento del tamaño efectivo y los cambios genéticos). El seguimiento genético es necesario debido a que los “cuellos de botella” en las poblaciones pueden ocurrir sin ser detectados por el enfoque de seguimiento demográfico tradicional, tal como el de capturarecaptura (Allendorf y Luikart, 2007). El tamaño efectivo de la población también incide en la estructura poblacional. En todos los modelos evolutivos considerados hasta el momento, el tamaño efectivo de la población se considera constante, sin embargo, en las poblaciones naturales este tamaño varía. De hecho, es importante la detección de los llamados “cuellos de botella” en poblaciones de especies amenazadas porque estos pueden conducir a la extinción de la población (Luikart et al., 1998). INTRODUCCIÓN 2 La biodiversidad marina puede verse desde una perspectiva genética al enfocarse en la distribución de las variantes genéticas encontradas a nivel de población. La distribución de los linajes genéticos resultan de la combinación de la conducta de migración y la dispersión, historia del paisaje y flujo genético. Varios estudios de esta naturaleza en tortugas marinas han provisto nuevos enfoques en la conducta migratoria, instintos de fidelidad al lugar de nacimiento y fronteras de las poblaciones con las implicaciones resultantes en el manejo (FitzSimmons et al., 2008). Por su extensión dentro de la región del Caribe, el archipiélago cubano contiene una gran variedad de hábitats para la reproducción y la alimentación de diferentes especies de tortugas marinas (Moncada y Nodarse, 1983), entre ellas C. mydas, la tortuga verde. No obstante, poco se ha publicado en la literatura internacional acerca de las poblaciones cubanas de esta especie. En esta región se manifiesta un intercambio o superposición entre diferentes poblaciones pertenecientes a Centroamérica y el Gran Caribe, tanto en subadultos como en adultos. Específicamente se observan tres comportamientos: 1. Las que se alimentan en la plataforma y posteriormente migran para efectuar la anidación en otras regiones; 2. Las que migran de la plataforma para alimentarse en otras zonas y 3. Las que vienen de otras zonas a anidar en la plataforma cubana (Moncada, 1998). Reportes anteriores afirman que en la costa sur del archipiélago de Cuba se concentra la mayor parte de la anidación de C. mydas y que constituye la más importante de Las Antillas (Cardona y de la Rúa, 1972). Posteriormente, Moncada y Nodarse (1983) señalan sitios de la costa sur como: Cayo Largo del Sur; Playa Larga y Rincón Francés en la Isla de la Juventud; Cabo Corrientes, Cachiboca, Cayo Grande, Cinco Balas y Cayo Caguama en los Jardines de la Reina. La unidad geográfica que constituye la plataforma sur del archipiélago cubano, con extensas praderas de pastos marinos que se consideran la fuente principal de alimento para la tortuga verde, hace preguntarse sobre las conexiones que pueden existir entre las colonias de anidación de esta especie que existen en el área. ¿Es esta región una unidad de manejo, o debe tratarse cada colonia de manera diferencial en el manejo de la especie? Por otra parte es importante conocer el comportamiento reproductivo de las colonias cubanas y los factores que lo afectan para poder adecuar el manejo de la especie en función de sus características. En particular, la Península de Guanahacabibes (de la provincia de Pinar del Río) declarada en 1987 por la UNESCO como Reserva de la Biosfera (Herrera, 2001) y que en febrero del INTRODUCCIÓN 3 año 2001 adquiere la categoría de Parque Nacional Marino-Costero dentro del Sistema Nacional de Áreas Protegidas (por Decreto-Ley del Consejo de Estado), constituye un área de interés para cualquier estudio de conservación. Localizada en la región occidental del archipiélago cubano y con un total de 1,015 km2, presenta una gran diversidad en su flora y fauna, incluidas las tortugas marinas que anidan en sus playas. En esta región, desde 1998, el Centro de Investigaciones Marinas y la Facultad de Biología de la Universidad de La Habana desarrollan el Proyecto Universitario de Estudio y Conservación de las Tortugas Marinas en Cuba. Con este Proyecto se han recopilado datos acerca de la ecología de C. mydas, la principal especie anidadora en la zona (Ibarra et al., 1999, 2000 y 2002), además de los primeros estudios genéticos de la especie C. mydas realizados en nuestro país (Espinosa et al., 1999). El seguimiento intensivo realizado en esta región en particular ofrece las herramientas necesarias para caracterizar desde el punto de vista ecológico y genético una colonia de anidación. ¿Qué características determinan la preferencia de las tortugas verdes por un área en particular?, ¿cuál es la variación en la anidación a lo largo del tiempo?, ¿cuál es la conducta de la hembra durante la temporada de anidación?, ¿cuál es el grado de fidelidad a un sitio en particular de anidación? Estas, entre otras interrogantes, pueden responderse mediante estudios de esta naturaleza. A partir de las inquietudes que aún existen acerca de la biología reproductiva de una especie amenazada como la tortuga verde, sobre todo por el valor que tienen para su conservación las colonias de anidación del suroccidente cubano en cuanto a su diversidad genética y tamaño efectivo, se proponen la siguiente hipótesis y objetivos de trabajo. HIPÓTESIS La estrategia reproductiva de las hembras de Chelonia mydas que anidan en el suroccidente de Cuba, influida por las características particulares del ambiente físico y biótico, determina el tamaño de las colonias y la existencia de diferencias genéticas entre áreas de anidación a escala microgeográfica. Objetivo general: Determinar la influencia de factores ambientales en la estrategia reproductiva de las hembras de C. mydas que anidan en el suroccidente de Cuba y su impacto en la estructura genética y tamaño efectivo de las colonias de anidación. INTRODUCCIÓN 4 Objetivos específicos: 1.-Determinar la influencia de factores bióticos y abióticos en la estrategia reproductiva de las hembras de C. mydas que anidan en el suroccidente de Cuba. 2.-Analizar las variaciones espaciales y temporales en la estrategia reproductiva de C. mydas y evaluar su efecto en la estructura genética de las principales colonias del suroccidente de Cuba. 3.-Evaluar el grado de filopatría y fidelidad al sitio de anidación a diferentes escalas geográficas dentro del suroccidente de Cuba y su efecto en los niveles de diferenciación genética. 4.-Estimar el tamaño efectivo en las principales colonias de anidación de C. mydas del suroccidente de Cuba. Novedad científica: − Por primera vez para el área de Guanahacabibes se relaciona el efecto de factores bióticos y abióticos en la anidación y éxito reproductivo de tortugas marinas y se asocian las características geomorfológicas de las playas con los niveles de anidación. − Por primera vez para la Ciencia se determina el impacto de ciclones en la selección y fidelidad al sitio de anidación de C. mydas. − Por primera vez para la Ciencia se determina en C. mydas la fidelidad al sitio de anidación dentro de una misma playa y se prueba una diferenciación genética entre colonias a escala microgeográfica (menos de 30 km) con ADNmt y microsatélites. − Por primera vez para la Ciencia se caracteriza la estructura poblacional de colonias de anidación cubanas de C. mydas a partir de un fragmento de 746pb de la región no codificadora del ADNmt y empleando nueve marcadores microsatélites, de ellos OR1, OR2, OR3 y OR8 son utilizados por primera vez para estudios poblacionales en esta especie. Importancia teórica: - Se caracteriza la estrategia reproductiva de C. mydas en la región occidental de Cuba y la influencia de factores bióticos y abióticos en ella. - Se demuestra, a escala microgeográfica, la existencia de diferencias genéticas entre las poblaciones de anidación del suroccidente de Cuba, que, unidas a la distribución de las INTRODUCCIÓN 5 hembras marcadas, prueban los elevados niveles de filopatría y fidelidad al sitio de anidación de las hembras de C. mydas. - Se aporta información sobre la complejidad de los ciclos reproductivos de C. mydas a partir de la comparación del comportamiento temporal de la anidación y la remigración con el análisis genético temporal. Importancia práctica: − La valoración de los niveles de anidación y el éxito reproductivo de las playas de la Península de Guanahacabibes contribuyen a evaluar el estado de conservación de la especie C. mydas. − La caracterización de la conducta de anidación y su respuesta ante los cambios del ambiente ayudarán a dirigir los esfuerzos de conservación hacia el logro de las mejores condiciones para el éxito reproductivo de la especie. − Las unidades geográficas que conforman las principales colonias de anidación de C. mydas del archipiélago cubano, definidas a partir de la marcación física y molecular, constituyen una información clave para definir las unidades de manejo dentro y fuera del archipiélago cubano. Los resultados presentados en esta tesis forman parte de cinco artículos científicos publicados en revistas arbitradas (Revista de Investigaciones Marinas (2006 y 2003), Marine Turtle Newsletter, (2002) Revista Cubana de Química (2004), un capítulo del libro “Investigaciones Interdisciplinarias y Manejo de Áreas Costeras en el Gran Caribe” (2002) y 11 Informes de Trabajo del “Proyecto Universitario para el estudio y conservación de las tortugas marinas en Cuba. También han sido presentados en 25 eventos científicos y una parte han sido premiados en dos ocasiones como el Premio de la Universidad de La Habana al resultado científico que más ha contribuido a la Conservación del Medio Ambiente en Cuba (2005 y 2000). Este documento está conformado por 102 páginas, distribuidas en introducción, revisión bibliográfica, materiales y métodos, resultados, discusión, conclusiones y recomendaciones. El documento consta además de los acápites índice, síntesis, referencias bibliográficas (322) y anexos. 6 1. REVISIÓN BIBLIOGRÁFICA. 1.1. Clasificación taxonómica. Si bien en épocas pretéritas las tortugas marinas fueron muy abundantes y diversas, representadas por un gran número de géneros (Márquez, 1996), en la actualidad permanecen sólo siete especies agrupadas en seis géneros y dos familias. Las especies modernas de tortugas marinas forman un grupo monofilético del suborden Cryptodira. (Eckert, et al., 2000). A continuación se muestra la ubicación taxonómica de la especie. Phylum Vertebrata Clase Reptilia Subclase Anapsida Orden Testudinata Familia Cheloniidae Tribu Chelonini Especie C. mydas (Linnaeus, 1758) Subespecie C. mydas mydas (Márquez, 1990) 1.2. Descripción de la especie. Como otros quelonios, C. mydas presenta adaptaciones para la vida en un medio acuático. Posee un caparazón aplanado de color variable, que está cubierto por placas óseas cuneiformes. Las partes que conforman las extremidades se encuentran fusionadas en forma de aletas. Las delanteras la utilizan para impulsarse, mientras las traseras le sirven como timón y para maniobrar dentro del agua. Ello le permite mantener velocidades de 30 y 40 km/h en distancias limitadas (Limpus et al., 1992). Posee una glándula lacrimal de sal encargada del mantenimiento del balance iónico-acuífero (Marshall y Cooper, 1988). El tamaño y la forma del cuerpo tienen implicaciones fisiológicas, evolutivas y ecológicas para las tortugas marinas. Van Buskirk y Crowder (1994), y Van Dam y Diez (1998) plantean que las medidas corporales de la tortuga están correlacionadas con muchos aspectos reproductivos y con otras propiedades como la temperatura del cuerpo, el rango metabólico, la pérdida de agua por evaporación y otras. 1.3. Distribución, estado de conservación y peligros actuales. C. mydas es una especie de distribución circunglobal, que puede encontrarse en todos los mares tropicales y en menor grado en aguas subtropicales, en las plataformas continentales y cerca de las islas. Es rara en aguas templadas (Pritchard y Montimer, 1999). Sus límites geográficos quedan dentro de la isoterma de 20°C y sus cambios de REVISIÓN BIBLIOGRÁFICA 7 distribución (migraciones) respetan esta frontera durante las diferentes estaciones del año (Márquez, 1996) aunque, según Hirth (1997) y Pritchard (1996), ha sido vista entre los 40° Latitud Norte y los 40° Latitud Sur. En cuanto a Cuba, se considera que en la costa sur del archipiélago se concentra la mayor parte de la anidación de C. mydas y a su vez que constituye la más importante de Las Antillas (Moncada et al., 1987). En los Canarreos se destacan zonas como: Cayo Largo del Sur; Playa Larga y Rincón Francés en la Isla de la Juventud mientras que se menciona Cabo Corrientes, Cachiboca, Cayo Grande, Cinco Balas y Cayo Caguama en los Jardines de la Reina (Moncada y Nodarse, 1998; Nodarse et al., 2000). Ibarra et al. (2000 y 2004) resaltan la importancia de la Península de Guanahacabibes como área de anidación. La población anidadora de Cayo Largo del Sur se considera la más importante del país (Nodarse et al., 2004). La distribución de esta especie en las áreas de anidación se caracteriza, en general, por un nivel alto de estructuración lo que hace pensar en una tendencia a la filopatría (Encalada et al., 1996). Las hipótesis de la filopatría y facilitación social son difíciles de probar directamente ante la imposibilidad de marcar a los neonatos de modo que se pueda recuperar con eficiencia la marca en el estado adulto. La filopatría, sin embargo, genera una predicción que puede probarse genéticamente a partir de la estructuración en áreas de anidación. Si las hembras regresan fielmente a su colonia de origen, cada población de anidación poseerá una identidad genética en términos del ADNmt (Bowen y Karl, 2007). Como consecuencia de este mecanismo el proceso de colonización ha sido lento. Solo porque este mecanismo no es infalible, debido a cambios en los elementos reconocibles que indican el sitio de anidación, ha sido posible la colonización de otras playas, la dispersión y el intercambio genético en la especie. Mediante el estudio de 350 sitios arqueológicos y fuentes históricas en el Caribe, han sido identificados 62 sitios de anidación de tortuga verde en los últimos 8000 años. La abundancia estimada para la especie en aquella época es de 120 millones de tortugas, de modo que si la abundancia real constituyó el 10 % de esta cifra, las poblaciones actuales del Caribe estarían severamente reducidas (McClenachan, 2007). Otros estudios sobre los registros de explotación iniciales, procedentes de la etapa colonial, indican que la población de tortuga verde en el Caribe antes de comenzar su explotación oscilaba entre 33 y 39 millones de tortugas (Jackson, 1997), por tanto, las poblaciones actuales de tortuga verde representan del 3 al 7 % de estos estimados (Jackson et al., 2001). Más aún si se REVISIÓN BIBLIOGRÁFICA 8 considera que las poblaciones de tortuga verde en el Caribe se encontraban limitadas fundamentalmente por la capacidad de carga de las praderas de Thalassia testudinum (su principal alimento), entonces los estimados serían del orden de 16 a 186 millones de tortugas verdes con 50 kg de peso como promedio. A pesar de la gran cantidad de colonias anidadoras que se han identificado (Márquez, 1996), esta especie se encuentra en la Lista Roja de la IUCN desde hace varios años (Groombridge y Luxmoore, 1989) en la cual mantiene el estatus de especie en peligro de extinción globalmente, con la población del mar Mediterráneo en extremo peligro de extinción. Seminoff (2002) determinó mediante extrapolaciones matemáticas que en tres generaciones (141 años) se habría perdido del 37 al 61 % de cada generación según el modelo matemático escogido. Estos reptiles, que han sobrevivido durante millones de años, enfrentan la amenaza de la extinción principalmente por el mayor agente transformador del ambiente: el hombre. Según Seminoff (2002), las principales acciones depredadoras por parte del hombre son: la recogida de huevos frescos y la matanza de hembras reproductoras en las playas de anidación, unidas a la pesca de juveniles y adultos en zonas de alimentación. El autor afirma que la sobreexplotación de este recurso natural ha sido la causa principal de que en algunos lugares lleguen a cero las poblaciones de tortugas verdes. Sin embargo, también señala que la lenta maduración de la C. mydas no ha permitido ver en su total magnitud los efectos de la depredación de los huevos. Mientras las hembras adultas prosiguen la ovoposición en esas playas, disminuye el número de juveniles que son reclutados para la sustitución de estas hembras, por lo que a largo plazo, es que se observará una disminución en el número de hembras anidadoras. 1.4. Estrategia reproductiva. 1.4.1. Ciclos de reproducción. Los ciclos reproductivos generalmente se refieren a una serie de eventos anatómicos y fisiológicos que conducen a la producción de gametos masculinos y femeninos, la fertilización y la producción de neonatos (Hamann, 2002). De modo similar a otros ectotermos, las tortugas marinas son reproductores estacionales aunque, en algunas poblaciones, ocurre durante todo el año (Hirth, 1997). Algunas especies como la tortuga verde muestran una marcada periodicidad que está en función de la variación ambiental y los intervalos de remigración (Hays 2000, Chaloupka 2001). El ciclo de reproducción de la REVISIÓN BIBLIOGRÁFICA 9 tortuga verde puede ser bienal o trienal. En la isla de Gran Caimán se ha observado que las hembras maduras de esta especie en cautiverio tienen un ciclo cercano a 1,6 años (Márquez, 1996), aunque para las de vida libre se refiere un ciclo de 2,3 años. Miller (1997) determina como el período más corto para tortuga verde el de dos años. Limpus y Nicholls (2000) plantean que la corriente oceánica El Niño pudiera determinar la variabilidad en cuanto al número de anidaciones que ocurren entre las distintas temporadas de reproducción, al afectar probablemente la calidad del alimento. El período de días entre una anidación y otra es diferente entre las poblaciones, aunque según la revisión realizada por Miller (1997) la media es de 12 días. Algunos de los intervalos registrados son: 13,9 días (SD = 2,4 días) para la isla Ascensión (Mortimer y Carr, 1987) y 14,9 días (SD = 2.2 días) en la isla Wan-an, Taiwán (Chen y Cheng, 1995), 15 días en Galápagos (Green, 1993). Particularmente en el Caribe está el caso de Costa Rica, donde la mayor frecuencia de hembras anida a los 12 días (Bjorndal et al., 1999). Por su parte Mortimer y Carr (1987) y Bjorndal y Carr (1989) plantean que seis días es el menor intervalo de tiempo entre dos anidaciones consecutivas, ya que las nidadas puestas dentro de este período son de forma general nidadas divididas (el intento de anidación anterior fue abortado o interrumpido). Resultados obtenidos entre 1982-1996 en la playa El Guanal, localizada en la costa sur de la Isla de Juventud, registran anidaciones cada 7 a 14 días con intervalo de 9 a 11 días como el de mayor frecuencia (Nodarse et al., 2000). 1.4.2. Migraciones. Cada uno, dos o tres años, las tortugas regresan desde las zonas de alimentación, que pueden estar alejadas de las de anidación varios cientos o miles de kilómetros. La conducta migratoria de las tortugas marinas es bien conocida desde que se comenzó a aplicar la telemetría por satélite. Al dejar el área de anidación, algunas especies nadan hacia áreas de alimentación fijas, generalmente en el ambiente nerítico, donde se quedan durante un tiempo largo, lo que sería el período inter-reproductivo que dura de uno a cuatro años (Balazs et al., 1994; Luschi et al., 1996; Cheng, 2000; Hays et al., 2002). Para muchos animales los desplazamientos a largas distancias son un componente importante en la historia de su vida. Se plantea que las hembras regresan a anidar a la playa en que nacieron, lo cual ha sido demostrado a través de análisis genéticos que se basan en la separación del ADN mitocondrial (Bowen et al., 1989; Meylan et al., 1990; Bowen et al., 1992 y Allard et al., 1994). Para entender cómo pueden reconocer y llegar con exactitud a estas playas se han propuesto dos hipótesis, la de la filopatría (Carr, 1967), que es la más REVISIÓN BIBLIOGRÁFICA 10 aceptada, y la de la facilitación social, introducida por Hendrickson (1958) y retomada por Owens et al., (1982). La primera consiste en que las hembras grávidas se orientan por mecanismos olfatorios, corrientes marinas y por el campo magnético de la Tierra (Lohmann et al., 1996); tratando de reconocer los elementos típicos de su playa, que fueron aprendidos durante la incubación, la eclosión y la trayectoria hacia el mar. La otra hipótesis plantea que las hembras que van a nidificar por primera vez pueden ser guiadas hacia las playas por otras más experimentadas. Si la primeriza posee éxito entonces regresará a esa playa durante las demás temporadas de anidación. Es conocido que las tortugas verdes tienden a regresar a anidar a su primera playa de anidación dentro de una misma temporada (Wang y Cheng, 1999). Casi todas las migraciones que realiza esta especie ocurren a lo largo de las costas, pero algunas poblaciones, por ejemplo aquellas en la Isla de Ascensión, realizan migraciones transoceánicas de más de 2 200 km desde esta isla, donde radica su área de anidación, a las costas de Brasil dónde se localizan las zonas de alimentación (Carr y Hirt, 1962; Carr, 1975). Según Acosta et al. (1987), los desplazamientos que realizan las tortugas hacia sus diferentes destinos sugieren un gasto de energía elevado, además del que presupone la reproducción. Es por ello que estos mismos autores sugieren que los medios de navegación que utilicen deben permitirles el menor gasto de energía posible, lo cual puede suceder si sus desplazamientos se sincronizan con la velocidad y dirección de las corrientes marinas. Al utilizar las corrientes como medios de navegación, su actividad dentro de ellas se reduce. Nadando con la corriente las tortugas aumentarán también la velocidad del viaje, minimizando el gasto enérgetico. Para permanecer dentro de la corriente, las tortugas podrían detectar varias señales que caracterizan las corrientes como por ejemplo la temperatura, la salinidad entre otras (Reverdin y McPhaden, 1986; Schäfer y Krauss 1995). Chen y Cai (2007) encontraron que las tortugas marinas no solamente aprovechan las fuertes corrientes oceánicas en sus migraciones, sino que emplean las corrientes superficiales más débiles para guiar su movimiento hacia la costa. 1.4.3. Emergencias. El número de nidos por tortuga más frecuente es de dos y tres (Carr et al., 1978). En un estudio realizado en la isla Wan-An se encontró que las tortugas realizaban, por término medio, una anidación por cada tres emergencias. Algunas de estas emergencias se REVISIÓN BIBLIOGRÁFICA explicaban como búsquedas infructuosas de los sitios de anidación y otras 11 por el derrumbe de las paredes del nido o presencia de algún obstáculo que impedían el seguimiento de la excavación (Cheng, 2002). Es también posible que la interferencia por humanos u otros animales obstaculicen la excavación y/o la búsqueda de señales térmicas (Mortimer, 1990; Salmon et al., 1996; Witherington y Martin, 1996). Asimismo, se plantea que las hembras anidadoras no siempre ovipositan al subir a la playa, con lo cual aparecen los llamados nidos falsos (Pritchard et al., 1983). Para la isla Wan-An se reporta que cada tortuga salió de 1 a 20 veces y depositó 2 a 5 nidos por estación (Cheng, 2002). 1.4.4. Rendimiento reproductivo. Todas las especies de tortugas marinas comienzan su vida en tierra firme (Wyneken, 1997) y no cuentan con cuidado materno por lo que deben depositar gran cantidad de huevos para contrarrestar la alta tasa de mortalidad de los neonatos y asegurar su supervivencia (Miller, 1997). Las tortugas marinas son medidas en las playas de anidación para relacionar las tallas corporales con el rendimiento reproductivo, el tamaño de la nidada y para determinar el tamaño mínimo de madurez sexual (Bolten, 1999). Hays y Speakman (1993) en la isla Wan-An encontraron que no existe relación entre la longitud del cuerpo y el número de nidos por individuo, aunque Olsson y Shine (1996) afirman lo contrario al decir que las variaciones en cuanto al rendimiento reproductor puede explicarse en parte por el tamaño del cuerpo. Las buenas condiciones del alimento, según Carr y Carr (1970), pudieran determinar una reducción en el intervalo de remigración de tres a dos años, lo que explica las altas anidaciones que ocurren en algunos años, para las tortugas que anidan en Costa Rica. Limpus y Nicols, (1987), Broderick et al., (2001), plantean al resptecto que los números de nidos fluctúan de modo dramático y probablemente están relacionados con las variaciones en la cantidad y calidad del pasto. 1.4.5. Etología de la anidación. La tortuga verde, al igual que los demás especies de tortugas marinas, desarrolla la misma rutina durante la anidación (Pritchard et al., 1983; Márquez, 1996 y Miller, 1997). El comportamiento general durante el desove está compuesto por las siguientes etapas: REVISIÓN BIBLIOGRÁFICA 12 regreso al área donde está su playa natal, emergencia desde la línea de marea, ascenso y selección del sitio de desove, construcción de la cama, excavación de la cámara del nido, oviposición, cubrimiento del nido y la cama, y regreso al mar. a. Selección del sitio de anidación La selección de un sitio bien enmascarado para los depredadores es muy importante para el mantenimiento de las poblaciones si se tiene en cuenta que la depredación es un factor que incide de manera importante en la mortalidad de la descendencia (Congdon et al., 1983; Thompson, 1983; Iverson, 1991; Yerli et al., 1997; Burke et al., 1998; Escalona y Fa, 1998). Las características de la arena influyen en la proporción sexual de los neonatos de cada nido. (Mrosovsky e Yntema, 1980; Mortimer, 1982; Ackerman et al., 1985; Whitemore y Dutton, 1985; Mrosovsky y Provancha, 1989; Mrosovsky, 1994; Ackerman, 1997). La forma y el tamaño, así como el lugar donde son construidos los nidos, condicionan el ambiente de su interior a la vez que mantienen la humedad y temperatura con cierta estabilidad. Así, aunque las condiciones del entorno varíen de forma brusca, en el interior de la cámara de incubación existe un microclima que favorece la incubación de los huevos y el óptimo desarrollo de los embriones (Ackerman, 1997). Los factores que afectan el sitio se presentan a nivel del macrohábitat (Spencer, 2002) y microhábitat (Schwarzkopf y Brooks, 1985, Janzen y Morjan, 2001). La mayoría de los estudios plantean que las anidaciones no ocurren al azar con respecto al microhábitat debido a su efecto sobre el desarrollo (Bilinski et al., 2001), sexo (Janzen y Morjan, 2001) y supervivencia (Wilson 1998, Kolbe y Janzen 2001), aunque también responden a la amenaza directa de la depredación de los nidos localizados cerca de la orilla (Spencer, 2002). La mortalidad de la descendencia aumenta generalmente más cerca de la orilla debido a inundaciones (Milton et al., 1994), depredación de los nidos (Horrocks y Scout, 1991) y los sustratos de anidación inapropiados (Spencer, 2002). De igual forma, si los nidos están más lejos de la orilla el riesgo de depredación al salir las crías aumenta y éstas deben gastar más tiempo en recorrer la distancia hasta llegar al agua (Wood, y Bjorndal, 2000). Los criterios de selección, al parecer, varían de una especie a otra. Por ejemplo, Stoneburner y Richardson (1981) encontraron que la selección del sitio de anidación por las tortugas de la Florida estaba relacionada con el gradiente de temperatura de la arena. En este sentido han sido propuestas varias hipótesis. Algunos autores han sugerido que REVISIÓN BIBLIOGRÁFICA 13 los sitios de anidación se encuentran esparcidos al máximo e incluso se seleccionan al azar (Mrosovsky 1983; Tucker 1990; Hays et al., 1995). Otros han pensado que la topografía de la playa, la pendiente, microhábitats, las piedras sumergidas (Dodd, 1988; Horrock y Scout, 1990; Crain et al., 1995; Hays et al., 1995; Mortimer, 1995), la vegetación de la playa (Horrock y Scout, 1990; Hays y Speakman, 1993; Mortimer, 1995), la contaminación por luz artificial (Mortimer, 1995; Salmon et al., 1996; Witherington y Martin, 1996); las señales de temperatura (Stoneburner y Richardson, 1981), la competición entre especies, (Whitmore y Dutton, 1985), y la perturbación humana (Williams-Walls et al.,1983; Murphy, 1985; Witherington, 1992) pueden influir en la selección del sitio de anidación (selección no al azar). Por otro lado, ha sido defendido que las propiedades estructurales de la arena, como la compresibilidad, y las características de las partículas se tienen en cuenta por la tortuga verde para la selección del sitio de anidación (Mortimer, 1990 y 1995; Foote y Sprinkel, 1994). Se formula también la hipótesis que la vegetación tiene un efecto importante en la conducta de selección del sitio de anidación de la tortuga de la isla Wan An (Cheng, 2000). Por lo general, suben hasta la segunda terraza buscando lugares libres de vegetación (Márquez, 1996; Meylan y Meylan, 1999). Los nidos puestos en la zona cercana a la línea de marea (menos de 3 m) son más susceptibles a ser inundados durante las mareas altas y los fuertes oleajes (Mrosovsky, 1983), con lo cual varían las condiciones ambientales del nido. Tanto el intercambio de gases como la humedad y la temperatura son afectados, con valores fuera de los límites de tolerancia del embrión (Pereira, 2002). Estudios realizados en isla Wan An muestran una dependencia entre el tiempo de búsqueda del sitio de anidación y el tamaño de la playa. En las playas más pequeñas este tiempo se hace menor, mientras que en las más grandes se incrementa al ser mayor la distancia entre la línea de marea alta y la zona de vegetación (Murphy 1985; Witherington y Martin, 1996). b. Oviposición Durante la etapa de puesta la tortuga invierte aproximadamente el mismo tiempo tanto en construir el nido como en terminarlo. La duración de estos eventos abarca la mayor parte del proceso de la anidación. (Pereira, 2002). La tendencia recta de la trayectoria costera de las reproductoras ovipositoras, reportada como frecuente en las poblaciones anidadoras de México (Márquez, 1996), puede estar REVISIÓN BIBLIOGRÁFICA 14 relacionada con la disminución del gasto energético para la optimización del proceso de anidación. Las reproductoras pueden variar la forma de la trayectoria si detectan obstáculos ocasionales (Pritchard et al., 1983), por lo que estas trayectorias serán menos frecuentes que las rectas en playas arenosas lo cual se evidencia en que las longitudes de los tipos de trayectorias (entrada y salida) sean similares (Pereira, 2002). En el tramo costero estudiado de Playa Larga se observó, sobre todo en la playa arenosa de alta energía, que prácticamente todos los intentos de construcción del nido no tuvieron éxito, debido al grosor de la arena y a la poca coherencia de la misma (Nodarse et al., 2000); en tanto que Mortimer (1990) informa que el éxito de anidación es diferente según el tipo de playa, lo cual atribuye a la textura de la arena al exponer que las tortugas pueden excavar más fácilmente los nidos si el tamaño de las partículas de arena es menor. En la isla Wan-An, Cheng (2000) reporta un éxito de anidación del 45 al 100 %. 1.5. Marcación. La marcación es un método muy utilizado en los estudios de tortugas marinas para obtener información sobre la biología reproductiva, movimientos, varamientos y lugares de residencia (Balaz, 1999). Las marcas más usadas en tortugas marinas son hechas de metal o plástico de gran durabilidad. Los trabajos con marcas tradicionales de acero inoxidable y de plástico, y en los últimos tiempos el marcado con radiotransmisores vía satélite, han permitido conocer un poco más sobre el ciclo de vida de las tortugas marinas y en algunos casos corroborar hipótesis sobre la conducta migratoria (Márquez, 1996). En este sentido, diversos trabajos han sido realizados como el Programa Nacional de Tortugas Marinas en México iniciado en 1964 (Márquez, 1996). Otro ejemplo más reciente es el seguimiento vía satélite de los movimientos de hembras post-anidadoras de tortugas en la costa sudoeste de Florida, EE.UU (Addison et al., 2002). En Cuba, el programa de marcación dirigido por el Ministerio de la Industria Pesquera, identificó un total de 742 individuos mediante la marcación física entre 1989 y el 2002 (Moncada et al., 2006), de ellos, más del 70 % en áreas de pesquería tradicional. 1.6. Factores que influyen en el éxito reproductivo en tortugas marinas La supervivencia de la hembra es muy afectada por el tiempo que permanece en la tierra y el éxito reproductivo depende de la aptitud de la descendencia. La aptitud de la REVISIÓN BIBLIOGRÁFICA 15 descendencia depende principalmente de dónde el nido se construye y es afectado el macro y el microhábitat a través de los factores como la depredación del nido y la temperatura de la incubación (Spencer y Thompson, 2003). La vegetación puede afectar el ambiente térmico y, a su vez, este incide en la proporción sexual de la descendencia. 1.6.1. Características de las playas de anidación Aunque han sido diversos los intentos por definir las cualidades de las playas de anidación -pues no es obvio que una población de tortugas marinas o un individuo prefieran una playa en particular- hay pocos resultados en este sentido (Mortimer, 1990). Mortimer (1982) identificó requisitos generales para las playas de anidación: 1. La playa debe ser accesible desde el mar. 2. La playa debe ser lo bastante alta para prevenir la inundación de los huevos por las mareas o las aguas subterráneas. 3. El sustrato debe facilitar la difusión de los gases. 4. El sustrato debe ser lo bastante húmedo y fino para prevenir que la cámara se colapse durante su construcción. Mortimer (1990) examinó las características físicas y químicas de la arena de 50 playas de diferentes áreas de anidación alrededor del mundo y encontró una alta variabilidad en ellas. Ella concluyó que otros factores como la fisonomía de la arena en las playas de anidación son importantes o más importantes en la selección del sitio de anidación. El resultado de la selección de la playa y el sitio de anidación es una buena incubación de los huevos en una salinidad baja, alta humedad, y buena ventilación del sustrato, el cual no debe inundarse durante la incubación (Ackerman, 1980; Miller, 1985; Maloney, 1990). Estudios realizados en diferentes playas del mundo demuestran que las características de las playas de anidación son diferentes en unas y otras e incluso dichas características difieren dentro de la misma playa. Varios autores, como Hendrickson (1982) y Mortimer (1990), han observado que factores como temperatura, humedad y tamaño de grano de la arena, son características importantes para la selección del sitio de anidación así como para el nacimiento de las crías de tortugas marinas. La influencia del tipo de arena, especialmente el tamaño del grano, es una cuestión muy discutida por diversos autores (Mortimer, 1995). Hendrickson (1958) sugiere que en Malasia la textura de la arena puede ser importante para la selección y diferenciación de la playa por las tortugas verdes y las caguamas, pues la playa escogida por las primeras estaba compuesta por arena fina mientras que las caguamas seleccionaban playas de arena gruesa. Otros autores opinan REVISIÓN BIBLIOGRÁFICA 16 que las caguamas anidan con éxito en arenas finas, además de plantear que el tamaño de las partículas es menos importante que la pendiente y la configuración costera de la playa (Carr y Ogren, 1960; Hirth, 1963). De acuerdo con Milton et al. (1994), la arena es una barrera a través de la cual el vapor de agua, el oxígeno y el dióxido de carbono deben pasar por lo que controla y afecta la disipación del calor. La composición granulométrica de la arena es reportada como uno de los principales elementos responsables de la temperatura que afecta a los embriones (IBAMA, 1989; Franco, 2003). El grado de humedad de la arena, que es un prerrequisito muy importante para la construcción del nido y la supervivencia de las crías, varía con las características de la arena, principalmente con el tamaño del grano (Demetropoulos, 2000). La temperatura en la cámara también varía con la profundidad y naturaleza de la arena. Las playas con arenas gruesas tienen temperaturas más altas que las de arenas finas (Demetropoulos, 2000). Las cámaras de los huevos en playas de arenas gruesas son simplemente menos profundas, pero también son más calientes y, en consecuencia, responden a la proporción sexual resultante de ellas, diferente inevitablemente a lo esperado con ese tipo de grano de arena. La implicación de esto es que en una misma área geográfica de la playa se puede hallar una tendencia a producir más machos que hembras. El microclima adecuado para la incubación es generado por la interacción entre las características físicas de la playa, el clima local y los huevos en el nido. El ambiente en el nido es dinámico y cambia con la actividad biológica dentro de él, pero desgraciadamente, se conoce muy poco sobre cómo es afectado por el desarrollo de los huevos durante su incubación y solo se conoce un mínimo de cómo influyen en él las características de la playa. 1.6.2. Mareas Las tortugas marinas emergen a la playa de anidación durante, o justo antes de la marea alta (Frazier, 1985; Chen y Cheng, 1995; Pilcher y Al-Merghani, 2000). Las playas trabajadas en la Península de Guanahacabibes, según Muñoz (2001), se caracterizan por tener una zona sublitoral poco profunda y de fondo rocoso, durante la marea baja, esta zona puede impedir o dificultar la subida de las tortugas a la playa. En el caso de aquellas playas que presenten una barrera arrecifal, durante las mareas altas las tortugas tienen REVISIÓN BIBLIOGRÁFICA 17 más tiempo para completar el proceso de anidación y retornar al mar antes de que puedan encallar en la cresta o en la laguna arrecifal de aguas poco profundas (Pilcher y AlMerghani, 2000). La relación entre la salida de las tortugas ovígeras y la fase de la marea alta también fue planteada por Chen y Cheng (1995). En este caso solo la encontraron en la primera reemergencia de las tortugas a la playa. El mayor tamaño de las tortugas verdes podría hacer más necesario aprovechar el efecto facilitador de las mareas altas para acceder a la playa. En la Isla St. Bangladesh, las tortugas normalmente ascienden a anidar entre las 19:0003:00, de 3-4 horas antes o con la marea alta (Zahirul, 2002). Asimismo, en la playa Ya Lima Po de la Guyana Francesa se ha encontrado relación entre la marea alta y la hora de arribo de tinglados a la playa, lo cual se explica por el efecto transportador de las mareas en ascenso que facilita la llegada de las tortugas a la playa (Fretey y Girondot, 1989). También puede producirse la sobre-elevación meteorológica del nivel del mar, la cual se observa habitualmente durante la ocurrencia de fenómenos meteorológicos extremos que generen vientos y olas de consideración: entiéndase huracanes, frentes fríos y bajas extratropicales. A la sobre-elevación meteorológica del nivel del mar también se le conoce como marea de tormenta o surgencia de tormenta (del inglés storm surge) y se define como la diferencia entre el nivel real del mar durante la ocurrencia de una tormenta y el nivel que debió haber existido en ausencia de ella. En la Península de Guanahacabibes esta sobreelevación puede llegar hasta los 2 m por encima del nivel del mar, cuando la amplitud máxima promedio para la zona es de 0,28 m (Camacho, 2002). 1.6.3. La luna La actividad de las tortugas marinas está muy relacionada con las fases de la luna, tanto por el efecto de ésta en las mareas como por las diferencias en la intensidad de la luz. Las tortugas verdes (C. mydas), los tinglados (Dermochelys coriacea) y otras especies que anidan en forma solitaria o en grupos, se les puede observar anidando todas las noches durante la temporada de anidación, pero las tortugas que anidan en arribadas presentan una mayor actividad durante las lunas de cuarto creciente y cuarto menguante. Cada tortuga anida varias veces durante la temporada y presenta ciclos de re-anidación de diez a quince días, por lo que van a calzar su siguiente salida con el otro cuarto de luna. La actividad cada día va variando según cambia la hora de la marea alta y las horas en que se observa la luz de la luna (Chaves, 1994). REVISIÓN BIBLIOGRÁFICA 18 En los días de cuarto creciente, la luna es brillante en las primeras horas de la noche, en el caso de las playas ubicadas en el Pacífico, la luna brilla en el cuadrante este del cielo o sea detrás de las tortugas, por lo que las afecta menos y es posible que la actividad sea más o menos uniforme durante las horas de la noche con un pico de actividad muy cerca de la marea alta. En los días de cuarto menguante, la luna brilla en el cuarto oeste del cielo, por lo que estará en el frente de las tortugas, en ese caso, las tortugas esperarán para salir a anidar después de que la luna haya subido más de 45 grados en el cielo. Durante estas fases de luna llena y luna nueva, las mareas son las más altas del mes, por lo que la actividad es menor y en el caso de los días de luna llena, la actividad se reduce más debido a que la luna es brillante toda la noche (Chaves, 1994). En el período de luna llena la claridad lunar facilita la orientación de las ovígeras en su arribo al área de anidación, la selección del sitio y la retirada del área. En el período de cuarto menguante a la luna nueva, mengua la cantidad de luz reflejada por lo que disminuye la identificación visual de las presas por los depredadores nocturnos. La claridad lunar estimula la actividad de los depredadores (Pitcher y Al-Marghani, 2000). Pereira (2002) y Muñoz (2001) encontraron una independencia de las salidas de las hembras a anidar con relación a las fases lunares. 1.6.4. Ciclones Los ciclones tropicales son eventos estacionales caracterizados por fuertes vientos, lluvias, mareas de tormentas, que a menudo inundan zonas costeras que normalmente no están expuestas al agua de mar. Esto puede alterar el hábitat severamente, resultando en la inundación localizada y el desplazamiento de grandes cantidades de arena (Shoener et al., 2004; Peterson y Bishop 2005). Los ciclones se incrementan en severidad debido a los cambios climáticos globales (Pike y Stiner, 2007). Estas perturbaciones estacionales se encuentran entre las que se han vuelto más comunes y destructivas (Landsea, 1993, Goldenberg et al., 2001) y esto es más devastador para las poblaciones de especies en peligro cuando coincide con su temporada reproductiva (Schoener et al., 2004). La surgencia de las tormentas reduce de modo significativo el éxito reproductivo al disminuir el número de nidos que eclosionan y el número de neonatos que emergen de los nidos. La temporada de anidación de tortuga verde transcurre completamente dentro de la temporada ciclónica, más aún el 79% de los nidos se encuentran en fase de incubación en el mes de septiembre cuando los ciclones REVISIÓN BIBLIOGRÁFICA 19 ocurren con mayor probabilidad. Según estudios realizados en áreas de anidación de Florida (Pike y Stiner, 2007) el número de ciclones se ha incrementado en la cuenca del Océano Atlántico durante los últimos 150 años, aunque no ha variado su intensidad o duración. 1.6.5. Temperatura Como en otros reptiles, las tortugas verdes pueden alterar su conducta en respuesta a los cambios estacionales en la temperatura, fotoperiodicidad y la disponibilidad de comida; sin embargo, aún no se comprende bien el grado en que se afectan los patrones de inmersión y los niveles de actividad (Southwood et al., 2003). Felger et al. (1976) realizaron observaciones directas de adultos y juveniles de la tortuga verde del Pacífico, la C. mydas agassizii, del Golfo de California y encontraron que estaban letárgicos y no respondían a la manipulación durante los meses invernales. Estudios dirigidos a juveniles de tortuga verde en una laguna en Florida mostraron que ellos permanecían activos todo el año y que aumentaban las distancias viajadas por día durante el invierno (Mendonca, 1983). Este mismo autor sugirió que el aumento en los movimientos diarios por las tortugas verdes durante el invierno podría representar un esfuerzo por dejar la laguna y buscar temperaturas más calurosas o, alternativamente, el incremento en la producción de calor metabólico producto de una mayor actividad física podría permitirles elevar su temperatura corporal respecto a la temperatura ambiente del agua. Por otro lado, una de las preocupaciones más crecientes de la comunidad científica, en general, lo constituyen los efectos directos e indirectos del recalentamiento global, lo que estima un aumento en el nivel medio del mar sobre territorios insulares y continentales. Este aumento en el nivel del mar afectará las playas de anidación, al restringir esa actividad en muchas playas del mundo (Miller, 1997). De igual manera, los efectos de El Niño, -conjunto de fenómenos relacionados con fluctuaciones de lluvias, temperatura y presión atmosférica en los océanos Pacífico, Atlántico e Índico- afectan los comportamientos asociados con la reproducción como por ejemplo el número de hembras que migran hacia zonas de reproducción (Limpus y Nicholls, 1987). En varias poblaciones se han descrito factores específicos que modifican las temperaturas del nido y las proporciones del sexo de las tortugas marinas. Entre estos se incluyen: la variación latitudinal, el cambio de la temperatura estacional, la sombra de la vegetación, el color de la arena, los eventos estocásticos como la lluvia, profundidad de los huevos REVISIÓN BIBLIOGRÁFICA 20 (Morreale et al., 1982, Mrosovsky et al., 1984, Mrosovsky, 1988, Hays et al., 1999), la playa, la distancia con respecto a la marea alta, entre otros (Kelez, 2003). Asimismo, las temperaturas también varían dentro de un mismo nido, ya que los huevos de la parte superior experimentarán temperaturas mayores comparados a los huevos de la parte inferior (Kelez, 2003). La forma y el tamaño, así como el lugar donde son construidos los nidos, condicionan el ambiente de su interior manteniendo la humedad y temperatura dentro de cierta estabilidad; así, mientras en la superficie de la arena cada día se presentan amplias variaciones que van desde 26ºC hasta más de 45ºC bajo la superficie, a la profundidad de los nidos (entre 30 y 60 cm), estas variaciones se reducen de 6 a 8ºC, generalmente entre los extremos de 27 y 36ºC. Aunque las oscilaciones son tan amplias en el entorno, en el interior de la cámara de incubación los cambios térmicos son mínimos, pues unas cuantas horas después del desove la temperatura dentro de la masa de huevos se estabiliza y generalmente se mantiene entre 1 y 2ºC por encima de la temperatura media ambiental. Durante todo el periodo de incubación las variaciones diarias en el interior del nido son del orden de 1 a 2ºC y conforme avanza el desarrollo embrionario se van reduciendo a menos de 0,5ºC; además, la temperatura media de la masa de los huevos, por efecto del metabolismo, se va incrementando constantemente, desde 26 o 27ºC hasta un promedio máximo de 34 a 35ºC, conforme se acerca el día de la eclosión. La incubación de los huevos se realiza de manera óptima entre los 30 y 32ºC y con cada grado de diferencia se acelera o retarda 2 o 3 días el momento en que ocurre la eclosión. Al acercarse o excederse de los límites entre 27 y 34ºC, la mortalidad se incrementa de forma sensible. Dentro de los límites térmicos óptimos, la incubación se completa de modo general entre 48 y 55 días (Márquez, 1996). Los estudios sobre la temperatura y humedad han mostrado que ambos parámetros son muy importantes para obtener una alta proporción de supervivencia. Si se conocen los parámetros de incubación óptimos, se puede ayudar a mejorar la tasa de supervivencia y determinar la proporción de los sexos (Carrasco et al., 1998). 1.6.6. Humedad Los huevos de muchas especies de quelonios tienen una membrana terciaria de textura coriácea y porosa, por lo que son dependientes de la toma de humedad desde el entorno para su completo desarrollo (Needham, 1966). Los huevos de tortugas marinas incubados en los nidos no siempre mantienen los niveles de humedad presentes en la naturaleza y REVISIÓN BIBLIOGRÁFICA 21 esta diferencia pudiera afectar directamente el desarrollo de los neonatos (Mc Gehee, 1979). La humedad de la arena es crítica para los nidos con huevos de caguama. Estudios previos han demostrado que los niveles altos de humedad causados por una intensa lluvia y altas mareas pueden destruir nidadas enteras de tortugas (Caldwell, 1959; Ragotzkie, 1959; Plumier, 1976; Kraemer y Bell, 1980). El intercambio de gases es impedido cuando los huevos están en un ambiente saturado de humedad (Plumier, 1976; Packard et al., 1977), y la difusión del oxígeno entre la atmósfera y los huevos en el nido puede afectar la relación y buen éxito del desarrollo de los embriones (Ackerman y Prange, 1972; Prange y Ackerman, 1974; Ackerman, 1980; Ackerman et al., 1985). Por el contrario, Bustard y Greenham, (1968) exponen que la carencia de suficiente humedad en la arena de la playa causa que la cámara de los huevos se colapse cuando la hembra la está construyendo y ante el fracaso de la anidación la hembra generalmente se mueve hacia otro sitio y comienza de nuevo todo el proceso. Esta acción puede estar representada como un mecanismo innato el cual previene a la tortuga a anidar en áreas regularmente sujetas a la desecación o a la inundación (Kramer y Bell (1980), Morris et al. (1983); Packard et al. (1980, 1981 y 1985) enfatizan la potencial importancia de la selección del sitio de anidación por las tortugas en relación con el gran éxito de anidación asociado con las propias condiciones de la humedad y la subsiguiente supervivencia de la nidada. La humedad también afecta directamente el resultado de la incubación y su falta o exceso son causas del incremento en la mortalidad; la humedad relativa apropiada en la anidación de las tortugas marinas es de 14 % (Márquez, 1996). 1.6.7. Precipitaciones En la isla Ascensión, Mortimer y Carr (1987) notaron que las tortugas anidan en la estación del año donde ocurren las mayores precipitaciones y se registran las temperaturas más elevadas. Ellos sugirieron que esto es una adaptación que las tortugas han tenido, pues se les facilita anidar cuando la arena está húmeda aunque no encuentran ninguna evidencia para apoyar la hipótesis. Primero, el éxito de la anidación no varió durante la estación y, segundo, este no tuvo relación con las lluvias. Se sugiere que la temperatura es, probablemente, el factor que define la temporada de anidación (Godley et al., 2001). 1.7. Marcadores genéticos en estudios poblacionales. En los últimos años las investigaciones en los campos de la genética poblacional han REVISIÓN BIBLIOGRÁFICA 22 encauzado su línea de trabajo en la utilización de dos tipos de marcadores genéticos fundamentalmente: el ADN mitocondrial y el ADN nuclear: secuencias mini y microsatélites (Bartlett, J. M. S. y D. Stirling, 2003). La aplicación de varias técnicas y metodologías para el estudio de las poblaciones naturales ha servido de complemento y herramienta para la utilización de estos marcadores genéticos. Se puede mencionar entre las técnicas, la Reacción en Cadena de la Polimerasa (P.C.R.), el estudio del Polimorfismo de Longitud por Fragmentos de Restricción (R.F.L.P.) y la secuenciación del ADN. Estás técnicas han servido para la aplicación de estadísticos para el estudio de la estructuración subpoblacional y poblacional, la determinación de diferentes variables genéticopoblacionales (diversidad nucleotídica, flujo genético) y para la construcción de árboles filogenéticos y redes de máxima parsimonia (Bartlett, J. M. S. y D. Stirling, 2003). 1.7.1. El ADN mitocondrial. Usos y limitaciones. El ADN mitocondrial (ADNmt) de los vertebrados presenta forma circular y una talla variable entre los 16 y 17 Kpb (Avise, 1994). Codifica la información para estructuras internas en la mitocondria celular así como ARN ribosomales y de transferencia (Avise, 1994). La región control del ADNmt, debido a la herencia materna, se caracteriza por una elevada tasa evolutiva y una mayor proporción de varianza genética entre poblaciones que los marcadores con herencia biparental (Cann, Stoneking and Wilson, 1987). La tasa de mutación generalmente es más alta en el ADNmt que en el nuclear (Ballard y Wirlock, 2004). Aunque se ha valorado una tasa de mutación hasta diez veces superior en este genoma respecto al nuclear (Brown et al., 1979) esta relación no siempre se cumple (Ballard y Wirlock, 2004). Según estos autores, los estimados filogenéticos de la tasa de mutación pueden estar influidos por el tamaño efectivo de la población, aunque esto no es exclusivo del ADNmt. La región control del ADNmt evoluciona aún más rápido que el resto del genoma mitocondrial por lo que es especialmente çutil en análisis de alta resolución para etructuras poblacionales recientes (Stoneking et al., 1991). Según Avise (1995) en muchas especies la dispersión y el flujo génico es altamente asimétrico en función del género, con el sexo femenino generalmente más sedentario, segundo, que en la mayoría de las especies las hembras y sus crías están espacialmente asociadas en el momento en que las crías comienzan su vida independiente y en tercer lugar, una fuerte estructura matrilineal implica un grado considerable de autonomía demográfica ente las poblaciones a lo largo de una escala de tiempo ecológica. En todos REVISIÓN BIBLIOGRÁFICA estos contextos, el ADNmt constituye una herramienta efectiva para 23 estudios poblacionales. Debido a su rápida evolución y herencia no recombinante, el ADNmt se ha convertido en un vehículo favorable para análisis filogeográficos (Álvarez et al., 2000; Avise et al., 1987) a nivel intraespecífico, y también para determinar las relaciones evolutivas matrilineales en un contexto geográfico (Wilson et al., 1985; Avise, 1989). Se han determinado limitaciones para el uso del ADNmt como marcador: los pseudogenes en el genoma mitocondrial pueden encontrarse en gran cantidad de copias dentro de la mitocondria con solo pequeñas diferencias entre miembros de la misma especie lo que provoca interferencia en los resultados (Zhang y Hewitt, 2003). Por otra parte, el ADNmt representa un único alelo del locus (el materno) por lo que solo refleja la historia de la herencia matrilineal, la cual puede ser diferente en cada especie. El tamaño efectivo de la población de ADNmt es la cuarta parte del tamaño de la secuencia nuclear autosomal, por lo que la diversidad genética puede ser subestimada, la incertidumbre en el análisis genealógico puede incrementarse debido al aumento de la probabilidad de pérdida de vínculos en los haplotipos mitocondriales, y procesos poblacionales anteriores no pueden ser detectados mediante el ADNmt (Zhang y Hewitt, 2003). 1.7.1.1. Uso en genética poblacional de tortugas marinas Aunque la variabilidad genética del ADNmt, al igual que su tasa de mutación, ha resultado ser menor en tortugas marinas que en otros taxa (Avise et al, 1992), el análisis de su región control ha aportado un alto grado de resolución para responder preguntas a escala regional sobre las poblaciones de tortugas marinas (Bowen et al., 1992, Laurent et al., 1993, Norman et al., 1994, Encalada et al., 1996, FitzSimmons, et al., 1997 a y b, Bass y Witzell 2000, Godley et al., 2004, Luke et al., 2004, Okuyama y Bolker, 2005, Dethmers et al., 2006, Formia et al., 2006, Naro-Maciel, 2007, Bolker et al., 2007, Bourjea et al., 2007, Bowen y Karl, 2007). También ha sido utilizado para determinar el origen de tortugas capturadas en mar abierto (Bowen et al., 1995). Particularmente, el ADNmt ha demostrado ser efectivo para detectar la estructura poblacional, al proporcionar perspectivas sobre las conductas de las ovipositoras de connotada importancia para la supervivencia de la especie (Bowen y Avise, 1995 en particular, para probar la conducta filopátrida de las hembras (Meylan et al., 1990, Allard et al., 1994). No obstante deben combinarse con REVISIÓN BIBLIOGRÁFICA 24 estimadores de la diversidad nuclear para determinar el flujo genético que propician los machos.). De cualquier forma, la región control del ADNmt puede perder su valor como marcador genético poblacional si existen cambios demográficos drásticos y eventos de colonización recientes debido a errores ocasionales de la filopatría, cuando el tamaño de muestra es muy pequeño para detectar variaciones pequeñas o cuando existe un bajo número de migrantes por generación, indetectables a nivel demográfico, pero suficientes para homogeneizar la población. En otras palabras, la uniformidad genética de las poblaciones de anidación basadas en las frecuencias haplotípicas del ADNmt, no siempre representan uniformidad demográfica de las colonias que pueden estar tan aisladas como para requerir estrategias de manejo distintas (FitzSimmons et al., 1999). 1.7.2. Uso de loci microsatélites. Los microsatélites son secuencias en el genoma eucariótico formadas por repeticiones cortas (1- 6 pb) situadas en tandem con un número variable de copias (longitud entre 20 y 300 pb) y flanqueadas por una única secuencia conservada (Tautz 1989). Han sido detectados en la mayoría de los organismos eucariontes analizados y son encontrados en mayor cuantía de la que puede ser predicha por el simple análisis del número de bases nitrogenadas (Tautz y Renz 1984; Epplen et al. 1993). La mayoría de los microsatélites detectados en eucariontes son repeticiones de mononucleótidos (A) y dinucleótidos (AC) y se ubican con frecuencia en zonas intergénicas e intrones (Gabor et al., 2000). Por este motivo no tienen alta incidencia en la codificación de la síntesis proteica pero sí participan en otras funciones como la organización del cromosoma (Cuadrado y Schwarzacher 1998), regulación de procesos como la recombinación (Jeffreys et al., 1998; Templeton et al., 2000), replicación y ciclo celular (Field y Wills 1996, Codegoni et al., 1999), así como regulación de la actividad génica en la transcripción (Sandaltzopoulos et al., 1995), y traducción (Martin-Farmer y Janssen, 1999). Todos estos factores han hecho pensar que la inestabilidad de estos motivos repetidos incida en fenómenos como el cáncer (Leung et al. 2000) y otras enfermedades genéticas (Cummings y Zoghbi 2000; Masino y Pastore 2001). Para explicar la alta variabilidad en las secuencias microsatélites se han postulado varios modelos de mutaciones: modelo de infinitos alelos (infinite alleles model “IAM”; Kimura y Crow 1964), modelo de K alelos (K-alleles model “KAM”), el modelo de mutaciones REVISIÓN BIBLIOGRÁFICA 25 puntuales (stepwise mutation model “SMM”; Otha y Kimura, 1973) y modelo de dos fases (Two-phase model “TPM”; Valdés et al., 1993; Di Rienzo et al., 1994). En el IAM cada mutación crea infinitos nuevos alelos en un intervalo dado, alelos idénticos comparten el mismo ancestro y son idénticos por descendencia. En caso del KAM la posibilidad de alelos nuevos es K, por lo que la probabilidad de mutar un alelo en otro estado alélico menor a K. El IAM es un estado particular del KAM en el cual K=infinito. Debido a las restricciones en el tamaño, el KAM, parece ser más realista que el IAM (Estoup y Cornuet, 1998). En caso de SMM cada mutación crea nuevos alelos mediante la deleción o adición de unidades repetidas con la misma probabilidad en ambas direcciones, por lo que alelos de diferentes longitudes están más alejados entre sí que alelos de similar longitud. Esto permitiría comparar evolutivamente alelos entre sí y en el tiempo. El TPM es una adaptación del modelo anterior, teniendo en cuenta la posible ocurrencia de grandes eventos mutacionales en múltiples unidades (Estoup y Cornuet, 1998). Todos estos modelos parten de la ocurrencia de errores durante la replicación del ADN que da lugar a la formación de las duplicaciones en tandem de secuencias cortas que se amplifican en sucesivas replicaciones. Esta acumulación de secuencias repetidas da lugar a un riesgo de recombinación homóloga entre repeticiones dispersas, de lo que resultan translocaciones, deleciones e inversiones (Selker, 1990). La velocidad de mutación estimada en los locus de microsatélites es de una mutación por locus por cada 102-106 meiosis (Zhang y Hewitt, 2003). En tortuga verde ocurre una mutación por locus por cada 5*102 meiosis (FitzSimmons, 1998)), lo que lleva a una alta variabilidad en los gametos resultantes. 1.7.2.1. Desventajas en el uso de los microsatélites. La inversión inicial para el estudio y obtención de los microsatélites como marcadores genéticos, así como la obtención de la técnica para PCR es relativamente alta, lo que constituye su mayor desventaja, aunque superada esta etapa, el uso requiere pocos gastos. Otra desventaja es la posible aparición en la corrida electroforética pequeñas bandas difusas que pudieran dificultar la búsqueda de alelos en cada muestra y, por consiguiente, la detección de homocigotos y heterocigotos, si la diferencia entre alelos es de menos de dos pares de bases. La interpretación errónea de estos parámetros pudiera conllevar a la existencia de un exceso de homocigosis calculada respecto a la existente y REVISIÓN BIBLIOGRÁFICA 26 una desviación artificial del equilibrio de Hardy-Weinberg (O’Connell y Wright, 1997). Estas “bandas fantasmas” pueden deberse a un mal apareamiento de las cadenas durante la PCR, migración diferencial de los fragmentos amplificados por errores de la enzima polimerasa al insertar los nucleótidos en las cadenas, o una desnaturalización incompleta de los productos de la amplificación. Un exceso de homocigotos pudiera ser causado por la presencia de alelos nulos (Callen et al., 1993), los cuales no se detectan en los ensayos estándares. Los alelos nulos pueden presentarse por no ocurrir su amplificación o porque la misma es débil y las cantidades de producto, por ende, no son detectables usualmente. Esto puede deberse a la alta variación de los alelos respecto a los iniciales en los sitios de unión a los oligos o en las regiones cercanas. Los microsatélites cumplen, en fin, con las siguientes características: son abundantes, están distribuidos regularmente en el genoma, se heredan de forma codominante y poseen un elevado grado de variabilidad en las poblaciones, además de que son fácilmente detectables y transferibles. 1.7.2.2. Utilización de los microsatélites en estudios genéticos. A partir de la demostración de la existencia de variabilidad genética en estas regiones del ADNn y la posibilidad de su detección mediante amplificación por PCR y posterior separación de los alelos en geles de poliacrilamida desnaturalizantes (Weber y May, 1989), los microsatélites se han convertido en una fuente importante de marcadores genéticos. Debido a sus propiedades, han adquirido una importancia creciente en los últimos años en estudios sobre análisis de variabilidad genética y relaciones entre especies y razas, así como marcadores genéticos que permitan la identificación individual y la realización de controles de paternidad (Buchanan et al., 1994; Marklund et al., 1994; Sergio et al., 1994; Vega Pla et al., 1996). En la actualidad se han empleado con éxito en variados estudios. Un ejemplo es la taxonomía molecular (Hennequin et al., 2001; Crespi y Fulton, 2004) donde se emplean en combinación con otros marcadores, por la alta variabilidad y la posibilidad de identificar ambos alelos en geles de poliacrilamida. Ese elevado polimorfismo los hace muy útiles para identificaciones individuales, ya que es muy poco probable que dos individuos elegidos al azar, si son analizados para una serie de estos marcadores, compartan todos sus alelos. También son útiles para la cartografía genética (Weissenbach et al., 1992), REVISIÓN BIBLIOGRÁFICA 27 sobre todo para la identificación de QTLs (quantitative trait loci), es decir loci que controlan rasgos de importancia cuantitativa en las especies, como el tamaño, peso, longitud, etc. (Hospital et al., 1992). Asimismo, han sido empleados en la determinación de la estructura genética de poblaciones biológicas para evaluar aspectos tales como su variabilidad genética, evolución, estabilidad, declinación y expansión, distribución geográfica y temporal, relaciones genéticas entre poblaciones y dentro de ellas (Bowen et al., 2008; Allendorf y Luickart, 2007 y Robert et al., 2004). En tortugas marinas, FitzSimmons et al. (1995), realizaron un estudio completo de loci microsatélites que pudieran encontrarse en estas especies, teniendo como base que el uso de las secuencias microsatélites en varias especies depende de la conservación de sitios cebadores dentro de las secuencias que las flanquean -que facilitan la amplificación- y que se mantienen arreglos repetidos suficientemente largos para promover polimorfismo. Se observó en estos estudios la conservación de diversos sitios flanqueantes de loci microsatélites en especies de las dos grandes familias de tortugas marinas, Cheloniidae y Dermochelyidae, a pesar de la divergencia que sufrieron estas hace 100-150 millones de años (Weems, 1988). Se llegó a la conclusión que estos loci se han conservado en estas especies durante más de 300 millones de años de evolución (FitzSimmons et al., 1995). Estos autores plantean que la magnitud de la conservación de estos sitios en tortugas marinas representa un periodo evolutivo mayor del que jamás se hubiese encontrado hasta ese momento y consideran que este grado de conservación es consecuencia de la aplicación del bajo ritmo de sustituciones de nucleótidos encontrado en ADN mitocondrial (Bowen et al., 1993) al ADN nuclear. Como resultado de estos estudios se diseñaron seis pares de oligos para el estudio de los loci microsatélites de seis especies de estas dos superfamilias, comprobadas en ese momento por los investigadores. En estudios posteriores otros oligos han sido diseñados para completar el espectro de especies de la superfamilia de tortugas marinas: Lepidochelys kempii (Kichler et al., 1999), D. coriacea (Crim et al., 2002) y Lepidochelys olivacea (Aggarwal et al., 2004). El mayor empleo que han tenido los loci microsatélites como marcadores genéticos en tortugas marinas ha sido la determinación de la presencia de paternidad múltiple o no en poblaciones de C. mydas (FitzSimmons, 1998; Ireland et al., 2003), Caretta caretta (Moore y Ball, 2002), L. olivacea (Hoekert et al., 2002), D. coriacea (Crim et al., 2002) todo lo cual ha permitido observar en la descendencia de la misma nidada alelos de diferentes progenitores masculinos. No obstante, este fenómeno no ha sido detectado como regla REVISIÓN BIBLIOGRÁFICA 28 general para la totalidad de las poblaciones (FitzSimmons, 1998), ya que sólo una minoría de las muestras en estos estudios presenta poliandria. Para el estudio de la estructura genética poblacional y el flujo mediado por machos entre poblaciones de C. mydas, Roberts et al. (2004), recogieron un total de 336 muestras de embriones en 16 áreas de todo el mundo y encontraron que en poblaciones regionales muy bien definidas el flujo de genes mediante los machos es significativo, aunque se encuentren maternalmente aisladas. También FitzSimmons et al. (1997 a y b) recurrieron al empleo de cuatro loci microsatélites en combinación con otros marcadores genéticos (ADNmt) para determinar la estructuración genética de poblaciones de C. mydas en Australia. Estos autores encuentran un fuerte intercambio genético entre ellas en relación a los machos. Para ello recolectaron muestras de individuos adultos (machos y hembras) en dos zonas separadas y las compararon entre sí. Para comprobar el impacto de una sobreexplotación desmesurada en la estructura genética de poblaciones de C. mydas del Pacífico Oriental, Chassin-Noria et al. (2004) realizaron estudios utilizando marcadores microsatélites y de ADN mitocondrial (ADNmt) de 123 hembras anidadoras. Ellos encuentran que la disminución del número de individuos en la población aun no ha causado un impacto reciente en esas poblaciones, lo cual se debe en mayor medida al lento crecimiento de los juveniles para llegar hasta la adultez. 1.8. Definición de las unidades adecuadas para el manejo. El declive precipitado de algunas poblaciones de tortuga verde durante los últimos siglos (Limpus, 1995) ha aumentado la necesidad para descubrir límites geográficos e identificar poblaciones con independencia demográfica para su manejo. Entender la escala geográfica de las colonias demográficamente conectadas versus las independientes es central para el diagnóstico, dirección y supervisión de estas poblaciones (Moritz 1994; Bowen y Avise, 1996). A pesar de décadas de marcación y estudios genéticos, aún no se conoce la escala geográfica de una población reproductora individual. ¿Se trata de una sola playa, playas inmediatamente adyacentes, o un archipiélago entero? La resolución de esta pregunta es esencial para entender cómo las tortugas verdes responden a los cambios en la disponibilidad de sitios de anidación en el tiempo, por ejemplo cuando se pierden las REVISIÓN BIBLIOGRÁFICA 29 playas de anidación como resultado del incremento en el nivel del mar producto del cambio climático. En primer lugar es necesario tener claridad acerca del criterio a considerar para definir las unidades de conservación. Desde el punto de vista evolutivo, las unidades con significación serán aquellas recíprocamente monofiléticas a partir del ADNmt y con divergencia significativa en las frecuencias alélicas de loci nucleares (Moritz, 1994). Estas diferencias fueron encontradas con uno o ambos marcadores para todas las colonias analizadas en este trabajo. Las unidades de conservación, en general, son aquellas definidas para ayudar al manejo, monitoreo u otros esfuerzos de conservación y para facilitar la aplicación de leyes que conserven taxa y sus hábitat. (Allendorf y Luickart, 2007). Según Bowen et al 2005, las unidades de manejo son equivalentes a poblaciones aisladas y típicamente se caracterizan por cambios en la frecuencia genotípica , así como diferencias en rasgos demográficos claves, incluyendo estructura de edad, supervivencia, fecundidad y proporción sexual. Generalmente, coinciden con las poblaciones demográficamente independientes que se definen como aquellas en las que la dinámica poblacional depende en mayor medida de las tasas de nacimiento y muerte que de la migración (Allendorf y Luickart, 2007). Recientemente, se ha manejado el criterio de unidades designables las cuales describen un estado de conservación de una especie y no necesariamente significación taxonómica, evolutiva o filogeográfica de cualquiera de sus partes componentes. Este estado está basado en datos ecológicos, incluyendo información del hábitat, tendencias poblacionales y amenazas (Green, 2005). Finalmente, las Unidades de Significación Evolutiva serán aquellas recíprocamente monofiléticas a partir del ADNmt y con divergencia significativa en las frecuencias alélicas de loci nucleares (Moritz, 1994). En las tortugas verdes se han propuesto dos ESUs: el océano atlántico y la región indopacífica (Karl y Bowen 1999). 30 2. MATERIALES Y MÉTODOS. 2.1. Área de estudio. El área de estudio abarcó las colonias de anidación más importantes del suroccidente de Cuba según Moncada y Nodarse (1983) (Fig. 1). El seguimiento de las anidaciones fue realizado en 9 playas situadas en la costa sur de la Península de Guanahacabibes (22o 21o59'N; 84o50' - 84o44'O). Los estudios se realizaron entre los años 1998 al 2008, en los meses de mayo a septiembre, etapa definida como la temporada de anidación de la tortuga verde para el Caribe (Márquez, 1996). Cada temporada fue dividida en ocho quincenas numeradas del I al VIII. 4 5 6 Resguardo Antonio 3 Perjuicio Cayuelos Caleta Larga C. Piojos 1 2 La Barca Holandés Las Canas Figura 1. Ubicación de las áreas de trabajo (1) Occidente, (2) Centro y (3) oriente de Guanahacabibes, (4) San Felipe, (5) Isla de la Juventud y (6) Cayo Largo. En rojo, las 5 playas índice de la Península de Guanahacabibes. En verde, ubicación de la estación meteorológica del Cabo de San Antonio Se determinó el ancho promedio y longitud de cada playa. Además fueron divididas para su estudio en tres zonas (A, B, C) y de tres a seis sectores (I, II, III, IV,V y VI) perpendiculares a la línea costera de acuerdo con su topografía. La zona A va desde la línea de marea alta hasta donde comienza la primera berma en la franja de arena, la B es a partir de la primera berma hasta donde comienza la cobertura de vegetación y la zona C incluye toda el área de vegetación supra-litoral. Los sectores fueron seleccionados teniendo en cuenta la existencia o no de accidentes geográficos presentes en la playa que de modo potencial pudieran obstaculizar el ascenso y selección del sitio de anidación de las tortugas. Se MATERIALES Y MÉTODOS 31 determinó la pendiente media de cada playa índice a partir de la trigonometría (Fig. 2). La distancia del punto más alto a la línea de marea alta se determinó con una cinta métrica de 50 metros de largo (precisión de 1 m). La altura se determinó con una cinta métrica de 135 cm de largo (precisión de 1 cm). a α b tag α = b a Figura 2. Cálculo de la pendiente de la playa tomando como medidas la longitud de la recta trazada desde el punto más alto de la misma (a), hasta la perpendicular que constituye la altura de la playa (b) medidas con cinta métrica de 50 m y 1,35 cm de longitud respectivamente. Se caracterizaron además según la energía del oleaje (alta energía: oleaje constante; mediana energía: poco oleaje; baja energía: mar tranquila), grosor del grano de arena (arena gruesa: 0.25- 2mm; arena media: 0,05- 0.25 mm y arena fina <0.0500), coloración de la arena y presencia de barreras arrecifales. También fue determinado el tipo de vegetación según Borhidi (1996). 2.2. Obtención de los datos ecológicos. Todos los datos empleados en el trabajo fueron tomados durante la ejecución del Proyecto Universitario para el Estudio y Conservación de las tortugas marinas en Cuba (Ibarra et al., 1999; Ibarra et al., 2000), que se lleva a cabo por el Centro de Investigaciones Marinas de la Universidad de La Habana. La selección de las playas se llevó a cabo previa consulta con residentes locales sobre las especies que anidan en la zona, su abundancia y distribución. Posteriormente determinó la densidad de anidación para seleccionar las playas índices (las de mayor importancia según los niveles de anidación). Debido a la relativa uniformidad de las playas analizadas, para determinar la densidad se consideró un área rectangular cuyos lados fueron la longitud de la playa y el ancho promedio de la franja arenosa. Asimismo, se determinó la relación entre la longitud de la playa y el número de nidos como medida de abundancia relativa. Las playas fueron patrulladas durante toda la noche a intervalos de 30 a 45 minutos. Una vez detectada la hembra ovígera se contó el número de huevos y al concluir el proceso de oviposición se realizó la medición y marcación del nido y de la hembra. Para la marcación de las hembras en el área de anidación se utilizaron marcas de acero-iconel estilo 681C MATERIALES Y MÉTODOS 32 con la serie HV y cuatro dígitos consecutivos comenzando por el 0001. Estas marcas tienen una garantía de duración de hasta 20 años en el agua salada (Productor: NBTC, Newport, Kentucky, U.S.A.). El término salidas o emergencias se emplea para referirse a la emergencia de las tortugas del mar y su ascenso a la playa, ya sea que aniden o no. Del mismo modo, el término hembras anidadoras se refiere a todas las tortugas que potencialmente pueden ovipositar durante la temporada de anidación. 2.2.1. Caracterización morfométrica de las hembras. A las hembras marcadas se les tomaron siete medidas morfométricas (Bolten, 2000). El largo curvo del carapacho fue medido desde el extremo anterior de la línea media, correspondiente con el escudo nucal, hasta el borde posterior de las supracaudales, mientras que el ancho curvo se midió en el primer tercio del carapacho tomando como extremo el borde de los escudos marginales. El ancho del rastro se tomó transversalmente de borde a borde de las huellas dejadas por las aletas anteriores. También se midió el largo y el ancho de la cabeza. Estas cinco medidas fueron tomadas con cinta métrica de 135 cm de largo, con una precisión de 1 mm. En las playas índice también fue medido el largo y ancho rectos del carapacho, tomados desde los mismos puntos descritos anteriormente pero con un pie de rey de 135 cm de largo y de 1 mm de precisión. Además, fue medida la distancia entre los nidos y la línea de marea alta con una soga con marcas cada un metro y la profundidad del nido con la cinta métrica de 135 cm de largo y 1 mm de precisión. 2.2.2. Conducta y éxito reproductivo La conducta de las hembras anidadoras fue analizada a partir de los siguientes aspectos: selección del sitio de anidación, etapas del proceso de anidación, fidelidad al sitio de anidación y la variación espacial y temporal de la anidación. La selección del sitio de anidación de las hembras fue analizada a partir de la geomorfología de las playas, mediante la ubicación de cada nido en esquemas de las playas. Estos esquemas fueron divididos en sectores en función del tamaño y abundancia de obstáculos para el acceso de las tortugas y en ellos se realizó el conteo del número de nidos y el número de puestas por hembra anidadora en las distintas zonas y sectores de las playas de anidación. La ubicación de las puestas sucesivas de cada hembra permitió determinar el nivel de fidelidad al sitio de anidación a diferentes escalas (dentro de cada sector, entre sectores y entre playas). Las etapas del proceso de anidación fueron caracterizadas mediante sus tiempos de ocurrencia. Estos fueron comparados entre sí y entre playas. Por otro lado, el éxito MATERIALES Y MÉTODOS 33 reproductivo fue medido en términos del éxito de anidación de la hembra y el procentaje de emergencia de las nidadas. Posterior a la eclosión de los nidos se procedió a revisar su contenido. Se determinó el período de incubación y se cuantificó el resto de los descriptores: número de neonatos vivos, número de deformaciones, número de neonatos muertos al nacer, número de huevos sin embrión, número de huevos con determinado desarrollo embrionario y número de huevos y neonatos depredados en el nido. A partir de estos se calcularon los siguientes indicadores en función de las categorías del contenido del nido que se recomienda para ser registradas (Miller, 2000): Número de neonatos vivos Éxito de emergencia = Total de huevos Número de huevos sin embrión evidente % de huevos sin embrión = x100 Total de huevos Número de huevos sin eclosionar con desarrollo embrionario evidente % de mortalidad embrionaria= % de depredación en el nido = Total de huevos Número de huevos y neonatos depredados en el nido A x100 x100 Total de huevos Número de deformaciones % de deformaciones = Total de huevos x100 Número de neonatos muertos al nacer % de mortalidad al nacer = Número de neonatos (muertos al nacer + neonatos vivos) x100 Los huevos infértiles y los que no presentaron desarrollo embrionario fueron analizados juntos en la categoría de huevos sin embrión, ya que es difícil diferenciarlos a simple vista (Miller, 1996). Por esta razón, los porcentajes de infertilidad y mortalidad embrionaria pueden no expresar con exactitud los fenómenos correspondientes y constituyen indicadores complejos para su correcta estimación. El tamaño de la nidada y el periodo de incubación fueron considerados como indicadores adicionales a los calculados. 2.2.3. Factores abióticos La fase de la luna fue determinada mediante el programa ASTROCAL versión 1.3 (McMullan, 1993). Las mareas fueron determinadas por tablas elaboradas y facilitadas por MATERIALES Y MÉTODOS 34 el Departamento de Mareas de Geocuba-Geodesia (Anónimo, 2000 al 2004 y 2007). Los datos de los años 2005 y 2006 no pudieron colectarse porque la estación fue desactivada por roturas. Las mediciones de temperatura en el nido se efectuaron empleando un termómetro digital y cuatro a seis sensores (Digi-sense Thermocouple Thermometer Model No. 8528-20, Coleparmer Instrument Company, error= 0,1ºC) para cada playa. Los sensores fueron colocados durante la oviposición a un nivel de profundidad en el nido de aproximadamente 20 cm midiendo desde el tope de los huevos hasta el fondo de la cámara de incubación. Después que cada uno fue asegurado de manera que no se saliera de su posición inicial, se procedió a la inmediata medición de la temperatura cada 4 horas comenzando a las 12:00am. Asimismo, se recopilaron los datos diarios de temperatura y precipitaciones durante los meses de anidación para los años 2000 al 2007 de la estación meteorológica del Faro del Cabo de San Antonio perteneciente al Instituto de Meteorología (Fig. 1). De esta última fuente se obtuvieron todos los datos referidos a ciclones tropicales -tanto tormentas tropicales como huracanes- que por su trayectoria tuvieron algún impacto en la Península de Guanahacabibes. Se recopiló información sobre el número y categoría de los ciclones que afectaron de manera directa (vientos, lluvia y elevación del nivel del mar) o indirecta (sobre-elevación del nivel del mar) a la Península de Guanahacabibes durante 10 temporadas de trabajo (Anexo 1). Posteriormente se evaluó el porcentaje de afectación de los nidos en función de los niveles de penetración del mar y la distribución espacial de los nidos que se encontraban en la playa en el momento del paso del ciclón. 2.3. Análisis de los datos ecológicos. Se comprobó el ajuste de los datos a la normalidad mediante la Prueba de KolmogorovSmirnov y la homogeneidad de varianza por la Prueba de Levene. Cuando no fueron cumplidas estas premisas, los datos de conteos se transformaron a través de mientras que a las proporciones se les aplicó el arcoseno X X , y luego se verificó nuevamente el cumplimiento de las premisas de las pruebas paramétricas. En el caso de las emergencias y anidaciones por temporada de anidación, del número de salidas por quincenas, del número de salidas por intervalo de una hora y las frecuencias con que las hembras anidadoras asumen determinado tipo de trayectoria, que cumplieron las premisas MATERIALES Y MÉTODOS 35 de la parametricidad, fueron analizadas mediante un ANOVA de clasificación simple y para las comparaciones múltiples se empleó la prueba de Student-Newman – Keuls (SNK). Por su parte, a las variables “salidas” (por año, por playas, en función de la hora en que se produce el pico de marea alta o pleamar más cercano; de los intervalos de una hora con relación a la pleamar) y a la comparación de los descriptores de anidación en cuanto a los tiempos de ocurrencia, que no cumplieron con la homogeneidad y la normalidad, se les aplicó un de Kruskal-Wallis. Para las comparaciones múltiples se empleó la prueba de Student-Newman-Keuls (SNK) no paramétrica que se realizó en el programa Excel. Se calculó la correlación paramétrica de las siguientes variables: número de reproductoras y el número anual de ciclones; salida de las hembras anidadoras y la temperatura atmosférica; salida de las hembras anidadoras y acumulados diarios de precipitaciones; media anual del Largo Curvo del Carapacho y el número de nidos por temporada; tamaño de la nidada y el largo curvo del carapacho; profundidad del nido y el largo curvo del carapacho de la hembra; profundidad del nido y tamaño de la nidada; relación entre el período de incubación y fecha de la anidación; temperatura del nido y temperatura atmosférica. Todos los análisis se realizaron con nivel de significación de 0.05 en el programa STATISTICA 6.0 (StatSoft, Inc., 2001). 2.4. Obtención del material biológico para los estudios genéticos. En total se colectaron 392 muestras de tejido muscular de 50 – 200 g (Tabla 1), tanto de adultos como embriones, provenientes de 8 áreas de anidación diferentes: Cayo Largo, El Guanal en la Isla de La Juventud, en Cayo Real (Cayería de San Felipe) y en las playas Antonio, Perjuicio, La Barca, El Holandés y Caleta de los Piojos de la Península de Guanahacabibes (Fig. 1). El período de colecta abarcó desde el año 1998 hasta el 2007. Las playas de la Península de Guanahacabibes se agruparon en tres regiones: oriente (Antonio y Perjuicio), centro (La Barca y El Holandés) y oriente (Caleta de los Piojos) tomando en cuenta su disposición a lo largo de la Península así como la distancia entre ellas. Para el análisis de secuencias del ADNmt se consideró, además, que las muestras pertenecieran a hembras con marcas físicas diferentes o cuyas fechas de oviposición difirieran en 10 días o menos para evitar la pseudorreplicación. Las muestras fueron conservadas en etanol (90 %), a temperatura ambiente. MATERIALES Y MÉTODOS 36 Tabla 1: Muestras analizadas en el trabajo de laboratorio divididas por sitio de muestreo. Se presenta el número de productos con calidad en cada paso. El número de amplificaciones es la sumatoria de los productos obtenidos para el análisis con los 9 loci analizados y para la secuenciación. Zonas de Colecta Península de Guanahacabibes Oriente Centro Occidente Cayería de San Felipe Guanal, Isla de la Juventud Cayo Largo del Sur Total Total de muestras 152 47 112 11 16 44 392 Extracciones válidas 99 42 45 11 15 40 258 Número de amplificaciones 690 424 342 90 84 174 1608 Muestras secuenciadas 66 26 43 11 10 34 190 2.5. Procesamiento de las muestras 2.5.1. Extracción del ADN total La extracción del ADN genómico se realizó a partir de 30 a 40 mg de tejido muscular siguiendo el protocolo descrito a continuación, el cual es una modificación de Hillis et al. (1996): Se eliminó el etanol y se cortó finamente el tejido, el que se colocó en un tubo Eppendorf de 1,5 ml y se agregaron 350 μl de tampón de extracción (100 mM NaCl, 50 mM Tris-HCl, 1% SDS, 50 mM EDTA, pH 8,0) y 20 μl de proteinasa K (Promega) a 20 mg/ mL. Se dejaron incubar en rotador toda la noche a 55oC. Se agregaron 300 μl de LiCl 5M y se agitó a temperatura ambiental por un minuto. Se añadieron 600 μl de cloroformo: alcohol isoamílico (24:1) y se mezcló en el rotador a temperatura ambiente durante 30 minutos aproximadamente. Se centrifugaron a 13,000 X g por 15 minutos. Se extrajeron 500 μl de la capa acuosa (parte superior) y posteriormente se transfirieron a un nuevo tubo Eppendorf de 1,5 mL. Se agregaron 50 μl de NaAc 3 M pH 5,2 y 1000 μl de etanol al 100% frío con vista a precipitar el ADN. Se invirtió el tubo varias veces y se colocó en el congelador a -20°C una hora. Posteriormente se centrifugaron a 13,000 X g por 20 minutos. Al terminar se desechó el líquido del tubo con cuidado de no perder el pellet de ADN. Se añadieron 750 μl de etanol al 70% y se colocaron los viales en un rotador durante 15 minutos a temperatura ambiente, y se volvió a centrifugar por 5 minutos, para poder desechar el líquido del tubo con sumo cuidado. Se dejó secar el contenido para evaporar todo el etanol. Finalmente se resuspendió el ADN en 50 μL de TE 1x a pH 8,0. MATERIALES Y MÉTODOS 37 2.5.2. Amplificación del ADN mediante la técnica del P.C.R. El ADN extraído fue amplificado para los loci microsatélites y ADNmt cuyas características se muestran en la tabla 2. Tabla 2 Características de los oligos de los marcadores microsatélites y ADNmt utilizados, T h: Temperatura de hibridación, Tp: Tamaño esperado de los productos de amplificación. Motivo repetido Secuencia cebador 5’-3’ Th Tp (pb) (oC) No. Referencia alelos OR-1 (CAAA)16 F: CCCCTTGTGTTCTGAAATCCTATGA R: CAGGCATAGGGAAAAATCAGAGGTA 50 150–202 1 OR-2 (GT)8GCC(GT)5 F: GCTCCTGCATCACTATTTCCTGTT R: TGCTGCCCCCACACCCTCTG 55 153–185 7 R:GCACCTTTTCACGTTGTCCACATGT 55 162-174 4 (TC)23 F: GCACTGGTGGGAAAATATTGTTGT R: GCTGGGCTAATAAAATGTTGTGCA 55 148–166 5 [148, 154] Ei8 (CA)19 F: ATATGATTAGGCAAGGCTCTCAACAAC R: AATCTTGAGATTGGCTTAGAAATCAATC 56 170 1 Cm58 (CA)13 F: GCCTGCAGTACACTCGGTATTTAT R: TCAATGAAAGCGTTAAGACA 48 130-148 8-18 Cm72 (CA)33 F:CTATAAGGAGAAAGCGTTAAGACA R:CCAAATTAGGATTACACAGCCAAC 58 237-295 28-37 Cm84 (CA)15 F:TGTTTTGACATTAGTCCAGGATTG R:ATTGTTATAGCCTATTGTTCAGGA 54 325-365 6 -21 Cc117 (CA)17 F:TCTTTAACGTATCTCCTGTAGCTC R:CAGTAGTGTCAGTTCATTGTTTCA 56 210-270 13-19 LTCM1 H950 CCCAAAACCGGAATCCTAT GTCTCGGATTTAGGGGTTT 50 745 Marcador Locus ADN mt Microsatélites OR3 OR-8 Aggarwal et al., 2004 (TC)9(AC)6GC(AC)2 F:TTGTTTTATTTTTATTGGTCATTTCAG FitzSimmons et al., 1995 Abreu-Grobois (com.per.) Se amplificaron las regiones caracterizadas por los autores que describen cada oligo mediante la Reacción en Cadena de la Polimerasa según Mullis et al. (1986). Se seleccionaron ocho loci para los microsatélites, pues las regiones correspondientes en el genoma son loci moderadamente variables, útiles para discriminar poblaciones y no individuos. Los oligos seleccionados para amplificar el ADNmt fueron escogidos porque definen una región más grande que potencialmente puede mostrar mayor variabilidad. Se procedió a estandarizar el procedimiento de amplificación de estos loci y se estableció un programa primario a partir del cual se variaron algunas condiciones principales (Tabla 3). Del mismo modo se estandarizaron las condiciones de la mezcla de amplificación variando dos elementos: concentración del ADN molde y concentración de cloruro de magnesio. MATERIALES Y MÉTODOS 38 Tabla 3. Programa primario de amplificación e intervalo en el que se variaron algunas condiciones en el programa de amplificación de los loci. Intervalos de Temperatura y Etapas Intervalos de tiempo número de ciclos o Desnaturalización inicial. 94 C 5 min. Desnaturalización 94 oC 30 seg. Hibridación 48 – 60 oC 60 – 90 seg. Extensión 72 oC 60 – 90 seg. Número de ciclos 35 o Extensión Final 72 C 5 min. Tabla 4. Intervalo de variación de algunos de los componentes de la mezcla de amplificación de los loci. Condiciones de la mezcla Concentración Mg2+ Concentración ADN dNTP oligos tampón Taq polimerasa Volumen final Intervalo de concentración y volumen 1,5 – 2,0 mM 0,2 – 20 µM 0,136 mM 0,4 µM 1x 1U 25 µL 2.6. Detección de la presencia de ADN total, productos de PCR y sus alelos 2.6.1. Electroforesis en geles de agarosa Para estimar la calidad y cantidad de ADN, se realizaron corridas en minigeles de agarosa al 0,8 % (3 μl de ADN y 3 μl de loading buffer, bromofenol azul) sumergido en un tampón TBE 0,5 X (Tris-borato 0,045 mol/L, EDTA 0,002 mol/L) durante 20 minutos a 85 volts. Se visualizó por exposición a luz UV con previa tinción en Bromuro de Etidio. El límite de detección de este método está entre los 5 y 300 ng en el gel (Fig. 3). Ei1 Cm84 Cm72 600pb Figura 3. Electroforesis en agarosa para determinar la presencia, tamaño y concentración a priori de productos de extracción. Izquierda: bandas de ADNmt y Derecha: PCR para 3 loci microsatélites de diferentes tamaños 2.6.2. Secuenciación y alineamiento del ADNmt Las muestras con buena calidad en la amplificación fueron purificadas y secuenciadas automáticamente mediante el servicio de la compañía Macrogen de Seúl, Corea del Sur. Las secuencias fueron alineadas y corroboradas visualmente mediante el programa BioEdit MATERIALES Y MÉTODOS 39 Sequence Alignment Editor ver. 7.0.5.3 (Hall, 2001). La numeración de los sitios polimórficos fue realizada tomando como referencia la base 1 de la región de control del ADNmt (Kumazawa y Nishida, 1999). En los casos en que existió una deleción/ inserción de más de una base, el sitio polimórfico se identificó con el número correspondiente al primer nucleótido y se mantuvo el resto de la numeración considerando el cambio como de una sola base. 2.6.3. Secuenciación y determinación de los alelos en loci microsatélite Las amplificaciones exitosas de los nueve loci microsatélites fueron desnaturalizadas por cinco minutos a 95oC con HiDi formamida y un marcador de peso molecular (Liz 500 (-250) y cuantificados empleando un secuenciador ABI 3730 (Applied Biosystems). Posteriormente se determinaron los alelos mediante el programa Peakscanner (Applied Biosystems, 2006). 2.7. Análisis de datos genéticos 2.7.1. Diversidad genética Se caracterizó la diversidad genética de los haplotipos a partir de los índices de H (Nei, 1987) y π (Tajima, 1983; Nei, 1987), y se probó que las mutaciones fueron selectivamente neutrales a través del las pruebas de Tajima (Tajima, 1989 y 1996) y Fu (Fu, 1997) mediante el programa dnaSP, versión 4.10 (Rozas et al., 2006). Para los microsatélites se calcularon las frecuencias alélicas por población, el número de alelos por locus, el porcentaje de loci polimórficos, los valores de heterocigosidad observada (Ho) y esperada (He) mediante el programa GenAlEx 6.1 para Excel 2007 (Peakall y Smouse, 2006). El polimorfismo de los loci fue atribuido a aquellos cuyo alelo más frecuente no excediera el 95%. 2.7.2. Equilibrio de Hardy- Weinberg y Desequilibrio de Ligamiento El cálculo del equilibrio genético y la heterogeneidad de las frecuencias alélicas y genotípicas entre poblaciones se realizó por el programa Genetix (Belkhir et al., 2000). Las desviaciones del equilibrio de Hardy-Weinberg fueron estimadas mediante el estadístico Fis (Indice de fijación, Wrights, 1978), según la adecuación de Weir y Cockerham (1984) para el análisis de varios loci simultáneamente. Este índice es la correlación entre dos gametos apareados relativo a la subpoblación y brinda una medida del exceso o déficit de heterocigotos y se calcula según la siguiente fórmula: MATERIALES Y MÉTODOS Fis= 1- (Ho/He)=Hs-Hi/Hs donde Hi = Hs = 1 n n∑ i =1 h s2 40 2 n r ∑ pi − pi 2 i =1 h, es la frecuencia promedio del heterocigoto para el i-ésimo alelo p, es la frecuencia promedio del i-ésimo alelo s2, es la varianza de la frecuencia del i-ésimo alelo sobre las poblaciones r, es el número de subpoblaciones n, número de copias del gen analizado en la i-ésima población La significación estadística de las desviaciones fue calculada empleando el algoritmo de las cadenas de Markov. Se determinó además el desequilibrio de ligamiento genotípico para todos los pares de loci en cada población mediante la prueba exacta de Fisher del programa Arlequin 3.1 (Excoffier et al. 2006). 2.7.3. Diferenciación y flujo génico Se compararon las frecuencias génicas y genotípicas entre todas las poblaciones. El nivel de diferenciación genética entre las localidades, entre temporadas y entre intervalos de talla del largo curvo de las hembras anidadoras se estimó a través del índice Fst, para todos los pares de poblaciones empleando las fórmulas de Weir y Cockerham (1984): Fst = Ht- Hs/ Ht donde Ht= 2 ( p − p 2 ) Fue calculado además, Rst (Slatkin, 1995), análogo de Fst que utiliza el modelo de mutación por pasos (SMM), mediante la siguiente fórmula: Rst = Vep Vdi + Vei + Vep donde Vep: varianza entre poblaciones, Vdi: varianza dentro de individuos y Vei: varianza entre individuos. El índice Fst fue empleado para calcular el flujo genético entre las diferentes localidades mediante la siguiente fórmula: Nem = ((1/Fst)-1)/4 donde Ne: es el tamaño efectivo de la población m: es la tasa de migración. La dirección del flujo fue verificada mediante le programa MIGRATE 2.0 (Beerli, 2004). De esta forma, aunque no se disponga del tamaño efectivo de la población ni la tasa de migración, es posible estimar el flujo como el número absoluto de migrantes (Nem). Se aplicó la prueba de Paetkau basada en la asignación sobre la base de frecuencias. Para cada muestra se calcula la frecuencia esperada de cada genotipo por locus, asumiendo apareamiento al azar, y se determina un valor de probabilidad usando las frecuencias alélicas de las poblaciones respectivas (GenAlEx 6.1 para Excel 2007, Peakall y Smouse, MATERIALES Y MÉTODOS 41 2006). Las relaciones genéticas entre las poblaciones analizadas también se evaluaron mediante la distancia genética de Nei (1978) que se calcula: D = - log e I Donde I = Jxy/ (JxJy)1/2 donde: Jx: promedio del mínimo de la diferencia de codones entre los alelos en la población x; Jy: promedio del mínimo de la diferencia de codones entre los alelos en la población y Jxy: promedio del mínimo de la diferencia de codones entre los alelos de las dos poblaciones. Estas distancias fueron empleadas para construir árboles según el algoritmo de UPGMA (Sneath y Sokal, 1973) mediante el Mega 2.1 (Kumar et al., 2001) y también sirvieron para realizar el análisis de Coordenadas Principales mediante el programa GenAlEx 6.1 para Excel 2007(Peakall y Smouse, 2006). El grado de diferenciación observado entre pares de poblaciones fue comprobado mediante un análisis molecular de varianza AMOVA (Excoffier, 1992, Michalakis y Excoffier, 1996). Los componentes de co-varianza dentro de individuos, entre ellos y entre poblaciones son utilizados para calcular un análogo de los índices de fijación de Wright (1978), el valor de φ, a diferentes niveles de jerarquía. El programa Structure 2.0 (Pritchard y Wen 2003) fue empleado para realizar el agrupamiento bayesiano de genotipos individuales. Los parámetros considerados fueron el modelo de mezcla y la opción de frecuencias alélicas correlacionadas entre la poblaciones según la configuración sugerida por Falush et al. (2003) para el caso de estructura poblacional sutil. El largo de la corrida inicial y el número de cadenas de Markov fue de 10 000 respectivamente. Se estableció a priori un número de k=13 y se realizaron 20 réplicas por cada una de las k. 2.7.4. Neutralidad La neutralidad de las mutaciones detectadas en cada población para el ADNmt fue verificada mediante los estadísticos D de Tajima (Tajima, 1989 y 1996) y Fs de Fu (Fu, 1997) mediante el programa dnaSP versión 4.10 (Rozas et al., 2006). En los loci microsatélites se comprobó mediante la prueba de Ewens-Watterson (Ewens, 1972; Watterson, 1978), a partir de la cual se calculan los índices de autocigosidad observados en la muestra y se comparan con los esperados bajo las condiciones de neutralidad selectiva, implementado en el programa ARLEQUIN (Excoffier and Schneider, 2005). 2.7.5. Tamaño poblacional En el caso del ADN mitocondrial, el tamaño efectivo de la población (Ne) se determinó a partir de la estimación del parámetro mutacional θ el cual es igual a 2Nm para este MATERIALES Y MÉTODOS 42 marcador según Watterson (1975). Theta fue calculado según el número de sitios segregativos y la diversidad nucleotídica, mediante el programa dnaSP, versión 4.10 (Rozas et al., 2006). El cálculo se realizó para cada colonia de anidación teniendo en cuenta una media de remigración de 3 años (Miller, 1997) y razón de mutación (1,2%), corregida por el tiempo promedio de vida de una generación. En el caso de los microsatélites, el tamaño efectivo fue estimado tomando en cuenta el posible ajuste de los marcadores a dos modelos de mutación fundamentales: el IAM, en cuyo caso el cálculo sería: 4Ne*u=He/1-He y el SMM según el cual el tamaño efectivo es igual a: 8Ne*u=He/(1He)2 donde He es la heterocigosidad esperada (Goldstein y Schloterer, 1999). Se empleó una tasa de mutación de 2x10-3 descrita para tortugas marinas por FitzSimmons et al. (1995). Se realizaron otras tres estimaciones del tamaño poblacional a partir de los datos ecológicos. Empleando la marcación física se consideró el total de hembras marcadas y una estimación mediante el modelo de Jolly-Seber del programa Ecological Methodology (Kreb, 1999). Por último, se calculó el número de hembras dividiendo el número de nidos por año por el promedio de anidaciones por hembra (2,5 para Guanahacabibes). Para analizar la demografía histórica de las poblaciones fue calculada la distribución del número observado de diferencias entre pares de haplotipos mediante el modelo de expansión súbita (Rogers y Harpending, 1992). Su significación fue examinada usando la desviación estándar de la suma de cuadrados entre las desigualdades observadas y esperadas mediante el programa Arlequin ver. 3.1 (Excoffier et al., 2006) considerando el intervalo de confianza (IC) para alpha igual a 0,05 (Li, 1977). En el caso de que Theta tomó valor cero al inicio de la expansión, el tamaño efectivo al inicio de la expansión fue calculado con el valor medio del IC del estadístico con igual alpha. En el análisis de expansión demográfica también fue tenida en cuenta la significación de la Prueba de Fu. 43 3. RESULTADOS. 3.1. Estrategia reproductiva de C. mydas y factores que la afectan 3.1.1. Influencia del ambiente en la selección del sitio de anidación La zona de anidación de Antonio (22o latitud norte y 84o 34’ longitud oeste) tiene una longitud aproximada de 240 m con un ancho de franja arenosa inicialmente entre 7,4-10,0 m que aumentó a unos 20 m después de los ciclones, limitada en ambos extremos por diente de perro. Esta playa presenta rocas aisladas en el rompiente. El extremo superior está delimitado por vegetación de playa arenosa y una franja de guano de costa (Fig. 4a). En Perjuicio (21o 54’ latitud norte y 84o 40’ longitud oeste), la zona de anidación es de aproximadamente 500 m de longitud con ancho variable de 2 m en los extremos y de 30 m hacia la parte central. Esta playa, que posterior al 2004 perdió toda su franja de vegetación, se considera de mediana energía, debido a que una barrera arrecifal mitiga el impacto del oleaje. También presenta rocas aisladas en el rompiente y está limitada en el borde superior por un farallón de aproximadamente 6-7 m de altura (Fig. 4c). La Barca (21o 50’ latitud norte y 84o 46’ 00’’ longitud oeste) originalmente tenía 298 m de longitud, de los cuales 75 m estaban cubiertos por una franja de piedra, luego del 2004 su longitud se incrementó a cerca de 800m por la deposición de arena. Lo mismo ocurrió con su ancho máximo que pasó de 16.5 m a más de 100 m en algunas partes. Está caracterizada por una gran cantidad de rocas de diferentes tamaños que pueden incluso hallarse bajo la arena. Posee una franja de guano de costa hacia el centro de la playa (Fig. 4d). El Holandés (21o 49’ latitud norte y 84o 46’ 53’’ longitud oeste) tiene 1020 m de largo total, que abarcan un caletón de 63 m de longitud, la parte central de la playa con 713 m- de los cuales hay 119 m cubiertos por una franja de piedra que forma una entrante hacia el mar (en la parte oriental de este tramo)-, seguida por un farallón intermedio de 76 m y finalmente una playa más pequeña de 168 m de longitud. Presenta grandes rocas ubicadas en determinados puntos. El ancho varía de 3 m en la parte más estrecha (hasta donde existe oviposición, ya que el farallón se encuentra con el mar en el extremo más occidental de la playa y en el farallón intermedio) y alrededor de 13 m en su parte más ancha. Después del 2004 el ancho se extiende a 25 m como promedio (Fig. 4e). La zona de anidación de Caleta de los Piojos (21o 50’ latitud norte y 84o 50’ longitud oeste) es pequeña en relación a las anteriores, aproximadamente de 100 m de longitud por 9 -15 m de ancho. Es de forma de herradura y también es de mediana energía, flanqueada en los extremos por lapiez y en la parte superior por un uveral (Fig. 4b). b. Caleta de los Piojos a. Antonio c. El Perjuicio e. El Holandés d. La Barca Vegetación de Trinax radiata (Guanal) Vegetación costera arbustiva Rocas dispersas Farallón o diente de perro Arena Mar Figura 4. Esquemas de las cinco playas índices de la Península de Guanahacabibes, Cuba. RESULTADOS 44 Las características más importantes para la anidación de las playas índice y secundarias se presentan en la tabla 5. Antonio presenta la mayor pendiente media con 6,25o a diferencia de las otras cuatro cuyos valores se encuentran por debajo de los 5o. Cualitativamente el grano más grueso se encuentra en las playas Antonio la Barca y Caleta de los Piojos que coinciden también con la energía. La coloración más oscura es la de Caleta de los Piojos, la mayoría posee una coloración intermedia mientras Las Canas, Perjuicio, EL Holandés y Caleta Larga poseen una arena clara. Tabla 5. Caracterización geomorfológica de las playas estudiadas en la Península de Guanahacabibes, Cuba. Se destacan en cursiva las playas índices Pendiente media (o) Grosor del grano de arena Coloración de la arena Barrera arrecifal Energía - Fino clara no Baja Antonio El Resguardo Perjuicio La Barca El Holandés 6,25 5,50 5,27 5,40 grueso Mediano Fino grueso Fino intermedia intermedia clara intermedia clara no no sí no sí Alta Mediana Mediana Alta Mediana C. Piojos 5,94 grueso oscura no Alta - Fino Fino clara intermedia no no Mediana Mediana Playas Las Canas Caleta Larga Los Cayuelos Vegetación distintiva Trinax radiata T. radiata T. radiata Coccoloba uvifera T. radiata C. uvifera La presencia de vegetación influye en la selección del sitio de anidación ya que la mayoría de las hembras de tortuga verde busca el inicio de la vegetación para anidar (Fig. 5). Además de la franja característica de incienso de costa presente en todas las playas, la zona de anidación de Las Canas, Antonio, La Barca y Caleta Larga está flanqueada por una franja de guano de costa (T.radiata) y Caleta de los Piojos y los Cayuelos presentan uvas caletas (Coccoloba uvifera). Al comparar las anidaciones en cada una de las zonas de la playa (A, B, C) se encuentran diferencias significativas entre ellas (Fig. 6). En las primeras temporadas evaluadas existió una marcada diferencia entre las anidaciones por zona, con una mayor frecuencia en la zona C. Fig. 5. Tortuga verde anidando en la zona de vegetación en playa Antonio, Península de Guanahacabibes Número de anidaciones RESULTADOS 400 350 300 250 A B C F (2,12) =4,95 a 200 a 50 0 a F (2,15) =12,19 b F (2,13) =8,93 F (2,6) =5,29 b a ab b 1999 b 2000 F (2,9) =4,27 a 150 100 F (2,15) =6,21 a F (2,11) =5,26 a 2001 a b b b 2003 ab a F (2,15) =16,19 2004 b b 2005 a a ab ab b F (2,15) =6,96 a a a F (2,15) =4,01 b 2002 45 2006 b 2007 2008 Temporada de anidación Figura 6. Distribución de las anidaciones por zonas de la playa de la Península de Guanahacabibes durante las temporadas de 1998 al 2008. Zona A: desde la línea de marea alta hasta donde comienza la primera berma (3 metros aproximadamente), zona B: a partir de la primera berma hasta donde comienza la vegetación y la zona C: incluye toda el área de vegetación supra-litoral. Todas las comparaciones de medias fueron significativas estadísticamente. La depredación de los huevos y las crías en su camino al mar, no constituye un factor que afecte de manera significativa el éxito reproductivo de las tortugas marinas en la península de Guanahacabibes ya que no representa más del 5% de los nidos, excepto en circunstancias excepcionales. Tal es el caso de los puercos domésticos que han causado pérdidas superiores al 5 % de los nidos, en Caleta de los Piojos en particular, donde acceden fácilmente a la playa (Fig.7). La actividad de los cerdos (Sus scropha) es la responsable del incremento hasta el 7 % de la depredación en el 2002. Figura 7. Depredación observada en Guanahacabibes (A) por Jubo negro (Tropidophis melanurus) (B) por cerdo doméstico (Sus scropha), (C) huevos con orificios abiertos por hormigas (Familia Formicidae) y (D) cangrejo fantasma (Ocypode quadrata). Las hormigas (Familia Formicidae), larvas de insectos y cangrejos fantasmas (Ocypode quadrata) son los que más contribuyen a la depredación de los nidos, aunque afectan a RESULTADOS 46 menos del 3 % de los huevos de cada nido. Por último, se encontraron en dos ocasiones nidos invadidos por el jubo negro (Tropidophis melanurus). Otro aspecto relacionado con la depredación es la medida en que afecta a huevos sin embrión o con desarrollo embrionario. La depredación por cangrejos representa el 55 % de las afectaciones en los huevos sin embrión, sin embargo, la presencia de larvas de insectos constituye también el 55 % pero de los huevos con embrión. Finalmente, las infecciones por hongos y bacterias pueden representar entre un 20 y un 30 % del total de afectaciones en los nidos y tienen frecuencias no tan diferentes en los huevos con embrión (32 %) y sin él (24 %). Las anidaciones no se comportaron de manera similar en todas las playas estudiadas. Se encontró un mayor número de anidaciones por unidad de área y de longitud en las playas más pequeñas (Fig. 8 y Tabla 6), con excepción de la playa Resguardo que presenta un bajo número de anidaciones. Figura 8. Densidad de anidaciones de C. mydas para las nueve playas estudiadas en la Península de Guanahacabibes, Cuba. Las letras señalan los grupos homogéneos estadísticamente. Entre paréntesis el tamaño de la muestra. La organización de las playas en función de estos valores permite clasificar a Antonio, Perjuicio, La Barca y Caleta de los Piojos como playas índices al ser las de mayores anidaciones por unidad de medida. Por otra parte, el Holandés, se incluye en esta categoría por el tiempo de estudio. RESULTADOS 47 Tabla 6. Número de anidaciones de tortuga verde (C. mydas) por unidad de longitud (m) en cada una de las playas monitoreadas en la Península de Guanahacabibes. Las playas se encuentran organizadas de mayor a menor valor de anidaciones. Entre corchetes se encuentran los valores de longitud de cada playa. Se encuentran subrayadas las playas índice. C. Piojos [100 m] Antonio [200 m] La Barca [300 m] Perjuicio [500 m] Canas [800 m] Holandés [1020 m] Cayuelos [800 m] C. Larga [800 m] 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 0,15 0,10 0,16 0,06 0,11 0,02 0,02 0,01 2,68 0,74 0,31 0,40 0,11 0,08 0,71 0,35 0,20 0,10 0,05 0,03 0,56 0,17 0,11 0,07 0,01 0,03 0,02 0,02 0,84 0,37 0,23 0,12 0,02 0,01 0,03 0,01 0,66 0,37 0,26 0,18 0,06 0,08 0,04 0,04 1,09 0,24 0,40 0,06 0,05 0,00 0,02 0,03 0,41 0,03 2,13 0,53 0,15 0,19 0,09 0,77 0,37 0,30 0,17 0,09 0,03 0,03 0,07 ± Entre las playas existen diferencias en cuanto a la eficiencia en la anidación. Antonio y Caleta de los Piojos presentan valores elevados de éxito de anidación, seguidos por La Barca, pero El Holandés es la playa con valores más bajos. Durante el tiempo de muestreo también se observan diferencias ya que los años 1998 al 2000 presentan los mayores valores (Tabla 7). En los años 2002 y 2004 se produjo el menor valor en el éxito de anidación, aunque entre ambas temporadas existen grandes diferencias en cuanto a las anidaciones, pues el 2002 fue la temporada más alta. Tabla 7. Eficiencia en la anidación de tortuga verde (C. mydas) por año en cada una de las playas índices de la Península de Guanahacabibes, Cuba. Éxito general/ 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 playa 63,36 Antonio 70,59 73,68 75,47 66,67 58,5 60 57,58 50 62,16 58,9 55,36 Perjuicio 50 64,21 83,33 60,4 48,98 50 31,15 51,11 59,04 57,67 Barca 52,17 40,63 44,68 78,33 48,15 81,03 57,81 58,55 47,72 Holandés 60,42 50 34,52 39,29 48,28 54,55 58,02 36,67 63,17 Caleta 60 64,32 50 68,66 52,11 69,64 70,24 62,12 71,43 Éxito general/año 70,59 61,23 63,32 58,13 53,35 55,74 54,73 57,39 58,25 56,92 En las playas fueron observadas áreas de mayor densidad de anidación (Fig. 9). Esto se correspondió con el el hecho de que el número de nidos en los diferentes sectores de las playas presentó diferencias significativas (Fig. 10). El mayor número de salidas en cada playa corresponde siempre con los sectores exentos de accidentes geográficos, u otros obstáculos que afectaran la anidación de las hembras anidadoras. √ 0,97±0,51 0,34±0,11 0,23±0,06 0,13±0,07 0,05±0,02 0,04±0,02 0,03±0,01 0,03±0,02 Antonio Perjuicio La Barca El Holandés Caleta de los Piojos 2000 2002 2004 2006 2007 Figura 9. Ubicación de los nidos en los sectores de las cinco playas índices estudiadas en la Península de Guanahacabibes. Los colores representan los nidos en diferentes temporadas. Frecuencia ablsoulta de observaciones RESULTADOS a 150 a 120 90 60 48 b a 30 bc ab bc abc bc c 0 I II III IV V VI Antonio bc c I II III ab a a a I Perjuicio b ab II III IV bc c c IV b V I Barca II III IV Holandés I II C. Piojos Sectores de la playa Figura 10. Número de nidos de tortuga verde (C. mydas) por sectores de cada playa de anidación en la Península de Guanahacabibes, Cuba (FAntonio (5,24)=4,71; p=0,003; FPerjuicio (3,20)=9,50; p<0,001; FBarca (2,20)=5,40; p=0,004; FHolandés (3,16)=10,73; p<0,001; FC.Piojos (2,12)=9,19; p=0,004) Como parte de la conducta de anidación también se analizó la profundidad a la que excavan el nido las tortugas en dependencia de las playas y sus zonas (Tabla 8). No fueron encontradas diferencias estadísticas para ninguna de las dos categorías analizadas. Tabla 8. Profundidad del nido (cm) e intervalo de confianza por playas (A) y zonas de la playa (B) para la población de tortuga verde (C. mydas) que anida en la Península de Guanahacabibes, Cuba. Se incluye el tamaño de la muestra (N), el coeficiente de variación y los valores mínimo y máximo encontrados. A Media± N Canas 49,67±4,39 3 Antonio 64,67±4,79 42 Perjuicio 61,88±4,83 25 Barca 54,43±6,21 44 Holandés 45,50±2,55 7 C. Piojos 70,16±6,17 18 CV Máximo Mínimo 8,83 65,00 6,87 99,00 7,97 93,00 6,67 87,00 5,60 54,00 7,32 128,00 28,00 34,00 36,00 36,00 B Media± N CV Máximo Mínimo A 62,00±31,01 3 41,00 64,74 ± 3,89 96 50,0 7,84 93,00 B 128,00 34,00 C 66,12 ± 3,79 82 7,62 117,00 28,00 34,00 34,00 Se encontraron diferencias entre las playas en cuanto al número promedio de huevos por nido y al Largo Curvo del Carapacho de las hembras (Fig. 11 y 12). III Número de huevos F(7,1486) = 4,01; p = 0,0002 210 200 190 180 170 160 150 140 130 120 110 100 90 80 70 60 50 40 30 20 10 0 ab (94) Canas ab (254) b (216) ab (287) ab (106) a (489) b (30) ab (20) Perjuicio Holandés C. Larga Antonio Barca C.Piojos Cayuelos Mediana 25%-75% Min-Max Playas Figura 11. Promedio del número de huevos por nido de C. mydas para las ocho playas estudiadas en la Península de Guanahacabibes, Cuba. Entre paréntesis el tamaño de la muestra y las letras iguales señalan los grupos homogéneos estadísticamente. F(7,1636) = 2,17, p = 0,03 180 b (315) Largo curvo del carapacho (cm) 170 160 150 ab (362) 140 130 120 ab (134) ab (241) a (106) ab (407) ab (37) ab (15) 110 100 90 80 70 60 50 Canas Perjuicio Antonio Holandés C.Larga Barca C. Piojos Cayuelos Mediana 25%-75% Min-Max Playas Figura 12. Comparación entre las ocho playas estudiadas en la Península de Guanahacabibes, Cuba del Largo Curvo del Carapacho de C. mydas. Entre paréntesis el tamaño de la muestra y las letras iguales señalan los grupos homogéneos estadísticamente. RESULTADOS 49 3.1.2. Efecto de los eventos meteorológicos en la anidación A lo largo del período de estudio 9 eventos meteorológicos afectaron de manera directa o indirecta a la Península de Guanahacabibes, con un impacto variable en el éxito reproductivo de las tortugas marinas que anidan en esta zona (Tabla 9). Con relación a las afectaciones a la producción de huevos y neonatos, los años 2004 y 2005, fueron los de mayor porcentaje a la vez que superaban en ambos casos el 55 % de pérdida de huevos. Tabla 9. Daños causados a la producción de neonatos de C. mydas luego del impacto de ciclones durante la temporada reproductiva en la Península de Guanahacabibes, Cuba Año Tormentas 2002 2003 2004 Isidore y Lili Claudette Charley e Iván Arlene, Katrina y Wilma Dean 2005 2007 Nidos Huevos Nidos Producción destruidos destruidos eclosionados de huevos Producción de Porcentaje de neonatos pérdida 31 26 81 3019 2 964 9 234 607 168 60 69 198 19 152 6 840 55 358 15 322 5 472 5 13 57 136 15 504 113 12 882 10 306 55 28 3 192 309 35 226 28 181 8 Uno de los impactos más importantes de los ciclones es sobre la selección del sitio de anidación. Los ciclones, en particular el Iván, causaron transformaciones en la morfología de las playas y la más importante fue la pérdida parcial o total de la franja de vegetación (Fig. 13). A partir del año 2005, luego de la ocurrencia del huracán Iván, se produjo un incremento 120 110 100 90 80 70 60 50 40 30 20 10 0 Intervalos de distancia (m) Figura 13. Distribución de las anidaciones con relación a la línea de marea alta durante las temporadas 2000-2007 >80 75,01-80 70,01-75 65,01-70 60,01-65 55,01-60 50,01-55 45,01-50 40,01-45 36,01-40 33,01-36 30,01-33 27,01-30 24,01-27 21,01-24 18,01-21 15,01-18 12,01-15 9,01-12 6,01-9 3,01-6 2000 2002 2004 2005 2006 2007 0-3 Número de nidos de las anidaciones en la zona arenosa sin vegetación. RESULTADOS 50 Figura 14. Neonato de C. mydas atrapado en las raíces de Trinax radiata Otro efecto de los cambios en la estructura de las playas fue el incremento en la frecuencia de neonatos atrapados en las raíces de las plantas, particularmente Trinax radiata (Fig. 14). Además, incrementó también el número de huevos depredados por hormigas. Se evidencia un cambio importante la distancia recorrida para anidar por las tortugas que anidaron a partir del 2005 con relación a años anteriores (Fig. 15 y Tabla 10). Tabla 10. Media, intervalo de confianza (± la línea de marea alta en las playas índice Media± √ √ ) y coeficiente de variación de la distancia de los nidos a Antes de Iván CVA Después de Iván CVB 7,65±0,29 32,23 27,71±2,74 45,14 Perjuicio 8,55±0,56 35,62 12,14±1,99 59,05 La Barca 9,37±0,52 27,80 31,33±4,56 68,50 El Holandés 8,00±0,56 30,46 18,16±3,57 77,69 C. Piojos 7,52±0,52 55,52 17,27±1,47 45,80 Antonio En años anteriores la máxima distancia recorrida pocas veces superó los 15 metros, en cambio, a partir del 2005 existen recorridos que superan los 60 metros hasta llegar a un máximo de 100 metros. Este cambio se refleja diferencialmente en las playas, pues mientras en algunas el incremento promedio fue de una decena de metros (Perjuicio, El Holandés y Caleta de los Piojos) en otras superó los 20 metros (Antonio y La Barca). A pesar de las afectaciones observadas en el éxito reproductivo por el efecto de los ciclones, no se encuentra una relación significativa entre el total de salidas de las hembras por año y la frecuencia de ciclones (Fig. 16). Figura 15. Afectaciones en las playas de la Península de Guanahacabibes por el huracán Iván (2004): A la izquierda se ejemplifica la pérdida total de la vegetación en playa Perjuicio; a la derecha arriba se muestra la banda de farallón expuesta por el movimiento de arena en la misma playa y a la derecha debajo se presenta el incremento en la franja arenosa en playa La Barca. Fotos 2,3 y 4: R. Díaz rtotal = -0,50, p = 0,20; r(-1) = -0,54, p = 0,20 Número de salidas de reproductoras 1000 Figura 16. Relación entre el número de salidas de reproductoras y la actividad ciclónica anual para la población anidadora de tortuga verde (C. mydas) de la Península de Guanahacabibes, Cuba. La línea de tendencia discontinua incluye a todas las temporadas, mientras que la continua, excluye la temporada con 26 ciclones, que fue inusual. 900 800 700 600 500 400 300 200 100 0 8 10 12 14 16 18 20 22 Número de ciclones por año 24 26 28 RESULTADOS 51 Unas de las etapas de mayor vulnerabilidad para el éxito reproductivo son la de desarrollo embrionario y la fase de emergencia de los neonatos desde las nidadas (Tabla 11). Entre los indicadores calculados, los porcentajes de anomalías, el porcentaje de huevos con embrión y la mortalidad de los neonatos al nacer, no mostraron diferencias significativas entre playas, zonas de las mismas y su interacción. Tabla 11. Resultados del análisis de los nidos que eclosionaron durante el tiempo de estudio. Se presentan los valores medios y su intervalo de confianza X ± tS n Año n % de Emergencia % de huevos con desarrollo embrionario 1999 5 56,4 ± 34,6 1,2 ± 2,1 9,1 ± 10,4 - - 53,0 ± 2,4 2000 65 84,9 ± 3,70 3,0 ± 1,7 8,5 ± 2,7 - 1,5 ± 1,3 53,5 ± 1,3 2002 2004 2005 2006 2007 153 11 14 136 119 73,9 ± 3,1 77,7 ± 2,4 71,9 ± 26,1 79,4 ± 24,3 82,7 ± 2 5,1 3,2 ± 0,8 3,2 ± 0,5 9,4 ± 1,7 9,4 ± 2,0 1,2 ± 2,0 13,6 ± 2,6 9,4 ± 1,7 6,6 ± 7,7 2,0 ± 4,4 6,5 ± 10,5 1,0 ± 0,7 0,5 ± 0,1 0,00 6,3 ± 16,9 0,5 ±1,3 7,7 ± 1,6 1,3 ± 0,3 1,9 ± 4,4 2,3 ± 7,1 2,1 ± 4,6 52,5 ± 2,2 53,3 ± 0,4 58,7 ± 2,9 55,6 ± 2,4 55,1 ± 2,7 % de huevos sin embrión % de anomalías % de depredación Período de incubación El éxito reproductivo, medido en términos de número de nidos, y el éxito de emergencia de los neonatos, no fue uniforme (Fig. 17). Se constata un incremento de ambas variables en la medida en que aumenta la distancia del nido a la línea de marea alta, hasta llegar a un límite alrededor de los siete metros donde la producción de neonatos se hace máxima. Pasado este límite, la proporción de neonatos que emergen sigue incrementándose, no así el número de nidos que comienza a disminuir por lo que se puede decir que el éxito mayor se alcanza en la franja comprendida entre los 6 y 12 metros de distancia donde la producción de neonatos supera los 20 000 individuos. También fue encontrada una relación entre el tamaño de las hembras anidadoras y la distancia a la cual anidan (Fig. 18). Antes de la ocurrencia de los huracanes, mientras mayor es la talla de la hembra, mayor es la distancia que recorre, hasta que se llega a los 15 metros hasta donde avanzan las hembras mayores, a partir de esa distancia, la talla de las hembras comienza a disminuir. Después de los huracanes, este comportamiento es menos evidente, aunque se observa un incremento en la talla de las hembras alrededor de los 50 metros de distancia seguida por una reducción. 26000 220 % Supervivencia 24000 200 No. Nidos 22000 180 Producción de neonatos 160 20000 18000 16000 140 14000 120 12000 100 10000 80 8000 60 6000 40 4000 20 2000 0 0 Distancia del nido a la línea de marea alta Figura 17. Número de anidaciones de hembras de tortuga verde (C. mydas) y emergencias de los neonatos en función de la distancia a la línea de marea alta a intervalos de 3 metros para la población anidadora de la Península de Guanahacabibes, Cuba. Los rombos indican en términos de miles de individuos la producción de neonatos por intervalo de distancia. Antes Largo Curvo del Carapacho (cm) 108 Después 107 106 105 104 103 102 101 100 0 a 3 3 a 6 6 a 9 9 a 12 12 a 15 15 a 18 18 a 21 21 a 24 24 a 27 27 a 30 30 a 35 35 a 40 40 a 45 45 a 50 50 a 55 55 a 60 60 a 70 Distancia (m) Figura 18. Distancia promedio al mar, antes y después del 2004, de los nidos de C. mydas en función del Largo Curvo del Carapacho de las hembras en la Península de Guanahacabibes, Cuba Producción de neonatos Total de huevos y % de Supervivencia 240 RESULTADOS 52 Fueron analizados seis descriptores de la fase final de la incubación como indicadores para evaluar el éxito reproductivo de las tortugas marinas en función del éxito de eclosión y viabilidad de los neonatos. Al comparar entre sí los indicadores expresados como Porcentaje porcentajes se encuentran diferencias significativas entre ellos (Fig. 19). 100 90 80 70 60 50 40 30 20 10 0 a b c c d d Emergencia Muerte embrionaria Anomalías Huevos sin embrión Depredación Mortalidad al nacer Mediana 25%-75% Min-Max INDICADORES Figura 19. Comparación entre seis de los indicadores del éxito reproductivo de C. mydas en la Península de Guanahacabibes, Cuba (F (5, N=1377)= 995,58; p< 0,01). Letras similares indican grupos estadísticamente homogéneos. El éxito de emergencia es el de mayor valor y se diferencia significativamente del resto de los indicadores. Este indicador abarcó alrededor del 75 % del total de la nidada, aunque se presentaron valores extremos desde el 0 hasta el 100 %. Su valor es inferior al éxito de eclosión ya que algunos neonatos quedan atrapados en el nido y mueren antes de poder emerger, el porcentaje de mortalidad por esta causa es bajo, pues solo alrededor del 2 % de los neonatos logra salir del huevo. El indicador que le sigue en cuanto a mayor valor promedio es el porcentaje de huevos sin embrión evidente, que también presenta diferencias significativas con respecto a los otros indicadores y como ellos fluctuó entre el cero y el 100%, con una media general del 12 %. Tanto el éxito de emergencia como el porcentaje de huevos sin embrión muestran diferencias significativas en dependencia de la zona de la playa (F(3, N=219)= 3,82; p= 0,02 y F(3, N=219)= 4,28; p= 0,01, respectivamente). En ambos casos estas diferencias se producen entre la zona cercana a la línea de marea y el resto de la playa. En esta zona contrastan los mayores valores de huevos sin embrión con los menores valores de éxito de emergencia. Los huevos donde no se detectó desarrollo embrionario representan para esta zona el 22,3 % respecto al total de la nidada, a la vez que existe una emergencia tan baja como el 60,3 % de los huevos en el nido. RESULTADOS 53 3.2. Estacionalidad de las anidaciones. 3.2.1. Anual. Mediante la marcación física se determinó el intervalo de remigración para las hembras anidadoras en Guanahacabibes. El intervalo medio fue de 2,47 años determinado por la mayor frecuencia de hembras que regresaron a los 2 y 3 años, aunque se registró un mayor número de remigrantes que regresaron a los 2 años (Fig. 20). Es de destacar la existencia de 18 hembras que retornaron al año siguiente y el primer avistamiento de una hembra a los seis años de marcada (2002-2008). Del total de remigrantes, una ha regresado en cuatro ocasiones a intervalos de dos años. Otras 14 han vuelto en tres años diferentes a intervalos constantes o mixtos. Las que regresaron a intervalos constantes lo hicieron cada año (solamente una), cada dos años (2 casos) o cada tres años (4). En cuanto a los intervalos mixtos, uno fue de uno y tres años mientras que el resto (6 casos) Frecuencia absoluta de hembras fue de dos y tres años. 44 40 36 32 28 24 20 16 12 8 4 0 Media±tS√n=2,47±0,24 1 año 2 años 3 años 4 años 5 años 6 años Período de remigración Figura 20. Distribución de frecuencias de los intervalos de remigración de tortuga verde (C. mydas) por temporada de anidación en la Península de Guanahacabibes, Cuba. Se señala además el intervalo medio de remigración y su intervalo de confianza El comportamiento de las emergencias y anidaciones de tortuga verde en la Península de Guanahacabibes durante once años (Fig. 21) demuestra que en los primeros 5 años se manifiesta una clara diferenciación entre años consecutivos, con mayor abundancia (>400 salidas) en los años 1998, 2000 y 2002. En contraste, el número de eventos que se produce en los años 1999 y 2001 no llega a 100. Luego de un descenso de las anidaciones del 2004, se observa en éstas un incremento gradual desde unas 250 en el 2004 hasta el 2008, cuando se vuelve a observar un número de salidas dentro del intervalo de las dos temporadas más altas (2000 y 2002). Estas mismas diferencias se evidencian para la anidación. Frecuencias absolutas 900 850 800 750 700 650 600 550 500 450 400 350 300 250 200 150 100 50 0 No. salidas No. nidos 1998a 1999a 2000a 2001a 2002a 2003a 2004a 2005a 2006a 2007a 2008a Temporadas Canas Antonio Resguardo Perjuicio La Barca Holandés C. Piojos Cayuelos C. Larga Eventos Totales 83 11 96 88 147 41 70 15 106 82 95 46 96 213 15 12 3 12 32 6 16 202 94 84 268 49 60 28 71 60 638 96 883 319 19 12 14 11 33 5 36 54 29 56 19 15 258 16 74 0 61 116 11 84 26 6 394 45 74 0 90 128 81 66 28 32 544 72 73 7 83 152 30 77 26 54 574 53 70 47 173+67 58 187 31 44 737 Figura 21. Comportamiento de las emergencias y anidaciones de tortuga verde (C. mydas) por temporada de anidación en la península de Guanahacabibes, Cuba. Las barras muestran el total de eventos y anidaciones por temporada y en la tabla el total de eventos para cada playa especificando al final de cada columna el total anual. Las casillas sombreadas en la tabla significan que no se realizó seguimiento. Se encuentran subrayadas las cinco playas índices. La barra más clara en 1998 es un valor estimado del número de salidas incluyendo las playas que no se monitorearon ese año a partir de lo observado en temporadas similares de anidación mientras que la azul oscura es el valor real observado. Las líneas azules representan la tendencia de las salidas por temporada durante el ciclo bienal (19982002) y a partir de los años con anidaciones crecientes (2003-2008). RESULTADOS 54 Desde el comienzo del programa de marcación en el 2001, ha existido un incremento en el número de hembras marcadas cada año (Fig. 22) con la excepción del año 2002 cuando fue marcado el mayor número de hembras en correspondencia con la temporada de anidación más alta dentro de los 10 años de trabajo del proyecto. El número de remigrantes también ha ido incrementándose respecto a las nuevas, hasta llegar a una Número de hembras proporción de 0,32 en la última temporada. 180 160 140 120 100 80 60 40 20 0 Las Canas Antonio Perjuicio La Barca El Holandés C. Piojos C. Larga Los Cayuelos Remigrantes 0,32 0,23 0,27 0,24 0,12 0,03 0,00 2001 Playas Nuevas 0,00 N 2002 R 7 N 2003 R 33 48 N R 16 1 18 4 72 17 2004 2005 Temporada N 5 8 12 9 6 11 2 6 R N 4 20 3 26 3 25 2006 R 2 2 3 11 N 10 19 17 27 10 8 5 2007 R 1 14 3 6 2008 N R N R 9 17 16 40 4 10 6 1 2 3 9 9 15 8 49 7 1 15 35 9 4 14 2 1 Figura 22. Número de hembras marcadas y remigrantes durante todas las temporadas desde 2001 en la Península de Guanahacabibes, Cuba. En cada columna se especifica la proporción entre las tortugas remigrantes y las nuevas. En la tabla se presentan los valores por playa. N: Nuevas marcas; R: Remigrantes Dentro de las variaciones detectadas cada temporada se advierte que las tallas medias de las hembras observadas por primera vez son menores que las remigrantes (F(1,547)=9,25 p=0,002) como se refleja en la Tabla 12. Tabla 12. Media del Largo Curvo del Carapacho y el intervalo de confianza para las hembras de tortuga verde (C. mydas) que anidan por primera vez en la Península de Guanahacabibes, Cuba y las remigrantes por temporada. t:valor de la t de Student para la muestra; S:varianza de los datos; n: tamaño de la muestra. LCC± Nuevas Remigrantes 2001 2002 2003 102,1±5,54 104,89±1,14 103,3±2,27 2004 2005 2006 2007 103,72±2,09 103,52±1,34 105,44±1,32 104,55±1,27 107,28±3,22 106,27±1,76 106,00±2,50 108,10±2,27 RESULTADOS 55 3.2.2. Durante la temporada reproductiva No se encontró una interacción significativa entre las salidas por quincena y las playas (Fig. 23). Sin embargo, existen diferencias en las salidas por quincenas (F(1,6)=5,94364; p<0,001) y por playas. La frecuencia por quincena en cada playa tiene un máximo en las quincenas del mes de julio. Sin embargo, debe señalarse la mayor abundancia de salidas en las primeras quincenas en el caso de las playas más occidentales. En dos de estas playas (Caleta de los Piojos y Los Cayuelos) se produce el máximo una quincena antes que en el resto de las playas. De manera excepcional, El Holandés es la única playa donde Frecuencia Relativa de eventos (%) el pico se produce en la sexta quincena. 32 I II III IV V VI VII VIII 28 24 20 16 12 8 4 0 Este Canas Antonio Resguardo Perjuicio Barca Holandés Caleta C. Piojos C.Larga Cayuelos Oeste Playas Figura 23. Comportamiento quincenal de las emergencias a la playa de hembras reproductoras de tortuga verde (C. mydas) dentro de cada temporada de anidación en la Península de Guanahacabibes para cada una de las playas (B). Tomando en cuenta la altura de la marea, no se encuentra una relación directa significativa con el número de salidas de hembras anidadoras, fundamentalmente a inicios y finales de la temporada cuando las salidas son escasas o nulas. Durante el pico de la anidación, es decir, a finales de junio y julio, se observa un mayor número de salidas alrededor del momento en que se produce la mayor altura de la marea (Fig. 24). 25 20 15 salidas marea 0,40 2000 0,32 0,24 10 0,16 5 0,08 0 0,00 25 2002 0,40 20 0,32 15 0,24 10 0,16 5 0,08 0 0,00 18 15 0,36 0,30 0,24 0,18 0,12 0,06 0,00 2003 12 9 6 3 0 10 2004 8 0,40 0,32 6 0,24 4 0,16 2 0,08 0 0,00 20 2007 15 10 5 8 de sep 12 de sep 16 de sep 31 de ago 4 de sep 15 de ago 19 de ago 23 de ago 27 de ago 3 de ago 7 de ago 11 de ago 22 de jul 26 de jul 30 de jul 18 de jul 6 de jul 10 de jul 14 de jul 28 de jun 2 de jul 24 de jun 4 de jun 8 de jun 12 de jun 16 de jun 20 de jun 27 de may 31 de may 15 de may 19 de may 23 de may 0 0,60 0,50 0,40 0,30 0,20 0,10 0,00 Días de la temporada Figura 24. (Continuación) Comportamiento de las salidas de tortugas en función de la altura de la marea por temporada. Eje izquierdo: Frecuencia absoluta de hembras (serie roja); Eje derecho: Altura de la marea en cm (serie azul) RESULTADOS 56 Se observó una mayor frecuencia de ascensos durante la luna llena que coincide, en su mayoría con la primera salida de las tortugas a anidar (Fig 25 arriba). Esto se ratifica con una mayor frecuencia de avistamientos de rastros de reconocimeinto durante la luna llena (Fig 25 debajo). Frecuencia abslouta de observaciones 180 Cuarto creciente Luna llena Cuarto menguante Luna nueva 160 140 120 100 80 60 40 20 0 I II III IV V VI VII VIII IX X XI XII XIII Frecuencia de los rastros de reconocimiento Número de salidas por hembra por temporada 80 70 60 50 40 30 20 10 0 Cuarto creciente Luna llena Cuarto menguante Luna nueva Fases lunares Figura 25. Arriba: Salida de las hembras anidadoras con relación a la fase lunar tomando en cuenta cada salida de la hembra a la playa durante la temporada de anidación (I a XIII). Debajo: Dentro de la primera salida, frecuencia de observación de los rastros de reconocimiento en función de la luna. Como la mayor frecuencia de tortugas se observa a mediados de la temporada, generalmente en el mes de julio, es en este período donde se observa el mayor número de salidas durante la luna llena (Fig. 26). Número de salidas 120 Luna llena Cuarto creciente 100 Cuarto menguante Luna nueva 80 60 40 20 Junio Julio Agosto Junio 1998 Julio Ago. Junio Julio 1999 Agosto Sept. Junio Julio 2000 Agosto Mayo Junio Julio 2001 Agosto Sept.Mayo Junio 2002 CM4 CC3 CM3 CC2 CM2 CC1 CM5 CC4 CM4 CC3 CM3 CC2 CM2 CC1 CC4 CM4 CC3 CM3 CC2 CM2 LN5 LL5 LN4 LL4 LN3 LL3 LN2 CM4 CC3 CM3 CC2 CM2 LN4 LL4 LN3 LL3 LN2 LL2 0 Julio Agosto 2003 Mayo Junio Julio 2004 Agosto Mayo Junio Julio 2005 Agosto Mayo Junio Julio Agosto Sept. Mayo Junio 2006 Julio 2007 Agosto Junio Julio LL4 LN3 LL3 LN2 LL2 LN1 LL1 CC4 CM4 CC3 CM3 CC2 CM2 CC1 CM1 LL5 LN4 LL4 LN3 LL3 LN2 LL2 LN1 CM5 CC4 CM4 CC3 CM3 CC2 LL5 LN4 LL4 LN3 LL3 LN2 LL2 LN1 100 90 80 70 60 50 40 30 20 10 0 LL1 Número de salidas Fases lunares durante cada temporada reproductiva Agosto Sept. 2008 Fases lunares durante cada temporada reproductiva Figura 26. Comportamiento de las salidas de hembras anidadoras en función de las fases lunares a lo largo de cada temporada para la Península de Guanahacabibes. En rojo se destaca la mayor frecuencia relativa observada RESULTADOS 57 Se observa un incremento de las salidas de las hembras reproductoras con el aumento de la temperatura ambiente hasta los 28,0oC (Fig. 27). El mayor número de salidas se Número de salidas de reproductoras concentró alrededor de los 27,0 a los 28,5oC. 660 600 540 480 420 360 300 240 180 120 60 0 24,0024,50 24,5125,00 25,0125,50 25,5126,00 26,0126,50 26,5127,00 27,0127,50 27,5128,00 28,0128,50 28,5129,00 29,0129,50 29,5130,00 Intervalos de temperatura (oC) Figura 27. Salida de las hembras anidadoras en función de la temperatura atmosférica en la Península de Guanahacabibes, Cuba. El seguimiento de la temperatura a lo largo del periodo de incubación muestra un aumento hacia los últimos días de incubación y se mantiene durante el segundo tercio del desarrollo o período termosensitivo para la diferenciación de los sexos, alrededor o por encima de los 29oC (Fig. 28). Teniendo en cuenta el intervalo de la temperatura pivote que se resalta en la figura y los valores alcanzados en la mayoría de los nidos durante el periodo termosensitivo, se estima para los nidos analizados una proporción de sexos sesgada a favor de las hembras. Además de la determinación del sexo, la temperatura determina el tiempo que tardan las nidadas en eclosionar. El período de incubación mostró una relación inversa significativa tanto con la fecha de oviposición como con la temperatura del ambiente (Fig. 29). 34 33 32 31 30 29 28 27 Temperatura del Nido ( oC) 1er tercio 3er tercio 2do tercio 2004 Nido 1 1er tercio 3er tercio 2do tercio 1er tercio 3er tercio 2do tercio 2004 Nido 2 2006 Nido 1 1er tercio 3er tercio 2do tercio 1er tercio 3er tercio 2do tercio 2006 Nido 3 2007 Nido 1 34 33 32 31 30 29 28 27 1er tercio 3er tercio 2do tercio 2006 Nido 2 34 33 32 Mediana 25%-75% Intervalo sin puntos extremos 31 30 29 28 27 1er tercio 3er tercio 2do tercio 2007 Nido 2 1er tercio 3er tercio 2do tercio 2007 Nido 3 Figura 28. Temperatura media durante los días de incubación de los nidos analizados en la península de Guanahacabibes. El área en rojo se corresponde con la temperatura pivote ± 1°C para la diferenciación de los sexos: 28 a 30 ºC (Ackerman, 1996); 28,26 ºC (Lutz y Musick, 1997). Período de Incubación (días) 58 r = -0,53, p = 0,01 57 56 55 54 53 52 51 A 50 28,0 28,5 29,0 29,5 30,0 30,5 31,0 31,5 Temperatura (oC) r = -0,47, p < 0,001 62 60 58 56 54 52 50 48 46 21 de jul 15 de jul 9 de jul 3 de jul 27 de jun 21 de jun 27 de may 21 de may 15 de may 42 14 de jun B 8 de jun 44 2 de jun Período de incubación (días) 64 Fecha Figura 29. Relación entre el período de incubación y dos factores (A) Temperatura del nido y (B) Duración de la temporada reproductiva. En rojo, línea de tendencia. RESULTADOS Las salidas de las hembras relación con las precipitaciones diarias durante el tiempo de estudio (Fig. 30). Tampoco se encuentra asociación significativa con los acumulados mensuales (Fig. 31). En los años 1998, 1999 y 2006, los picos de anidación no coinciden con los acumulados de lluvia pero en el resto de los años, el pico de las Número de salidas de hembras anidadoras 26 anidadoras a la playa no tienen 24 r = - 0,07, p = 0,26; 22 20 18 16 14 12 10 8 6 4 2 0 0 20 40 60 80 100 120 Precipitaciones (mm) anidaciones coincide con el momento del mayor promedio acumulado de lluvias mensuales. Figura 30. Salida de las hembras anidadoras en función de los acumulados diarios de precipitaciones en la Península de Guanahacabibes. En rojo, línea de tendencia. 500 450 450 400 350 No. Salidas 400 Precipitaciones 350 250 250 200 200 150 150 100 100 50 50 0 0 1999 2001 2002 2003 2004 2005 2006 2007 Meses por temporada de anidación Figura 31. Salida de las hembras anidadoras de C. mydas en función de los acumulados mensuales de precipitaciones en la Península de Guanahacabibes. Precipitación mensual (mm) 300 300 mayo junio julio agosto septiembre mayo junio julio agosto septiembre mayo junio julio agosto septiembre mayo junio julio agosto septiembre mayo junio julio agosto septiembre mayo junio julio agosto septiembre mayo junio julio agosto septiembre mayo junio julio agosto septiembre Freuencia de salidas de hembras 58 RESULTADOS 59 Fueron observadas frecuencias máximas y equivalentes en los intervalos de 10 y 20 días entre el primer y último avistamiento de las hembras en las playas (Fig. 32). El máximo 59 57 55 53 51 48 45 43 41 39 37 35 33 31 29 27 25 23 21 19 17 15 13 11 9 7 5 3 18 16 14 12 10 8 6 4 2 0 1 Frecuencia absoltua de observaciones tiempo observado entre dos avistamientos fue de 59 días. Días entre el primer y último avistamiento Figura 32. Distribución de frecuencias de hembras observadas en las playas respecto al número de días entre el primer y el último avistamiento. La eficiencia en la anidación varía durante la temporada. En general, antes del pico de anidación existe una mayor frecuencia de rastros de reconocimiento y rastros incompletos Reconocimiento Incompleto Completo 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% III V VII III V VII III V VII II IV VI I III V VII I III V VII I III V VII III V VII I III V VII I III V VII I III V VII Frecuencia absoluta de los rastros (Fig. 33). 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 Quincenas por temporada Figura 33. Proporción de cada tipo de rastro de C. mydas por quincena por año en la península de Guanahacabibes, Cuba. Los números romanos indican las quincenas El promedio de huevos por tortuga también se comporta de forma diferente a lo largo de la temporada de anidación ya que desciende en la medida que esta avanza (Fig. 34). RESULTADOS 60 Número de huevos por tortuga 200 175 150 125 100 I II III IV V VI 75 50 25 0 0 10 20 30 40 50 60 70 80 90 100 110 120 130 Días por temporada reproductiva Figura 34. Número de huevos por tortuga en función de los días transcurridos en la temporada y según el número de puestas de cada tortuga para la Península de Guanahacabibes, Cuba. 3.2.3. Durante la noche Las salidas en las playas se producen en horas próximas al pico de marea alta más cercano (Fig. 35), con evidente concentración en las horas anteriores a dicho pico, período Antes más de 12 11 a 12 10 a 11 9 a 10 8a9 7a8 6a7 5a6 4a5 3a4 2a3 1a2 menos de 1 menos de 1 1a2 2a3 3a4 4a5 5a6 6a7 7a8 8a9 9 a 10 10 a 11 11 a 12 120 100 80 60 40 20 0 más de 12 No. de observaciones en el que se produce más del 75 % de las salidas. Después Diferencia de horas entre las salidas de tortugas y la pleamar Figura 35. Salidas de hembras anidadoras de C. mydas con relación a la hora del pico de marea más cercano en la Península de Guanahacabibes, Cuba. Las fases lunares también influyen en el momento de la noche en que salen las tortugas a anidar (Fig. 36). Durante la luna llena, las tortugas salen en las primeras horas de la noche, similar a lo que ocurre durante el cuarto creciente, aunque más cercano a la media noche. Durante las otras dos fases, sin embargo, las salidas de tortugas ocurren a horas más avanzadas. Esto se relaciona directamente con la hora en que se produce la salida de la luna (Fig. 37) Las hembras salen cuando la luna está fuera o cerca del momento de su salida con excepción de la luna nueva. 180 Cuarto creciente Luna llena Cuarto menguante Luna nueva Frecuencia absoluta 160 140 120 100 80 60 40 20 0 20 a 21 a 22 a 23 a 0 a 20:59 21:59 22:59 23:59 0:59 1a 1:59 2a 2:59 3a 3:59 4a 4:59 5a 5:59 6a 6:59 7a 7:59 Intervalos de horario 150 140 130 120 110 100 90 80 70 60 50 40 30 20 10 0 Antes Después Diferencia de horas respecto a la salida de la luna Figura 37. Número de eventos de anidación con relación a la hora de salida de la luna para la Península de Guanahacabibes, Cuba. 12:00 a 12:59 11:00 a 11:59 10:00 a 10:59 9:00 a 9:59 8:00 a 8:59 7:00 a 7:59 6:00 a 6:59 5:00 a 5:59 4:00 a 4:59 3:00 a 3:59 2:00 a 2:59 1:00 a 1:59 0:00 a 0:59 0:00 a 0:59 1:00 a 1:59 2:00 a 2:59 3:00 a 3:59 4:00 a 4:59 5:00 a 5:59 6:00 a 6:59 7:00 a 7:59 8:00 a 8:59 9:00 a 9:59 10:00 a 10:59 11:00 a 11:59 Cuarto creciente Luna llena Cuarto menguante Luna nueva 12:00 a 12:59 Número de obarvaciones Figura 36. Número de eventos de anidación de hembras de C. mydas durante la noche según las fases lunares en la Península de Guanahacabibes, Cuba. RESULTADOS 61 Una vez que la tortuga asciende a la playa, el proceso de la anidación transcurre en tres etapas fundamentales: construcción del nido, oviposición y enmascaramiento de los huevos. Las tres etapas presentan diferencias significativas en cuanto a su duración (Fig. 38). La mayor duración corresponde al proceso de enmascaramiento del nido (una media de 40 minutos). Le siguen en duración la construcción y luego la oviposición. 120 a (174) Frecuencia absoluta F (2,468) = 86,88, p<0,0001 100 b (137) 80 c (160) 60 40 20 0 Construcción Mediana 25%-75% Min-Max Enmascaramiento Oviposición Variables de tiempo de la anidación (min) Figura 38. Comparación de las etapas de anidación de C. mydas en cuanto a su duración para la Península de Guanahacabibes, Cuba. Las letras indican grupos homogéneos estadísticamente. Entre paréntesis el tamaño de la muestra. Se analizaron las etapas de la anidación entre las playas (Tabla 13). La playa Antonio fue la que presentó los mayores tiempos en cada una de las etapas mientras que en La Barca fueron los más bajos, pero la proporción entre todos los tiempos se mantuvo. Tabla. 13. Etapas de la anidación en las cinco playas analizadas en la Península de Guanahacabibes. El tiempo se expresa en minutos. Se presenta la media y su intervalo de confianza. Playas (n) Duración de las etapas de la anidación en minutos ( X ± tS n ) Construcción del nido Oviposición Enmascaramiento Tiempo total Antonio (21) 37,05±0,99 23,62±1,11 54,19±3,52 114,86±3,78 Perjuicio (13) 35,61±2,49 20,69±1,48 41,57±1,80 93,23±3,13 La Barca (5) 26,00±2,15 17,80±2,83 35,88±4,60 74,40±4,49 El Holandés (8) 33,75±3,47 21,50±1,46 50,12±3,84 105,37±5,31 C. Piojos (38) 25,63±0,54 18,47±0,24 46,03±0,88 90,13±1,14 General (85) 35,00±0,56 20,33±0,19 41,89±0,35 97,22±0,67 RESULTADOS 62 El tiempo que permanecen las tortugas en la playa varía en dependencia del éxito en completar la anidación (Fig. 39). Las tortugas que salen a reconocer la playa no llegan, en general, a permanecer más de media hora en la playa. Los rastros incompletos o anidaciones interrumpidas no demoran, en su mayoría, más de una hora. Finalmente, el completamiento del proceso de anidación demora en general cerca de dos horas pero 50 45 40 35 30 25 20 15 10 5 0 más de 6:30 6:00 a 6:29 5:30 a 5:59 5:00 a 5:29 4:30 a 4:59 4:00 a 4:29 3:30 a 3:59 3:00 a 3:29 2:30 a 2:59 2:00 a 2:29 1:30 a 1:59 1:00 a 1:29 0:30 a 0:59 Completo Incompleto Reconocimiento 0:00 a 0:29 Frecuencia arelativa (%) algunas tortugas pueden permanecer más seis horas en la playa. Tiempo (min) Figura 39. Tiempo de permanencia de las hembras de C. mydas en la playa en función del tipo de rastro para la Península de Guanahacabibes, Cuba. 3.3. Características de las hembras anidadoras. Existen diferencias significativas en la frecuencia relativa de los intervalos de Largo Curvo del Carapacho (H(11, 120) =103,01 p <0,01) (Fig. 40). El 60 % de las hembras se encuentra dentro de los intervalos de tallas de 100,1-105 y 105,1-110 cm de Largo Curvo del Carapacho. El intervalo de 100,1-105 cm, que incluye a la media poblacional de 104,49 cm, es el más frecuente en los años 2000 al 2002, 2004 y 2005, mientras que el intervalo de 105,1 -110 cm fue el más frecuente en el resto lo que determina las diferencias encontradas en las medias anuales (F(9,1634) = 1,89, p = 0,049) (Fig. 41). El intervalo de 95,1-100 cm fue igualmente abundante en el año 1998. 550 500 509 Frecuencia absoluta 450 480 400 350 300 250 306 200 150 100 50 0 4 5 <70 156 31 70 70,1 a 8085,1 a 90 90,1 a 95 95,1 a 100 100,1 a 105 105,1 a 110 110,1 a 115 65 14 115,1 a 120 121 a 130 3 131 a 140 1 151 a 160 Largo Curvo del Carapacho (cm) Largo Curvo del Carapacho (cm) Figura 40. Distribución de frecuencias del Largo Curvo del Carapacho para la hembras anidadoras de tortuga verde (C. mydas) de la Península de Guanahacabibes, Cuba. En cada columna se indica el número de tortugas 160 155 150 145 140 135 130 125 120 115 110 105 100 95 90 85 80 75 70 65 60 F(10,1774) = 1,78; p = 0,049 ab (51) 1998a 1998 b (35) 1999a 1999 ab (316) ab (32) 2000a 2000 2001a 2001 Mediana 25%-75% ab (353) a (137) a (89) b (156) 2002a 2003 2003a 2004 2004a 2005 2005a 2002 a (226) Min-Max a (249) a (130) 2006a 2007 2007a 2008 2008a 2006 Temporadas Figura 41. Valor medio anual del Largo Curvo del Carapacho para la población anidadora de tortuga verde (C. mydas) de la Península de Guanahacabibes. Las letras indican los grupos homogéneos estadísticamente. Entre paréntesis el tamaño de la muestra. RESULTADOS 63 En la tabla 14 se encuentran resumidas las medias del resto de las variables morfométricas analizadas. Resalta la similitud entre los valores del Largo Curvo del Carapacho y el ancho del rastro. Los rasgos redondeados de la cabeza de la especie estudiada se reflejan en la semejanza de los valores medios de largo y ancho encontrados. Tabla 14. Media de las medidas morfométricas y el intervalo de confianza para la población de tortuga verde (C. mydas) que anida en la Península de Guanahacabibes. Se incluye también el tamaño de la muestra (N) así como los valores mínimo y máximo encontrados. Medidas (cm) N Largo Curvo del Carapacho Largo Recto del Carapacho Ancho Curvo del Carapacho Ancho Recto del Carapacho Ancho del Rastro Largo de la Cabeza Ancho de la Cabeza Media± 1644 1079 1643 1072 2161 265 67 √ Mínimo 104,49±0,35 95,64±0,43 92,95±0,38 73,57±0,42 107±0,58 19,6±0,35 15,54±0,88 48,00 34,00 41,00 32,00 32,00 14,00 10,00 Máximo 162,00 128,00 120,00 110,00 164,00 32,00 25,00 Se determinó la ecuación de regresión entre las cuatro medidas morfométricas del carapacho analizadas (Tabla 15). Todas las regresiones fueron positivas y estadísticamente significativas. El mayor porcentaje de la variación de la variable X descrito por cada una de las ecuaciones fue del 62 % para el caso de la predicción del LRC a partir del LCC, mientras que la de menor predictibilidad es la ecuación que relaciona el LCC con el ARC con solamente el 20% de la variación descrita mediante la ecuación de regresión. Se destaca el valor similar del coeficiente de determinación (R2) para las ecuaciones que relacionan a LRC con los valores recto y curvo del ancho. Tabla 15. Resultados del ANOVA y ecuaciones de regresión entre las cuatro medidas morfométricas tomadas a ovígeras de tortuga verde (C. mydas) en áreas de anidación de la Península de Guanahacabibes Largo Recto del Carapacho Largo Recto del Carapacho Largo Curvo del Carapacho F(1,140)= 221,58; R²= 0,62; p<0,05 y=5,74 + 0,78x Ancho Curvo del Carapacho F(1,179)= 134,11; R²= 0,43; p<0,05 y=14,20 + 0,65x F(1,140)= 64,07; R²= 0,31; p<0,05 y=33,08 + 0,56x Ancho Recto del Carapacho F(1,138)= 35,21; R²= 0,20; p<0,05 y=12,47 + 0,45x F(1,141)= 64,92; R²= 0,31; p<0,05 y=10,71 + 0,56x Ancho Curvo del Carapacho F(1,138)= 67,45;R²= 0,32; p<0,05 y=17,94 +0,57x El tamaño medio de la nidada para la población de tortuga verde que anida en la Península de Guanahacabibes es de 112,5, aunque fueron encontrados algunos valores extremos bien distantes de la media desde un mínimo de 6 huevos hasta un máximo de 192. RESULTADOS 64 Se encontró una asociación positiva y significativa entre el LCC y el tamaño de la nidada para las tres primeras puestas de las tortugas (Fig. 42A), en las cuales el coeficiente de correlación oscila entre 0,33 y 0,46. Para las otras tres salidas, los valores no fueron significativos, el valor de la potencia en estos casos fue menor a 0,1. Al analizar el comportamiento del tamaño medio de la nidada en función de los intervalos de talla, también se observa un incremento de éste con el aumento de la talla (Fig. 42B) aunque el incremento es mucho más marcado en los primeros intervalos y luego se vuelve asintótico. A I: r2 = 0,15;r = 0,39, p = 0,001;II: r2 = 0,11;r = 0,33,p = 0,05; 2 2 2 2 III: r = 0,21;r = 0,46,p = 0,01;IV: r = 0,16;r =0,40, p = 0,09; V: r = 0,19;r = 0,44, p = 0,19;VI: r = 1,00;r = 1,00, p = 1,00 160 140 120 20 40 60 + 6, 54x 581,0 9 40 I II III IV V VI y=- 60 +3 ,19 x 80 0x + 0 ,6 x 9 ,8 8 + 0,74 4 = y 19 30, 8x x y= 0,8 ,3 4 + 1 ,40 3 + 15 9 = , y 3 -2 = y -22 4,7 4 100 y= Número de huevos 180 80 100 120 140 160 180 Largo Curvo del Carapacho (cm) H (7,1106) = 93,38; p< 0,001 200 Tamaño de la nidada 180 160 140 120 b (2) ab (4) ab (22) ab (267) a (676) a (147) B a (3) a (5) 100 80 60 40 Mediana 20 Min-Max 0 61-70 71-80 81-90 91-100 101-110 111-120 121-130 131-140 Clases de Tallas del LCC (cm) Figura 42. Relación entre el tamaño de la nidada y el Largo Curvo del Carapacho de la hembra. A: Correlación entre las dos variables B: Número de huevos por intervalos de talla de 10 cm considerando el Largo Curvo del Carapacho de las hembras anidadoras de C. mydas de la Península de Guanahacabibes, Cuba. Las letras indican los grupos homogéneos estadísticamente. Entre paréntesis el tamaño de la muestra. RESULTADOS 65 La profundidad del nido no se relacionó de manera significativa con el tamaño de las hembras anidadoras expresado a través del Largo Curvo del Carapacho (Fig. 43A) y tampoco determinó el tamaño de la nidada (Fig 43B). r = 0,10, p = 0,44; Potencia= 0,11 r = 0,10, p = 0,43; Potencia= 0,25 90 180 A Número de huevos (N.H.) Profundidad del nido (cm) 100 80 70 60 50 40 30 92 94 96 98 100 102 104 106 108 110 112 114 116 118 120 122 160 B 140 120 100 80 60 40 30 40 Largo Curvo del Carapacho (cm) 50 60 70 80 Profundidad (cm) Figura 43. Relación entre la profundidad del nido y el Largo Curvo del Carapacho de la hembra. (A) y con el tamaño de la nidada (B) para la población anidadora de tortuga verde (C. mydas) de la Península de Guanahacabibes, Cuba. El número medio de intentos de anidación y anidaciones efectivas es similar (Tabla 16) lo cual se corresponde con el predominio de tortugas que fueron observadas solamente una vez durante la temporada de anidación (Fig. 44). No obstante, existen diferencias en los máximos de tortugas que ascienden a la playa y las que concluyen con éxito la anidación. Tabla 16. Número medio de intentos de anidación y anidaciones efectivas para cada temporada de anidación desde el 2001 en la Península de Guanahacabibes, Cuba. También se presentan los valores máximo y los límites de confianza (±tS√ ) 2001 Media± tS√ 1,54±0,72 No. de intentos/ (n) (11) hembra máximo 4 No. de nidos/ hembra Media± tS√ 1,5±0,64 (n) (8) máximo 3 2002 2003 2004 2005 2006 2007 2,39±0,32 (172) 13 2,62±0,61 1,91±0,37 1,42±0,14 2,19±0,34 1,99±0,26 (34) (66) (94) (110) (126) 6 8 4 11 7 1,94±0,22 (158) 6 2,22±0,49 1,60±0,23 1,40±0,15 1,81±0,21 1,76±0,22 (32) (62) (83) (100) (116) 5 4 4 5 6 Se destacan, en particular, los años 2002, 2004 y 2006 en los que son mayores las diferencias entre los intentos de anidación y el número de nidos por hembra. El máximo número de salidas por hembra fue observado en el año 2002 (13) y coincide con el mayor número de anidaciones (6) aunque un número similar de anidaciones se encuentra en el año 2007 a pesar del menor número de intentos por hembra. 90 Frecuencia absoluta RESULTADOS 180 160 140 120 100 80 60 40 20 0 66 Salidas Nidos I III 2001a I III V VII IX XI XIII II 2002a IV VI 2003a II IV VI VIII II 2004a IV 2005a II IV VI VIII X 2006a I III V VII 2007a Salidas/tortuga/año Figura 42. Distribución de frecuencia de los intentos de anidación y anidaciones efectivas por tortuga para la Península de Guanahacabibes, Cuba, en las temporadas del 2001 al 2007. 3.4. Fidelidad al sitio de anidación Se determinó el grado de fidelidad al sitio de anidación de todas las hembras marcadas dentro y entre las temporadas de anidación (Fig. 45). De las 1652 observaciones de hembras marcadas, 692 fueron en más de una ocasión. Solamente 44 de 692 anidaron en más de una playa durante una misma temporada lo que representa el 6,3 % del total. El 99 % de estos movimientos se realizó a distancias menores de 25 km y el 80% a distancias menores de 15 km. De las 113 remigrantes observadas, 12 regresaron a una playa diferente, es decir, el 10,6 %, el 70% de estas observaciones se produjeron después del impacto del huracán Iván. Los movimientos dentro de la Península fueron más frecuentes en la dirección Oeste-Este. La mayoría de los desplazamientos en la dirección opuesta ocurrieron durante el mes de julio. Antonio (14) y La Barca (13) presentaron el mayor número de desplazamientos de hembras a otras playas. La relación entre la dirección del rastro y el éxito de la anidación mostró dos rasgos importantes: que sobresale el valor de frecuencia de los rastros en dirección este-oeste respecto a los otros tipos de rastro y que no se observan los rastros rectos en la categoría de reconocimiento (Fig. 46A). Distancia (km) Este-Oeste 1 2 6 7 8 13 15 17 18 21 28 40 Total general Distancia (km) 7 1 20 Este-Oeste Oeste-Este 9 1 11 Mes E-O O-E junio 3 16 1 20 11 10 3 24 julio agosto Total general A 1 1 3 1 24 2 2 B 4 3 25 1 40 Total 3 2 1 2 2 1 7 6 8 15 Oeste-Este 1 3 1 6 6 Figura 45. Desplazamientos de hembras marcadas de tortuga verde desde la playa donde fueron marcadas hacia otras playas de la Península de Guanahacabibes dentro de la temporada de anidación (A) y entre temporadas (B). El número sobre cada trayectoria representa el número de tortugas que las siguieron. El color de las trayectorias coincide con la playa de origen. En las tablas se presentan las frecuencias absolutas de desplazamientos en dependencia de la distancia recorrida y la dirección seguida. Se presenta también la dirección de los desplazamientos por mes. RESULTADOS 67 De la misma forma, existe una desproporción entre los rastros de este a oeste con relación al resto para el caso de la primera salida de la tortuga (Fig 46B). De la segunda salida de la Este-Oeste Oeste-Este Recto A 80 No. de hembras 180 160 140 120 100 80 60 40 20 0 B Este-Oeste Oeste-Este Recto V VI 70 60 50 40 30 20 10 0 Completo Incompleto I Reconocimiento II III IV VII No. de salida/tortuga Tipo de rastro Figura 46. Distribución de frecuencia de la dirección de los rastros de las hembras anidadoras en dependencia del tipo de rastro (A) y el número de intentos de anidación (B) para la población anidadora de Tortuga Verde en la Península de Guanahacabibes, Cuba. A escala local, se determinó la preferencia de las tortugas por anidar en el mismo sector de la playa (Fig. 47). El 52,58 % de las tortugas analizadas anidó en el mismo sector de la playa. Otro 40,53 % lo hizo en un sector diferente, de las cuales la mitad lo hizo en un sector adyacente al primero. Frecuencia relativa (%) No. de hembras tortuga en adelante existe mayor proporción entre ambas direcciones. 70 65 60 55 50 45 40 35 30 25 20 15 10 5 0 Otra playa Otro sector Mismo sector II III IV V Mismo año Número de salida VI I Otro año Figura 47. Fidelidad de hembras marcadas de C. mydas a los sectores de la playa donde fueron marcadas y desplazamientos hacia otras playas de la Península de Guanahacabibes, Cuba, dentro de la temporada de anidación y entre temporadas. RESULTADOS 68 3.5. Características genéticas de las poblaciones La secuencia parcial estudiada de 742 pb de la región control del ADNmt, involucra 14 sitios polimórficos (Tabla 17). Tabla 17. Sitios polimórficos de secuencias parciales (742 pb) de la región de control del ADNmt de C. mydas, determinados en la muestra de colonias anidadoras de la región suroccidental de la plataforma cubana. En negrita y color rojo se resaltan los sitios segregativos. El símbolo de (+) representa una adición de 6pb (CAATGG). Haplotipos: CM-A1 – 3 (Allard et al., 1994); CM-A12-18 (Encalada et al., 1996); CM-A27 y 28 (Bjorndal y Bolten, inscritos en el GenBank 2001); A34 (Bjorndal y Bolten, inscrita en base de datos del Centro “Archie Carr”); CM-A48, 56 y 57 (Espinosa et al., inscritos en el GenBank 2003). A partir de los polimorfismos encontrados en el sitio 693 por la extensión del tramo de secuencia, se subdividieron los haplotipos originales en .1 y .2 96 133 149 250 272 284 367 371 410 431 433 470 493 693 CM-A1.1 CM-A1.2 CM-A3.1 CM-A3.2 CM-A12 CM-A13.1 CM-A13.2 CM-A18.1 CM-A18.2 CM-A27.1 CM-A27.2 CM-A28 CM-A34 CM-A48.1 CM-A48.2 CM-A56 CM-A57 N 93 Sitios polimórficos Haplotipo 23 10 78 4 1 7 3 3 1 25 1 2 2 35 2 1 1 C C T T C C C C C C C T C C C C T A A A A G A A G G A A A A A A A A G G G G G G G G G G G G G G G G G G G G G G A A G G G G G A G G A A T T T T C C C T T C C C C T T T T C C C C T C C C C C C C C C C C C T T T T G T T T T T T T T T T T T G G G G A G G G G G G G G G G G G G G G G G G G G G G G G A G G G G T T T T C T T T T T T T T T T T T A A A A G A A A A A A A A A A A A G G G G A G G G G G G G G G G G G + + - A A A A G A A A A A A A A A A A A A A A A A A A A Estos se descomponen en 11 transiciones, 1 transversión y 2 inserciones/ deleciones. Seis de los haplotipos encontrados se subdividen en 2 variantes genéticas nuevas a partir de los cambios observados en el sitio 693, que involucra un indel de A, por lo que el total de variantes asciende a 17 en áreas de anidación y las variantes CM-A16 y CM-A20 de áreas de alimentación (Anexo 7). Con la excepción del haplotipo CM-A1, el resto de los haplotipos subdivididos tuvo una variante mucho más abundante que la otra. Existe una gran interrelación entre los haplotipos encontrados en el presente estudio, como se observa en el dendrograma no enraizado de máxima parsimonia elaborado (Fig. 48). La diferencia entre la mayoría de los haplotipos es solamente de un cambio y de tipo transicional. Solamente en los casos de CM-A18.2 a CM-A48.2 existen dos cambios de diferencia y en el caso de CM-A27 a CM-A12 se constatan siete cambios. Las inserciones consisten en la adición de seis pares de bases (CAATGG) y de una adenina respectivamente. Figura 48. Red de parsimonia estadística tomando en cuenta los haplotipos encontrados en sitios de anidación de Cuba. Las flechas se emplean para señalar la dirección considerada para especificar los cambios entre los haplotipos. RESULTADOS Los nueve loci microsatélites analizados tuvieron una variabilidad mínimo de 4 alelos hasta un máximo de 17 (Fig. 49). 69 que varió desde un En las poblaciones de Guanahacabibes y Cayo Largo el número promedio de alelos fue superior a 10, mientras que en San Felipe fue menor con 5,4 alelos como promedio. En los loci Cm84, OR2 y OR3 los alelos intermedios fueron más abundantes, en Ei8 y OR1 fueron los alelos pequeños y finalmente en Cc117 predominaron los alelos con un gran número de repeticiones y predominó la distribución unimodal (Fig. 49). En Cm58 y OR8 la distribución fue bimodal, con mayor frecuencia de los alelos pequeños e intermedios. Los loci OR1, OR2, OR3 y CM58 fueron selectivamente neutrales en todas las poblaciones (Anexo 2). Los loci Ei8, Or8 y CM84 tuvieron algunas poblaciones alejadas de la neutralidad y en el caso de Cc117 esto último ocurrió en todas prácticamente todas las poblaciones por lo que fue excluido en los análisis de diferenciación. Del análisis efectuado a las 199 muestras de C. mydas provenientes de 6 sitios de anidación dentro de la plataforma cubana, fueron encontrados 17 haplotipos (Fig. 50 y Tabla 18). Tabla 18. Distribución de haplotipos de secuencias parciales (742 pb) de la región de control del mtDNA de C. mydas, en áreas de anidación del suroccidente de Cuba. Nota: Haplotipos CM-A1 – 3 (Allard et al., 1994); CM-A12-18 (Encalada et al., 1996) ; CM-A27, 28 y 34 (Bjorndal y Bolten, inscritos en el GenBank 2001); CM-A48, 56 y 57 (Espinosa et al., inscritos en el GenBank 2003) San Felipe La Isla Cayo Largo 1 2 1 1 2 1 1 1 13 1 12 1 5 5 3 2 21 5 16 1 1 1 2 4 1 1 2 1 2 1 1 1 1 1 CM-A57 24 5 19 1 1 CM-A56 6 5 1 1 1 7 1 CM-A48.2 2 CM-A48.1 1 2 1 1 CM-A34 CM-A13.2 1 CM-A28 CM-A13.1 2 CM-A27.2 CM-A12 2 10 10 CM-A27.1 CM-A3.2 2 2 2 8 1 32 CM-A18.2 CM-A3.1 16 4 3 1 3 3 CM-A18.1 CM-A1.2 Guanahacabibes Localidad Caleta de los Piojos Centro La Barca El Holandés Oriente Perjuicio Antonio Las Canas CM-A1.1 Haplotipos 1 1 N 42 26 21 5 73 17 56 3 11 10 34 Occidente Centro Antonio Perjuicio San Felipe Isla cayo largo 0,60 0,40 0,20 102,30 (66) p(a)=0,02 Frecuencia relativa Frecuencia relativa 0,80 0,00 124 128 136 152 164 166 0,40 0,35 0,30 0,25 0,20 0,15 0,10 0,05 0,00 198,37 (90) p(a)=0,00 180 112 150 154 156 160 164 OR1 166,07 (54) p(a)=0,00 0,40 0,30 0,20 0,10 0,00 132 152 156 160 166 170 1,00 0,90 0,80 0,70 0,60 0,50 0,40 0,30 0,20 0,10 0,00 178 180 178 97,89 (42) p(a)=0,00 123 125 OR3 Frecuencia relativa 172 OR2 Frecuencia relativa Frecuencia relativa 0,50 168 133 135 Ei8 0,40 0,35 0,30 0,25 0,20 0,15 0,10 0,05 0,00 198,98 (114) p(a)=0,00 128 130 134 136 142 144 146 150 152 154 156 158 160 162 164 166 Frecuencia relativa OR8 0,35 0,30 0,25 0,20 0,15 0,10 0,05 0,00 173,56 (132) p(a)=0,01 36 62 130 132 134 144 148 150 152 154 156 158 cm58 Figura 49. Frecuencias alélicas de los ocho loci analizados para las siete poblaciones de anidación de la región occidental del Archipiélago cubano. Se muestra el valor de Chi-cuadrado calculado para comparar las frecuencias alélicas entre playas. 160 188 Frecuencia relativa 0,40 0,35 0,30 0,25 0,20 0,15 0,10 0,05 0,00 354.07 (162) p(a)=0,00 128 134 136 138 144 166 174 230 232 234 236 240 242 244 264 270 288 Frecuencia relativa CM72 0,40 398.15 (138) p(a)=0,00 0,30 0,20 0,10 0,00 300 310 322 324 326 328 330 332 334 336 338 340 342 344 346 CM84 Figura 49. (Cont.) Frecuencias alélicas de los nueve loci analizados para las seis poblaciones de anidación de la región occidental del archipiélago cubano. Se muestra el valor de Chi-cuadrado calculado para comparar las frecuencias alélicas entre playas. Centro A48.2 A48 A3.1 A56 A57 A1.1 Oriente A1.1 A48.2 A1.2 A48 A18 A3.2 A3.2 A3.1 A28 A1.2 A13.1 A27 A18 Occidente A48 A1.1 A27 A3.1 A1.2 A13.1 A27.2 A12 A27 A13.2 A28 San Felipe A48.2 A48 A3.1 Isla. Guanal A3.2 A27 A34 A3.1 A27 Cayo Largo A13.1 A3.1 A13.2 Figura 50. Distribución y frecuencia relativa de los haplotipos de C. mydas en las áreas de anidación de la plataforma suroccidental. 348 RESULTADOS 70 Los haplotipos encontrados se distribuyen diferencialmente entre las áreas de anidación (Fig. 50). Se observan gradientes longitudinales en la frecuencia de los haplotipos más abundantes. Los haplotipos CM-A3.1, CM-A1.2, CM-A13.1 y CM-A48.2 incrementan su frecuencia de las colonias occidentales hacia las orientales, y lo inverso ocurre con el CMA27. La Isla de la Juventud presenta un haplotipo exclusivo, el CM-A34. El haplotipo CMA48, el endémico mejor representado de la región suroccidental de Cuba, se distribuye en frecuencias similares entre las playas de Guanahacabibes y San Felipe, aunque no se observa en la Isla de la Juventud ni en Cayo Largo. A pesar de que la región occidental de Guanahacabibes posee el mayor número de haplotipos (13 considerando las nuevas variantes), cuatro de ellos considerados exclusivos, y un haplotipo del linaje del Atlántico Sur, los mayores valores de diversidad haplotípica y nucleotídica aparecen en la colonia del sur de la Isla de la Juventud (Tabla 20). Por el contrario, Cayo Largo es la de menor variabilidad con sólo tres haplotipos, pero dos de ellos en muy baja frecuencia. La presencia de CM-A12 determina que la región del occidente de Guanahacabibes posea el mayor número de sitios segregativos, aunque ocho de ellos diferencian a esta única secuencia. Los estadísticos de neutralidad (D y Fs) indican que las sustituciones en las secuencias son neutrales. Tabla 20. Estadígrafos genéticos de las áreas de anidación de la plataforma suroccidental de Cuba. D, Prueba de Tajima; Fs, Prueba de Fu; H, número de haplotipos; Ĥ, diversidad haplotípica; n, tamaño de la muestra; p, probabilidad; s, sitios segregativos; η, diversidad nucleotídica;θ, estimador de theta Figura 51. Relación entre la diversidad haplotípica (Ĥ) y la diversidad nucleotídica (π) 0,0020 Playa n H π̂ n± s η Ĥ ± DE( Ĥ ) DE( π̂ n) 0,69± Occidente 43 13 0,06 0,65± Centro 26 8 0,06 0,69± Oriente 66 9 0,03 0,41± San Felipe 11 3 0,13 Isla de la 0,79± 10 5 Juventud 0,16 0,06± Cayo Largo 34 3 0,05 0,0017± 0,00050 0,0012± 0,00081 0,0012± 0,00062 0,0005± 0,00018 0,0019± 0,00012 0,0002± 0,00015 D (p)/ Fs (p) 1 13 3 0,58(p>0,10)/ -0,25 (p>0,10) 6 6 -0,36(p>0,10)/ -1,04( p>0,10) 0,20(p>0,10)/ -1,02( p>0,10) 0,54 (p>0,10)/ 0,73( p>0,10) -0,38(p>0,10)/ -0,45( p>0,10) -1,50(p>0,10)/ -0,51( p>0,10) 6 6 3 3 5 5 2 2 Diversidad nucleotídica (π) 0,0018 Isla de la Juventud Occidente 0,0016 0,0014 Antonio 0,0012 Centro 0,0010 Perjuicio 0,0008 0,0006 0,0004 Cayo Largo San Felipe 0,0002 0,0000 0,0 0,2 0,4 0,6 Diversidad haplotípica (Ĥ) 0,8 1,0 RESULTADOS 71 La relación que se observa entre la diversidad haplotípica y la nucleotídica apuntan a que Occidente y la Isla de la Juventud son las áreas donde se concentra la mayor variabilidad mientras que en Cayo Largo y San Felipe son las colonias menos variables (Fig. 51) Los valores de la heterocigosidad observada en los loci microsatélites son altos, por encima del 70 % en el 82 % de los casos y superior al 80 % en el 55 % de las observaciones (Tabla 21). A pesar de la variabilidad encontrada, muy pocos alelos fueron exclusivos de cada población, aunque sí varió su frecuencia (Fig. 49). Predominan alelos de baja frecuencia que pueden representar más de la mitad de los alelos en algunas poblaciones (10 de 16 en el oriente de Guanahacabibes). El estadígrafo Fis mostró algunas desviaciones significativas del equilibrio de HardyWeinberg, para los loci OR2, Or8 y Cc117 en varias de las poblaciones (Tabla 22). El análisis del desequilibrio de ligamiento indica independencia entre la mayoría de los loci en todas las poblaciones, excepto para el centro de Guanahacabibes (Tabla 23). Los loci OR8 y cm58 se encuentran ligados en 4 de las siete poblaciones. Tabla 23. Valores de probabilidad obtenidos a partir de las pruebas de desequilibrio de ligamiento con 10000 permutaciones por pares de loci microsatélites para todas las áreas de anidación de C. mydas del suroccidente de Cuba. Guanahacabibes Occidente Ei8-OR2 0,95 Ei8-OR8 0,45 OR2-OR8 0,10 Ei8-cm58 0,09 OR2-cm58 0,31 0,04 OR8-cm58 Ei8-OR3 0,38 OR2-OR3 0,25 0,01 OR8-OR3 cm58-OR3 0,17 Centro 0,09 0,97 0,40 0,35 0,67 0,00 0,71 0,75 0,04 0,01 Antonio Perjuicio San Felipe 0,80 0,31 0,46 0,27 0,81 0,86 0,04 0,54 0,43 0,56 0,11 0,13 0,69 0,32 0,05 0,02 0,03 0,95 0,22 0,41 0,55 0,30 0,92 0,37 0,30 0,05 0,11 0,02 0,36 0,09 I. Juventud 0,64 0,43 0,48 0,20 0,27 0,10 0,85 0,54 0,13 0,14 Cayo Largo 0,70 0,35 0,82 0,46 0,24 0,01 1,00 0,08 0,12 0,14 Tabla 21. Valores de heterocigosidad esperada (He), observada (Ho) y número de alelos (Na) por locus para cada una de las poblaciones de la región suroccidental del archipiélago cubano. En rojo los valores correspondientes a resultados significativos de la prueba de equilibrio genético mediante la estimación de Fis Guana.Occidente Guana.Centro Guana.Antonio Guana.Perjuicio San Felipe N Ho/He Na Isla de la Juventud N Ho/He Na Cayo Largo N Ho/He Na N Ho/He Na N Ho/He Na N Ho/He Na N Ho/He 45 43 39 37 0,73/0,61 0,68/0,90 0,79/0,63 0,76/0,91 Na 47 37 38 46 53 51 52 51 0,71/0,63 0,83/0,87 0,65/0,53 0,80/0,76 6 14 6 11 41 39 39 41 0,90/0,63 0,97/0,92 0,92/0,63 0,95/0,94 3 15 7 16 69 68 64 65 0,71/0,62 0,88/0,91 0,75/0,64 0,75/0,89 5 16 7 15 17 16 13 16 0,88/0,64 1,00/0,92 0,92/0,61 0,95/0,87 3 13 3 11 0,88/0,84 0,72/0,85 11 42 0,92/0,86 10 68 0,77/0,86 13 42 0,81/0,90 14 68 0,67/0,91 11 15 0,67/0,84 9 16 17 0,54/0,87 8 10 0,90/0,77 7 10 0,80/0,75 6 14 0,87/0,85 11 43 0,76/0,93 11 14 0,92/0,86 11 43 0,84/0,85 12 0,91/0,88 0,80/0,83 11 41 0,88/0,90 13 70 0,86/0,89 7 41 0,61/0,74 7 70 0,73/0,74 13 13 0,90/0,84 9 7 11 0,72/0,72 5 9 8 14 0,86/0,79 8 15 0,60/0,81 6 Locus Ei8 CM84 OR1 CM72 OR2 OR8 cm58 OR3 10 10 8 8 0,70/0,57 0,60/0,73 0,87/0,68 0,60/0,72 3 5 4 5 1,00/0,79 7 0,75/0,68 5 15 15 15 14 0,86/0,54 0,73/0,84 0,80/0,64 0,67/0,86 3 9 5 10 5 16 4 14 40 0,92/0,88 13 38 0,82/0,85 6 Tabla 22. Estimados de Fis por locus y por poblaciones, utilizados para probar la significación del equilibrio de Hardy-Weinberg, luego del ajuste del nivel de signifiación al 5% (α =0.0008, 100 comparaciones) a través de 100, 000 permutaciones, utilizando Fstat 2.93 Península de Guanahacabibes Locus Fis P(a) Fis P(a) Fis P(a) Fis P(a) Fis P(a) Isla de la Juventud Fis P(a) Ei8 CM84 OR1 CM72 OR2 OR8 cm58 OR3 Total -0,104 0,055 -0,200 -0,046 -0,040 0,159 -0,079 0,003 -0,020 0,194 0,892 0,048 0,352 0,307 0,997 0,101 0,595 0,213 -0,533 -0,050 -0,38 -0,020 -0,062 0,116 0,044 0,187 -0,061 0,001 0,224 0,001 0,445 0,208 0,991 0,867 0,991 0,005 -0,341 -0,084 -0,574 -0,127 0,241 0,462 -0,112 0,048 -0,03 0,033 0,287 0,011 0,124 0,995 1,000 0,283 0,762 0,243 -0,164 0,089 -0,171 0,180 0,134 0,267 0,043 0,019 0,069 0,023 0,993 0,009 1,000 0,999 1,000 0,884 0,664 1,000 -0,313 0,234 -0,225 0,533 -0,117 -0,007 -0,210 -0,037 -0,003 0,215 0,952 0,297 0,998 0,398 0,681 0,160 0,649 0,512 -0,583 0,168 -0,213 0,269 0,019 -0,027 -0,065 0,292 0,019 Occidente Centro Antonio Perjuicio San Felipe 0,009 0,979 0,148 0,998 0,777 0,615 0,446 0,995 0,645 Cayo Largo Fis P(a) -0,174 0,284 -0,232 0,328 0,112 0,009 -0,031 0,112 0,073 0,069 1,000 0,011 1,000 0,983 0,654 0,383 0,937 1,000 RESULTADOS 72 3.6. Diferenciación genética Aunque se observan algunas variaciones en cuanto a la frecuencia de los haplotipos a lo largo de los años para la Península de Guanahacabibes, las frecuencias relativas no Frecuencia relativa de haplotipos mostraron diferencias significativas (H (6, 119) = 9,97 p =0,13) (Fig 52). 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% 1998 2000 2002 (21) (17) (17) 2004 2005 2006 (6) (18) (51) 2007 A57 A56 A48.2 A48.1 A28 A27.2 A27.1 A18 A13.2 A13.1 A12 A3.2 A3.1 A1.2 A1.1 (40) Temporadas Figura 52. Frecuencia haplotípica por año para la población anidadora de C. mydas de la Península de Guanahacabibes, Cuba. Entre paréntesis el tamaño de la muestra por año. Las hembras marcadas que fueron observadas en más de una temporada correspondieron en su mayoría con variantes endémicas de Cuba (A27 y A48) (Tabla 24). Tabla 24. Número de hembras marcadas con haplotipos conocidos que fueron observadas en más de una temporada. No. Temporadas A1.1 2 3 Total de hembras por haplotipo 1 A1.2 A3.1 A3.2 A18 A27.1 A48.1 1 2 2 1 2 5 1 1 2 2 3 6 1 1 1 Total de hembras remigrantes 12 4 La ausencia de diferencias estadísticas en el tiempo permitió agrupar las muestras de todos los años de cada área de anidación para el análisis de secuencias. No ocurrió lo mismo con los microsatélites. Algunos de los loci, en dependencia de la población, mostraron estructuración entre años (Anexo 3). Las principales diferencias se encuentran entre los años 2006 y 2007 con el resto de los años. Para evitar un efecto confundido en el análisis por población, las muestras de los años que presentaron diferencias significativas fueron excluidas en los análisis de diferenciación espacial. La mayor diferenciación existe entre el occidente de Guanahacabibes y Cayo Largo. El centro y oriente de Guanahacabibes no se diferencian entre sí ni con San Felipe (Tabla RESULTADOS 73 25). De manera que se logran delimitar cuatro regiones: occidente de Guanahacabibes, centro y oriente con San Felipe, Isla de la Juventud y finalmente Cayo Largo. Tabla 25. Comparación de las áreas de anidación de C. mydas de la plataforma suroccidental de Cuba, a partir de haplotipos de la RNC del mtDNA (747 pb). Arriba de la diagonal: comparación de las frecuencias 2 haplotípicas empleando la Prueba X corregido por el procedimiento de Bonferroni a través del método Monte Carlo (5000 2 simulaciones). El primer número se corresponde con el valor de X , los grados de libertad (entre paréntesis) seguido de la probabilidad (/ valor). Debajo de la diagonal: número absoluto de migrantes intercambiados por generación en la parte superior y entre paréntesis valor corregido en función de la distancia molecular, prueba de diferenciación por pares de colonias de anidación (Fst) basada en permutaciones no paramétricas, seguida de la probabilidad (/ valor). Las celdas en gris corresponden con los pares de colonias donde no se detectaron diferencias significativas Localidad Isla de la Juventud Centro Oriente San Felipe Occidente 23,54(13)/ 0,03 36,79 (13)/ <0,001 28,17(12) /<0,01 27,83(12) /<0,001 59,52(11) /<0,001 Occidente (sin A12) 22,80 (12)/ 0,03 36,13 (12)/ <0,001 27,49(11) /<0,01 27,19(11) /<0,001 58,56(10) /<0,001 10,24 (10)/ 0,42 ns 9,47(8) / 0,30 ns Centro Oriente San Felipe Isla de la Juventud Cayo Largo Occidente Guanahacabibes Occidente (sin A12) 14,83 (8,84) 0,66/<0,001 9,63 (9,28) 0,86/ <0,001 4,82 (1,68) 0,22/ <0,001 9,28 (0,96) 0,34/ <0,001 1,14(0,81) 0,56/ <0,001 10,77 (7,29) 0,59/<0,001 10,30 (6,12) 0,75/<0,001 4,84 (1,51) 0,24/<0,001 8,98 (0,83) 0,37/<0,001 1,11 (0,42) 0,54/<0,001 524,06 (169,74) -0,02/ 0,46ns 18,33 (9,00) 0,068/ 0,13ns 7,91 (1,66) 0,42/ <0,001 2,14 (1,50) 0,35/ <0,001 19,82 (8) /0,01 Cayo Largo 29,36(8) /<0,001 11,07 (10) /0,35 ns 42,32 (11) /<0,001 34,05 (10) /<0,001 17,51 (16,92) 0,075/ 0,09ns 9,30 (3,27) 0,42/ <0,001 2,92 (2,48) 0,35/ <0,001 17,37 (6) /<0,01 2,59 (0,65) 0,57/ <0,001 8,41 (3,39) 0,13/ <0,001 10,21 (4) /0,03 33,11 (4) /<0,001 0,85 (0,29) 0,71/ <0,001 El número de hembras intercambiadas entre las colonias, no supera a los 10 animales por generación en la mayoría de los casos (0,5 animales por año). Las regiones central y oriental de Guanahacabibes son las de mayor intercambio con más de 500 hembras por generación (25 animales por año). La dirección del intercambio fue fundamentalmente de las colonias occidentales hacia las orientales (Tabla 26). Centro y San Felipe, sin embargo, reciben migrantes de San Felipe y Cayo Largo respectivamente, ubicadas al este de las primeras. Población fuente Tabla 26. Tasas de migración entre poblaciones considerando la dirección del flujo (de poblaciones fuente a poblaciones sumideros). En rojo se destacan los valores diferentes de cero. 1: Occidente 2: Centro 3: Oriente 4: San Felipe 5: I. Juventud 6: CayoLargo Población sumidero 1 2 3 4 5 6 ------ 1,5 x105 2,1 x105 0,00 0,00 0,00 0,00 ------0,00 0,00 0,00 0,00 0,00 0,00 ------- 3,3 x105 0,00 0,00 5 0,00 3,9 x10 0,00 ------0,00 0,00 0,00 0,00 0,00 0,00 ------- 2,9 x105 0,00 0,00 0,00 8,3 x106 0,00 ------ 3 1 2 4 5 6 RESULTADOS 74 Las regiones analizadas mostraron una diferenciación significativa cuando se calcula el estadígrado Fst con los microsatélites con la excepción de Perjuicio con Antonio, la Isla y Cayo Largo (Tabla 27). Tabla 27. Comparación entre áreas de anidación de C. mydas de la plataforma suroccidental de Cuba, a partir de nueve loci microsatélites. Arriba de la diagonal: Valores de Rst y su probabilidad. Debajo de la diagonal: índice de diferenciación por pares de colonias de anidación (Fst) basada en permutaciones no paramétricas, seguida de la probabilidad (valor), su significación a partir del método de remuestreo Jacknife y debajo el número de migrantes. Las celdas en gris corresponden con los pares de colonias donde no se detectaron diferencias significativas Rst (Pa) Fst (Pa) Occidente Nm Occidente 0,08(0,01)* Centro 8,00 0,07(0,01)* Antonio 9,53 0,04(0,01)* Perjuicio 9,40 0,09(0, 01)* San Felipe 3,73 0,10(0,01)* Isla 7,35 0,06(0,01)* Cayo Largo 10,88 Centro 0,39(<0,01) 0,26(0,01)* 23,16 0,14(0,01)* 9,79 0,25(0,01)* 6,01 0,28(0,02)* 19,96 0,24(0,01)* 22,71 Antonio Perjuicio San Felipe Cayo Largo Isla 0,36 (0,02) 0,05(< 0,01) 0,17(0,02) 0,34(<0,01) 0,36(<0,01) 0,53(<0,01) 0,80(<0,01) 0,90(<0,01) 0,89(<0,01) 0,86(<0,01) 0,20 (0,17) 0,11(<0,01) 0,00(0,43) 0,07(0,02) 0,05 (<0,01) 0,18(<0,01) 0,20(<0,01) 0,06 (0,05) 0,03(0,10) 0,04(0,01)ns 12,26 0,05(0,01)* 6,02 0,03(0,02)* 21,68 0,02(0,01)* 19,85 0,05(0,01)* 4,78 0,04(0,02)ns 10,83 0,04(0,02)ns 24,12 0,02(0,01)* 6,12 0, 04(0,01)* 7,76 0,02(0,13) 0,02(0,01)* 19,68 Considerando el Rst, se mantiene la similitud entre Antonio y Perjuicio. Además, se asocian las tres colonias al este del archipiélago y la Isla de la Juventud, en particular, no se diferencia de Antonio. Las frecuencias alélicas también presentan diferencias significativas entre las poblaciones en dependencia del locus empleado (Anexo 4). Al comparar con los microsatélites muestras del mismo haplotipo se observaron diferencias significativas entre algunas de ellas, especialmente con el haplotipo mayoritario A3. Sin embargo, con el el A48, no se encuentran diferencias entre las poblaciones (Tabla 28). Empleando solamente los cinco loci microsatélites menos variables (OR2, OR3, OR8 Cm58 y Ei8), se obtiene la ubicación de las muestras en su población correspondiente con una precisión que va desde el 44 % en el caso del occidente de Guanahacabibes hasta el 100 % para San Felipe (Tabla 29). No obstante, la capacidad de asignación se incrementa al aumentar a ocho el número de loci con valores superiores al 70 %. Al emplear métodos bayesianos para identificar las poblaciones, se logra distinguir cuatro agrupamientos fundamentales: Occidente, Centro, Perjuicio +Antonio y San Felipe+Isla de la Juventud+Cayo Largo (Fig. 53). Las diferencias genéticas encontradas para el ADN mitocondrial están relacionadas con la distancia geográfica que existe entre las colonias a la escala analizada (Fig. 54A). Sin embargo, no se encuentra una asociación significativa entre ellas con los microsatélites. Tabla 28. Comparación de individuos con haplotipos idénticos por pares de colonias de anidación de C. mydas de la plataforma suroccidental de Cuba, a partir de nueve loci microsatélites. Prueba de diferenciación por pares de colonias de anidación (Fst) basada en permutaciones no paramétricas, seguida de la probabilidad (valor). Izquierda superior: haplotipo correspondiente A3 Fst (Pa) Centro Perjuicio Antonio Cayo Largo A1 Fst (Pa) Centro Occidente Perjuicio Occidente 0,049 (0,01) 0,039 (0,07) 0,010 (0,09) 0,014 (0,09) Antonio Centro Perjuicio 0,074 (0,02) 0,023 (0,01) 0,020 (0,01) 0,035 (0,02) 0,032 (0,01) Centro 0,005 (0,32) 0,025 (0,03) 0,031 (0,18) A27 Fst (Pa) Antonio Occidente Occidente 0,038 (0,01) 0,059 (0,06) Antonio 0,034 (0,08) 0,02 (0,04) 0,018 (0,01) A48 Fst (Pa) Occidente Centro Antonio Centro Antonio Perjuicio 0,005(0,29) 0,001(0,47) 0,032 (0,01) 0,000(0,47) 0,020(0,09) 0,011(0,23) Tabla 29. Porcentaje de asignación de las muestras a cada población para cinco (izquierda) y ocho (derecha) loci microsatélites. Poblaciones asignadas Caleta Barca Poblaciones originales Antonio Perjuicio San Felipe Isla Cayo Largo Caleta 47,17/71,7 7,55/7,55 11,32/1,89 5,67/1,89 1,89/0 13,21/7,55 13,21/9,43 Barca 14,28/4,76 64,28/80,95 7,14/4,76 2,38/2,38 2,38/0 4,76/4,76 4,76/2,38 Antonio 5,88/5,88 0/0 82,35/88,23 5,88/5,88 0/0 0/0 5,89/0 Perjuicio 9,59/2,74 47,94/67,12 5,48/1,37 12,33/0 0/4,11 6,85/1,37 17,81/10,96 San Felipe 0/0 0/0 0/0 0 100/100 0/0 0/0 Isla Cayo Largo 0/0 0/0 0/0 6,67/0 6,67/0 80/93,33 6,67/6,67 6,67/15,56 13,33/11,11 11,11/0 4,44/0 6,67/2,22 2,22/0 55,56/71,11 Centro Perjuicio Occidente Antonio S.Felipe Isla Cayo Largo Figura 53. Agrupamiento bayesiano de genotipos individuales. Cada sitio se muestra por separado. Los individuos están representados a lo largo del eje x por barras verticales que representan su probabilidad de origen. En rojo se destacan las agrupaciones que se observan a partir de las similitudes de color. 0,9 r = 0,60, p<0,001 Diferenciación genética (Fst) 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0,0 0 50 100 150 200 250 300 350 400 450 Distancia geográfica (km) Diferenciación genética (Fst) 0,10 r = -0,34, p = 0,22; 0,08 0,06 0,04 0,02 0,00 0 50 100 150 200 250 300 350 400 450 Distancia geográfica (km) Figura 54. Regresión lineal entre la diferenciación genética (Fst) y la distancia geográfica entre pares de colonias (A) determinada mediante el ADNmt y (B) mediante microsatélites. RESULTADOS 75 Las distancias genéticas de Nei (1978) fueron utilizadas para analizar el ordenamiento de las poblaciones a partir de árboles filogenéticos y un Análisis de Coordenadas Principales (Fig. 55). En ambos métodos se observa la estrecha relación entre el centro y oriente de Guanahacabibes con San Felipe, teniendo en cuenta el ADNmt. Tanto el occidente de Guanahacabibes como la Isla de la Juventud y Cayo Largo se separan más entre sí y con el resto de las poblaciones. Con los microsatélites el grado de diferenciación cambia en dependencia del estadístico empleado (Fig. 56). Con ambos estadísticos, el occidente de Guanahacabibes y Perjuicio se separan del resto de las colonias y Antonio se mantiene próximo a Cayo Largo. Sin embargo, el centro de Guanahacabibes y la Isla de la Juventud se encuentran próximos a Antonio con el Fst pero se alejan con el Rst. San Felipe, por su parte, está más relacionada con el resto de las colonias con el Fst pero se separa con el Rst. La diferenciación observada entre pares de poblaciones fue corroborada al realizar el Análisis Molecular de Varianza (AMOVA) para ambos marcadores (Tabla 30). En dicho análisis se encuentran diferencias significativas a los tres niveles analizados (individuo, población y grupos de poblaciones). Esta última categoría se aplicó solamente para la región formada por el centro y oriente de Guanahacabibes con San Felipe en el caso del ADNmt al no mostrar diferencias significativas con Fst. En ambos casos la variación dentro de las poblaciones representó un elevado porcentaje, superior al 70 %, aunque en los microsatélites fue superior al 95 %. Tabla 30. Resultados del análisis jerárquico de varianza molecular para las áreas de anidación de C. mydas del suroccidente del archipiélago cubano sobre la base de los haplotipos encontrados en el fragmento de 742pb analizado en la región no codificadora del ADNmt y en los nueve loci microsatélites analizados. Se agruparon exclusivamente las playas La Barca y El Holandés y Antonio y Perjuicio para el análisis por grupos de poblaciones. Fuente de variación ADNmt Entre grupos de poblaciones Entre poblaciones Dentro de las poblaciones Componentes de la Varianza g.l. Msat 3 ADNmt Msat 0,092 Φst % de variación ADNmt Msat 23,96 ADNmt Msat 0,27 2 5 0,01 0,12 3,04 3,00 0,04 184 278 0,28 3,38 73,00 97,00 0,24 P(a) ADNmt Msat 0,046 0,033 0,001 0,001 0,01 Centro San Felipe Occidente Cayo Largo Isla Eje de Coordenadas 2 (14,50%) Oriente Centro y Oriente Occidente San Felipe Isla de la Juventud Cayo Largo Eje de Coordenadas 1 (72,30%) 0.05 Isla de la Juventud Centro Antonio Cayo Largo San Felipe Perjuicio Occidente Eje de coordenadas 2 (12,97%) Eje de coordenadas 2 (22,15%) Figura 55. Izquierda: en un árbol mediante el método de UPGMA y Derecha: mediante un Análisis de Coordenadas Principales (PCA) donde los ejes explican más del 80% de las diferencias entre poblaciones ambos a partir de las distancias genéticas de Nei (1978) obtenidas con el ADNmt para las poblaciones estudiadas en la región occidental del archipiélago cubano. Perjuicio Cayo Largo San Felipe Isla de la Juventud Antonio Occidente Centro Eje de coordenadas 1 (77,85%) Eje de coordenadas 1 (87,03%) Figura 56. Análisis de Coordenadas Principales (PCA) donde los ejes explican más del 80% de las diferencias entre poblaciones a la Izquierda: empleando el índice Fst Derecha: índice Rst. RESULTADOS 76 3.7. Tamaño efectivo de las poblaciones Las estimaciones de los tamaños efectivos de las colonias de anidación según theta, por el número de sitios segregativos o por la diversidad nucleotídica (π), tuvieron diferencias (Tabla 31). En el caso del occidente de Guanahacabibes, el estimado según los sitios segregativos fue el doble al estimado calculado por la diversidad nucleotídica y en Cayo Largo el primero fue cuatro veces el segundo, en tanto que para las poblaciones del centro y oriente de Guanahacabibes y para la Isla de la Juventud y San Felipe, ambas estimaciones fueron similares con una diferencia máxima de 39 individuos. Los tamaños efectivos calculados para la Península de Guanahacabibes, con la excepción de la población de oriente, son superiores a los tamaños censales obtenidos mediante marcación y mediante la estimación del total de hembras a partir del número de nidos. Para los microsatélites, los valores calculados asumiendo un IAM, aunque son superiores, se encuentran en el mismo orden de magnitud que el resto de los estimados. Para el SMM, sin embargo, es de dos a más de 10 veces el valor del estimado con ADNmt y aún más elevado respecto a los valores censales. La excepción es Cayo Largo, cuya estimación por este método se acerca más al tamaño estimado de la población mediante el conteo de nidos. Sin embargo, al realizar la estimación según el método de marcación y recaptura de Jolly-Seber, los valores estimados para el occidente se encuentran dentro del intervalo definido por los estimadores genéticos de tamaño efectivo mientras que en oriente el valor es el triple. Las diferencias entre el oriente y el occidente radican en la probabilidad de recuperación de marcas lo que determina el cálculo de la supervivencia de las hembras. Para el centro no se pudo aplicar el método de Jolly-Seber por el bajo número de recapturas. Los índices de expansión demográfica calculados a partir del ADNmt indican un ajuste al modelo de expansión súbita, con excepción del oriente (Tabla 32). Por ello en la prueba de distribución desigual de frecuencias no se observan diferencias entre el número esperado de cambios entre pares de haplotipos y los valores observados (Fig. 57). Al analizar el comportamiento demográfico de las poblaciones con los microsatélites, el estadístico M (Garza y Williamson, 2001) indica valores por debajo del valor crítico (Mc=0,68) lo que significa una reducción del tamaño poblacional (Tabla 33). Tabla 31. Estimaciones del tamaño poblacional de las seis áreas de anidación analizadas de la plataforma suroccidental de Cuba. E.E., Error estándar; Ne(h), tamaño efectivo de la subpoblación; Neh, tamaño censal efectivo de la subpoblación; p, probabilidad; θ, estimador de theta; *Según Nodarse et al. 2000 y 2003; No. Total, tamaño de la población según Jolly – Seber, P(a) marcas, probabilidad de recuperación de marcas según Jolly – Seber; P(a)Superviv , probabilidad de supervivencia según Jolly – Seber. L.C. Límites de confianza; * Oriente es la suma de Antonio y Perjuicio para ADNmt y Jolly-Seber Ne(h) θˆ S/ θˆ π Ne IAM Ne SMM Neh Neh censado estimado Occidente 666/341 439 992 202 231 Playa P(a) marcas (α) No. Total ± E.E. P(a)Superviv ± (L.C.) E.E. (L.C.) Centro 272/236 593 1706 195 261 0,24 - Oriente* 218/238 - - 222 296 0,18 Antonio Perjuicio San Felipe 88/113 Is.Juventud 365/326 591 528 374 553 1695 1380 747 1500 160 62 - - Cayo Largo 126/30 557 1522 - 165 132 100-500* 10004000* 471,72±126,82 101,02-3809,58 599,10±730,35 115,74-4942,54 - - - 0,88±0,68 0,23-0,80 0,38±0,40 0,21-0,63 - Tabla 32. Índices de expansión demográfica de las seis poblaciones analizadas con el ADNmt de la plataforma suroccidental de Cuba. Expansión demográfica Tau Theta0 Theta1 Desviación de la suma de cuadrados P(a) Occidente Centro Perjuicio Antonio San Felipe I. Juventud Cayo Largo 1,76 0,0 3,9 2,38 0,0 11,1 1,97 0,0 10,2 2,79 0,0 7,8 0,0 0,0 99.999,0 1,2 1,4 99.999,0 3,0 0,0 0,0 0,007 0,020 0,005 0,080 0,330 0,020 0,010 0,46 0,26 0,60 0,05 0,00 0,46 0,08 Tabla 33. Índice de Garza y Williamson (2001) (M) para detectar reducción del tamaño poblacional mediante microsatélites en las siete poblaciones analizadas de la plataforma suroccidental de Cuba. Los valores menores que el valor crítico de M (Mc=0,68), el cual es valor menor que M en el 95% de 10 000 simulaciones, indican reducción en el tamaño de la población. Occidente Media±E.E. 0,52±0,1 Centro Perjuicio 0,40±0,05 0,39±0,05 Antonio Isla de la San Felipe Juventud 0,43±0,13 0,40±0,05 0,27±0,06 Cayo Largo 0,39±0,11 0,4 Observada Frecuencia relativa 0,3 Modelada 0,3 0,2 0,2 Occidente 0,1 0,1 0,0 0 1 2 3 4 5 6 7 8 9 10 11 12 13 Número de diferencias por pares 0,4 0,3 0,3 0,2 Centro 0,2 Observada Modelada 0,4 Frecuencia relativa Frecuencia relativa 0,4 Observada Modelada 0,4 0,1 0,1 0,3 0,3 0,2 Perjuicio 0,2 0,1 0,1 0,0 0,0 0 1 2 3 4 5 6 7 8 9 10 0 1 2 Número de diferencias por pares 0,45 0,30 0,25 0,20 Antonio 0,15 0,10 0,05 0,00 6 7 8 9 10 Observada Modelada 0,80 0,60 0,40 San Felipe 0,20 0,00 0 1 2 3 4 5 6 7 8 9 10 0 1 2 3 Número de diferencias por pares 4 5 6 7 0,40 0,50 0,45 0,40 0,35 0,30 0,25 0,20 0,15 0,10 0,05 0,00 8 9 10 Número de diferencias por pares Observada Modelada Observada Modelada 0,35 Frecuencia relativa Frecuencia relativa 5 1,00 Frecuencia relativa Frecuencia relativa 0,35 4 Número de diferencias por pares Observada Modelada 0,40 3 Isla de la Juventud 0,30 0,25 0,20 Cayo Largo 0,15 0,10 0,05 0,00 0 1 2 3 4 5 6 7 Número de diferencias por pares 8 9 10 0 1 2 3 4 5 6 7 8 9 Número de diferencias por pares Figura 57. Frecuencias del número de cambios entre pares de haplotipos de cada colonia. No hay diferencias significativas entre los valores esperados (línea continua) y los valores observados (línea discontinua) excepto en Antonio y San Felipe 10 77 4. DISCUSIÓN 4.1. Selección de las playas de anidación En Cuba las principales áreas de anidación se encuentran en las playas de los cayos e islas de la parte sur del archipiélago, entre los que están: la playa de Cayo Largo del Sur, Playa Larga, en la Isla de la Juventud, Cabo Corrientes en la Península de Guanahacabibes y algunas playas de Doce Leguas (Nodarse et al., 2000). Aunque existen varios intentos de definir las cualidades para la selección de una “buena” playa de anidación, los motivos reales para la selección continúan siendo un misterio (Mortimer, 1990). Las playas Antonio, La Barca y Caleta de los Piojos son las que presentan los mayores niveles de anidación y coinciden en sus características geomorfológicas. Estas tres playas poseen la vegetación más desarrollada, con presencia de guanal o uveral, por lo que la arena es más oscura. La coloración oscura de la arena se vincula con una mayor proporción de partículas pequeñas (más finas y coloridas de tipo arcilla y fango), asociada con la cobertura vegetal, en cuyo manto y raíces se desarrolla la microfauna detritívora (Barrán, 2007). Se considera que estas playas tienen, además, arenas de grano más grueso que las otras dos, sin embargo, el tamaño medio de la partícula es menor en la medida en que el nido se ubica más próximo a la vegetación (Barrán, 2007). Hendrickson y Balandingam (1966) sugieren que en Malasia, la playa escogida por las tortugas verdes estaba preferentemente compuesta por arena fina al igual que Nodarse et al. (2000) quienes plantean que en el tramo costero de Playa Larga se observó que con cierta frecuencia (sobre todo en la playa arenosa de alta energía), prácticamente todos los intentos de construcción del nido fallaron debido al grosor de la arena y a la poca coherencia de la misma. Mortimer (1990) también refiere que el éxito de anidación varía en las diferentes playas por la textura de la arena, a la vez que expone que las tortugas pueden excavar más fácilmente los nidos si el tamaño de las partículas de arena es menor. Asimismo, según Mortimer (1990), las características de la arena más alejada del mar reducen las posibilidades de destrucción del nido durante la excavación y son menos propicias para que ocurra la desecación durante el desarrollo embrionario. Franco (2003), por su parte, plantea que el tamaño del grano no influye en la supervivencia de los neonatos. Sin embargo, otros autores, si bien opinan que las tortugas en otras regiones anidan exitosamente en arenas finas (Carr y Ogren, 1959; Hirth, 1963), plantean que el tamaño de las partículas es menos importante que la pendiente y la configuración costera de la playa. La pendiente de la playa puede determinar el grado de impacto de las sobre-elevaciones del nivel del mar, pues en playas de poca pendiente es mayor el riesgo de inundación. Todas las DISCUSIÓN 78 playas de Guanahacabibes estudiadas presentan valores de pendientes dentro del intervalo que describe Márquez (1996) como propicio para la anidación de C. mydas (entre 5 y 10 grados). Antonio y Caleta de los Piojos, dos de las playas de mayor anidación, presentan las mayores pendientes. La Barca, sin embargo, presenta el valor más bajo con relación al resto de las playas, pero las tortugas que anidan en ella recorren como promedio mayores distancias desde el mar para anidar, lo que reduce el riesgo de inundación de los nidos. Perjuicio y El Holandés presentan una geomorfología muy distinta a las anteriores, sobre todo, carecen de una vegetación bien desarrollada. En consecuencia, disminuye su éxito de anidación al encontrar condiciones menos propicias. No obstante, la presencia de una barrera arrecifal frente a las playas parece ser el factor limitante en estos dos casos. La ubicación paralela a la costa de estas barreras constituye un obstáculo significativo para llegar éxitosamente a la costa. Esta también puede ser la causa del bajo número de anidaciones en las playas de San Felipe y del sur de la Isla de la Juventud en donde existen barreras arrecifales (Nodarse et al., 2000; Medina, com.per.) que limitan el acceso de las tortugas a la playa. Estos resultados coinciden con las conclusiones de otros investigadores que afirman que la topografía, pendiente, microhábitat, piedras sumergidas (Dodd, 1988; Horrock y Scott, 1990; Crain et al., 1995; Hays et al., 1995; Mortimer, 1995), vegetación terrestre (Horrock y Scott, 1991; Hays y Speakman, 1993; Mortimer, 1995) y las propiedades estructurales de la arena, como compresibilidad y características de la partícula (Mortimer, 1990 y 1995; Foote y Sprinkel, 1994) pueden influir fuertemente en la selección del sitio de anidación. Las reproductoras pueden variar la forma de la trayectoria si detectan obstáculos ocasionales (Pritchart et al., 1983), por lo que estas trayectorias serán menos frecuentes que las rectas en playas arenosas lo cual se evidencia en que las longitudes de los tipos de trayectorias (entrada y salida) sean similares (Pereira, 2002). La trayectoria recta puede estar relacionada con la disminución del gasto energético para la optimización del proceso de anidación. En Guanahacabibes, sin embargo, las trayectorias rectas son menos frecuentes que las otras, independientemente del tipo de playa, ya que en todas existen grandes rocas en la orilla u otros obstáculos que dificultan el acceso a la playa. Los niveles de anidación en función del tamaño de la playa coinciden con los de Aiken et al. (2001), quienes observan las mayores anidaciones en las playas más pequeñas. Una vez escogida el área de anidación, las tortugas continuarán regresando a la misma por su elevada fidelidad al sitio de anidación (Miller, 1997), independientemente de las limitaciones de espacio. DISCUSIÓN 79 El microhábitat también afecta el desarrollo (Bilinski et al., 2001), sexo (Reinhold, 1998) y supervivencia (Mortimer, 1990) de los embriones. Esto pudiera explicar por qué las oviposiciones en los diferentes sectores de cada playa presentaron diferencias significativas entre sí. En la península de Guanahacabibes, la mayor concentración de las anidaciones ocurre en la zona de vegetación, aunque este comportamiento se afectó con el paso de los huracanes. Otros estudios observan que la vegetación desempeña un papel importante en la selección del sitio de anidación (Cheng, 2000). Al elegir la zona de vegetación como sitio de anidación, las tortugas verdes incrementan las posibilidades de supervivencia de su nidada. La distancia del nido al agua depende de las condiciones ambientales, ya que, aunque las hembras anidadoras de tortuga verde se encuentran a merced de procesos que controlan la distribución de la vegetación en la playa seleccionada, sus preferencias conductuales por la selección del sitio de anidación próximo a la vegetación sirven como garantía en caso de efectos potencialmente negativos del tamaño de playas pequeñas y de eventos climáticos severos como los huracanes. En ambos casos, si los nidos estuvieran ubicados de manera aleatoria, una mayor proporción de los nidos se hallaría expuesta a la inundación (Barrán, 2007). Evidencias empíricas muestran una correlación entre la distancia de los nidos con respecto a la línea de marea alta y la mortalidad en playas someras, lo que soporta el valor adaptativo de este comportamiento (Mortimer 1990). De igual forma, en el presente estudio se observó un incremento en el éxito de eclosión en los nidos más alejados de la línea de marea alta. En cuanto a los posibles efectos negativos de anidar en la vegetación, no se encontraron evidencias de que la invasión de raíces sea un factor causante de la mortalidad embrionaria temprana como plantea Miller (1997) aunque sí se hallaron embriones atrapados vivos en raíces de guano. Lazou y Rees (2006) detectan una relación negativa significativa entre la profundidad del nido y la infección por sarcofágidos (moscas), lo que implica que los nidos más superficiales mostraron mayores niveles de infección. El número de embriones muertos también representó un factor importante, pues en la medida que se incrementó su número, aumentó el nivel de infección por larvas de moscas. Por otra parte, según estos autores, el papel más importante para la presencia de elastéridos (coleópteros) fue la posición del nido respecto a la vegetación, pues señalan una relación significativa entre esta variable y la presencia de coleópteros. Otro resultado interesante apuntado por estos autores es la variación en los niveles de infección en una playa rodeada por farallón. Aparentemente, el farallón constituye DISCUSIÓN 80 una barrera entre el refugio de los adultos de los insectos y la playa con lo que se evita que estos detecten los nidos. Phillott y Parmenter (2006) afirman que los hongos que atacan a los huevos de tortugas aparecen por primera vez en huevos que no completan su desarrollo por causas naturales. Usando esta fuente de nutrientes, las hifas se expanden a huevos viables adyacentes y provocan la mortalidad de los embriones por la inhibición de la superficie respiratoria o por la reducción en el calcio. Dado que las lluvias remueven las sales del sustrato donde se halla el nido, precipitaciones reducidas provocarán un incremento de la conductividad del sustrato y una mayor mortalidad embrionaria debido a condiciones desfavorables, lo que permite múltiples focos para la invasión de hongos en los nidos y la subsecuente infección de huevos viables. Esto explica los porcentajes encontrados en el presente estudio tanto en huevos sin embrión como con ellos. Los nidos puestos en la zona cercana a la línea de marea (menos de 3 m) son más susceptibles a ser inundados durante las mareas altas y los fuertes oleajes (Mrosovsky, 1983), con lo cual varían las condiciones ambientales del nido. Tanto el intercambio de gases como la humedad y la temperatura son afectados con valores fuera de los límites de tolerancia del embrión (Pereira, 2002). De ahí que sean poco frecuentes las hembras que asumen la conducta de anidar en la zona cercana a la línea de marea alta ya que son contraseleccionadas respecto a las demás. La media del éxito de emergencia de los neonatos excede el 70 %, excepto en el año 1999, y es elevado según criterios de Miller (1997). Sin embargo, es bajo comparado con otros valores informados para Cuba, ya que en algunas playas excede el 90 % (Nodarse et al., 2000), y es más bajo que la media (88 %) encontrada en Tortuguero, Costa Rica (Reyes y Troëng, 2001). El principal factor que influye en los valores encontrados en este estudio es la presencia de mortalidad embrionaria avanzada (embriones visibles) que puede atribuirse a características microambientales (ej. temperatura de la arena, humedad). En los nidos expuestos, el sobrecalentamiento puede causar la mortalidad embrionaria (Moncada et al. 1998) sin embargo, no se encuentran diferencias en este trabajo en la mortalidad embrionaria por zonas de la playa, aunque sí una mayor frecuencia de huevos sin embrión visible en la zona cercana a la línea de marea alta. Uno de los efectos más negativos es que la surgencia de las tormentas disminuye de modo significativo el éxito reproductivo al reducir el número de nidos que eclosionan y el número de neonatos que emergen de los nidos. A esto se suma que la temporada de anidación de DISCUSIÓN 81 tortuga verde transcurre completamente dentro de la temporada ciclónica y más aún porque el 79% de los nidos se encuentra en fase de incubación en el mes de septiembre cuando los ciclones ocurren con mayor probabilidad. De hecho, el ciclón más devastador, Iván, ocurrió en el mes septiembre, causando cuantiosas pérdidas en los nidos de esa temporada. Lo mismo sucedió con Wilma, el segundo en importancia que impactó a principios de octubre (Anexo 1). Nodarse et al., (2008) encuentran una reducción en las anidaciones en cayos al sur de la Isla de la Juventud, lo cual atribuyen a cambios en la configuración de las playas como resultado de los huracanes Michelle (2001) y Charlie (2004). Sin embargo, en este estudio, aunque se observaron cambios en la distancia promedio recorrida hasta el nido, producto de la pérdida de la línea de vegetación, en general, el legado de los huracanes más importantes ha sido beneficioso para la anidación, al incrementar notablemente el área de anidación efectiva en todas las playas, no sólo en ancho sino en la longitud en algunos casos. A partir del año siguiente al paso del huracán Iván, comenzó a incrementarse año tras año el número total de nidos por temporada, aunque esto no significa que estén directamente relacionados. De cualquier manera Loughland y Miller (2006) plantean que el incremento en el nivel del mar y las tormentas que se predicen aportarán un estrés adicional a las poblaciones anidadoras mediante la inundación de los nidos y la erosión de las playas.La variación latitudinal, el cambio de la temperatura estacional, la sombra de la vegetación, el color de la arena, los eventos estocásticos como la lluvia, profundidad de los huevos (Morreale et al., 1982, Mrosovsky et al., 1984, Mrosovsky 1988, Hays et al., 1999), la playa, la distancia con respecto a la marea alta, entre otros (Kelez, 2003) afectan las temperaturas del nido y las proporciones del sexo de las tortugas marinas. En la medida en que las tasas de cambio climático varíen entre zonas tropicales y templadas, las condiciones climáticas que pueden conducir al indicio de la vitelogénesis y la migración podrían no garantizar el arribo en fechas adecuadas a la playas de anidación o el tiempo óptimo de llegada a las playas puede variar en el tiempo (Both y Visser, 2001). El aumento de las temperaturas en las playas de anidación puede afectar el desarrollo embrionario y provocar un cambio hacia temperaturas productoras de hembras (Davenport, 1997). En el caso de las playas de Guanahacabibes, es clara la tendencia hacia temperaturas determinantes de hembras que incluso comienzan a acercarse al límite de tolerancia de la especie (35oC según Ackerman, 1997). El otro aspecto importante de la incubación de los nidos regulado por la temperatura es el período que demora el desarrollo embrionario. Según DISCUSIÓN 82 Ackerman (1997), el período de incubación decrece típicamente con el aumento de la temperatura, lo cual fue observado en este trabajo. 4.2. Estacionalidad Algunas especies como la tortuga verde muestran una marcada periodicidad que está en función de la variación ambiental y los intervalos de remigración (Hays 2000, Chaloupka 2001). La variabilidad entre temporadas que se observa en esta especie ha sido tratada por diversos autores (Bjorndal et al., 1999; Godley et al., 2001, Solow et al., 2002, Balaz y Chaloupka 2004, Troeng y Ranking, 2005; Antworth et al., 2006). Las tortugas verdes que anidan en Guanahacabibes mostraron un ciclo reproductivo durante los seis primeros años similar al descrito por Márquez (1996): 2,3 años. Sin embargo, este comportamiento cambió en los últimos cuatro años. Se destaca el mantenimiento del ciclo bienal de anidaciones observado en programas de seguimiento prolongados (Antworth et al., 2006) aunque sólo se analiza hasta el 2003. De igual forma, el ciclo de anidación dominante para la población del Guanal en la costa sur de la Isla de la Juventud, Cuba, es de dos años (Moncada, 1998). Un fuerte ciclo bienal también ha sido encontrado en otras poblaciones de tortuga verde (Broderick et al., 2001; Limpus y Nicholls, 1988; Witherington et al., 2006), pero nunca ha sido totalmente explicado. Durante el año 2003, un año que se esperaba fuera de baja anidación en función del ciclo bienal observado entre 1998 y 2002, fueron detectadas anidaciones superiores al resto de los años impares. A partir del 2004, se advierte un incremento paulatino de las anidaciones en los años siguientes. Para las áreas de anidación de Galápagos, sin embargo, el 2001 constituye una temporada alta de anidación a diferencia del 2005 (Zárate et al., 2006). De acuerdo con sus resultados, la actividad de anidación en el 2001 fue de 2756 tortugas verdes mientras que solamente 726 anidaron en el 2005. Nodarse et al. (2008) encuentran el mismo comportamiento anual informado en las anidaciones en la Península de Guanahacabibes a partir del 2004. En estudios realizados con series de tiempo largas se observan períodos donde también se produce un incremento anual de las anidaciones y otros donde ocurre un decremento continuo con los años hasta que se restablece el ciclo bienal (Troeng y Ranking, 2005). El gran número de hembras nuevas que llegan a Guanahacabibes cada año refleja que los intervalos remigratorios de parte de estas hembras superan los años dedicados al programa de marcación. Esto se comprueba por el hecho de que cada año es mayor el porcentaje de hembras remigrantes. No obstante, el reclutamiento es un componente importante que contribuye a este elevado número de DISCUSIÓN 83 hembras sin marcar, lo que se refleja en las mayores tallas de las hembras remigrantes respecto a las nuevas. La periodicidad reproductiva está relacionada con la calidad y cantidad del alimento disponible (Bjorndal, 1980), así como con un conjunto de variables exógenas (como el fotoperiodo) y endógenas (niveles hormonales y de grasas) según Wibbels et al. (1990). Broderick et al. (2001) sugieren que la variación en la cantidad y calidad de los pastos marinos puede producir dramáticas fluctuaciones en los esfuerzos anuales de anidación. De manera similar, Carr y Carr (1970) argumentan que condiciones favorables relacionadas con la disponibilidad de alimento contribuyen a la reducción del intervalo de remigración de tres a dos años explicando las amplias fluctuaciones en la actividad anidadora entre años en Costa Rica. Se asume que estas variaciones en el ambiente natural contribuyen a las fluctuaciones observadas en el número de tortugas que llegan a ovipositar cada año en Cuba. Además, se observa un comportamiento similar entre el índice oceanográfico de la NOAA para el Caribe (Anexo 5) y las anidaciones anuales, dado que en ambas curvas se observa un cambio de un ciclo bienal a un incremento contínuo. El intervalo de remigración de dos años encontrado como más abundante podría explicar el comportamiento bienal de las anidaciones. Más aún, el incremento de anidaciones en años consecutivos observado en los últimos cuatro años, pudiera ser la explicación para el incremento anual en el total de anidaciones ocurrido durante este período. Solomon et al. (2006) valoran que la recurrencia de hembras en años consecutivos puede estar relacionada con la disponibilidad de machos en poblaciones reducidas. Si se considera que las tortugas son especies longevas (Heppell et al., 2000), es posible que el intervalo de tiempo considerado (ocho años) sea insuficiente para definir ciclos reproductivos a nivel de población, especialmente si las condiciones ambientales son tan variables. En Galápagos el intervalo de remigración predominante fue de tres años (Zárate et al., 2006). Existe una relación positiva de las salidas de las ovígeras con la temperatura, debida posiblemente a que las tortugas marinas presentan su temporada de reproducción en los meses más calurosos del año, pues el desarrollo embrionario, así como la proporción sexual dependen en gran medida de la temperatura que se presente en el nido. Godley et al. (2001) encontraron una fuerte relación entre la temperatura del aire y la magnitud de las anidaciones en la Isla Ascensión. A pesar de las diferencias existentes entre temporadas reproductivas en cuanto al número de hembras anidadoras, no se apreció un patrón visible en el comportamiento de los haplotipos DISCUSIÓN 84 durante los años analizados. De cualquier manera, factores estocásticos vinculados con la variabilidad ambiental, más que determinantes genéticos, parecen ser los responsables de estas diferencias en el potencial reproductivo de la población anidadora (Chaloupka, 2002). Por otra parte, las diferencias encontradas con los microsatélites a lo largo del tiempo para las colonias del suroccidente de Cuba pudieran ser un artificio ocasionado por la baja N en esos años en particular. Este resultado coincide con lo encontrado para ADNmt por Bjorndal et al. (2005) en Tortuguero, Costa Rica y por Hatase et al. (2002) en las colonias anidadoras de caguama en Japón. Para el caso de los microsatélites esta homogeneidad puede deberse, entre otras razones, al hecho de que machos y hembras no tienen necesariamente la misma escala de tiempo para la reproducción. Mientras que el período de remigración más frecuente en las hembras es de 2 ó 3 años, los machos se reproducen anualmente o cada dos años (Miller, 1997) de tal manera que los machos podrían evitar la diferenciación interanual. Del mismo modo, las variaciones en el potencial reproductivo de las hembras comentado anteriormente pueden contribuir a la mezcla de las mismas a través de los años. La variación dentro de las estaciones de la actividad anidadora es similar a la de otros reportes (Aiken et al., 2001; Mortimer y Carr, 1987), incluyendo patrones de selección del sitio de anidación que aparentemente reducen el impacto de un ambiente impredecible en la producción de crías (Eckert, 1987). Se ha constatado que las tortugas marinas ponen menos huevos al principio de la temporada reproductiva. Esto puede ser una consecuencia del incremento en la eficiencia y capacidad del proceso relacionado con la vitelogénesis y que en la medida que la estación reproductiva avanza, las hembras se alimentan menos, con lo que liberan espacio en la cavidad del cuerpo para acomodar más huevos (Broderick et al., 2003). Al final de la estación, disminuye el número de huevos, presumiblemente producto de la disminución de la producción de huevos asociada con el agotamiento de las reservas energéticas de las hembras. Los huevos de reptiles son vulnerables a condiciones de elevada salinidad y humedad lo cual causa la pérdida del nido o bajas tasas de eclosión (Martín, 1996, Packard, 1999, Foley et al., 2006). Aunque las salidas de las ovígeras son independientes de las precipitaciones diarias y la humedad relativa al igual que de los acumulados mensuales de lluvia, sí se observa la mayor concentración de las anidaciones durante el periodo lluvioso. Mortimer y Carr (1987) en la isla Ascensión notaron que las tortugas anidaban en la estación del año en la que ocurrían las mayores precipitaciones y se registraban las temperaturas más elevadas y sugieren que es una adaptación que las tortugas han tenido, pues se les facilita anidar cuando la arena DISCUSIÓN 85 está húmeda. Se sugiere que las temperaturas son probablemente el factor que define la temporada de anidación (Godley et al., 2001). De hecho, en Guanahacabibes, las salidas de las hembras a anidar se ajustan a un máximo que coincide con la temperatura óptima para la incubación de los huevos. Las diferencias encontradas en cuanto al número de salidas por tipos de rastros en el tiempo de estudio por cada una de las quincenas tienen explicación por la paulatina llegada de las ovígeras a sus respectivas playas de anidación. La existencia de estos rastros incompletos puede ser debida a la interferencia por humanos u otros animales, que estén involucrados en el impedimento de la excavación y/o la búsqueda de señales termales (Mortimer, 1990; Salmon et al., 1996; Witherington y Martin, 1996). Por su parte, los rastros de reconocimiento aumentan al inicio de la temporada por la llegada de las hembras a sus playas, pero al final de la temporada de anidación son escasos, pues estas ya están en sus respectivas playas de anidación. Esto es un indicador de la alta fidelidad a una playa determinada por las ovígeras. En un estudio realizado en la isla Wan An se encontró que las tortugas realizaban por término medio una anidación por cada tres emergencias. Algunas de estas emergencias se explicaban como búsquedas infructuosas en lo que respecta a los sitios de anidación y otras por el derrumbe o presencia de algún obstáculo que impidió el seguimiento de la excavación (Wang y Cheng, 1999). Otro elemento que determina el momento de salir las tortugas durante la temporada es la luna. La mayor frecuencia de la primera salidade las hembras ocurrió durante la luna llena lo que se justifica pues la claridad lunar facilita tanto la orientación de las reproductoras ovipositoras en su arribo al área de anidación como la selección del sitio y la retirada del área (Pilcher y Al-Merghani, 2000). Una vez detectada la playa parece carecer de importancia la fase lunar, lo que se manifiesta en valores similares para las distintas fases lunares en las siguientes salidas de las hembras. La concentración de un mayor número de emergencias de hembras alrededor de la media noche coincide con patrones descritos por Miller (1997) y Hirth (1997) para C. mydas. Este patrón pudiera responder a un proceso de selección para optimizar las posibilidades de completar el proceso de anidación antes del amanecer. De este modo se reduce el riesgo de depredación o exposición al sol. Esta conducta está relacionada también con la marea y la luna. Por una parte el ascenso a la playa de anidación se produce durante, o justo antes de la marea alta (Frazier, 1985; Chen y Cheng, 1995; Pilcher y Al-Merghani, 2000). El mayor número de emergencias exitosas se produce durante el llenante lo que se explica por el DISCUSIÓN 86 efecto transportador que tiene este proceso. De este modo las ovígeras acceden a las playas de anidación mucho más fácil y con un menor gasto de energía, la cual almacenan para la puesta efectiva. Las playas trabajadas en la Península de Guanahacabibes poseen una zona sublitoral poco profunda y de fondo rocoso. Estas características pueden impedir o dificultar la subida de las tortugas a la playa durante la marea baja. En las playas que presentan una barrera arrecifal, durante las mareas altas, las tortugas tienen más tiempo para completar el proceso de anidación y retornar al mar antes de que puedan encallar en la cresta o en la laguna arrecifal de aguas poco profundas (Pilcher y Al-Merghani, 2000). La relación entre la salida de las tortugas ovígeras y la fase de la marea alta también fue planteada por Chen y Cheng (1995). En este caso solo la encontraron en la primera reemergencia de las tortugas a la playa. En la Isla St. Bangladesh, las tortugas normalmente ascienden a anidar entre las 19:00-03:00, de 3-4 horas antes o con la marea alta (Zahirul, 2002). Por otro lado, en la playa Ya Lima Po de la Guyana Francesa se ha encontrado relación entre la marea alta y la hora de arribo de tinglados a la playa, lo cual se explica por el efecto transportador de las mareas en ascenso que facilita la llegada de las tortugas a la playa (Fretey y Girondot, 1989). Además de la conocida relación que existe entre la luna y la marea, la iluminación de la luna es otro factor ha tomar en cuenta. La orientación de las playas en Guanahacabibes determina que en las horas cercanas a la salida de la luna, el astro se encuentra a espaldas de las hembras, por lo que su resplandor facilita la visualización de la playa. Cerca de su puesta, por el contrario la luna se encontrará frente a las hembras por lo será más difícil detectar la franja clara de arena en el horizonte. Por este motivo en las fases de luna llena y cuarto menguante las hembras salen con mayor frecuencia en las horas cercanas a la salida de la luna. En las otras dos fases, la luna sale durante el día por lo que la salida de las hembras se separa en tiempo respecto a la de la luna para poder aprovechar el horario nocturno. 4.3. Características de las hembras anidadoras Durante este estudio se pudo observar que el largo curvo del carapacho de las tortugas anidadoras se encuentra comprendido en mayor proporción en el rango de 101-110 cm. Esto puede deberse a que la madurez sexual de esta especie se empieza a manifestar a partir de los 90 cm. de largo curvo del caparazón (Chaloupka, 2004), pero no alcanza su plenitud hasta cuando exhibe un intervalo promedio de 101-110 cm. Dada la baja tasa de crecimiento en esta etapa de la vida de las tortugas, estas mantienen este tamaño promedio de modo que son muy raros los individuos que sobrepasan los 120 cm de largo curvo del caparazón (Chaloupka, 2004; Zug et al, 2002). El valor medio del largo curvo del carapacho (104,49±0,35 DISCUSIÓN 87 cm, N=1644) de las tortugas verdes de la Península de Guanahacabibes cae dentro del intervalo global de valores (71,1– 139,5 cm) referido para esta especie por Márquez (1996), y dentro del intervalo encontrado en otras poblaciones cubanas (Nodarse et al., 2000). En contraste, la media del largo recto del carapacho (95,64±0,43, N=1079) es menor a la referida por Miller (1997) para la especie (LRC=99,1 ±1,9 cm Npoblaciones = 22) y para otras áreas del Caribe (Bjorndal y Carr, 1989, para Costa Rica: LRC=100,2± 5,0 cm, N=2107 y Cayo Cañaveral y Melbourne, Florida: LRC= 101,5 cm; Hutchinson, Florida: LRC=101,1 cm, Islas Contoy, México: LRC=99 cm según Hirth (1997)). Es posible que la población cubana tenga una mayor proporción de hembras jóvenes, con un número importante de nuevas reclutas, lo cual es consistente con el gran número de nuevas hembras marcadas anualmente. Para varias especies incluyendo C. mydas se describen diferencias entre las reproductoras experimentadas (remigrantes) y las que se reproducen por primera vez (neófitas). De ellas son mayores las primeras (Limpus 1985, Parmenter y Limpus, 1999, Limpus et al., 2001, Hamman, 2002). Esto fue observado también para el área de Guanahacabibes. El tamaño promedio de la nidada en la Península de Guanahacabibes también se incluye en el intervalo descrito por otros autores (Pritchard y Mortimer, 1999: 110-130). Es cercano al valor medio descrito por Márquez (1996: 114 huevos), el de otras colonias de anidación importantes del Atlántico, como Tortuguero y Costa Rica (Bjorndal y Carr, 1989: 112,2) y al de la costa sur de la Isla de la Juventud, Cuba (Nodarse et al., 2000: 103,9). Las diferencias significativas en la media del tamaño de la nidada entre las diferentes clases de tallas de las hembras contrasta con estudios previos (Bjorndal y Carr, 1989; Chen y Cheng, 1995) que sugieren que la talla no se correlaciona con el número promedio de huevos (Broderick et al., 2003). En el presente estudio el número de huevos se incrementa con el tamaño de la hembra. Por otra parte, las diferencias estadísticas encontradas en el tamaño de las hembras por año y por playa, al igual que el número de huevos por playa parece ser resultado de un artificio de la n que permitió hallar diferencias estadísticas aún cuando las diferencias entre los valores de la media es muy pequeña, en el orden de una o dos unidades solamente. En la medida que avanza la temporada, el número de huevos puestos por las hembras disminuye, aunque se exceptúan los valores más extremos encontrados al inicio y final que pueden constituir un artificio numérico debido al bajo número de nidos que se registran durante esos períodos. Esto coincide con el número de huevos en cada puesta de las DISCUSIÓN 88 hembras, el cual de manera general se reduce en la medida que la hembra anida un mayor número de veces. Antworth et al. (2006) también observan las mayores variaciones en el tamaño de la nidada dentro de cada temporada de anidación, aunque atribuyendo esta variación al tamaño de la hembra. En el presente estudio, aunque se encuentra relación estadísticamente significativa entre estas dos variables, en realidad la relación es pobre, con solamente un 15 a un 20 % de la variabilidad en el tamaño de la nidada explicado por el tamaño de la hembra. La construcción del nido se divide casi equitativamente en la construcción de la cama y la cámara de incubación, aunque se mantiene la tendencia de que mientras más dure un proceso, menos dura el otro. De esta forma permanece inalterable el tiempo de construcción del nido. La oviposición constituye el paso irreversible dentro de la etapa de puesta, a pesar de que su duración es la menor de todos los descriptores temporales. Esta corta duración podría estar relacionada con la vulnerabilidad de la reproductora ovipositora que durante este periodo es relativamente tolerante a niveles de perturbación externa (Miller, 1996; Márquez, 1996). Pereira (2002) también informa que entre estos estados existe diferenciación, puesto que el tiempo de oviposición es el de menor duración de la generalidad de los estados temporales. El enmascaramiento del nido es muy importante para el mantenimiento de las poblaciones de tortugas marinas si se tiene en cuenta que la depredación es un factor que incide de manera significativa en la mortalidad de la descendencia (Congdon et al., 1983; Thompson, 1983; Iverson, 1991; Yerli et al., 1997; Burke et al., 1998; Escalona y Fa, 1998). Por otro lado, la existencia de hembras que permanecen en la playa durante un período muy superior al de la media (hasta seis horas) coincide con los casos de varios intentos fallidos previos a la anidación exitosa. Esto sucede con frecuencia en zonas de la playa donde el lecho rocoso está cerca de la superficie, por ejemplo cerca de los farallones, o cuando existen muchas rocas enterradas en la arena que entorpecen la excavación del nido. Las diferencias en cuanto al número de hembras con una sola puesta y salida en la temporada con respecto a las que se observaron en más ocasiones, pudiera reflejar vacíos en el seguimiento de las anidaciones dentro de la Península, pues estas tortugas podrían anidar en otras playas que no estudia el proyecto. Aunque no se descarta esta posibilidad, la fidelidad que muestran las hembras a su lugar de anidación la hace menos probable. También puede asociarse a una capacidad reproductiva diferencial, aunque las hembras con una sola salida no son significativamente menores que las otras. DISCUSIÓN 89 Desde el punto de vista genético, entre todas las colonias estudiadas sólo se encontraron haplotipos exclusivos en dos de ellas: en la playa Caleta de los Piojos (CMA 12, CMA 27.2, CMA 56 y CMA 57) y en la colonia de la Isla de la Juventud (CMA 34). A pesar de las muestras analizadas de varias temporadas, solamente fueron hallados estos haplotipos en un único año. El resto de los haplotipos se encuentra al menos en dos de las colonias y está representado en mayor o menor medida a lo largo del tiempo. Sin embargo, la región estudiada y Guanahacabibes en particular, presenta un elevado endemismo con seis variantes exclusivas de la región: CMA 27, CMA28, CMA34, CMA 48, CMA 56 y CMA 57 (Anexo 7). La inmigración o la mezcla genética, a pesar de la conducta filopátrida general de las tortugas marinas, se ha usado para explicar los valores relativamente altos de la diversidad haplotípica y nucleotídica encontrados en algunas colonias relativamente pequeñas de tortugas verdes: Polinesia (h=0,44 π=0,0027, número de hembras en la población = pocos centenares; Bowen et al., 1992); Isla Aves, Venezuela (h=0,25, π =0,0053; número de hembras en la población=300–500, Lahanas et al., 1994); y Quintana Roo, México (h=0,82, π =0,0057; número de hembras en la población=100–400, Encalada et al., 1996). En todos estos casos, los altos valores de π se han interpretado como reflejo histórico de las integraciones de individuos con haplotipos divergentes. Los resultados de este trabajo reflejan valores de diversidad haplotípica muy altos, superiores a los valores informados para la misma especie para el Atlántico (0,22±0,0041 según Formia, 2002) o para el Caribe en particular (0,44 según Bjorndal et al., 2005). Este resultado coincide con lo encontrado por Chassin-Noria et al. (2004) en las colonias de tortugas verdes de Michoacán, México y es un indicativo de que existen fuerzas evolutivas afectando el equilibrio ya que, según Kalinowski (2002) en condiciones de equilibrio, las poblaciones pequeñas tienen diversidad genética más baja que las grandes. Los “cuellos de botella” usualmente pueden causar la rápida pérdida de variación genética y la fijación de alelos deletéreos así como la depresión por consanguinidad (Luickart et al., 1998). Aún en los pocos estudios donde los “cuellos de botella” producen un incremento de la variación genética, normalmente existen evidencias de una reducción en la capacidad adaptativa y los valores fenotípicos medios (Bryant et al. 1986; Soulé y Kohm 1989; Brakefield y Saccheri 1994). Los valores de diversidad nucleotídica, sin embargo, son más bajos que los del Atlántico (0,0030±0,0021 según Formia, 2002) y la región del Caribe (0,0078 según Bjorndal et al., DISCUSIÓN 90 2005). El contraste entre la baja diversidad nucleotídica y la elevada diversidad haplotípica sugiere que los haplotipos de frecuencia más baja se originaron a partir de un proceso evolutivo local y no por procesos de inmigración (Chassin-Noria et al., 2004). Esta afirmación se sostiene por el hecho de que la mayoría de los haplotipos encontrados en el suroeste del archipiélago cubano se relacionan entre sí por uno o dos cambios. La excepción sería el haplotipo CMA 12 encontrado en el occidente de Guanahacabibes el cual constituye un claro ejemplo de fallo a la filopatría no sólo por el número de cambios que lo separan del resto sino porque ha sido previamente descrito en zonas de anidación de Brasil (Encalada et al. 1996). No se hallaron diferencias entre las tallas promedios de las tortugas que presentaron distintos haplotipos. Aunque todos se detectaron en el intervalo de tamaño más frecuente, se observan los loci más raros en tortugas con tamaños cercanos a los límites de este intervalo. Entre los haplotipos más abundantes también se hallan diferencias entre los tamaños promedios de cada uno con respecto a los demás. Según Grant y Bowen (1998), cuando los valores de la diversidad haplotípica y nucleotídica son bajos (<0,5 y 0,005 respectivamente), es debido a la ocurrencia de un cuello de botella reciente en la población o efecto fundador por uno o muy pocos linajes de ADNmt. Este sería el caso de las poblaciones de San Felipe y Cayo Largo. Ahora, si la diversidad haplotípica es alta pero la nucleotídica es baja, como sucede en el resto de las colonias analizadas, entonces se ha producido un cuello de botella en la población seguido por un rápido crecimiento de la población y acumulación de mutaciones. Valores de diversidad del 90 % e incluso del 95 % son reportados comúnmente en estudios con microsatélites (Balloux y Lougon, 2002). Estos elevados valores fueron también observados en el presente estudio aunque fueron más abundantes valores de heterocigosidad del 70 al 80 %. 4.4. Consecuencias de la filopatría y fidelidad al sitio de anidación en la estructuración genética Carr (1975) hizo distinciones para las tortugas marinas entre la discriminación regional (filopatría) y el regreso a una playa, que incluye una escala más fina (fidelidad a un sitio). Las tortugas verdes muestran una elevada fidelidad a un sitio de anidación específico (Miller, 1997). La filopatría es el paradigma dominante para las migraciones de tortugas marinas, aunque la especificidad geográfica de este comportamiento varía bastante, al parecer. Recientemente, DISCUSIÓN 91 los investigadores han estado volviendo su atención hacia análisis más finos de la filopatría. Aunque está claro que las tortugas hembras regresan para anidar a sus playas natales, la especificidad geográfica de la filopatría es incierta. En estudios iniciales con ADNmt, los estudios en playas de anidación se prolongan unas decenas o cientos de kilómetros en el litoral. El problema más interesante es si las hembras regresan a su sitio natal o si definen una playa de anidación de manera menos específica a escala regional. Por ejemplo, Bjorndal et al. (2006) observaron estructura poblacional con ADNmt entre islas separadas por 1800 km, pero no entre islas separadas por 150 km. Bourjea et al. (2007) encuentran diferenciación genética entre sitios a más de 500 km de separación pero no a menos de 150 km en el sudoeste del Océano Indico. Los estudios con microsatélites para analizar playas de anidación próximas han comenzado a solucionar este problema. Lee et al. (2007) usan la prueba de asignación para evaluar la filopatría a una escala de pocos kilómetros en la Isla de Ascensión. Ellos observaron un signo modesto pero significativo para dos de tres playas. Un estudio similar por Peare y Parker (1996) empleando minisatélites informó estructura poblacional entre áreas de anidación a escala de 10 km en Tortuguero, Costa Rica, pero no en la Playa de Melbourne, Florida, EE.UU. Es claro que el problema de precisión en la filopatría necesita más investigación. La alta fidelidad de las hembras a un área de anidación específica (>90 %) fue encontrada en este trabajo, lo que se explica por una conducta ya planteada para las tortugas marinas (Grassman y Owens, 1981; Bowen et al., 1989; Meylan et al., 1990; Limpus et al., 1992., Miller, 1997). Los fallos a la fidelidad al sitio ocurrieron en su mayoría entre playas adyacentes y que constituyen una unidad desde el punto de vista genético (La Barca y el Holandés; Antonio y Perjuicio). No obstante, los fallos al a fidelidad ocurrida entre años se producen en su mayoría del resto de las playas hacia La Barca, la playa ubicada más al centro de la Península. Aunque no necesariamente regresen a la playa donde nacieron, los estudios genéticos han demostrado que las tortugas reproductoras sí regresan a la región de nacimiento (Bowen et al., 1992). Lo anterior se pudo constatar en este trabajo ya que sólo el 6,3 % de las hembras ovígeras fue encontrado en más de una playa, que distaban en su mayoría menos de 30 km entre ellas. Al respecto la Caribbean Conservation Corporation (1996) plantea que la fidelidad a un área determinada no se limita a que las hembras aparecen siempre en la misma playa, sino que a menudo emergen a unos cientos de metros del lugar donde realizaron la anidación previa. Esta afirmación también fue comprobada en el presente estudio, pues las hembras mostraron fidelidad incluso al mismo sector de la playa. DISCUSIÓN 92 De manera general una vez que ha regresado a la región donde nació y selecciona una playa de anidación, una tortuga tenderá a reanidar en una proximidad cercana, 0/0,5 km. durante los intentos de anidación subsiguientes, aunque un pequeño porcentaje utilizará sitios más distantes dentro del área total (Bjorndal et al., 1985). Para determinar de qué manera ocurre el flujo génico entre las poblaciones del suroccidente de Cuba se prueban dos modelos. El modelo de aislamiento por distancia que examina la relación del flujo génico entre pares de poblaciones (M, equivalente a Nm entre pares de poblaciones) con la distancia geográfica (Slatkin, 1993) y el de islas infinitas (infinite islands model) de Wright (1951). Este último considera condiciones en equilibrio entre un número infinito de islas o subpoblaciones de igual tamaño, que intercambian migrantes entre cualquiera de las islas con igual probabilidad, a una tasa constante. Dados los niveles de diferenciación encontrados entre pares de poblaciones, especialmente con el ADNmt, el modelo que más se ajusta es el primero. Otros factores pueden determinar las relaciones entre las poblaciones además de su separación, como es el caso de los patrones de corrientes existentes en la zona (Anexo 6) o el acceso restringido que tienen las playas del interior de la Península de Guanahacabibes. Un elemento a favor de esta diferenciación con la distancia es la observación de las clinas descritas en varios de los haplotipos. Las clinas genéticas han sido descritas previamente para Caretta caretta (Shamblin et al., 2007; Ruiz et al., 2008) pero con un gradiente latitudinal. Sin embargo, no se había observado previamente un gradiente longitudinal de la variación genética en tortugas marinas y, menos aún, para C. mydas. Como se menciona con anterioridad, las limitaciones en el acceso al igual que las corrientes marinas (Anexo 6) son probablemente la causa de esta distribución espacial tan inusual. El punto de inicio es el occidente de Guanahacabibes, la zona más externa y próxima a la corriente del Golfo, donde existe una mayor probabilidad de la llegada de un número variado de haplotipos, incluyendo fallos a la filopatría como es el caso del haplotipo A12, oriundo de Brasil. A partir de esta zona, disminuye la proximidad a las grandes corrientes transportadoras, tanto hacia el interior de Guanahacabibes como al interior del archipiélago de los Canarreos. Por este motivo se observan clinas en estas dos direcciones. Otro de los indicios para movimientos migratorios a largas distancias es la presencia en varias colonias del suroccidente cubano del haplotipo A13, descrito por primera vez en Chipre. Debido a que se diferencia solamente por un cambio de otros haplotipos endémicos de Cuba (A27 y A56) se podría pensar en una evolución convergente. Sin embargo, su relación con el DISCUSIÓN 93 haplotipo ancestral a través de los haplotipos cubanos conduce a la valoración de una posible colonización del Mediterráneo vía Caribe y Cuba en particular. A pesar de no encontrar una relación entre las salidas quincenales en dependencia de la playa, debido principalmente a la similitud en las frecuencias de las playas interiores, sí es evidente que en dos de las tres playas externas (Caleta de los Piojos y Los Cayuelos) el pico de las anidaciones ocurre una quincena antes que en el resto. Esto es un indicativo de que las tortugas llegan siguiendo la fuerte Corriente del Golfo que pasa muy cercana a esa zona y luego se introducen en busca de las otras playas. Esto se confirma a partir de la dirección del flujo genético estimada a partir del ADNmt que indica un movimiento de individuos del occidente de la península hacia el interior. De igual manera, la dirección del flujo hacia y desde las otras colonias del archipiélago (San Felipe y Cayo Largo) se ajusta a los patrones de corrientes de la zona, debido a los dos giros que se forman cerca de las mismas, que permiten el movimiento en ambas direcciones (Anexo 6). En estudios con marcadores satelitales, el análisis de las trayectorias mostró que las tortugas marinas no compensaron la deriva de las corrientes marinas. Aparentemente, se movieron de forma directa con mayor o menor precisión hacia sus áreas de anidación, pero las corrientes les hicieron tomar las rutas menos eficientes (Girard et al. 2006). Se advierten evidencias de la relación existente entre la conducta migratoria de las tortugas verdes y las corrientes marinas superficiales (Cheng y Cai, 2007). Algunas tortugas utilizan las corrientes más fuertes por cortos períodos de tiempo. Incluso pueden utilizar las corrientes como guía en las áreas de alimentación para aproximarse hacia aguas someras. Una vez dentro de la Península esta asociación migración-corrientes es más difícil de seguir. El predominio de trayectorias en dirección este-oeste, en la primera salida pudiera ser una evidencia de que las tortugas que anidan en la costa sur de la Península de Guanahacabibes realmente se ajustan al patrón de las corrientes para realizar sus desplazamientos luego de abandonar las playas de anidación. Acosta et al., (1987) encuentran que la tortuga prieta que anida en el Pacífico Sur de México se desplaza hacía Centroamérica coincidiendo con las corrientes de la zona. Estos autores plantean que los desplazamientos que realizan las tortugas marinas hacia sus diferentes destinos sugieren un gasto energético elevado, además de la energía que utilizan en la reproducción. Es por ello que los medios de navegación deben permitirles el menor gasto posible, lo cual puede suceder si sus desplazamientos se sincronizan con la velocidad y dirección de las corrientes marinas. Esto podría significar que los movimientos hacia las DISCUSIÓN 94 playas son independientes de la migración o que la migración está ocurriendo en dirección opuesta a lo esperado. Entender el patrón y el grado de divergencia genética entre poblaciones es crucial para la protección de especies y elaboración de planes de manejo adecuados (Allendorf y Luikart, 2007). Para la interpretación de la diferenciación y flujo entre las subpoblaciones, el uso del estadístico Fst es fundamental pues determina el grado de divergencia entre ellas (Allendorf y Luikart, 2007). La diferenciación que se observa entre las colonias empleando el ADNmt es grande, sin embargo, es baja considerando los microsatélites. En el caso particular de los microsatélites se esperaría la presencia de un flujo genético alto entre las poblaciones a partir de los resultados obtenidos en estudios previos en otras áreas de anidación (Karl et al. 1992; FitzSimmons et al., 1997a; Roberts et al., 2004).. El flujo genético alto evita la adaptación local (es decir la fijación de alelos que son favorecidos bajo las condiciones locales), e impedirá por consiguiente también el proceso de diferenciación (Barton, 2001). Sin embargo, con ninguno de los marcadores supera los 25 individuos por generación, exceptuando el centro y oriente de Guanahacabibes para el ADNmt con más de 500 individuos. Por otro lado, el flujo genético produce nuevo polimorfismo en las poblaciones y aumenta el tamaño efectivo de la población local (la habilidad de resistirse a los cambios aleatorios en las frecuencias de los alelos), con lo que genera nuevas combinaciones en las que la selección natural puede actuar potencialmente (Barton, 2001). Naro-Maciel et al. (2007), empleando microsatélites, encuentran una débil estructura de las tortugas verdes del Atlántico. La diferenciación genética fue menos pronunciada en los loci microsatélites que en la región control del ADNmt. Resultados similares en colonias se atribuyen en primer lugar a la influencia homogeneizadora del flujo genético mediado por los machos detectado en los loci nucleares (Karl et al. 1992; FitzSimmons et al., 1997a; Roberts et al., 2004). En algunas áreas, el flujo genético se piensa que ocurre durante las migraciones reproductivas que se superponen espacialmente (FitzSimmons et al., 1997a y 1997b) y pudiera estar mediado por los machos (Karl et al. ,1992; Roberts et al., 2004). Fst es un estadístico afectado por las tasas de mutación. En el caso particular de los microsatélites, donde existen eventos de homoplasia, los valores de Fst se reducirán por este efecto aún cuando no exista migración entre las subpoblaciones analizadas. Rst, por su parte, es independiente de las tasas de mutación siempre que se cumpla el modelo de mutación por pasos (SMM). Desafortunadamente no es robusto cuando existen desviaciones de este modelo lo cual es común en muchos microsatélites por lo que se convierte en una función DISCUSIÓN 95 tanto de la migración como la mutación (Balloux y Lougon, 2002). El factor importante no es la mutación per se sino la magnitud de la relación de la mutación sobre la migración. Cuando el flujo genético es limitado, la mutación puede convertirse en un factor importante a ser tenido en cuenta, más que la migración. Si los niveles de intercambio son elevados, la mutación no es tan relevante (Balloux y Lougon, 2002). Esto pudiera explicar las diferencias en los resultados que aportan ambos estadísticos para los resultados con microsatélites de las poblaciones del suroccidente de Cuba. Mientras que con Fst se encuentran diferencias entre todas las poblaciones, con Rst existe una mayor interconexión entre ellas. Es decir, las diferencias en las frecuencias de los alelos, dada fundamentalmente por el intercambio genético (salvo que exista homoplasia), genera mayor variación entre las poblaciones. En cambio las diferencias en cuanto a las tallas de los alelos presentes en cada población, generadas por procesos de mutación, son mucho menores o simplemente no existen. En resumen, todo parece indicar que, al menos para la zona estudiada, las limitaciones en el intercambio de individuos son el factor desencadenante de la diferenciación entre las poblaciones estudiadas. Recientemente ha sido criticada la utilidad del Fst y otros métodos similares para analizar los datos genéticos de poblaciones naturales (Whitlock y McCauley, 1999; Pearse y Crandall, 2004). Estos estudios revelan que el Fst, que se deriva de un conjunto de asunciones idealizadas y muy poco realistas debe interpretarse con cautela cuando viene de poblaciones naturales, particularmente en aquellas con interés para la conservación donde tales asunciones probablemente son violadas. La interpretación de Fst per se, puede ser un arma de doble filo. Por ejemplo, valores idénticos de Fst pueden ser estimados de patrones diferentes de frecuencias alélicas (Wright, 1978). La interpretación de los extremos teóricos de Fst (0 y 1) es, sin embargo, fiable. Un valor de cero significa que las subpoblaciones analizadas son una unidad (no existe diferenciación), mientras que un valor de uno, es medida de que las subpoblaciones están completamente regidas por alelos diferentes. No obstante, la prueba de Chi cuadrado realizada a las frecuencias alélicas de las poblaciones cubanas reafirma los resultados encontrados con el Fst. En contraste, la prueba de asignación desarrollada por Paetkau et al. (1995) estima la probabilidad de asignación de cada individuo a una población fuente potencial, y la similitud de los genotipos multilocus individuales proporciona un medio de agrupar a los individuos en las poblaciones así como excluir una población como el origen de un individuo (Cornuet et al. 1999). El enfoque basado en el individuo proporciona un poder potencialmente mayor que el DISCUSIÓN 96 Fst como discernidor a escala fina de los modelos genéticos (Waser y Strobeck, 1998), sobre todo cuando se emplea con sitios muy inconstantes (Campbell et al. 2003). De hecho, Paetkau et al. (1995) originalmente desarrollaron el método para cuantificar grados sutiles de diferenciación genética entre poblaciones de oso polares que habían demostrado previamente ser difíciles de estudiar debido a la baja variación en marcadores como aloenzimas y ADNmt. A partir de este primer uso, las pruebas se han aplicado para la asignación de individuos o muestras a las poblaciones fuente. Con los datos del suroccidente cubano se prueba la utilidad de este método para asignar individuos a sus poblaciones. En el peor de los escenarios se logró identificar de modo correcto alrededor del 50 % de los individuos con su localidad fuente, aunque se llegó hasta el 100% en uno de los casos. Se informa que la elevada variabilidad de los microsatélites así como el número de ellos empleado pueden limitar la efectividad de este método (Paetkau et al., 1995), sin embargo, los mejores resultados en el presente estudio fueron encontrados empleando ocho loci microsatélites. Con el empleo del STRUCTURE, también fue posible distinguir grupos, incluso dentro del área de Guanahacabibes, aunque la resolución de esta prueba fue menor. De acuerdo al algoritmo propuesto por Evanno et al. (2005), el número de grupos más factible occila entre tres y cuatro (Anexo 8). En función de este ordenamiento, se pueden separar tres regiones en Guanahacabibes: occidente, centro y oriente que se distinguen del resto del archipiélago pero el resto de las colonias no se diferencia. Karl et al. (1992) proporcionan la primera comparación de resultados genéticos del ADNmt y ADNn, a la vez que permiten la resolución de influencias maternales y paternales en la estructura genética de la población. En su estudio reanalizan la filopatría en las islas de Ascensión y Surinam en las que anidan poblaciones de tortugas verdes que no comparten ningún haplotipo de ADNmt y la estimación de flujo genético materno es cercano a cero (Bowen et al. 1992). Basados en cinco loci nucleares, las dos poblaciones son indistinguibles, y el flujo genético correspondiente indica que existe un flujo o intercambio genético reciente. A gran escala, Karl et al. (1992) informan una baja estructura poblacional con RFLPs aplicados a siete loci nucleares (Fst Atlántico = 0.130, Indo-Pacífico Fst = 0.126), comparado con el ADNmt (Gst Atlántico = 0.63, Indo-Pacífico Gst = 0.71; Bowen et al. 1992). Un estudio con 4 microsatélites para inspeccionar el mismo rango corrobora este hallazgo (Fst Atlántico = 0.038, Indo-Pacífico Fst = 0.024: Roberts et al., 2004). Estos estudios demuestran un flujo genético significativo mediado por machos entre colonias de anidación, un hallazgo apoyado por estudios de ADNmt y microsatélites en el Pacífico Oriental (FitzSimmons et al. 1997b), DISCUSIÓN 97 aunque según estos autores el flujo genético se produce con mayor probabilidad durante las migraciones o por fallos a la fidelidad tanto de machos como de hembras ya que también encontraron fidelidad de los machos a las áreas de reproducción. La discrepancia genética entre el ADNmt y los estudios del ADNn proporcionan dos lecciones sobre la estructura poblacional relevantes para el manejo en vida libre de tortugas marinas y otros animales marinos migratorios: 1. Las poblaciones de anidación son unidades de manejo independientes sin tener en cuenta el nivel de flujo génico mediado por los machos. Esto se justifica evaluando las dos posibilidades extremas de extinción de uno de los géneros. Si desaparecen los machos, las hembras que anidan todavía tienen posibilidad de fecundarse durante sus recorridos migratorios desde las áreas de alimentación. Si las que se extinguen son las hembras entonces la población que anida desaparece. Las hembras transmiten los caracteres genéticos de la vida a través de las generaciones (Avise, 1995) y la conducta filopátrida de la hembra define las poblaciones reproductivas independientemente de la conducta de los machos. 2. Tanto el ADNn o el ADNmt por separado solo podrían proporcionar conclusiones incompletas y engañosas sobre la estructura de la población. El estudio con ADNmt exclusivamente de los juveniles de tortugas del Atlántico Norte indicaría una sola población panmíctica y disimularía la verdadera estructura de subadultos y adultos reproductores. 4.5. Tamaño efectivo de las poblaciones Se observó que el tamaño efectivo calculado es mayor que el censado, aunque en el mismo orden de magnitud con la mayoría de los estimadores. Esto puede deberse a que la gran variabilidad genética encontrada en poblaciones tan pequeñas puede conllevar a sobreestimar sus tamaños efectivos. Estos dependen de la diversidad genética sobre todo si es alta, aunque en teoría están en correlación positiva con el tamaño de la población (Soule y Khom, 1989; Frankham, 1996). También puede ser el resultado de eventos de colonización múltiples, o de migración desde otras poblaciones diferentes. Esto también explica el contraste entre los valores estimados para la población de Cayo Largo y los resultados de los censos debido a que Cayo Largo es una población grande con baja variabilidad genética. Este mismo comportamiento se observa en la colonia de anidación de Costa Rica (Bjorndal et al., 2005). Estimados de la tasa, a la cual se generan nuevos rasgos cuantitativos mediante la mutación, fueron utilizados para sugerir que las poblaciones deben mantenerse con un tamaño efectivo mínimo de 500 individuos para lograr la sostenibilidad a largo plazo (Soule, DISCUSIÓN 98 1980; Franklin, 1980). Según este criterio, las poblaciones analizadas presentan tamaños efectivos en el límite o insuficientes para garantizar su continuidad. Esto puede ser el resultado de una reducción histórica o reciente de sus poblaciones lo cual es señalado por los estadísticos de cambios demográficos analizados para cada marcador molecular. Por otra parte, aunque los estimados a partir del método de Jolly-Seber dan valores más altos, este método no es muy efectivo para las poblaciones de tortugas marinas pues, entre otras asunciones, presupone que la probabilidad de recaptura de todos los animales marcados es la misma a lo largo de muestreos sucesivos cuando en realidad esta probabilidad depende del intervalo de remigración de las tortugas que puede variar desde un año hasta 6 o más años. Los tamaños poblacionales estimados por los diferentes métodos coinciden en ubicar a las mayores poblaciones en áreas con características geomorfológicas particulares (por ejemplo la ausencia de barrera arrecifal) como es el caso de Antonio, La Barca y Caleta de los Piojos en Guanahacabibes y Cayo Largo al este del archipiélago. A pesar de los tamaños poblacionales pequeños de manera individual, dos de las áreas de anidación cubanas (Guanahacabibes y Cayo Largo) tienen un tamaño efectivo superior (<500 hembras) al de dos de las regiones del Caribe descritas como índices dentro de la distribución mundial de la especie C. mydas (Seminoff, 2002) que es el caso de la Península de Yucatán, México e Isla de Aves en Venezuela con menos de 500 hembras. 4.6. Definición de las unidades de conservación Las unidades de manejo se identifican con las poblaciones que son demográficamente independientes, es decir, que la dinámica poblacional depende en mayor medida de las tasas de nacimiento y muerte que de la migración (Allendorf y Luickart, 2007). En este caso, aunque las tasas de migración por generación pueden alcanzar los 20 individuos, la marcación física no muestra un intercambio de individuos superior a dos entre zonas diferentes desde el punto de vista genético. En general, las unidades de manejo no muestran evolución a largo plazo o una fuerte diferenciación adaptativa. Las unidades de manejo deben representar poblaciones que sean importantes para la persistencia a largo plazo de la unidad de significación evolutiva. La comprensión de los movimientos de las hembras como el que se obtiene a partir del ADNmt es de un relevancia particular para definir unidades de manejo porque la colonización por hembras es crucial para mantener la viabilidad de las metapoblaciones a raíz de una perturbación (Avise, 1995). Una limitación común a todos los estudios del ADNmt anteriores DISCUSIÓN 99 es que ellos raramente comparan colonias a escalas pequeñas (<500 km), de modo que la magnitud del intercambio a una escala local no ha sido determinada. Una segunda limitación general de tales estudios es que, a pesar del énfasis puesto en la diferenciación del ADNmt (ej. Moritz, 1994; Avise, 1995), hay una considerable incertidumbre al estimar la tasa de migración del ADNmt (Whitlock y McCauley, 1999; Ballard y Whitlock, 2004). En este contexto, es muy deseable combinar evidencias obtenidas con ADNmt con datos de marcación-recaptura para probar su congruencia. En general solo se han realizado comparaciones a gran escala para las tortugas marinas. Las diferencias genéticas que se han verificado a lo largo de este documento indican que, al menos las cuatro áreas de anidación consideradas (Guanahacabibes, San Felipe, Isla de la Juventud y Cayo Largo) deben ser manejadas de manera independiente con el fin de conservar su valor genético, particularmente ante el aparente estado de declive en el cual se encuentran. Dentro de Guanahacabibes, Caleta de los Piojos requiere particular atención por su posición geográfica clave que determina su gran variabilidad. Finalmente, a pesar de no encontrarse diferencias entre las playas internas de la Península de Guanahacabibes con el ADNmt, los loci microsatélites sí discriminan entre todas ellas, excepto La Barca y El Holandés, que se encuentran a sólo dos kilómetros y, por tanto, fueron manejadas en todo momento como una unidad. Esta separación que indica un pasado más reciente, e incluso lo que ocurre actualmente, sugiere que se consideren las playas de Guanahacabibes como unidades de manejo independientes. Los resultados de este estudio constituyen solamente la primera aproximación hacia la caracterización de los valores reproductivos de las poblaciones que anidan en el occidente cubano. Aunque se destaca la importancia de las colonias de anidación del suroccidente del archipiélago cubano, también se apunta la necesidad de un seguimiento a largo plazo antes de que muchas de las preguntas relacionadas con su biología reproductiva y dinámica poblacional puedan ser resueltas. De todos modos la información obtenida es necesaria para establecer las prioridades de conservación dentro del contexto de los planes de manejo nacionales y para una protección y seguimiento más eficiente de la anidación en las playas del suroccidente de Cuba. 100 CONCLUSIONES 1.- La marcada estacionalidad anual de las anidaciones de C. mydas está relacionada con la frecuencia de remigración de las hembras, debido a la coincidencia del ciclo bienal con una mayor frecuencia de remigraciones cada dos años. Los períodos de remigración, unido al reclutamiento de hembras jóvenes, determinan la existencia de un mayor número de hembras sin marcar con relación a las remigrantes. No obstante, las variaciones en el intervalo de remigración produce una mezcla de individuos entre los años por lo que no se observan diferencias genéticas en el tiempo, lo que demuestra desde el punto de vista teórico la complejidad del ciclo reproductivo de esta especie. 2.- La estacionalidad de las anidaciones dentro de la temporada reproductiva tiene dos componentes principales: el momento en que se produce el pico reproductivo dentro de la temporada y el momento del ascenso de las tortugas a la playa. El primero se produce cuando se alcanza una temperatura atmosférica óptima entre 27,5 y 28,5oC y los mayores acumulados mensuales de precipitaciones, generalmente en el mes de julio. Por otra parte, la luna llena parece ser determinante en la primera salida de las hembras a la playa. La salida a las playas ocurre en horas cercanas a la media noche en dependencia de la posición de la luna respecto a la playa y el momento en que se produce el llenante de la marea. Estos datos permiten establecer los intervalos óptimos para el trabajo en las playas. 3.-Como parte de su estrategia reproductiva, las hembras de C. mydas que anidan en la Península de Guanahacabibes seleccionan playas de grano grueso, alta energía, con una pendiente cercana a los 6o, con presencia de una línea de vegetación secundaria de Trinax radiata y que no presentan barrera de arrecifes que limiten el acceso de las hembras. En la práctica, la correcta identificación de las playas con condiciones adecuadas para la anidación de C. mydas, permite concentrar en ellas los esfuerzos de conservación. 4.- Una vez seleccionado el sitio de anidación, las hembras anidadoras de C. mydas permanecen fieles a él incluso dentro de la misma playa, por lo que se observa solamente un 6,3% de fallos a la fidelidad, la mayor parte después de la ocurrencia de los ciclones. Estos eventos, además de disminuir la supervivencia de embriones y crías, transforman las playas, por lo que las hembras alteran sus recorridos habituales para ubicar nuevos sitios apropiados para la anidación. La fidelidad al sitio de anidación también se refleja en una 101 diferenciación genética a escala microgeográfica entre las colonias de Guanahacabibes lo que demuestra que los niveles de filopatría y fidelidad al sitio en C. mydas son elevados. 5.- La distribución geográfica particular de las colonias de anidación del suroccidente de Cuba y su accesibilidad en función de los patrones de corrientes, unida a las características de las playas, contribuyen a la diferenciación genética y al elevado endemismo haplotípico encontrado, al punto de originar un gradiente longitudinal en la distribución de los haplotipos. La diferenciación con el ADNmt distingue cinco regiones: el occidente de Guanahacabibes, el interior de la Península, San Felipe, la Isla de la Juventud y Cayo Largo. Con los microsatélites se logra una mayor resolución entre las colonias de Guanahacabibes. Estos aspectos se deben considerar en el manejo de la especie con el fin de preservar el valor genético de cada una de estas colonias. 6.- Los estimados del tamaño efectivo de las poblaciones indican tamaños pequeños (<500 hembras), con la excepción de Cayo Largo, lo cual se ajusta a lo esperado después de una contracción crítica de su tamaño histórico, comprobado con los dos marcadores moleculares. Los mayores tamaños efectivos se encuentran en playas con características geomorfológicas similares. Desde el punto de vista de la conservación de la especie, el tamaño estimado de las colonias de la Península de Guanahacabibes amerita una reevaluación en cuanto a su importancia respecto al resto de las colonias de anidación en el área del Caribe. 102 RECOMENDACIONES 1.- Realizar la evaluación de las características geomorfológicas en las principales playas de anidación del archipiélago cubano e identificar las que presentan las características apropiadas de acuerdo con este estudio. Una vez corroborada su importancia según los niveles de anidación, concentrar los mayores esfuerzos de conservación en las que presenten las mejores características para la anidación. 2.- Reevaluar los planes de manejo de la tortuga verde en el archipiélago cubano a partir del seguimiento de los factores afectados por el cambio global como el nivel del mar, la temperatura y los eventos meteorológicos. 3.- Considerar las colonias estudiadas en el suroccidente del archipiélago cubano como unidades de manejo independientes y prestar especial atención a las de mayor variabilidad como Caleta de los Piojos o con el mayor número de haplotipos representativos como es el caso de la Isla de la Juventud. 4.- Realizar nuevos análisis aumentando el tamaño de muestras para San Felipe e Isla de la Juventud. 5.- Utilizar rastreos satelitales para verificar patrones de migración durante período interanidatorio (intra temporada de anidación) y sus derroteros migratorios. 6.- Continuar programas de marcado para solidificar estimaciones de parámetros críticos (tasa de mortalidad, proporción remigrantes:neófitas y tasas de migración entre colonias) 103 REFERENCIAS BIBLIOGRÁFICAS Ackerman, R. A. (1980): Physiological and ecological aspects of gas exchange by sea turtle eggs. Amer. Zool. (20): 575–583. Ackerman, R. A. (1997): The nest environment and the embryonic development of sea turtles, pp. 83-106. En: P. L. Lutz y J. A. Musick (eds.) The Biology of Sea Turtles. CRC Press, Boca Raton, Florida. Ackerman, R. A., R. C. Seagrave y R. C. Dmiel (1985): Water and heat exchange between parchment-shelled reptile eggs and their surroundings. Copeia 1985: 703-711. Ackerman, R. A., y H. D. Prange (1972): Oxygen diffusion across a sea turtle (C. mydas) eggs shell. Comp. Biochem. Physiol. 43A: 905-909. Acosta, A., P. Alarcón y U. Guzmán (1987): Evaluación de la actividad migratoria de la tortuga negra C. agassizi. (Inédito). México. Addison, D. S., J. A. Gore., J. Ryder y K. Worley (2002): Tracking post-nesting movements of loggerhead turtles (Caretta caretta) with sonic and radio telemetry on the southwest coast of Florida, USA. Mar. Biol. (141): 201-205. Aggarwal R. K., T. P. Velavan, D. Udaykumar, P. S. Hendre, K. Shanker, B. C. Choudhury y L. Singh (2004): Development and Characterization of novel microsatellite markers from the olive ridley sea turtle (Lepidochelys olivacea). Mol. Ecol. Not., (4): 77-79. Aiken. J. J., B. J. Godeny, A. C. Broderick, T. Austin, G. Ebanks-Ptrie y G. C. Hays (2001): Two hundred years after a commercial marine turtle fishery: the current status of marine turtles nesting in the Cayman Island. Allard, M.W., M. M. Miyamoto, K. A. Bjorndal, A.B. Bolten, y B.W. Bowen (1994): Support for natal homing in green turtles from mitochondrial DNA sequences. Copeia 1994 (1): 34-41. Allendorf, F.W. y G. Luikart (2007): Conservation and the Genetics of Populations. Blackwell Publishing. Alvarez Y., J.A. Mateo, A.C. Andreu, C. Diaz-Paniagua, A. Diez y J.M. Bautista (2000): Mitochondrial DNA haplotyping of Testudo graeca on both continental sides of the Straits of Gibraltar. J Hered. Jan-Feb; 91(1):3941. Anónimo (2000): Tablas de Marea de las Costas de Cuba. Servicio Hidrográfico y Geodésico de la República de Cuba. Edimar, Agencia de Cartografía Náutica. p. 27-29 Anónimo (2001): Tablas de Marea de las Costas de Cuba. Servicio Hidrográfico y Geodésico de la República de Cuba. Edimar, Agencia de Cartografía Náutica. p. 24-25 Anónimo (2002): Tablas de Marea de las Costas de Cuba. Servicio Hidrográfico y Geodésico de la República de Cuba. Edimar, Agencia de Cartografía Náutica. p. 24-25 Anónimo (2003): Tablas de Marea de las Costas de Cuba. Servicio Hidrográfico y Geodésico de la República de Cuba. Edimar, Agencia de Cartografía Náutica. p. 24-25 Anónimo (2004): Tablas de Marea de las Costas de Cuba. Servicio Hidrográfico y Geodésico de la República de Cuba. Edimar, Agencia de Cartografía Náutica. p. 24-25 Anónimo (2007): Tablas de Marea de las Costas de Cuba. Servicio Hidrográfico y Geodésico de la República de Cuba. Edimar, Agencia de Cartografía Náutica. p. 23-28 Antworth, R. L., D. A. Pike y J.C. Stiner (2006): Nesting ecology, current status, and conservation of sea turtles on an uninhabited beach in Florida, USA. Biol. Cons. (130):10–15 Avise J.C. (1994): Molecular markers, natural history and evolution. Ed. Chapman y Hall. N.Y. p. 511. REFERENCIAS BIBLIOGRÁFICAS 104 Avise J.C. (1995): Mitochondrial DNA polymorphism and a connection between genetics and demography of relevance to conservation. Cons. Biol., (9): 686–690. Avise, J. C., B. W. Bowen, T. Lamb, A. B. Meyland, y E. Bermingham (1992): Mitochondrial DNA evolution at a turtle´s pace: Evidence for low genetic variability and reduced microevolutionary rate in the Testudines. Mol. Biol. Evol. (9): 457-473. Avise,J. C., J. Arnold, R. M. Ball, E. Bermingham, T. Lamb, J. E. Neigel, C. A. Reeb y N. C. Saunders. (1987): Intraspecific phylogeography: the mitochondrial DNA bridge between population genetics and systematics. Annu. Rev. Ecol. Syst. 18:489-522. Bagley, D. A. (2003): Characterizing juvenile green turtles (Chelonia mydas) from three east central Florida developmental habitats. MS thesis, University of Central Florida, Orlando, Florida, USA. Balazs, G. H. (1999): Factors to consider in the tagging of sea turtles. En: Eckert K. L.; K. A. Bjorndal; F. A. Abreu-Grobois y M. Donnelly (eds.). Research and management techniques for the conservation of sea turtles. IUCN/SSC Marine turtle specialist group publication (4): 101-109. Balazs, G. H. (2000): Factores a considerar en el marcado de tortugas marinas En: Eckert, K., Bjorndal, K., Abreu, F. y Donnelly, M. (editors). Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. Grupo Especialista en Tortugas Marinas UICN/CSE. Publicación No. 4, pp. 125-166. Balazs, G. H., P. B. R. CraigWinton, R. K. y Miya (1994): Satellite telemetry of green turtles nesting at French Frigate Shoals, Hawaii, and Rose Atoll, American Samoa. En: Proceedings of the 18th Annual Workshop on Sea Turtle Biology and Conservation, NOAA Technical Memorandum, NMFS-SEFSC-351 p. 184 Balazs, G.H. y M. Chaloupka (2004): Thirty-year recovery trend in the once depletedHawaiian green sea turtle stock Biological Conservation 117: 491–498 Ballard, J. W. O. y M. C. Whitlock (2004): The incomplete natural history of mitochondria. Mol. Ecol. 13: 729– 744 Balloux, F. y N. M. Lougon (2002): The estimation of population differentiation with microsatellite markers. Molecular Ecology (11): 155-165. Barrán, T. (2007): Hurricane Toll: Variable Effects of Large-Scale Climatic Perturbations on Green Sea Turtle (C. mydas) Nesting Behaviour and Ecology A thesis submitted to the Department of Biology in partial fulfilment of the requirements of the degree of Bachelor of Science (Honours) Queen's University Kingston, Ontario, Canada. 64 pp. Bartlett, J. M. S. y D. Stirling (2003): A Short History of the Polymerase Chain Reaction. En: Methods in Molecular Biology, PCR Protocols. 2da edición. Ed: J. M. S. Bartlett y D. Stirling Humana Press Inc., Totowa, NJ Vol. 226: 3-6 Barton, N. H. (2001): The role of hybridization in evolution. Mol. Ecol. (10): 551–568. Bass, A. L., S. P. Epperly y J. Braun-McNeill (2006): Green Turtle (C. mydas) Foraging and Nesting Aggregations in the Caribbean and Atlantic: Impact of Currents and Behavior on Dispersal. Jour. Her. 97(4): 346–354 Bass, A. y W.N. Witzell (2000): Demographic composition of inmature green turtle (C. mydas) from the east central Florida coast: evidence from mtDNA markers. Herpetologica. (56): 357-367 Beerli, L. (2004): Programa Migrate. Versión 2.0. Universidad de Florida Belkhir, K., P. Borsa, J. Goudet, L. Chikni, y F. Bonhomme (1998): GENETIX, logiciel soud Windows TM pour la génetique des populations. Laboratoire Génome et Population, CNRS UPR 9060, Université de Montpellier (France) REFERENCIAS BIBLIOGRÁFICAS 105 Bilinski, J.J., R. D. Reina, J. R. Spotila, y F. V. Paladino (2001): The effects of nest environment on calcium mobilization by leatherback turtle embryos (Dermochelys coriacea) during development. Comp. Bioch. Physiol. Part A (130): 151-162. Bjorndal, K. A. (1980): Dermography of the breeding population of the green turtle, C. mydas, at Tortugero, Costa Rica, Copeia. p. 525. Bjorndal, K. A., A. B. Bolten y M. Y. Chaloupka (2005): Evaluating trends in abundance of inmature green turtle C. mydas in The Greater Caribbean. Ecol. Applic. 15(1): 304–314. Bjorndal, K. A. y A. Carr (1989): Variation in clutch size and egg size in the green turtle nesting population at Tortuguero, Costa Rica. Herpetologica 45 (2): 181-189. Bjorndal, K. A., A. Carr, A. B. Meylan y J. A. Mortimer (1985): Reproductive biology of the hawksbill Eretmochelys imbricata at tortuguero, Costa Rica, With notes on the ecology of the species in the Caribbean, Biol. Conserv., 343-353. Bjorndal, K. A., J. A. Wetherall, A. B. Bolten y J. A. Mortimer (1999):Twenty-Six Years of Green Turtle Nesting at Tortuguero, Costa Rica: An Encouraging Trend. Cons. Biol. 13(1): 126–134. Bolker, B. M., T.Okuyama, K.A. Bjorndal y A. B. Bolten. (2007): Incorporating multiple mixed stocks in mixed stock analysis: ‘many-to-many’ analysis Mol. Ecol. (16): 685–695 Bolten, A. (1999): Techniques for measuring sea turtles. En: Eckert, K. L.; K. A. Bjorndal; F. A. Abreu-Grobois y M. Donnelly (eds.). Research and management techniques for the conservation of sea turtles. IUCN/SSC Marine turtle specialist group publication. (4): 110-114. Bolten, A. (2000): Técnicas para la medición de tortugas marinas En: Eckert, K. L.; K. A. Bjorndal; F. A. AbreuGrobois y M. Donnelly (eds.). Research and management techniques for the conservation of sea turtles. IUCN/SSC Marine turtle specialist group publication No. 4: p. 126-131 Borhidi, A. (1996): Phytogeography and Vegetation Ecology of Cuba. 347pp. Both, C. y M. E. Visser (2001): Adjustment to climate change is constrained by arrival date in a long-distance migrant bird. Nature 411, 296±298 Bourjea, J., S. Lapègue, L. Gagnevin, D. Broderick, J. A. Mortimer, S. Ciccione, D. Roos, C. Taquet y H. Grizel (2007): Phylogeography of the green turtle, C. mydas, in the Southwest Indian Ocean. Mol. Ecol. (16): 175–186 Bowen, B. W., F. A. Abreu-Grobois, G. H. Balazs, N. Kamezaki, C. J. Limpus y R. J. Ferl (1995): TransPacific migrations of the loggerhead turtle (Caretta caretta) demonstrated with mitochondrial DNA markers. Proc. Natl. Acad. Sci. USA, 92 (9): 3731-3734. Bowen, B. W. y J. C. Avise (1995): Conservation Genetics of Marine Turtles. En: Avise, J. L. y J. L. Hamrick (eds.), Conservation Genetics: Case Histories from Nature. Chapman and Hall, NY, EE.UU. p. 190-237 Bowen B.W., A.L. Bass, L. Soares y R.J. Toonen (2005): Conservation implications of complex population structure: lessons from the loggerhead turtle (Caretta caretta). Molecular Ecology, 14, 2389–2402. Bowen, B. W. y S. A. Karl (2007): Population genetics and phylogeography of sea turtles. Mol. Ecol. (16): 4886–4907 Bowen, B. W., A. B. Meylan, J. P. Ross, C. J. Limpus, G. H. Balazs y J. C. Avise (1992): Global population structure and natural history of the green turtle (C. mydas) in terms of matriarchal phylogeny. Evolution (46): 865-881. Bowen, B. W., A. Meylan y J. C. Avise. (1989): An odyssey of the green sea turtle: Ascension Island revisited. Proc. Natl. Acad. Sci. USA (86): 573-576. REFERENCIAS BIBLIOGRÁFICAS 106 Bowen, B. W., W. S. Nelson, y J. C. Avise (1993): A molecular phylogeny for marine turtles: trait mapping, rate assessment, and conservation relevance. Proc. Natl. Acad. Sci. USA (90): 5574-5577. Brakefield P.M e I.J. Saccheri (1994): Guidelines in conservation genetics and the use of population cage experiments withbutterflies to investigate the effects of genetic drift and inbreeding. Cons. Gen. pp. 165-179. Broderick, A. C., B. J. Godley, y G. C. Hays. (2001): Trophic status drives inter-annual variability in nesting numbers of marine turtles. Proceedings of the Royal Society (268):1481-1487. Broderick, A.C., F. Glen, B. J. Godley y G. C. Hays. (2003): Variation in reproductive output of marine tuytles. Journal of Experimental Marine Biol. and Ecol. (288):95-109. Brown, W. M., M. George y A. C. Wilson (1979): Rapid evolution of animal mitochondrial DNA. Proc. Natl. Acad. Sci. USA 76: 1967-1971. Bryant E.H., S.A. McCommas y L.M. Combs (1986): The effect of an experimental bottleneck upon quantitative genetic variation in the housefly. Genetics. (114): 1191-1211. Buchanan, F.C., L.J. Adams y R.P. Littlejohn (1994): Determination of evolutionary relationships among sheep breeds using microsatellites. Genomics. (22): 397-403. Burke, V. J., S. L Rathbun, J. R. Bodie y J. W. Gibbons (1998): Effect of density on predation rate for turtle nests in a complex landscape. Oikos. (83): 3–11. Bustard, H. R. y P. Greenham (1968): Physical and chemical factores affecting hatching in green sea turtle, C. mydas (L.). Ecology. (49): 269-276. Caldwell, D. K. (1959): The longgerhead turtles of Cape Romain, South Carolina. Bull. Florida State. Mus. Biol. Sci. (4): 319-348. Callen, D. F., A. D. Thompson, Y. Shen, H. A. Phillips y R. I. Richards (1993): Incidence and origin of ''null'' alleles in the (AC)n microsatellite markers. Am. J. Hum. Genet. (52): 922-927. Campbell, L. (2003): Contemporary culture, use, and conservation of sea turtles. En: The biology of sea turtles, Vol II, P. L. Lutz, J. A. Musik and Wyneken (eds), pp 307-338. CRC Press. USA. Campbell D., P. Duchesne y L. Bernatchez (2003): AFLP utility for population assignment studies: analytical investigation and empirical comparison with microsatellites. Molecular Ecology, (12): 1979–1991. Cann, R. L., M. Stoneking y A. C. Wilson (1987): Mitochondrial DNA and human evolution. Nature 325: 31-36. Cardona, C y R. de la Rúa (1972): Protejamos nuestras tortugas. Bol. Divulgación Tec. Inst. Nac. Pesca. (5): 1-35. Caribbean Conservation Corporation http://www.tamar.cccturtle.org/ccctmp.htm). (1996): Behavior Patterns of Sea Turtles. URL: Carr, A. (1967): So excellent a fishe. Natural History Press, New York. 249 pp. Carr, A. (1975): The Ascension Island green turtle colony. Copeia. p. 547. Carr, A. y M. H. Carr (1970): Modulated reproductive periodicity in C.mydas. Ecology. ( 51):335-37. Carr, A., M. H. Carr, y A. B. Meylan (1978): The ecology and migrations of sea turtles, 7. The West Caribbean green turtle colony. Bull.Am. Mus.Nat. His. (162):1-46. Carr, A. y H. Hirt (1962): The ecology and migrations of sea turtles. 5. Comparative features of isolated green turtle colonies. Amer. Mus. Novitates, (2091):42. REFERENCIAS BIBLIOGRÁFICAS 107 Carr, A.F., y L.H. Ogren. (1959): The ecology and migrations of sea turtles, 3. Dermochelys in Costa Rica. Amer. Mus. Novitates. 29 pp. Carr, A.F., y L.H. Ogren. (1960): The ecology and migrations of sea turtles, 4. The green turtle in the Caribbean Sea. Bull. Am. Mus. Nat. His. (121):1-48. Carrasco, M. A., R. Márquez, J. Díaz, V. Benitez, N. Villanueva y M. del C. Jiménez. (1998): Effect of partial shadow in the incubation temperature in Kemp’s ridley (Lepidochelys kempii) nest, in the beach hatcheries, at Rancho Nuevo, Tamaulipas, México. Proceedings of the 18th Annual Workshop on Sea Turtle Biology and Conservation. p. 43-44 Chaloupka, M. (2001): Historical trends, seasonaly and spatial synchrony in green sea turtle egg production. Biol. Cons. (101): 263-279. Chaloupka, M. (2002): Stochastic simulation modelling of southern Great Barrier Reef green turtle population dynamics. Ecological Modelling 148: 79–109 Chaloupka M., C. Limpus y J. Miller (2004): Green turtle somatic growth dynamics in a spatially disjunct Great Barrier Reef metapopulation. Coral Reefs (23):325–335 Chaloupka, M.Y. y J.A. Musick (1997): Age, growth ans population dynamics. En: P.L. Lutz y J.A. Musick, editors. The biology of sea turtles. CRC Press, Boca Raton, Florida. p.233-276. Chassin-Noria O., A. Abreu-Grobois, P. H. Dutton y K. Oyama (2004): Conservation genetics of the east Pacific green turtle (C. mydas) in Michoacan, Mexico. Genetica (121): 195–206. Chávez, A. (1994): Efecto de al Luna en la actividad de los animales. Lunario 2002. CIENTEC. Costa Rica. Cheng, I.J y Y. Cai (2007): Can surface current influence the migration behavior of green turtle? En: Mast, R.B., Hurchinson B.J. y A.H. Hutchinson, compiladores. Proceeding of the Twenty-Fourth Annual Symposium on Sea Turtle Biology and Conservation. NOAA Technical Memorandum NMFS-SEFSC-567 p. 68-69 Chen, T.H. y I.J. Cheng (1995): Breading biology of the green turtle, C. mydas (Reptilia: Cheloniidae), on WanAn Island, PengHu archipelago, Taiwan. Ι. Nesting ecology. Mar. Biol. (124): 9-15. Cheng, I.J. (2000): Post-nesting migrations of green turtles (C. mydas) at Wan-An Island, Penghu Archielago, Taiwan. (137): 747-754 Cheng, I.J. (2002): The-years research and conservation on the green sea turtle refuge site at wan-an island, peng-hu archipelago, Taiwan, r.o.c: Proceedings of IUCN/WCPA-EA-4 Taipei Conference March 18-23, Taipei, Taiwan. p. 335-341. Codegoni A.M., F. Bertoni y G. Collela (1999): Microsatellite instability and frameshift mutations in genes involved in cell cycle progression or apoptosis in ovarian cancer. Oncology Research, (11): 297-301. Congdon, J. D., D. W. Tinkle, G. L. Breitenbach y R. C. van Loben Sels (1983): Nesting ecology and hatching sucess in the turtle Emydoidea blandingii. Herpetologica (39): 417–429. Cornuet J.M., S. Piry, G. Luikart, A. Estoup y M. Solignac (1999): New methods employing multilocus genotypes to select or exclude population as origin of individuals. Genetics, 153, 1889–2000. Crain D.A., A. B. Bolten y K. A. Bjorndal (1995): Efects of beach nourishment on sea turtles: review and research initiatives. Restor Ecol 2: 95-104 Crespi B.J. y M.J. Fulton (2004): Molecular systematics of Salmonidae: combined nuclear data yields a robust phylogeny Molecular Phylogenetics and Evolution 31:658–679 Crim J. L, L. D. Spotila y J.R. Spotila (2002): The leatherback turtle, markers will be most useful for studying the reproductive Dermochelys coriaceae, exhibits both polyandry and polygeny. Molecular Ecology, 11: 2097– 2106. REFERENCIAS BIBLIOGRÁFICAS 108 Cuadrado A. y T. Schwarzacher (1998): The chromosomal organization of simple sequence repeats in wheat and rye genomes. Chromosoma, 107:587-594. Cummings C.J. y H.Y. Zoghbi (2000): Trinucleotide repeats: mechanisms and pathophysiology. Annual Review of Genomics and Human Genetics, 1, 281-328. Davenport, J. (1997): Temperature and the life-history strategies of sea turtles J. Therm. Biol. 22(6): 479-488. Demetropoulos, A. (2000): Impact of tourism development on marine turtle nesting: strategies and actions to minimise impact. Convention on the conservation of european wildlife and natural habitats, Strasbourg. pp.130 Dethmers, K. E. M., D. Broderick, C. Moritz, N. N. FitzSimmons, C. J. Limpus, S. Lavery, S. Whiting, M. Guinea, R. I. T. Prince y R. Kennett (2006): The genetic structure of Australasian green turtles (C. mydas): exploring the geographical scale of genetic exchange. Mol.Ecol. (15): 3931–3946 Di Rienzo, A., A.C. Peterson, J.C. Garza, A.M. Valdés, M. Slatkin y N.B. Freimer (1994): Mutational processes of simple-sequence repeat loci in human populations. Proc. Natl. Acad. Sci. USA (91): 3166–3170. Dodd, C.K. Jr (1988): Synopsis of the biological data on the log- gerhead sea turtle Caretta caretta (Linnaeus, 1758). US Fish Wild Serv Biol Rep. (88): 1-110. Eckert, K. L. (1987): Environmental unpredictability and leatherback sea turtle (Dermochelys coriacea) nest loss, Herpetologica, 43-315. Eckert, K. L., K. A. Bjorndal, F. A. Abreu-Grobois y M. Donnelly (eds). (2000): Research and Management Techniques for the Conservation of Sea Turtles. IUCN/SSC Marine Turtles Specialist Group Publication. N0. 4.235pp. Encalada, S. E., P. N. Lahanas, K. A. Bjorndal, A. B. Bolten, M. M. Miyamoto y B. W. Bowens (1996): Phylogeography and population structure of the Atlantic and Mediterranean green turtle (C. mydas): a mitochondrial DNA control region sequence assessment. Mol. Ecol. (5): 473-483. Epplen C, G. Melmer y I. Siedlaczck (1993): On the essence of ‘meaningless’ simple repetitive DNA in eukaryote genomes. In: DNA Fingerprinting: State of the Science (eds Pena SDJ, Chakraborty R, Epplen JT, Jeffreys AJ), Birkhäuser Verlag, Basel Switzerland. pp. 29–45. Escalona, T. y J. E. Fa (1998): Survival of nests of the terecay turtle (Podocnemis unifilis) in the NichareTawadu rivers, Venezuela. J. Zool. (244): 303–312. Espinosa, G., G. Hernández, M. Jager, K. Olavarría, M.E. Ibarra, M. Masselot y J. Deutch (1999): Genetic identification of a nesting colony of green turtles, C. mydas, from the western Cuban shelf. En: Proceedings of th the 19 Annual Sea Turtle Symposium. South Padre Islan, Texas, USA p.120-123. Estoup A. y J.M. Cornuet (1999): Microsatellite evolution: inferences from population data. In: Microsatellites: Evolution and Applications (eds Goldstein DB, Schlötterer C), pp. 49–65. Oxford University Press, Oxford. Evanno, G., S. Regnaut y J. Goudet (2005): Detecting the number of clusters of individuals using the software STRUCTURe: a simulation study. Mol. Ecol. 14: 2611–2620. Ewens, W. J. (1972): The sampling theory of selectively neutral alleles. Theor. Popul. Biol 3, 87-112. Excoffier, L. G. Laval, y S. Schneider (2005): Arlequin ver. 3.0: An integrated software package for population genetics data analysis. Evolutionary Bioinformatics Online 1: 47-50. Excoffier, L. G. Laval, y S. Schneider (2006): Arlequin ver. 3.1: An integrated software package for population genetics data analysis. Evol. Bioinf. Online (1): 47-50. Excoffier, L., P. Smouse y J. Quattro (1992): Analysis of molecular variance inferred from metric distances among DNA haplotypes: Application to human mitochondrial DNA restriction data. Genetics 131: 479–491. REFERENCIAS BIBLIOGRÁFICAS 109 Falush, D., M. Stephens y J.K. Pritchard (2003): Inference of population structure using multilocus genotype data: linked loci and correlated allele frequencies. Genetics, 164, 1567–1587. Felger, R.S., K. Cliffton, y P.J. Regal (1976): Winter dormancy in sea turtles: independent discovery and exploitation in the Golf of California by two local cultures. Science (Wash., D.C.) (191): 283–285. Field D. y C. Wills (1996): Long, polymorphic microsatellite in simple organisms. Proceedings of Royal Society of London B Biological Sciences, (263): 209-215. Finkler, M. S. (1995): Effects of temperature, substrate, body size and season on locomotor performance in three species of colubrid snake (Nerodia sipedon, Regina septemittata and Thamnophis sirtalis). Masters thesis, Miami Univ. Ohio. Fish, M. R., I. M. Cote, J. A. Gill, A. P. Jones, S. Renshoff y A. R. Watkinson (2005): Predicting the impact of sea level rise on Caribbean nesting habitat. Cons. Biol. (19) (2): 482-491 FitzSimmons, N. N. (1998): Single paternity of clutches and sperm storage in the promiscuous green turtle C. mydas. Mol. Ecol. (7): 575-584. FitzSimmons N.N., M. Craig, y S. Moore. (1995): Conservation and Dynamics of Microsatellite Loci over 300 Million Years of Marine Turtle Evolution. Mol. Biol. Evol. 12(3): 432-440. FitzSimmons, N. N., C. Moritz y B. W. Bowen. (1999): Population identification. En: Eckert K.L., K.A. Bjorndal y F.A. Abreu-Grobois (eds). Management and research techniques for the conservation of sea turtles.IUCN, Gland, Switzerland, p. 72-79. FitzSimmons, N. N., C. Moritz, C. J. Limpus, L. Pope y R. Frince. (1997a): Geographic structure of mitochondrial and nuclear gene polymorphisms in Australian green turtle populations and male-biased gene flow. Genetics 147: 1843–1854. FitzSimmons, N. N., C. J. Limpus, J. A. Normans, A. R. Goldzien, J. D. Miller y C. Moritz (1997b): Philopatry of male marine turtles inferred from mitochondrial DNA markers. Proc. Natl. Acad. Sci. USA (94): 8912–8917. FitzSimmons, N. N., C. Moritz, C.J. Limpus, K. Dethmers, J. D. Miller, J. Parmenter, R. Prince y P. H. Dutton (2008): How migratory behavior shapes gene flow and the distribution of biodiversity in marine turtles. En: Mast, R.B., Hurchinson B.J. y A.H. Hutchinson, compiladores. Proceeding of the Twenty-Fourth Annual Symposium on Sea Turtle Biology and Conservation. NOAA Technical Memorandum NMFS-SEFSC-567 p. 25 Foley, A. M., S. A. Peck y D. R. Harman (2006): Effect of sand characteristics ans inundation on the hatchling success of loggerhead sea turtle (Caretta caretta) clutches on low-relief mangrove island of southern Florida. Chel. Cons. Biol. 5: 32-41 Foote J. y J. Sprinkel (1994): Beach compactness as a factor affecting turtle nesting on the west coast of Florida. In: Proceedings of the 14th Annual Workshop on Sea Turtle Biology and Con- servation. NOAA-TMNMFS-SEFSC-351, Miami, Florida, pp 1-217. Formia, A. (2002): Population and genetic structure of the green turtle (Chelonia mydas) in west and Central Africa; implications for management and conservation, Thesis of Doctor of Philosophy School of Biosciences Cardiff University. Formia, A., B.J. Godley, J.F. Dontaine y M.W. Bruford (2006): Mitochondrial DNA diversity and phylogeography of endangered green turtle (C. mydas) populations in Africa. Cons.Gen. (7):353–369 Franco, L. V. (2003): A influência da granulometria no sucesso de eclosão e duracão de incubacão nos ninhos da tartaruga marinha Caretta caretta nas praias de Itaúnas, Espírito Santo, Brasil. Relatório Final. Facultade de Biologia. UNIV. STO AMARO. São Paulo. Frankham, R. (1996): Relationship of genetic variation to population size in wildlife. Conserv. Biol. 10: 1500– 1508. REFERENCIAS BIBLIOGRÁFICAS 110 Franklin, I.R. (1980): Evolutionary change in small populations, pp. 135–149 in Conservation biology an evolutionary-ecological perspective, edited by M.E. Soule & B.A. Wilcox. Sinauer Associates. Sunderland, Massachusetts. Frazier, J. G. (1985): Season variation in clutch size for loggerhead sea turtle, Caretta caretta , nesting on Little Cumberland Island Georgia, U.S. A. Copeia 4: 1083-1085. Fretey, J. y M. Girondot (1989): Hydrodynamic factors involved in choice of nesting site and time of arrivals of leatherbacks in french Guiana. 9th Workshopon Sea Turtle, Biology and Conservation, Jeckhill Island (Georgia). Fu, Y.X. (1997): Statistical tests of neutrality of mutations against population growth, hitchhiking and background selection. Genetics 147: 915-925. Gabor Toth, Z. Gaspari, y J. Jurka (2000): Microsatellites in Different Eukaryotic Genomes Survey and Analysis. Genome, 10:967–981. García, C., A. Chirino y J. Rodríguez (1991): Corrientes Geostróficas en la ZEE al sur de Cuba. Rev. Investig. Mar. (12): 29–38. Girard, C., J. Sudre, S. Benhamou, D. Roos y S. Ciccione (2006): Sea turtles in the flow: coupling satellitetracking and remote-sensing oceanographic data to analyze navigation behavior. En: Frick, M., Panagopoulou A., Rees A. F. Y K. Williams (compiladores). Book of Abstracts. Twenty Sixth Annual Symposium on Sea Turtle Biology and Conservation. International Sea Turtle Society, Athens, Greece. p. 354 Godley B.J., A.C. Broderick, L.M. Campbell, S. Ranger y P.B. Richardson (2004): Towards a Molecular Profile of Marine Turtles in the Caribbean Overseas Territories. In: An Assessment of the Status and Exploitation of Marine Turtles in the UK Overseas Territories in the Wider Caribbean. pp 223-236. Final Project Report for the Department of Environment, Food and Rural Affairs and the Foreign and Commonwealth Office. Godley, B. J., A. B. Broderick y G. C. Hays (2001): Nesting of green turtle (C. mydas) at Ascension Island, South Atlantic. Biol.Cons. 97:151-158 Goldenberg, S. B., C. W. Landsea, A. M. Mestas-Nuñez y W. M. Gray (2001): The recent increase in Atlantic hurricane activity: causes and implications. Science 293: 474-479 Goldstein, D. y C. Schloterer (1999): Microsatellites Evolution and Applications. Oxford University Press, Inc. New York. Grant, W.S. y B.W. Bowen (1998): Shallow population histories in deep evolutionary lineages of marine fisheries: insights from Sardines and Anchovies and lessons for conservation. J. Hered. 89: 415–426. Grassman, M. A. y D. W. Owens (1981): Evidence of olfactory imprinting in loggerhead turtles. Mar. turtle Newsl. 19:7-10. Green, D. (1993): Galapagos sea turtles: an overview. En: Schroeder B. A. y B. E. Witherington, Compilers. Proceedings of the thirteenth annual symposium on sea turtle biology and conservation Jekyll Island, Georgia.p. 65 Green, D. M. (2005): Designatable Units for Status Assessment of Endangered Species Conservation Biology. Society for Conservation Biology. p.1813–1820 Groombridge, B. y R. Luxmoore (1989): The green turtle and hawksbill (Reptilia: Cheloniidae): World status, exploitation, and trade. Lausanne, Switzerland: CITES Secretariat 601. Hall, T. (2001): BioEdit version 5.0.6. North Carolina State University, Department of Microbiology. Hamann, M., C. J. Limpus y J. M. Whittier (2002): Patterns of lipid storage and mobilization in the female green sea turtle ( Chelonia mydas). J Comp Physiol B (172): 485-493. REFERENCIAS BIBLIOGRÁFICAS 111 Hatase, H., M. Kinoshita, T. Bando, N. Kamezaki, K. Sato, Y. Matsuzawa, K. Goto, K. Omuta, Y. Nakashima, H. Takeshita y W. Sakamoto (2002): Population structure of loggerhead turtles, Caretta caretta, nesting in Japan: bottlenecks on the Pacific population. Mar. Biol. (141): 299–305. Hays, C. G. y J. R. Speakman (1993): Nest placement by loggerhead turtles, Caretta caretta. Anim Behav 45: 47-53. Hays, C. G., A. Mackay, C. R. Adams, J. A. Mortimer, J. R. Speakman y M. Boerma (1995): Nest site selection by sea turtles. J Mar. Boil. Ass. UK (75): 667-674. Hays, G. C. (2000): The Implications of Variable Remigration Intervals for the Assessment of Population Size in Marine Turtles. J. Theor. Biol. (206): 221-227. Hays, G.C., P. Luschi, F. Papidel, C. Seppia, y R. Marsh (1999): Changes in behaviour during the internesting period and post-nesting migration for Ascension Island green turtles. Mar. Ecol. Prog. Ser. (189): 263– 273. Hays, G.C., S. Akesson, A.C. Broderick, F. Glen, B.J. Godley y J.D. Metcalfe (2002): Behavioural plasticity in a large marine herbivore: contrasting patterns of depth utilization between two green turtle (C. mydas) populations. Mar. Biol. (141): 985-990 Hendrickson, J.R. (1958): The green turtle, C. mydas (L) in Malaya and Sarawak. Proc. Zool. Soc. London (130): 455–535. Hendrickson, J.R. (1982): Nesting behavior of sea turtles with emphasis on physical and behavioral determinants of nesting success or failure. En K. A.Bjorndal (ed.). Biology and conservation of sea turtles, Washington, D.C.: Smithsonian Institution Press. p. 53–57. Hendrikson J.R. y E. Balandingam (1966): Nesting beach preferences of Malayssian sea turtles. Bull. Nat. Mus. Singapore (33): 69-76 Hennequin, C., A. Thierry, G. F. Richard, G. Lecointre, H. V. Nguyen, C. Gaillardin, y B. Dujon (2001): Microsatellite typing as a new tool for identification of Saccharomyces cerevisiae strains. J. Clin.Microbiol. (39): 551–559. Heppell, S. S., H. Caswell y L.B. Crowder (2000): Life history and elasticity patterns: perturbation analysis for species with minimal demographic data. Ecology 81:654-665. Herrera, M. (2001): El Programa MAB de la UNESCO. Comité MAB de Cuba. Hillis, D., C. Moritz y B. Baner (1996): Molecular Systematics. Sinauer Associates, Inc. Sunderland, Massachusetts. Hirth, H. (1963): The ecology of two lizards on a tropical beach. Ecol. Monogr. 33(2): 83-112 Hirth, H. (1997): Synopsis of the biological data on the green turtle, C. mydas (Linnaeus 1758). United States Fish and Wildlife Service Biological Report 97-1. 120 pp. Hoekert W. E. J, H. Neuféglise, A. D. Schouten y S. B. J. Menken (2002): Multiple paternity and female biased mutation at a microsatellite locus in the olive ridley sea turtle (Lepidochelys olivacea). Heredity. (89): 107-113. Horrock, J. A. y N. McA. Scott (1990): Nest site location and nest success in the hawksbill turtle (Eremtochelys imbricata) in Barbados, West Indies. En: Proceedings of the 10th Annual Workshop on Sea Turtle Biology and Conservation. NOAA- TM-NMFS-SEFSC-278, Miami, Florida, pp 245-248. Horrocks, J. A. y N. M. Scott (1991): Nest site location and nest success in the hawksbill turtle, Eretmochelys imbricata, in Barbados West Indies. Mar. Ecol. Progr. Ser. 69: 1–8. REFERENCIAS BIBLIOGRÁFICAS 112 Hospital, F., C. Chevalet y P. Mulsant. (1992): Using markers in gene introgression breeding programs. Genetics. (132): 1199-1210. IBAMA- Instituto brasileiro do meio Ambiente e Recursos Naturais Renováveis (1989): Projeto Quelônios da Amazônia, 10 anos. Brasília, IBAMA, 119p. Ibarra, M. E., J. Angulo, G. Espinosa, J. Pacheco, F. Moncada, G. Nodarse y E. Escobar (1999): University project on the study and conservation of sea turtles. Marine Turtles Newsletter (84): 11-12. Ibarra, M.E. J. Azanza, R. Díaz-Fernández, G. Espinosa, F. Hernández, Estudiantes de la Facultad de Biología, F. Moncada y G. Nodarse (2004): The conservation of marine turtles in nesting areas of Guanahacabibes Peninsula: six years of work. En: Mast, R.B., B. J. Hutchinson y A. H. Hutchinson. Proceeding of the Twenty-fourth Annual Sea Turtles Symposium. U.S.Dep. Commer. NOAA. NMFS-SEFSC-567, p. 26. Ibarra, M. E., R. Díaz-Fernández, A. Nodarse, J. Azanza, J. Angulo; G. Espinosa; J. Pacheco (2002): Project Update: Project for the study and conservation of Cuban Sea Turtles. Marine Turtles Newsletter (95): 18-21. Ibarra, M. E., G. Espinosa, J. Angulo, J. Pacheco y estudiantes de la Facultad de Biología de la Universidad de la Habana (2000): University project on the study and conservation of sea turtles. Preliminary results and future plans. En: Kalb, H. J. y T. Wibbels (comp.) Proceedings of the nineteenth Annual Symposium on sea turtle biology and conservation. U. S. Dept. Commerce. NOAA Tech. Memo. NMFS-SEFSC-443: 272. Ireland J. S., A. C., F. Broderick, B. J. Glen, G. C. Godley, P. Hays, L. M. Lee y D. O. F. Skibinski (2003): Multiple paternity assessed using microsatellite markers, in green turtles C. mydas of Ascension Island, South Atlantic. J. Exp. Mar. Biol. Ecol. (291):149–160. Iverson, J. B. (1991): Life history and demography of the yellow mud turtle Kinosternon flaescens. Herpetologica (47): 373-395. Jackson J.B.C. (1997): Reef since Columbus. Coral Reefs (16): S23-S33 Jackson J.B.C., M.X. Kirby, W.H. Berger, K.A. Bjorndal, L.W. Botsford, B.J. Bourque, R. H. Bradbury, R. Cooke, J. Erlandson, J.A. Estes, T.P. Hughes, S. Kidwell, C. Lange, H.S. Lenihan, J.M. Pandolfi C.H. Peterson, R.S. Steneck, M.J. Tegner, y R.R. Warner (2001): Historical overfishing and the recent collapse of coastal ecosystems. Science 293: 629-638 Janzen, F. J. y C. L. Morjan (2001): Repeatability of microenvironment- specific nesting behaviour in a turtle with environmental sex determination. Anim. Behav. (62): 73-82. Jeffreys A.J., J. Murray y R. Neumann (1998): High-resolution mapping of crossovers in human sperm defines a minisatellite associated recombination hotspot. Molecular Cell. (2):267-273. Kalinowski, S. T. (2002): How many alleles per locus should be used to estimate genetic distance? Heredity. 88: 62-65. Karl S.A. y B.W. Bowen (1999): Evolutionary significant units versus geopolitical taxonomy: molecular systematics of an endangered sea turtle (genus Chelonia). Conservation Biology, 13, 990–999. Karl, S. A., B. W. Bowen y J. C. Avise (1992): Global Population Genetic Structure and Male-Mediated Gene Flow in the Green Turtle (C. mydas): RFLP Analyses of Anonymous Nuclear Loci. Genetics. (131): 163-173. Kelez, S. (2003): Proyecto de tesis: ventajas de nidos de tortuga carey Eretmochelys imbricata (Linnaeus, 1766) bajo dos condiciones ambientales diferentes. Kichler K., M.T. Holder, S.K. Davis, S.R. Marquez y D.W. Owens (1999): Detection of multiple paternity in the kemps ridley sea turtle with limited sampling. Mol. Ecol. (8): 819–830. REFERENCIAS BIBLIOGRÁFICAS 113 Kimura, M. y J. F. Crow (1964): The number of alleles that can be maintained in a finite population. Genetics (49): 725-738. Kolbe, J. y F. J. Janzen (2001): The influence of propagule size and maternal nest-site selection on survival and behaviour of neonate turtles.Funct. Ecol. (15): 772–781. Kraemer, J. E. y R. Bell (1980): Rain-induced mortality of eggs and hatchling of loggerhead sea turtle (Caretta caretta) on the Georgia coast. Herpetologica. (36):72-77. Krebs, C. J. (1999): Ecological Methodology. Second Edition. Addison – Welsey Educational Publishers, Inc. p.19-93 Kumar, S., K. Tamura y M. Nei (2001): MEGA 2.1: Molecular Evolutionary Genetics Analysis. Pennsylvania State University, University Park, PA. Kumazawa, Y. y M. Nishida. (1999): Complete Mitochondrial DNA Sequences of the Green Turtle and BlueTailed Mole Skink: Statistical Evidence for Archosaurian Affinity of Turtles. Mol. Biol. Evol. 16(6): 784–792. Lahanas, P. N., K. A. Bjorndal, A. B. Bolten, S. E. Encalada, M. M. Miyamoto, R. A. Valverde y B. W. Bowen (1998): Genetic composition of green turtle (Chelonia mydas) feeding ground population: evidence for multiple origins. Mar. Biol. 130: 345-352. Landsea, C. W. (1993): A climatology of intense (or major) Atlantic hurricanes. Mon Weather Rev 121:17031713 Laurent, L., J. Lescure, L. Exoffier, B. Bowen, M. Domingo, M. Hadjichristophorou, L. Kornaraky y G. Trabuchet (1993): Genetic studies of relationships between Mediterranean and Atlantic populations of loggerhead Caretta caretta with a mitochondrial marker. Comptes Rendus de l´Academie Des Sciences, Paris, (316): 1233-1239 Lazou, A. P. y A. F. Rees (2006): Factors influencing insect infestation of loggerhead (Caretta caretta) sea turtle nests on Zakynthos, Greece. En: Frick, M., Panagopoulou A., Rees A. F. Y K. Williams (compiladores). Book of Abstracts. Twenty Sixth Annual Symposium on Sea Turtle Biology and Conservation. International Sea Turtle Society, Athens, Greece. p. 354 Lee, P. L. M., P. Luschi y G. C. Hays (2007): Detecting female precise natal philopatry in green using assignment methods Molecular Ecology 16 , 61–74 Leung W.K., J.J. Kim, J.G. Kim, D.Y. Graham y A.R. Sepulveda (2000): Microsatellite instability in gastric intestinal metaplasia in patients with and without gastric cancer. American Journal of Pathology, 156, 537-543. Li, W. H. (1977): Distribution of nucleotide differences between two randomly chosen cistrons in a finite population. Genetics (85): 331-337. Limpus, C.J. (1992): The hawksbill turtle, Eretmochelys imbricata, in Queensland: population structure within a southern Great Barrier Reef feeding ground. Wildlife Research (19): 489-506. Limpus, C. J. (1995): Global overview of the status of marine turtles: a 1995 viewpoint. Pp. 605-609 in Bjorndal, K. (Ed.) The Biology and Conservation of Sea Turtles. Revised edition. Smithsonian Institute Press, Washington D.C. Limpus, C. J. y N. Nichols (1987): The southern oscillation regulates the annual numbers of green turtles (C. mydas) breeding around northern Australia. Australian Journal of Wildlife Research (15):157-161. Limpus C.J. y C.J. Parmenter (1985): The sea turtle resources of the Torres Strait region. In: Torres Strait Fisheries Seminar (eds Haines AK, Williams GC, Coates D), Department of Primary Industry, Port Moresby, Papua New Guinea. pp. 95 –107. REFERENCIAS BIBLIOGRÁFICAS 114 Limpus C.J., D. Carter y M. Hamann (2001): The green turtle, C. mydas, in Queensland, Australia: the Bramble Cay rookery in the 1979–80 breeding season. Cons. Biol. (4): 34–46. Lohmann, K. J., B. E. Witherington, C. M. F. Lohmann y M. Salmon (1996): Orientation, navigation, and natal beach homing in sea turtles. En: Lutz, P. L. y J. A. Musick (eds.). The biology of sea turtles. CRC Press, New York: 107-135. Loughland, R. y J. Miller (2006): Beach temperatures and the potential impact of global warming on marine Tortuga nesting in the United Arab Emirates. En: Frick, M., Panagopoulou A., Rees A. F. y K. Williams (compiladores). Book of Abstracts. Twenty Sixth Annual Symposium on Sea Turtle Biology and Conservation. International Sea Turtle Society, Athens, Greece. p. 352 Luikart, G., W. B. Sherwin, B. M. Steele y F. W. Allendorf (1998): Usefulness of molecular markers for detecting population bottlenecks via monitoring genetic change Mol.Ecol. (7): 963-974 Luke K., J. A. Horrocks, R. A. LeRoux y P. H. Dutton (2004): Origins of green turtle (C. mydas) feeding aggregations around Barbados, West Indies. Mar. Biol. (144): 799–805 Luschi, P., F. Papi, H. C. Liew, E. H. Chan y F. Bonadonna (1996): Long distance migration and homing after displacement in the green turtle (C. mydas): a satellite tracking study. J. Comp. Physiol. (178): 447- 452. Maloney, J. E., C. Darian-Smith, Y. Takahashi y C. J. Limpus. (1990): The environment for development of the embryonic loggerhead turtle (Caretta caretta) in Queensland. Copeia: 378–387. Marklund, S., H. Ellegren, S. Ericsson, K. Sandberg y L. Andersson (1994): Patentage testing and linkage analysis in the horse using a set of highly polymorphic microsatellites. An. Gen. (25):19-23. Márquez, R. (1996): Las tortugas marinas y nuestro tiempo. Fondo de Cultura Económica, México. 197 pp. Marshall. A.T. y P.D. Cooper (1988): Secretory capacity of the lachrymal salt gland of hatchling sea turtles, Chelonia mydas. J. Com. Physiol. 157 B (6): 821-827 Martín, R.E. (1996): Storm impact on loggerhead reproductive success. Mar. Tur. News 73:10-12 Martin-Farmer J. y G.R. Janssen (1999): A downstream CA repeat sequence increases translation from leadered and unleadered mRNA in Escherichia coli. Mol. Microbiol. (31): 1025-1038. Masino L. y A. Pastore (2001): A structural approach to trinucleotide expansion diseases. Research Bulletin of the Brain (56): 183-189. Mc Gehee, M. A. (1979): Factors Affecting the H atching Success of Longgerhead Sea turtles Eggs (Caretta carretta). M. S. Thesis, Univeristy of Central Fflorida, Orlando. McClenachan, L. (2007). Historic decline of green and hawksbill turtle populations in the Caribbean En: Mast, R.B., Hurchinson B.J. y A.H. Hutchinson, compiladores. Proceeding of the Twenty-Fourth Annual Symposium on Sea Turtle Biology and Conservation. NOAA Technical Memorandum NMFS-SEFSC-567 p. 82 McMullan, R. (1993): An implementation of the algorithms in Jean Meeus’ Book Astronomical Formulae for calculators Mendonca, M. (1983): Movements and feeding ecology of immature green turtles (C. mydas) in a Florida Lagoon. Copeia, 1983: 1013–1023. Meylan, A. B. y P. Meylan (1999): Introduction to the evolution, life history, and biology of sea turtles. En: Eckert K. L.; K. A. Bjorndal; F. A. Abreu-Grobois y M. Donnelly (eds.). Research and management techniques for the conservation of sea turtles. IUCN/SSC Marine turtle specialist group publication No. 4: 3-6. Meylan, A. B., B. W. Bowen y J. C. Avise (1990): A genetic test of the natal homing versus social facilitation models for green turtle migration. Science 248:724-727. REFERENCIAS BIBLIOGRÁFICAS 115 Michalakys Y. y L. Excoffier (1996): A generic estimation of population subdivision using distances between alleles with special reference for microsatellite loci. Genetics (142): 1061-1064 Miller, J. D. (1985): Embryology of marine turtles. En: C. Gans, F. Billett, and P. F. A. Maderson (eds.). Biology of the Reptilia, vol. 14A, 269–328. New York: Wiley-Interscience. Miller, J. D. (1997): Reproduction in sea turtles. In: Lutz PL,Musick JA (eds) The Biology of Sea Turtles. CRC, Boca Raton, pp 51–83. Miller, J. D. (2000): Determination of clutch size and hatching success En: Eckert, K. L.; K. A. Bjorndal; F. A. Abreu-Grobois y M. Donnelly (eds.). Research and management techniques for the conservation of sea turtles. IUCN/SSC Marine turtle specialist group publication No. 4: p. 146 Milton, S. L., S. Leone-Kabler, A. A. Schulman, and P. L. Lutz (1994): Effects of hurricane Andrew on the sea turtle nesting beaches of south Florida. – Bull. Mar. Sci. 54: 974–981. Moncada F., F. A. Abreu-Grobois, A. Muhlia-Melo, C. Bell, S.Troeng, K. A. Bjorndal, A.B. Bolten, A. B. Meylan, J. Zurita, G. Espinosa, G. Nodarse, R. Marquez-Millán, A. Foley y L. Ehrhart (2006): Movement Patterns of Green Turtles (C. mydas) in Cuba and Adjacent Caribbean Waters Inferred from Flipper Tag Recaptures. Journal of Herpetology, Vol. 40, No. 1, pp. 22–34. Moncada, F. (1998): Migraciones de la tortuga verde (C. mydas), la caguama (Caretta caretta) y el carey (Eretmochelys imbricata), en aguas cubanas y áreas adyacentes. Tesis de Maestría. Moncada, F., E. Carrillo, S. Elizalde, G. Nodarse, B. Anderes, C. Sacantlebury, A. Alvarez y A. Rodríguez (1995): Migraciones de las tortugas marinas en la plataforma cubana. In: Proceedings of the 16th Annual Sea Turtle Symposium. Hilton. Head island. South California, U.S.A. Moncada, F., R. Cardona y G. Nodarse (1987): Comportamiento reproductivo de los quelonios marinos en el archipiélago cubano. Resúmenes I Congreso de Ciencias del Mar. La Habana. Cuba. Moncada, F y G. Nodarse (1983): Informe nacional sobre la actividad desarrollada por Cuba en el estudio y conservación de las tortugas marinas. Cent. Invest. Pesq., Dept. Cría experimental, Min. Invest. Pesq., Habana. 4p. Moncada, F y G. Nodarse (1998): The green turtle (C. mydas) in Cuba. En: Epperly, S. P and J. Braun, compiler. 1998. Proceeding of the Seventeenth Annual Sea Turtles Symposium. U.S.Dep. Commer. NOAA. NMFS-SEFSC-415. p.54-56. Moncada, F. G., C. Pérez, G. Nodarse, S. Elizalde, A. M. Rodríguez y A. Meneses (1998): Reproducción y anidación de E. imbricata en Cuba. Revista Cubana de Investigaciones Pesqueras 22 (1): 101-109. Moore M.K. y R.M. Ball Jr. (2002): Multiple paternity in loggerhead turtle (Caretta caretta) nests on Melbourne Beach, Florida: a microsatellite analysis. Molecular Ecology( 11): 281-288. Moritz C. (1994): Defining ‘evolutionary significant units’ for conservation. Trends in Ecology & Evolution, 9, 373–375. Morreale, S. J., G. J. Ruiz, J. R. Spotila y E. A. Standora (1982): Temperature-dependent sex determination: current practices threaten conservation of sea turtles. Science (216): 1245–1247. Morris, K. A., G. C. Packard, T. J. Boardman, G. L. Paukstis y M. J. Packard (1983): Effect of the hydric environment on growth of embryonic snapping turtles (Chelydra serpentine) Herpetologica (39): 272-285. Mortimer, J. A. (1982): Factors influencing beach selection by nesting behavior and Conservation of Sea Turtles, Bjorndal, K., Ed., Smithsonian Institution Press, Washington, D. C., 45. Mortimer, J. A. (1990): The influence of beach sand characteristics on the nesting behavior and clutch survival of green turtles (C. mydas). Copeia. 802. REFERENCIAS BIBLIOGRÁFICAS 116 Mortimer, J. A. (1995): Factors influencing beach selection by nesting sea turtles. En: Bjorndal, K. A. (ed.). Biology and conservation of sea turtles. Smithsonian Inst. Press: 45-52. Mortimer, J. y A. Carr (1987): Reproduction and migrations of the Ascencion Island green turtle (C. mydas). Copeia (1): 103-113. Mrosovsky, N. (1983): Ecology and nest site selection of leatherback turtles, Dermochelys coriacea. Biol. Conserv. (26): 47-56. Mrosovsky, N. (1988): Pivotal temperatures for loggerhead turtles (Caretta caretta) from northern and southern nesting beaches. Can. J. Zool. (66): 661–669. Mrosovsky. N (1994): Sex ratio of sea turtle. J. Exp. Zool. (270): 16-27. Mrosovsky N. y C. L. Yntema (1980): Temperature dependence of sexual diferentiation in sea turtle: implication for conservation practices. Biol. Conserv. (18): 271-280. Mrosovsky, N, P. H. Dutton, y C. P. Whitmore (1984): Sex ratios of two species of sea turtle nesting in Suriname. Can. J. Zool. (62): 2227–2239. Mrosovsky. N. y J. Provancha (1989): Sex ratio of loggerhead sea turtle hatchlings on a Florida beach. Can. J. Zool. (67): 2533-2539. Mullis, K., F. Faloona, S. Schare, R. Saiki, C. Horn, y H. Erlich (1986): Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Cold Spring Harbor Symposium of Quantitative Biology (51): 263273. Muñoz, D. (2001): Anidación de Ch. mydas (Linnaeus, 1758) (Reptilia: Cheloniidae) en Caleta de los Piojos, Península de Guanahacabibes, Cuba. Tesis de Diploma. Facultad de Biología. Murphy, T. M. (1985): Annual performance report. Submitted to the US Fish and Wildlife and Marine Resources Department, Columbia, S. Carolina. Naro-Maciel, E., J.H.Becker, E. H. S. M. Lima, M. A. Marcovaldi y R. DeSalle (2007): Testing Dispersal Hypotheses in Foraging Green Sea Turtles (C. mydas) of Brazil. Journal of Heredity 98(1):29–39 Needham, J. (1966): Biochemistry and Morphogenesis. Cambridge University Press. Cambridge. Nei, M. (1978): estimation of average heterozygosity and genetic distance from a small number of individuals. Genetics, 89:583-590 Nei, M. (1987): Molecular Evolutionary Genetics. Columbia University Press, New York. Nodarse, G. F. Moncada, Y. Medina, F. Hernández, R. Blanco, C. Rodríguez y E. Escobar (2008): Nesting behavior of marine turles in the Archipiélago de los Canarreos, Cuba (2001-2006). En: Book of abstracts of the Twenty-eight Annual Sea Turtles Symposium. U.S.Dep. Commer. Nodarse, G., F. Moncada, A. Meneses y C. Rodríguez (2000): Long-Term monitorig of nesting of the green sea turtle (C. mydas) in the southwest plataform of Cuba. En: Abreu-Grobois, F. A., R. Briseño-Dueñas, R. Márquez y L. Sarti (Eds) Proceeding of the Eighteenth Annual Sea Turtles Symposium. U.S.Dep. Commer. NOAA. NMFS-SEFSC-436, p. 68-69. Nodarse, G., F. Moncada, C. Rodríguez, E. Escobar, F. Hernández y O. Ávila (2004): Marine turtles nesting in Cuban archipelago in 2002 and 2003. En: Mast, R.B., B. J. Hutchinson y A. H. Hutchinson. Proceeding of the Twenty-fourth Annual Sea Turtles Symposium. U.S.Dep. Commer. NOAA. NMFS-SEFSC-567, p. 144. Norman J.A., C. Moritz y C. J. Limpus (1994): Mitochondrial DNA control region polymorphisms: genetics markers for ecologicals studies of marine turtles. Molecular ecology 3:363-373. REFERENCIAS BIBLIOGRÁFICAS 117 O’Connell, M. y J.M. Wright (1997): Microsatellite DNA in fishes. Review in Fish Biology and Fisheries, 7:331363. Okuyama T. y B.M. Bolker (2005): Combining genetic and ecological data to estimate sea turtle origins. Ecol. Appl., 15(1): pp. 315–325 Olsson, M. y R. Shine (1996): Does reproductive success increase with age or with size in species with indeterminate growth? Oecologia. (105): 175– 178. Otha, T. y M. Kimura (1973): The model of mutation appropriate to calculate the number of electrophoretically detectable alleles in a genetic population. Genet. Res. 22, 201–204. Owens, D. W., M. A. Grassman y J. R. Hendrickson (1982): The imprinting hypothesis and sea turtle reproduction. Herpetologica 38 (1): 124-135. Packard, L. (1999): Water relations of chelonian eggs and embryos: is wetter better? American Zoologist 39: 289–303. Packard, G.C., M. J. Packard y T. J. Boardman (1981): Patterns and possible significance of water exchange by flexible-shelled eggs of turtles. Science (213): 471-173. Packard, G.C., M. J. Packard y W. H. NGutzke (1985): Influence of hydration of the environment on eggs and embryos of the terrestrial turtle Terrapene ornata. Physiol. Zool. (56): 217-230. Packard, G.C., M. J. Tracy, y J. J. Roth (1977): the physiological ecology of Reptilian eggs and embrios, and the evolution of viviparity within the Class Reptilia. Biol. Rev. (52): 71-103. Packard, G.C., T. L. Taigen., M. J. Packard y T. J. Boardman (1980): Water relation of pliables shelled eggs of common snapping Turtles (Chelydra serpentina). Can. J. Zool. (58): 1404-1411. Paetkau D., W. Calvert, I. Stirling y C. Strobeck (1995): Microsatellite analysis of population structure in Canadian polar bears. Mol. Ecol. (4): 347–354. Parmenter, C.J. y C. Limpus (1999): Female recreuitmanet, reproductive longevity ans inferred hatchling survivorship for the flatback turtle (Natator depressus) at a major easten Australian rookery, Copeia, 2: 474. Peakall, R. y P.E. Smouse (2006): GENEALEX 6.1: genetic analysis in Excel. Population genetic software for teaching and research. Mol. Ecol. Notes (6): 288-295. Peare y Parker (1996): Local genetic structure within two rookeries or Chelonia mydas (the green turtle). Heredity. 77:619-628 Pearse D.E. y K.A. Crandall (2004): Beyond FST: analysis of population genetic data for conservation. Cons. Gen. (5): 585–602. Pereira, Y. (2002): Tesis de opción al titulo de Licenciado en Biología. Fac. Biología. UH, Julio, 2002. Peterson, C.H. y M.J. Bishop, (2005): Assessing the environmental impacts of beach nourishment. BioScience 55, 887–896. Phillott A. D. y C. J. Parmenter (2006): The effect of decreasing rainfall as climatic change on substrate conductivity, embryo mortality and fungal invasion of sea turtle nests En: Frick, M., Panagopoulou A., Rees A. F. y K. Williams (compiladores). Book of Abstracts. Twenty Sixth Annual Symposium on Sea Turtle Biology and Conservation. International Sea Turtle Society, Athens, Greece. p. 354 Pike, D.A. y J.C. Stiner (2007): Sea turtle species vary in their susceptibility to tropical ciclones. Oecologia 153: 471-478 Pilcher, N. J. y M. Al-Merghani (2000): Reproductive biology of green Turtles at Ras Baridi, Saudi Arabia. Herpetological Review. 31 (3): 142-147. REFERENCIAS BIBLIOGRÁFICAS 118 Plumier, M. V. (1976): Some aspects of nesting success in the turtle, Trionyx musticus. Herpetologica. (32): 353-359. Prange, H.D, y R. A. Ackerman (1974): Oxygen consumption and mechanisms of gas exchange of green turtle (C. mydas) eggs and hatchlings. Copeia. 758-763. Pritchard, J.K. y W. Wen http://pritch.bsd.uchicago.edu (2003): Documentation for STRUCTURE software: Version 2. Pritchard, P. y J. Mortimer (1999): Taxonomy, external morphology, and species identification. En: Eckert, K. L.; K. A. Bjorndal; F. A. Abreu-Grobois y M. Donnelly (eds.). Research and management techniques for the conservation of sea turtles. IUCN/SSC Marine turtle specialist group publication. (4): 21-38. Pritchard, P., P. Bacon, F. Berry, A. Carr, J. Fletemeyer, R. Gallagher, S. Hopkins, R. Lankford, R. Márquez M., L. Ogren, W. Pringle, Jr., H. Reichart y R. Witham. (1983): Taxonomy, External morphology and species identification. En:Manual of Sea Turtle Research and Conservation Techniques, Segunda Edición. K.A. Bjorndal y G. H. Balazs (Editores), Center for EnvironmentalEducation, Washington D.C. 126 pp. Pritchard, P.C. (1996): The Galapagos tortoise. Nomemclatural and Survival Status, Monography. No 1. Chelonian Research Foundation. 85 p. Ragotzkie, R. A. (1959): Mortality of longgerhead turtle eggs from excessive rainfall. Ecology. (40): 307-305. Reece, J. S., T. A. Castoe y C. L. Parkinson (2005): Historical perspectives on population genetics and conservation of three marine turtle species. Con. Gen. (6): 235–251 Reinhold, K. (1998): Nest-site philopatry and selection for environmental sex determination. Evol. Ecol. (12): 245-250. Reverdin, G. y M. J. McPhaden (1986): Near-surface current and temperature variability observed in the equatorial Atlantic from drifting buoys. J. Geophys. Res. C5 91, 6569-6581. Reyes, C. y S. Troeng (2001): Report on the 201 Green Turtle Program at Tortuguero, Costa Rica. Caribbean Conservation Corporation. Roberts M. A., T. S. Schwartz y S. A. Karl. (2004): Global Population Genetic Structure and Male-Mediated Gene Flow in the Green Sea Turtle (C. mydas): Analysis of Microsatellite Loci. Genetics (166): 1857–1870. Rogers, A. R., y H. Harpending (1992): Population growth makes waves in the distribution of pairwise genetic differences. Mol. Biol. Evol. (9): 552–569. Rozas, J., J. Sánchez-Del Barrio, C. X. Messeguer y R. Rozas (2003): DnaSP, DNA polymorphism analyses by the coalescent and other methods. Bioinformatics 19, 2496-2497. Ruiz, A., M. Vega, F. B. Riverón, F. A. Abreu, J. Solano, T. Pérez, E.Pérez, J. Azanza, R. Frías, R. Díaz, M. E. Ibarra y G. Espinosa. (2008): Estructura genética de poblaciones de Caretta caretta en el Gran Caribe y la costa Atlántica de Estados Unidos, con énfasis en colonias de anidación del suroeste cubano. Rev. Invest. Mar. 29(2): 151-160 Salmon, M., R. C. Reiners Lavin y J. Wyneken (1996): Behavior of loggerhead sea turtles on an urban beach. I. Correlates of nest placement. J. Herpetol. (29): 560-567. Sandaltzopoulos R, C. Mitchelmore, E. Bonte, G. Wall y P.B. Becker (1995): Dual regulation of the Drosophila hsp26 promoter in vitro. Nucleic Acids Research, (23): 2479-2487. Schäfer, H. y W. Krauss (1995): Eddy statistics in the South Atlantic as derived from drifters drogued at 100 m. J. Mar. Res. (53): 403-431. REFERENCIAS BIBLIOGRÁFICAS 119 Schoener, T.W. D.A. Spiller y J.B. Losos (2004): Variable ecological effects of hurricanes: the importances of seasonal timing for survival of lizards on Bahamian island. Proc. Nat Acad. Sci. USa 101: 177-181 Schwarzkopf, L. y R. J. Brooks (1985): Sex determination in northern painted turtles, Chrysemys picta. Effect of incubation at constant and fluctuating temperatures. Can. J. Zool. (63): 2543–2547. Selker, E.U. (1990): Premeotic instability od repeated sequences in Neurospora crassa. Annu. Rev. Genet., (24): 211-215. Seminoff. J. (2002): MTSG Green Turtle Assessment ed. por IUCN 87 pp. 87 Sergio, D., J. Pena y R. Chakraborty (1994): Paternity testing in the DNA era. Genetics. 10:204-209. Shamblin, B. M., B. C. Faircloth, M.Dodd, A. Wood-Jones,S.B. Castleberry, J. P. Carroll y C. J. Nairn (2007): Tetranucleotide microsatellites from the loggerhead sea turtle (Caretta caretta). Molecular Ecology Notes (7): 784–787 Slatkin M. (1993): Isolation by distance in equilibrium and nonequilibrium populations. Evolution. (47): 264–279. Slatkin M. (1995): A measure of population subdivision based on microsatellite allele frequencies. Genetics 139:457-462. Sneath, P. H. A. y R. R. Sokal (1973): Numerical Taxonomy. W. H. Freeman and Co., San Francisco. [CA] Solomon, J. L., J. Blumenthal, T. J. Austin, G. Ebank-Petrie, A. C. Broderick y B.J. Godley (2006): Insights into the nesting population of marine turtles in Cayman Islands. En: Frick, M., Panagopoulou A., Rees A. F. y K. Williams (compiladores). Book of Abstracts. Twenty Sixth Annual Symposium on Sea Turtle Biology and Conservation. International Sea Turtle Society, Athens, Greece. p. 323-324 Solow, A.R., Bjorndal, K.A. y Bolten, A.B. (2002): Annual variation in nesting numbers of marine turtles: the effect of sea surface temperature on remigration intervals. Ecol. Lett. 5: 742-746. Soulé, M.E. (1980): Thresholds for survival: Maintaining fitness and evolutionary potential. En M.E. Soule and B.A. Wilcox (eds.), “Conservation Biology" An Evolutionary-Ecological Perspective. Sinauer, Sunderland, MA. Pp. 151-169. Soulé M.E. y K.A. Kohm (1989): Research Priorities for ConservationBiology. Island Press, Washington, DC. Southwood, A. L., C. A. Darveau y D. R. Jones (2003): Metabolic and cardiovascular adjustments of juvenile green turtles to seasonal changes in temperature and photoperiod. Jour. Exper. Biol. (206): 4521-4531 Spencer, R. J. (2002): Experimentally testing nest site selection: fitness trade-offs and predation risk in turtles. Ecology. (83): 2136–2144. Spencer, R.J. y M. B. Thompson (2003): The significance of predation in nest siteselection of turtles: an experimental consideration of macro- and microhabitat preferences. Oikos (102): 592–600. StatSoft, Inc. (2001): STATISTICA (data analysis software system), version 6. www.statsoft.com. Stoneburner, D. L. y J. L. Richardson (1981): Observations on the role of temperature in loggerhead turtle nest site selection. Copeia. 238-241. Stoneking, M., Vigilant, L., H. Harpending, K. Hawkes y A. C. Wilson (1991): African populations and the evolution of human mitochondrial DNA. Science 253: 1503–1507. Tajima, F. (1983): Evolutionary relationship of DNA sequences in finite populations. Genetics. (105): 437–460. Tajima, M. (1989): Statistical method for testing the neutral mutation hypothesis by DNA polymorphism. Genetics. (123): 585-595. REFERENCIAS BIBLIOGRÁFICAS 120 Tajima, M. (1996): The amount of DNA polymorphism maintained in a finite population when the neutral mutation rate varies among sites. Genetics. (143): 1457-1465. Tautz D. (1989): Hipervariability of simple sequences as a general source of for polymorphic DNA markers. Nucleics Ácids Res. (17): 6463-6470. Tautz, D. y M. Renz (1984): Simple sequences are ubiquitous repetitive components of eukaryotic genomes. Nucleic Acids Research, (12): 4127-4138. Templeton A.R., A.G. Clark, K.M. Weiss, D.A. Nickerson, E. Boerwinkle y C.F. Sing (2000): Recombinational and mutational hot spots within the human lipoprotein lipase gene. Am. J. Hum. Gen.(66): 6983. Thompson, M. B. (1983): Murray River tortoise (Emydura, Chelodina) populations: the effect of egg predation by the red fox, Vulpes vulpes. Aust. Wildlife Res. (10): 363–371. Troeng, S. y E. Rankin (2005): Long-term conservation efforts contribute to positive green turtle Chelonia mydas nesting trend at Tortuguero, Costa Rica. Biol. Cons. (121): 111–116 Tucker, A. D. (1990): A test of the scatter-nesting hypothesis at a seasonally stable leatherback rookery. In: Proceedings of the 10th Annual Workshop on Sea Turtle Biology and Conserva- tion. NOAA-TM-NMFSSEFSC-278, Miami, Florida, pp. 11-13. Valdes, A.M., M. Slatkin y N.B. Freimer (1993): Allele frequencies at microsatellite loci: the stepwise mutation model revisited. Genetics. (133): 737–749. Van Buskirk, J. y L. B. Crowder (1994): Life-history variation in marine turtles. Copeia. 66-81. Van Dam, R. P. y C. Diez (1998): Caribbean hawksbill turtle morphometrics. Bull. Mari. Sci. 62 (1): 145-155. Vega Pla, J.L., J.J. Garrido, G. Dorado y D.F. de Andrés y Cara (1996): Three new polymorphic equine microsatellites: HML2, HML3, HLM5. Animal Genetics. (27): 215. Velez-Zuazo, X., W. D. Ramos, R. P. Van Dam, C. E. Diez, A. Abreu-Grobois y W. O. McMillan (2008): Dispersal, recruitment and migratory behaviour in a hawksbill sea turtle aggregation. Mol. Ecol. (17): 839-853 Wang, H. C. y I. J. Cheng (1999): Breading biology of the green turtle, C. mydas (Reptilia: Cheloniidae), on Wan-An Island, Peng-Hu archipelago.ΙΙ Nest site selection. Mar. Biol. p. 182-190 Waser P.M. y C. Strobeck (1998): Genetic signatures of interpopulation dispersal. Trends in Ecology & Evolution. (13): 43–44. Watterson, G. (1975): On the number of segregation sites in genetical models without recombination. Theor. Popul. Biol. (7): 256-276. Watterson, G. (1978): The homozygosity test of neutrality. Genetics 88, 405-417. Weber, J. L. y P. E. May (1989): Abundant class of human DNA polymorhism which can be typed using the polymerase chain reaction. American Journal of Human Genetics. (44): 388-396. Weems R. E. (1988): Paleocene turtles from the Aquia and Brightseat formations, with a discussion of their bearing on sea turtles evolution and phylogeny. Proc. Biol. Soc. Washington (101): 109-145. Weir, B.S. y C. C. Cockerham (1984): Estimating F-statistics for the análisis of population structure. Evolution. (38): 1358-1370. Weissenbach, X., G. Gyapay, C. Dib, A. Vignal, J. Morisset y P. Millasse (1992): A second-generation linkage map of the human genome. Nature (359): 794-801. REFERENCIAS BIBLIOGRÁFICAS 121 Whitlock M.C. y D.E. McCauley (1999): Indirect measures of gene flow and migration: FST does not equal 1/(4Nm + 1). Heredity (82): 117-125. Whitmore, C. P. y P. H. Dutton (1985): Infertility, embryonic mortality and nest-site selection in leatherback and green sea turtles in Suriname. Biol. Conserv. (34): 251-272. Wibbels, T., W. D. Owens, J.C. Limpus, C. P. Reed, y S. M. Amoss (1990): Seasonal Changes in serum gonadal steroids associated with migration, mating and nesting in the loggerhead sea turtle (Caretta Caretta), Gen. Comp. Endocrinol., 79-154. Williams-Walls J., J. O'Hara y R. Wilcox (1983): Spatial and temporal trends of sea turtle nesting on Hutchinson Island, Florida, 1971±1979. Bull. Mar. Sci. (33): 55-66. Wilson, A. C., Cann, R. L., Carr, S. M., George, M., Gyllensten, U. B., Helm-Bychowski, K. M., Higuchi, R. G., Palumbi, S. R., Prager, E. M., Sage, R. D. & Stoneking, M. (1985): Mitochondrial DNA and two perspectives on evolutionary genetics. Biol. J. Linn. Soc. 26: 375-400. Wilson, D. (1998): Nest-site selection: microhabitat variation and its effects on the survival of turtle embryos. – Ecology. (79): 1884–1892. Witherington, B. E. (1992): Behavioral responses of nesting sea turtles to artificial lighting. Herpetologica. (48): 31-39. Witherington, B.E. y C.M. Koeppel (2006): Sea turtle nesting in Florida, USA, during the decade 1989–1998: an analysis of trends. Proceedings of the Nineteenth Annual Symposium on Sea Turtle Biology and Conservation (ed. by H. Kalb and T. Wibbels), US Department of Commerce, NOAA Technical Memorandum NMFS-SEFSC-443, pp. 94–96. Miami. Witherington, B.E. y R.E. Martin (1996): Understanding, assessing, and resolving light pollution problems on sea turtle nesting beaches. FMRI Technical Report TR-2. Florida Marine Research Institute; St. Petersburg, Florida. Wood, D. W. y K. A. Bjorndal (2000): Relation of temperature, moisture, salinity and slope to nest site selection in loggerhead sea turtles. Copeia. 119-128. Wright, J. M. (1978): The interpretation of population structure by F-statistics with special regards to systems of mating. Evolution. (19): 395-420 Wright, S. (1951): The genetical structure of populations. Ann. Eugen. 15:323-354 Wyneken, J. (1997): Sea Turtle Locomotion: Mechanism, Behavior and Energetics. Memorias del 18vo Simposio Internacional sobre Biología y Conservación de Tortugas Marinas. p. 33. Yerli, S., A. F. Canbolat, L. J. Brown y D. W. Macdonald (1997): Mesh grids protect loggerhead turtle (Caretta caretta) nests from red fox (Vulpes vulpes) predation. Biol. Conserv. (82): 109–111. Zahirul, M. (2002): Marine Turtle Nesting at St. Martin's Island, Bangladesh Marine Turtle Newsletter (96):1921. Zárate, P. M., S. S. Cahoon, M. C. D. Contato, P. H. Dutton y J. A. Seminoff (2006): Nesting beach monitoring of green turtles in the Galapagos islands: a 4-year evaluation. En: Frick, M., Panagopoulou A., Rees A. F. Y K. Williams (compiladores). Book of Abstracts. Twenty Sixth Annual Symposium on Sea Turtle Biology and Conservation. International Sea Turtle Society, Athens, Greece. p. 354 Zhang D.X. y G. M. Hewitt (2003): Nuclear DNA analyses in genetic studies of populations: practice, problems and prospects. Mol. Ecol. (12): 563–584. Zug G.R., G.H. Balazs, J.A. Wetherall, D.M. Parker y S.K.K. Murakawa (2002): Age and growth in Hawaiian green seaturtles (C. mydas): an analysis based on skeletochronology. Fish. Bull. (100):117–127 122 Anexo 1: Características de los ciclones que afectaron el occidente de Cuba durante el período de estudio Tabla1.Clasificación de los ciclones tropicales atendiendo a la intensidad de los vientos máximos sostenidos en superficie. Clasificacion Viento máximo sostenido en km/h (media en un minuto) Depresión Tormenta Tropical Huracán <63 63-117 >117 Tabla 2. Clasificación de los huracanes según la escala de Saffir – Simpson. Categoría Presión central (hPa) Viento máximo sostenido (km/h) Daños 1 2 3 4 5 >= 980 965 - 979 945 – 964 920 – 944 < 920 118-153 154-177 178-209 210-250 >250 Mínimos Moderados Extensos Extremos Catastróficos 2002 2002 2003 2004 2004 2005 2005 2005 2006 2007 Nombre Fecha de inicio Fecha en que finaliza Viento máximo (km/h) Presión mínima (hPa) Fecha y hora (UTC*) en que alcanzó la máxima intensidad Escala Saffir Simpson Isidore Lili Claudette Charley Iván Arlene Katrina Wilma Alberto Dean 14/9 21/9 8/7 9/8 2/9 08/6 23/8 15/10 10/6 13/8 26/9 td> 17/7 15/8 24/9 13/6 31/8 25/10 14/6 23/8 205 230 150 230 270 110 280 295 110 280 934 938 979 941 910 989 902 882 995 905 22/9 11:31 2/10 20:13 15/7 14:14 8/13 19:57 12/9 00:05 11/6 1:47 28/8 17:55 19/10 12:00 13/6 00:00 21/8 08:30 3 4 1 4 5 5 5 5 3 4 5 2 1 Figura 1. Trayectoria los ciclones Isidore (1), Lili (2), Charley (3), Iván (4) y Arlene (5) sobre el archipiélago cubano. ANEXOS 123 Anexo 2: Valores de F (índice de autocigosidad) observados y esperados bajo el modelo de alelos infinitos (IAM), y probabilidad de que sean significativamente diferentes, obtenidos mediante la prueba de neutralidad de EwensWatterson (Ewens, 1972; Watterson, 1978) para todas las muestras según su localidad. Locus Ei8 Localidad Localidad 0,46085 Cayo Largo 0,42474 0,471 Centro 0,95211 0,66089 0,06 Isla 0,56222 0,5913 0,225 Isla Occidente 0,39574 0,35331 0,697 Perjuicio 0,44358 0,62217 0,495 Antonio Fobservada Fesperada p Antonio 0,10597 0,16902 0,001 Cayo Largo 0,28502 0,2175 0,236 Centro 0,12302 0,16667 0,007 0,25 0,15967 0,162 Occidente 0,15776 0,19281 0,092 0,025 Perjuicio 0,14583 0,17947 0,289 0,55592 0,423 San Felipe 0,21 0,29453 0,291 0,15733 0,14668 0,012 Antonio 0,09 0,12732 0,219 Cayo Largo 0,11736 0,15681 0,071 Cayo Largo 0,10875 0,13155 0,256 Centro 0,20414 0,13826 0,002 Centro 0,37061 0,11628 0,347 Isla 0,16667 0,21582 0,092 Isla 0,31888 0,18158 0,551 Occidente 0,14661 0,16665 0,059 Occidente 0,14524 0,14084 0,354 Perjuicio 0,12193 0,1324 0,011 Perjuicio 0,12125 0,14873 0,848 San Felipe 0,22222 0,23678 0,41 0,3549 0,246 OR8 CM58 0,34 0,3591 0,139 0,1283 0,26234 0,856 Antonio 0,27112 0,72617 0,54754 0,166 Cayo Largo 0,52839 0,40792 0,053 0,2288 0,32136 0,733 Centro 0,20226 0,36084 0,219 0,44444 0,39923 0,431 Isla 0,51556 0,33524 0,001 Occidente 0,2927 0,37901 0,784 Occidente 0,39919 0,35544 0,252 Perjuicio 0,605 0,60849 0,085 Perjuicio 0,29475 0,41231 0,104 San Felipe 0,39844 0,41355 0,195 San Felipe 0,32812 0,33302 0,569 Antonio 0,19964 0,1439 0,145 Antonio 0,20959 0,22058 0,01 Cayo Largo 0,10226 0,11825 0,023 Cayo Largo 0,29398 0,28188 0,029 0,1282 0,10224 0,021 Centro 0,20293 0,27508 0,084 Isla 0,19333 0,18704 0,036 Isla 0,22917 0,26235 0,009 Occidente 0,20433 0,20252 0,544 Occidente 0,25222 0,22799 0,02 Perjuicio 0,12004 0,15884 0,574 Perjuicio 0,19274 0,27284 0,001 0,25 0,33349 0,267 San Felipe 0,25926 0,28381 0,582 Antonio 0,15073 0,2036 0,079 Cayo Largo 0,15819 0,171 0,097 Centro 0,18934 0,17954 0,034 Isla 0,14286 0,16093 0,597 Occidente 0,19681 0,22526 0,108 Perjuicio 0,16529 0,1729 0,214 0,17 0,24659 0,514 Antonio Centro Isla Centro San Felipe OR2 0,364 Locus 0,38716 Cayo Largo CM72 p 0,66929 San Felipe OR1 Fesperada Antonio San Felipe CM84 Fobservada San Felipe OR3 Cc117 ANEXOS 124 Anexo 3: Evaluación de la diferenciación genética por año para los nueve loci microsatélites para las poblaciones de Guanahacabibes (Fst (Pa)) Antonio OR3 2004 2006 2006a 0,000(0,40) 2007a 0,009(0,18) OR8 2004 0,007(0,26) 2006 2006a 0,030(0,03) 2007a 0,022(0,08) OR2 2004 2004 2006 2007a 0,003(0,33) CM58 0,037(0,04) 2004 2006 2006a 0,004(0,33) 0,024(0,03) 2006 2006a 0,000(0,42) 2007a 0,000(0,38) OR1 2006a 0,037(0,06) 2007a 0,000(0,38) CM72 0,000(0,35) 2004 2006 2007a 0,000(0,48) 2004 2006a 0,047(0,01) 2006 2007a 0,052(0,02) 0,031(0,02) 2006 CM84 2004 2006a 0,024(0,06) 2007a 0,069(0,01) 0,024(0,01) 2006 Ei8 2004 2006a 0,028(0,13) 0,071(0,01) 2007a 0,018(0,19) 0,007(0,23) 2006 Cc117 2004 2006 2006a 0,000(0,52) 2007a 0,005(0,39) 0,009(0,44) 2006 2006a 0,062(0,01) 0,009(0,14) Cc117 Perjuicio OR3 2004 2006a 0,000(0,38) 2006 2007a 0,071(0,06) 0,048(0,12) OR8 2004 2006 2006a 0,000(0,41) 2007a 0,000(0,32) 0,061(0,05) OR2 2004 2006 2006a 0,020(0,22) 2007a 0,093(0,02) 0,060(0,02) OR1 2004 2006a 0,059(0,20) 2007a 0,000(0,38) 0,070(0,12) 2006 CM58 2004 2006a 0,017(0,27) 2007a 0,018(0,32) 0,092(0,01) 2006 CM72 2004 2006a 0,017(0,28) 2007a 0,000(0,40) 0,0210,18) 2006 CM84 2004 2006a 0,011(0,26) 2007a 0,009(0,33) 0,016(0,30) 2006 Ei8 2004 2006a 0,00(0,42) 2007a 0,00(0,28) 0,00(0,38) La Barca OR3 2004 2006 0,012(0,21) 2007 0,070(0,01) OR8 2004 2006 OR1 2004 2006 0,059(0,06) 0,006 (0,30) 2007 0,040(0,11) 2006 CM58 2004 Cc117 2004 2006 0,000(0,41) 2006 0,020(0,22) 2007 0,001(0,38) 0,034(0,04) 2006 CM84 2004 2006 2006 0,000(0,45) 2006 0,020(0,09) 2006 0,012(0,15) 2007 0,000(0,54) 0,000(0,49) 2007 0,033(0,06) 0,000(0,40) 2007 0,012(0,25) 0,018(0,11) OR2 2004 2006 CM72 2004 2006 Ei8 2004 2006 2006 0,033(0,01) 2006 0,009(0,35) 0,000(0,47) 2007 0,027(0,07) 2007 0,000(0,33) 2006 0,007(0,32) 2007 0,008(0,27) 0,001(0,44) 0,000(0,44) ANEXOS 125 Caleta de los Piojos OR1 2000 2002a 0,006(0,34) 2002 2004 2006 CM72 2000 2002a 0,011(0,23) 2004a 0,000(0,25) 0,000(0,37) 2006a 0,018(0,14) 0,081(0,06) 0,014(0,30) 2007a 0,000(0,37) 0,003(0,40) 0,000(0,36) OR2 2000 2002 2004 2002a 0,000(0,44) 2004a 0,000(0,37) 0,005(0,28) 2006a 0,099(0,01) 0,122(0,01) 0,126(0,01) 2007a 0,057(0,04) 0,082(0,01) 0,047(0,12) CM58 2000 2002 2004 2002a 0,084(0,01) 2004a 0,010(0,31) 0,050(0,02) 2006a 0,016(0,15) 0,062(0,01) 0,041(0,05) 2007a 0,015(0,29) 0,084(0,01) 0,070(0,02) 0,000(0,36) Cc117 2000 2002 2004 2006 2002a 0,029(0,08) 2004a 0,010(0,30) 2004a 0,000(0,30) 0,000(0,47) 2006a 0,119(0,01) 0,080(0,01) 0,105(0,01) 0,067(0,08) 2007a 0,082(0,01) 0,090(0,03) 0,109(0,01) 0,142(0,01) 2006 OR8 2000 2002 2004 2006 2002a 0,050(0,02) 2004a 0,009(0,16) 0,000(0,42) 2006a 0,052(0,04) 0,053(0,01) 0,035(0,11) 0,048(0,16) 2007a 0,000(0,47) 0,020(0,19) 0,000(0,44) 0,021(0,21) 2006 OR3 2000 2002 2004 2006 2002a 0,000(0,46) 2004a 0,000(0,44) 0,000(0,35) 2006a 0,024(0,17) 0,066(0,01) 0,078(0,02) 2007a 0,058(0,05) 0,092(0,02) 0,062(0,09) 0,036(0,06) 2006a 0,000(0,37) 0,012(0,24) 0,00(0,48) 2007a 0,000(0,42) 0,085(0,01) 0,00(0,39) 0,00(0,32) 2002 2004 2006 0,010(0,28) ANEXOS 126 Anexo 4: Prueba de Chi-cuadrado por pares de poblaciones para los nueve loci microsatélites estudiados. En las tablas se muestran los valores del estadístico, entre paréntesis los grados de libertad y debajo el valor de probabilidad de existencia de diferencias entre pares de poblaciones corregida con el procedimiento de Bonferroni con 1000 simulaciones Ei8 Occidente 21,10 (7) Centro 0,00 16,71 (7) Perjuicio 0,03 12,17 (7) Antonio 0,02 19.69 (7) San Felipe 0,02 12.36 (7) Isla 0, 01 Cayo 17.34 (7) largo 0,02 OR2 Occidente 40.06 (14) Centro 0,00 26.22 (13) Perjuicio 0,01 46.48 (13) Antonio 0,00 15.54 (12) San Felipe 0,22 17.36 (12) Isla 0,14 Cayo 31.83 (15) largo 0,00 OR8 Occidente 25.82 (18) Centro 0,07 31.23 (15) Perjuicio 0,00 38.56 (17) Antonio 0,00 33.57 (14) San Felipe 0,01 4.21 (15) Isla 0,06 Cayo 13.98 (15) largo 0,53 Centro 44.17 (2) 0,00 71.27 (5) 0,00 48.50 (3) 0,00 16.34 (2) 0,00 48.59 (5) 0,00 Centro Perjuicio 11.53 (5) 0,04 14.51 (3) 0,00 6.79 (2) 0,03 5.94 (5) 0,29 Perjuicio 25.19 (14) 0,02 45.49 (14) 0,00 17.66 (13) 0,18 15.65 (14) 0,30 19.76 (15) 0,18 4.83 (13) 0,98 11.61 (11) 0,43 11.61 (11) 0,40 21.86 (15) 0,07 Centro Perjuicio 29.19 (16) 0,02 30.25 (18) 0,02 19.34 (14) 0,13 22.66 (16) 0,09 24.31 (15) 0,03 34.52 (16) 0,00 18.57 (12) 0,06 22.96 (13) 0,02 81.65 (14) 0,00 Antonio 18.44 (5) 0,01 3.88 (5) 0,55 8.39 (7) 0,27 Antonio San Felipe 7.08 (3) 0,05 18.24 (6) 0,00 San Felipe Isla 2.85 (5) 0,76 Isla 16.32 (13) 0,26 22.29 (13) 5.61 (10) 0,04 0,94 40.36 (15) 17.76 (14) 18.44 (14) 0,00 0,21 0,15 Antonio 39.99 (16) 0,00 18.02 (16) 0,32 52.73 (16) 0,00 San Felipe Isla 20,00 (11) 0,01 38.05 (12) 35.78 (14) 0,00 0,00 OR1 Occidente 20.65 (8) Centro 0,00 10.16 (6) Perjuicio 0,10 9.60 (10) Antonio 0,50 20.15 (10) San Felipe 0,01 16.01 (6) Isla 0,03 Cayo 12.49 (6) largo 0,02 OR3 Occidente 21.73 (9) Centro 0,00 18.07 (9) Perjuicio 0,03 19.50 (9) Antonio 0,02 21.13 (9) San Felipe 0,03 34.49 (9) Isla 0,00 Cayo 14.94 (9) largo 0,06 CM58 Occidente 35.39 (22) Centro 0,02 25.21 (19) Perjuicio 0,14 23.76 (22) Antonio 0,37 24.73 (20) San Felipe 0,24 30.45 (20) Isla 0,07 Cayo 26.17 (21) largo 0,21 Centro 9.98 (7) 0,13 28.75 (11) 0,00 23.71 (7) 0,00 12.96 (7) 0,07 31.09 (7) 0,00 Centro 42.02 (7) 0,00 3.54 (8) 0,92 29.98 (8) 0,00 22.19 (8) 0,00 34.01 (8) 0,00 Centro 28.73 (21) 0,08 25.83 (22) 0,23 15.67 (19) 0,70 37.26 (22) 0,01 20.27 (20) 0,47 Perjuicio 14.39 (10) 0,15 16.91 (4) 0,00 5.92 (4) 0,17 9.72 (3) 0,02 Perjuicio 46.48 (8) 0,00 11.29 (6) 0,07 28.45 (7) 0,00 11.97 (6) 0,05 Perjuicio 36.28 (22) 0,04 16.54 (14) 0,27 24.52 (17) 0,05 20.72 (18) 0,27 Antonio 13.28 (10) 0,27 4.13 (10) 0,93 10.75 (10) 0,39 Antonio 25.24 (8) 0,00 25.20 (8) 0,00 31.68 (8) 0,00 Antonio 20.09 (21) 0,51 32.12 (21) 0,07 31.63 (22) 0,07 San Felipe 5.16 (3) 0,30 12.65 (3) 0,02 San Felipe 10.37 (6) 0,11 7.25 (6) 0,30 San Felipe Isla 3.07 (4) 0,57 Isla 22.22 (7) 0,00 Isla 11.62 (11) 0,41 7.56 (17) 33.30 (20) 0,97 0,01 ANEXOS 127 CM72 Occidente 76.23 (22) Centro 0,00 41.03 (19) Perjuicio 0,00 55.90 (21) Antonio 0,00 75.51 (16) San Felipe 0,00 35.36 (15) Isla 0,00 Cayo 65.26 (23) largo 0,00 Cc117 Occidente 45.22 (13) Centro 0,00 43.59 (13) Perjuicio 0,00 54.80 (13) Antonio 0,00 19.78 (12) San Felipe 0,08 26.00 (12) Isla 0,02 Cayo 52.29 (12) largo 0,00 Centro Perjuicio Antonio 28.37 (23) 0,17 79.80 (27) 0,00 37.74 (22) 0,02 27.77 (23) 0,20 42.06 (24)0,00 39.88 (21) 0,00 33.80 (13) 0,00 24.33 (16) 0,04 32.16 (19) 0,02 57.08 (20) 0,00 42.06 (19) 0,00 46.35 (24) 0,00 Centro Perjuicio Antonio 13.29 (8) 0,08 34.66 (14) 0,00 7.55 (8) 0,52 11.15 (9) 0,26 10.08 (9) 0,35 20.11 (13) 0,07 12.97 (7) 0,05 8.07 (8) 0,48 18.67 (9) 0,02 16.98 (12) 0,17 17.66 (12) 0,14 41.74 (13) 0,00 San Felipe Isla 30.71 (12) 0,00 37.66 (16) 35.75 0,01 (20)0,01 San Felipe 13.30 (7) 0,05 9.90 (8) 0,27 Isla 12.78 (8) 0,11 CM84 Occidente 51.77 (19) Centro 0,00 49.29 (17) Perjuicio 0,00 52.91 (19) Antonio 0,00 88.03 (17) San Felipe 0,00 39.51 (16) Isla 0,00 Cayo 27.58 (17) largo 0,00 Centro 30.14 (19) 0,03 32.63 (21) 0,03 41.33 (18) 0,00 29.08 (17) 0,03 27.09 (19) 0,07 Perjuicio 33.09 (20)0,02 41.77 (16) 0,00 26.94 (15) 0,01 27.17 (17) 0,05 Antonio 70.14 (20) 0,00 35.75 (19) 0,01 32.42 (20) 0,02 San Felipe Isla 36.53 (10) 0,00 69.61 (17) 26.68 (16) 0,00 0,04 ANEXOS 128 1000 0,45 Salidas 0,40 CSST 0,35 800 0,30 Número de salidas 700 0,25 600 0,20 500 0,15 400 0,10 300 0,05 200 0,00 100 -0,05 -0,10 0 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 Año Anexo 5: Relación entre las salidas anuales de hembras anidadoras y el índice oceanográfico del Caribe de la NOAA. Índice del Caribe Índice oceanográfico 900 ANEXOS 129 Anexo 6: Comportamiento de las corrientes marinas en Cuba Fig. 1. Mapa general de las corrientes marinas en Cuba. Tomado de Moncada (2005) Figura 2. Detalle de las corrientes marinas en el suroccidente del archipiélago cubano. Adaptado de García et al. (1991). ANEXOS 130 Anexo 7. Distribución de haplotipos de secuencias parciales (742 pb) de la región de control del mtDNA de C. mydas, en áreas de anidación y agregación marina del Atlántico. a b Nota: Haplotipos CM-A1 – 3 (Allard et al., 1994); CM-A4-18 (Encalada et al., 1996) ; CM-A19-21 (Lahanas et al., 1998) ; CM-A22, 26-28 y 34 (Bjorndal & Bolten, inscritos en el c d e f GenBank 2001); CMA-A35-46 (Formia, 2002) ; CM-A48, 56 y 57 (Espinosa et al., inscritos en el GenBank 2003); (Bjorndal et al., 2005) ; (Luke et al., 2004) ; (Bagley., 2003) ; (Bass et al., 2003) g Áreas de agregación Áreas de anidación 7 497 Florida 1 (e) Florida 2 (f) Carolina del Norte (g) Norte Habana Norte Camagüey Bahamas (e) Nicaragua (e) Barbados (e) N 12 109 34 1 9 2 54 7 228 1 3 2 43 142 43 3 5 1 1 1 32 27 13 1 74 1 2 CM-A39 CM-A45 CM-A46 CM-A38 CM-A27 CM-A28 CM-A34 CM-A35 CM-A36 CM-A37 1 1 1 7 1 7 3 1 0 10 6 13 49 66 11 10 34 20 433 30 15 16 11 51 50 1 6 20 10 2 3 1 8 59 51 45 1 4 13 1 10 1 5 1 181 6 1 2 3 3 1 1 3 4 7 9 1 19 1 1 1 2 7 3 1 3 2 2 7 3 3 1 0 52 27 3 2 3 12 5 62 21 311 9 2 1 0 0 14 26 1 1 2 2 0 0 3 0 1 6 1 4 12 2 3 0 1 0 2 6 4 4 2 2 1 2 1 1 2 1 3 1 2 1 1 1 1 1 1 3 6 1 1 1 1 1 1 1 3 1 3 3 1 9 CM-A57 1 3 1 1 1 1 1 1 1 3 2 5 53 1 N 24 1 3 N CM-A56 8 1 33 5 395 3 CM-A48 San Felipe (Cuba) La Isla (Cuba) Cayo Largo (Cuba) Quintana Roo (Méx) ( a) Tortuguero (C. Rica) (d) Isla Aves (Venez) (b) Matapica (Surinam) ( a) Atolón Rocas (Brasil) ( a) Isla Ascensión (c) Guinea Bissau (c) Bioko (Guinea Ec.) (c) Corisco (Guinea Ec.) (c) Príncipe (c) Sao Tomé (c) Lara (Chipre) ( a) CM-A22 CM-A24 CM-A26 24 CM-A19 CM-A20 CM-A21 10 CM-A18 Oriente (Guana) CM-A15 CM-A16 CM-A17 10 CM-A14 6 CM-A13 Centro (Guana) CM-A9 CM-A10 CM-A11 CM-A12 6 CM-A8 12 CM-A7 1 19 CM-A6 CM-A3 11 Occidente (Guana) CM-A5 CM-A2 Hutchinson (Florida) ( a) CM-A4 Localidad CM-A1 Haplotipos 1 1 1 1 2 0 4 4 0 1 0 0 0 0 0 0 1 1 0 0 887 62 295 97 6 12 80 60 60 672 131 -6800 100 -6900 80 -7000 60 -7100 40 L´k L -7200 -7300 -7400 20 0 -7500 -20 -7600 -40 -7700 Media ± D.E. -7800 1 3 5 7 9 11 13 -60 1 k 3 5 7 9 11 13 Media ±D.E. k 180 70 160 140 60 100 50 80 40 60 ∆K L´´ 120 40 20 30 20 0 10 -20 -40 -60 1 3 5 7 9 k 11 13 Media ±D.E. 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 K Anexo 8. Método gráfico para detectar el verdadero número de grupos en el structure (K*) (Evanno et al., 2005). (A) Media de L(K) (±DE) para 20 corridas de cada valor de K. (B) Tasa de cambio de la distribución de L (k) (media ± D.E.) calculado como L′ (K) = L(K) – L(K – 1). (C) Valor absoluto de la tasa de cambio de segundo orden de la distribución de L(K) (media ± DE) calculada de acuerdo a la fórmula: |L′′(K)| = |L′(K + 1) – L′(K)|. (D) ΔK calculado como: ΔK = m|L′′(K)|/ s[L(K)]. El valor modal de las distribuciones es el verdadero valor de K(*) o el nivel superior de estructura. 132 AUTOBIOGRAFÍA Trabajos presentados en eventos científicos relacionados con el tema de tesis: 1. V Congreso de Ciencias del Mar, MARCUBA 2000, efectuado en el Palacio de las Convenciones, La Habana, del 4 al 8 de diciembre del 2000 con la ponencia “Proyecto universitario para el estudio y conservación de las tortugas marinas en Cuba”. 2. Ecojoven 2001 provincial de las Brigadas Técnicas Juveniles, como coautora del trabajo “Proyecto universitario para el estudio y conservación de las tortugas marinas en Cuba”, el 11 de mayo de 2001, el cual resultó premiado. 3. XV Forum Nacional de Estudiantes de Ciencias Sociales, Naturales y Exactas. Proyecto Universitario para el estudio y conservación de las tortugas marinas en Cuba. Cuba, junio del 2001. 4. III Convención Internacional sobre Medio Ambiente y Desarrollo efectuada en el Palacio de las Convenciones, Ciudad Habana, Cuba, del 18 al 22 de junio del 2001 con el trabajo: “La Educación Ambiental a través de la actividad investigativa: una experiencia en Guanahacabibes”. 5. Taller sobre el Manejo Conjunto de los Recursos Marinos y Costeros en el Gran Caribe. Ciudad Habana, Cuba, 12 al 15 de diciembre, 2001. 6. X Exposición Forjadores del Futuro con el trabajo “La Conservación de tortugas Marinas en Áreas de Anidación: Estudio en la Península de Guanahacabibes”. Premios a nivel municipal y provincial, año 2002. 7. Taller sobre técnicas de Seguimiento para el proyecto PNUD de Sabana – Camagüey impartiendo las técnicas de seguimiento de tortugas marinas. (17 al 22 de junio del 2002). 8. Taller sobre el “Proyecto Universitario para el estudio y conservación de las Tortugas Marinas en Cuba” (7 al 11 de julio, 2002). 9. Molecular Evolution Meeting. Population Genetics and Molecular Evolution of mt DNA noncoding region in Cuban nesting colony of Green Turtle C. mydas. Italia, junio del 2002. 10. Forum de Ciencia y Técnica. Nivel de Base. El seguimiento de tortugas marinas en áreas de anidación: estudio de caso en la Península de Guanahacabibes. Cuba. Junio, 2003. 11. Simposub 2003. Proyecto Universitario para el estudio y conservación de tortugas marinas en Cuba. Cuba. Septiembre del 2003. 12. VI Congreso de Ciencias del Mar, MARCUBA 2003. Cuba. Diciembre, 2003, con los trabajos: − Factores que afectan la conducta de anidación de C. mydas en la Península de Guanahacabibes, Pinar del Río, Cuba. − Estructura genética de dos colonias de anidación cubanas de C. mydas empleando un marcador de mtDNA. − Estructura genética de una muestra de colonias de anidación cubanas de Caretta caretta empleando un marcador de mtDNA. − Proyecto Universitario para el Estudio y Conservación de las tortugas marinas en Cuba; seis años de trabajo. 13. Primer Taller Nacional de Tortugas Marinas. Cuba, Diciembre del 2003, con los trabajos: − Genética de poblaciones de tortugas marinas utilizando un marcador de mtDNA. 133 − Seis años de trabajo con Tortugas Marinas en la Península de Guanahacabibes. − Filogeografía de tortugas marinas utilizando un marcador de mt DNA. 14. Mesa Redonda “Opciones sostenibles para la pesquería en Cuba”. Proyecto Universitario para el Estudio y Conservación de las tortugas marinas en Cuba; seis años de trabajo. Cuba. Diciembre del 2003 15. Universidad 2004, Convención. La educación ambiental en la Reserva de la Biosfera “Península de Guanahacabibes” y comunidades aledañas. Cuba. Febrero del 2004. 16. 11na Reunión Latina de Especialistas en tortugas Marinas. RETOMALA. Ostional, Costa Rica. Febrero del 2004 17. 24th Annual Symposium on Sea Turtle Biology and Conservation, San José, Costa Rica en febrero del 2004, con los trabajos: − Implicaciones de la genética poblacional de una muestra cubana de colonias de anidación de Caretta caretta en la filogeografía de la especie. − Implicaciones de la genética poblacional de muestras cubanas de colonias de anidación de C. mydas en la filogeografía de la especie. − La conservación de tortugas marinas en las áreas de anidación de la Península de Guanahacabibes, Cuba: seis años de trabajo. 18. I Simposium Internacional de Ciencias Biológicas Charles T. Ramsden in memoriam. Resultados Preliminares del seguimiento de tortugas marinas en áreas de anidación de la Península de Guanahacabibes. Santiago de Cuba, 11 al 14 de Octubre del 2004. 19. V Taller Nacional de Hacedores de Mapa Verde, 9 y 10 de diciembre del 2004 20. 25th Annual Symposium on Sea Turtle Biology and Conservation, Savanna, Georgia, EU en febrero del 2005, con los trabajos: − Reproductive success indicators of green turtles (C. mydas) in Guanahacabibes Peninsula, Pinar del Río, Cuba − Repercussion of abiotic factors in nesting process of C. mydas in nesting areas of the west of Cuba. 21. Segundo taller internacional para la conservación de las tortugas marinas en Guanahacabibes, Cuba: La participación de las comunidades locales en la conservación. 12 al 15 de septiembre del 2005 con los trabajos: − Caracterización de la colonia de anidación de C. mydas de la Península de Guanahacabibes, Pinar del Río, Cuba − Indicadores del éxito reproductivo e influencia de la temperatura en el desarrollo embrionario de C. mydas en la Península de Guanahacabibes, Pinar del Río, Cuba. − Dinámica poblacional de tortugas marinas en el archipiélago cubano, empleando marcadores moleculares. 22. 26th Annual Symposium on Sea Turtle Biology and Conservation, Creta, Grecia, en abril del 2006, con los trabajos: − Reproductive success of C. mydas in nesting areas of Guanahacabibes Peninsula, Cuba. − Implementation of GIS systems in C. mydas’ nesting areas of the West of Cuba. Population genetic of rookeries of green turtle in the west of the Cuban Archipelago, using a mtDNA marker 134 − Population genetic of rookeries of green turtle in the west of the Cuban Archipelago, using a mtDNA marker 23. VII Congreso de Ciencias del Mar, MARCUBA 2006. Cuba. Diciembre, 2006, con los trabajos: − Implementación de los SIG en áreas de anidación de C. mydas’ en el occidente de Cuba. − Influencia de los cambios geomorfológicos en las playas sobre la conducta reproductiva de C. mydas en el occidente de Cuba. − Influencia de factores abióticos en el éxito reproductivo de C. mydas en áreas de anidación de la Península de Guanahacabibes, Pinar del Río, Cuba. − Caracterización del agregado de C. mydas en los pesqueros legales localizados en el archipiélago de jardines del rey. − Caracterización del agregado de Caretta caretta en los pesqueros legales localizados en el archipiélago de jardines del rey. − Caracterización del agregado de Eretmochelys imbricata en los pesqueros legales localizados en el Archipiélago de Jardines del Rey (Cuba). Caracterización del agregado de Caretta caretta en los pesqueros legales localizados en el archipiélago de Jardines del Rey (Cuba). 24. PESCA 2007. “A dos años del huracán Iván: biología reproductiva de la colonia de anidación de la península de Guanahacabibes”. Cuba. Marzo, 2007. 25. 28th Annual Symposium on Sea Turtle Biology and Conservation, Loreto, Baja California, México, en enero del 2008, con los trabajos: − Impacto de huracanes de gran intensidad en la biología reproductiva de la colonia de anidación de tortugas marinas de la península de Guanahacabibes, Cuba. − Seven years results of the tagging program of marine turtles in Guanahacabibes Peninsula, Cuba. Publicaciones que forman parte de la tesis: Azanza, J., M. E. Ibarra, J. Hernández, R. Díaz y N. Hernández. 2008. Análisis de nidos de tortuga verde (C. mydas) durante la temporada 2006 en la Península de Guanahacabibes, Cuba Rev. Invest. Mar. 29 (2) Azanza, J., Y. Ruisanchez, M. E. Ibarra, A. Ruiz, & C. Y. Luis. 2006. Indicadores del éxito reproductivo de la tortuga verde (C. mydas) en tres playas de la Península de Guanahacabibes, Pinar del Río, Cuba. Rev. Inv. Mar. 27 (1): 69-79. Azanza, J., M. E. Ibarra, G. Espinosa, R.Díaz y G. Sansón. 2003. Conducta de anidación de la Tortuga Verde (C. mydas) en las playas Antonio y Caleta de los Piojos de la Península de Guanahacabibes, Pinar del Río, Cuba. Revista de Investigaciones Marinas 24 (3): 231-240 Azanza, J., 2002. Genética Poblacional de la tortuga verde (Chelonia mydas), que anida en las playas Antonio y Caleta de los Piojos, Península de Guanahacabibes, Cuba. Factores Ambientales que influyen en su conducta de anidación. Tesis de Maestría. Centro de Investigaciones Marinas. Universidad de La Habana. Espinosa, G., A. Ruiz, J. Azanza, R. Frías, R. Díaz, & M. Ramos. 2004. Population genetic from turtle in Cuban shelf using mitochondrial DNA. Rev. Cub. Quím. 16 (3): 317. 135 Ibarra, M. E; Díaz- Fernández, R.; Nodarse, A.; Azanza, J; Angulo, J.; Espinosa, G. y Pacheco, J. 2002. Project Update: University Project for the Study and Conservation of Cuban Sea Turtles- Completion of Year 3. Marine Turtle Newsletter No 95, p. 18- 20. Ibarra Martín, M. E., R. Díaz-Fernández, G. Espinosa López, J. Azanza Ricardo, A. Nodarse Konnorov, F. Hernández Orozco, Colectivo e Estudiantes de la Facultad de Biología. 2002. Las comunidades locales en el estudio y conservación de las Tortugas Marinas en Cuba. Balance entre Población y Recursos. Investigaciones Interdisciplinarias y Manejo de Áreas Costeras en el Gran Caribe. CBCRM Program. 115-130. Ed. IDRC / CFU-IOI-LAVAL- 1ª Ed. Heredia EFUNA, 594 p., 14 x 11 cm. ISBN 9968-14-089-9 Otras publicaciones relacionadas con el tema: Espinosa López, G., U. Bécquer Zuñiga, Y. Borrell Pichs, J. Romo Ramos, R. Díaz Fernández, J. Azanza Ricardo y R de Dios. 2002. Variación genética y morfológica en poblaciones naturales y cautivas del Camarón Blanco Litopenaeus schmitti en Cuba Aquatic. aquatic.unizar.es. Bécquer, U., J. Diaz, N. Hernandez, J. Azanza, G. Espinosa, Y. Borrell, J. Romo C. Guerrero. 2002. La Genética en el Cultivo de Camarón Penaeus schmitti en Cuba: Resultados y Perspectivas. Revista Acuacultura del Ecuador. Pág 33-36