Alteraciones patológicas en el líquido seminal
Anuncio

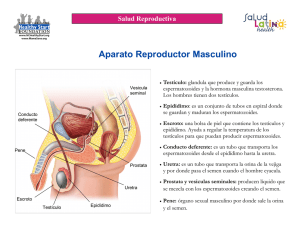
UNIVERSIDAD CATÓLICA DE CUENCA UNIDAD ACADÉMICA DE INGENIERÍA QUÍMICA, INDUSTRIAL, DE ALIMENTOS, BIOMOLECULAR, BIOCOMBUSTIBLES Y BIOFARMACIA ALTERACIONES PATOLÓGICAS DEL LÍQUIDO SEMINAL Monografía previa a la obtención del título De Químico Farmaceuta DIRECTOR: DR: JUAN CABRERA REALIZADO POR: Tecnóloga. NIDIA PESÁNTEZ 2009-2010 CUENCA- ECUADOR DEDICATORIA La presente monografía va dedicada con mucho cariño y aprecio a mi esposo a mis padres y hermanos, quienes día tras día fueron mi apoyo y me han sabido brindar esa ayuda de forma desinteresada, la necesaria para cumplir un sueño. AGRADECIMIENTO Quiero dejar plasmados mis agradecimientos a la Universidad Católica de Cuenca por los beneficios recibidos, en el campo docente, ya que siendo una persona ordinaria con los conocimientos adquiridos he llegado a ser una persona extraordinaria. Al Ing. Santiago Gómez Decano de la Facultad por habernos dotado de buenos catedráticos. Al Dr. Juan Cabrera, por su apoyo moral y Psicológico, que me ha brindado como dirigente de la monografía; y a todo el cuerpo docente por haberme inculcado sus conocimientos, y preocuparse por darme la mejor preparación posible. INTRODUCCION La presente monografía tiene como finalidad servir de guía para el estudio del líquido seminal de una manera general indicando sus técnicas y así evitar la infertilidad. En él los alumnos podrán encontrar de forma resumida y organizada los aspectos más importantes y necesarios para el estudio del esperma humano, desde el punto de vista macro y microscópicamente; además el análisis bioquímico, que es una determinación analítico-clínica de suma importancia en los estudios de esterilidad. En tales casos, uno de los primeros aspectos a estudiar es evaluar la calidad del semen, para descartar el factor masculino. Proponiendo los siguientes objetivos: o o o o o Establecer la anatomía y fisiología del líquido seminal. Determinar el examen físico y macroscópico del líquido seminal. Describir el examen microscópico del líquido seminal. Conocer el estudio bioquímico del líquido seminal. Investigar las causas de las alteraciones patológicas del líquido seminal. Su estudio se ha diseñado para determinar la existencia de alguna asociación entre la respuesta de las vesículas seminales y la movilidad espermática, la viscosidad seminal y la estabilidad de la cromatina. El estudio del semen basal o seminograma es el pilar básico en que se fundamenta el diagnóstico de la esterilidad masculina. La calidad del semen no ha disminuido de forma tan drástica en las últimas décadas como algunos investigadores señalan. Hoy en día no conocemos las razones del deterioro del semen en los varones, aunque algunos estudios apuntan hacía la contaminación y los malos hábitos (alcohol, tabaco, estrés, entre otros). Entre las parejas en edad reproductiva, se considera que del 10 al 15% son infértiles, al alrededor de un 50% se puede detectar el factor masculino como causa única o asociada de la infertilidad. En los últimos años se han logrado avances notables en el conocimiento de los mecanismos de la reproducción humana, así como en los métodos de investigación y diagnóstico de los trastornos de la fertilidad. A pesar de esto, el análisis del semen sigue siendo un examen imprescindible en el estudio del hombre que acude a consulta por infertilidad; luego se realizan otros exámenes según los resultados del mismo. En esta monografía se expone una sistemática analítica razonada, resultado de una amplia experiencia, que se basa en la recopilación y contraste de técnicas internacionales elegidos por sus buenos resultados hasta el momento actual. INDICE CAPITULO I 1. ANATOMIA Y FISIOLOGIA DEL LÍQUIDO SEMINAL 1.1 BASES ANATOMOFISIOLOGICAS 1.2 ESPERMATOGENESIS 1.2.1 Espermatogonio 1.2.2 Espermatocitos secundarios 1.2.3 Espermatides 1.3 FORMACION DEL LÍQUIDO SEMINAL 1.3.1 Testículos 1.3.2. Los testículos y el escroto 1.3.3 Epidídimo 1.3.4 Vasos deferentes 1.3.5Vesículas seminales 1.3.6 Glándula prostática 1.3.7 Conductos eyaculatorios 1.3.8 La uretra 1.3.9 Glándulas bulbo uretrales 1.3.10 El pene 1 3 4 6 7 8 9 10 11 11 12 12 13 14 14 15 15 CAPITULO II 2 .EXAMEN FÌSICO 0 MACROSCOPICO DEL LÍQUIDO SEMINAL 2.1 Aspecto 2.2 Volumen 2.3 Tiempo de licuación 2.4 Color 2.5 p H 2.6 Viscosidad 16 16 17 17 17 17 18 2.7 Filancia 18 CAPITULO III 3. EXAMEN MICROSCOPICO DEL LÍQUIDO SEMINAL 3.1 RECUENTO 3.1.1 El método automático 3.1.2 El recuento manual 3.1.3 Cálculo 3.1.4 Interpretación clínica 3.2 ESTUDIO DE LA MOTILIDAD 3.2.1 Técnicas de la observación directa. 3.2.2 Informe 3.2.3 Interpretación clínica 3.3 ÍNDICE DE VITALIDAD 3.3.1 Técnica. 3.3.2 Informe 3.3.3 Interpretación clínica 3.4 ESTUDIO MORFOLÓGICO. 3.4.1 Técnica 3.4.2 Informe 3.4.3 Interpretación clínica 3.4.5 Valores normales 3.5 OTRAS CÉLULAS EN EL SEMEN CAPITULO IV 4. ESTUDIO BIOQUIMICO DEL LÍQUIDO SEMINAL 4.1 MARCADORES PROSTATICOS 4.1.1 Acido cítrico 4.1.2 Técnicas de determinación 19 20 20 21 22 23 24 25 26 26 27 28 29 29 30 31 32 33 34 34 36 36 36 37 4.1.3 Valores normales 4.2 MARCADORES DE LAS VESICULAS SEMINALES 4.2.1 Fructosa 4.2.2 Técnica de determinación 4.2.3 Valores normales CAPITULO V 5. CAUSAS DE LAS ALTERACIONES PATOLOGICAS DEL LÍQUIDO SEMINAL 5.1 Infecciones 5.1.1 Prostatitis 5.1.2 Epididimitis 5.1.3 Orquitis 5.2 Azoospermia 5.2.1 Azoospermia obstructiva 37 37 38 38 38 5.2.2 Azoospermia secretora 5.3 Oligospermia 5.4 Teratozoospermia 5.5 Factor inmunológico 5.6 Síndrome de inmovilidad ciliar 5.7 Anomalías anatómicas 5.7.1 Varicocele 5.8 Disfunción eréctil 5.9 Astenozoospermia 41 41 41 41 42 43 43 43 43 40 40 40 40 40 41 41 OBJETIVOS: OBJETIVO GENERAL: Identificar las alteraciones patológicas del líquido seminal; a través de la consulta bibliográfica, para determinar su relación con la infertilidad masculina. OBJETIVOS ESPECIFICOS: o o o o o Establecer la anatomía y fisiología del líquido seminal. Determinar el examen físico o macroscópico del líquido seminal. Describir el examen microscópico del líquido seminal. Conocer el estudio bioquímico del líquido seminal. Investigar las causas de las alteraciones patológicas del líquido seminal. CONCLUSIONES Luego de haber culminado con la realización de esta monografía en base a investigación bibliográficas se ha llegado a las siguientes conclusiones: Primeramente se ha logrado el objetivo especifico ; mediante investigaciones , y conocimientos obtenidos en las aulas de nuestra prestigiosa Universidad se ha podido .Identificar las alteraciones patológicas del líquido seminal; a través de la consulta bibliográfica, para determinar su relación con la infertilidad masculina; los cuales servirán para mejorar la calidad de vida de los pacientes, aportando en conjunto con el médico; en el cumplimiento de los diferentes tratamientos administrados al paciente en forma individual. El primer objetivo específico planteado fue: “Establecer la anatomía y fisiología del líquido seminal” Anatomía del líquido seminal: Los principales órganos que forman el aparato reproductor masculino para formación del semen son: Pene Testículos Escroto Uretra Epidídimo Próstata Vesículas seminales Conducto eyaculadores Glándulas bulbo uretrales Tanto el pene como los testículos son órganos externos que se encuentran fuera de la cavidad abdominal. Los testículos producen espermatozoides y liberan a la sangre hormonas sexuales masculinas (testosterona). Un sistema de conductos que incluyen el epidídimo y los conductos deferentes almacenan los espermatozoides y los conducen al exterior a través del pene. En el transcurso de las relaciones sexuales se produce la eyaculación que consiste en la liberación en la vagina de la mujer del líquido seminal o semen. El semen está compuesto por los espermatozoides producidos por el testículo y diversas secreciones de las glándulas sexuales accesorias que son la próstata y las glándulas bulbo uretrales. Fisiología del líquido seminal:El semen es un fluido orgánico que sólo fabrican los varones (todos los mamíferos machos lo fabrican). El semen sale al exterior con la eyaculación, coincidiendo con el orgasmo. Su función es reproductora. El semen contiene millones de células reproductoras masculinas (espermatozoides). En cada una de ellas está incluido el mensaje genético que se transmitirá a los hijos (caso de que se fecunde el óvulo femenino). Los Espermatozoides: Son las células reproductoras (germinales) masculinas. Se fabrican en el testículo a partir de células especializadas llamadas de Sertoli. Una vez en el epidídimo, los espermatozoides circulan y van completando un proceso de maduración y capacitación. En el testículo son fabricadas células inmaduras, llamadas espermatogonias, que no serían capaces de fecundar un óvulo. A lo largo del epidídimo van desarrollándose formas más maduras, como los Espermatocitos de primer y segundo orden. Cuando estas formas jóvenes llegan al conducto deferente y a las vesículas seminales, maduranllamándose espermatozoides, que son células germinales efectivas (que pueden germinar si se unen a un óvulo, dando lugar a un embarazo). Líquido Seminal: Representa la mayor parte del volumen del eyaculado. En realidad se trata de un gel que se licuará una vez expulsado. Consta a su vez de dos partes: una contenida en las vesículas seminales (sacos que guardan la reserva de espermatozoides y líquido, listos para ser expulsados); y otra parte producida por la próstata. Al eyacular se unen ambas y salen mezcladas. Este gel contiene nutrientes y conservantes para los espermatozoides, imprescindibles para que los espermatozoides puedan llegar hasta el óvulo en las mejores condiciones de vitalidad. Concluyendo que tanto la anatomía y fisiología del liquido seminal es importante establecer para conocer de donde proviene el semen para su formación y qué función cumple en los hombres. El segundo objetivo específico planteado fue: Determinar el examen físico o macroscópico del líquido seminal. Se estudia los siguientes parámetros: Aspecto Volumen Tiempo de licuefacción Color pH Viscosidad Filancia Todas las muestras deben tomarse a través de la masturbación con 72 hs de abstinencia sexual y retención urinaria mínima de 3 horas. La abstinencia sexual permite detectar la mayor concentración de MO infectantes en las vías espermáticas y glándulas anexas, como así también minimiza la contaminación con los MO de la flora normal o colonizantes transitorios de la compañera sexual. El paciente, en el momento de la realización del estudio, no debe presentar secreción uretral ni infección urinaria. Se debe manejar la muestra con precaución, recordando que se puede transmitir a partir de ella, HIV. HEPATITIS B. VIRUS HERPES. Siendo importante determinar éste examen que a simple vista; el paciente con el médico puedan descartar o aceptar ciertos problemas de salud. El tercer objetivo especifico planteado fue: Describir el examen microscópico de líquido seminal; El examen del semen a través del microscopio es una fase esencial de la inseminación ya que será a partir de esta observación que decidiremos si utilizar o no el semen recogido. Lo primero a observar será el porcentaje de espermatozoides vivos así como su motilidad. Para poder realizar esta observación es preciso disponer de un microscopio de buena calidad y poder controlar la temperatura durante el examen a través de una platina térmica. En el transcurso de las investigaciones bibliográficas de los diferentes estudios se concluye que este análisis es de gran importancia para saber la razón de la infertilidad. El cuarto objetivo específico planteado fue: Conocer el estudio bioquímico del líquido seminal; El semen está compuesto por espermatozoides y plasma seminal producto de la secreción de las glándulas anexas. Hay compuestos de mayor secreción o secreción exclusiva de una glándula, el cual se utiliza como marcador bioquímico para evaluar la funcionalidad de dicha glándula. Acido Cítrico: evalúa la actividad prostática. Se encuentra alterado en procesos infecciosos-inflamatorios (actuales o anteriores) de la glándula, hipoandrogenismo, perdida de la primera porción del eyaculado. Fructosa: marcador bioquímico secretado principalmente por las vesículas seminales. Se encuentra disminuido en vesículas hipofuncionantes, azoospermias de tipo obstructivo, hipoandrogenismo. Este estudio bioquímico nos permite conocer que los marcadores en la reproducción son de gran importancia; por lo tanto es necesario que estén desempeñando correctamente. El quinto objetivo específico planteado fue: Investigar las causas de las alteraciones patológicas del líquido seminal. Causas de alteraciones: Infecciones: prostatitis, Epididimitis, Orquitis Azoospermia Azoospermia obstructiva Azoospermia secretora Oligospermia Teratozoospermia Factor inmunológico Síndrome de inmovilidad ciliar Anomalías anatómicas: Varicocele Disfunción eréctil Astenozoospermia Existen diversas causas siendo la más específica para que se produzca alteraciones en el semen; la infección que consta de prostatitis, epididimitis, orquitis que al no ser detectada a tiempo. No se podrá dar un tratamiento adecuado para esta patología llevando consigo la infertilidad. RECOMENDACIONES Tener abstinencia sexual 3 – 5 días antes de tomar la muestra. Abstinencia alcohólica de 3 - 5 días. Lavarse las manos antes de la toma de la muestra. El paciente debe higienizarse los genitales con agua y jabón, luego secarse con una toalla limpia. Obtener muestra completa. Recoger el semen a través de la masturbación. Recoger en recipiente de boca ancha estéril. La muestra debe ser remitida dentro de una hora de su obtención, protegiendo de la temperatura extrema < 20°C ˃ 40°C. Manipulación correcta de la muestra. En el laboratorio rotular correctamente el envase. Dejar reposar 45 min desde su obtención en el laboratorio. El médico debe dar información de su patología solo al paciente. BIBLIOGRAFIA NAVASA Carmen, GARCÍA José. “Fundamentos y Técnicas de Análisis Bioquímico”. Edit.Thompson. Segunda Ed. España.2002. URIBE Juan, FERES Silva.”Fundamentos de Cirugía Urología” .Edit. CIM. Tercera Ed. Colombia 2006. KOLMER John.”Métodos de Laboratorio Clínico” Edit. Interamericana. S.A. Segunda Ed. México 1948. M Ángel Gilberto, R Mauricio Ángel.” Interpretación Clínica de Laboratorio” Edit. México Internacional L.T.D.A. Séptima Ed. BogotáColombia 2006 GUYTON.“Anatomía y Fisiología de Guyton”. Edit. Interamericana S.A. Tercera Ed. Colombia 1991 SMITH.”Urología General de Smith”. Edit. El Manual Moderno S.A de C.V. Decima Ed. México DF-Santa Fe de Bogotá 1993 http://salud.kioskea.net/faq. http://www.infodoctor.org. http://www.scribd.com/doc http://www.cib.org.co CAPITULO I ANATOMÍA Y FISIOLOGÍA DEL LÍQUIDO SEMINAL El esperma es el líquido expulsado por el hombre durante la eyaculación. Ese líquido se compone de un 10% de células reproductoras, los espermatozoides, fabricado por los testículos y el 90% es un líquido seminal que viene de las glándulas anexas, próstata y vesícula seminal. Contiene entre 200 y 500 millones de espermatozoides. El volumen del eyaculado (esperma expulsado) es de unos 4 mililitros. Ese volumen es diferente para cada hombre y depende de la frecuencia de las eyaculaciones. Cuanto más frecuentes son las eyaculaciones, menos importante es el volumen. Después de la eyaculación el esperma tiene un olor característico en relación con la espermina componente volátil odorante .El color del esperma es lechoso, amarillenta; coagula en pocos minutos; se vuelve un líquido viscoso que pega. El esperma contiene, además de los espermatozoides, tres componentes principales que le dan su color y su gusto: la carnitina, el zinc y la fructosa. En términos generales las concentraciones iónicas son similares. Posee una gran concentración de zinc, procedente de la secreción prostática, que disminuye en las prostatitis junto a un aumento del número de leucocitos. Es muy rico en fructosa y apenas contiene glucosa .La fructosa procede de la secreción de las vesículas seminales y de las ampollas de los conductos deferentes. Se sintetiza a partir de la glucosa, por lo que su concentración puede estar elevada en diabéticos .Constituye la principal fuente de energía para los espermatozoides. Es rico en ácido cítrico de origen prostático y aminoácidos libres. La carnitina (derivado de la lisina), de origen epididimal, participa en la maduración y GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 1 adquisición de la movilidad de los espermatozoides. Un derivado de la espemina (una poli amina) es el responsable del olor espermático. La concentración menor, y la proporción de las proteínas son, también, muy distintas a las de suero. En la hipertrofia prostática aumenta el contenido de alfaglobulinas. Las gamma - globulinas aumentan en la prostatitis. Entre las enzimas destacan la fosfatasa ácida, una hidrolasa prostática, que aumenta su concentración, en el suero, esperma y en el cáncer de próstata. Finalmente, contiene prostaglandinas, que al contrario de lo que sugiere su nombre proceden de la secreción de las vesículas seminales. El pH, determinado principalmente por la secreción de las vesículas seminales protege a los espermatozoides, neutralizando el pH ácido de las secreciones prostáticas, así como del aparato genital femenino. Hay unos 20 millones de espermatozoides por mililitro de esperma. Es de notar que lo importante no es la cantidad de esperma sino la cualidad. El término cualidad se refiere a la movilidad y a la morfología de los espermatozoides. Funciones sexuales masculinas Eyaculación: Proceso mediante el cual se expulsa el semen a través del pene. No es igual al orgasmo. Esto obliga a que sus diversas secreciones desciendan por los conductos eyaculatorios y la uretra prostática. Los esfínteres internos y externos de la uretra cierran y atrapan el flujo seminal en el bulbo de la uretra. Fase de expulsión: El semen reunido se expulsa fuera del pene por contracciones fuertes y rítmicas de los músculos que rodean el bulbo de la uretra y la raíz del pene. El esfínter externo de la uretra se relaja, lo que permite que el flujo pase, mientras que el esfínter interno permanece contraído para evitar la salida de la orina. Eyaculación retrograda: Se expulsa semen hacia la vejiga y no al exterior del cuerpo por el pene. Funcionamiento invertido de los dos esfínteres (interno se relaja/ externo se contrae) .El flujo seminal posteriormente se elimina con la orina GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 2 Emisión nocturna: orgasmo sin estimulación genital directa. Sueños húmedos. http: www.google.com.ec 1.1. BASES ANATOMOFISIOLOGICAS El estudio del líquido seminal constituye el primer paso para el estudio de la fertilidad masculina. Debido a que es un análisis simple, se solicita a menudo en los estudios de infertilidad de una pareja, en estudios medico legales y para la investigación de la eficacia de una vasectomía. El semen es una solución compleja, compuesta básicamente por espermatozoides suspendidos en un líquido llamado plasma seminal, cuya misión es proporcionar un medio nutritivo de osmolalidad y volumen adecuado para llevar los espermatozoides hacia el moco cervical. Es una mezcla de secreciones producidas por los testículos y las diferentes glándulas del aparato reproductor masculino: vesículas seminales, próstata, epidídimos, conductos deferentes, glándulas bulbo uretrales (cowper) y glándulas uretrales (littré). GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 3 http:// www.google.com.es 1.2. ESPERMATOGÉNESIS La Espermatogénesis se lleva a cabo bajo influencias hormonales. La LH, secretada por la hipófisis, estimula a las células de Leydig induciendo la síntesis de testosterona. La testosterona se distribuye en todos los tejidos del cuerpo, se convierte en dehidrotestosterona y es la encargada de desarrollar las características sexuales secundarias. Las células de Sertoli tiene receptores para FSH, cuando reciben este estímulo convierten parte de la testosterona en estrógenos. La inhibina, producida por las células de Sertoli, actúa como regulador negativo de la secreción de FSH. Es el proceso mediante el cual se desarrollan los gametos masculinos. Inicia en la adolescencia y se lleva a cabo en los túbulos seminíferos. Las células en los túbulos seminíferos se disponen alrededor del lúmen, las espermatogonias se encuentran en la base del epitelio y proliferan por mitosis. Existen dos tipos de espermatogonias; tipo A y B. Las espermatogonias tipo A se encargan de dividirse y dan origen a espermatogonias tipo B que son las que van a diferenciarse en espermatozoides. Las descendientes de las espermatogonias tipo B son las que entran a la primera diversión meiótica duplicando su material genético y son los espermatocitos primarios; siendo su material genético 2n4c. Cuando se completa la primera división meiótica el resultado son dos espermatocitos secundarios cuyo complemento cromosómico es 1n2c. Por cada espermatocito secundario que entra a meiosis II se obtienen dos espermatides, que madurarán para formar espermatozoides. GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 4 Las células de Sertoli se encuentran también en los túbulos seminíferos y se encargan de dar sostén y nutrir a los gametos en diferenciación, de igual manera forman la barrera hematotesticular, necesaria para proveer un sitio de inmunoprivilegio para los gametos. Desde los espermatocitos primarios hasta los espermatozoides en el proceso de diferenciación se hacen acreedores de proteínas antigénicas diferentes a las del resto de las células corporales, por lo que necesitan estar en un lugar fuera del alcance del sistema inmunológico para no ser víctimas del mismo. La maduración de los espermatides en espermatozoides es un asunto denominado espermiogénesis. Los eventos más importantes de éste proceso serán nombrados a continuación: 1. Reducción del tamaño nuclear. 2. Condensación del material genético por la sustitución de las histonas por protaminas. 3. Formación de la vesícula acrosómica a partir del aparato de golgi. 4. Crece un flagelo a partir de la región centriolar. 5. Las mitocondrias se acomodan en la parte proximal del flagelo. 6. El citoplasma se reduce y se separa formando el cuerpo residual. El tiempo total de duración del proceso de espermatogénesis y espermiogénesis es de 64 días. La maduración bioquímica se lleva a cabo en el epidídimo y posteriormente cuando los espermatozoides entran en contacto con el líquido seminal y el prostático. El porcentaje de espermatozoides anómalos maduros es del 10% y si se eleva por encima del 20% es probable que exista repercusión en la fertilidad del individuo. Espermatogénesis Túbulos seminíferos con espermatozoides maduros http://tarwi.lanolina.edu.pe. GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 5 1.2.1. Espermatogonio Es una célula de gran tamaño (15-20 micras) con un núcleo central grande, nucléolo altamente diferenciado y citoplasma ligeramente basófilo. Esta célula sufre un proceso de división obteniéndose dos espermatogonios de tamaño ligeramente inferior (12-18 micras) con una cromatina nuclear característica de aspecto trabeculado y nucléolo visible o no. Cada espermatogonio sufre 4 divisiones mitóticas dando lugar a 16 células hijas diploides que son células aun grandes con núcleo arriñonado, frecuentemente excéntrico y en contacto con la membrana citoplasmática. Estas células entran en meiosis llamándose entonces espermatocitos primarios. En este momento, cada cromosoma está formado por dos cromátides hermanas resultantes de la replicación del ADN. Los cromosomas homólogos se reconocen y yuxtaponen formando unas estructuras llamadas tétradas. Al final de la meiosis la dotación cromosómica se ha reducido de tetraploide a diploide y segrega una nueva célula llamada espermatocito secundario. http://images.es.ask.com GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 6 1.2.2. Espermatocitos secundarios Son células pequeñas (8-12 micras), con núcleo centrado sin nucléolo y relación N/C aproximadamente igual a uno. Sufren una rápida meiosis y dan lugar a los espermatides. http: tarwi.images.edu GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 7 1.2.3. Espermatides Estas células más pequeñas (aproximadamente la mitad de las anteriores) redondas, con núcleo concéntrico oscuro, sin núcleo y con un citoplasma marcadamente acidófilo. Durante la asegunda mitad del ciclo espermatogénico sufren una reestructuración considerable y forman los espermatozoides maduros: El núcleo se hace excéntrico, disminuye de tamaño y la cromatina se condensa. El contenido citoplasmático se redistribuye y elimina, en su mayor parte, como cuerpos residuales. Aparición de un flagelo en el extremo opuesto al núcleo. Cuando estos cambios se completan queda constituido el espermatozoide maduro que es una célula móvil de 60 a 70 micras de longitud con tres proporciones claramente diferenciadas: Cabeza de forma oval o piriforme compuesta por la cromatina condensada y el acrosoma que contiene enzimas proteolíticas. En la cabeza se encuentra el núcleo, que contiene 23 cromosomas, es decir la mitad de la dotación cromosómica completa de una célula normal, con un citoplasma y una membrana citoplasmática muy delgada a su alrededor. Sobre el exterior de los 2/3 anteriores de la cabeza se encuentra un capuchón grueso, el acrosoma, que contiene numerosas enzimas que ayudan al espermatozoide a penetrar en el ovocito secundario y así conseguir la fecundación. Segmento intermedio o cuello, alargado y situado inmediatamente después de la cabeza contiene capas de mitocondrias que suministran energía al espermatozoide. Cola, con diámetro en disminución progresiva hasta el final y una longitud de 45-55 micras. La cola es móvil con una gran cantidad de mitocondrias en la parte proximal, y la parte restante es, en realidad, un largo flagelo que contiene microtúbulos con una estructura similar a la de los cilios, que sirven para que el espermatozoide pueda avanzar, lo que realiza por medio de un movimiento flagelar de la cola a una velocidad de 1-4 mm/min. Una vez producida la eyaculación, la mayoría de espermatozoides no sobreviven más de 48 horas dentro del sistema reproductor femenino. GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 8 http://www.google.com.ec 1.3. FORMACIÓN DEL LÍQUIDO SEMINAL En los testículos se producen espermatozoides y hormonas sexuales masculinas. Desde estos órganos, los espermatozoides pasan al epidídimo donde maduran unas tres semanas y son almacenados hasta que son eyaculados o reabsorbidos por el organismo. Si se va a producir eyaculación, los espermatozoides son impulsados por un largo conducto, el conducto deferente, añadiéndose a ellos el fluido producido por las vesículas seminales y la próstata para formar el semen que sale al exterior a través de la uretra. Las secreciones son emitidas en el siguiente orden: 1.- Fracción pre-eyaculatoria (10 – 15 %): Secreción clara de las glándulas uretrales y bulbo uretrales. Su función es hacer más resbaladizo el canal uretral para facilitar el vaciado de las siguientes fracciones. 2.-Fracción previa (20%): secreción prostática. Contiene acido cítrico y enzimas proteolíticas como la fosfatasa ácida. 3.-Fracción principal (5-10 %): Secreción testículo-epidídimo-deferencial. Contiene los espermatozoides. 4.-Fraccion final (50.60%): Secreción coloide de las vesículas seminales .Son la fuente de fructosa del semen que constituye el principal nutriente de los espermatozoides. Debido a que las diversas fracciones presentan una gran disparidad en cuanto a su calidad, el líquido seminal fresco tiene una composición poco uniforme. GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 9 Presenta a una consistencia parcialmente hebrosa y/o gelatinosa, y solo después de licuado y mezclado, puede ser apto para las determinaciones de los componentes celulares o químicos. http://monografias.com 1.3.1. Testículos Los testículos son los órganos sexuales (gónadas) esenciales en el hombre, que sirven para producir los gametos masculinos (espermatozoides) y la hormona sexual masculina, testosterona. Las estructuras reproductivas accesorias masculinas ayudan en la maduración, nutrición y transporte del espermatozoide a lo largo del aparato reproductor del hombre y al interior del cuerpo de la mujer, para la fertilización. http://www.google.com.images. GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 10 1.3.2. Los testículos y el escroto. La función de los testículos es producir espermatozoides y la hormona sexual masculina, la testosterona. Para producir y nutrir los espermatozoides, la temperatura dentro de los testículos debe permanecer aproximadamente 1°C por debajo de la temperatura corporal normal. Parte de la función del escroto es mantener esta temperatura óptima, manteniendo a los testículos más lejos del cuerpo durante el clima caluroso o contrayéndose y llevándolos más cerca del cuerpo durante el clima frío. Los testículos también contienen las células intersticiales de Leydig y las células de Sertoli. Las células de Leydig producen testosterona. Las células de Sertoli nutren al espermatozoide inmaduro dándoles un soporte mecánico y protegiéndolos hasta que puedan llegar a la madurez y sean liberados en los túbulos. Las células de Sertoli también juegan un papel activo en la liberación de los espermatozoides maduros en los túbulos. http:www.google.com.images. 1.3.3 Epidídimo Cada epidídimo tiene un cuerpo que consiste en el conducto del epidídimo que está muy contorneado y en donde los espermatozoides son almacenados para pasar las etapas finales de su maduración, y una cola o cola del epidídimo que se continúa con el conducto deferente que transporta el esperma hacia el conducto eyaculador para su expulsión hacia la uretra. El epidídimo ayuda a expulsar los espermatozoides hacia el conducto deferente durante la excitación sexual por medio de contracciones peristálticas del músculo liso de su pared. Los espermatozoides pueden permanecer almacenados y viables en el epidídimo durante meses. GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 11 http:www.google.com.images. 1.3.4 Vasos deferentes Forma el conducto eyaculatorio. Además de funcionar como parte del sistema de transporte de los espermatozoides, actúa también como sitio de almacenamiento para la mayoría de los espermatozoides producidos hasta la eyaculación. Todo el proceso de maduración del espermatozoide, desde sus comienzos primitivos en los túbulos seminíferos hasta su forma totalmente madura en los vasos deferentes, lleva alrededor de 74 días. http:www.google.com.images. 1.3.5 Vesículas seminales Su principal finalidad es aportar una secreción viscosa, alcalina, que forma parte del líquido seminal. El líquido seminal es también conocido como semen e incluye secreciones de las vesículas seminales, próstata y glándulas bulbo uretrales, así como células espermáticas. Las vesículas seminales aportan alrededor de 30% GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 12 del volumen del líquido seminal. El líquido de las vesículas seminales es rico en nutrientes, incluyendo ácido cítrico y aminoácidos y fructosa para suministrar una fuente de energía para el metabolismo del espermatozoide y para aumentar la motilidad de los espermatozoides. http://lomalindahealth.org 1.3.6 Glándula prostática La próstata contribuye con alrededor de 60% del líquido seminal, secretando un líquido poco espeso, alcalino, blanco lechoso similar al de las vesículas seminales. El líquido es eliminado hacia la uretra durante la eyaculación para ayudar a neutralizar los líquidos ácidos en la uretra masculina y la vagina femenina. Esta función es importante porque los ácidos pueden tener un efecto adverso sobre los espermatozoides y, a concentraciones más altas, los puede matar. http://images.es.ask.com GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 13 1.3.7 Conductos eyaculatorios Están formados por la unión de los vasos deferentes y los conductos de las vesículas seminales. http://images.es.ask.com. 1.3.8 La uretra Forma el sector final del pasaje del líquido seminal. La uretra funciona como el punto de salida para el semen y la orina. Al cerrarse los esfínteres musculares automáticamente, bloquean el flujo de un proceso cuando está desarrollándose el otro. http://lomalindahealth.org GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 14 1.3.9 Glándulas bulbo uretrales También secretan un líquido alcalino, si bien constituye menos de 5% del volumen del líquido seminal. http://images.google.com 1.3.10 El pene El pene es el órgano masculino a través del cual pasan los espermatozoides y la orina desde el cuerpo. En el proceso de la eyaculación, el pene transporta los espermatozoides contenidos en el líquido seminal hasta el cuerpo de la mujer para la fertilización del óvulo. http://images.google.com GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 15 GUYTON.”Anatomía y Fisiología de Guyton”. Pág. 409-435 Página 16 CAPITULO II EXAMEN FÍSICO 0 MACROSCÓPICO DEL LÍQUIDO SEMINAL El examen del semen debe realizarse en determinadas condiciones lo mas estandarizado posible. Se recomienda un período de cuatro días de abstinencia sexual antes de la obtención de la muestra ya que la cantidad, la composición química y celular del eyaculado dependen de dicho periodo.El recipiente en el que se recoja debe ser de boca ancha y estéril, preferentemente graduado.Se suelen utilizar frascos de polipropileno neutro diseñados para la recogida de orina.Previamente a la recogida se debe realizar un lavado minucioso del meato urinario y del glande. El método de elección para la recogida es la masturbación, puesto que permite que la muestra sea completa y sin contaminación. No deben aceptarse las muestras recogidas en preservativos ya que contienen sustancias espermicidas que alterarían el resultado. Es deseable que se recoja en una zona próxima al laboratorio, con el recipiente precalentado a la temperatura corporal ya que el análisis debe realizarse en un plazo de 2 horas máxima después de eyacular. Si se recoge la muestra fuera del laboratorio esta debe llegar al mismo en un plazo máximo de una hora. El estudio comprende: Examen macroscópico y de características físicas del semen. Examen citológico. Análisis bioquímico de los componentes del plasma seminal. Estudio macroscópico: 2.1 Aspecto:El semen recién emitido es denso, viscoso, opaco y blanquecino. El color amarillento indica piospermia por infecciones y el color rojizo hemospermia por procesos varicosos o traumáticos. 2.2 Volumen: El volumen normal de la muestra tras un período de continencia de 3 a 5 días es de 2 a 6 ml, siendo el volumen medio 3.5 ml. Volumen superior a 10 ml se denomina polisemia y es patológico, ya que los espermatozoides van muy diluidos y llegan en poca concentración al moco cervical. KOLMER John.”Métodos de Laboratorio Clínico” .Pág. 277-290 Página 16 Un volumen inferior a 1 ml se denomina oligocemia y también es completamente patológico. La ausencia total de eyaculado, que se denomina aspermia, se observa con más frecuencia en pacientes con eyaculación retrógrada o con hipogonadismo severo. La medida del volumen se realiza colocando la muestra en un tubo de centrífuga graduado y leyendo directamente el volumen ocupado por la misma. 2.3 Tiempo de licuación: El líquido seminal coagula tras su emisión y en circunstancias normales deben licuarse totalmente a los 15 minutos tanto “en vitro” como “en vivo”. Un semen ya excretado en forma líquida floculada indica posible inflamación prostática o de vesículas seminales. Un tiempo de licuación superior a 4 horas supone un obstáculo para la fecundación. 2.4 Color: El color normal es blanquecino opalescente. Puede presentar variaciones de color con tonalidades amarillentas más o menos acusadas que pueden relacionarse con procesos supurativos (piospermia) o bien ser debidas a una prolongada abstinencia sexual .El color rosado o rojizo indica presencia de sangre. 2.5 pH: El líquido seminal se compone de la secreción alcalina de las vesículas seminales y de la secreción ácida prostática. Normalmente tiene un pH alcalino oscilando entre 7,2 – 7,8, aunque se consideran variaciones fisiológicas límites comprendidas entre 7,5 y 8,1. Si hay inflamación de la glándula sexual (prostatitis, vesiculitis, epididimitis), el pH es superior a 8. Una obstrucción en el conducto eyaculador y en las patologías crónicas el pH puede ser ácido. El pH se determina fácilmente con una tira reactiva y debe hacerse relativamente pronto por qué se va alcalinizando con el tiempo debido a la actuación de la anhidrasa carbónica de los espermatozoides sobre el bicarbonato y los grupos carboxilos, así como hidrólisis proteica con liberación de amoniaco. No se requiere una valoración con p H-metro, simplemente se realiza con papel indicador. KOLMER John.”Métodos de Laboratorio Clínico” .Pág. 277-290 Página 17 2.6 Viscosidad:La disminución de la viscosidad se manifiesta generalmente por ausencia de la coagulación espontánea del líquido seminal.Esta anormalidad, de gran importancia clínica, se produce en casos de muestras con acusada disminución del número de espermatozoides o con ausencia de los mismos. En casos de incrementos importantes de la viscosidad puede producirse la anulación total de la progresión espermática en el moco cervical. La determinación se realiza, de forma rutinaria, observando el deslizamiento del semen desde la punta de una pipeta Pasteur, de forma que si su viscosidad es normal, caerá gota a gota. También puede apreciarse dispensando lentamente la muestra contenida en una jeringuilla con aguja de 0,8mm. Si se determina con viscosímetro, los valores normales oscilan entre 5 y 8, con un valor fisiológico medio de 6,5. Hay que tener en cuenta que este es un valor relativo que corresponde al número de veces que la muestra a estudiar es más viscosa que el agua. 2.7 Filancia: El líquido seminal ya licuado forma un filamento de hasta un centímetro de longitud al introducir en su seno una varilla fina o un asa de platino y retirarlas suavemente.Si el filamento formado es mayor se trata de un semen no licuado y de viscosidad aumentada. Valores normales: EXAMEN MACROSCÓPICO RANGO NORMAL Volumen 2-8 ml(valor medio= 4 ml) Color Blanquecino Viscosidad Normal (gota a gota) Ph 7-8,1( normalmente de 7,3 a 7,8) Filancia Filancia menor o igual a 1 cm Tiempo de licuación 15 min tras emisión KOLMER John.”Métodos de Laboratorio Clínico” .Pág. 277-290 Página 18 CAPITULO III EXAMEN MICROSCÓPICO DEL LÍQUIDO SEMINAL El primer paso del examen microscópico consiste en la observación directa, en fresco, de una gota del líquido seminal homogeneizado entre porta y cubre objetos. Este es un estudio rápido que orientara los posteriores exámenes microscópicos. Se observa la presencia o ausencia de espermatozoides y células espermáticas, su concentración aproximada, movilidad, formas anormales que pudiera haber y la aglutinación de los mismos. Otros aspectos a destacar son la presencia de cristales de fosfato de espermina en forma de aguja debido a la reacción de la espermina prostática con el ácido fosfórico formado por la degradación enzimática de la muestra, la espermiofagia (fagocitosis de los espermatozoides por leucocitos) y la presencia de leucocitos, hematíes, etc. Consiste en el estudio de las características de los espermatozoides comprende los siguientes exámenes. a) Recuento. b) Motilidad. c) Índice de vitalidad: d) Estudio morfológico (formula espermática). Estos son los estudios de rutina de una muestra de semen. Sin embargo para el control de vasectomía se determinan únicamente 2 parámetros el recuento y la movilidad espermática. NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 19 http://www.urologie-tivoli.com 3.1 RECUENTO El cálculo del número de espermatozoides en la muestra seminal puede realizarse de forma automática o manualmente. 3.1.1 El método automático: Es similar al de células sanguíneas. Después de la licuefacción del semen; los espermatozoides pueden contarse en un hemocitómetro tras la dilución inicial de la muestra. Como líquido de dilución puede utilizarse la solución diluyente de Macomber y Saunders de formol de bicarbonato. La composición es la siguiente: Bicarbonato sódico Formol al 40 % Agua destilada c.s.p 5g 1 ml 100 ml NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 20 http://www.urologie-tivole.com. 3.1.2 El recuento manual: Se realiza en cámara. 1. Lo primero que debe hacerse es la homogenización minuciosa de la muestra, agitando con una varilla de vidrio hasta obtener una gota pendiente en el extremo de la misma. 2. Dilución de la muestra con una pipeta de Thomas de glóbulos blancos hasta la señal 0,5 y el líquido diluyente hasta la señal 11. Con ello se obtienen una dilución 1/20. 3. Se homogeniza la muestra agitando intensamente la pipeta sujeta por ambos extremos con movimientos horizontales y de rotación haciendo girar la bolita de su interior. 4. Llenamos la cámara de recuento de Neubauer. Se desecha las 3 ó 4 primeras gotas, y se llena la cámara dejando reposar 2 minutos en una cámara húmeda para que sedimente los espermatozoides. (La cámara húmeda puede ser una placa Petri con torunda de algodón o papel de filtro, humedecidos con agua.) NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 21 5. Se coloca la cámara en la platina del microscopio y con el objetivo 10x se comprueba que la distribución que es homogénea y que no hay aglutinación de espermatozoides. Estos se cuentan en 2 mm² cuadrados (dos cuadros grandes de las esquinas de 1mm por 1mm o cuadrados de leucocitos.) 3.1.3 Cálculo El resultado del recuentodebe expresarse como número de espermatozoides/ml. Nº espermatozoide/ml = N.Cx 5 x 20 x 1000= N.C x100.000 http://www.urologie-tivole.com. NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 22 3.1.4 Interpretación clínica En condiciones normales el número de espermatozoides/ml de semen oscila entre 50 y 100 millones algunos se consideran normales hasta 120 millones, ya que se observa fertilidad en hombres con valores inferiores a 50 millones/ml de espermatozoides. Hay que tener en cuenta que el criterio de fecundidad probable puede derivarse del conjunto de datos del examen global del semen y que el número de espermatozoides es un factor más a valorar junto con la motilidad y el porcentaje de formas normales fundamentalmente. El semen en función del número de los espermatozoides se clasifica de la siguiente forma: CLASIFICACION DEL SEMEN EN FUNCION DEL NUMERO DE ESPERMATOZOIDES HIPERESPERMIA 120-400 millones /ml NORMOSPERMIA 50 -120 millones /ml HIPOSPERMIA 30-50 millones/ml OLIGOSPERMIA 1-30 millones /ml Ausencia de espermatozoides maduros. Presencia de células de espermiogénesis AZOOSPERMIA ASPERMIA Ausencia de espermatozoides. Ausencia de células precursoras NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 23 3.2 ESTUDIO DE LA MOTILIDAD El estudio de la motilidad de los espermatozoides es un parámetro muy importante en el espermiograma. Es necesario que los espermatozoides tengan una motilidad activa para que atraviesen el moco cervical y lleguen hasta el óvulo. Esta motilidad va a depender de factores extrínsecos (composición del medio en el que se encuentra el espermatozoide) e intrínsecos (estructura y función del flagelo). La movilidad puede medirse mediante observación directa o con analizadores de imágenes, obteniéndose, en este caso, medidas objetivas de la motilidad. Para la correcta evaluación de la movilidad, el espermograma debe haber sido hecho en las primeras 2 h de haberse producido el eyaculado, a un mayor intervalo de tiempo desde la eyaculación se hallará un menor porcentaje de espermatozoides móviles. En años recientes se han desarrollado nuevas técnicas que permiten medir objetivamente y con medios computadorizados las características del movimiento de los espermatozoides, pero los equipos no están disponibles en muchos centros, pues son costosos. Por esta razón, la OMS recomienda un sistema simple de medir la movilidad espermática sin necesidad de equipos complejos, para esto la movilidad se divide en 4 categorías, a saber: a) movilidad progresiva rápida, b) movilidad progresiva lenta, lineal o no, c) movilidad no progresiva y, d) inmovilidad (espermatozoides inmóviles). Se considera normal cuando el 50 % de los espermatozoides o más presentan una movilidad progresiva rápida (categoría a). La disminución de la movilidad se denomina astenozoospermia, puede ser un hallazgo aislado en el espermograma o acompañarse de alteraciones en la concentración y morfología normal de los espermatozoides (que es lo más común), en este último caso indica un daño global de la espermatogénesis. La disminución de la movilidad espermática tiene múltiples causas que no son posibles diagnosticar por el simple análisis seminal y en la mayoría de los casos tampoco es posible establecer un pronóstico por este examen. Una excepción a lo dicho anteriormente es el hallazgo de una movilidad menor del 5 % o incluso nula por completo, asociada a densidad, morfología y viabilidad espermática normal o muy cercanas a lo normal, en este caso es muy probable se trate de un síndrome de cilias inmóviles, trastorno de causa genética que es irreversible y que por tanto hasta el presente los pacientes son definitivamente estériles; el diagnóstico de certeza se realiza por medio de la microscopia electrónica. Se considera que es menos probable que un hombre sea fértil si tiene menos del 40 % de espermatozoides con movimiento lineal progresivo, pero no existe una relación directa entre el porcentaje de espermatozoides móviles y la fertilidad potencial de un individuo. NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 24 En ocasiones, al analizar el semen por el microscopio, se observan espermatozoides aglutinados, estas aglutinaciones pueden ser cabeza-cabeza, cola-cola, pieza intermedia-pieza intermedia o cualquier otra combinación. La aglutinación puede ser un fenómeno normal siempre que no afecte a más del 10 % de los espermatozoides del eyaculado. Cifras mayores pueden deberse a trastornos inmunológicos o a infecciones. Es importante conocer que la aglutinación puede interferir la medición de la movilidad y si tenemos una muestra de semen donde se informa aglutinación y movilidad disminuida es necesario repetir el examen antes de hacer conclusiones. http://blogspot.com 3.2.1 Técnicas de la observación directa Para el recuento de los espermatozoides móviles se realiza un montaje húmedo (una gota de semen líquido o licuado entre porta y cubre) con el portaobjeto precalentado a 37º y se observa microscópicamente. Es conveniente untar los bordes del cubre objetos con vaselina para evitar la desecación. La motilidad se valora observando varios campos con el objetivo de 40x, contando por lo menos 200 espermatozoides por campo. Hay que tener precaución de enfocar el fondo del campo microscópico, ya que allí puede encontrarse formas inmóviles que podrían pasar desapercibidas. NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 25 3.2.2 Informe Se registra el porcentaje total de espermatozoides que presentan movilidad y el porcentaje de inmóviles. También puede hacerse un estudio cualitativo de la motilidad clasificando los espermatozoides móviles según presenten movilidad activa (avanzan) o pasiva (se mueven pero no avanzan).En este caso, la OMS recomienda emplear la siguiente terminología. Movimiento rápido y rectilíneo Movimiento progresivo pero menor o no rectilíneo Movimiento sin progresión Inmóviles categoría a. categoría b. categoría c categoría d. 3.2.3 Interpretación clínica NORMAL 60-90 % movilidad ASTENOSPERMIA NECROSPERMIA Menos del 50% de formas móviles a las 2 horas Todas las formas carecen de motilidad NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 26 http://www.urologie-tivole.com 3.3 ÍNDICE DE VITALIDAD Consiste en un estudio de la necrospermia. Los espermatozoides muertos sufren una modificación de la permeabilidad de su membrana a la eosina y, en presencia de este colorante, la cabeza se colorea en rosa mientras que las cabezas de las formas vivas quedan incoloras. Es un estudio complementario de la motilidad, ya que distingue dentro del grupo de formas inmóviles, las vivas de las muertas. Permite verificar la exactitud de la evaluación de la motilidad (% teñidos no debe ser superior a % inmóviles). Cuando en un espermograma se comprueba astenozoospermia es necesario medir la viabilidad o porcentaje de espermatozoides vivos; esto permite precisar si la baja movilidad se debe en realidad a que existe un gran número de espermatozoides muertos, lo que habitualmente tiene un peor pronóstico. En 1986, la OMS daba como valor normal el hallazgo de 60 % o más de espermatozoides vivos, en la segunda edición del Manual de laboratorio de la OMS para el examen del semen humano, se daba como valor normal 50 % o más de espermatozoides vivos, mientras que en la tercera edición de este Manual la cifra normal se considera 75 % o más. En nuestro laboratorio la cifra normal, basada en un estudio de hombres sanos, es de 50 %. Estas diferencias demuestran la importancia de que cada laboratorio establezca sus valores normales. NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 27 El hallazgo en un espermograma de una disminución de la movilidad espermática con un porcentaje normal de espermatozoides vivos sugiere la existencia de anomalías estructurales de la cola de los espermatozoides, cuyo diagnóstico de certeza sólo puede hacerse por microscopia electrónica; estas anomalías, entre las que se incluye el síndrome de cilias inmóviles mencionado anteriormente, tienen muy mal pronóstico. Si la concentración y la morfología de los espermatozoides es normal y el porcentaje de espermatozoides muertos es mayor de lo normal el trastorno se ha denominado necrozoospermia. Este hallazgo se consideró muy raro, de pésimo pronóstico y de etiología desconocida. En la actualidad, la mayoría de los investigadores dudan de su existencia y lo atribuyen a defectos en la técnica de tinción, incluso en la última edición del Manual de la OMS no se incluye este término. En el laboratorio de nuestro Instituto nunca hemos encontrado un caso en más de 30 años de trabajo. http://www.urologie-tivole.com 3.3.1 Técnica. Se utilizan dos colorantes, uno tiñe a los espermatozoides y el otro sirve de contraste tiñendo el fondo: Eosina al 0,5% en suero fisiológico. Nigrosina al 1 % en suero fisiológico. Se puede realizar de dos formas diferentes, coloración en fresco o bien en frotis teñido. a) Montaje húmedo para lectura rápida en fresco. Se mezcla en un portaobjetos una gota de líquido seminal y una gota de la solución de eosina durante 20 segundos. NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 28 Se añade una gota de solución de Nigrosina y se homogeniza. Colocar un cubreobjetos y se observa rápidamente para evitar la desecación. b) Frotis para observar con el objeto de inmersión. Se mezcla en un extremo del portaobjetos una gota de líquido seminal y una gota de eosina durante 20 segundos. Se añade una gota de solución de Nigrosina y se homogeniza. Se extiende la muestra con ayuda de un extensor haciendo un frotis fino. Dejar secar y se observa con objetivo de inmersión. En ambos casos se observan varios campos microscópicos contando el número de espermatozoides teñidos y los que quedan sin teñir, obteniéndose los porcentajes correspondientes. 3.3.2 Informe Los resultados se expresan como porcentajes de espermatozoides teñidos y además se indica el índice de vitalidad que es la inversa del número de espermatozoides teñidos. Si estos son el 40% el índice de vitalidad es el 60%. 3.3.3 Interpretación clínica Se considera normal una coloración con eosina de menos del 40%.Si el porcentaje es mayor, puede indicar infertilidad. NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 29 3.4 ESTUDIO MORFOLÓGICO. El conocimiento de las características morfológicas de los espermatozoides es fundamental para valorar el potencial fecundativo de una muestra, junto con el número total de espermios y su motricidad. La morfología del espermatozoide se valora mediante recuentos diferenciales de los tipos de espermatozoides morfológicamente normales y anormales en extensiones teñidas. También se observan las células de espermiogénesis que pueden aparecer. En el proceso de formación de los espermatozoides en los tubos seminíferos pueden producirse divisiones anormales del espermatocito secundario con el resultado de la aparición de espermátidas que no evolucionaran hacia espermatozoides normales. Los efectos teratógenos pueden deberse a causas genéticas, agentes citostáticos químicos (fármacos) o físicos (radiaciones), alcoholismo, tabaquismo, enfermedades infecciosas, etc. Las principales alteraciones se reflejan el cuadro siguiente. El criterio de nivel normal de la morfología espermática ha variado a través del tiempo. Los estudios clásicos de la era moderna consideran como normal el hallazgo del 50 % o más de espermatozoides de morfología normal, cifra que utilizamos en nuestro laboratorio y que era la recomendada por la OMS. En fecha reciente se ha sugerido que cuando se utilizan criterios "estrictos" de normalidad, el límite debe ajustarse en un nivel inferior. Aunque no hay estudios clínicos que permitan hacer conclusiones definitivas, empíricamente muchos autores (incluyendo los expertos de la OMS) han recomendado tomar como valor de NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 30 referencia la cifra de 30 % o más de formas normales, y en fecha más reciente se ha sugerido que el límite normal es 14 %. El uso de los criterios estrictos, descriptos por Kruger, tiene el inconveniente de que es necesaria una tinción especial que no está disponible en todos los laboratorios. El aumento de formas anormales puede existir aisladamente y se denomina teratozoospermia, pero con más frecuencia se asocia a alteraciones de la concentración y movilidad de los espermatozoides. La relación de la morfología espermática con la fertilización es de difícil interpretación pues en un mismo eyaculado se presenta una gran variabilidad y en muchos espermatozoides anormales se observan múltiples defectos. No es frecuente que en un paciente dado se presente un defecto único en todos los espermatozoides o en la mayoría de ellos. Por estas razones, en la literatura no hay un acuerdo sobre si el resultado de la morfología debe expresarse en forma global (total de espermatozoides normales y anormales) o si es más conveniente especificar el porcentaje de ellos con anomalías de la cabeza, pieza intermedia y cola; incluso se ha sugerido que el número promedio de defectos por espermatozoide puede ser un predictor de su función. La teratozoospermia puede observarse en un gran número de trastornos, como el varicocele, la sepsis seminal, el estrés y la exposición a agentes externos nocivos, entre otros, por lo cual su presencia no es suficiente para establecer un diagnóstico causal. En cuanto a su valor pronóstico, también es muy difícil de establecer, aunque es necesario aclarar que en raras ocasiones se encuentran anomalías morfológicas que invariablemente den lugar a esterilidad, entre estas tenemos los espermatozoides de cabeza redonda, los de cabeza en forma de pera y los de cabeza en forma de cabeza de alfiler. Para comunicarle al paciente su mal pronóstico recomendamos que se haya comprobado que esta anomalía existe en más del 95 % de sus espermatozoides. 3.4.1 Técnica Extensión de la muestra: Se realiza una extensión de la muestra sobre un portaobjetos de forma similar a la de un frotis sanguíneo que tener en cuenta que si el recuento de espermatozoides es bajo, se hará una extensión más gruesa que asegure suficientes formas para el recuento. Fijación: Se cubre la extensión con alcohol, si fuera necesario con alcohol metílico durante 5 minutos, renovando el alcohol, si fuera necesario y se deja secar el aire o en estufa a 37°C. NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 31 Tinción: Puede emplearse diferentes técnicas de tinción: Hematoxilina eosina Papanicolau MayGrumwald-Giemsa Las dos primeras proporciones excelentes resultados para la apreciación morfológica detallada, sin embargo en el examen de rutinas es muy recomendable la tercera ya que es más sencilla y también permite una buena visualización estructural. Tinción de MayGrumwald-Giemsa Cubrir la preparación con solución MayGrumwald durante 4 minutos Diluir con la misma cantidad de gotas de agua de p H 7,2, durante 4 minutos. Decantar y lavar con agua destilada suavemente. Cubrir la extensión con una dilución de Giemsa diluido (3 gotas de colorante por ml de agua de p H 7,2) durante 12 minutos. Lavar. Dejar secar al aire. Se deben estudiar con el objetivo de inmersión al menos 200 espermatozoides. 3.4.2 Informe Se registran los porcentajes de espermatozoides normales y anormales, y dentro de estos últimos se especifica el tipo de anomalía encontrada y su NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 32 proporción (anomalías en cabeza, cuello y cola).También se informa de la presencia de células de espermiogénesis y teratógenos, células sanguíneas, de descamación y de cualquier otro tipo que se puedan observar. 3.4.3 Interpretación clínica El índice de mal formaciones debe ser inferior al 30%.En caso de valores netamente superiores (mayor del 40%), habla de teratospermia que es un signo de esterilidad definitiva y se considera que el liquido seminal es hipo fecundante cuando las alteraciones morfológicas oscilan entre un 30 y un 40%. Se acepta un pequeño porcentaje de células teratógenos (degeneradas, estados abortivos) y la presencia de escasas células de descamación (0- 0,5%) de origen uretral o prostático. Un incremento importante de las células de descamación puede indicar prostatitis o uretritis de distinta etiología. En cuanto a las células sanguíneas, se consideran normal la presencia de escasos leucocitos (1 o 2 por campo microscópico, con objetivo de 40x). Si hay abundantes leucocitos (piospermia) es, normalmente, consecuencia de un proceso infeccioso. La presencia de eritrocitos constituye siempre un hallazgo patológico que puede deberse a un proceso inflamatorio o infeccioso del conducto seminal deferente. NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 33 3.4.5 Valores normales EXAMEN MICROSCÓPICO RANGO NORMAL Número de espermatozoides Motilidad Vitalidad Espermatozoides normales Alteraciones de la cabeza Alteraciones del cuello Alteraciones de la cola Alteraciones mixtas Células espermiogénicas y teratógenos Leucocitos Mayor de 25 millones/ml Mayor de 60% Mayor de 60% Mas del 70% 18% 5% 5% 0 - 2% 1 – 3% 1 – 2/campo (menos 15%/campo). Ausencia 0 – 0,5% Eritrocitos Otras células del 3.5 OTRAS CÉLULAS EN EL SEMEN El semen eyaculado invariablemente contiene otras células además de los espermatozoides, entre ellas se incluyen células epiteliales de la uretra, células espermatogénicas inmaduras de distintos tipos y leucocitos. La concentración del total de células debe medirse y dar su resultado en porcentaje; se considera normal que el eyaculado no contenga más del 5 % de estas células. La presencia de células espermatogénicas inmaduras en el eyaculado es un signo de irritación del epitelio germinal y en ocasiones hemos observado este fenómeno si se producen eyaculaciones repetidas o después de un tratamiento de la oligozoospermia idiopática. Su presencia no es útil para establecer un diagnóstico causal ni para conocer el pronóstico. Las células de mayor importancia son los leucocitos; se considera que en un eyaculado normal debe haber menos de 1000 000/mL. La presencia de cantidades mayores de leucocitos se denomina leucocitospermia y no siempre se debe a procesos infecciosos, pero la ausencia de ellos tampoco nos asegura que no exista una sepsis de las vías seminales. No obstante, aunque la leucocitospermia no asegura el diagnóstico de infección sí se considera un signo de sospecha, que NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 34 en asociación con otros signos seminales y clínicos confirman dicho diagnóstico. Estos signos y síntomas son los siguientes: leucocitospermia repetida, dolor al eyacular, antecedentes de infección genitourinaria o de enfermedades de transmisión sexual, examen anormal de la próstata, epidídimos y vesículas seminales, análisis anormal del líquido prostático, alteraciones de las características físicas o bioquímicas del plasma seminal y análisis bacteriológico anormal. Seguimos los criterios de la OMS en cuanto a la combinación de 2 o más de estos signos para establecer el diagnóstico de sepsis de las vías seminales. La importancia de este diagnóstico radica en la posibilidad de su tratamiento inmediato con antibióticos específicos para así evitar secuelas a largo plazo. NAVASA Carmen. GARCÍA José.”Fundamentos y Técnicas de Análisis Bioquímico”. Pág. 275-285 Página 35 CAPITULO IV ESTUDIO BIOQUÍMICO DEL LÍQUIDO SEMINAL La exploración bioquímica del semen se basa en la dosificación de ciertos compuestos secretados por las vesículas seminales, próstata y por los epidídimos. También en el análisis de los componentes del espermatozoide (LDH, acrosina, adenosintrifosfato), aunque no se determinan en análisis de rutina. Marcadores bioquímicos y su localización en el aparato genital masculino. ÓRGANO Próstata Vesículas seminales Epidídimo PARÁMETRO BIOQUÍMICO Acido cítrico Fosfatasa alcalina Cinc Fructosa Carnitina 4.1 MARCADORES PROSTÁTICOS El acido cítrico y la fosfatasa acida tienen una reacción muy estrecha en el plasma seminal y son igualmente representativos del funcionalismo prostático, teniendo el mismo valor diagnostico. El laboratorio da, casi siempre, preferencia a la determinación del citrato ya que su realización es más sencilla y puede hacerse de forma más reproducible. El cinc es un parámetro representativo de la actividad bacteriana y en casos de inflamaciones crónicas es más frecuente encontrar su valor disminuido que el de otros parámetros. 4.1.1 Acido cítrico La próstata secreta un líquido alcalino que contiene ácido cítrico, calcio, fosfatasa ácida, una enzima coagulante y una profibrinolisina. Durante la eyaculación esta secreción se une a la masa del semen. El líquido prostático aumenta la motilidad y fertilidad de los espermatozoides. El citrato seminal bajo indica trastornos funcionales. El citrato seminal alto es fisiológico en hombres entre 30 y 40 años, con funcionalismo pronunciado de la actividad prostática. El citrato seminal muy alto indica insuficiencia de vesículas SMITH.”Urología General de Smith” .Pág. 697-721 Página 36 seminales. El citrato seminal máximo indica oclusión en la parte alta de la vía seminal. Tiene como función fisiológica el transporte del calcio. Un exceso del cítrico puede provocar la esclerosis del endotelio del tubo seminífero .Un defecto del mismo puede inducir un defecto de aporte cálcico regulador del metabolismo de las células germinativas con déficit de la motricidad de los espermatozoides maduros. En ambos casos, la consecuencia será una disminución del número de espermatozoides o su ausencia, dependiendo del grado de afectación. 4.1.2 Técnicas de determinación Se emplean técnicas colorimétricas (piridina y anhídrido acétio), y técnicas enzimáticas U.V, que consisten en desproteinizar la muestra con acido perclórico o, 33 N (1:10) y realizar la determinación del citrato en el líquido sobrenadante tras el centrifugado. La adición de los reactivos enzimáticos produce la siguiente reacción: Citrato citrato liasa Oxalaceato + NADH + H L- malato + NAD + H oxalaceato + acetato malato deshidrogenasa lactato-deshidrogenasa L-malato + NAD L-lactato + NAD Basándose en la absorbancia que presenta el NADH a 340 nm y no la forma oxidada NAD; puede determinarse espectrofotométricamente la diferencia de absorción antes y después de finalizada la reacción, obteniéndose el consumo o desaparición del NDAH que será proporcional a la concentración del citrato en la muestra. 4.1.3 Valores normales 250 – 800 mg/ dl. 4.2 MARCADORES DE LAS VESÍCULAS SEMINALES La glucosa que llega por la sangre hasta las vesículas seminales es convertida de fructosa y concentrada hasta cifras bastante altas por influencia de la testosterona. Se utiliza para el estudio de la función de las vesículas seminales para la testosterona. La técnica de determinación, emplea un método colorimétrico o métodos enzimáticos. Los valores normales oscilan entre 180 y 500 mg/dl. SMITH.”Urología General de Smith” .Pág. 697-721 Página 37 4.2.1 Fructosa Es un glúcido que se origina de la glucosa sanguínea y es fuente de energía del espermatozoide, donde la fosforilaciòn oxidativa de su metabolismo le da vitalidad suficiente para sus movimientos progresivos. En el liquido espermático su concentración oscila entre 200 y 400 mg/d L, e indirectamente da el dato funcional de las vesículas seminales, pues su disminución está relacionada con vesiculitis originadas por infecciones crónicas del conducto uretroprotatico. Las vesículas seminales son glándulas secretoras cuyo contenido es rico en fructosa y otros nutrientes, fibrinógeno y prostaglandinas. Durante la eyaculación cada vesícula seminal vacía su contenido en el conducto eyaculador, poco después de que el conducto deferente vacíe el semen. Esto aumenta considerablemente el volumen de semen eyaculado, en tanto que la fructosa tiene gran valor nutritivo y protector para los espermatozoides. 4.2.2 Técnica de determinación Para su determinación se utiliza métodos colorimétricos (resorcina en medio acido) o método enzimático. En éste, previa desproteinización de la muestra con acido perclórico y en el centrifugado, se llevan a cabo las siguientes reacciones: Fructosa + ATP Fructosa 6 - P hexoquinasa Fructosa 6 - P + ADP fosfoglucoisomerasa Glucosa 6 - P Glucosa 6 – P + NADP glucosa 6P deshidrogenasa Gluconato 6 – P + NADPH + H Al igual que en la determinación del acido cítrico, la concentración de fructosa es proporcional a al absorbancia a 340 nm del NADPH. 4.2.3 Valores normales 160 – 500 mg/dl. SMITH.”Urología General de Smith” .Pág. 697-721 Página 38 INFORME DE ESPERMIOGRAMA CONDICIONES DEL EXAMEN Hora de eyaculación___________________ Método de obtención________________ Hora de examen______________________ Abstinencia sexual__________________ Tiempo de transporte__________________ Ultimo proceso febril_________________ EXAMEN MACROSCÓPICO Volumen____________________________ Color_______________________________ Olor________________________________ Viscosidad___________________________ Aspecto__________________________ Licuación_________________________ Filancia__________________________ p H_____________________________ EXAMEN MICROSCÓPICO PREPARADO DE ORIENTACIÓN Espermatozoos_______________________ Aglutinación________________________ Células_____________________________ Cristalización_______________________ Espermiofagia________________________ Leucocitos por campo________________ NÚMERO DE ESPERMATOZOOS POR C.C________________________________ MOVILIDAD Inmóviles__________________% Movilidad total______________% Activa________________% Pasiva___________% VITALIDAD Espermatozoides teñidos___________________% ÍNDICE DE VITALIDAD_____________________% ESPERMIOCITOGRAMA Espermatozoides normales_________________% Espermatozoides anormales________________% Alteraciones de la cabeza_________________% Macros_____% Micros______% Alteraciones de S.I______________________% que corresponde: Alteraciones de cola_____________________% que corresponde: Alteraciones mixtas______________________% que corresponde: Células de espermiogénesis_______________ Leucocitos_____________________________ Otras células___________________________ Fructosa_________________mg/dl Fosfatasa ácida___________UI/dl BIOQUÍMICA Acido cítrico_______________mg/dl Cinc_____________________mg/L DIAGNÓSTICO: SMITH.”Urología General de Smith” .Pág. 697-721 Página 39 CAPITULO V CAUSAS DE LAS ALTERACIONES PATOLOGICAS DEL LÍQUIDO SEMINAL 5.1 Infecciones Pueden ser de la próstata –prostatitis-, del epidídimo –epididimitis- o al testículo – orquitis-. La más común es la orquitis urliana, que se produce en un 30 a 40% de los casos de parotiditis o paperas. En un tercio de ellos el compromiso es bilateral, de ese grupo sólo el 10% puede presentar esterilidad. Las enfermedades de transmisión sexual, también pueden afectar la fertilidad de la pareja. 5.1.1 Prostatitis La prostatitis es una inflamación de la próstata. En general, la prostatitis no se debe a una infección que se pueda identificar pero, en ocasiones, alguna infección bacteriana se extiende hasta la próstata desde el tracto urinario. La infección de la próstata causa dolor en la ingle, entre el pene y el ano y en la parte inferior de la espalda, así como escalofríos y fiebre. El paciente también puede necesitar orinar con frecuencia y de forma imperiosa y puede aparecer sangre en la orina. La infección bact eriana puede extenderse al escroto, causando intenso malestar, hinchazón y dolor muy fuerte cuando se toca la zona afectada. Incluso se puede experimentar impotencia debido al dolor. La prostatitis también puede ser el resultado de infecciones por hongos, virus y protozoos. 5.1.2 Epididimitis Inflamación de los conductos a través de los cuales el esperma sale del testículo. Esto a menudo es causado por bacterias como Clamidia, una enfermedad de transmisión sexual. 5.1.3 Orquitis Inflamación de uno o ambos testículos que puede ser causada por bacterias o virus como las paperas. Esta afección puede suceder al mismo tiempo que la epididimitis o la prostatitis (inflamación de la glándula prostática). El líquido en los testículos a menudo causa inflamación indolora, pero puede provocar una molestia leve. Hay varias especies principales de acumulación de líquido: URIBE Juan. SILVA Ferez.”Fundamentos de Cirugía Urología”. Pág. 328-338 Página 40 5.2 Azoospermia Es la ausencia total de espermatozoides en el semen. Si ésta es adquirida por una disfunción en la estimulación del testículo, la producción de espermatozoides se puede recuperar mediante un tratamiento hormonal. Pero si es congénita o por destrucción de la gónada, sólo se puede optar por la fecundación asistida para lograr un embarazo. 5.2.1 Azoospermia obstructiva Ausencia de espermatozoides en el líquido seminal debido a una alteración en los vasos deferentes, que son responsables de extraer los espermatozoides del testículo. Los vasos pueden estar obstruidos de forma parcial o total, o incluso faltar. 5.2.2 Azoospermia secretora Ausencia de espermatozoides en el líquido seminal debido a una incapacidad funcional del testículo, en estos casos la espermatogénesis se puede bloquear en diversos estadios madurativos. 5.3 Oligospermia El conteo bajo de esperma, es una de las causas de infertilidad masculina. Este se da cuando el conteo de espermatozoides es menor a 20 millones por mililitro. Algunas de sus causas pueden ser el varicocele o efectos secundarios de medicamentos, pero también puede ser tratado si se detecta a tiempo. 5.4 Teratozoospermia Células masculinas que presentan formas anormales o inmaduras. Según sea el grado del trastorno, habrá posibilidad o no de fertilidad, tanto de forma natural como mediante reproducción asistida. Puede darse el embarazo natural aunque haya niveles bajos de formas normales, siempre y cuando el resto de las características de los espermatozoides sean estándares. 5.5 Factor inmunológico Ocasionalmente, pueden estar presentes en el hombre anticuerpos antiespermáticos que no permiten que pueda ocurrir la fertilización. Aproximadamente el 3% de los hombres estériles poseen los auto anticuerpos anti-espermáticos en el suero y el líquido seminal. En algunos casos, el título de anticuerpos es más elevado en líquido seminal que en el plasma, lo que sugiere la producción local de estos anticuerpos. Se distinguen anticuerpos dirigidos contra URIBE Juan. SILVA Ferez.”Fundamentos de Cirugía Urología”. Pág. 328-338 Página 41 antígenos específicos de los espermatozoides (los más patógenos) y anticuerpos que son específicos de antígenos presentes inicialmente en el líquido seminal y, de forma secundaria, fijados en los espermatozoides. Existen datos que sugieren que las lesiones obstructivas (lesiones infecciosas con obstrucción de los conductos deferentes o vasectomía) provocan una irrupción anormal de antígenos de espermatozoides a la circulación, lo que determina un aumento de anticuerpos anti espermatozoides. Los tratamientos cortos con corticoides no tienen una eficacia totalmente comprobada. http//:images.inmune.com 5.6 Síndrome de inmovilidad ciliar En esta condición el recuento de esperma es normal, pero los espermatozoides no tienen movilidad, como sucede en el síndrome de Kartagener; un trastorno hereditario por lo que no pueden desplazarse por el cuello del útero para encontrarse con el óvulo en la trompa de Falopio. http//:www.urologie.com URIBE Juan. SILVA Ferez.”Fundamentos de Cirugía Urología”. Pág. 328-338 Página 42 5.7 Anomalías anatómicas Las obstrucciones del tracto genital pueden causar infertilidad al bloquear parcial o totalmente el flujo del líquido seminal. Algunas de estas anomalías pueden ser de origen congénito. Otras podrían ocurrir debido a una infección o inflamación del tracto urogenital; una cirugía que dejó una cicatriz en el tracto genital o por la presencia de venas varicosas en el escroto (varicoceles). 5.7.1 Varicocele Agrandamiento de la venas en el escroto que llevan la sangre lejos de los testículos 5.8 Disfunción eréctil Al no haber erección se dificulta la obtención seminal. Este problema se puede tratar con medicamentos, prótesis, inyecciones o tratamientos psicológicos. 5.9 Astenozoospermia Alteración patológica de la movilidad de los espermatozoides en una muestra del líquido seminal. URIBE Juan. SILVA Ferez.”Fundamentos de Cirugía Urología”. Pág. 328-338 Página 43