Tema 15. DEL ADN A LAS PROTEÍNAS
Anuncio
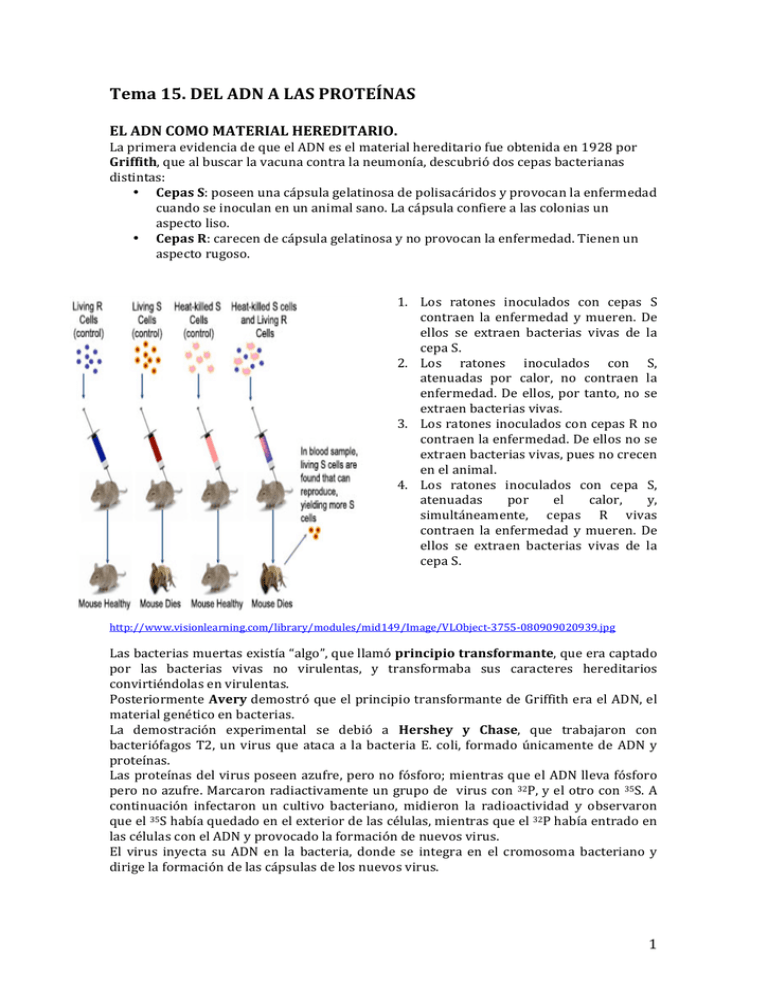
Tema 15. DEL ADN A LAS PROTEÍNAS EL ADN COMO MATERIAL HEREDITARIO. La primera evidencia de que el ADN es el material hereditario fue obtenida en 1928 por Griffith, que al buscar la vacuna contra la neumonía, descubrió dos cepas bacterianas distintas: • Cepas S: poseen una cápsula gelatinosa de polisacáridos y provocan la enfermedad cuando se inoculan en un animal sano. La cápsula confiere a las colonias un aspecto liso. • Cepas R: carecen de cápsula gelatinosa y no provocan la enfermedad. Tienen un aspecto rugoso. 1. Los ratones inoculados con cepas S contraen la enfermedad y mueren. De ellos se extraen bacterias vivas de la cepa S. 2. Los ratones inoculados con S, atenuadas por calor, no contraen la enfermedad. De ellos, por tanto, no se extraen bacterias vivas. 3. Los ratones inoculados con cepas R no contraen la enfermedad. De ellos no se extraen bacterias vivas, pues no crecen en el animal. 4. Los ratones inoculados con cepa S, atenuadas por el calor, y, simultáneamente, cepas R vivas contraen la enfermedad y mueren. De ellos se extraen bacterias vivas de la cepa S. http://www.visionlearning.com/library/modules/mid149/Image/VLObject-­‐3755-­‐080909020939.jpg Las bacterias muertas existía “algo”, que llamó principio transformante, que era captado por las bacterias vivas no virulentas, y transformaba sus caracteres hereditarios convirtiéndolas en virulentas. Posteriormente Avery demostró que el principio transformante de Griffith era el ADN, el material genético en bacterias. La demostración experimental se debió a Hershey y Chase, que trabajaron con bacteriófagos T2, un virus que ataca a la bacteria E. coli, formado únicamente de ADN y proteínas. Las proteínas del virus poseen azufre, pero no fósforo; mientras que el ADN lleva fósforo pero no azufre. Marcaron radiactivamente un grupo de virus con 32P, y el otro con 35S. A continuación infectaron un cultivo bacteriano, midieron la radioactividad y observaron que el 35S había quedado en el exterior de las células, mientras que el 32P había entrado en las células con el ADN y provocado la formación de nuevos virus. El virus inyecta su ADN en la bacteria, donde se integra en el cromosoma bacteriano y dirige la formación de las cápsulas de los nuevos virus. 1 ESTRUCTURA DEL GENOMA Y SU EXPRESIÓN. UN GEN, UNA ENZIMA. G. Beadle y E. Tatum establecieron la existencia de una relación directa entre la molécula de ADN y la secuencia de aminoácidos de una enzima. Propusieron la hipótesis de “un gen, una enzima”, según la cual un gen contiene la información para que los aminoácidos se unan en un determinado orden y formen una enzima. Trabajaron con el hongo común del pan, lo sometieron a rayos X para aumentar la tasa de mutación, cosa que afectaba a ciertas enzimas que perdían su actividad normal. Posteriormente, puesto que no todas las proteínas son enzimas la hipótesis “un gen, una enzima” se transformó en la de “un gen, una cadena polipeptídica”. 1. Organismos procarióticos. El genoma de los organismos procarióticos está formado por un solo cromosoma circular. Los genes son continuos, toda la información genética contenida en cada gen se traduce en la información de una proteína. Además, muchas bacterias contienen plásmidos, moléculas de ADN circulares más pequeñas que el cromosoma y con capacidad para replicarse independientemente de él. 2. Organismos eucarióticos. Características del genoma nuclear: • Mayor cantidad de ADN. • Presencia de ADN repetitivo. • Genes fragmentados en porciones: intrones, que se transcriben, pero no se traducen; y los exones, que se transcriben y se traducen, es decir, codifican una secuencia de aminoácidos. • ADN asociado con proteínas llamadas histonas. Una parte del genoma eucariótico se encuentra en los cloroplastos y en las mitocondrias, que carecen de histonas. Los cromosomas de estos orgánulos forman un sistema genético propio con plena capacidad para realizar la replicación del ADN, transcripción y síntesis proteica. La mayoría de las proteínas de estos orgánulos son codificadas por el ADN nuclear y transportadas hasta el orgánulo. FLUJO DE INFORMACIÓN GENÉTICA. Los estudios llevados a cabo por Griffith, Avery, Hershey y Chase demostraron que el ADN tiene información para que los aminoácidos se unan y formen las proteínas. La síntesis proteica se realiza en los ribosomas del citoplasma y el ADN no sale del núcleo, luego este ácido nucleico tiene que fabricar una molécula intermediaria que es un ARNm, en un proceso llamado transcripción. Con la información contenida en este ARNm se sintetiza una cadena polipeptídica en un proceso llamado traducción, en el cual intervienen también ARN transferente (ARNt) y ARN ribosómico (ARNr). • Algunos virus que almacenan su información genética en forma de ARN poseen una enzima, la ARN-­replicasa, capaz de fabricar copias de este ARN. • Los retrovirus emplean una enzima, la transcriptasa inversa, que sintetiza ADN a partir de una molécula de ARN en un proceso que recibe el nombre de retrotranscripción o trascripción inversa. DOGMA CENTRAL DE LA BIOLOGÍA MOLECULAR 2 SÍNTESIS DEL ARN: TRANSCRIPCIÓN. Es la transformación de la información de ADN a ARNm, es decir la formación de copias complementarias (ARN) de un fragmento determinado de una de las hélices del ADN. Se realiza en el núcleo celular. Requiere: 1. Una cadena de ADN que actúe como molde. 2. Las enzimas ARN-­‐polimerasas. -­‐ En procariontes hay una sola ARN-­‐polimerasa. -­‐ En eucariontes hay tres: ARN-­‐polimerasa I, II y III. 3. Ribonucleótidos trifosfatos de A, G, C y U. Se unan mediante un enlace éster entre el ácido fosfórico, situado en la posición 5’ de un ribonucleótido trifosfato, y el grupo –OH, situado en posición 3’ del último ribonucleótido de la cadena de ARN en formación. La transcripción consta de tres etapas: 1. Iniciación. Comienza cuando la ARN-­‐polimerasa reconoce en el ADN y se transcribe una señal denominada centro promotor, que es una secuencia cortas de bases nitrogenadas a las que se una la ARN-­‐polimerasa. El ARN-­‐polimerasa hace que la doble hélice de ADN se abra para permitir que la secuencia de bases del ADN quede expuesta, y se pueden incorporar los ribonucleótidos que se van a unir. 2. Elongación. Es la adición de sucesivos ribonucleótidos para formar el ARN. La ARN-­‐polimerasa avanza a lo largo de la cadena molde de ADN “leyéndola” en sentido 3’ 5’, mientras que el sentido de la síntesis del ARN es 5’ 3’. La enzima selecciona el ribonucleótido trifosfato y lo une mediante un enlace éster al siguiente nucleótido. En los eucariontes, tras la unión de los 30 primeros ribonucleótidos, se añade en el extremo 3’ una caperuza formada por metil-­‐guanosín-­‐fosfato, que durante la traducción será una señal de reconocimiento del inicio de lectura. 3. Terminación. La ARN-­‐polimerasa reconoce en el ADN unas señales de terminación. Esto implica el cierre de la burbuja formada en el ADN y la separación de la ARN-­‐polimerasa del ARN transcrito. • En los procariontes, la señal de terminación es una secuencia de bases palindrómica formada por G y C seguidas de varias T, que origina al final del ARN un bucle. Este favorece la separación del ADN. • En los eucariontes, la señal de corte es una secuencia (AAUAAA), llamada señal de poliadenilación, que aparece sobre el ARN unos pocos nucleótidos antes del punto de corte. Después de la separación del ARN, una enzima (poli-­‐A-­‐polimerasa) añade en el extremo final 3’ una secuencia formada por unos 200 nucleótidos de adenina, llamada cola poli A, la cual interviene en los procesos de maduración y transporte del ARN fuera del núcleo. 3 LA MADURACIÓN DEL ARN. Organismos procarióticos. El ARN de los procariontes puede ser directamente traducido, dando lugar a una proteína funcional. Pero cuando se transcribe el ADN que codifica los ARNt y los ARNr, se forma una larga molécula de ARN que contiene numerosas copias de las secuencias del ARNr o del ARNt. Esta larga molécula se denomina transcrito primario y es posteriormente cortada en fragmentos más pequeños para dar lugar a los distintos ARNt y ARNr. Organismos eucarióticos. La mayor parte de los genes que codifican las proteínas están fragmentados, es decir, cada gen consta de intrones y exones. Así pues, el ARNm transcrito primario también está formado por intrones y por exones. Su maduración consiste en la eliminación de los intrones y la unión de los exones, en un proceso llamado “splicing” (empalme). Requiere la presencia de una enzima llamada ribonucleoproteína pequeña nuclear (RNPpn). Las secuencias intrónicas forman unos bucles que provocan el acercamiento de los extremos de los exones, continúa con el corte de los intrones y la unión de los exones. Este ARN formado ya puede salir del núcleo. A veces, un mismo gen puede madurar de diferentes formas, según se eliminen los intrones. Por eso, a partir de un único gen se pueden obtener proteínas distintas. Actualmente se piensa que los genes del antecesor común a procariotas y eucariotas tenían intrones. Las bacterias los perdieron por selección natural, puesto que necesitan replicarse rápidamente, mientras que los eucariontes los conservaron debido a que representaban una ventaja adaptativa para ellos. EL DESCUBRIMIENTO DEL CÓDIGO GENÉTICO El problema planteado en este momento es el paso de una molécula de ARN a una molécula proteica, es decir, la transformación de los núcleotidos existentes a los 20 aminoácidos. Este paso constituye el código genético. Los puntos más importantes de este proceso fueron: • Tres bases nitrogenadas dan lugar a un aminoácido, ya que el número de posibles secuencias formadas por tres núcleotidos es 64, que es un número suficiente para codificar los 20 aminoácidos. Cada una de estas combinaciones se denomina codón. • Los trabajos se basan en el descubrimiento de Severo Ochoa de una enzima llamada polinucleótido fosforilasa, que cataliza la síntesis de ARNm sin emplear un molde de ADN. Esta enzima une los ribonucleótidos que están en el medio. Ochoa desarrolló un procedimiento de laboratorio en el que se obtuvo un ARN llamado “poli U”, ya que estaba formado únicamente por uracilo. • Nirenberg y Matthaei demostraron que el ARN dirige la síntesis de proteínas. -­‐ Prepararon 20 tubos de ensayo con extracto de E.coli y toda la maquinaria necesaria para la síntesis de proteínas. A cada tubo añadieron un solo de los 20 aminoácidos proteicos previamente marcados radiactivamente. -­‐ En cada tubo añadieron el ARN descubierto por Ochoa, es decir, el poli-­‐U. -­‐ En 19 de los 20 tubos no se obtuvo ningún polinucleótido marcado, y en el tubo que tenía como aminoácido la fenilalanina (phe), se encontró una cadena polipeptídica marcada radiactivamente. Aceptando que el código genético está formado por tripletes, dedujeron que el triplete UUU codificaba el aminoácido fenilalanina. Del mismo modo averiguaron los aminoácidos codificados por los tripletes AAA, CCC y GGG. -­‐ Fabricando cadenas de ARN sintético con distintos tripletes pudieron descifrar todo el código genético. Los codones de terminación no codificaban ningún aminoácido. 4 CARACTERÍSTICAS DEL CÓDIGO GENÉTICO. Casi todos los organismos comparten un mismo código genético que comprende toda la información almacenada en el ADN. • Es universal, compartido por todos los organismos conocidos, incluyendo los virus. • Es degenerado, la mayor parte de los aminoácidos, a excepción de la metionina y el triptófano, están codificados por más de un codón. Los distintos codones que codifican para un mismo aminoácido se denominan codones sinónimos. • No presentan imperfección. Ningún codón codifica más de un aminoácido. • Carece de solapamiento. Los tripletes se hallan dispuestos sin que compartan ninguna base nitrogenada. Su lectura se hace en un solo sentido (5’-­‐3’). Existe la posibilidad de que un mismo ARNm contenga varios codones de iniciación, es decir, se podrían realizar varias fases de lectura y se sintetizaría más de un polipéptido. EL PROCESO DE TRADUCCIÓN Se necesitan: • Ribosomas, donde se realiza la síntesis proteica. • ARN mensajero, que lleva la información para sintetizar cada proteína. • Aminoácidos, que son los aminoácidos en el orden preciso. • Enzimas y energía, necesarias en toda reacción de biosíntesis. La traducción permite la síntesis de proteínas por polimerización de los aminoácidos mediante enlaces peptídicos y de acuerdo con el orden o secuencia de tripletes de bases nitrogenadas que forman la molécula de ARNm. La traducción se realiza en los ribosomas, orgánulos citoplasmáticos formados por dos subunidades: una pequeña, donde se une el ARNm y una grande, donde se unen los aminoácidos. Ambas se unen cuando se van a sintetizar proteínas. En el ribosoma se distinguen tras lugares: el sitio P, donde se sitúa la cadena polipeptídica; el sitio A, donde entran los aminoácidos; y el sitio E, donde se sitúa el ARNt. El ARN de transferencia (ARNt). Encargado de transportar los aminoácidos hasta el ribosoma, e incorporarlos a la proteína según indica la secuencia de bases del ARN. Dos zonas: • El anticodón. Formado por tres bases nitrogenadas que son complementarias con las que forman un codón del ARN. • El extremo 3’. Lugar al que se une el aminoácido correspondiente al codón que reconoce ese ARNt. http://www.ucm.es/info/genetica/grupod/Estruadn/Arnt.gif 5 Activación de los aminoácidos. El aminoácido es activado al unirse con el ARNt que le corresponde, en presencia de aminoacil-­‐ARNt-­‐sintetasa. Se forma un complejo enzimático denominado aminoacil-­‐ ARNt. Para ello se necesita un aporte de energía que viene dado por el ATP. Este complejo desprende la molécula de AMP. Aminoácido + ARNt + ATP Aminoacil-­‐ ARNt + AMP + PPi SÍNTESIS DE PROTEÍNAS 1. Iniciación de la cadena de proteínas. La subunidad pequeña del ribosoma y el ARNm se unen cerca del codón de iniciación AUG. A continuación, entra en el sitio P un primer aminoacil-­‐ARNt, cuyo anticodón está formado por tres bases (UAC) complementarias a las del codón iniciador. Este primer ARNt lleva unido el aminoácido N-­‐formil metionina (f-­‐Met), en los organismos procariontes, y metionina en los eucariontes. La subunidad pequeña del ribosoma, el ARNm, y el primer aminoacil-­‐ARNt forman el complejo de iniciación, al que después se une la subunidad grande del ribosoma. 6 2. Elongación de la cadena de proteínas. Es el alargamiento de la cadena proteica, para lo cual un segundo aminoacil-­‐ARNt, cuyo anticodón es complementario al codón localizado a continuación del codón iniciador entra en el ribosoma y ocupa el sitio A que se halla libre. Se forma un enlace peptídico entre el aminoácido que ocupa el sitio P y el nuevo aminoácido que ocupa el sitio A, catalizada por la enzima peptidil-­transferasa. El segundo ARNt queda unido por un extremo al dipéptido formado, y por el otro, a su codón complementario. A continuación se produce la translocación, que es el desplazamiento del ribosoma a lo largo del ARNm en sentido 5´ 3´. El desplazamiento es exactamente de tres bases, luego el primer ARNt abandona el ribosoma por el sitio E, pasa a ocupar el sitio P quedando libre el sitio A. En estas condiciones, otro aminoacil-­‐ARNt se puede incorporar al sitio A. 3. Terminación de la cadena de proteínas. Cuando el ribosoma llega a un lugar del ARNm donde se encuentra un codón de terminación (UAA, UGA o UAG) no es reconocido por ningún ARNt, sino por factores de liberación de naturaleza proteica que se sitúan en el sitio A, y hacen que la peptidil-­‐ transferasa separe, por hidrólisis, la cadena polipeptídica del ARNt. Posteriormente se separan todos los componentes. Tanto en procariontes como en eucariontes, si el ARNm que se tiene que traducir es lo suficientemente largo, puede ser leído por más de un ribosoma a la vez, formando un polirribosoma o polisoma; este hecho permite que las células sinteticen rápidamente muchas copias de un mismo polipéptido. Las tres etapas que caracterizan la síntesis de proteínas requieren energía procedente de la hidrólisis de GTG a GDP. 7 REGULACIÓN DE LA EXPRESIÓN GÉNICA. La regulación de la expresión génica puede llevarse a cabo en diferentes momentos, pero lo frecuente es que ocurra durante la transcripción. 1. Regulación de la expresión génica en los procariontes. Modelo del operón. • Genes estructurales. Codifican la síntesis de las proteínas implicadas en un mismo proceso metabólico. Se transcriben sin interrupción, de modo que el ARNm resultante lleva la información para varias proteínas, y se llama ARNm policistrónico. • Promotor (p). Es una secuencia de nucleótidos de ADN, a la que se une la ARN-­‐ polimerasa para iniciar la transcripción de un gen o conjunto de genes. • Operador (o). Secuencia de nucleótidos situada entre el promotor y los genes estructurales. • Gen regulador (r). Puede estar situado en cualquier lugar del cromosoma bacteriano, y codifica la proteína que actúa como represor. Cuando la proteína represora se asocia al operador impide físicamente que la ARN-­‐polimerasa se pueda unir al ADN, y con ello, imposibilita la transcripción. Cuando el represor se separa, la transcripción ya es posible. • Proteína reguladora. Codificada por el gen regulador, y se une a la región del operador. • Inductor. Sustrato o compuesto cuya presencia induce la expresión de los genes. 2. Regulación de la expresión génica en los eucariontes. Se lleva a cabo en diferentes momentos: A. Antes de la transcripción. Los genes que se hallan dentro de la heterocromatina no se expresan, ya que debido a su compactación, esta es inaccesible a las enzimas de la transcripción. B. Controles transcripcionales. Ciertas proteínas, llamadas factores de transcripción específicos (activadores o represores), que se unen a secuencias específicas cercanas al promotor, pueden facilitar o impedir la transcripción. C. Controles postranscripcionales. Después de la transcripción hay arios mecanismos de regulación: • Corte y empalme alternativo del ARN. A partir de un mismo ARNm transcrito primario, se pueden obtener distintos ARNm dependiendo de qué segmentos del ARN se traten como exones y cuáles como intrones. • Degradación del ARNm. La degradación del ARNm comienza con el acortamiento enzimático de la cola poli-­‐A y de la caperuza. Una vez eliminados estos extremos, las enzimas nucleasas lo destruyen con rapidez. • Procesamiento después de la traducción. Los polipéptidos de los eucariontes deben procesarse para obtener proteínas funcionales. 8 9