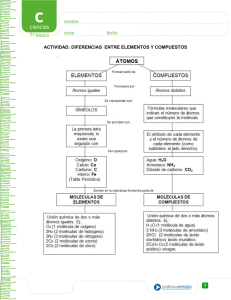
plan de nivelación académica talentos
Anuncio

Plan de Nivelación Académica TALENTOS Química Autor: Germania Micolta S. Coordinador: M.Sc. Germania Micolta S. MG. Lección 1 Cinética 1.1 Introducción Cuando en el laboratorio se realiza una reacción química, estamos interesados en conocer qué tan rápido ocurre la reacción. El área de la química relacionada con la velocidad de reacción, la secuencia de etapas en que ocurre la reacción se conoce como Cinética Química. La Cinética Química es muy importante desde el punto de vista ambiental y económico. En la atmósfera por ejemplo, el mantenimiento o la perdida de la capa de ozono, la cual nos protege de los peligrosa radiación ultravioleta del sol, depende de la velocidad de reacción que produce y destruye las moléculas de O3. En la industria química, el proceso de síntesis de amoníaco, usado como un fertilizante, depende de la velocidad a la cual el N2 y H2 pueden convertirse en NH3. En este capítulo, se describe la velocidad de reacción y se examina como ellas son afectadas por variables tales como la concentración y la temperatura. 1.2 Velocidad de reacción La velocidad de las reacciones químicas difiere considerablemente. Algunas, como por ejemplo la combinación del sodio y el bromo, ocurren instantáneamente, sin embargo otras, como por ejemplo la oxidación del hierro, son lentas. Para describir la velocidad de reacción cuantitativamente, se debe especificar, qué tan rápido cambia la concentración de un reactivo o un producto por unidad de tiempo R P Cambio de Concentración Velocidad = Cambio del tiempo Se define la velocidad de reacción como el cambio de la concentración de un reactante o un producto por unidad de tiempo (M/s). 76 Convenio Universidad del Valle - Alcaldía de Santiago de Cali V - A t V B t D[A] = Cambio en la concentración de A (Reactivo) respecto a un periodo de tiempo Dt. Porque [A] disminuye con el tiempo, D[A] es negativo D[B] = Cambio de concentración en B(producto) respecto a un periodo de tiempo ∆t. Ejemplo 1 En la figura 1 se observa la transformación de las esferas negras en grises como un modelo representativo de la aparición de las moléculas representadas por las esferas grises a través del tiempo, hasta que queda muy poco de las esferas negras al final de la reacción Figura 1. Cambio de reactivos (esferas negras) a productos (esferas grises) con el tiempo. Gráficamente este fenómeno se puede representar como se muestra a continuación Grafico 1. Cambio del número de moléculas vs tiempo, para una reacción general de la transformación de A en B. Plan de nivelación académica Talentos QUÍMICA 77 Ejemplo 2 La descomposición termal en fase gaseosa del pentóxido de dinitrógeno, N2O5, produciendo el dióxido de nitrógeno gaseoso café y el oxígeno molecular: 2N2O5(g) Incoloro 4NO2(g) + O2(g) Café Incoloro El cambio en concentración como función del tiempo puede determinarse midiendo el incremento en la presión como la conversión de 2 moléculas gaseosas en 5 moléculas gaseosas. Otra alternativa es monitorear el cambio de la concentración midiendo la intensidad del color café debido al NO2. La tabla 1 muestra los cambios en concentración de reactivos y productos como una función del tiempo a 55ºC. Concentración (M) Tiempo (s) N2O5 NO2 O2 0 100 200 300 400 500 600 700 0.0200 0.0169 0.0142 0.0120 0.0101 0.0086 0.0072 0.0061 0 0.0063 0.0115 0.0160 0.0197 0.0229 0.256 0.0278 0 0.0016 0.0029 0.0040 0.0049 0.0057 0.0064 0.0070 Tabla 1. Concentración como función del tiempo a 55 ºC para la reacción de descomposición del pentóxido de dinitrógeno. La velocidad de reacción se define como el incremento en la concentración de uno de los productos por unidad de tiempo o como el decrecimiento en la concentración de un reactante por unidad de tiempo. En la descomposición del N2O5, la velocidad de formación del O2 está dada por la ecuación: Recuerde que O2 representa la concentración molar del O2 y O2 el cambio en la concentración molar de O2; ∆t es el cambio del tiempo y ∆[O 2 ] representa ∆t ∆[O 2 ] ∆t 78 Convenio Universidad del Valle - Alcaldía de Santiago de Cali el cambio en la concentración molar del O2 durante el intervalo de tiempo entre t1 a t2. Conociendo los valores de concentración y de tiempo se puede calcular la velocidad de formación del O2. Así por ejemplo la velocidad de formación de O2 en el periodo de tiempo entre 300 y 400 s tomado de la tabla 1 es: Las unidades de velocidad corresponden a Molar por segundo (M/s), y esta variación de la concentración con el tiempo corresponde a la pendiente en un grafico de concentración vs tiempo. Ejercicio 1 Con los datos de la tabla 1, grafique las concentraciones dadas tanto para reactivo y productos y calcule la velocidad de formación del O2 y NO2 y desaparición del N2O5 en el intervalo de tiempo entre 200 y 300 s. Ahora estudiemos lo que ocurre cuando se tiene la reacción química del tipo: A 2B Se observa que la velocidad de producción de B es dos veces la velocidad de desaparición de A. Estequiométricamente de la ecuación presentada, por cada mol que reacciona de A se producen 2 moles de B. La expresión matemática que representa esta variación corresponde a: Es así que para la ecuación general: aA + bB cC + dD La velocidad de reacción puede ser expresada como: Ejemplo 3 Escriba la relación de velocidad de desaparición de reactivos y aparición de productos, para la siguiente reacción hipotética. 2A + 3B C Plan de nivelación académica Talentos 79 QUÍMICA La ecuación planteada indica la presencia de 2 moles de A reaccionando con 3 moles de B para producir un mol de C. En otras palabras B desaparece más rápido que A en proporción de 3 a 2. Matemáticamente la desaparición de B se expresa en función de A como: De la misma ecuación química, se puede deducir la relación entre las velocidades de C y B. Por cada 3 moles de B desaparecidos se produce un mol de C, luego la velocidad de formación de C es menor que la velocidad de desaparición de B. Matemáticamente se expresa: En conclusión la velocidad para la ecuación del ejemplo sería: Ejemplo 4 El etanol (C2H50H), es un ingrediente activo en las bebidas alcohólicas y utilizado en las gasolinas como combustibles verdes. Se produce por la fermentación de la glucosa según la ecuación balanceada: a). Cuál es la velocidad de formación del etanol relativa a la velocidad de consumo de glucosa?. b). Escriba esta relación en términos de y Solución a). De acuerdo a la ecuación balanceada, 2 moles de etanol se producen por cada mol de glucosa que reacciona. Entonces, la velocidad de formación del etanol es dos veces la velocidad de la concentración de la glucosa. b). Ya que la velocidad de formación del etanol es la relación se puede escribir: y , 80 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Ejercicio 2 Para la reacción: , escriba la relación de velocidad para la desaparición de reactivos y aparición de los productos. 1.3 Ley de Velocidad y Orden de reacción En la mayoría de las reacciones químicas a temperatura constante, la velocidad es proporcional a las concentraciones de los reactivos elevadas a un exponente n. Para la reacción general A →Productos Se introduce una constante de proporcionalidad k Esta ecuación empírica se conoce como la Ley de Velocidad donde k es la constante de velocidad y n es el orden de la reacción. Si n= 0 se considera la reacción como de orden cero y la ley de velocidad será: Recuerde: cualquier término elevado al exponencial cero tiene como valor 1 por lo tanto cuando una reacción es de orden cero la velocidad de reacción no depende de la concentración del reactivo, quedando finalmente la expresión de velocidad: Si n= 1, la reacción es de primer orden y la ley de velocidad corresponde a: Si n = 2, la reacción es de segundo orden y la ley de velocidad será: Es posible tener un orden de reacción 2 cuando la velocidad dependa de dos reactivos. A + B → C En este caso la reacción es de primer orden con respecto a cada reactivo y la ley de velocidad será: Donde el orden total de la reacción es 2. Plan de nivelación académica Talentos QUÍMICA 81 En resumen: Ley de velocidad Velocidad = k Velocidad = k [A] Velocidad = k[A][B] Velocidad = k[A][B]2 Orden de reacción total Orden cero Primer orden Segundo orden Tercer orden Unidades para k M/s ó Ms-1 1/s ó s-1 1/ (M* s) ó M-1 s-1 1/ (M2* s) ó M-2 s-1 El orden de reacción es una magnitud estrictamente experimental y depende tan solo de la forma como la velocidad se relaciona con la concentración de los reactivos. La ley de velocidad tiene unidades de M/s, mientras que las unidades de k dependen del orden total de la reacción. Reacción (CH3)3CBr(ac) + H2O(ac) → (CH3)3COH(ac) + H+(ac) + Br-(ac) HCO2H(ac) + Br2(ac) → 2H+(ac) + 2Br-(ac) + CO2(g) BrO3-(ac) + 5Br-(ac) + 6H+ (ac) → 3Br2(ac) + 3H2O(l) H2(g) + I2(g) → 2HI(g) CH3CHO(g) → CH4(g) + CO(g) Ley de velocidad Velocidad k[(CH3)3CBr] Velocidad = k[Br2] = Velocidad = k[BrO3-] [Br-][H+]2 Velocidad = k[H2][I2] Velocidad = k[CH3CHO]3/2 Tabla 2. Ecuaciones químicas balanceadas y Ley de velocidad determinada experimentalmente para algunas reacciones. Ejemplo 5 Para la reacción: 2NO(g) + 2H2(g) ® 2H2O(l) + N2(g), se encuentra experimentalmente que es de segundo orden respecto al NO y de orden cero respecto al H2, exprese la Ley de velocidad e indique el orden total de reacción. Solución De la información se establece que la velocidad no depende del H2, por lo tanto la ley de velocidad será: 82 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Como el orden total de la reacción es la suma de los exponentes de las concentraciones de las especies reaccionantes, se encuentra que el orden total es 2 porque el orden con respecto al H2 es cero. Recuerde: los coeficientes estequiométricos de la ecuación de reacción no son necesariamente los exponentes de la Ley de velocidad. Esto significa que una reacción ocurre en varios pasos, los cuales constituyen el mecanismo de reacción. El paso más lento de este mecanismo es el que determina la velocidad de reacción y por lo tanto define la Ley de velocidad. Ejercicio 3 De la tabla 2 escoja la reacción 2 y responda: a). Cuál es el orden de la reacción con respecto a cada reactivo? b). Cuál es el orden total de la reacción? c). Para todas las reacciones de la tabla 2, indique cuál es el orden total de la reacción. 1.4 Determinación experimental de la velocidad de reacción El estudio experimental de la velocidad de una reacción implica el conocimiento de las concentraciones de los reactivos o de los productos durante el transcurso de la reacción. Se puede medir en vez de la concentración, una propiedad física que sea directamente proporcional a la concentración y que cambie a medida que la reacción avanza. La propiedad física utilizada para el seguimiento, depende del tipo de reacción en estudio, por ejemplo en la descomposición del carbonato de calcio sólido. CaCO3(s) → CaO(s) + CO2(g) Tanto el carbonato de calcio (II) como el óxido de calcio (II), son sólidos, solo el dióxido de carbono es gaseoso, por lo tanto si se tiene un recipiente cerrado, se puede cuantificar el aumento de la presión a medida que transcurre la reacción, debido a que su concentración esta en aumento. La velocidad de este sistema se expresa como la variación de la presión del CO2(g) Plan de nivelación académica Talentos QUÍMICA 83 Otro ejemplo es la oxidación del oxido nítrico por el aire, (la cual contribuye a la lluvia ácida), según la reacción: 2NO(g) + O2(g) ® 2NO2(g) Los datos de velocidad inicial obtenidos experimentalmente se observan en la tabla 3. Experimento Inicial [NO] Inicial [O2] 1 2 3 4 0.015 0.030 0.015 0.030 0.015 0.015 0.030 0.030 Velocidad inicial de formación del NO2 (M/s) 0.048 0.192 0.096 0.384 Tabla 3. Concentración y datos de velocidad para la reacción de oxidación del oxido nítrico. Note: los datos experimentales se han diseñado para investigar el efecto sobre la velocidad inicial de un cambio en la concentración inicial de un reactivo. En los primeros dos experimentos se mantiene constante la concentración del oxígeno y se dobla la concentración de NO. Se observa en este caso un incremento en la velocidad inicial, en un factor de 4, va desde 0.048 M/s a 0.192 M/s, indicando que la velocidad depende de la concentración del NO al cuadrado [NO]2. Cuando se mantiene la concentración de NO constante y se dobla la concentración de oxígeno, (experimentos 1 y 3), la velocidad inicial de formación se dobla, indicando que la velocidad depende de la concentración del O2 a una potencia de 1. De estos resultados se concluye que la ley de velocidad para la formación del NO2 es: Ejercicio 4 La oxidación del ion ioduro por el peróxido de hidrógeno en medio ácido se describe según la ecuación balanceada: 84 Convenio Universidad del Valle - Alcaldía de Santiago de Cali La velocidad de formación del ión triyoduro, , se determina midiendo la velocidad de aparición del color del triyoduro, obteniéndose los datos registrados en la siguiente tabla: Experimento Inicial [H2O2] Inicial [I-] 1 2 3 4 0.100 0.100 0.200 0.200 0.100 0.200 0.100 0.200 a). Cuál es la ley de velocidad para la formación del I3-?. b). Cuál es el valor de la constante de velocidad?. Velocidad inicial de formación del I3-(M/s) 1.5 x 10-4 2.30 x 10-4 2.30 x 10-4 4.60 x 10-4 Ejercicio 5 Las velocidades de reacción para A + B Þ Productos, se representa en los vasos de reacción de a hasta d. Las esferas negras representan a A y las grises a B. a b c d a). Cuál es el orden de reacción para A y B?, cuál el orden de reacción total? b). Escriba la ley de velocidad. 1.5 Ley de velocidad integrada para una reacción de primer orden y tiempo de vida media. Para una reacción A Þ Productos, la ley de velocidad = utilizando el cálculo diferencial, se puede convertir esta expresión en otra forma conocida como la ley de velocidad integrada: Plan de nivelación académica Talentos QUÍMICA 85 En esta ecuación, ln corresponde al logaritmo natural, [A]0 señala la concentración de A al tiempo inicial, y arbitrariamente considerando este t=0, y [A]t, la concentración de A en cualquier tiempo t. La relación [A]t /[A]0, corresponde a la fracción de A que permanece al tiempo t. La ley de velocidad integrada es por tanto una ecuación de concentración vs. Tiempo que hace posible calcular la concentración de A a cualquier tiempo t o la fracción de A que permanece a cualquier tiempo t. Como ln([A]t/[A]0 = ln[A]t - ln[A]0 La ecuación se puede transformar en ln[A]t = -kt + ln[A]0 ,la cual tiene la forma de la ecuación de una recta y = mx + b, indicando que ln[A]t es una función lineal del tiempo Sí se grafica ln[A] contra tiempo, se obtiene una línea recta cuya pendiente m = -k y el intercepto b = ln[A]0. Grafico 2. Curva de variación de la concentración de A contra tiempo, donde se observa la disminución del reactivo (izquierda) y línea recta al graficar ln[A] contra tiempo cuya pendiente corresponde al valor de la constante de velocidad (derecha). a) Concentración de reactivos versus tiempo.5 b) Logaritmo natural de la concentración de reactivos versus tiempo para una reacción de primer orden. 86 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Ejemplo 6 La descomposición del peróxido de hidrógeno en una solución de hidróxido de sodio se describe mediante la ecuación: 2H2O2(ac) Þ 2H2O(l) + O2(g) Se encuentra que la reacción es de primer orden con respecto al peróxido, la constante de velocidad para el consumo del H2O2 a 20ºC es 1.8 x 10-5 s-1, y la concentración inicial del peróxido es 0.30 M. a). Cuál es la concentración del peróxido después de 4 h?. b). Cuánto tiempo transcurre para que el peróxido alcance una concentración de 0.12M?. c). Cuánto tiempo se toma en descomponerse el 90% del peróxido?. Solución a). Como las unidades de k estan en s-1, hay que convertir las horas a segundos: t = (4.00h)(60min/h)(60s/min) = 1.44 x 104 s Al sustituir los valores de concentración inicial, k y t en la ecuación de concentración vs. Tiempo: ln[H2O2]t/ 0.30M = (1.8X10-5 s-1)(1.44X104 s) = -0.259 Al tomar el antilogaritmo de -0.259, que corresponde a la función exponencial, se obtiene la relación de concentración para despejar la incógnita: [H2O2]t/ 0.30M = e-0.259 = 0.772 Despejando: [H2O2]t = 0.772 x 0.30M = 0.23M b). Para una reacción de primer orden: Despejando el tiempo: Reemplazando: Asi que la concentración 0.12M del peróxido se alcanza cuando han transcurrido 14 h. Plan de nivelación académica Talentos QUÍMICA 87 c). Como se descompone el 90% del peróxido, permanece sin desomponerse el 10%, por tanto: [H2O2]t/ [H2O2]0 = (0.10 x 0.30M)/0.30M = 0.10 El tiempo Por lo tanto el tiempo requerido para descomponer 90% del peróxido equivale a 1.3x105 s equivalente a 36 h. Ejercicio 6 Tomando los datos experimentales de concentración versus tiempo para la descomposición del pentoxido de dinitrógeno a 55ºC dados en la tabla 1 confirme que la descomposición del pentóxido es una reacción de primer orden. Calcule la constante para la descomposición de N2O5. En cinética se considera el tiempo de vida media, como el tiempo gastado para llevar a la mitad de la concentración inicial los reactivos. En una reacción de primer orden el tiempo se calcula mediante la ecuación: Si la reacción se lleva a la mitad de la concentración inicial entonces para una cinetica de primer orden el tiempo gastado en llevar la concentración inicial a la mitad es: Ejercicio 7 Considere la descomposición del peroxido de hidrógeno del ejemplo 6, cuál es el tiempo de vida media (en horas) de la reacción a 20ºC?. 1.6 Mecanismo de reacción. Se ha estudiado hasta aquí, que la velocidad de una reacción usualmente depende de las concentraciones de los reactantes y del valor de la constante de velocidad. Otro aspecto importante en cinética es tratar de explicar cómo puede ocurrir la reacción química, lo que se conoce como el mecanismo de la reacción, es decir la secuencia de eventos moleculares, o las etapas de reacción, las cuales definen la vía de reactivos a productos. Una etapa simple en un mecanismo de reacción se conoce como reacción elemental o etapa elemental. Normalmente se presentan las reacciones totales más no las reacciones elementales por ejemplo. 88 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Figura 2. Etapas elementales en la reacción del NO2 con CO. La ecuación química para una reacción elemental es una descripción de un evento molecular individual que involucra el rompimiento y la formación de enlaces químicos. En contraste, la ecuación balanceada para una reacción total describe solamente la estequiometría del proceso total, y no proporciona información de cómo ocurre la reacción. NO2(g) + CO(g) ® NO(g) + CO2(g) Reacción Total Primera etapa: ción elemental Segunda Etapa: ción elemental NO2(g) + NO2(g) NO(g) + NO3(g) Reac- NO3(g) + CO(g) NO2(g) + CO2(g) Reac- Si se revisa la reacción total, en ella no aparece el NO3 y en las reacciones elementales en la primera etapa aparece y en la segunda desaparece, a este tipo de reactivo se le da el nombre de reactivo intermediario. La molecularidad corresponde para una reacción elemental el número de moléculas presentes en cada etapa. Así, una reacción unimolecular corresponde a la descomposición de una molécula en otras. De otro lado, una reacción bimolecular, para una reacción elemental, corresponde a la presencia de 2 moléculas reaccionantes. Las reacciones elementales del ejemplo anterior corresponden a reacciones bimoleculares. Plan de nivelación académica Talentos QUÍMICA 89 No se puede utilizar la palabra molecularidad conectado con una reacción total, porque la reacción total no describe un evento molecular individual. Únicamente para reacciones elementales se puede hablar de molecularidad. Ejercicio 8 Se propone el siguiente mecanismo en 2 etapas para la descomposición en fase gaseosa del oxido nitroso (N2O): Etapa 1 N2O (g) Þ N2(g) + O(g) Etapa 2 N2O(g) + O(g) Þ N2(g) + O2(g) a). Escriba la ecuación química para la reacción total. b). Identifique los intermediarios de la reacción. c). Cuál es la molecularidad de cada una de las reacciones elementales?. d). Cuál es la molecularidad de la reacción total?. Experimentalmente se ha observado que la cinética de una reacción total depende del mecanismo de la reacción, esto es, de la secuencia de etapas elementales y sus velocidades relativas. Si una reacción total ocurre en una etapa elemental simple, la ley de velocidad es igual a la ley de velocidad para la etapa elemental. Un ejemplo de esto es la conversión del bromometano en metanol en solución básica: CH3Br(ac) + OH-(ac) Þ Br-(ac) + CH3OH(ac) La reacción ocurre en una simple etapa bimolecular por lo tanto la ley de velocidad será: En el caso de la reacción entre el NO2 y el CO dada arriba la cual ocurre en 2 etapas: k1 La primera etapa NO2(g) + NO2(g) Þ NO(g) + NO3(g) Etapa lenta, determinante de la velocidad k2 La segunda etapa NO3(g) + CO(g) Þ NO2(g) + CO2(g) Etapa rápida 90 NO2(g) Convenio Universidad del Valle - Alcaldía de Santiago de Cali + CO(g) Þ NO(g) + CO2(g) La reacción total La ley de velocidad la determina la etapa lenta, un diagrama de flujo para determinar la ley se da a continuación: 1.7 Energía de activación y estado de transición. Para que los reactivos se conviertan en productos, es necesario que las colisiones entre las moléculas alcancen una energía mínima suficiente para lograr la transformación, esta energía se conoce como energía de activación. Es así como solo las moléculas que alcanzan un estado energético alto, serán las que reacciones y a este estado energético se le conoce como complejo activado o estado de transición. Grafico3. Perfil de Energía potencial vs. progreso de la reacción de A + B® C + D Plan de nivelación académica Talentos QUÍMICA 91 Sí tenemos la reacción general: A + B → AB¹ → C + D a) Reacción Exotérmica b) Reacción Endotérmica Grafico 4: Variación de la energía potencial cuando A + B se transforma en C + D En el grafico 4, en el caso a se observa la energía de los productos es menor que la energía de los reactivos, cuando esto ocurre el sistema produce calor y se conoce como reacción exotérmica. En el caso b, la energía de los productos está por encima de la energía de los reactivos, este proceso requiere energía, y a este tipo de reacciones se les conoce como reacciones endotérmicas. 1.8 Catálisis. La velocidad de reacción se ve afectada, no solo por la concentración de los reactivos y la temperatura, sino por la presencia de catalizadores. Un catalizador es una sustancia que incrementa la velocidad de una reacción sin ser consumido en la misma. Un ejemplo es el dióxido de manganeso, un polvo blanco que agiliza la descomposición termal del clorato de potasio. 2KClO3(s) Calor 2KCl(s) + 3O2(g) En ausencia de catalizador el KClO3, se descompone muy lentamente, aunque se caliente, pero cuando se añade pequeñas cantidades de MnO2 y se mezcla con el KClO3, con rapidez se observa la evolución del oxígeno gaseoso. 92 Convenio Universidad del Valle - Alcaldía de Santiago de Cali a b Grafico 5. Curvas de reacción para reacciones sin catalizador (a) y con catalizador (b). En el grafico 5 se observa el efecto de la adición de un catalizador a una mezcla de reaccionantes, donde claramente se aprecia una disminución de la Energía de activación para una reacción catalizada, lo que le permitirá llegar a productos mucho más rápidamente, que una reacción sin catalizador. El trabajo de un catalizador es permitirle a la reacción utilizar otro camino de menor energía de activación para llegar a los productos. Los catalizadores son muy importantes, tanto en la industria química como en los organismos vivos. Casi todos los procesos industriales para la manufactura de químicos esenciales usan catálisis para favorecer la formación de un producto específico y bajar la temperatura de reacción, efecto que les permite reducir los costos de energía. En química ambiental, los catalizadores, por ejemplo el óxido nítrico, juega un importante papel en la formación de polutantes del aire, mientras que otros catalizadores, como el platino en convertidores catalíticos de los autos, son armas potentes en la batalla para el control de la polución del aire. Plan de nivelación académica Talentos 93 QUÍMICA En los organismos vivos, las reacciones químicas son catalizadas por las moléculas grandes llamadas enzimas, que facilitan las reacciones específicas de importancia biológica esencial. Por ejemplo, la nitrogenasa, una enzima presente en las bacterias en la raíz nódulos de las leguminosas como los guisantes y frijoles, cataliza la conversión de nitrógeno atmosférico en amoníaco. Un modelo explicativo del proceso se observa a continuación: Grafico 6. Mecanismo de acción de las enzimas. V= �[P] V=k [ES] �t 94 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Plan de nivelación académica Talentos QUÍMICA 95 Lección 2 Química orgánica 2.1 Introducción A mediados del siglo XVIII, los dedicados a la ciencia de la época, notaron que los componentes de las plantas y los animales eran más difíciles de purificar y trabajar con ellas que las extraídas de los minerales. Para expresar esta diferencia, se acuña el término química orgánica, el cual significa el estudio de los compuestos de los organismos vivos, mientras que la química inorgánica se utilizaba para el estudio de los compuestos provenientes de fuentes minerales. Hoy se conoce que no hay una diferencia como se pretendía en esta época, dado que los mismos principios se aplican para ambos. Dada la cantidad de compuestos desarrollados a base de carbono, se sigue realizando su estudio como un capítulo aparte del resto de elementos de la tabla periódica. Toda la química del carbono se basa en la habilidad del carbono para enlazarse con otros átomos de carbono, formando grandes cadenas (cate nación) y anillos. En la química orgánica, no se consideran moléculas pequeñas del carbono como el dióxido y el monóxido de carbono, pero es más por conveniencia. Para representar las cadenas o anillos es bueno tener en cuenta los esqueletos carbonados y los tipos de carbono como fundamentos para escribir las moléculas orgánicas. 98 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Esqueletos carbonados C C C C C C C C C C C C C C C C C C C C C C C C C Lineal Cíclicos Ramificados Tipos de carbonos Carbono primario Aquel que está unido a un solo carbono C-C Carbono secundario Aquel que está unido a dos carbonos C-C-C Carbono terciario Aquel que está unido a tres carbonos C C C C C Aquel que está unido Carbono cuaternario a cuatro carbonos C C C C Los seres vivos están hechos de moléculas muy grandes las cuales constituyen el campo de la Bioquímica, como parte de la química orgánica, sin embargo dados los avances en la investigación en química orgánica, otra serie de moléculas grandes se han desarrollado a partir del carbono de mucho uso industrial, como son los polímeros orgánicos: los polietilenos, los poli-cloroetano, poli-estireno, el teflón, etc. Plan de nivelación académica Talentos QUÍMICA 99 2.2 Naturaleza de las moléculas orgánicas Como se estudio en el capítulo 4 de enlace, el carbono en la molécula de CH4, se une de manera covalente con 4 átomos de H, utilizando los 4 electrones de su capa de valencia (1s2 2s2 2p2), cuya geometría es tetrahedral con hibridización sp3. Figura 1. Estructura del Metano. La unión de dos átomos de carbono a través de enlace covalente, formado entre átomos de carbono y de hidrógeno, produce la primera molécula, el etano, cuya representación se puede observar en el siguiente esquema. Figura 2. Estructura del Etano. No solo se presenta un enlace covalente simple en las especies orgánicas. Cuando se enlaza al carbono un átomo más electronegativo, se puede tener un enlace covalente polar como el que se presenta en el clorometano, sin embargo no siempre el carbono se puede unir a un átomo más electronegativo, también lo puede hacer con un átomo menos electronegativo. En los ejemplos mostrados (esquema 3), se ve al carbono como electropositivo en el clorometano y a su vez en el metil-litio, al ser el litio muy electropositivo, el carbono actúa como una especie más electronegativa. 100 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Figura 3. Polaridad del enlace en compuestos del Carbono. El carbono no solo forma enlaces simples σ, sino que puede producir enlaces dobles en moléculas como el eteno, o etileno, donde el carbono esta compartiendo 4 electrones con el otro carbono. El etileno se enlaza mediante un enlace σ y un enlace π, lo cual constituye el doble enlace. Los dos átomos de carbono en el etino o acetileno, se encuentran enlazados triplemente, donde se presentan 1 enlace σ y 2 π. Esto constituye un enlace triple (Figura 4). Figura 4. Representación del Eteno y Etino. Alcanos y sus isómeros 2.3 Alcanos y sus isómeros Todas las moléculas formadas por átomos de carbono e hidrógeno se conocen como hidrocarburos. Si están unidos solo por enlaces simples σ, estos compuestos conforman la familia de los hidrocarburos saturados o alcanos, identificados por la fórmula CnH(2n+2). Plan de nivelación académica Talentos QUÍMICA 101 Figura 5. Ejemplo de algunos alcanos. Cuando se combinan más de 3 carbonos e hidrógenos, más de una estructura puede resultar a partir de la misma fórmula molecular. Por ejemplo cuando se tiene 4 o 5 carbonos se pueden arreglar en forma lineal o en forma ramificada. (Figura 6). Cuando ambas especies tienen la misma fórmula molecular pero difieren en su estructura, se conocen como isómeros estructurales. A medida que aumenta el número de carbonos, aumenta el número de isómeros. (Figura 7). Es importante resaltar que los isómeros a pesar de tener la misma formula molecular, poseen propiedades químicas y físicas diferentes. Figura 6. Isómeros del C4H10. Figura 7. Isómeros del C5H12. 102 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Ejemplo 1 Dibuje todos los isómeros que poseen la formula molecular C2H6O. Consulte sus propiedades físicas. Solución El alcohol etílico y el éter dimetílico tienen la fórmula empírica propuesta: Etanol C2H5OH Líquido, p. eb. 78.5 ºC Dimetileter Gas, p. eb. = -23 ºC Ejercicio 1 Dibuje todos los isómeros con fórmula C7H16. 2.4 Nomenclatura Aunque se conocen nombres comunes para ciertos compuestos, la necesidad de identificar correctamente los mismos ha requerido de un método sistemático para nombrarlos y ha sido la International Union of Pure and Applied Chemistry, abreviado IUPAC, quien ha realizado la sistematización de los compuestos orgánicos para darles su nombre. El nombre sistemático para un compuesto tiene un tronco que describe el esqueleto carbonado, prefijos y sufijos que indican los grupos funcionales y los números (localizaciones) que definen la posición. Los prefijos se pueden adicionar para indicar modificaciones al esqueleto carbonado y definir la estereoquímica. Plan de nivelación académica Talentos QUÍMICA 103 En los alcanos, las cadenas lineales se nombran contando el número de carbonos en la cadena y adicionando el sufijo ano, con excepción de los 4 primeros compuestos, (metano, etano, propano y butano), cuyos nombres tienen origen histórico, (nombres comunes), el resto se nombra usando los prefijos de los números griegos de acuerdo al número de carbonos presentes, así por ejemplo un alcano de 5 carbonos se nombra pentano. Tabla 1. Nombre de los alcanos de cadena lineal. Los alcanos de cadena ramificada se nombran siguiendo estas 4 etapas: 1. Nombre de la cadena principal. Encuentre la cadena continua más larga de carbonos en la molécula y use el nombre de esa cadena como el nombre del tronco principal. La cadena más larga no siempre es la más obvia en la forma escrita, debe analizarla para encontrarla. Se nombra como Hexano, no como pentano, porque la cadena más larga tiene 6 carbonos. Esta estructura es igual a identificar la cadena lineal. de esta manera puede Ud. 2. Numeración de los átomos de carbono en la cadena principal. Se inicia la numeración buscando el extremo más cercano al punto donde está la ramificación, para el caso anterior: 104 Convenio Universidad del Valle - Alcaldía de Santiago de Cali La única ramificación ocurre en el carbono 3, C3, si se inicia la numeración por el otro extremo la ramificación queda ubicada en el carbono 4, C4, lo cual es erróneo. 3 Identificar y numerar el sustituyente ramificado. Asignar un número a cada grupo sustituyente ramificado sobre la cadena base de acuerdo a su punto de unión. Los grupos sustituyentes se nombran derivados de su tronco patrón, normalmente pierden un hidrógeno, así el derivado del metano al perder un hidrogeno y estar como sustituyente se denomina grupo metilo, el derivado del etano se denomina etilo, no existen más posibilidades en su nombre, dado que todos los hidrógenos de las 2 especies mencionadas son equivalentes. Sin embargo esto no es igual cuando se tienen hidrógenos no equivalentes en el grupo sustituyente. C3 CH3CH2CH3 Propano CH3CH2CH2 Propil y CH3CHCH3 Isopropil Plan de nivelación académica Talentos QUÍMICA 105 Los sustituyentes se nombran en orden alfabético. Los nombres se separan por comas y las letras de los números por guiones. Si un grupo sustituyente se encuentra repetido se utilizan los prefijos di (dos); tri (tres), tetra (cuatro); etc. Así podemos nombrar los siguientes ejemplos: Ejemplo2 Cuál es el nombre IUPAC del siguiente alcano?. Solución Aplicando los pasos vistos arriba, la numeración buscando la cadena más larga iniciando por el terminal donde se encuentre la sustitución más cercana nos produce: La molécula tiene 8 carbonos en su cadena principal con dos sustituyentes metilos en las posiciones de C2 y C6. Su nombre: 2,6-Dimetiloctano. Ejemplo 3 Dibuje la estructura del 3-isopropil-2-metilhexano. Solución 106 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Siguiendo los pasos, se dibuja inicialmente la cadena lineal de 6 carbonos y se numeran del 1 al 6, colocando en los carbonos 2 y 3 los respectivos sustituyentes. Debe adicionar tantos hidrógenos a cada átomo de carbono de la cadena lineal de tal manera que todos ellos tengan 4 átomos enlazados. Ejercicio 2 Nombre según la IUPAC: a). Los tres isómeros del C5H12 b). Ejercicio 3 Dibuje las estructuras correspondientes a los siguientes compuestos: a). 3,4-Dimetilnonano b). 3-Etil-4,4-dimetilheptano c). 2,2-Dimetil-4-propiloctano d). 2,2,4-trimetilpentano 2.5 Ciclo alcanos En la naturaleza no solo hay alcanos de cadena abierta, sino también átomos de carbono formando anillos que unen desde 3 átomos de carbonos hasta 30. Algunos de ellos han sido sintetizados. Cada una de las esquinas de los anillos representa un átomo de carbono en forma de CH2, con hibridización sp3, aunque éste se encuentra distorsionado en el ciclo propano y el ciclo butano, (ángulos menores a 109.5º), generando anillos con enlaces más débiles de lo normal, lo cual les otorga mas reactividad a estos dos anillos, comparados con los otros ejemplos de anillos mostrados. Plan de nivelación académica Talentos QUÍMICA 107 Para nombrar cicloalcanos sustituidos se sigue utilizando el tronco básico, es decir, el nombre de ciclo respectivo e identificando como primera posición sobre el anillo donde se encuentra el sustituyente teniendo presente el orden alfabético. Los sustituyentes son etil y metil, por orden alfabético la posición 1 será para el etil, se sigue la numeración de tal manera que el siguiente sustituyente tenga la numeración más baja. Es por eso que no se puede numerar siguiendo las manecillas del reloj, porque el metilo, le correspondería la posición 5 que es más alta que la posición 3, la cual es la correcta. Ejemplo 4 Cuál es el nombre IUPAC del siguiente cicloalcano? Solución El cicloalcano tiene 5 carbonos luego será un ciclopentano, las dos sustituciones corresponden a un metil y un isopropilo, alfabéticamente la posición 1 corresponde al isopropil y la 3 al metil, por lo tanto el nombre del cicloalcano es 1-Isopropil-3-metilciclopentano. Ejercicio 4 Escriba los nombres IUPAC de los siguientes cicloalcanos: 108 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Ejercicio 5 Dibuje las estructuras correspondientes a los siguientes nombres IUPAC: a). 1,1-Dimetilciclobutano b). 1-ter-Butil-2-metilciclopentano c). 1,3,5-Trimetilcicloheptano 2.6 Reacciones de los alcanos Los alcanos tienen una baja reactividad química y son inertes a los ácidos, bases y a la mayoría de los reactivos comunes de laboratorio. Bajo condiciones apropiadas reaccionan con oxígeno y con halógenos, la primera se conoce como reacción de combustión, y la segunda como reacción de halogenación. La reacción de combustión produce energía, y por eso se utilizan en máquinas y hornos como combustibles. El alcano más usado es el metano y su reacción es: El propano, la gasolina (una mezcla de alcanos entre C5-C11), el kerosene (una mezcla de alcanos de C11- C14) y otros alcanos hacen combustión de manera similar. Para la reacción de alcanos con Br2 ó Cl2, se mezclan los reactivos y se irradia con luz ultravioleta. En este proceso ocurre la sustitución de átomos de hidrógenos del alcano por átomos de halógeno. 2.7 Grupos funcionales Los compuestos orgánicos pueden clasificarse en familias de acuerdo a su estructura y al comportamiento químico que presentan. Los hechos estructurales que hacen posible la ubicación de un grupo de compuestos en una misma familia, se conoce como grupo funcional. Plan de nivelación académica Talentos QUÍMICA 109 Un grupo funcional es un átomo o grupo de átomos dentro de una molécula que tiene un comportamiento químico característico. Los compuestos que poseen el mismo grupo funcional tienden a presentar la misma clase de reacciones. En la tabla se identifican principales grupos funcionales. 110 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Tabla 2. Familias de moléculas en química orgánica. Alquenos y alquinos 2.8 Alquenos y alquinos Estos compuestos se caracterizan por presentar un doble enlace (alquenos) o un triple enlace (los alquinos). Se nombran teniendo en cuenta la cadena carbonada más larga que contenga el enlace doble enlace añadiéndole el sufijo eno o ino respectivamente. Por ejemplo propeno. Los alquenos superiores pueden producir isómeros, dependiendo de la posición del doble enlace en la cadena lineal, el cual se especifica con prefijos numéricos. 2-Metil-3-hexeno Alrededor de la posición del doble enlace se pueden considerar isómeros geométricos del tipo conocidos como cis y trans. Reacciones de alquenos y alquinos Reacciones de adición Los alquenos reaccionan con moléculas tipo XY, donde el doble enlace se transforma en un enlace sencillo, donde XY puede ser H2, Cl2, Br2; H-OH, etc. Plan de nivelación académica Talentos QUÍMICA 111 a. Adición de hidrógeno: Los alquenos reaccionan con hidrógeno gaseoso en presencia de un catalizador de Ni, Pd o Pt para producir el correspondiente alcano. 3-HexenoHexano b. Adición de halógeno: Eteno1,2-Dibromoetano c. Adición de agua: Los alquenos no reaccionan con agua pura, pero en presencia de un catalizar acido fuerte como el ácido sulfúrico, una reacción de hidratación ocurre para producir alcoholes. Eteno Etanol 2.9 Reacciones de los compuestos aromáticos El más conocido es el benceno, se caracteriza por tener un anillo con 3 dobles enlaces delocalizados, característica que lo hace energéticamente más estable que moléculas similares con enlaces alternos simples y dobles. Se puede distinguir 3 posiciones en el anillo: orto, meta y para, lo que permite identificar en su nomenclatura, por ejemplo: El anillo puede sufrir reacciones de sustitución electrofílica aromática: nitración, halogenación, sulfonación así: 112 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Ejercicio 6 Dibuje las estructuras correspondientes a los siguientes nombres: a). o-Dibromobenceno b). p-Cloronitrobenceno c). m-Dietilbenceno Ejercicio 7 Escriba los productos de reacción de los siguientes reactivos con benceno: a). Br2, FeBr3 b). HNO3, H2SO4 c). SO3, H2SO4 2.10 Alcoholes, fenoles, eteres, y aminas Alcoholes Los alcoholes, al igual que el agua, por tener un átomo de oxígeno muy electronegativo unido a un átomo de hidrógeno, forma enlaces puente de hidrógeno, el cual afecta muchas de sus propiedades físicas y químicas. Los alcoholes tienen puntos de ebullición más altos que los alcanos de tamaño similar, la mayoría son solubles en agua, hasta 6 carbonos, por su habilidad de formar puentes de hidrógeno. Se nombran a partir de la cadena principal, señalando la posición del grupo funcional con el sufijo ol. Plan de nivelación académica Talentos H C 3C H 3 2 QUÍMICA 113 H 2O H 2C 1 1-Propanol El más sencillo es el metanol y se produce por la reacción catalizada del CO con hidrógeno. El metanol el tóxico y causa ceguera en bajas dosis (15mL) y la muerte en grandes cantidades (100-200 mL). Industrialmente es importante porque es la materia prima para la obtención de formaldehido, (CH2O), ácido fórmico (HCOOH). El etanol es uno de los conocidos más antiguos, se produce por procesos de fermentación de cereales, o de azúcar de caña o remolacha, siendo purificado por procesos de destilación fraccionada. C6H12 O6 LEVADURA 2CO2 + 2CH3CH2OH Los alcoholes pueden ser primarios, secundarios o terciarios; por ejemplo: En el esquema se observan los sitios por donde puede reaccionar un alcohol, con los distintos tipos de reacciones que pueden ocurrir. Figura 8. Reacciones del grupo alcohol. 114 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Fenoles Cuando uno de los hidrógenos de la estructura molecular de los hidrocarburos aromáticos se sustituye por el grupo hidroxilo (-OH), característico de los alcoholes, se les denomina fenoles. El más simple de los hidrocarburos aromáticos es el benceno (C6H6), de estructura de resonancia en forma de anillo hexagonal. Cuando uno de los hidrógenos del benceno se sustituye por un grupo hidroxilo obtenemos el Fenol, el más simple de los fenoles y al cual debe el nombre la clase. H C H C C H H C C H C H H C C H C H Estructuras Benceno H O H C H C C H resonantes Benceno Fenol del Ejemplo de otros fenoles: Los fenoles además pueden tener varios anillos bencénicos (policíclicos) en la estructura molecular y acoplarse de diversa manera con diferentes radicales en los vértices de los hexágonos del anillo para formar compuestos de elevada complejidad y características muy diferentes. Fuentes naturales y uso de los fenoles: La elaboración de coque a partir del carbón de piedra proporciona importantes cantidades de fenol. En los seres vivos están presentes con frecuencia formas más complejas de fenoles, como aceites esenciales en el té o el tomillo, o como hormonas en los animales superiores y el hombre. El fenol es una sustancia con enorme valor industrial, directamente o en derivados, se usa como desinfectante, anestésicos tópicos y germicidas. Grandes cantidades de fenol se usan para la producción de formaldehído, resinas y plásticos. La bakelita, un termoplástico que se produce industrialmente desde 1909 es un polímero del formaldehído cuya base principal es el fenol. Plan de nivelación académica Talentos QUÍMICA 115 Propiedades físicas y químicas de los fenoles: La enorme diversidad de fenoles posibles, hace imposible generalizar características físicas comunes a la clase, deben consultarse sus propiedades individualmente. Con respecto a sus propiedades químicas, los fenoles pueden en general, reaccionar de dos maneras diferentes: a). Los cambios químicos que se producen en el grupo hidroxilo. Los fenoles tienen, a diferencia de los alcoholes, un carácter más ácido y pueden reaccionar con el hidróxido de sodio para formar una sal, el fenóxido de sodio. En este caso el ion sodio sustituye al hidrógeno del grupo hidroxilo. b. Reacciones sobre el propio anillo bencénico. Cuando el fenol reacciona con el bromo (halogenación) se forma un tribromofenol, en el cual se acoplan tres átomos de bromo en los vértices del anillo bencénico quedando el grupo hidroxilo intacto. La reacción de una molécula dibencénica con el ácido nítrico (nitración) produce dos compuestos diferentes con el grupo NO2. Aquí tampoco participa el grupo hidroxilo. Eteres El compuesto más común es el éter dietílico, CH3CH2OCH2CH3, utilizado como anestésico en cirugía. Los eteres se forman por la eliminación de una molécula de agua de dos moléculas de alcohol. Existe una gran cantidad de agentes deshidratantes entre otros el ácido sulfúrico, el ácido fosfórico, el sulfato ácido 116 Convenio Universidad del Valle - Alcaldía de Santiago de Cali de potasio y la alúmina. Son compuestos poco reactivos, de ahí que se les utilice como solventes en reacciones orgánicas, por ejemplo el éter dietílico y el tetrahidrofurano. Aminas Son derivados orgánicos del amoniaco, de la misma forma que los alcoholes y los éteres son derivados orgánicos del agua. Se nombran utilizando el sufijo amina en su nombre. Por ejemplo metilamina, dimetilamina, trimetilamina bencenamina o anilina, todos derivados del amoniaco. Al igual que el amoníaco, son compuestos básicos, el nitrógeno puede recibir un protón de un ácido para formar sales iónicas de amonio, solubles en agua, sin embargo la mayoría de las aminas por sí mismas no son solubles en agua. Esta propiedad de formar las sales iónicas, es muy útil para convertir compuestos derivados del amoníaco, como algunas drogas en sales solubles en los fluidos líquidos del cuerpo para su trasporte por el torrente sanguíneo y mejorar su asimilación. Ejercicio 8 Escriba las estructuras de las sales de amonio producidas por la reacción de las siguientes aminas con ácido clorhídrico: Plan de nivelación académica Talentos QUÍMICA 117 2.11 Aldehídos y Cetonas Se caracterizan por tener un enlace doble entre el carbono-oxígeno (C=O), conocido como grupo funcional carbonilo. Las reacciones del grupo carbonilo se observan en el figura 9. Figura 9. Reacciones del grupo carbonilo. El aldehído más simple es el metanal o formaldehído, (H2C=O) usado en procesos biológicos como esterilizante y preservante de tejidos y en la industria química como material de partida en la producción de plásticos como la bakelita y melamina y como componente de los adhesivo utilizados en el trabajo con madera. Los aldehídos y cetonas se preparan a partir de la oxidación de los alcoholes, produciéndose aldehídos de alcoholes primarios y cetonas de alcoholes secundarios. Los grupos funcionales de aldehídos y cetonas se encuentran presentes en muchos compuestos biológicos por ejemplo la mayoría de las azúcares como la glucosa tienen grupos aldehídos, y en las hormonas esteroidales se encuentran los cetónicos. H O H H H O H 2C O H C O H H O H H O Glucosa (pentahidroxihexanal) 2.12 Ácidos carboxílicos y derivados (anhídridos, esteres y amidas) Ácidos carboxílicos Los ácidos carboxílicos, los esteres y las amidas tienen los grupos carbonilos enlazados a un átomo (de oxígeno o nitrógeno) que son fuertemente atrayentes de 118 Convenio Universidad del Valle - Alcaldía de Santiago de Cali electrones. Estas 3 familias siguen reacciones de sustitución en el grupo carbonilo, donde el sustituyente Y reemplaza los grupos –OH, -OC, o –N de los grupos carbonilos. O C O C O H O C C O C C Un ester Un Ácido carboxílico N Una amida H Y H Y C H Y O C C Y Figura 10. Reacciones de sustitución del grupo carbonilo en ácidos y derivados. Los ácidos carboxílicos se encuentran tanto en el reino animal como vegetal. El ácido acético, (acido etanoíco) es el principal componente del vinagre y el ácido butanoico es el responsable del olor rancio de las mantecas envejecidas. Los ácidos carboxílicos de cadena larga como el ácido esteárico son los componentes principales de las grasas animales y los aceites vegetales. El nombre sistemático de este tipo de compuestos se deriva del alcano base con el sufijo oico, precedido de la palabra ácido. Como son ácidos ellos disocian débilmente en solución: Ión Acetato Ácido Acético Una de las reacciones más interesantes de los ácidos carboxílicos es su reacción catalizada por ácido con un alcohol, para producir un ester. Plan de nivelación académica Talentos QUÍMICA 119 Anhídridos Los anhídridos de ácido (o anhídridos carboxílicos) son compuestos químicos orgánicos de formula general (RCO)2O, formalmente son el producto de deshidratación de dos moléculas de ácido carboxílico (o una si tiene lugar de forma intermolecular en un ácido di carboxílico). Al reaccionar con agua (hidrólisis) vuelven a formar los ácidos carboxílicos de partida. Los anhídridos de ácido simétricos y mixtos son respectivamente aquellos donde los grupos acilo (RCO-) son iguales o diferentes: Anhídrido de ácido Anhídrido de ácido simétrico Anhídrido de ácido mixto Nomenclatura, para nombrar: Reconocer la cadena principal que pertenece al grupo funcional anhídrido (O). Dar el nombre de los ácidos carboxílicos de origen suprimiendo la palabra ÁCIDO. Recordar que para numerar los grupos funcionales siempre se debe empezar por el carbono que este unido al grupo funcional. Ejemplo: 120 Convenio Universidad del Valle - Alcaldía de Santiago de Cali O C O C O Anhídrido ftálico ó Anhídrido 1,2-Bencencarboxílico Esteres Anhídrido (2,2-Dimetilpropanoico)(2-metil-2propenoico) Los esteres tienen muchos usos en la medicina, (por ejemplo la aspirina), la industria (los poliésteres como el Dacrón) y en las fragancias (el olor del banano se debe al acetato de pentilo). La hidrólisis ácida o básica de los esteres rompe es grupo funcional ester y produce nuevamente el ácido carboxílico y el alcohol. Si la reacción se lleva en medio básico se conoce como saponificación. Es el proceso para la obtención del jabón. Amidas Enlace formado entre el nitrógeno y el carbonilo, se presenta fundamentalmente para formar las proteínas. Adicionalmente se consigue formando polímeros sintéticos como el nylon, en agentes farmacéuticos como el acetaminofen, sustituto de la aspirina. Plan de nivelación académica Talentos QUÍMICA 121 Acetaminofen Las amidas se sintetizan por la reacción entre un ácido carboxílico y una amina o amoníaco de igual forma como se preparan los esteres. Las amidas se nombran citando el grupo N-alquilo sobre la parte de la amina (el N porque el grupo se une al nitrógeno) y se identifica el ácido carboxílico adicionando la terminación amida. N-Metilacetamida La química de las amidas se caracteriza por la disminución de la reactividad del carbonilo y una disminución de la basicidad y nucleofilicidad del nitrógeno, originada por la interacción entre el grupo carbonilo y el par solitario del nitrógeno. Las amidas pueden reducirse a aminas tratándolas con hidruro de aluminio y litio. Ejemplo 5 Nombre sistemáticamente los siguientes compuestos: Solución Se identifica si es un derivado de alcohol o un derivado de amina y se asigna el nombre. Esta amida es derivada de la dimetilamina y el ácido benzoico. Su nombre será N, N-dimetilbenza- mida. 122 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Para el caso b, es un derivado alcohólico donde el alcohol es el propanol y el ácido el butanoico, su nombre será butanoato propílico. Ejercicio 9 a). Cuál es el producto de las siguientes reacciones? b). Dé el nombre sistemático tanto de reactivos como de productos. 1). O C H O + NH3 H C CALOR 3 2.13 Polímeros sintéticos Son moléculas formadas por el enlace repetido de muchas moléculas pequeñas conocidas como monómeros. En la naturaleza existen polímeros biológicos, por ejemplo la celulosa y el almidón son polímeros construidos de monómeros de azúcar, las proteínas son polímeros construidos de aminoácidos como monómeros. Con esta idea se producen polímeros sintéticos (ver tabla 3). Plan de nivelación académica Talentos QUÍMICA 123 Tabla3. Ejemp los de polímeros derivados de alquenos y sus usos. La formación del polímero a partir del etileno se produce por la repetición de las unidades. S Representa los sustituyentes como H, CH3, Cl, OH, ó fenilo y n cientos o miles de monómeros. El procedimiento de la polimerización de alquenos es una adición al doble enlace como se vio en las reacciones de alquenos, un iniciador se añade primero al doble enlace de un alqueno produciendo un reactivo intermedio que a su vez añade un segundo alqueno para producir otro intermediario reactivo y así sucesivamente. 124 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Otro tipo de polimerización puede ocurrir con moléculas que posean más de un grupo funcional así por ejemplo si se tiene una especie con dos grupos de ácido carboxílico y otra con dos grupos amino, se unen por sus extremos formando una amida inicial y se continúan generando uniones amida, así se produce el Nylon 66. 2.14 Ejercicios de fin de capitulo 1. Qué es un grupo funcional y por qué son importantes? 2. Identifique los grupos funcionales para: 3. Nombre utilizando las normas IUPAC los siguientes alcanos: 4. Nombre utilizando las normas IUPAC los siguientes cicloalcanos: Plan de nivelación académica Talentos QUÍMICA 125 5. Nombre utilizando las normas IUPAC los siguientes compuestos e identificar los grupos funcionales: 6. Identifique el ácido carboxílico y el alcohol que dan origen al ester: 7. Escriba las formulas condensadas de los siguientes compuestos: a). 3-Etilhexano b). 2,2,3-Trimetilpentano c). 3-Etil-3,4-dimetilheptano d). 5-Isopropil-2metiloctano e). Ciclooctano f). 1,1-Dimetilciclopentano g). 1,2,3,4-Tetrametilciclobutano h). 4-Etil-1,1-dimetilciclohexano i). 2,4-Dimetil-2-pentanol 126 Convenio Universidad del Valle - Alcaldía de Santiago de Cali j). 2,2-Dimetilciclohexanol k). 5,5-Dietil-1-heptanol l). 3-Etil-3-hexanol 8. Cuál es la diferencia estructural entre un aldehído y una cetona?. 9. Muestre la estructura polimérica obtenida de los siguientes Monoceros: a). F2C=CF2 para producir el Teflón. b). H2C= CHCO2CH3 para producir la Lucita. 10. El ácido fumarico es una sustancia orgánica usada ampliamente como un aditivo en alimentos. Su composición es 41.4% C, 3.5% H, y 55.1% O. Una solución producida al disolver 0.1500g de ácido fumarico en agua y diluida a un volumen de 100 mL eleva la presión osmótica a 240.3 mmHg a 298 K. Una muestra de 0.573 g, gasta 94.1 mL de una solución de NaOH 0.105M para llegar al punto de equivalencia, al ser titulada. El ácido fumarico reacciona con 1 mol de HCl para dar un producto de adición y con 1 mol de H2 da un producto de reducción. a). Cuál es la fórmula empírica del ácido fumarico?. b). Cuál es la masa molecular del acido fumarico?. c). Dibuje las 3 estructuras posibles del ácido fumarico. d). Sí es ácido fumarico posee un doble enlace y es trans cuál es la estructura del compuesto? Plan de nivelación académica Talentos QUÍMICA 127 Lección 3 Bioquímica 3.1 Biomoléculas y energía Su estudio genera un campo interesante que relaciona las bases de la química orgánica con la química de la vida. El uso del término bioquímica o también biomoléculas, coincide con un renovado interés en la interacción entre la química y la bioquímica durante el siglo XX. Es así que en este siglo, los bioquímicos se dedicaron a dar explicación de los procesos celulares con grandes éxitos en el entendimiento de las funciones biológicas básicas de las células, incluyendo su regulación, reproducción, producción de energía, nutrición y diferenciación. A continuación se estudiará las principales clases de biomoléculas: Proteínas, carbohidratos, lípidos, y ácidos nucleicos, iniciando con una mirada a la energética bioquímica involucrada, de donde proviene y cómo es usada por los organismos. Todas las cosas vivientes hacen trabajo físico. Los microorganismos se encuentran en las comidas, las plantas se inclinan hacia el sol, los animales se mueven a su alrededor. Los organismos igualmente realizan trabajo químico, al sintetizar las biomoléculas necesarias para almacenar la energía, crecer y repararse. Más aún, las células individuales hacen trabajo cuando ellas mueven moléculas y iones a través de la membrana celular. Los animales, extraen la energía de la comida a través de un proceso conocido como metabolismo y la utilizan para producir trabajo. Todos los animales obtienen energía al realizar la oxidación celular de las biomoléculas, las cuales contienen carbono hidrógeno y oxigeno produciendo como producto final dióxido de carbono agua y energía, de igual manera como los productos de la combustión de compuestos orgánicos, como el metano, en presencia de oxigeno en un horno. C, H, O (moléculas de los alimentos) + O2 CO2 + H2O + Energía La energía usada por la gran mayoría de los seres vivos proviene del sol. Las plantas a través de la fotosíntesis convierten la luz del sol en energía potencial 130 Convenio Universidad del Valle - Alcaldía de Santiago de Cali que almacena en los enlaces químicos de los carbohidratos. Los animales al alimentarse de plantas usan algo de esta energía para vivir y almacenan el resto, principalmente en enlaces químicos de las grasas. Otros animales, incluyendo los humanos comen plantas y animales haciendo uso de la energía química almacenada por estos organismos. El metabolismo es la suma de muchas reacciones orgánicas que ocurren en la célula. Estas pueden producirse en secuencias largas lineales o cíclicas. Cuando la secuencia es lineal, el producto de una reacción sirve de material de partida para la siguiente. En la secuencia cíclica, una serie de reacciones generan el primer reactivo y produce otros productos a lo largo de la vía. Aquellas secuencias de reacciones que rompen moléculas se denomina Catabolismo, mientras que aquellas que se unen como bloques para construir nuevas moléculas se conoce como anabolismo. Las reacciones catabólicas que generan energía son usadas por los organismos vivos como fuente de energía, mientras que las reacciones anabólicas generalmente absorben energía. La figura 1 muestra el catabolismo de los alimentos resumido en 4 etapas: Etapa 1. La digestión ocurre en el estómago y el intestino delgado donde los alimentos son degradados a moléculas pequeñas como azúcares simples, ácidos carboxílicos de cadena larga (llamados ácidos grasos); y aminoácidos. Etapa 2. Estas moléculas pequeñas siguen su degradación dentro de las céH 3C O , unida a una gran molécula llamadas = lulas produciendo grupos acetilo, C coenzima A. El compuesto resultante conocido como Acetil coenzima A (Acetil CoA), es un intermediario en la degradación de toda clase de moléculas de los alimentos. Plan de nivelación académica Talentos QUÍMICA 131 Etapa 3. Los grupos acetilo son oxidados en esta etapa del catabolismo, en el ciclo del ácido cítrico para producir CO2 y H2O. Esta etapa produce gran cantidad de energía utilizable en la siguiente etapa. Etapa 4. La coenzima reducida en la etapa 3 es oxidada por la cadena transportadora de electrones para producir moléculas como el adenosina trifosfato o ATP, siendo el ATP el producto final del catabolismo de los alimentos y es el productor biológico de energía. Figura 1. Vía catabólica para la degradación de alimentos y la producción bioquímica de energía. 132 Convenio Universidad del Valle - Alcaldía de Santiago de Cali El ATP es la fuente de energía de los seres vivos, su reacción catabólica produce: ATP ADP + HPO42- Las reacciones anabólicas gastan ATP cuando transfieren grupos fosfatos a otras moléculas regenerando ADP. Qué sucede en el cuerpo con el ATP?. Hay que recordar de las unidades anteriores, el concepto de que una reacción es espontánea cuando el cambio de energía libre (DG) para el proceso es negativo y este cambio depende de dos factores, la absorción o cesión de calor (DH) y el incremento o decrecimiento en la entropía (∆S), o sea: DG = DH - T∆S Las reacciones en los seres vivos, no son diferentes a las reacciones en el laboratorio ya vistas, se cumplen las mismas leyes, por tanto una reacción espontánea, el DG debe ser negativo. Así por ejemplo la oxidación de 1 mol de glucosa, la fuente más importante de energía en los animales tiene un DGº = -2870 kJ. Ocurre sin embargo que reacciones energéticamente desfavorable como es la conversión de glucosa en glucosa-6-fosfato. Plan de nivelación académica Talentos 133 QUÍMICA Solo puede ocurrir si está involucrada con otra reacción quien aporte la energía, dando como producto final lo deseado. Aquí interviene el ATP, el cual en presencia de agua produce: ADP + HPO42- + H+ ATP + H2O ∆Gº = - 30.5 kJ El acople de las dos reacciones hace posible la conversión de glucosa en glucosa-6-fosfato, porque es favorable en 16.7kJ. O P Glucosa + H 2 4 ATP + H2O Glucosa-6 -fosfato H + 2O ADP + HPO42- + H+ ∆Gº = +13.8 kJ ∆Gº = -30.5kJ Glucosa-6 -fosfato + ADP + H+ ∆Gº = -16.7 kJ Glucosa + ATP Es así como el ATP permite que una reacción no favorable sea posible en los seres vivos. 3.2 Proteínas Derivado del griego proteios que significa primaria o del dios proteo, describe un grupo de moléculas biológicas de importancia primaria en los organismos vivos. Cerca del 50% del peso en seco de un cuerpo es proteína y casi todas las reacciones que ocurren en el cuerpo son catalizadas por proteínas. En efecto, el cuerpo humano contiene alrededor de 100000 clases diferentes de proteínas. Las proteínas tiene diferentes funciones biológicas, algunas como la queratina en la piel, el cabello y las uñas de los dedos, tienen propósitos estructurales, otros, como la insulina controla el metabolismo de la glucosa; cuando actúa como una hormona (mensajero químico) coordina la actividad de diferentes células en un organismo. Todas las proteínas son polímeros biológicos cuya unidad monómero corresponde a moléculas de aminoácidos que enlazados forman grandes cadenas. Los aminoácidos poseen 2 grupos funcionales, un grupo amino básico (-NH2) y un grupo ácido (-CO2H). La Alanina es un aminoácido sencillo, cuando se unen dos o más aminoácidos forman un enlace amido, conocido como enlace peptídico. Estos enlaces peptídico son esencialmente unidades planares que usualmente existen en la configuración trans como se muestra en la figura 2. O O Cα C Cα N H C Cα + N H Figura 2. Enlace peptídico. Cα 134 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Las proteínas poseen combinaciones de 20 aminoácidos diferentes, (ver adelante), cada uno de ellos se identifica por 3 letras y difieren únicamente por la naturaleza del grupo unido al carbono alfa (α), esta cadena lateral se simboliza en general por la letra R. El cuerpo humano requiere incorporar al organismo en su alimentación diaria los 10 aminoácidos que aparecen resaltados en el esquema 3, conocidos como esenciales. Los más problemáticos de tener en la dieta son el triptófano, la lisina y la metionina, en especial en poblaciones cuya base alimenticia es de tubérculos y cereales, porque no los contiene. Por ejemplo el maíz tiene poca cantidad de lisina. A continuación se muestra el listado de los 20 aminoácidos: Plan de nivelación académica Talentos QUÍMICA 135 136 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Ejemplo1 Identifique en los aminoácidos listados anteriormente, sí las cadenas laterales son básicas, neutras o polares neutras. En el caso de la leucina esta contiene una cadena lateral hidrocarbonada la cual no posee grupos ricos en electrones o pobres en electrones. Es un aminoácido hidrocarbonado (Neutro). Con este ejemplo, complete el análisis del resto como ejercicio. Recordando que una molécula quiral no es idéntica a su imagen espejo, y se caracterizan por rotar la luz polarizada a la derecha o a la izquierda, se puede comparar la alanina con el propano. La alanina al rotar la luz polarizada a la derecha se conoce como dextrógiro y si la rota a la izquierda será levógiro, esto se debe a que el plano que contiene los 3 carbonos con geometría tetrahedral, los grupos adicionales de la alanina quedan de uno y del otro lado del plano, son diferentes, por lo tanto al hacerse su imagen y sobre imponerse una en la otra no coinciden, de ahí que se les llame compuestos quirales. En el caso del propano, igualmente se tiene 3 carbonos en el plano pero los átomos por encima y debajo del plano son los mismos (H) por lo tanto al sobreponer el uno en el otro quedan indistinguibles por eso se les conoce como a-quirales. Figura 3. Formas enantiómeras de C unido a 4 grupos diferentes Figura 4. Representación estructural de un aminoácido Plan de nivelación académica Talentos QUÍMICA 137 Cuando las dos formas de una molécula quiral se encuentran presente tenemos enantiomeros o isómeros ópticos. En la figura 3 se observa la imagen de una molécula de carbono quiral con 4 diferentes grupos unidos a él. De los 20 aminoácidos, 19 son quirales, porque los 4 enlaces al carbono α son diferentes. Tan solo la glicina es aquiral. Ejercicio 1 Para cada uno de los aminoácidos de la figura 3 dibuje la estructura correspondiente siguiendo el modelo de la figura 4. Ejemplo 2 El ácido láctico se puede aislar del suero de la leche, es el ácido láctico un ácido quiral?. Sí observamos los 3 carbonos que constituyen el ácido láctico, cada uno de ellos, con sus grupos acompañantes se observa que de los 3 carbonos tan solo el carbono numero 2 posee los 4 grupos diferentes, por lo tanto es un compuesto quiral. Ejercicio 2 Cuál de las siguientes moléculas es quiral?. a). 3-Cloropentano b). 2-Cloropentano c). Ejercicio 3 De los 20 aminoácidos, hay dos de ellos que tienen 2 átomos de carbonos quirales en su estructura, identifíquelos. 3.3 Estructura de las proteínas Las proteínas son polímeros naturales formados por la unión de aminoácidos a través de enlaces peptídicos. Esta primera unión donde se distinguen cuales son aminoácidos constituyentes del polímero se conoce como la estructura primaria 138 Convenio Universidad del Valle - Alcaldía de Santiago de Cali del polímero, es la más importante de las 4 estructuras de la proteínas porque es la que determina su forma y su función. Un cambio de un solo aminoácido en la cadena produce cambios drásticos en las propiedades biológicas. Figura 5. Estructura primaria de un polipéptido. Observe que esta cadena de aminoácidos posee de lado y lado de la cadena principal átomos de oxigeno y de hidrógeno (Figura 5), esto le permite orientarse en patrones regulares que se denomina estructura secundaria. Dos clases de estos patrones son las alfa hélices y las hojas beta plegadas (Figura 6, 7). Las alfa hélices estabilizan la estructura por la formación de enlaces puente de hidrógeno entre el grupo N_H de un aminoácido con un grupo CO de otro aminoácido. Esta unión hace que la cadena se enrolle como una hélice. La keratina una proteína fibrosa es un ejemplo de estas proteínas y se encuentra en las uñas, la lana, el pelo. Plan de nivelación académica Talentos QUÍMICA 139 Figura 6. Estructura secundaria de alfa hélice. La proteína fibrosa encontrada en la lana conocida como fibrina, tiene una estructura de hoja beta plegada. Las dos secciones de la cadena se enlazan en arreglo paralelo uno junto a otro a través de enlaces de hidrógeno. Figura 7. Estructura secundaria en forma de hoja beta plegada. Una estructura terciaria y cuaternaria se obtiene de las interacciones de los grupos R de las cadenas laterales, por ejemplo la Mioglobina es una proteína globular que une varios segmentos de estructuras secundarias. En la figura 8 se observan ejemplos de posibles interacciones entre distintos tipos de grupos R en los aminoácidos que permiten la formación de estructuras terciarias y cuaternarias para las proteínas. Figura 8. Estructuras de las proteínas. 140 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Figura 9. Distintos tipos de enlace entre segmentos de proteínas. Enzimas Así se conocen a grandes proteínas que actúan como catalizadores en reacciones biológicas. Como se estudio en la unidad de cinética, un catalizador es un agente que acelera la velocidad de la reacción sin consumirse. Aquí también las enzimas catalizan reacciones que ocurren lentamente y se caracterizan por ser grandes y complicadas moléculas al contrario de los catalizadores vistos en procesos inorgánicos. La segunda característica de las enzimas es que solo actúan en un tipo de reacción, por ejemplo la amilasa encontrada en el sistema digestivo humano solo cataliza el rompimiento del almidón para producir glucosa y aunque la estructura del almidón y la celulosa son similares, no actúa en la celulosa. 3.4 Carbohidratos Están presentes en cada organismo vivo. Un ejemplo de ellos son el almidón en las comidas y la celulosa en las plantas. Los carbohidratos modificados forman parte de la pared celular de los seres vivos y otros se encuentran haciendo parte del DNA portador de la información genética de una generación a la siguiente. Los carbohidratos se clasifican en simples y complejos. Los simples son los azúcares o monosacáridos como la glucosa y la fructuosa los cuales son el producto final de la hidrólisis ácida de los polisacáridos. Los monosacáridos se clasifican en aldosas, aquellos que contienen un aldehído como grupo carbonilo y cetosas los que contienen un grupo cetónico como grupo carbonilo. Plan de nivelación académica Talentos QUÍMICA 141 Los carbohidratos se nombran usando el sufijo osa unido al azúcar, especificando el numero de átomos de carbono del azúcar con los prefijos multiplicativos. Por ejemplo la glucosa es una aldohexosa (azúcar con 6 carbonos) la fructosa es una cetohexosa (azúcar de 6 C con un grupo ceto). Hexosas Las hexosas son monosacáridos (glúcidos simples) formados por una cadena de 6 átomos de carbono. Su fórmula general es C6H12O6. Su principal función es producir energía. Un gramo de cualquier hexosa produce unas 4 kilocalorías de energía. Las más importantes desde el punto de vista biológico son: glucosa, galactosa y fructosa. Estructuras Fischer de las cetohexosas, en la naturaleza sólo se conocen cuatro D-isómeros: D-psicosa D-fructusa D-sorbosa Estructuras Fischer de las aldohexosas: D-tagatosa 142 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Pentosas Las pentosas son monosacáridos (glúcidos simples) formados por una cadena de 5 átomos de carbono. Como en los demás monosacáridos aparecen en su estructura grupos hidroxilo (OH). Además, también pueden llevar grupos cetónico o aldehídos. La fórmula general de las pentosas es C5H1005. A continuación se citan algunas pentosas: Aldopentosas: como su nombre lo indica contienen la función aldehído. Una de las más importantes es la ribosa, la cual hace parte de los nucleótidos que forman el ARN. A partir de la ribosa se puede obtener la desoxirribosa, la cual forma parte del ADN. Cetopentosas: contienen la función cetona. Plan de nivelación académica Talentos QUÍMICA 143 Ejercicio 4 Clasificar cada uno de los siguientes monosacáridos: Los azúcares se pueden presentar en forma cíclica cuando se cierra a través del grupo –OH del C5 con el grupo C=O del C1 como se observa en la figura 10. Figura 10. Glucosa cíclica. Dependiendo por donde se une, el grupo OH puede quedar por encima o por debajo del plano del anillo, lo que produce dos tipos de glucosa la α-glucosa y la β-glucosa, como se observa en la figura 10. Ejemplos de disacáridos y polisacáridos se observa en la Figura 11. 144 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Figura 11. Ejemplo de disacáridos y polisacáridos. Lípidos 3.5 Lípidos Su importancia biológica tiene varios aspectos: Plan de nivelación académica Talentos QUÍMICA 145 Sirven como fuente para el almacenaje de energía. Sirven como cubierta protectora en plantas e insectos. Son el componente mayoritario de las membranas que rodean cada célula viva. Figura 12. Ejemplo de lípidos. Químicamente un lípido es una molécula orgánica que se encuentra en la naturaleza, disuelve en solventes orgánicos no polares, de acuerdo a su solubilidad (una propiedad física) se les clasifica en triglicéridos los cuales forman las grasas y los aceites; los esteres de glicerol (1,2,3-propanetriol) se les conoce como ácidos grasos, que se caracterizan por no poseer ramificaciones y tener un numero par (de 12-22) átomos de carbono. Tabla 1. Estructura de algunos ácidos grasos. 146 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Ejercicio 5 Cuál es el producto de reacción del oleico con hidrógeno? 3.6 Esteroides Un esteroide es un lípido cuya estructura está basada en un sistema tetra cíclico (4 anillos) como se observa en la figura 12. Figura 13. Ejemplo de esteroides. Los esteroides tienen diversos papeles tanto en el reino vegetal como animal, así por ejemplo la digitoxigenina, aislada de la Digitalis purpurea se usa en medicina como un estimulante del corazón. El colesterol mostrado en la figura 10 es el esteroide más abundante entre los animales, este esteroide tiene dos funciones importantes, la primera mantener los fluidos líquidos la segunda es el material de partida para la síntesis de otros esteroides, incluyendo las hormonas sexuales. 3.7 Ácidos nucleicos Son los portadores químicos de la información genética. Se conoce como ácido desoxirribonucleico (DNA) y el ácido ribonucleico (RNA). Al igual que las proteínas son polímeros de unidades de nucleótidos cuya formación se observa en el siguiente esquema. Plan de nivelación académica Talentos QUÍMICA 147 En la tabla 11 se observan las bases pirimidínicas y purinas encontradas en el DNA y el RNA. 148 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Tabla 2. Purinas, pirimidinas, azúcares encontrados en el DNA y RNA. Lección 4 Aire, agua y suelo 4.1 Introducción En las unidades previas se ha estudiado las definiciones básicas en química, y examinado las propiedades de los 3 estados de la materia: gases, líquidos los sólidos y las soluciones, como están constituidos a nivel microscópico (estructura atómica y enlace) y como se comportan a nivel microscópico (Termodinámica, cinética, equilibrio químico e iónico y propiedades de las soluciones), con este conocimiento se entiende la naturaleza de las reacciones químicas. Se aplica en esta unidad todos estos conocimientos a los constituyentes más importantes para los seres vivos, como son el aire, el agua y el suelo, dado que todos los seres vivos para poder existir requiere de estos tres, porque los seres vivos para existir requieren del aire, están constituidos en más del 70% por agua y todos los complementos requeridos para su supervivencia los encuentra en la tierra. Es así como los humanos están preocupados en los últimos años por los procesos de contaminación que por los procesos industriales, el aumento de la población concentración en las grandes ciudades, al igual que la explotación minera ha originado la contaminación tanto del aire, el agua y el suelo. El tener conocimiento en química, te ofrece las herramientas para entender los procesos de contaminación y ayudar a dar solución a la recuperación del aire, el agua y el suelo. Para su logro, se hace necesario conocer la composición general del aire el agua y el suelo, y las propiedades de estos. Ejercicio 1. Escriba un listado de las propiedades del agua relacionadas con los temas explorados en las unidades anteriores. 4.2 Aire La tierra es el único planeta rodeado de una atmosfera químicamente activa y rica en oxigeno, a la cual se llegó después de muchas transformaciones químicas durante muchísimo tiempo. Se calcula que la masa total de la atmosfera que rodea la tierra pesa alrededor de 5.3x1018 Kg. La atmosfera tiene una composición (ver 150 Convenio Universidad del Valle - Alcaldía de Santiago de Cali tabla 1) donde se muestra que sus principales componentes son el Nitrógeno con un 78.03% y de Oxígeno 20.99%, de ahí que estos dos elementos en la naturaleza se pueden obtener por destilación fraccionada de estos gases. Tabla 1. Composición del aire seco a nivel del mar. Aunque el aire contiene vapor de agua, la lectura se reporta en seco, dado que el porcentaje de agua depende del lugar donde se realice la medidaPara su estudio, los científicos han dividido la atmosfera en 4 regiones: 1. Troposfera: es la capa de la atmosfera más visible que contiene alrededor del 80% de la masa total del aire y casi todo el vapor de agua de la atmósfera. Es la región más delgada de la atmosfera (10 km) y es donde ocurren todos los fenómenos que influyen en el clima, como la lluvia, las tormentas los huracanes. En esta región, la temperatura disminuye casi linealmente con el incremento de altitud, por eso la temperatura en las altas montañas es más baja. 2. Estratósfera: compuesta por nitrógeno oxígeno y ozono, se encuentra por encima de la troposfera. En esta región, la temperatura del aire aumenta con la altitud, debido a las reacciones exotérmicas provocadas por la radiación UV del sol, es por esto que aquí se encuentra ozono, al reaccionar O2 + hn Þ O + O, cuando cada átomo formado reacciona con mas oxigeno molecular se produce ozono. Ejemplo 1 La energía de disociación de enlace del O2 es de 498.7 kJ/mol. Calcule la longitud de onda máxima (nm) de un fotón que puede disociar una molécula de O2. Solución Calcular la energía necesaria para romper una molécula de O2. Como la energía de un fotón está dada por E = hn, la frecuencia õ = E , (re h vise estructura, factores de conversión, constante de Planck, velocidad de la luz). Plan de nivelación académica Talentos v= QUÍMICA E 8.281x10 −19 J = = 1.25 x10 h 6.63 x10 −34 Js 15 151 s −1 Como se pregunta por la longitud de onda del fotón, dada por la relación λ=c/ν 3.00x10 8 m s ë= = 2.40x10 −7 m = 240 nm 15 −1 1.25x10 s Ejercicio 2 Calcule la longitud de onda de un fotón (en nm), necesaria para disociar una molécula de ozono. O3 Þ O + O2 DHº = 107.2 kJ. 3. Mesosfera: se encuentra por encima de la estratosfera, aquí la concentración de ozono y otros gases es baja y la temperatura disminuye a medida que aumenta la altitud. 4. Termosfera o Ionosfera: Es la capa más externa de la atmósfera. En ella aumenta la temperatura en la medida que se aumenta la altitud, esto se produce porque ocurren una serie de reacciones de partículas energéticas provenientes del sol como electrones y protones con nitrógeno y oxigeno molecular y otras especies atómicas. Las reacciones características son: N2 ⇒ 2N N ⇒ N* + e O2 ⇒O2* + e DHº = 941 kJ DHº = 1400 kJ DHº = 1176 kJ Las auroras boreales se producen por la energía producida por estas reacciones, los tintes rojizos y verdes que aparece se deben a la descomposición de O* Þ O + hv. Ejercicio 3 Realice la configuración electrónica del Oxígeno, señale si tiene electrones desapareados y cuantos. Figura 1. Regiones de la atmósfera. 152 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Ejercicio 4 De acuerdo a los datos de la tabla 1, calcule la fracción molar del CO2 y su concentración en ppm en volumen. Ejercicio 5 Calcule la presión parcial del CO2 (en atm) en el aire seco cuando la presión atmosférica es de 754 mm de Hg. Ejercicio 6 Cuál es la hibridización y la geometría del CO2?. Ejercicio 7 Dos recipientes, M y N contienen oxígeno y nitrógeno, respectivamente, como se ve en el esquema: Si se abre completamente la llave de paso, dibuje un grafico que represente la variación de presión con el tiempo. Ejercicio 8 Realice el diagrama de energía de orbital molecular que represente Nitrógeno molecular. Cuál es su orden de enlace? Ejercicio 9 En el siguiente esquema se muestra un proceso de compresión de un gas X en un cilindro. Plan de nivelación académica Talentos QUÍMICA 153 a). Si se aumenta la presión sobre el gas, cuál es el resultado?. b). Si disminuye la presión sobre el líquido X, cuál es el resultado?. 4.3 Agua c). Si tiene un mol de X a 300 K y ocupa un volumen de 0.5L, cuál es la presión?. El agua es líquido sin color e insípido que cubre cerca del 71% de la tierra (Figura 2). El 97 % del agua en la tierra es agua salada y el otro 3% es agua dulce (Figura 2, Tabla 2,3). La mayor parte del agua dulce se encuentra congelada en el Polo Norte y el Polo Sur. Cerca de la tercera parte del de agua dulce está en ríos, en las corrientes, en los acuíferos, y en las vertientes que forman parte del agua potable (Tabla 3). Figura 2. Distribución del agua en la tierra. 154 Convenio Universidad del Valle - Alcaldía de Santiago de Cali Iones Cloruro (Cl-) Sodio (Na+) Sulfato (SO42) Magnesio (Mg2+) Calcio (Ca2+) Potasio (K+) Bicarbonato (HCO3-) g/kg de agua de mar 19.35 10.75 2.75 1.29 0.41 0.39 0.14 Tabla 2. Composición del agua de mar. Porcentaje Porcentaje de agua de agua total dulce Océanos, mares y bahías 1.338.000.000 96.5 Casquetes polares, glaciares y nieves 24.064.000 68.7 1.74 eternas Aguas subterráneas 23.400.000 1.7 Dulce 10.530.000 30.1 0.76 Salina 12.870.000 0.94 Humedad del suelo 16.500 0.05 0.001 Tierras congeladas 300.000 0.86 0.022 Lagos 176.400 0.013 Dulce 91.000 0.26 0.007 Salina 85.400 0.006 Atmosférica 12.900 0.04 0.001 Agua de Pantano 11.470 0.03 0.0008 Ríos 2.120 0.006 0.0002 Agua Biológica 1.120 0.003 0.0001 TOTAL 1.386.000.000 100 Fuente de Agua Volumen de agua, en Km3 Tabla 3. Estimado de agua en la tierra. Propiedades físicas y químicas del agua Plan de nivelación académica Talentos QUÍMICA 155 Tabla 4. Propiedades físicas del agua Propiedades químicas del agua El agua es compuesta de hidrógeno y oxígeno, en una razón de dos átomos de hidrógeno y un átomo de oxígeno en ella. Se caracteriza porque el oxígeno como átomo central, hibridiza sp3 uniéndose a través de dos enlaces covalentes sigma con dos átomos de hidrógeno y dejando 2 pares de electrones no enlazante, lo cual le otorga una geometría angular, con ángulo de 104.5º (Figura 3). Un listado de sus propiedades químicas se muestra en la tabla 5. Figura 3. Molécula de agua. Tabla 5. Propiedades químicas del agua. 156 Convenio Universidad del Valle - Alcaldía de Santiago de Cali 4.4 Ciclo del agua Cuando llueve, el agua cae del cielo y se acumula en los charcos. El calor del sol la convierte en diminutas gotitas, las cuales se elevan en el aire. Este proceso se denomina evaporación y las gotitas se llaman vapor de agua, el sol no solo evapora el agua de los charcos, imagínate que cada año, por efecto del calor, se evaporan más de 500.000 kilómetros cúbicos de agua proveniente del mar, de los ríos y de los lagos (Figura 4). El sol evapora el agua de los océanos, ríos y lagos, este vapor asciende en el aire. Mientras más sube, más frío es el aire, y cuando es muy frío empieza a formar nubes, porque el vapor de agua se condensa en el aire frío y se forman gotas de agua. En ciertas condiciones atmosféricas, las pequeñas gotas las cuales están formando las nubes, se agrandan, y cuando se vuelven pesadas para permanecer en el aire, caen en forma de lluvia, granizo o nieve. Una parte de esa agua se evapora de nuevo apenas cae. Parte del agua que alcanza el suelo permanece en la superficie, otra es absorbida por el suelo. Una parte del agua que penetra en el subsuelo es absorbida por las raíces de las plantas y, una vez utilizada por ésta en su ciclo vital, forma parte del círculo de la atmósfera en forma de vapor (Figura 4). Figura 4. Ciclo del agua. El agua es considerada como el solvente universal. Sus propiedades fisicoquímicas se han relacionado en las tablas 4 y 5 y en la unidad 6 se puede revisar su comportamiento líquido. Plan de nivelación académica Talentos QUÍMICA 157 Con este concepto se pueden preparar soluciones de distintas concentraciones, las cuales adquieren propiedades características como solución. Ejemplo 2 El ácido clorhídrico se vende comercialmente como una solución 12.0 M. Cuántas moles de HCl hay en 300.0 mL de la solución 12.0M?. Solución Moles de HCl = (Molaridad de la solución) x (volumen de la solución) 12.0 mol HCl X 0.3000L = 3.60 mol HCl = 1L Ejercicio 10 Cuántas moles de soluto están presentes en las siguientes soluciones?. a). Un volumen de 125 mL de NaHCO3 0.20 M. b). Un volumen de 650 mL de H2SO4 2.5 M. Una propiedad intensiva no depende de la cantidad de muestra, mientras que una propiedad extensiva depende de la cantidad de muestra. Ejercicio 11 Las soluciones del ejercicio anterior se consideran intensivas o extensivas?, explique. Ejercicio 12 Cuántos gramos de soluto se requieren para preparar las siguientes soluciones?. a). Preparar 500 mL de una solución 1.25 M de NaOH. b). Preparar 1.5 L de una solución de glucosa 0.250M. Ejercicio 13 Calcule el pH de las soluciones preparadas en el ejemplo 2 y el ejercicio 12 literal a). Ejercicio 14 Teniendo como base el diagrama de fases para el agua dado en la unidad 6, indique qué sucede cuando una muestra de agua sigue los siguientes cambios: a). La temperatura se reduce de 49º C a -4.4º C a una presión constante de 6.5 atm b). Cuando la presión se incrementa de 86 a 226 atm a una temperatura constante de 390º C. 158 Convenio Universidad del Valle - Alcaldía de Santiago de Cali 4.5 Suelos La química plantea la formación de los suelos a través de una serie de reacciones químicas que ocurren en el ambiente El agua, el dióxido de carbono y el oxígeno producen la desintegración de las rocas. Estos elementos se introducen en el terreno para producir cambios químicos como la oxidación entre otros. Podemos agregar a la acidificación producida por el aumento de las precipitaciones y entre otros procesos químicos que aportan a la creación de los suelos la Hidrólisis, la Carbonatación, etc. Al igual que el aire y el agua, los suelos pueden sufrir contaminación debida al mal uso o alteración del mismo. De la composición de los suelos, los cuales pueden ser ricos en cierto tipo de minerales se obtienen los elementos conocidos en la tabla periódica, es así como se obtienen 46 elementos que conforman los elementos del grupo principal, subdivididos en los elementos del bloque s y del bloque p, porque completan la capa s y la capa p. Adicionalmente a estos elementos, se tienen en los suelos minas ricas en los elementos de transición, que se caracterizan por completar la capa d, y los elementos de transición interna, que completan la capa f. Como se observa, todos estos elementos están formando una serie de compuestos que vamos a encontrar en los suelos. Estos se dieron por una gran cantidad de reacciones químicas que para entenderlas mejor se han clasificado en varios tipos. 4.6 Tipos de reacciones químicas 1. Según la forma de intercambio de los átomos para generar diferentes productos, estas pueden ser: a. Reacción de combinación Es aquella en la que se unen dos o más reactivos para dar un solo producto: C + O2 → CO2 b. Reacción de descomposición Es aquella en la que a partir de un solo reactivo se obtienen varios productos: CaCO3 → CaO + CO2 c. Reacción de sustitución sencilla Es aquella en la que un elemento sustituye a otro que forma parte de un compuesto, liberándose este elemento. 2 HCl + Zn → ZnCl2 + H2 Plan de nivelación académica Talentos QUÍMICA 159 d. Reacción de doble sustitución Es aquella en la que dos compuestos intercambian algunos de sus elementos: HCI + NaOH → NaCl + H2O e. Reacción de cambio isomérico o reagrupamiento interno Es la transformación de un compuesto en otro, manteniéndose la cantidad inicial de cada uno de los elementos: NH4CNO → (NH2)2CO Ejercicio 15 La reacción entre el litio y el flúor produce fluoruro de litio, un polvo blanco venenoso que se usa para disminuir el punto de fusión de la soldadura y en la fabricación de cerámica. a). Cuál es la configuración electrónica del litio y la del flúor?. b). Identifique de acuerdo a su configuración electrónica la posición en la tabla periódica. c). De acuerdo a las propiedades periódicas, qué tipo de enlace produce la combinación de litio con flúor?. d). Clasifique el tipo de reacción a que pertenece. 2. De acuerdo al tipo de proceso químico que tenga lugar: a. Reacción de formación Es aquella en la que se obtiene un mol de un compuesto a partir de sus elementos componentes en su forma más estable. (Las reacciones de formación son todas reacciones de combinación): S + 2 O2 + H2 → H2SO4 H2 + ½ O2 → H2O b. Reacción de combustión Es aquella en la que un compuesto reacciona con el oxígeno (se quema), obteniéndose los correspondientes óxidos. Si se quema un compuesto orgánico se forman siempre agua y óxido de carbono (IV), ya que está compuesto por carbono e hidrógeno. CH4 + 2O2 → CO2 + 2H2O S + O2 → SO2 c. Reacción de neutralización Es aquella en la reaccionan un ácido con una base (hidróxido), obteniéndose siempre la sal correspondiente y agua: 160 Convenio Universidad del Valle - Alcaldía de Santiago de Cali H2SO4 + 2NaOH → Na2SO4 + 2H2O d. Reacción de oxidación-redacción (redox) Es aquella en la que cambia el número de oxidación de algunos de los elementos que intervienen en ella: 10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O Cambia el yodo pasa de estado de oxidación 0 a -5 y el nitrógeno pasa de estado de oxidación +5 a +4. Recuerde la asignación de los estados de oxidación. Ejercicio 16 Señale los tipos de enlace en los siguientes compuestos, indique su estado de agregación. Proponga para cada compuesto como obtenerlo a partir de sus elementos constitutivos. a). HCl, H2O, NH3 b). CH4, CO2, SiCl4 c). NaCl, MgCl2, KBr d). HBr, Cl2, HF e). Si un compuesto iónico se forma entre átomos que tengan una amplia diferencia de electronegatividad (metales y no metales), el metal pierde electrones y forma un ion positivo (catión), el no metal capta electrones y forma un ión negativo (anión). La atracción entre estos iones de distinta carga es lo que se conoce como enlace iónico, identifique en de los literales anteriores cuáles son ejemplos de este tipo de compuesto, indicando el número de oxidación involucrado para cada elemento. 3. Atendiendo al intercambio de energía que tenga lugar: a. Reacción exotérmica Es aquella en las que se produce un desprendimiento de energía en forma de calor. b. Reacción endotérmica Aquella en la que es necesario suministrar calor a los reactivos para que se produzcan. Absorben energía. Ejercicio 17 Relacione cada uno de los siguientes cambios de energía con cada uno de los siguientes procesos: energía de ionización, afinidad electrónica, energía de enlace y entalpía estándar de formación: Plan de nivelación académica Talentos QUÍMICA 161 a). F(g) + 1 e Þ F-(g) b). F2 Þ 2F(g) c). Na(g) Þ Na+(g) d). Na(s) + ½F(g) Þ NaF(s) Señale para las reacciones anteriores cuales serian exotérmicas y cuales endotérmicas. Una ecuación química completa y balanceada, además de permitirnos conocer cuáles son los reactivos y cuales los productos, nos indica las cantidades relativas de los mismos participantes en la reacción, cantidades que pueden expresarse en términos de moléculas, moles, gramos e incluso unidades de volumen si se trata de gases. Así, de la reacción de combustión del butano: 2 CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l) ∆H = - 890 KJ Podemos obtener la siguiente información: 1- Reactivos y productos: El metano gas reacciona con el oxígeno, también gas, para formar dióxido de carbono gaseoso y agua líquida, desprendiéndose calor en el proceso. 2- Cantidades que intervienen: Se produce la reacción entre un mol de metano (12 + 2.1 = 16 gramos = 22,4 litros a condiciones normales) con 2 moles de oxígeno (2.32 = 64 g = 2.22,4 = 44,8 litros a condiciones normales) originándose 1 mol de dióxido de carbono (12 + 16.2 = 44 gramos = 22,4 litros a condiciones normales), 2 moles de agua líquida (1.2 + 16 = 18 gramos) a la vez que se desprenden 890 kJ en el proceso. Por tanto, es necesario ajustar todas las ecuaciones químicas antes de proceder a realizar cualquier tipo de cálculo en ellas. Para ajustar estas reacciones, pueden utilizarse varios métodos generales, como son: 1. Ajuste por “tanteo”: colocando aleatoriamente los coeficientes hasta conseguir el ajuste. Es útil y rápido en ecuaciones sencillas. a. Reacciones ácido-base, en las que deben colocarse unos coeficientes tales que nos den el mismo número de H+ que de OH-: 162 Convenio Universidad del Valle - Alcaldía de Santiago de Cali H2SO4 + Al(OH)3 → Al2(SO4)3 + H2O A la izquierda de la ecuación se tiene 3 grupos hidroxilo (OH-) y 2 protones (H+), el mínimo común múltiplo de estos dos números es 6, por lo tanto debe multiplicarse ambos reactivos por 3 y 2 respectivamente para igualar el número total de H+ y OH-, ajustando los demás coeficientes de la derecha, resultando: 3H2SO4 + 2 Al(OH)3 → Al2(SO4)3 + 6 H2O b. Reacciones de combustión: en la que un compuesto se combina con oxígeno para dar los óxidos correspondientes a todos los elementos que lo componen: CH4 + O2 → CO2 + H2O En las que deben igualarse primero los elementos formadores de óxidos dejando siempre para el final el Oxígeno: CH4 + 2O2 → CO2 + 2 H2O 2. Ajuste por el “método algebraico o de los coeficientes”: este método se basa en la aplicación de un balance de materia para todos y cada uno de los elementos que intervienen en el proceso. En él, se colocan unos coeficientes delante de cada uno de los reactivos y productos tales que hagan que el número de átomos de cada elemento en los reactivos y productos sea el mismo. Para aplicarlo correctamente hemos de seguir los pasos siguientes: a- Se escriben correctamente las fórmulas de los reactivos y productos que intervienen en la reacción. b- Se coloca delante de cada símbolo o fórmula un coeficiente: a, b, c, d, ... c- Teniendo en cuenta que el número de átomos de cada elemento ha de ser el mismo a ambos lados de la ecuación química, se establece una ecuación para cada uno de los elementos que intervienen en el proceso, igualando el número de átomos de cada uno, en ambos lados de la ecuación. d- Normalmente aparecerán más incógnitas que ecuaciones, por lo que le asigna un valor a uno de los coeficientes (puede darse cualquier valor a cualquier coeficiente) y se resuelve después el sistema. Plan de nivelación académica Talentos QUÍMICA 163 e- Si las soluciones obtenidas son números fraccionarios, se multiplican todos ellos por un número tal que los convierta en números enteros. f- Se sustituyen los valores obtenidos en la ecuación química dada, con lo que tendremos ya la ecuación estequiométrica que representa el proceso. Ejercicio 18 Balancear las siguientes reacciones: a). K2Cr2O7 + SO2 + H2SO4 → KCr(SO4)2 + H2O b). KMnO4 + HCI → MnCl2 + KCl + Cl2 + H2O c). K2Cr2O7 + H2S + H2SO4 → K2SO4 + Cr2(SO4)3 + S + H2O d). KMnO4 + H2O2 + H2SO4 → MnSO4 + K2SO4 + O2 + H2O e). HNO3 + HCl → Cl2 + ClNO + H2O f). As + NaClO + H2O → NaCl + H3AsO4 g). Cr(OH)3 + NaClO + Na2CO3 → Na2CrO4 + NaCl + H2O + CO2 h). PbO2 + HI → I2 + PbI2 + H2O i). KMnO4 + H2SO4 + Na2C2O4 → MnSO4 + K2SO4 + Na2SO4 + CO2 + H2O j). K2Cr2O7 + HCI → CrCI3 + Cl2 + KCI + H2O k). MnO2 + NaCl + H2SO4 → MnSO4 + Na2SO4 + Cl2 + H2O l). Crl3 + Cl2 + NaOH → Na2CrO4 + NaIO4 + NaCl + H2O m). FeS2 + O2 → SO2 + Fe2O3 Ejercicio 19 Se hacen reaccionar 5 g de un mármol que contiene un 73% de carbonato de calcio con una disolución de ácido clorhídrico del 20% en peso. Calcular la cantidad de cloruro de calcio que se formará. Cuántos litros de oxido de carbono (IV) medidos en condiciones normales se obtendrán?, cuánto ácido clorhídrico se necesitará?. Respuesta: 4,05 g CaCl2; 0,82litros CO2; 13,3 g de HCl del 20% 164 Convenio Universidad del Valle - Alcaldía de Santiago de Cali BIBLIOGRAFíA McMURRY, J; FAY, R.C. Chemistry. 4ed. New Jersey Prentice Hall, 2001, Cap 10, 19, 20. CHANG, R. Quimica General 7ed. Mexico:McGraw-Hill .2001. http://www.redaguas.unalmed.edu.co/default.php?link=recursos&sub=suelo &item=tipos Revisada enero 2011.