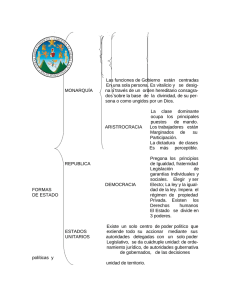
Química General
Anuncio
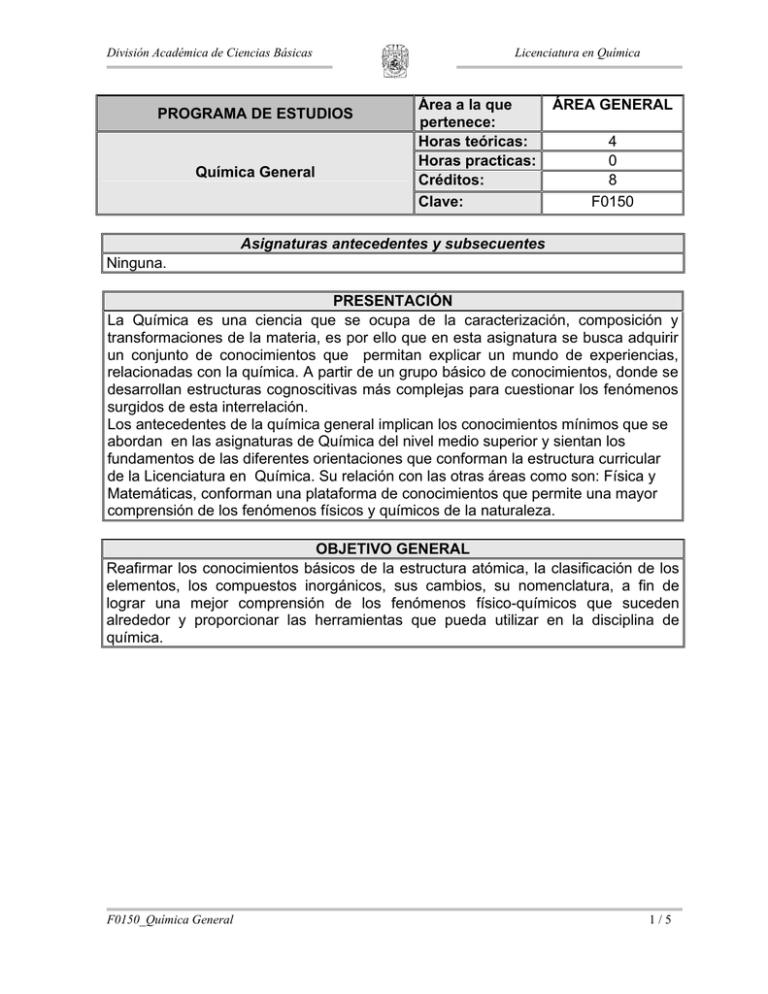
División Académica de Ciencias Básicas PROGRAMA DE ESTUDIOS Química General Licenciatura en Química Área a la que pertenece: Horas teóricas: Horas practicas: Créditos: Clave: ÁREA GENERAL 4 0 8 F0150 Asignaturas antecedentes y subsecuentes Ninguna. PRESENTACIÓN La Química es una ciencia que se ocupa de la caracterización, composición y transformaciones de la materia, es por ello que en esta asignatura se busca adquirir un conjunto de conocimientos que permitan explicar un mundo de experiencias, relacionadas con la química. A partir de un grupo básico de conocimientos, donde se desarrollan estructuras cognoscitivas más complejas para cuestionar los fenómenos surgidos de esta interrelación. Los antecedentes de la química general implican los conocimientos mínimos que se abordan en las asignaturas de Química del nivel medio superior y sientan los fundamentos de las diferentes orientaciones que conforman la estructura curricular de la Licenciatura en Química. Su relación con las otras áreas como son: Física y Matemáticas, conforman una plataforma de conocimientos que permite una mayor comprensión de los fenómenos físicos y químicos de la naturaleza. OBJETIVO GENERAL Reafirmar los conocimientos básicos de la estructura atómica, la clasificación de los elementos, los compuestos inorgánicos, sus cambios, su nomenclatura, a fin de lograr una mejor comprensión de los fenómenos físico-químicos que suceden alrededor y proporcionar las herramientas que pueda utilizar en la disciplina de química. F0150_Química General 1/5 División Académica de Ciencias Básicas Licenciatura en Química CONTENIDO Unidad No. Objetivo particular 1 INTRODUCCIÓN A LA QUÍMICA Comprender el desarrollo de la química desde su génesis hasta la actualidad, los conceptos básicos, su importancia de estudio, y su campo de acción. Hrs. estimadas Temas 1.1. Definición, Importancia e ubicación 1.2. en su contexto con las demás ciencias así como su campo de acción. 1.3. Aspectos históricos. 1.4. Conceptos generales: Materia (Propiedades, Clasificación y Composición), Energía, Cambios físicos y químicos de la materia. Unidad No. Objetivo particular 2 Resultados del aprendizaje Reafirmar conceptos fundamentales de la química y establecer diferencias entre ellos. ESTRUCTURA ATÓMICA Conocer y comprender la evolución de los diferentes modelos atómicos con el fin de explicar la estructura de la materia resaltando la importancia del modelo cuántico como base de la química moderna. Hrs estimadas Temas 2.1. De la antigüedad a John Dalton. 2.2. Modelo atómico de Thomson. 2.2.1. Experimento de los rayos catódicos. 2.2.2. Experimento de Millikan. 2.2.3. Modelo atómico de Thomson. 2.3. Modelo atómico de Rutherford. 2.3.1. La radioactividad y los rayos X. 2.3.2. Experimento de Rutherford. 2.4. Modelo atómico de Bohr. 2.4.1. Antecedentes de la teoría F0150_Química General Resultados del aprendizaje Reafirmar conceptos sobre la estructura atómica. Explicar en forma elemental, los principios de la mecánica cuántica ondulatoria. Diferenciar los cuatro números cuánticos. Aplicar los principios sobre la distribución electrónica, para representar las configuraciones de los átomos. 2/5 División Académica de Ciencias Básicas 2.5. 2.6. 2.7. 2.8. Licenciatura en Química cuántica. 2.4.2. Radiaciones electromagnéticas. 2.4.3. Espectro del hidrógeno. 2.4.4. Orbital atómico. Modelo Cuántico. 2.5.1. Principio de Incertidumbre. 2.5.2. La ecuación de onda de Schrödinger. 2.5.3. Dualidad de la materia (Louis De Broglie). Números cuánticos. Configuraciones electrónicas. 2.7.1. Principio de Aufbau, regla de Hund (principio de máxima multiplicidad). Desarrollo de configuraciones electrónicas usando el Kernel. Unidad No. Objetivo particular 3 PERIODICIDAD QUÍMICA Comprender las estructuras de las tablas periódica y cuántica de los elementos; conocer su utilización para predecir las propiedades periódicas de los mismos. Hrs. estimadas Temas 3.1. Antecedentes de la tabla periódica. 3.2. Tabla periódica de Mendeleiev, Ley periódica de Mendeleiev y Ley periódica moderna. 3.3. Estructura de la Tabla periódica, grupos y periodos. 3.3.1. Clasificaciones usuales; 3.3.2. metales, no metales, elementos representativos, de transición, bloques s, p, d y f , lantánidos, actínidos, metales alcalinos y alcalinotérreos, halógenos y gases nobles. 3.4. Propiedades periódicas; radio atómico, radio iónico, energía de ionización, Afinidad electrónica y electronegatividad F0150_Química General Resultados del aprendizaje Comprender la distribución de la tabla periódica y los principales grupos y periodos Reafirmar el conocimiento de la tabla cuántica y su fundamento Conocer la influencia de las propiedades periódicas 3/5 División Académica de Ciencias Básicas Unidad No. Objetivo particular 4 Licenciatura en Química ENLACES, COMPUESTOS Y REACCIONES QUÍMICAS INORGÁNICAS Conocer las diferentes formas en que los átomos y las moléculas pueden unirse para originar otras especies químicas, clasificar y nombrar a los compuestos inorgánicos, conocer los diferentes tipos de reacciones y los métodos usuales de balanceo de ecuaciones químicas. Hrs estimadas Temas Resultados del aprendizaje 4.1. Enlaces Químicos: Aspectos Diferenciar los enlaces químicos generales de los enlaces iónicos y Identificar a los compuestos inorgánicos covalente. por su nomenclatura. 4.2. Clasificación y nomenclatura de los compuestos químicos inorgánicos: Nombrar los compuestos inorgánicos. 4.3. Obtención y reglas para ácidos, bases, anhídridos, óxidos metálicos Balancear ecuaciones químicas. y sales. 4.4. Número de oxidación: conceptos y reglas para asignar números de oxidación a iones y a compuestos. 4.5. Reacciones y ecuaciones químicas: 4.5.1. Tipo de reacciones: sustitución, síntesis, descomposición, sustitución simple y doble, reacciones endotérmicas, exotérmicas, reversibles e irreversibles 4.6. Balanceo de ecuaciones químicas por los siguientes métodos; Algebraico, Redox, Ión electrón. Unidad 5 ESTEQUIOMETRÍA No. Comprender y realizar cálculos químicos a partir de la interpretación Objetivo de las fórmulas moleculares y ecuaciones químicas. particular Hrs estimadas Temas Resultados del aprendizaje 5.1. Cálculos de la fórmula mínima y la Desarrollar cálculos estequiométricos fórmula molecular. 5.2. Cálculo de la composición porcentual de un compuesto. 5.3. Concepto de reactivo limitante y F0150_Química General 4/5 División Académica de Ciencias Básicas 5.4. 5.5. Licenciatura en Química reactivo en exceso. Cálculos estequiométricos. Rendimiento de una reacción. Estrategias de evaluación del aprendizaje Resolución de problemas. Examen. Asistencia Bibliografía Básica 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. Bibliografía Complementaria 14. 15. 16. 17. F0150_Química General Brady, J.E. Química Básica. Principios y Estructura. Editorial Limusa Wiley. 2ª. Ed. México. 2001. Buttler-Harrod, Química Inorgánica Principios y Aplicaciones, Edit. Adison-Wesley Iberoamericana, México D.F. 1992. Chang, R., Química. Edit. Mc-Graw Hill. México, 1992. Cotton y Wilkinsin, Química Inorgánica Básica, Edit. Limusa, 2001. Ebbing, Química General, Mc Graw Hill, México, D.F. 1997. Garzon, G. Fundamentos de Química General con Laboratorio. Edit. Mc-Graw Hill. México, 1989. Garritz, A., Chamizo. J.A. Química. Adisson Wesley Iberoemaricana. México. 1994. Glen E. Rodgers, Química Inorgánica, Mc Graw Hill 1995. G.S. Manfu, Principios de Química Inorgánica, Mc Graw Hill. 1983. Malone L.J. Introducción a la Química, Segunda Edición, Editorial Limusa, México D.F. 2001. Masterton-Slowinsky-Stanitski. Química General Superior Iberoamericana S.A. 5ta. Edición. México, 1983. Russel, I.Química. Edit. Mc-Graw Hill. México, 1989. Whitten, K., Gailey K. Química General. Edit. Mc-Graw Hill. México, 1998. P. Ander, A.J. Sonnessa. Principios de Química. Limusa Wiley. México.1989. Browm, T., Química: La Ciencia Central. 4a edición. Edit. Prentice-Hall. México, 1987. Mahan, B. Química: Curso Universitario. 3a edición. Fondo Educativo Interamericano. México, 1990. Mortimer, Ch. Química. Grupo edit. Iberoamericana. México, 1983. 5/5