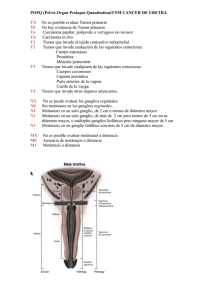
El cancer de mama se presenta habitualmente como un nódulo
Anuncio

Capítulo Cáncer de Mama Dr. Claudio Lorusso Especialista en Mastologia Médico de Staff del Servicio de Ginecología. Hospital Italiano de Buenos Aires Jefe Sección de Patología Mamaria Dra. Karina Pesce Especialista en Mastologia Medica Asociada del Servicio de Ginecología, Sección Patología Mamaria Hospital Italiano de Buenos Aires INDICE Introducción 1-Epidemiología a) Edad b) Incidencia c) Factores de Riesgo 2- Diagnóstico a) Clínica b) Métodos Diagnósticos c) Anatomía Patológica 3-Estadio Clínico y Quirúrgico a) Vías de propagación b) Exámenes complementarios de Estadificación c) Estadificación quirúrgica 4- Factores Pronósticos 5- Tratamiento 6- Seguimiento 7-Casos Clínicos 8-Bibliografia Dr. Claudio Lorusso- Dra. Karina Pesce Página 1 OBJETIVOS: Los objetivos de este capitulo es que el estudiante de Medicina al finalizar el capitulo sea capaz de identificar los signos y síntomas del cáncer de mama, como diagnosticarlo, su tratamiento y seguimiento. Reconocer la importancia de un diagnóstico precoz. INTRODUCCIÓN El cáncer es una de las enfermedades más prevalentes en los países occidentales, representa un problema importante desde el punto de vista medico-social principalmente en los países desarrollados. Entre las mujeres de los países occidentales el cáncer de mama constituye la primera causa de muerte por cáncer seguido por cánceres de colon y recto, cuerpo de útero, ovario y estómago. 1. EPIDEMIOLOGÍA: a) Edad: La edad media de presentación al momento del diagnóstico es 53 años b) Incidencia y Mortalidad: En Argentina, el cáncer de mama es responsable del mayor número de muertes por tumores malignos entre las mujeres, representa el 21% del total de muertes por cáncer. El cáncer de mama es el tumor más frecuente en la mujer, representando el 31% de todos los tumores de la población femenina. Se estima que una de cada ocho mujeres que alcancen la edad de 85 años habrá desarrollado un cáncer de mama en el curso de su vida. Entre los países latinoamericanos Uruguay tiene la tasa de mortalidad más alta, seguido de Argentina. En Argentina se registraron alrededor de 34 y 37 muertes por 100.000 mujeres entre los 25 y 75 años, entre 1996 y 1998. En la Unión Europea se producen 135000 casos anuales, de los cuales 12000 corresponden a España, con una incidencia de entre 34-50 casos/100000 mujeres/año. En Estados Unidos el 32% de todos los nuevos casos de cáncer registrados corresponde al cáncer de mama, ocupando la mayor frecuencia. La tendencia mundial es una disminución en la tasa de mortalidad por cáncer de mama, pero con una tasa de incidencia mayor. c) Factores de Riesgo: El riesgo de una mujer de padecer cáncer de mama en el transcurso de su vida es de un 8%, mientras que el riesgo de morir de esta enfermedad es de 3.6%. La amplia mayoría de los cánceres de mama son esporádicos. Se calcula que entre el 10 y el 15% de los cánceres de mama pueden ser neoplasias familiares, de las cuales el 30% son atribuibles a mutaciones en genes de susceptibilidad, denominados BRCA1 y BRCA2. Para poder determinar el grado de asociación entre la exposición a un cierto factor y el riesgo de un desenlace dado se emplea una herramienta epidemiológica denominada Riesgo Relativo (RR). Por definición RR es la razón de la tasa de la enfermedad (generalmente incidencia o mortalidad) en los expuestos, sobre la tasa en los no expuestos. Con RR se denota, en forma cuantitativa, el riesgo que tiene una paciente que es positiva a la presencia de un factor en relación a otra que es negativa para el mismo. Así, un riesgo relativo de 1 indica que no existe un incremento de riesgo de padecer la patología, mientras que un riesgo de 10 indica que existe un aumento en el riesgo 10 veces mayor. Únicamente el 12% de los pacientes con cáncer de mama tienen un factor de riesgo identificable. Dr. Claudio Lorusso- Dra. Karina Pesce Página 2 Se consideran factores de riesgo: a.-historia familiar de cáncer de mama. b.-menopausia tardía. c.-nuliparidad d.edad mayor a 30 años al primer embarazo e.-menarca precoz f.-ausencia de lactancia. g.-tratamiento hormonal de reemplazo THR h.-obesidad i.-antecedente personal de cáncer de mama f. cáncer de endometrio, entre otras. Se puede valorar el riesgo individual de desarrollar cáncer de mama a partir de los llamados modelos predictivos del riesgo. Dichos modelos parten del conocimiento etiológico disponible sobre el cáncer de mama basado en el análisis de estudios epidemiológicos de grandes muestras de la población. Existen cuatro grandes modelos, de ellos el más usado es, sin duda, el modelo de Gail. El modelo de Gail es un modelo de regresión logística multivariante que se desarrolló a partir de los datos de mujeres sometidas a exploraciones anuales que participaban en el Breast Cancer Detection Demonstración Project (BCDDP). Los factores de riesgo considerados por el modelo de Gail son: edad, edad de la menarca, edad de la paciente al primer hijo nacido vivo, número de biopsias previas y número de familiares en primer grado (madre o hermana) con cáncer de mama. Se considera alto riesgo cuando el riesgo de desarrollo de cáncer de mama es > 1,7% en los próximos 5 años. El modelo de Gail está pensado como una orientación clínica inicial, basada en elementos simples, fácilmente recogidos en una consulta clínica. De todos modos, se trata de una estimación, con un margen no despreciable de error. El modelo de Gail tiene ciertas deficiencias: no considera la edad a la que se diagnosticaron los casos de cáncer de mama en la familia y no incorpora los resultados de test genéticos. Cuadro 1. Modelo de Gail Edad a la primera menstruación (< 12 años) Número de biopsias mamarias previas (2 o más) Hiperplasia atípica en una biopsia mamaria. Edad al primer nacimiento de recién nacido vivo (≥ 30 años, o bien nulípara) Número de familiares de primer grado con historia de cáncer de mama (madre y hermana) Edad (≥ 50 años) Entre paréntesis se señalan los factores asociados con un riesgo más elevado A pesar de sus limitaciones este tipo de modelo puede servir de guía para el consejo de las pacientes con historia familiar de cáncer de mama, ya que su uso es sencillo, barato y rápido. Está disponible una versión en software y también una para su utilización "on-line" en la página web del National Cancer Institute bcra.nci.nih.gov/brc/q1.htm. Entre sus posibles aplicaciones está la selección de candidatas a ensayos de quimioprevención así como a programas de screening individual o de consejo genético u otro tipo de intervención (ej: cirugía profiláctica). Mutaciones genéticas BRCA1 y BRCA 2: La prevalencia de las mutaciones BRCA1 y BRCA2 en la población general se desconoce, pero se piensa que es menos de 0,12% y 0,044%, respectivamente. d) Pesquisa y Diagnóstico precoz del cáncer de mama Si bien la quimioprevención primaria ha significado un avance de la oncología, la herramienta más efectiva para reducir la mortalidad es la prevención secundaria. Diversos estudios prospectivos Dr. Claudio Lorusso- Dra. Karina Pesce Página 3 randomizados de screening, hallaron reducción de la mortalidad entre 30-40% dependiendo de la edad de la población estudiada y de la metología empleada. Si bien hubieron criticas que invalidaban los beneficios del Screening en reducir la mortalidad, la mayoría de los autores convalida los beneficios. La Sociedad Americana del Cancer ha publicado recientemente una guía o recomendaciones para el Screening CA CANCER J CLINIC 53:141-169 realizando algunas modificaciones a las publicadas en 1997. Los cambios más notables fueron: 1.- las mujeres deben comenzar la pesquisa a los 40 años. 2.- entre los 20-30 años examen físico (EF) de la mama como parte del examen general. 3.- explicar los beneficios y limitaciones del autoexamen mamario a partir de los 20 años y aceptar que la mujer elija no realizarlo. 4.- en la mujer anciana la decisión debe ser individualizada; valorar riesgos y beneficios en relación a la salud y expectativa de vida , ya que si la mujer es sana y candidata a tratamiento el Screening puede continuar 5.- la mujer de riesgo aumentado puede beneficiarse de una iniciación de la pesquisa más temprana, a intervalos más cortos, estrategias adicionales (ultrasonografía, resonancia nuclear magnética, etc) aunque de estas ultimas no hay evidencias concluyentes. 2- DIAGNÓSTICO a) Clínica: Los síntomas más frecuentes de la enfermedad son la presencia de un tumor palpable, y alteraciones cutáneas del tipo de las retracciones del pezón o de la piel de la mama, provocadas por la existencia de un tumor subyacente. Menos frecuentemente son otros síntomas como derrame por pezón, edema, afectación ganglionar axilar o inflamación. Carcinoma de Mama Localmente avanzado Dr. Claudio Lorusso- Dra. Karina Pesce Página 4 b) Métodos Diagnósticos: La aplicación de distintos métodos complementarios son necesarios para completar o profundizar la presentación clínica del cáncer de mama (mamografía, ultrasonografía),para certificarla(biopsia), para conocer la hormonodependencia del tumor(estudio de receptores hormonales para estrógenos y progesterona),para conocer la agresividad del tumor (KI 67,PCNA,HER2 NEU,etc) Mamografía: La mamografía es el método más eficaz en la pesquisa del cáncer. Para una correcta evaluación mamográfica es imprescindible disponer de un mamógrafo de última generación, realizar 2 proyecciones (oblicuo mediolateral y craneocaudal), y verificar que todo el tejido mamario este presente en la placa (referencia en el plano posterior del músculo pectoral mayor). En algunos casos para un diagnóstico final se pueden requerir proyecciones adicionales y compresiones focales con magnificación y estudio ecográfico. Si fuera posible, la mamografía actual debería ser comparada con estudios previos. Los informes mamográficos deben incluir una descripción precisa de los hallazgos anormales y el especialista debería estimar el nivel de sospecha de cáncer que conlleva esa determinada anomalía. En Argentina se utiliza una clasificación radiológica basada en una que fue propuesta por el American College of Radiologyst que se conoce como clasificación BI.RADS, y se divide en 6 categorías. Las imágenes sugerentes de carcinoma son: Nódulo denso espiculado o de contornos irregulares, distorsión de la arquitectura o microcalcificaciones agrupadas, heteromorfas e irregulares. Cuando las microcalcificaciones se asocian a una masa o nódulo, se eleva el índice de sospecha Engrosamiento o retracción de la piel de la mama o el pezón. Ecografía: La ecografía juega un importante rol en el diagnóstico de cáncer en las mamas radiológicamente densas. El carcinoma se presenta ecográficamente como un nódulo irregular hipoecoico (por absorción tumoral de ecos) de aspecto sólido y con sombra acústica posterior. No puede emplearse como un método de pesquisa dado que posee menor sensibilidad que la mamografía y no visualiza las microcalcificaciones, que constituyen un hallazgo frecuente del carcinoma infraclínico. Dr. Claudio Lorusso- Dra. Karina Pesce Página 5 Mamografía: Imagen Nodular densa espiculada (Señalizada con flecha) BI.RADS 5 Procedimientos de Biopsias Los procedimientos por biopsias que permiten el diagnóstico de un carcinoma de mama dependen fundamentalmente de la condición palpable o no palpable de la lesión. La conducta y diagnóstico de las lesiones no palpables serán consideradas en un capitulo aparte. En lesiones palpables se puede realizar los siguientes procedimientos: Punción citológica, core-biopsy, biopsia diferida y biopsia intraoperatoria. Punción citológica: Es un método complementario de diagnóstico, útil, fácil de realizar y económico. La obtención de muestras satisfactorias para diagnóstico, depende de la experiencia del operador, y la seguridad en la interpretación, de la disponibilidad de un patólogo entrenado en citología mamaria; de cumplirse estos dos requisitos la confiabilidad diagnóstica puede ser de 95%. Dr. Claudio Lorusso- Dra. Karina Pesce Página 6 Biopsia: certifica el diagnóstico y es imprescindible antes de instituir cualquier forma de tratamiento. Puede realizarse por punción o a cielo abierto (biopsia quirúrgica). La biopsia quirúrgica puede ser diferida o intraoperatoria. En las lesiones no palpables, salvo raras excepciones, la biopsia debe ser diferida. En las palpables, que muestran signos de sospecha se prefiere la biopsia intraoperatoria (por congelación). c) Anatomía Patológica La mayoría de los carcinomas de mama se originan en los conductos y con menor frecuencia en los lobulillos o acinos. A continuación se presenta una sencilla clasificación histopatológica de los canceres (figura 1): Figura 1. Clasificación histopatológica de los cánceres Carcinoma intralobulillar 1- No infiltrante (in situ) Solido Carcinoma intraductal Comedociano Papilar Cribiforme Ca. lobulillar infiltrante 2- Infiltrantes N.O.S (80% de los carcinomas) Pronostico favorable Ca. ductal infiltrante Formas especiales Otros Ca. medular tipico Ca. mucosecretante Ca. adenoquistico Ca. papilar Ca. tubular Ca. liposecretante Ca. apocrino Ca. secretorio Ca. metaplasico 3- Enfermedad de Paget El carcinoma infiltrante (el más frecuente) se presenta macroscópicamente como un nódulo duro pétreo de bordes espiculados, superficie de corte de color blanco grisáceo, granular y surcado por estrías blancoamarillentas. Microscópicamente, la proliferación tumoral se dispone en nidos o cordones que invaden el estroma, con grados variables de diferenciación tubular. En la literatura de habla inglesa se lo menciona como ductal N.O.S. (not otherwise specified) es decir carcinoma ductal no especificado de otra forma. El carcinoma lobulillar infiltrante, segundo en frecuencia, se caracteriza macroscópicamente por nódulos blanco grisáceos que en ciertas ocasiones se tornan indistinguibles del parénquima mamario vecino si no es por su patognomónica induración leñosa. Al microscopio se observa como una Dr. Claudio Lorusso- Dra. Karina Pesce Página 7 proliferación de células pequeñas, redondeadas, monomorfas dispuestas generalmente en regueros o filas indias. En el informe anatomopatológico es imprescindible considerar el grado de diferenciación histológico y nuclear, el cual se clasificará en grado I (bien diferenciado), grado II (moderadamente diferenciado), grado III (pobremente diferenciado) y grado IV (indiferenciado). Otros elementos histológicos del tumor que deben ser descriptos son: índice mitótico, invasión linfática ó vascular, necrosis, presencia o no de carcinoma intraductal asociado a la masa infiltrante y cuantificación del mismo. En el estudio de la axila debe incluirse el número de ganglios encontrados, cuantos de ellos tienen metástasis y la extensión de éstas (macro o micrometástasis, intra o extracapsulares) 3. ESTADIO CLÍNICO Y PATOLÓGICO a) Vías de Propagación: La diseminación a distancia del cáncer de mama se hace por las vías linfáticas y hemática, siendo los ganglios linfáticos locorregionales los axilares, los del territorio de la cadena mamaria interna y los supraclaviculares. b) Estudios complementarios de Estadificación: Una vez establecido el diagnóstico de carcinoma mamario es imprescindible definir su estadio. Habitualmente en forma conjunta con los estudios pre-quirúrgicos se solicita: Laboratorio Radiografía de Tórax: sirve para el pre-quirúrgico y detección de metástasis o segundo primario. Centellograma Óseo: en Estadios I y II solamente en los casos sintomáticos o con fosfatasa alcalina elevada; y en Estadios III y IV se solicita en forma rutinaria. Ecografía Hepática: en estadios III o con hepatograma patológico. Otros estudios se solicitaran únicamente frente a signos o síntomas que hagan presumir metástasis en una determinada localización. c) Estadificación clínica y quirúrgica Dr. Claudio Lorusso- Dra. Karina Pesce Página 8 Cuadro 2. Clasificación TNM de la UICC Tumor primario (T) Tx El tumor primario no puede ser evaluado T0 No evidencia de tumor primario Tis Carcinoma in situ (Carcinoma ductal in situ, Carcinoma lobulillar in situ, enfermedad de Pager del pezón sin carcinoma asociado. Nota: la enfermedad de Paget con carcinoma asociado se clasifica de acuerdo con el tamaño del tumor) T1 Tumor de 2 cm o menos de dimensión mayor T1mic Microinvasión de 0,1 cm o menos de dimensión máxima T1a Tumor de más de 0,1 cm pero no más de 0,5 cm de dimensión máxima T1b Tumor de más de 0,5 cm pero no más de 1cm de máxima dimensión T1c Tumor de más de 1 cm pero no más de 2 cm de máxima dimensión T2 Tumor de más de 2 cm pero no más de 5 cm de máxima dimensión T3 Tumor de más de 5 cm de máxima dimensión T4 Tumor de cualquier tamaño con extensión directa a la pared torácica o la piel T4a Extensión a pared torácica (no se incluye el músculo pectoral) T4b Edema (incluyendo piel de naranja) o ulceración de la piel de la mama, nódulos cutáneos satélites T4c T4a + T4b T4d Carcinoma inflamatorio Ganglios linfáticos regionales (N) NX No pueden evaluarse (por ejemplo, previamente resecados) N0 No metástasis en ganglios regionales N1 Metástasis en ganglios axilares ipsilaterales móviles N2 Metástasis en ganglios axilares ipsilaterales fijos o adheridos entre si, o en ganglios de la mamaria interna ipsilateral clínicamente aparentes (en ausencia de metástasis axilares clínicamente evidentes) N2a Metástasis en ganglios axilares ipsilaterales fijos entre sí o a otras estructuras N2b Metástasis únicamente en ganglios de la cadena mamaria interna ipsilateral clínicamente aparentes N3 Metástasis en ganglios linfáticos infraclaviculares ipsilaterales, o en ganglios de la cadena mamaria interna clínicamente aparentes asociadas a metástasis en ganglios axilares clínicamente aparentes, o metástasis en ganglios supraclaviculares ipsilaterales con o sin simultánea afectación de ganglios axilares y/o de cadena mamaria interna. N3a Metástasis en ganglios infraclaviculares ipsilaterales y ganglios axilares N3b Metástasis en ganglios de la cadena mamaria interna ipsilateral y ganglios axilares N3c Metástasis en ganglios supraclaviculares ipsilaterales Metastasis distantes (M) MX Desconocidas M0 No existen M1 Si existen Dr. Claudio Lorusso- Dra. Karina Pesce Página 9 Ganglios linfáticos regionales (pN) pNx No pueden evaluarse (por ejemplo, previamente resecados o no realizada linfadenectomía) pN0 No afectación histológica, no examen adicional para células tumorales aisladas (CTA). pN0 (i-) No afectación histológica, inmunohistoquímica (IHQ) negativa pN0(i+) No afectación histológica, IHQ positiva pero sin acúmulos celulares mayores de 0,2 mm pN0 (mol-) No metástasis histológicas demostradas, hallazgos moleculares negativos (RT-PCR) pN0 (mol+) No metástasis histológicas demostradas, hallazgos moleculares positivos (RT-PCR) pN1mic Micrometástasis (mayores de 0,2 mm, pero menores de 2 mm) pN1 Metástasis en 1 a 3 ganglios axilares y/o metástasis microscópicas en ganglios de la cadena mamaria interna detectadas por biopsia del ganglio centinela pero no clínicamente aparentes. pN1a Metástasis en 1 a 3 ganglios axilares pN1b Metástasis microscópicas en ganglios de la cadena mamaria interna detectadas por biopsia del ganglio centinela. pN1c Metástasis en 1 a 3 ganglios axilares y en ganglios de la cadena mamaria interna con enfermedad microscópica detectada por disección del ganglio centinela, pero no clínicamente aparentes pN2 Metástasis en 4 a 9 ganglios axilares o en ganglios de la cadena mamaria interna ipsilateral clínicamente aparentes en ausencia de metástasis ganglionares axilares pN2a Metástasis en 4 a 9 ganglios axilares (al menos un deposito tumoral mayor de 2 mm) pN2b Metástasis en ganglios de la cadena mamaria interna clínicamente aparentes a, en ausencia de ganglios axilares pN3 Metástasis en 10 o mas ganglios axilares; o en ganglios inflaclaviculares; o en ganglios de la cadena mamaria ipsilateral clínicamente aparentes en presencia de afectación de 1 o más ganglios axilares ipsilaterales; o en mas de 3 ganglios axilares con afectación microscópica de ganglios de la cadena mamaria interna ipsilateral no clínicamente aparentes; o metástasis en ganglios supraclavicualres ipsilaterales. pN3a Metástasis en 10 o más ganglios axilares (al menos un deposito tumoral mayor de 2 mm) o metástasis en ganglios infraclaviculares ipsilaterales pN3b Metástasis en ganglios de la cadena mamaria interna ipsilateral clínicamente aparentes a en presencia de afectación de 1 o más ganglios axilares ipsilaterales o en más de 3 ganglios axilares con afectación microscópica de ganglios de la cadena mamaria interna ipsilateral no clínicamente aparentes. pN3c Metástasis en ganglios supraclaviculares ipsilaterales Dr. Claudio Lorusso- Dra. Karina Pesce Página 10 Cuadro 3 Estadios ESTADIO 0 I II T0 N1 M0 T1* N1 M0 T2 N0 M0 II B T2 N1 M0 T3 N0 M0 III A III B III C IV T N M Tis N0 T1 N0 T0 N2 M0 T1* N2 M0 T2 N2 M0 T3 N1 M0 T3 N2 M0 T4 N0 M0 T4 N1 M0 T4 N2 M0 Cualquier T N3 M0 Cualquier T Cualquier N M1 T1 incluye T1mic 4. FACTORES PRONÓSTICOS Los factores pronósticos en el cáncer de mama son: Estado axilar, tamaño tumoral, parámetros histológicos, receptores hormonales, factores proliferativos. Estado axilar: el estado de los ganglios axilares es el factor pronóstico más importante. El tamaño tumoral es probablemente el factor pronóstico aislado más importante para determinar el riesgo de recurrencia y los subsecuentes beneficios de la terapia adyuvante en pacientes con axila negativa. La sobrevida global disminuye con el aumento del tamaño tumoral. Otro importante marcador son los parámetros histológicos, determinados por el grado nuclear y grado histológico y el tipo histológico. Hay tumores histológicos de pronóstico más favorable como son los tubulares, mucinosos y medulares. Los receptores hormonales son un factor pronóstico y a la vez de predicción. Mientras que el primero establece el riesgo de recidiva, el factor de predicción indica la posibilidad de respuesta a un determinado tratamiento. Dr. Claudio Lorusso- Dra. Karina Pesce Página 11 Los tumores cuyas células expresan receptores para estrógenos y progesterona >10% (detectadas tanto por inmunohistoquímica o por bioquímica) es posible que el tratamiento hormonal sea eficaz en prolongar la supervivencia libre de enfermedad y la supervivencia global. Los tumores que presentan ausencia de expresión de los receptores hormonales no responden a la hormonoterapia Los factores proliferativos son: porcentaje de células en fase S (fase de síntesis de ADN en el ciclo celular), el KI-67, P53 y el Her 2 Neu. El Her 2 Neu es un oncogén que actuaría también como factor de predicción de respuesta. Su amplificación (que se encuentra hasta en un 20-25% de los carcinomas mamarios) se asocia con peor pronóstico y predice el beneficio del tratamiento con antraciclinas o la respuesta al tratamiento con trastuzumab. 5. TRATAMIENTO a) Tratamiento Quirúrgico Los objetivos del tratamiento quirúrgico son tanto el control locoregional de la enfermedad como obtener información pronostica que permita seleccionar el tratamiento complementario apropiado con la menor mutilación y secuelas estéticas posibles. Aunque durante décadas ha prevalecido el planteamiento Halstediano de control local y extirpación en bloque del proceso tumoral, a partir de los anos 70, se comenzó a considerar el cáncer de mama como un proceso sistémico, reduciéndose la agresividad de la cirugía. Tanto los estudios europeos como americanos han demostrado supervivencias libres de enfermedad y supervivencia global idénticos cuando se compara cirugía conservadora y radioterapia con cirugías radicales con mejores resultados estéticos. Esto ha llevado a considerar la cirugía conservadora de mama, cuando es posible, como la terapia local de elección en el cáncer de mama. Cirugía conservadora El tratamiento quirúrgico conservador consiste en la extirpación del tumor con un margen de tejido mamario sano, preservando el aspecto anatómico de la mama. Las principales indicaciones de cirugía conservadora son los estadios I y II. En función del tamaño y localización del tumor y de la relación tumor-mama se puede optar por diversas técnicas quirúrgicas (tumorectomía, segmentectomía, cuadrantectomía): 1. Cuadrantectomía: consiste en la resección en bloque del tumor con un cuadrante de parénquima mamario, la fascia subyacente del músculo pectoral mayor y la piel que lo recubre. 2. Escisión amplia (segmentectomia): consiste en la escisión del tumor con amplios márgenes de tejido microscópicamente sano. 3. Tumorectomia (lumpectomia): consiste en la extirpación del tumor con un pequeño margen de tejido microscópicamente sano, con confirmación anatomopatológica de que los bordes quirúrgicos están microscópicamente libres de tumor. Dr. Claudio Lorusso- Dra. Karina Pesce Página 12 Contraindicaciones del tratamiento conservador: 1. Sospecha clínica de un carcinoma inflamatorio. 2. Multicentricidad clínica o radiológica (incluyendo focos de microcalcificaciones sospechosas en varios cuadrantes). 3. Relación desfavorable entre el tamaño del tumor y el de la mama que no permita un buen resultado estético. 4. Cáncer de mama en el embarazo. 5. Cáncer de mama en el varón. 6. Contraindicaciones para administrar radioterapia (Por ej. paciente con colagenopatías) La extirpación quirúrgica de un tumor mamario maligno infiltrante de modo conservador debe acompañarse de la evaluación axilar. Actualmente se considera como tratamiento estándar en pacientes con axila clínicamente negativa, la biopsia del ganglio centinela. El ganglio centinela es el primer ganglio que recibe drenaje del área donde asienta el tumor primario, y por tanto, seria el primer afectado cuando existen metástasis linfáticas. Aunque suele tratarse de un ganglio axilar y habitualmente se encuentra en el grupo central del nivel I, el ganglio centinela puede estar en el nivel II o en el nivel III, o incluso puede ser un ganglio intramamario, un ganglio interpectoral de Rotter o un ganglio de la cadena mamaria interna. En los casos en el que el ganglio centinela es negativo, no se procede a la investigación del resto de la axila. En los casos en que el ganglio centinela resulte positivo se procede a la linfadenectomía axilar (habitualmente niveles I y II de Berg). Los beneficios de la biopsia del ganglio centinela es evitar disecciones axilares innecesarias y sus eventuales complicaciones (linfedema, parestesias, etc). La linfadenectomía axilar esta indicada en todos los casos que presenten axila clínicamente positiva o cuando el ganglio centinela fuera positivo. Dr. Claudio Lorusso- Dra. Karina Pesce Página 13 Biopsia del Ganglio Centinela: Ganglio y conducto aferente teñido de Azul Cirugía Radical 1) Mastectomía radical Se propondrá cirugía radical a aquellas pacientes con cáncer de mama que no cumplan los criterios para tratamiento conservador. La intervención mas frecuentemente realizada en la actualidad es la propuesta por Madden. En la intervención propuesta por Madden se extirpa la mama, se respetan ambos músculos pectorales y por ello la linfadenectomia axilar suele restringirse a los niveles I y II. Otro tipo de mastectomía radical menos frecuentemente utilizada es la descripta por Patey donde se extirpa la mama en su totalidad, se respeta el músculo pectoral mayor y se desinserta el pectoral menor de la apófisis coracoides para permitir un acceso más cómodo al nivel ganglionar III de Berg. La incisión cutánea preferida suele ser la horizontal propuesta por Stewart o ligeramente oblicua (Orr). Habitualmente se colocan drenajes por aspiración tipo Redon o Jackson-Prat en el hueco axilar y en el lecho del pectoral mayor, que se retiraran cuando el débito diario sea menor de 30-50 cc. 2) Mastectomía simple Consiste en la escisión de la glándula mamaria con la piel que la recubre y el complejo areola-pezón. La Mastectomía simple esta indicada en pacientes con carcinoma ductal in situ extenso, en pacientes con carcinomas infiltrantes en los que debido a la edad o al estado general de la paciente no se benefician de linfadenectomia axilar, en mastectomías profilácticas en pacientes de alto riesgo, en recidivas locales de carcinomas de mama tratados previamente con cirugía conservadora y en tumores localmente avanzados con finalidad de toilette. 3) Mastectomía subcutánea Es una modificación de la mastectomía simple en la que se extirpa la glándula mamaria, respetando Dr. Claudio Lorusso- Dra. Karina Pesce Página 14 la piel y en algunos casos el complejo areola-pezón. Su principal indicación es la mastectomía profiláctica en mujeres de alto riesgo y en aquellas pacientes con carcinomas in situ o infiltrantes con el fin de realizar reconstrucción inmediata. Indicaciones de Mastectomía en estadio I y II 1-Microcalcificaciones difusas (ocupando más de un cuadrante) 2-Multicentricidad verdadera (clínica o mamográfica) 3-Relación volumen tumoral/volumen mamario. Un tumor de 2cm en una mama pequeña puede ser una contraindicación para el tratamiento conservador; por el contrario, sería un tumor pequeño en una mama grande 4-Márgenes microscópicos masivamente comprometidos en una tumorectomía 5-Reescisión con márgenes comprometidos (2do. intento conservador con margen positivo) 6-Derrame hemático por pezón como signo acompañante 7-Decisión personal de la paciente b) Tratamiento Radiante La radioterapia complementaria reduce el porcentaje de recidivas locoregionales y mejora la supervivencia. El momento óptimo de administración dependerá de la administración o no de quimioterapia y del esquema utilizado. Así en el caso de no administración de quimioterapia, se recomienda hacerlo antes de los dos meses de la cirugía y en el caso de recibir quimioterapia antes de los 6 meses del tratamiento quirúrgico. Si se utilizan esquemas con antraciclinas se iniciara a las 3-4 semanas de finalizar el último ciclo, mientras que con esquemas tipo CMF se podrá realizar en modo concomitante. En el caso de utilizar quimioterapia con taxanos se puede realizar radioterapia en forma concurrente. Irradiación de la mama En el caso de tratamiento conservador se recomienda radioterapia sobre el volumen total de la glándula mamaria (45-50 Gy). Se recomienda sobreimpresión del lecho quirúrgico (10-20 Gy) si los márgenes son inferiores a 1cm o hay un extenso componente intraductal. Cuando los ganglios axilares son negativos no esta indicada la irradiación axilar. Indicaciones de irradiación de la pared torácica en Pacientes Mastectomizadas Se recomienda radioterapia sobre la pared torácica (45-50 Gy) en los siguientes casos: 1. Tumores localmente avanzados (T3-T4) independientemente de la afectación ganglionar tras la mastectomía. 2. Tumores localmente avanzados (T3-T4, N2-N3), tratados con quimioterapia primaria, independientemente de la respuesta obtenida con la misma. 3. Tumores con afectación del borde profundo de resección tras la mastectomía o con márgenes insuficientes (< 1mm). 4. Tumores con afectación de 4 o más ganglios axilares. 5. Tumores con afectación extracapsular o de la grasa axilar. c) Tratamiento Sistémico Adyuvante Consiste en el tratamiento sistémico administrado luego de un tratamiento regional con intención curativa (ejemplo: post- cirugía conservadora o radical). Dr. Claudio Lorusso- Dra. Karina Pesce Página 15 Para evaluar la necesidad o no de administrar tratamientos adyuvantes, se tiene en cuenta la prolongación de la sobrevida libre de enfermedad y la sobrevida global, el costo, la toxicidad aguda y a largo plazo. La gran mayoría de las pacientes con axila negativa se cura sólo con el tratamiento loco-regional. Por lo tanto se decidirá administrar o no un tratamiento adyuvante sistémico luego de sopesar los beneficios en la reducción del riesgo de recurrencias contra los efectos indeseables y riesgos del tratamiento propuesto. En pacientes con axila negativa existe evidencia que indica que la quimioterapia y el tamoxifeno adyuvantes producen un pequeño pero consistente incremento en la sobrevida global y libre de enfermedad (17-26%). Recientemente han sido publicadas las conclusiones de la reunión de consenso de Saint Gallen 2007 que clasifica a las pacientes en 3 categorías de riesgo. Las categorías de riesgo se basan en el estado de los ganglios axilares, la respuesta endocrina del tumor, en las características histológicas y el tamaño del tumor, y la sobre-expresión del oncogen Her 2 Neu. En base a estos parámetros se definen 3 categorías de Riesgo: Bajo, Intermedio, Alto Bajo Riesgo -PT < 2 cm, Grado 1, ausencia de invasión vascular peritumoral, sobreexpresión o amplificación del oncogén Her 2 Neu -Ganglios negativos -Edad = o > 35 años Riesgo intermedio -Ganglios negativos y al menos una de las siguientes características: PT > 2 cm, grado 2-3, invasión vascular peritumoral, sobreexpresión o amplificación del oncogén HER2/neu, edad < 35 años. -Ganglios positivos (1-3) y Ausencia de sobreexpresión o amplificación del oncogén HER2/neu. Alto riesgo -Ganglios positivos (1-3) y Sobreexpresión o amplificación del oncogén HER2/neu. -Ganglios positivos (≥ 4) En la categoría de bajo riesgo el riesgo de recurrencia a 10 años es menor a 10%. Dr. Claudio Lorusso- Dra. Karina Pesce Página 16 Cuadro 4 Resumen de Tratamiento según categorías de riesgo Categoría de Riesgo Hormono Hormono respondedoras dependencia Incierta Bajo Riesgo Hormonoterapia Hormonoterapia o o Ningún Tratamiento Ningún Tratamiento Riesgo Intermedio Hormonoterapia sola Quimioterapia sola o o Quimioterapia + Quimioterapia + Hormonoterapia Hormoterapia Alto Riesgo Quimioterapia + Quimioterapia + Hormonoterapia Hormonoterapia No-Hormono respondedoras Quimioterapia Quimioterapia Hormonoterapia a) Premenopáusicas El tratamiento hormonal de elección en mujeres premenopáusicas con RE positivos es la administración de tamoxifeno 20 mg/día durante 5 años que ofrece una disminución del 32% en la mortalidad y del 45% en el riesgo de recaída. En mujeres con contraindicación para la administración de tamoxifeno una opción alternativa es la castración quirúrgica o radiante o la administración de análogos de LHRH durante 5 años. Se puede combinar el uso de tamoxifeno y ablación de la función ovárica en mujeres jóvenes (menores de 35 anos) con riesgo intermedio/alto y en mujeres premenopáusicas de cualquier edad con riesgo alto, especialmente si no consiguen la amenorrea tras la quimioterapia. b) Postmenopaúsicas Durante muchos anos, la administración de tamoxifeno durante 5 anos ha sido el tratamiento hormonal estándar en el tratamiento adyuvante del cáncer de mama en mujeres postmenopáusicas. En diciembre del 2001, los resultados preliminares del estudio ATAC marcaron el comienzo de la aparición de los resultados de ensayos con inhibidores de la aromatasa (anastrazol, letrozol, exemestane) utilizados durante 5 años en lugar de tamoxifeno, tras 2-3 años de tamoxifeno y durante 5 años tras finalizar 5 años de tratamiento con tamoxifeno. Los resultados de estos estudios confirman el beneficio de utilizar inhibidores de la aromatasa en el tratamiento adyuvante del cáncer de mama en mujeres postmenopáusicas al incrementar el intervalo libre de enfermedad (no disponemos aún de evidencia de aumento de supervivencia global). Quimioterapia Adyuvante La administración de quimioterapia adyuvante sistémica ha demostrado una mejoría en la supervivencia global independientemente de la edad, afectación ganglionar y sensibilidad hormonal. De los estudios publicados con quimioterapia en el tratamiento adyuvante del cáncer de mama se pueden establecer las siguientes conclusiones: 1. La administración de la poliquimioterapia es superior a la monoterapia. 2. Los resultados del análisis del Early Breast Cancer Trialists Collaborative Group (EBCTCG) Dr. Claudio Lorusso- Dra. Karina Pesce Página 17 confirman la superioridad de los regimenes con antraciclinas (FAC y FEC) sobre CMF, con una disminución del riesgo relativo de recaída y muerte por cáncer de mama del 11% y 16% respectivamente. Este beneficio, aunque significativo, es menor en mujeres mayores de 50 anos, sin afectación ganglionar y con receptores hormonales negativos. 3. Existe poca evidencia sobre el beneficio de la quimioterapia en pacientes mayores de 70 años, por lo que habría que individualizar su administración en pacientes ancianas. Los esquemas de quimioterapia habitualmente utilizados son: CMF (ciclofosfamida, metrotexate y fluoracilo) o el AC o EC (adriblastina o epirrubicina y ciclofosfamida). Hoy no rige el uso de uno u otro esquema solamente por el estado axilar y el consenso general es tratar a todas las pacientes con axila positiva con algún esquema que contemple el uso de antraciclinas dado que el último metanálisis mostró un beneficio absoluto de un 3 % en sobrevida de estos esquemas en relación al clásico CMF. Pero dada la escasa magnitud del beneficio hay quienes no aceptan esta indicación de modo universal, y prefieren continuar indicando el CMF en pacientes con menos de 3 ganglios comprometidos. El empleo de los taxanos en la adyuvancia no es tratamiento estándar. En pacientes que sobreexpresen el oncogen Her 2 Neu está indicado realizar terapia con trastuzumab cada 28 días durante un período de 1 año. La utilización de trastuzumab en mujeres con cáncer de mama y sobreexpresión de c-erb-B2 de manera concurrente o secuencial con la quimioterapia ofrece un incremento significativo de la supervivencia global y supervivencia libre de enfermedad. Tratamiento Neoadyuvante Consiste en el tratamiento sistémico administrado antes del tratamiento regional con intención curativa. A los parámetros antes mencionados se suma la repuesta tumoral, una prueba in vivo de la eficacia del tratamiento y que puede traducirse en una cirugía menos radical. 6- SEGUIMIENTO Historia clínica y examen físico cada 4 a 6 meses los 3 primeros años, cada 6 meses los 2 años siguientes y luego anuales. Mamografía y ecografía mamaria (si corresponde) anual (para las tratadas con cirugía conservadora, la primera 6 meses después de terminada la radioterapia) Examen ginecológico anual Ecografía ginecológica transvaginal solamente si hay metrorragia, aún en las que reciben tamoxifeno y anual asociada a determinación de Ca 125 en las pacientes de alto riesgo de desarrollar cáncer heredofamiliar: ° Historia familiar altamente positiva de cáncer de mama ° Cáncer de mama en premenopáusicas y bilaterales ° Cáncer de mama en hombres ° Múltiples primarios (colon, ovario, próstata) y/o ° Mutación de BRCA 1-2 conocida en familiar o paciente IMPORTANTE!!! En pacientes asintomáticas NO DEBE INDICARSE NINGÚN OTRO EXÁMEN COMPLEMENTARIO Dr. Claudio Lorusso- Dra. Karina Pesce Página 18 CUESTIONARIO DE AUTOEVALUCION 123456789- ¿Cuál es la edad más frecuente de presentación del cáncer de mama? ¿Cuál es el carcinoma más frecuente en la mujer? Enumere los Factores de Riesgo para cáncer de mama ¿Cuál es el carcinoma de mama más frecuente? ¿el esporádico? o ¿el familiar? ¿Cuál es el síntoma más frecuente de presentación del cáncer de mama? ¿Cuál es el método de screening para el diagnóstico de cáncer de mama? ¿Cuál es el tipo histológico más frecuente, y cuál es su origen? Describa las vías de propagación del carcinoma de mama ¿Cuáles son los estudios complementarios que se utilizan para la estadificación del cáncer de mama, y en que casos están indicados? 10- Enumere los Factores Pronósticos, e identifique cuál es el más importante 11- ¿En que estadios clínicos está indicada la Cirugía conservadora? 12- Enumere las contraindicaciones del tratamiento conservador 13- Concepto-definición del ganglio centinela 14- ¿Cuándo esta indicada la radioterapia? 15- ¿Qué entiende por tratamiento adyuvante sistémico? ¿Qué terapias incluye? 16- De acuerdo al Consenso de Saint Gallen cuales son categorías de Riesgo 17- ¿Cómo se realiza el seguimiento de una paciente tratada por un carcinoma mamario? Casos Clínicos Caso 1 Paciente 50 años, Nulípara, Menopáusica desde los 48 años. Nunca recibió terapia hormonal de remplazo. Sin antecedentes personales ni familiares patológicos (Niega antecedentes familiares de cáncer de mama, colon, ovario). Consulta por Nódulo localizado en el CSE de Mama Derecha. Al Examen Físico: Inspección negativa, se palpa en el CSE de MD nódulo de 1 cm, duro-pétreo, de bordes mal definidos, no adherido a planos superficiales ni profundos. Axila Clínicamente negativa Mamografía nódulo denso espiculado de 1 cm en el CSE de MD. Ecografía mamaria nódulo hipoecoico heterogéneo de aspecto sólido de 1 cm, de contornos irregulares, con atenuación sónica posterior. BI.RADS 5 El alumno deberá responder los siguientes ítems 1- Diagnósticos Diferenciales posibles 2- Estadio Clínico 3- Propuesta terapéutica Dr. Claudio Lorusso- Dra. Karina Pesce Página 19 Caso 2 Paciente de 65 años, Menopáusica desde los 50 años. A la que se le efectuó Cuadrantectomia CSE de Mama Derecha con Biopsia de Ganglio Centinela, con diagnóstico anatomopatológico de carcinoma ductal invasor tubular , tamaño tumoral de 7 mm, GN: 1, GH1; Márgenes quirúrgicos de cuadrantectomía mayores de 1 cm. Receptores hormonales Estrógeno positivo (+++), Receptor de Progesterona RPG Positivo (+++), Her 2 Neu Negativo. Ganglio centinela Negativo. El alumno deberá responder: 1- Cual es el tratamiento adyuvante que deberá recibir esta paciente? 2- Deberá recibir radioterapia local? Dr. Claudio Lorusso- Dra. Karina Pesce Página 20 BIBLIOGRAFIA 1-ICAR GLOBOCAN 2002 database. http://www-dep.iarc.fr/. 2002 2-Breast imaging reporting and data system (B1-RADStm), 2nd ed. Reston (VA): American College of Radiology; 1995. 3-Fisher B, Redmond C, Fisher ER, Bauer M, Wolmark N, Wickerham LD, et al. Ten-year results of a randomized clinical trial comparing radical mastectomy and total mastectomy with or without radiation. N Eng J Med 1985; 312:674-81. 4-Fisher B, Anderson S, Redmond C, Wolmark N, Wickerham DL, Cronin W. Reanalysis and results after 12 years of follow-up in a randomized clinical trial comparing total mastectomy with lumpectomy with or without irradiation in the treatment of breast cancer. N Eng J Med 1995;333:1456-61. 5-Veronesi U, Luini A, Del Vecchio, Greco M, Galimberti V, Merson M, et al. Radiotherapy after breat-conserving surgery in women with localized cancer of the breast. N Eng J Med 1993;328: 158791. Dr. Claudio Lorusso- Dra. Karina Pesce Página 21 Dr. Claudio Lorusso- Dra. Karina Pesce Página 22