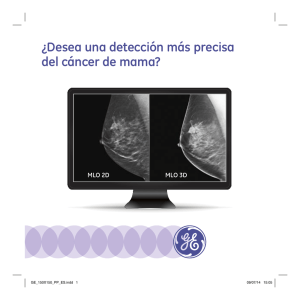
hospital santiago oriente dr. luis tisné brousse
Anuncio

ISSN 0718 - 3127 REVISTA DE OBSTETRICIA Y GINECOLOGÍA HOSPITAL SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE R EV . OBSTET . GINECOL .-H OSP . S ANTIAGO O RIENTE D R . L UIS T ISNÉ B ROUSSE F UNDADA EN EL AÑO 2006 Profesor Dr. Luis Tisné Brousse (1909-1995) Director Hospital Santiago Oriente Dr. Luis Tisné Brousse Dr. Enrique Hering Araya Jefe de Servicio Obstetricia y Ginecología Dr. Patricio Gayán Barba D irector de R evista D r. Patricio G ayán B arba E ditor Jefe D r. Jorge Varas C ortés C omité E ditorial D r. Jorge T isné T orreblanca Dr. José Lattus Olmos Dr. Sócrates Aedo Monsalve Dr. Ricardo Benítez Molina Dra. Angélica Díaz Rojas Dr. Italo Campodónico Garibaldi Revista de distribución gratuita a los profesionales médicos de obstetricia y ginecología. Toda correspondencia debe ser enviada al Editor Jefe, Dr. Jorge Varas C., a las siguientes direcciones: Revista de Obstetricia y Ginecología del Hospital Santiago Oriente Dr. Luis Tisné Brousse. Avenida Las Torres 5150, Peñalolén, Santiago. Teléfono 4725293. E mail: drjorgevaras@gmail.com ©Servicio de Obstetricia y Ginecología Hospital Santiago Oriente Dr. Luis Tisné Brousse. 179 INDICE VOL 4 Nº 3 DICIEMBRE 2009 EDITORIAL Patología mamaria: Importancia de su difusión Dr. Jorge Varas C. 183 ARTÍCULOS Semiología de la mama Dra. Isabel Saffie V. 185 Patología mamaria e imágenes Dra. Karen Junemann U. 189 Efectividad del screening mamográfico anual y costos de la implementación de un Programa de Detección Precoz en el Servicio de Salud Metropolitano Oriente Dra. Bernardita Blümel M. Dra. Paula Escobar O. Dr. Gonzalo Sandoval S. 195 Patología mamaria benigna Dra. Karen Junemann U. 201 Procesos inflamatorios benignos de la mama Dra. Bárbara Aguilera R. 207 Identificación de riesgo de cáncer de mama Dra. Claudia Parra G. 211 Terapia hormonal y riesgo de cáncer de mama Dra. Paola Ruiz de Viñaspre A. 215 Biopsias percutáneas en cáncer de mama Dra. Paula Escobar O. 219 Cáncer de mama Dr. Alonso Uribe O. 223 Cáncer de mama y embarazo Dra. Paola Ruiz de Viñaspre A. 233 Reconstrucción mamaria Dra. Paula Escobar O. 237 Radioterapia en cáncer de mama Dr. Patricio Olfos G. 241 Manejo sistémico del cáncer de mama Dr. Claudio Salas F. Dra. Marta Palma L. 245 Tamoxifeno y patología ginecológica Dra. Karen Junemann U. 247 Normativa de derivación a Unidad de Patología Mamaria Hospital Dr. Luis Tisné Brousse Dr. Miguel Celis M. 251 Programa de tratamiento integral de pacientes con cáncer de mama en Hospital Dr. Luis Tisné Brousse y Centro de Referencia de Salud Cordillera Equipo Multidisciplinario 254 CARTA AL EDITOR Dr. Alejandro Goic G. 256 181 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (2): 183-184 EDITORIAL Patología mamaria: Importancia de su difusión Las mamas han sido a través de la historia del arte, símbolo de femineidad y constituyen parte importante de representación de la mujer especialmente en pinturas famosas. Ejemplos de ellas “El nacimiento de Venus” (1484) Sandro Botticelli; “La maja desnuda” (1800) Francisco de Goya; “La libertad guiando al pueblo” (1830) Eugène Delacroix. Las mamas constituyen también símbolo de fertilidad, asegurando mediante la lactancia la nutrición del recién nacido y creando además vínculos de afecto entre madre e hijo. Al amamantar, el contacto piel a piel favorece el apego y estimula las manifestaciones de amor y seguridad entre ambos, permitiendo que el niño afirme su presencia como persona a través de la interacción con su madre. La formación de las bases de su personalidad y seguridad en sí mismo, están estrechamente ligados al amamantamiento. Sin embargo, las glándulas mamarias pueden presentar patologías benignas y lamentablemente malignas. El conocimiento de estas enfermedades, su prevención, diagnóstico, tratamiento y seguimiento, debe estar al alcance del mayor número posible de profesionales de la salud y de la población en general. Como respuesta a este desafío surge la iniciativa de la Unidad de Patología Mamaria del Servicio de Obstetricia y Ginecología del Hospital Dr. Luis Tisné Brousse, quienes de manera organizada y sistemática, dan a conocer en esta edición, diversos temas de interés. Resulta gratificante presentar el valioso esfuerzo realizado por todos los autores en cada uno de sus textos. En forma ordenada y didáctica son dados a conocer los diferentes temas, que abarcan desde la epidemiología y la anatomía, enfermedades benignas de la mama, patología maligna y su estadificación, procedimientos diagnósticos, tratamientos quirúrgico, médico y radiante, así como procedimientos reconstructivos y de rehabilitación. Se trata de artículos de gran utilidad, para los médicos en formación, especialistas interesados en la Mastología y para todos aquellos que son capaces de creer en que es posible brindar a nuestras pacientes una atención cada vez mejor, más digna, segura y de calidad. Mis felicitaciones y agradecimientos hacia todos quienes colaboraron con esfuerzo y vocación a lograr que el Vol 4, Nº 3 de la Revista de Obstetricia y Ginecología del Hospital Dr. Luis Tisné Brousse esté dedicado íntegramente a temas tan trascendentes. Mención especial para la Dra. Paula Escobar Oliva y Dra. Paola Ruiz de Viñaspre Alvear, quienes proponen esta iniciativa, motivan a los demás integrantes del equipo de la Unidad de Patología Mamaria y a los integrantes del Comité Oncológico. Organizan además los temas a desarrollar y revisan acuciosamente cada uno de ellos con el fin de entregar herramientas importantes en el proceso continuo tendiente a mejorar la calidad de vida de las pacientes. Dr. Jorge Varas Cortés Editor Jefe 183 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 183-184 184 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 185-188 ARTÍCULO Semiología de la mama Isabel Saffie V. Las mamas femeninas están localizadas en la pared torácica anterior y se sitúan normalmente entre la segunda y sexta costilla y entre el borde lateral del esternón y la línea medio axilar. En la zona mamaria más prominente se encuentra el complejo areolapezón. Una pequeña porción de la glándula mamaria se extiende superolateralmente a lo largo del borde inferior del músculo pectoral mayor para formar el proceso axilar o cola de la mama. Figura 1. División en cuadrantes de la mama. Para localizar las lesiones de la mama, ésta se divide en cuatro cuadrantes mediante dos líneas virtuales transversales que pasan por el pezón (Figura 1). Así, cada zona tiene una denominación: cuadrante superior externo (CSE), cuadrante superior interno (CSI), unión de cuadrantes superiores (UCS), unión de cuadrantes externos (UCE), unión de cuadrantes internos (UCInt), cuadrante inferior externo (CIE), unión de cuadrantes inferiores (UCinf) y región retroareolar (RA). Otra forma de referirse a una zona particular de la mama, es imaginando que ésta es un reloj análogo e identificando la lesión según donde apuntarían las manecillas del reloj. En otras palabras, un tumor ubicado en el CIE derecho podría también ser descrito como ubicado a la hora 7 u 8 de la misma mama. Es muy importante precisar la ubicación y consignar la mama afectada sobre todo en los casos de neoplasia y de lesiones múltiples. Casi todo el tejido glandular se encuentra en el cuadrante superior externo y su proceso axilar, por lo tanto, son zonas de frecuente asiento de patología. La glándula mamaria contiene entre 20 y 40 lóbulos que drenan hacia conductos galactóforos, generalmente 12, que se abren posteriormente en el pezón. En la región areolar existen también las glándulas de Montgomery que se observan como pequeñas protuberancias alrededor del pezón y originan los denominados quistes retroareolares de Médico Becada Obstetricia y Ginecología, Facultad de Medicina Campus Oriente, Universidad de Chile. Servicio Obstetricia y Ginecología. Hospital Dr. Luis Tisné Brousse. E mail: saffa99@hotmail.com 185 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 185-188 las adolescentes que son una inflamación local de éstas que ocurre cuando comienza la secreción apocrina en un conducto ciego al momento del desarrollo mamario. La mama infantil se define por ausencia de botón mamario que puede aparecer desde los 8 años y también puede presentar patología casi siempre benigna y caracterizada por tumores fibroepiteliales. En la actualidad se utiliza la escala de Tanner para clasificar el grado de desarrollo mamario, que va de 1 a 5, siendo esta última la mama adulta. En la anamnesis, se deben consignar algunos datos trascendentes como el motivo de consulta, el tiempo de evolución de los síntomas y algún otro síntoma o signo asociado. Es importante indagar sobre enfermedades anteriores de la mama y otros sistemas, cirugías previas, hábitos como el tabaquismo, uso de medicamentos con especial énfasis en el uso de anticoncepción hormonal y terapia hormonal de reemplazo. Además, incluir historia gíneco-obstétrica: ciclos menstruales, paridad, edad del primer hijo y lactancia. Preguntar acerca de antecedentes familiares de cáncer y grado de parentesco en ambas líneas genéticas. En relación a los síntomas específicos de patología mamaria, interrogar sobre dolor mamario, palpación de masas, cambios de la piel, retracción o descargas a través del pezón y nódulos axilares. El examen físico, se debe realizar en un lugar tranquilo, cómodo y privado. La paciente debe desvestirse de la cintura hacia arriba, primero sentada frente al examinador y luego en decúbito supino, adoptando distintas posiciones con los brazos. Se deben examinar ambas mamas, regiones axilares y supraclaviculares de forma prolija y ordenada. Se recomienda dibujar hallazgos, según la localización por cuadrantes, describiendo el tamaño y ubicación en la mama. Se sugiere inspeccionar la paciente sentada, observar tamaño, forma, contorno de las mamas y la posición del complejo areola-pezón. Apreciar deformidades, retracciones, cambios de color y de la superficie de la piel. Estas mismas características deben observarse con la paciente extendiendo sus brazos e inclinando su cuerpo hacia adelante (tensión de ligamentos de Cooper) y colocando sus brazos en la cintura contrayendo los músculos pectorales (masa adherida a planos profundos) (Figura 2). Con la paciente aun sentada, se deben inspeccionar las regiones supraclaviculares y axilares. 186 Figura 2. Extensión y elevación de brazos para evaluar retracción de la piel de las mamas. Figura 3. Decúbito dorsal con brazos en la nuca e hiperextensión de músculos pectorales. Figura 4. Palpación de mama y caracterización de nódulos. PATOLOGÍA Figura 5. Expresión del pezón y evaluación de secreción obtenida. Figura 6. Palpación axilar. Figura 7. Palpación adenopatías supraclaviculares. MAMARIA E IMÁGENES Luego se realiza el examen con la paciente en decúbito dorsal y ambos brazos detrás de la cabeza. Buscar los mismos elementos mencionados anteriormente, además de grietas o secreciones a través del pezón (Figura 3). La palpación se realiza en decúbito dorsal, con ambos brazos detrás de la cabeza. La superficie de la mama es finamente nodular, lo que puede acentuarse en ciertos períodos fisiológicos y confundirse con lesiones tumorales. Se debe realizar en forma suave con los pulpejos de los dedos, haciendo una leve presión hacia la pared torácica abarcando todos los cuadrantes mamarios. Cada lesión encontrada debe describirse en cuanto a consistencia, bordes, sensibilidad, adherencia a planos superficiales y profundos, características de la piel, ubicación y tamaño (Figura 4). El pezón debe palparse en busca de nódulos retroareolares y comprimirlo para ver si existe algún tipo de secreción, describiendo las características de ésta (Figura 5). La palpación de regiones axilares en busca de adenopatías debe hacerse con la paciente sentada frente al examinador. Ésta descansa su brazo ipsilateral de la axila a examinar sobre el hombro o brazo del examinador, el que palpa la axila derecha con su mano izquierda y viceversa. Se deslizan los dedos de atrás hacia delante contra la pared torácica y el músculo pectoral mayor. Se describen, tal como de mencionó anteriormente, las características de las adenopatías si éstas fueran palpables. (Figura 6). Finalmente, se palpa la fosa supraclavicular (Figura 7). SIGNOS Y SÍNTOMAS DE ALARMA Nódulos: indoloros, de consistencia aumentada, límites difusos, fijos a la piel o planos profundos. Unidad areola pezón: retracciones, desviaciones, eccema o ulceraciones. Alteraciones cutáneas: retracciones de la piel, piel de naranja, eritema, edema, ulceraciones, nódulos cutáneos, alteraciones inflamatorias en general. Descargas por el pezón: hemática o acuosa. Adenopatías: axilares, cervicales o supraclaviculares. Derivados de enfermedad metastásica: dolores o fracturas óseas inesperadas, tos y disnea, nódulos hepáticos o hígado sensible a la palpación, cefalea y síntomas visuales. A continuación se dan a conocer algunos casos con características que determinan distintos tipos de cánceres de mama (Figuras 8, 9, 10 y 11). 187 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 185-188 Figura 8. Nódulo cutáneo en zona areolar más retracción pezón derecho. Figura 9. Cáncer de mama localmente avanzado con ulceraciones, eritema y edema de la piel. Figura 10. Cáncer de mama inflamatorio. Eritema, edema y aumento de volumen mama derecha. Figura 11. Enfermedad de Paget de la Mama. Eccema y eritema del pezón. LECTURAS – – – RECOMENDADAS Semiología Médica, Segunda Edición 1999. Editorial Mediterráneo. Capítulo 28, 406-9. Compendio de Anatomía con Orientación Clínica. 1998. Capítulo 2. 36. Blueprints in Obstetrics and Gynecology. Fourth Edition 2007. Chapter 32. 333-7. 188 – – – Cirugía General. 2002. Editorial Mediterráneo. Capítulo 31. 222-7. Ilustraciones: The breast examination. ncbi.nlm.nih.gov Imágenes: www.produccioneschapinas.net/images/ articulos; Mayo Foundation for Medical Education and Research. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 189-194 ARTÍCULO Patología mamaria e imágenes Karen Junemann U. I. MAMOGRAFÍA La mamografía es el método de tamizaje (screening) para detección precoz del cáncer de mama, que ha demostrado mayor utilidad. Diversos estudios señalan que ha logrando disminuir la mortalidad hasta en 30%. Sin embargo en Chile no existe tamizaje mamario y sólo se utiliza la mamografía como método diagnóstico. Son indicaciones de mamografía: • Paciente mayor de cuarenta años de edad, asintomática: mamografía anual. • Paciente sintomática mayor de 25 años, como primer examen de la mama (eventualmente se complementará con ecotomografía mamaria). • Paciente con antecedentes familiares de cáncer mamario, desde 10 años antes de la edad del familiar que tuvo cáncer. • Ginecomastia. • Cirugía plástica: examen preoperatorio y control postoperatorio. La mamografía es un examen radiológico, que tiene que ser realizado con estándares de calidad (técnicos y humanos) con el fin de obtener una imagen que permita emitir un diagnóstico adecuado. La mama se evalúa en dos proyecciones, cráneo caudal (CC) y medio oblicua lateral (MLO). Pueden ser necesarias proyecciones adicionales con el objeto de comprimir una imagen dudosa, o bien magnificarla. Elementos a detectar en un estudio imagenológico mamario (Figura 1): • Nódulos: evaluar tamaño, forma, márgenes y calcificaciones asociadas. • Microcalcificaciones: identificar densidad, forma y su distribución. • Distorsión de la arquitectura glandular: es una alteración del tejido glandular con la producción de radiaciones finas, espiculadas que no se encuentran asociadas con una masa. Masa bien definida Deformidad parenquimatosa Lesión estrellada Masa mal definida Distorsión de la arquitectura Masa espiculada Microcalcificaciones Figura 1. Alteraciones mamográficas. Médico. Especialista en Obstetricia y Ginecología. Unidad de Patología Mamaria. Servicio Obstetricia y Ginecología. Hospital Dr. Luis Tisné Brousse. E mail: kjunemann@yahoo.com 189 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 189-194 • Asimetría de densidad: es la presencia de tejido glandular en una parte de la mama que no presenta una localización similar en la mama contralateral, puede estar asociada a microcalcificaciones. • Otras anormalidades: retracción de la piel y el pezón, engrosamiento de la piel, engrosamiento trabecular, lesiones de la piel y linfadenopatía axilares entre otras. En el informe de la mamografía se utiliza la clasificación BIRADS (Breast Imaging Report and Database System), del Colegio Americano de Radiología: BIRADS 1: Examen normal. BIRADS 2: Hallazgos benignos. BIRADS 3: Hallazgos muy probablemente benignos, pero que requieren control en un intervalo corto, a los seis meses. Posibilidad de malignidad de 5%. BIRADS 4: Hallazgos que hacen sospechar al radiólogo la posibilidad de un cáncer, por lo cual es necesario una biopsia. Posibilidad de malignidad entre 20% a 25%. BIRADS 5: Hallazgo altamente sugerente de cáncer. Biopsia indispensable. Posibilidad de malignidad mayor a 95%. BIRADS 6: Paciente con cáncer de mama diagnosticado y que se controla entre tratamientos previo a la cirugía. Ejemplo: quimioterapia neoadyuvante. BIRADS 0: Estudio incompleto, son necesarias proyecciones adicionales y/o ecotomografía. Figura 2. Nódulo benigno, flecha marca halo de seguridad. Nódulos Los nódulos benignos suelen tener bordes bien definidos, pueden presentar halo de seguridad, y en ocasiones, calcificaciones gruesas en su periferia que aumentan con el tiempo. También son imágenes benignas los galactoceles que son de aspecto típico. En las Figuras 2 a 4, se muestran ejemplos de diferentes nódulos benignos. Los nódulos malignos son aquellos de bordes mal definidos o espiculados, pueden asociarse a microcalcificaciones y a veces presentan extensión intraductal, que se denomina cola de cometa (Figuras 5 y 6). En estos casos se puede complementar el estudio con ultrasonografía, que permite caracterizarlos mejor. Figura 3. Nódulo benigno, calcificado. Microcalcificaciones El principal valor de encontrar microcalcificaciones en la mamografía es diagnosticar cáncer ductal in situ (CDIS). 190 Figura 4. Nódulo benigno, galactocele. PATOLOGÍA MAMARIA E IMÁGENES Figura 5. Nódulo sospechoso, bordes mal definidos, BIRADS 4. Figura 6. Densidad espiculada asociada a microcalcificaciones, BIRADS 5. Las calcificaciones se pueden disponer de diferentes formas y tamaños según su ubicación y fisiopatología, es decir, pueden ubicarse aisladamente en la mama o agrupadas. Las microcalcificaciones se producen mayoritariamente por procesos benignos; cuando éstas están agrupadas requieren evaluación (magnificación), sin embargo, sólo el 20% de las agrupadas representan enfermedad maligna. El análisis morfológico cuantitativo y cualitativo de las calcificaciones ha sido utilizado para predecir la estirpe histológica del tejido que las contiene: • Las calcificaciones cutáneas son en general de baja densidad y a menudo poseen un centro radio-lúcido parecido al glóbulo rojo. • Las calcificaciones vasculares son fácilmente reconocibles como líneas paralelas entrecortadas con un patrón tubular. En ocasiones, si sólo una pared de una arteria se encuentra calcificada, puede ser más difícil su caracterización. • Groseras calcificaciones, con forma de «palomitas de maíz» (popcornlike), se asocian a fibroadenomas en involución. • Largas calcificaciones en vara (rodlike) son características de enfermedad secretora, también conocida como mastitis a células plasmáticas. Éstas surgen en patrón ductal hacia el pezón. • Son comunes las calcificaciones de suturas en mamas operadas y luego irradiadas (es posible ver incluso los nudos). Clásicamente se define como microcalcificación a toda aquella que mide en su diámetro máximo hasta un milímetro. Las calcificaciones redondas pueden variar en su tamaño, cuando son muy pequeñas, <0,5 mm con márgenes bien definidos, son llamadas «puntiformes». Las calcificaciones mayores con un centro más lúcido, pueden corresponder a calcificaciones de las paredes de un quiste; si el grosor del borde es mayor pueden en general corresponder a necrosis grasa. Las calcificaciones asociadas con patología maligna pueden aparecer como hallazgo único o asociadas a distorsión del parénquima o a una masa. La mayoría de los autores clasifican el grado de sospecha de las microcalcificaciones según su morfología y forma de agruparse, siendo de mayor grado de sospecha las lineales o ramificadas que las puntiformes y las agrupadas que las dispersas. De la Fontan evaluó 400 casos de microcalcificaciones agrupadas que tuvieron como mínimo cinco calcificaciones, encontrando ocho características que resultaron estadísticamente significativas para sospecha de carcinoma: 1. Número de microcalcificaciones por cm2. 2. El diámetro medio de las microcalcificaciones. 3. Número total de microcalcificaciones. 4. Irregularidad en la densidad de las microcalcificaciones. 5. Irregularidad en los tamaños. 6. Formas lineales o ramificadas. 7. Alta densidad. 8. Calcificaciones vermiculares. 191 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 189-194 Según su morfología y distribución a las microcalcificaciones se les asigna una categoría de riesgo y probable etiología. Se consideran BIRADS 2 las típicamente benignas, ilustradas en el siguiente esquema, BIRADS 3 las intermedias y BIRADS 4 y 5 las sospechosas (Figura 7). Ejemplos de mamografías con microcalcificaciones (Figuras 8, 9, 10). Figura 7. Microcalficaciones BIRADS 2. Figura 9. Microcalcificaciones benignas, puntiformes, BIRADS 3. 192 En general la conducta frente a la presencia de las microcalcificaciones va a depender de sus características y, por lo tanto, del BIRADS: Cabe señalar, que en Chile por ley GES todo caso de microcalcificaciones y/o nódulos y/o densidades asimétricas BIRADS 4 ó 5 implican estudio histológico, ya sea por biopsia percutánea o excisional. Figura 8. Microcalcificaciones, vasculares, BIRADS 2. Figura 10. Microcalcificaciones agrupadas sospechosas, heterogéneas, heterodensas. BIRADS 4. PATOLOGÍA DENSIDAD ASIMÉTRICA En el caso de encontrarnos con una densidad en la mamografía debemos ver, si ésta es igual, menor o mayor que el tejido circundante, si existe o no la presencia de contenido graso, ya sea en parte o en la totalidad de la lesión (Figura 11). Se debe pedir en estos casos exámenes complementarios como una compresión focalizada de la zona de la densidad asimétrica y/o una ecografía mamaria para hacer el diagnóstico diferencial entre una alteración real o la presencia de un acúmulo de tejido que puede simular una densidad asimétrica. MAMARIA E IMÁGENES II. ECOGRAFÍA Es el hallazgo mamográfico más difícil de identificar, se asocia a carcinoma lobulillar y cicatriz radiada. Requiere estudio complementario con proyecciones adicionales (compresión focalizada) que evidencian más la desestructuración del parénquima. La ultrasonografía también puede ser de utilidad. (Figura 12). El ultrasonido mamario ha tenido un gran desarrollo en los últimos años. Permite caracterizar imágenes visualizadas a la mamografía y discriminar entre nódulos sólidos y quísticos. Nódulo sólido es aquel hipoecogénico en el que se aprecia una sombra acústica tras el paso del sonido (Figura 13a). Por su parte los quistes, son más hipoecogénicos y producen un refuerzo del sonido (refuerzo blanco) tras la amplificación del sonido al atravesar el medio líquido (Figura 13b). La ecografía permite también detectar imágenes sólidas intraquísticas como los papilomas intraductales y evaluar vascularización de los nódulos a la señal doppler. Stavros y cols. en 1995, estudiaron el aspecto ecográfico de las lesiones sólidas y definieron características morfológicas que por su frecuente asociación con cáncer, permitieron clasificar los nódulos mamarios sólidos en tres grupos, según su riesgo relativo de cáncer de mama: Nódulo probablemente benigno. Nódulo probablemente maligno. Nódulo indeterminado. Figura 11. Densidad asimétrica. Figura 12. Distorsión de la arquitectura. Figura 13a. Nódulo sólido benigno. Figura 13b. Quiste simple. Distorsión de la arquitectura 193 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 189-194 Figura 14. Nódulo sospechoso. Nódulos sospechosos vascularizados, BIRADS 5. Figura 15. Captación bifocal en mama izquierda. Criterios de benignidad según Stavros Las características de benignidad: • Iso o hiperecogenicidad. • Lobulaciones (3 o menos). • Forma elipsoide y presencia. • De cápsula delgada. Para que una lesión fuera clasificada benigna no debe poseer ningún criterio de malignidad y tener alguna de las siguientes combinaciones: hiperecogénica, con forma elipsoide y cápsula ecogénica o con 2 ó 3 lobulaciones y cápsula ecogénica. Criterios de malignidad según Stavros Los • • • • • • • hallazgos considerados malignos: Espiculaciones. Márgenes angulares. Marcada hipoecogenicidad. Sombra acústica posterior. Presencia de calcificaciones. Extensión ductal. Microlobulación. Las lesiones se clasifican como indeterminadas si no cumplen con los criterios de benignidad o malignidad. LECTURAS – – RECOMENDADAS PÉREZ SÁNCHEZ A. Enfermedades Benignas de la Mama 2003; 46: 818-36. PÉREZ SÁNCHEZ A. Cáncer de Mama. 2003; 47: 836-73. 194 Curva con patrón neoplásico. En la Figura 14, se muestran ejemplos de nódulos sospechosos. III. RESONANCIA MAGNÉTICA Se basa en la captación exagerada de Gadolinio por las células neoplásicas que experimentan angiogénesis. Su uso ha aumentado en forma exponencial a pesar de ser un examen muy costoso. Se solicita cuando se sospecha pudiera cambiar la conducta quirúrgica. Su uso ha producido un aumento en las mastectomías, sin que esto haya significado un aumento en la sobrevida. Son indicaciones: • Evaluación de extensión. • Monitorización quimioterapia neoadyuvante. • Evaluar bilateralidad. • Prótesis complicadas. • Cáncer de mama familiar (tamizaje). • Cáncer de mama oculto. En la Figura 15, se muestra resonancia magnética mamaria, con captación anormal izquierda y curva patológica representativa de neoplasia. – – ALBARRACÍN A. Microcalcificaciones mamarias: Evaluación y Manejo. 2005. Fotos gentileza Dr. Sandoval G, Radiólogo Unidad de Patología Mamaria CRS Cordillera Oriente. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 195-200 ARTÍCULO Efectividad del screening mamográfico anual y costos de la implementación de un Programa de Detección Precoz en el Servicio de Salud Metropolitano Oriente Bernardita Blümel M1, Paula Escobar O2, Gonzalo Sandoval S3. INTRODUCCIÓN El cáncer de mama es la neoplasia maligna más frecuente en la mujer occidental y la principal causa de muerte por cáncer en la mujer en Europa y Estados Unidos. En Norteamérica, el cáncer de mama da cuenta del 26% de los cánceres que afectan a la mujer. En el año 2007, aproximadamente 178.480 mujeres fueron diagnosticadas con cáncer de mama y 40.460 mujeres fallecieron de la enfermedad1. En Europa constituye la principal causa de mortalidad femenina entre los 35 y los 55 años; en el Reino Unido se reportaron 35.000 casos nuevos y 13.000 fallecimientos2. En Chile, la incidencia del cáncer de mama es desconocida, dado que la notificación se realiza sólo a nivel de los 28 Servicios de Salud que conforman la red del sistema público, que corresponde a alrededor del 70%-75% de la población total chilena, y es limitada sólo a algunos centros en el sistema privado. Es por esto que la incidencia de cáncer de mama en la mujer chilena se ha estimado a partir del grupo de beneficiarias mayores de 15 años, calculándose para el año 2003 una tasa de 36,8 por 100.000 mujeres3. En cuanto a la mortalidad, desde el año 2000 representa la segunda causa de muerte por cáncer en la mujer después del cáncer de vías biliares y se ha mantenido estable en los últimos años con tasas entre 12 y 13 x 100.000 mujeres4. Se conoce que la incidencia de cáncer de mama aumenta progresivamente a partir de los 35 a 40 años, presentando una curva bimodal con mayores tasas entre los 45 a 65 años4. Antes de los 20 años es excepcional. Se calcula un riesgo de 1 en 20.000 para mujeres menores de 25 años que se eleva hasta 1 en 9 para mujeres de 85 y más años5,6. Un análisis epidemiológico efectuado en el Servicio de Salud Metropolitano Central, evidenció que el 65% de los cánceres de mama ocurrió en mujeres entre 35 y 65 años destacándose mayor frecuencia en el grupo de mujeres de 40 a 50 años7. Una de las estrategias que ha demostrado reducir la mortalidad por cáncer de mama ha sido la implementación de programas de screening (o tami- 1 Becada de Obstetricia y Ginecología. Hospital Clínico Universidad de Chile. 2 Médico. Especialista en Obstetricia y Ginecología. Unidad de Patología Mamaria. Servicio Obstetricia y Ginecología. Hospital Dr. Luis Tisné Brousse. Profesor Asistente Departamento Cirugía. Facultad de Medicina. Universidad de Chile. 3 Servicio de Radiología, Hospital Dr. Luis Tisné Brousse. CRS Cordillera. E mail: paulaescobaro@yahoo.com 195 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 195-200 zaje) mamario dentro del cual se encuentra como pilar fundamental la mamografía. El objetivo primario de este trabajo es realizar una revisión de la utilidad de la mamografía como test de screening y estimar el costo de la implementación de un programa masivo de screening a nivel público a toda mujer entre 40 y 69 años beneficiaria del Servicio de Salud Metropolitano Oriente (SSMO). Efectividad del screening mamográfico en la reducción de la mortalidad por cáncer de mama. El screening se define como un examen de rutina realizado a una población asintomática que no tiene signos o síntomas evidentes, y así detectar la enfermedad en etapas tempranas y realizar tratamiento oportuno con el objetivo de disminuir la mortalidad. El cáncer de mama cumple con los requisitos para una pesquisa precoz: alta prevalencia, su tratamiento en etapas precoces está asociado a menor morbilidad, mayor probabilidad de curación y menor costo que cuando el tratamiento es realizado en etapa localmente avanzada. El screening a través de la mamografía anual después de los 40 años de edad diagnostica lesiones no palpables, correspondientes a estadios precoces que pueden tener 95%-98% de sobrevida a 10 años. A partir de 1963 se han publicado ocho estudios randomizados que han evaluado la efectividad de la mamografía8-15: cuatro estudios en Suecia que compararon la mamografía versus no realizar screening, uno en Edimburgo, Escocia, uno en Nueva York y uno en Canadá que compararon la combinación de mamografía y examen físico mamario versus no realizar screening; y uno en Canadá que evaluó el efecto de adicionar la mamografía al examen clínico estandarizado de la mama (Tabla 1). Los estudios difirieron en el tipo de mamografía utilizada, el intervalo entre mamografías, el método de randomización, la edad de las mujeres incluidas y el método de análisis. Para las mujeres entre 50 y 69 años de edad, todos los estudios demostraron el efecto protector de screening. Los metaanálisis que incluyeron todos los estudios demostraron una reducción estadísticamente significativa de la mortalidad por cáncer de mama entre 20% a 35%, beneficio que se evidenció a partir de los 5 años16. Sin embargo, una publicación de dos investigadores daneses del año 2000, cuestionó la metodología de dichos estudios y concluyó que sólo tres de los ocho estudios randomizados eran de suficiente calidad para determinar la efectividad de la mamografía. El metaa- Tabla 1. Tabla comparativa de los ocho estudios randomizados que evaluaron la efectividad de la mamografía Estudio Rango edad (años) Protocolo de screening Intervalo (meses) Invitadas Control Años seguim. Reducción de riesgo mortalidad Hip (1963-1969) 40-64 M + EFM 12 31.000 31.000 18 23% Edinburgh (1979-1988) 45-64 M + EFM 24 23.000 23.000 14 36% Swedish twocountry study 40-74 M 24 (40-49a) 33 (mayor 50a) 77.058 52.661 20 32% Malmo (1976-1990) 43-70 M 18-24 30.662 29.407 12,7 ns Stockholm (1981-1985) 40-64 M 28 40.000 20.000 11,4 26% Gothenburg (1982-1988) 39-59 M 18 21.000 30.611 12 44% en 39-49 a n.s en 50-54 a CNBSS-1 (1980-1987) 40-49 M+EFM+AEM vs EFM+ AEM 12 25.214 25.216 16 -7% CNBSS-2 (1980-1987) 50-59 M+EFM+AEM vs. EFM + AEM 12 19.711 19.694 13 ns EFM: AEM: M: 196 Examen físico mamario Autoexamen mamario Mamografía EFECTIVIDAD DEL SCREENING MAMOGRÁFICO ANUAL Y COSTOS DE IMPLEMENTACIÓN DEL nálisis de estos tres estudios no demostró efectos benéficos de la mamografía16. Sin embargo, estos investigadores fueron criticados en aspectos metodológicos, por lo que finalmente se concluye que no es posible negar la efectividad de la mamografía, especialmente para mujeres mayores de 50 años17,18. EDAD DE INICIO Y DE TÉRMINO DEL SCREENING Existía controversia en cuanto a la edad de ingreso a un programa de pesquisa y la eficacia de éste; especialmente en el uso del screening mamográfico en el grupo de mujeres de 40 a 49 años. Antiguamente se estimaba que sólo existía un claro beneficio sobre la reducción de mortalidad en mujeres mayores de 50 años19. Sin embargo, en los últimos años se ha podido apreciar que este beneficio se extiende también al grupo de 40 a 49 años20. En general, la reducción de la mortalidad en mujeres menores de 50 años es de menor magnitud y se hace evidente al cabo de un período de observación más prolongado que el necesario para ver el mismo beneficio que en las mayores de 50 años21,22. Esto sería atribuible a que los estudios han asignado un intervalo de control demasiado largo (dos años) a este grupo etario. Tres metaanálisis han demostrado que el screening en este grupo etario, reduce en alrededor de 20% la mortalidad por cáncer de mama después de un seguimiento superior a 10 años17,23,24. Esta diferencia podría resultar por la mayor densidad mamaria en mujeres más jóvenes (lo que reduce la sensibilidad del examen) y la diseminación más rápida de algunos cánceres25. En mujeres mayores de 70 años no se ha confirmado el beneficio del screening mamográfico en la reducción de la mortalidad por cáncer de mama. Dado que pocas mujeres mayores de 70 años participaron en los estudios randomizados, no es posible obtener mayores conclusiones25. PROGRAMA FRECUENCIA DE DETECCIÓN PRECOZ EN EL SSMO DEL SCREENING En cuanto a la frecuencia, algunos sugieren que un control cada dos años sería suficiente. El intervalo cada dos años ha demostrado cierta reducción de la mortalidad por cáncer de mama en las mayores de 50 años26, pero es demasiado largo para ser suficientemente efectivo en reducir la mortalidad en las menores de 50 años quienes suelen tener tumores más agresivos21,22,27. Actualmente existe evidencia que el examen anual es más beneficioso. Tabar y col., estimaron que la sensibilidad de la mamografía en las mujeres de 40 a 49 años es del 83% y en las de 50 a 69 años es del 100%28. Con esa sensibilidad y con aproximadamente 90% de cumplimiento del programa se ha estimado la disminución de la mortalidad en las distintas décadas según el intervalo de controles. Como se puede ver en la Tabla 2, es en el grupo de 40 a 49 años donde es más significativa la diferencia en la reducción de la mortalidad, al comparar los distintos intervalos. En resumen, la evidencia que avala la utilidad del screening mamográfico es más fuerte para mujeres entre 50-69 años de edad y debería ser recomendado de rutina. Para las mujeres entre los 40-49 años de edad, el beneficio del tamizaje es menor y a más largo plazo, por lo que el screening debería ser discutido entre el médico y el paciente. Sin embargo, al realizar un control mamográfico con un tiempo de intervalo anual en este grupo etario, la reducción de la mortalidad se hace más evidente. Actualmente la American Cancer Society, el American College of Radiology, el National Cancer Institute y numerosas sociedades científicas recomiendan el uso de la mamografía en forma anual a partir de los 40 años en toda mujer asintomática 25. Tabla 2. Estimación de la disminución de la mortalidad en las distintas décadas según el intervalo de controles Mujeres de 40-49 años Mujeres de 50-59 años Mujeres de 60-69 años Control Control Control Control Control Control Control Control Control anual cada 2 cada 3 anual cada 2 cada 3 anual cada 2 cada 3 años años años años años años 36% 18% 4% 46% 39% 34% 44% 39% 34% 197 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 195-200 EXPERIENCIA NACIONAL Chile cuenta con un Programa Nacional de Cáncer de Mama implementado por el Ministerio de Salud a partir de 1995. Este programa protocoliza la pesquisa de los tumores palpables y la derivación de los casos sospechosos o con historia familiar de cáncer mamario a las Unidades de Patología Mamaria. Así el 81,8% de los ingresos fue por tumor palpable; sólo el 14% de los cánceres se diagnosticó mediante mamografía y permitió un aumento del diagnóstico de etapas I-II de 53% en 1995 a 67,6% en 200029. Actualmente no existe a nivel nacional un programa anual de screening mamográfico. Existen dos grupos que han publicado su experiencia en la implementación de un programa de pesquisa precoz de cáncer de mama mediante mamografía. La primera es la de Instituto de Radiomedicina (IRAM) realizada en una población de mujeres asintomáticas mayores de 40 años beneficiarias de la Isapre Fundación del Banco del Estado. El estudio incluyó 2.749 mujeres entre 40 y 75 años. En el período comprendido entre enero de 1988 y diciembre de 1997, se diagnosticaron mediante mamografía 3,3 nuevos casos por 1.000 mujeres examinadas al año, resultados similares a otros estudios. De 34 cánceres encontrados, 32 fueron tratados con cirugía conservadora (94%) y 17/34 (50%) fueron no palpables al momento del diagnóstico. El estudio contó con un grupo control, y las mujeres del grupo intervenido se beneficiaron con el diagnóstico de cánceres más pequeños, con un mayor porcentaje de cánceres ocultos (50% v/s 9%), con un mayor porcentaje de tratamientos conservadores (94% v/s 64%) y, finalmente con una mayor sobrevida libre de enfermedad (86% v/s 70%) a cinco años30. El segundo reporte fue presentado por el Hospital Clínico FUSAT, quienes publicaron su experiencia durante el período de enero 1975 a diciembre 2000, con un total de 126 casos de cáncer de mama. Desde el año 1993 se inició un programa de screening mamario con control médico y mamográfico cada dos años en mujeres de 45 a 70 años. Se comparó la sobrevida 8 años antes y 8 años después de iniciado el screening, observándose un aumento importante en la detección de tumores en estadio subclínico y además un aumento significativo (p =0,04) en la sobrevida de 31% al comparar el período con screening respecto del sin tamizaje31. Estos estudios han demostrado la factibilidad de realizar un programa de detección precoz de cáncer de mama, ofreciendo la ventaja del tratamiento conservador junto con un aumento en la sobrevida. IMPLEMENTACIÓN DE UN PROGRAMA DE SCREENING MAMOGRÁFICO EN SSMO Actualmente, la evidencia disponible valida la implementación de programas de detección precoz mediante mamografía en la mujer asintomática entre los 40 y 69 años. Un programa de pesquisa precoz, financiado y bien organizado, parece ser un objetivo razonable de alcanzar y que puede ser logrado en nuestro medio. En promedio 11% de las mamografías son informadas como anormal y necesitan mayor evaluación diagnóstica; encontrándose cáncer de mama en el 3% de todas las mujeres con un examen anormal (representando el 0,3% de todas las mamografías)25. El cálculo por año salvado sería de U$ 105.000 en las mujeres de 40 a 49 años, y U$ 21.400 para las de 50 a 59 años32. A continuación se propone el costo anual de la implementación de un programa masivo de screening a nivel público en el SSMO para el grupo de mujeres entre 40 y 69 años. El número de mujeres entre 40 y 69 años candidatas a participar del programa de screening se determinó en base a la población beneficiaria estimada en diciembre 2007, publicada por el Fondo Nacional de Salud y el SSMO33,34 (Tabla 3). Tabla 3. Número de mujeres beneficiarias del SSMO, candidatas a screening de cáncer de mama por grupo de edad estimadas para diciembre del 2007 según FONASA 198 Rango de edad Nº de mujeres 40-44 años 45-49 años 50-54 años 55-59 años 60-65 años 66-69 años Total 18.580 17.017 14.623 13.582 17.442 16.347 97.591 EFECTIVIDAD DEL SCREENING MAMOGRÁFICO ANUAL Y COSTOS DE IMPLEMENTACIÓN DEL El SSMO tiene asignado 9 comunas con una población total estimada de 1.178.146 habitantes. La población beneficiaria del Fondo Nacional de Salud se estima en 504.036 (42,8%), de los cuales 281.471 son mujeres. El grupo etario entre 40 y 69 años al cual estaría orientado el programa, se calcula en un total de 97.591 mujeres. Considerando que la mamografía bilateral tiene un costo de $ 13.030 (costo actual en modalidad institucional)33, el costo total anual de un programa de screening mamográfico realizado una vez al año a todas las mujeres entre 40 y 69 años beneficiarias del SSMO, sería de 1.271 millones de pesos. Si consideramos que el Proyecto de Presupuestos Nacional 2008 asignó 37.825 millones de pesos para cubrir los costos del programa de salud del Plan AUGE y 9.764 millones de pesos para el programa Transantiago35, en términos comparativos el costo del programa de screening mamográfico en SSMO, correspondería a 13% del gasto asignado al Transantiago o a 3,3% del gasto asignado al plan AUGE. Si bien son conocidos los beneficios de implementar un programa de screening mamográfico, analizando estas cifras parece poco razonable que el Estado asigne un presupuesto a un programa de tan alto costo y destinado a beneficiar a un porcentaje pequeño de la población. REFERENCIAS 1. LESTER J. Breast Cancer in 2007: Incidence, Risk Assessment, and Risk Reduction Strategies. Clin J Oncol Nurs 2007; 11: 619-22. 2. WILLETT W, ROCKHILL B, HANKINSON S, HUNTER D, COLDITZ G. Diseases of the Breast. Epidemiology and nongenetic causes of breast cancer. En: J. R. Harris, M. E. Lippman, editors. Philadelphia; Lippincott Williams & Wilkins; 2000; 175-220. 3. Ministerio de Salud. Guía Clínica cáncer de mama en personas de 15 años y más. 1st Ed. Santiago. Minsal, 2005. Disponible en: www.minsal.cl [Consultado el 1 de diciembre de 2008]. 4. Ministerio de Salud. Protocolo AUGE. Diagnóstico y tratamiento de cáncer de mama. Comisión nacional de cáncer de mama. Unidad de Cancer. Abril 2004. Disponible en: www.minsal.cl [Consultado el 1 de diciembre de 2008]. 5. WILLETT W, ROCKHILL B, HANKINSON S, HUNTER D, COLDITZ G. Diseases of the Breast. Epidemiology and nongenetic causes of breast cancer. En: J. R. Harris, M. E. Lippman, editors. Philadelphia; Lippincott Williams & Wilkins; 2000; 175-220. PROGRAMA DE DETECCIÓN PRECOZ EN EL SSMO CONCLUSIÓN El cáncer de mama es la neoplasia maligna más frecuente en la mujer occidental y a nivel mundial se estiman que es la primera causa de muerte. La evidencia disponible avala la implementación de un programa de screening mamográfico a partir de los 40 años Existe evidencia nacional del beneficio de implementar un programa de screening mamario. Sin embargo, en nuestro país estamos lejos de contar con un programa de screening financiado por el estado, dado que al evaluar la implementación de un programa mediante mamografía en la mujer asintomática entre los 40 y 69 años en una población limitada al SSMO, los costos parecen poco razonables, representando el 13% del gasto asignado al Transantiago o el 3,3% del gasto asignado al plan AUGE, programas implementados a nivel regional o nacional. Sin embargo, como médicos tenemos un importante rol en la concientización de las autoridades para mejorar la disponibilidad y la calidad de la mamografía y en la educación de nuestras pacientes recalcando la importancia del cumplimiento del control anual. 6. GUINEE V. Epidemiology of breast cancer. In: Bland K, Copeland E (eds). The Breast. 2nd ed., 1998; 1: 339-51. 7. PERALTA M. Cáncer de Mama en Chile. Datos Epidemiológicos. Rev Chil Obstet Ginecol 2002; 67: 439-45. 8. SHAPIRO S. Periodic screening for breast cancer: the HIP Randomized Controlled Trial. Health Insurance Plan. J Natl Cancer Inst Monogr 1997; 22: 27-30. 9. ALEXANDER FE, ANDERSON TJ, BROWN HK, FORREST AP, HEPBUM W, KIRKPATRICK AE ET AL. 14 years of follow-up from the Edinburgh randomised trial of breastcancer screening. Lancet 1999; 353: 1903-8. 10. DUFFY S, TABAR L, VITAK B, YEN MF, WARWICK J, SMITH RA, ET AL. The Swedish Two-County Trial of mammographic screening: cluster randomization and end point evaluation. Ann Oncol 2003; 14: 1196-8. 11. TABAR L, DUFFY S. Malmö mammographic screening trial. BMJ 1989; 298: 48-9. 12. FRISELL J, LIDBRINK E, HELLSTRÖM L, RUTQVIST L-E. Followup after 11 years—update of mortality results in the Stockholm mammographic screening trial. Breast Cancer Res Treat 1997; 45: 263-70. 13. BJURSTAM N, BJÖRNELD L, WARWICK J, SALA E, DUFFY S, NYSTRÖM L, ET AL. Gothenburg Breast Screening Trial. Cancer 2003; 97: 2387-96. 199 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 195-200 14. MILLER AB, BAINES CJ, TO T, WALL C. Canadian National Breast Screening Study: 1. Breast cancer detection and death rates among women aged 40 to 49 years. CMAJ 1992; 147: 1459-76. 15. MILLER AB, BAINES CJ, TO T, WALL C. Canadian National Breast Screening Study: 2. Breast cancer detection and death rates among women aged 50 to 59 years. CMAJ 1992 147: 1477-88. 16. GOTZSCHE PC, OLSEN O. Is screening for breast cancer with mammography justifiable? Lancet 2000; 355: 129-34. 17. US PREVENTIVE SERVICES TASK FORCE. Screening for breast cancer: recommendations and rationale. Ann Intern Med 2002; 137: 344-6. 18. VAINIO H, BIANCHINI F. Breast cancer screening. Lyons, France: IARC Press, 2002. 19. SHAPIRO S. Periodic breast cancer screening in seven foreing countries. Cancer 1992; 69: 1919-24. 20. KOPANS DB. Screening for breast cancer and mortality reduction among women 40-49 years of age. Cancer 1994; 74: 311-22. 21. SHAPIRO S, VENET W, STRAX P, VENET. Periodic Screening for Breast Cáncer: The Health Insurance Plan Project and Its Sequelae, 1963-1986. Baltimore, Md: Johns Hopkins University Press 1988. 22. NYSTRÖM L, RUTQVIST LE, WALL S, LINDGREN A, LINDQVIST M, RYDEN S, ET AL. Breast cancer screening with mammography: overview of Swedish randomised trials. The Lancet 1993; 341: 973-8. 23. HENDRICK RE, SMITH RA, RUTLEDGE JH, SMART CR. Benefit of screening mammography in women ages 40-49: a new metaanalysis of randomized controlled trials. J Natl Cancer Inst Monogr 1997; 22: 87-92. 200 24. BERRY DA. Benefits and risks of screening mammography for women in their forties: a statistical appraisal. J Natl Cancer Inst 1998; 90: 1431-9. 25. FLETCHER SW, ELMORE JG. Clinical practice. Mammographic Screening for Breast Cancer. N Engl J Med 2003; 348: 1672-80. 26. Breast Cancer Screening for Women Ages 40-49. NIH Consens Statement Online 1997 Jan 21-23; 15: 1-35. [Consultado 1 diciembre 2008]. 27. D’ORSI CJ. To follow or not to follow, that is the question. Radiology 1992; 184: 306. 28. TABAR L, FAGERBERG G, CHEN HH, DUFFY SW, SMART CR, GAD A ET AL. Efficacy of breast cancer screening by age: New Results from The Swedish two-county trial. Cancer 1995; 75: 2507-17. 29. DONOSO E, CUELLO M. Mortalidad por Cáncer en la Mujer Chilena. Análisis Comparativo entre los años 1997 y 2003. Rev Chil Obstet Ginecol 2006; 71: 10-6. 30. ACEVEDO JC, ET AL. Programa de Screening y tratamiento de Cáncer de Mama. Rev Chilena de Cancerología 1998; 8: 27-34. 31. SEPÚLVEDA E, VILLAGRÁN H, LAGOS M. Cáncer de Mama en FUSAT. Revisión de 26 años. Contribuciones Científicas y Tecnológicas, Área Ciencias Médicas N° 131, diciembre de 2002 32. TENGS TO, ADAMS ME, PLISKIN JS, SAFRAN DG, SIEGEL JE, WEINSTEIN MC, ET AL. Five-hundred life-saving interventions and Their cost-effectiveness. Risk Anal 1995; 15: 369-90. 33. www.fonasa.cl [Consultado 1 de diciembre 2008]. 34. www.saludoriente.cl [Consultado 1 de diciembre 2008]. 35. www.dipres.cl [Consultado 1 de diciembre 2008]. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 201-206 ARTÍCULO Patología mamaria benigna Karen Junemann U. INTRODUCCIÓN La consulta por patología mamaria de tipo benigna es la más frecuente, siendo el principal motivo de consulta. La dificultad en cuanto a este tipo de patología es su nomenclatura. Existen múltiples clasificaciones distintas, en ocasiones confundentes, dado que existe una línea sutil entre la normalidad y la anormali- dad. Además, existen clasificaciones netamente clínicas y otras de tipo histológico. Consideramos que la mejor manera de clasificarlos actualmente es acorde a la clasificación ANDI, la cual busca unificar los conceptos sintomatológicos con los histológicos y lo más importante, con los conceptos fisiológicos según la edad y por consiguiente, la etapa del desarrollo de las mujeres (Tabla 1). Tabla 1. Clasificación ANDI Médico. Especialista en Obstetricia y Ginecología, Unidad de Patología Mamaria, Servicio Obstetricia y Ginecología, Hospital Dr. Luis Tisné Brousse. E mail : kjunemann@yahoo.com 201 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 201-206 Otro problema de la patología benigna es la ansiedad que produce en la paciente y en cuanto a su evaluación de potencial premaligno. De esta manera, la forma más fácil de entender y enfrentar la patología benigna es según el síntoma que motiva a la paciente a consultar. MASTALGIA El dolor mamario constituye entre 45% a 85% de las consultas. Este se puede presentar de forma uni o bilateral. Generalmente se localiza en los cuadrantes superiores externos (existe mayor concentración de tejido mamario en esta zona) (Figura 1). Las características del dolor son variadas pero se presenta frecuentemente como dolor tipo punzante, cansado o de distensión. Es importante caracterizar el dolor y definir si es de tipo cíclico o no cíclico. Es muy raro que el cáncer de mama se relacione con dolor, salvo casos específicos como los cánceres localmente avanzados o los de tipo inflamatorio. El dolor de tipo cíclico se presenta principalmente en mujeres jóvenes, de forma bilateral, premenstrual y tiende a la resolución con la menstruación (5 días). Existiría una eventual relación con el consumo de cafeína, grasas, tabaco y eventualmente con factores psicológicos. El dolor no cíclico se considera el verdadero dolor mamario. Suele ser unilateral y más bien localizado a una zona o cuadrante específico. Es el menos frecuente no llegando a superar el 25% de las consultas por dolor. Lo importante frente a una paciente con dolor mamario es: • Disminuir la ansiedad que el dolor puede implicar en la paciente. • Caracterizar el tipo de dolor. • Siempre descartar patología con imágenes, sea mamografía y/o ecografía según corresponda. • Si en las imágenes existiera un quiste doloroso y que sea factible puncionarlo, proceder a hacerlo. • Eventualmente se pueden usar fármacos para manejar el dolor. • Se debe enfatizar el tratar de disminuir el consumo de metilxantinas, alcohol, tabaco y cafeína. El manejo farmacológico es principalmente para casos refractarios. Existen múltiples alternativas, la mejor elección va a depender de cada caso y de la edad de la paciente. Algunos ejemplos son: • Ácido linoleico 3 g/d, efectividad 50%-60%. • Danazol 100-600 mg/d, efectividad 70%-90%. • Bromocriptina 5 mg/d, efectividad 60%-80%. • Tamoxifeno 20 mg/d, efectividad moderada. • Agonistas LHRH efecto en más de 80%. • Antiinflamatorios no esteroidales AINES orales (nimesulida). • AINES tópicos. Cabe señalar que hasta la fecha no existe evidencia que la vitamina E, vitamina B, acetato de medroxiprogesterona o diuréticos sean efectivos. NÓDULOS Constituyen aproximadamente el 20% de la consulta. El 75% de ellos es benigno pero a pesar de esta estadística, siempre se debe tener frente a ellos un enfoque más bien agresivo. Se pueden clasificar en: • Tumores benignos específicos: 1. Fibroadenoma 2. Tumor filodes 3. Tumores papilares 4. Adenoma del pezón o papilomatosis florida 5. Hamartomas • Tumores inespecíficos: lipomas, fibromas, angiomas, leiomiomas, osteomas, condromas, neurinomas. Figura 1. Mastalgia. Síntomas acompañantes. 202 El enfoque va a depender principalmente de los factores de riesgo que presente la paciente, el tiempo de evolución desde la aparición del nódulo, siendo los de corta evolución los más preocupantes. Otra característica PATOLOGÍA importante es la velocidad de crecimiento, siendo los de rápido crecimiento los de mayor sospecha. Se debe ver también si es único o son múltiples y si existen cambios cíclicos, en relación a la aparición/desaparición, crecimiento, disminución de tamaño, presencia o no de dolor. Al enfrentar a una paciente con nódulo mamario, se debe realizar examen físico acucioso y de esta manera caracterizar el o los nódulos. En términos generales, un nódulo de características benignas será de consistencia elástica, de bordes regulares, bien definidos y móviles o libres; por el contrario, un nódulo sospechoso será aquel de consistencia aumentada o duro, de bordes irregulares, mal definidos y puede estar fijo, o adherido a otros planos. Por lo tanto, la evaluación de los nódulos implica anamnesis detallada, examen físico completo y posteriormente evaluación con imágenes, sea mamografía y/o ecografía mamaria según corresponda. Según los resultados se indicarán o no biopsias para la evaluación histológica de éstos. MAMARIA BENIGNA Tratamiento Existen diversos enfoques: • Observación con controles mediante imágenes periódicas para ver evolutividad. • Confirmación histológica y observación. • La cirugía se indicará cuando: 1. Son de rápido crecimiento. 2. Son de gran tamaño o producen un defecto cosmético. 3. La citología o histología no son concluyentes. 4. Deseo de la paciente (pacientes nódulo-fóbicas). 2) Tumor filodes Es un tumor fibroepitelial, raro (0,3%-0,9% tumores neoplásicos mamarios). Se ve más frecuentemente entre los 40 y 50 años. Son de tamaño variable (suelen ser mayores de 5 cm), raramente bilaterales (menos del 1%) y habitualmente son de tipo benignos (Figura 3). 1) Fibroadenomas Representa al 70% de los tumores benignos de la mama. Se origina en el lobulillo mamario (epitelio y estroma). Aparecen generalmente entre los 25 y 35 años. En el 20% de los casos pueden ser múltiples y en el 15% incluso bilateral. Suelen ser asintomáticos, salvo por la percepción de masa y generalmente miden menos de 3 cm (80%). Al examen se presentan como nódulos de consistencia firme, gomosos, lisos, de forma ovoidea (Figura 2). Las complicaciones son raras y pueden ser hemorragia, infarto y necrosis (embarazo y lactancia) y la degeneración es rarísima. La asociación con cáncer se observa principalmente en mujeres mayores de 40 años. Se puede ver cáncer en su interior en menos del 1% y/o puede encontrarse un cáncer en el tejido adyacente. Figura 2. Fibroadenoma mamario. Figura 3. Tumor Filodes: a) Imagen mamografía, b) ultrasonografía, c) histología. 203 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 201-206 Generalmente se presenta como «fibroadenoma» de rápido crecimiento. Al examen podemos encontrar un tumor con una superficie abollonada, generalmente blando, bien delimitado. Casi siempre es indoloro, pudiendo presentar signos cutáneos por distensión. Existe tendencia a la recidiva local de aproximadamente 15% y eventualmente pueden producir metástasis entre 3% y 7% de los casos. Tratamiento Es siempre quirúrgico, con márgenes amplios. 3) Tumores papilares – Se localizan en el interior de los conductos. Se caracterizan por ser una lesión pediculada con un eje conjuntivo vascular. – Pueden ser únicos o múltiples. – Se clasifican en: - Papiloma intracanalicular - Papilomas múltiples (más frecuente en pacientes jóvenes). - Papilomatosis juvenil. Generalmente son pequeños pero visibles. Se pueden presentar como hallazgo por imágenes, asintomático, presentar secreción hemática o agua de roca por el pezón, o nódulo palpable y/o en imágenes. El manejo es quirúrgico. 4) Adenomas del pezón (papilomatosis florida del pezón) Se presentan generalmente entre los 30-40 años. La clínica puede ser muy variada, presentándose como nódulo del pezón, ulceración, prurito o sensibilidad del pezón. Se puede o no encontrar descarga asociada por el pezón. La malignización es rara. El tratamiento es quirúrgico. 5) Hamartomas Tumor bien encapsulado, de tejido glandular, fibroso y adiposo, que se asemeja mucho al resto de la mama, por lo que generalmente es blando y habitualmente único. Pueden ser de gran tamaño y pasar inadvertido en las imágenes, por ser de densidad similar al resto de la mama. Se extrae quirúrgicamente por enucleación. 204 QUISTES El 7% de las mujeres desarrollará quistes mamarios, en forma de macro y/o microquistes. Se presentan con mayor frecuencia entre 40-50 años. En 50% de los casos son únicos, generalmente de aparición súbita. Pueden presentar cambios cíclicos y pueden doler y/o presentarse como masa. La asociación con cáncer es extremadamente rara, pero se debe sospechar cuando al aspirar el quiste durante la punción el aspirado sea de tipo hemorrágico, cuando luego de la punción y/o aspirado quede una masa residual, cuando en el control mamográfico pospunción se vea una densidad asimétrica persistente, cuando exista una recurrencia en más de tres oportunidades y cuando existan componentes intraquísticos sólidos. Tratamiento Aspiración de aquellos palpables o sintomáticos. Citología en caso de duda. Anticonceptivos orales, danazol y tamoxifeno disminuyen dolor. Cirugía en caso de sospecha o en casos de quistes complejos. Descarga por el pezón Es un motivo menos frecuente de consulta, pudiéndose encontrar en 20% de los casos si se hace una búsqueda dirigida. Clasificación: Podemos clasificar a las descargas por el pezón en fisiológicas y no fisiológicas. Fisiológica: Es aquella que se produce principalmente de forma inducida (al exprimir el pezón), generalmente se presenta en forma bilateral, procedente de varios conductos y de tipo serosa. Patológica: Por el contrario, este tipo de secreción o descarga por el pezón tiende a ser espontánea e intermitente, generalmente unilateral. Se puede ver asociado a cáncer en 7% de pacientes menores de 60 años pero en 32% si la paciente es mayor de 60 años. Lo más frecuente es que se trate de papilomas, ectasia ductal o condición fibroquística. El examen físico y la caracterización del tipo de descarga por el pezón es elemental, pues debemos determinar si la secreción es uni o bilateral, de uno o varios ductos, el color, la presencia de secreción hemática y si la secreción se presenta de manera espontánea o inducida. Los tipos más frecuentes son: PATOLOGÍA Serosa: Generalmente se ve en los casos de condición fibroquística, presentándose de forma ocasional y en escasa cantidad. Serohemorrágica-hemorrágica: Generalmente benigno. Pero SIEMPRE implica descartar un cáncer. Verde grisácea: Es la secreción más frecuentemente asociada a la ectasia ductal. Generalmente es MAMARIA BENIGNA espesa por lo que es difícil de observar durante el examen pero existe el antecedente y la eventual visión de que mancha el sostén. Purulento: Se ve habitualmente en procesos inflamatorios infecciosos, de patologías del tejido conectivo. Es importante pues no descarta la presencia de un cáncer. Galactorrea: si se encuentra fuera del embarazo, debe realizarse estudio de prolactina plasmática y de eventual hiperprolactinemia. Manejo Siempre se debe solicitar imágenes para comprobar si existe o no asociación con masas. Si efectivamente está asociado a masa se debiera realizar biopsia de la lesión. Si existiera un papiloma, como se señaló anteriormente, esto implica resección de éste. Si lo que se encuentra es ectasia, se puede observar, indicar antiinflamatorios no esteroidales en forma local y/o por vía oral. Eventualmente, se usará antibiótico y/o corticoide según corresponda. Condición fibroquística Figura 4. Amastia. Constituye 30% de las consultas. Generalmente se presenta en mujeres entre 35 a 45 años. Puede ser uni o bilateral, presentar dolor premenstrual que cede con la menstruación, descarga por el pezón y/o mamas nodulares. Alteraciones del desarrollo Amastia Figura 5. Polimastia axilar bilateral. Se refiere a la ausencia congénita de tejido mamario (Figura 4). Es una patología rara de ver y generalmente va asociada a alteraciones congénitas de tórax y extremidades superiores. Hipoplasia El menor desarrollo del tejido mamario se puede deber a múltiples causas, siendo las más frecuentes e importantes, las alteraciones del desarrollo puberal, la presencia o el antecedente de algún tipo de daño de los tejidos mamarios durante la niñez, la insuficiencia ovárica prematura y las enfermedades de tipo crónicas conjuntivas. Polimastia Figura 6. Polimastia en planta del pie. Se refiere a la presencia de tejido mamario supernumerario a lo largo de la línea de la leche. Las localizaciones más frecuentes son en la línea media del tórax y/o abdomen, en la escápula y genitales externos (Figuras 5 y 6). 205 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 201-206 Figura 7. Asimetría mamaria. Pueden sufrir cáncer como cualquier tejido mamario. Asimetría Se define como aquel desarrollo mamario asimétrico, que puede ser transitorio, durante el desarrollo puberal o permanente (Figura 7). Cuando se presenta durante la adolescencia, se debe observar debido a que solo el 25% de los casos perdura. La solución en estos casos es quirúrgica, ya sea con mamoplastía de aumento, mamoplastía de reducción o una combinación de ambas según sea el caso. LECTURAS RECOMENDADAS – PÉREZ SÁNCHEZ A. Enfermedades benignas de la mama. 2003; 46: 818-36. 206 Hipertrofia Generalmente es de aparición juvenil, presentándose como un crecimiento excesivo de una o ambas mamas durante la adolescencia. La causa es desconocida, eventualmente se debería a una mayor sensibilidad del tejido mamario a las hormonas. Puede conllevar a alteraciones psicológicas, alteraciones de la columna cervical y/o dorsal. El tratamiento es la reducción mamaria, una vez que se haya detenido el crecimiento mamario e idealmente con un índice de masa corporal normal. – – ACEVEDO JC, ALIAGA N. Patología benigna de la mama: información para el médico general. Rev Med Clínica Las Condes 2009; 75-83. SANTEN R. Benign breast disease. Up to Date 2005. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 207-210 ARTÍCULO Procesos inflamatorios benignos de la mama Bárbara Aguilera R. INTRODUCCIÓN Los procesos inflamatorios benignos de la mama representan un capítulo importante en la patología mamaria. Son motivo de consulta frecuente en centros de atención primaria y representan también un motivo de consulta frecuente en servicios de urgencia ginecológica. Afectan preferentemente a mujeres en edad fértil. El diagnóstico de estas lesiones puede resultar sencillo y su tratamiento no ofrecer dificultades, de tal manera que este proceso puede y debe iniciarse a nivel primario de atención. La mayoría de las lesiones inflamatorias mamarias finalmente demostrarán ser benignas. No obstante, el equipo de salud debe estar vigilante excluyendo en cualquier lesión la posibilidad de cáncer de mama, en especial su variante inflamatorio. Se entrega a continuación una breve revisión de los principales cuadros y recomendaciones respecto de su manejo para los centros de atención primaria. PROCESOS INFLAMATORIOS AGUDOS DE LA MAMA Mastitis aguda puerperal Es un cuadro inflamatorio de la glándula mamaria, secundario a un foco infeccioso aparecido durante la lactancia, usualmente a los pocos días o semanas después del parto (entre la segunda y la sexta semana). Afecta a 2,5% de las madres que amamantan y se calcula que aproximadamente 10% de ellas evolucionará a absceso mamario. Se trata de un cuadro doloroso, que dificulta la lactancia. Entre las estrategias de prevención primaria tendrían importancia el tratamiento oportuno de las grietas o heridas del pezón y el fomento de técnicas adecuadas de lactancia. Esto porque en su patogenia intervendría algún grado de retención láctea y alguna puerta de entrada a los gérmenes de la piel de la madre y de la flora orofaríngea del lactante. Esto se ve favorecido por condiciones de desaseo, un defi- Médico. Especialista en Obstetricia y Ginecología, Unidad de Patología Mamaria, Servicio de Obstetricia y Ginecología, Hospital Dr. Luis Tisné Brousse. E mail: barbara.aguilera@gmail.com 207 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 207-210 ciente estado nutricional y la posible inmunodeficiencia posparto de la madre. Una vez producida la colonización de la leche retenida la infección puede producir un verdadero flegmón o celulitis de todo el órgano, es decir una mastitis difusa, o producir abscedación del área en que se retuvo la leche, con o sin fistulización al exterior. En el 98% de los casos el agente causal es Staphylococcus aureus. En menor frecuencia el Streptococcus pyogenes y excepcionalmente, bacilos gram negativos como Salmonella sp. La mastitis aguda puerperal se presenta en la mayoría de los casos como un cuadro unilateral. Hay dolor local, sensación de tensión mamaria, y los signos clásicos de inflamación como eritema, calor y a veces edema cutáneo, casi siempre acompañada de fiebre alta, cefalea y calofríos. Los abscesos se presentan como masas que tienden a ocupar una posición periférica en la mama, se van haciendo fluctuantes y tienden a buscar salida hacia el exterior. El diagnóstico se establece principalmente sobre la base del cuadro clínico y el examen físico. El estudio de laboratorio está indicado en casos especiales, preferentemente en centros especializados y no es requisito para iniciar tratamiento. El tratamiento debe incluir analgésicos y/o antiinflamatorios, de preferencia no esteroidales y suspensión de la glándula con un sostén compresivo. Se puede usar frío local como analgésico, o calor local para facilitar la extracción de leche. No se debe interrumpir la lactancia. Se recomienda el control del tratamiento a las 72 horas, plazo en el que se espera observar mejoría clínica. Si al cabo de 72 horas no hay signos de mejoría clínica, es muy probable que haya progresado a un absceso y la paciente debe ser derivada a un servicio de urgencia de nivel terciario, para evaluación. Probablemente se modifique el esquema antibiótico a uno de segunda línea y se realice drenaje en caso de absceso. Algunas sugerencias de inicio de tratamiento a nivel primario son: Analgésicos: Ibuprofeno 400 mg cada 6-8 horas, o ketoprofeno 50 mg cada 8 horas, o nimesulide 100 mg cada 12 horas. Antibióticos: cloxacilina 1 g cada 6-8 horas o cefradina 500 mg cada 6 horas, o bien lincomicina 500 mg cada 6-8 horas en caso de pacientes alérgicas. Mastitis aguda no puerperal Ocurre fuera del período de lactancia y la inflamación de la mama se origina en lesiones previas como ocurre en el caso de hematomas, secundarios a traumatismos mamarios, que pueden infectarse. 208 También pueden originarse en infecciones de las glándulas de Montgomery, lesiones supuradas cutáneas, quistes subcutáneos que se infectan, picaduras de insectos infectadas, furúnculos, eczema del pezón y areola, intértrigo mamario, etc. Frecuentemente, las pacientes afectadas presentan condiciones predisponentes, tales como diabetes mellitus o inmunosupresión por terapia esteroidal. Generalmente estas lesiones derivan en abscesos mamarios periféricos que deben ser tratados en niveles terciarios de atención. En el tratamiento quirúrgico siempre se debe incluir la toma de biopsias junto al vaciamiento para descartar una neoplasia como sitio original de la infección, secundaria a un foco de necrosis tumoral. El tratamiento antibiótico debe iniciarse al momento de la derivación y debe incluir esquemas de amplio espectro puesto que en general se trata de infecciones polimicrobianas en pacientes inmunosuprimidas (ver esquemas sugeridos para mastitis periductal). Es importante además tratar la condición de inmunosupresión asociada. Cuando las lesiones son retroareolares se debe considerar la posibilidad de ectasia ductal y mastitis periductal. Esta última representa un cuadro clínico de importancia por su frecuencia y tendencia a la recidiva, que genera habitualmente consultas reiteradas. Ectasia ductal y mastitis periductal Ectasia ductal y mastitis periductal son dos cuadros clínicos que afectan la región de los grandes conductos bajo el pezón y que representan etapas evolutivas de una misma enfermedad. La mastitis periductal también se denomina comedomastitis o mastitis de células plasmáticas. Se caracteriza por un ensanchamiento y dilatación del sistema ductal principal de la mama, que puede presentar un diámetro luminal irregular y asociarse o no con inflamación y fibrosis periductal. Representan de 2% a 4% de las consultas por patología mamaria. En estudios de autopsia se detectan entre 11% y 75% de los casos. La edad de presentación varía según el tipo de cuadro, para los casos diagnosticados como mastitis periductal, la media correspondería a 33 años y para la ectasia ductal, los 58 años. La etiología de la enfermedad no está clara. Se ha atribuido a fenómenos involutivos, ya que habitualmente se presenta en mujeres mayores de 40 años. PROCESOS También se atribuye cierta participación al embarazo, la lactancia y a la succión, ya que es más frecuente en multíparas y en lactancias prolongadas. Se produce un proceso de epidermización o metaplasia escamosa del epitelio cuboidal que recubre los conductos, lo que produce obstrucción de éstos por un tapón de queratina. En este proceso de metaplasia escamosa ductal se atribuye un factor etiológico al hábito de fumar, antecedente que es habitual entre las pacientes que padecen esta condición. En la mayoría de los casos la enfermedad es asintomática, siendo descubierta incidentalmente en exámenes de rutina. Cuando produce síntomas ésta se manifiesta por dolor, descarga por el pezón, retracción del pezón, enrojecimiento y calor local, tumoración, absceso y fístula periareolar. El dolor suele ser persistente y punzante, localizado en la región central o retroareolar; la descarga por el pezón puede ser serosa y fluida o cremosa, de tal manera que escurre por el pezón en forma espontánea manchando el sostén o al exprimirlo, rara vez la secreción es sanguinolenta debido a fenómenos inflamatorios de la pared. La retracción del pezón se presenta hasta en el 75% de las pacientes como resultado de la fibrosis periductal. La inflamación pericanalicular puede llevar a la ruptura de la pared del conducto poniendo el material acumulado en contacto con el tejido vecino. Esta inflamación se asocia a colonización por gérmenes aerobios y anaerobios, lo que genera una infiltración importante por células inflamatorias, entre ellas principalmente células plasmáticas. Si la infección progresa se desarrollan abscesos crónicos periareolares recidivantes los cuales, por drenaje espontáneo o quirúrgico pueden desarrollar fístulas, habitualmente de curso crónico. También la infiltración de material amorfo intraductal hacia el estroma circundante puede originar la formación de LECTURAS – – RECOMENDADAS PABST Y. Enfermedades inflamatorias de la mama II. Bol Hosp S J de Dios 1992; 39: 328-36. TANABE KK. Duct Ectasia, Periductal Mastitis, and Infections. In: Harris JR, Lippman ME, Morrow M, Hellman S (eds), Diseases of the Breast. Philadelphia, Lippincott-Raven, 1996; 51. INFLAMATORIOS BENIGNOS DE LA MAMA una tumoración de evolución crónica, que aparece como una masa firme, de límites poco definidos, que suele adherir a la piel y retraer el pezón, con aspecto inflamatorio. El estudio histológico para el diagnóstico diferencial con neoplasias es fundamental en estos casos, en los que incluso puede haber asociación a adenopatías axilares por el componente inflamatorio. La mayor importancia de esta patología, en su etapa sintomática, es la posibilidad de que sea confundida con un carcinoma. El estudio para el diagnóstico diferencial puede incluir mamografía, ecografía mamaria, estudio citológico de la descarga por el pezón y biopsia del tejido mamario. Cuando la enfermedad es asintomática no requiere tratamiento ni derivación. La primera recomendación terapéutica siempre consiste en recomendar suspender el hábito tabáquico. Si se manifiesta por dolor, puede ser suficiente la administración de analgésicos o antiinflamatorios. Si existe descarga por el pezón de tipo seroso o cremoso, se sugieren maniobras de expresión suave. En caso de complicaciones infecciosas se sugiere el uso de esquemas antibióticos asociados con cobertura para Staphylococcus aureus y anaerobios. 99% de todas las cepas aisladas en cultivos de tejidos son sensibles a ampicilina/sulbactam; 96,7% lo fueron a ceftizoxima y ciprofloxacino; siendo la sensibilidad más baja para metronidazol con 72,2%. Por lo tanto, parece racional plantear que el tratamiento antibiótico de los procesos inflamatorios agudos no puerperales de la mama se inicie en los centros de atención primaria con un esquema biasociado y que la paciente sea derivada para atención en centros especializados. El manejo de abscesos y fístulas también debe hacerse en centros de mayor complejidad, idealmente en unidades especializadas para el tratamiento y seguimiento adecuados. – – EDMISTON C, WALKER A, KREPEL C, GOHR C. The nonpuerperal breast infections: aerobic and anaerobic microbial recovery from acute and chronic disease. J Infect Dis 1990; 162: 695-9. MEGUID MM, OLER A, NUMANN PJ. Subareolar Breast Abscess: The Penultimate Stage of the Mammary Duct-associated Inflammatory Disease Sequence. In: Bland KI, Copeland EM (eds), The Breast. 209 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 207-210 – – Comprensive Management of Benign and Malignant Diseases. Philadelphia, WB Saunders Company, 1998; 109-52. SAN MARTÍN S. Enfermedades benignas de la mama. En: Arraztoa J (ed) Patología mamaria. Santiago, Mediterráneo, 1993; 38-43. SALOMON R. Recurrent breast abscess: role of smok- 210 – – ing. J Gynecol Obstet Biol Reprod Paris 1996; 25: 242-3. BROOK I. Microbiology of non-puerperal breast abscesses. J Infect Dis 1988; 157: 377-9. Procesos inflamatorios benignos de la mama. Juan Antonio Pérez, Luis Barrientos S. Cuad. Cir. 2000; 14: 70-9. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 211-214 ARTÍCULO Identificación de riesgo de cáncer de mama Claudia Parra G. INTRODUCCIÓN Se ha identificado la presencia de diferentes factores de riesgo que aumentan la probabilidad de desarrollar cáncer de mama en mujeres sanas. Una de cada 8 a 12 mujeres desarrollará cáncer de mama a lo largo de su vida. La proporción es mayor entre los 35 y 55 años, con las muertes cardiovasculares por encima de las muertes por cáncer de mama en todas las edades1. Aunque existen variaciones en distintos países, las pacientes con riesgo de cáncer de mama son típicamente asignadas a alguna categoría: bajo, moderado o alto riesgo, siendo cada categoría manejada de distinta manera de acuerdo a guías de reducción de riesgo. Riesgo alto o moderado2 • Portadoras de mutaciones de alta penetrancia (BRCA 1 y 2; otras mutaciones). • Familiares de primer grado con cáncer bilateral o cáncer antes de los 50 años, sin mutaciones demostradas. • Radioterapia de tórax antes de los 30 años. • Antecedente de hiperplasia atípica, neoplasia lobulillar, atipia plana, cicatriz radiada. • Antecedente personal de cáncer de mama. • Densidad mamográfica aumentada. Riesgo bajo • Mayores de 60 años. • Historia familiar después de los 60 años, de segundo o tercer grado. • Factores reproductivos (menarquia precoz, menopausia tardía, nuliparidad, primer parto mayor de 35 años). • Enfermedades mamarias benignas proliferativas. • Sobrepeso después de la menopausia. • Ingesta crónica de alcohol. • Algunas terapias de reemplazo hormonal en la menopausia. • Nivel socioeconómico elevado. Se estima que 5%-10% de todos los cánceres de mama ocurren en mujeres con predisposición genética y la mayoría de ellos son atribuibles a mutaciones en el gen BRCA 1 y BRCA 2, existen otros genes también asociados a cáncer de mama como p53, PTEN, STK11/LKB1, CDH 1, ATM, Y CHEK 23. Estas mutaciones están asociadas con una variedad de síndromes como el síndrome de cáncer hereditario de mama-ovario (BRCA 1 y 2), responsable del 50% de los casos conocidos de cáncer de mama hereditario, Li-Fraumeni (p53), enfermedad de Cowden (PTEN), Peutz-Jeghers syndrome (STK11/ LKB1), síndrome carcinoma gástrico difuso hereditario (CDH1), ataxia-telangectasia (ATM). Médico. Especialista en Obstetricia y Ginecología. Unidad de Patología Mamaria. Servicio Obstetricia y Ginecología. Hospital Dr. Luis Tisné Brousse. E mail: clauparrag@yahoo.com 211 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 211-214 BRCA 1 y 2 son genes supresores de tumores, identificados en los cromosomas 17 y 13 respectivamente. La mutación de estos genes es trasmitida de manera autosómica dominante, por lo tanto se puede originar desde la línea materna o paterna. Entre las mujeres que presentan mutaciones en BRCA 1 o BRCA 2, el riesgo de cáncer de mama durante su vida es 36% a 85% y el riesgo de cáncer de ovario, es de 16% a 60% (Tabla 1)4,5. Las mujeres con mutación en BRCA tienen riesgo marcado de desarrollar cáncer de mama y ovario a edad temprana. Los hombres con mutaciones en BRCA 1 o BRCA 2 también presentan riesgo aumentado de cáncer de mama, aunque el riesgo es menor que en las mujeres (1,2% con mutación en BRCA 1 y 6,8% en BRCA 2)6. Se ha observado además, que estos hombres, también tendrán riesgo aumentado de desarrollar otro cáncer como próstata y páncreas7. Las mujeres que tienen una fuerte historia familiar de cáncer de mama deben considerar un estudio genético, particularmente si desean buscar estrategias de disminución de riesgo. Las pruebas diagnósticas confirman la presencia de una condición en particular, mientras que los tests predictivos revelan la probabilidad de desarrollar una enfermedad, pero no confirman que un individuo desarrollará esta patología. Aquellas pacientes que soliciten estudio genético, deben entonces entender que el test BRCA es predictivo y no diagnóstico8. Factores hormonales y reproductivos también son considerados en el desarrollo de cáncer de mama. La exposición prolongada a estrógeno endógeno es un factor de riesgo. Menarquia precoz y menopausia tardía aumentan el riesgo, ya que prolongan la exposición a estrógeno y progesterona9. La terapia de reemplazo hormonal combinada a largo plazo (>5 años), está asociada a un aumento del riesgo. En un metaanálisis se observó que el riesgo aumenta en 1 a 2% por año, pero desaparece luego de 5 años de abandonado el tratamiento10. La edad del primer embarazo influencia el riesgo relativo de cáncer de mama, ya que el embarazo transforma a las células del parénquima mamario en un estado más estable, resultando potencialmente en menor proliferación en la segunda mitad del ciclo menstrual. Como resultado un primer embarazo a edad temprana, ofrece alguna protección mientras que las mujeres con un primer embarazo después de los 35 años tienen un riesgo del doble que aquellas mujeres que tienen su primer hijo antes de los 20 años11. También se han considerado de riesgo algunas lesiones12,13: HDA (Hiperplasia Ductal Atípica): Aumenta el riesgo entre 2,5 a 5 veces. HDA (Hiperplasia Ductal Atípica): Asociado a mutaciones BRCA1/2 aumenta a 10 el riesgo relativo. HLA (Hiperplasia lobulillar atípica): Aumenta el riesgo a 4 veces. CLIS (Carcinoma lobulillar in situ): Aumenta a 10 el riesgo relativo. Cicatriz radiada: Aumenta en 2 a 3 veces el riesgo. Papiloma intraductal: 2 a 3 veces. Hiperplasia apocrina y adenosis esclerosante: Aumenta el riesgo en menos de 2 veces. ESTIMACIÓN DE RIESGO El primer paso en el proceso de estimación de riesgo es elaborar el “pedigree” de la paciente, con el objetivo de evaluar si un cáncer es más probable debido a una susceptibilidad heredada o de ocurrencia esporádica. La predicción de riesgo se logra identificando características que son asociadas con alto o bajo riesgo de desarrollar la enfermedad y luego combinando aquellas características en un modelo estadístico para producir una probabilidad estimada de desarrollar la enfermedad en un periodo de tiempo determinado. Existen modelos computacionales estadísticos que nos permiten estimar el riesgo de presentar la enfermedad, estos modelos tienen un buen valor predictivo, pero son aún débiles en predecir qué mujer en particular desarrollará la enfermedad. Entre los modelos más utilizados está Gail. Es un modelo que se enfoca principalmente en los factores de riesgo no genéticos, diseñado por científicos del National Cancer Institute y el National Surgical Adjuvant Breast and Bowel Project y estima el riesgo que presenta una mujer de desarrollar un cáncer invasor. Tabla 1. Riesgo de cáncer de mama con mutación BRCA 1-2 Proyección cáncer de mama a los 50 años. Mutación en BRCA 1 Mutación en BRCA 2 Población general 50% 28% 2% * Ford D, Easton DF, Stratton M, et al: Genetic heterogeneity and penetrance analysis of the BRCA1 and BRCA2 genes in breast cancer families. The Breast Cancer Linkage Consortium. Am J Hum Genet 1998; 62: 676-89. 212 IDENTIFICACIÓN Las variables consideradas son: Edad de menarquia. Edad del primer parto. Número de biopsias mamarias previas. Número de familiares de primer grado con cáncer de mama. • Presencia de hiperplasia ductal atípica. • Raza14. Tanto el modelo de Gail como el modelo de Claus NO deben ser usados en mujeres con antecedente personal de cáncer de mama o con mutaciones demostradas de los genes BRCA1/2. Para pacientes con sospecha de mutaciones de los genes existen otros modelos que permiten calcular el riesgo de presentar la enfermedad: BRCA1 y/o BRCA2: BRCA-PRO®, CancerGene®, Myriad I, Myriad II, Couch. Estos modelos estadísticos establecen en forma rápida y objetiva el riesgo de cáncer de mama de las mujeres. Al poder objetivar el riesgo permiten educar a las pacientes y establecer un manejo racional en la disminución de éste. • • • • ESTRATEGIAS DE PREVENCIÓN DEL RIESGO Cualquier método de prevención tendrá asociados riesgos y complicaciones, o efectos adversos y determinar el riesgo/beneficio neto, depende de la habilidad en cuantificar la posibilidad que tiene la paciente de desarrollar la enfermedad. Screening Mamografía: En población general el screening disminuye mortalidad en 30%. El Valor Predictivo Positivo (VPP) es mayor para el grupo de alto riesgo, especialmente para el grupo entre 40 y 59 años. Sin embargo no se ha podido demostrar disminución de la mortalidad por mamografía en el grupo de alto riesgo15,16. DE RIESGO DE CÁNCER DE MAMA Ecografía mamaria No se recomienda como screening en población general. Aporta 37% más de diagnóstico de cáncer que con mamografía sola en grupo de alto riesgo17. La Resonancia Magnética (RM) mamaria parece ser más sensible que la mamografía para la detección de cáncer en mujeres con alto riesgo para cáncer de mama. (Tabla 2). La implementación de un programa de seguimiento con examen físico, mamografía y especialmente resonancia mamaria, en la población de alto riesgo, permite detectar el cáncer en etapas precoces. Quimioprevención La habilidad de manipular hormonalmente el tejido mamario y así disminuir los cambios proliferativos que pudieran evolucionar a cáncer de la mama, ha sido reconocida en las últimas décadas. Luego de observar la gran diferencia de incidencia de cáncer entre mujeres tratadas y ramas control se ha observado que el tamoxifeno disminuye el riesgo de cáncer en 49%. Actualmente se debe considerar evaluar el riesgo de cáncer de mama en mujeres y aconsejar a aquellas de alto riesgo, el uso de quimioprevención. CIRUGÍAS DE REDUCCIÓN DE RIESGO La ooforectomía profiláctica en mujeres premenopáusicas y la mastectomía profiláctica, son opciones adicionales en reducción de riesgo de cáncer de mama. La menopausia quirúrgica antes de los 35 años se ha establecido como factor protector. La disponibilidad del test genético y la identificación del gen BRCA, ha resultado en la identificación de mujeres de familias con cáncer de mama-ovario hereditario. Estas mujeres son especialmente motivadas a considerar la remoción profi- Tabla 2. Eficacia de los distintos estudios imagenológicos en pacientes de alto riesgo Estudio Kuhl et al Warner et al Podo el al Total Mamografía Sensib Especif Ultrasonografía Sensib Especif Sensib Resonancia Especif 3/9 (33) 3/7 (43) 1/8 (13) 7/24 (29) 3/9 (33) 3/6 (50) 1/8 (13) 7/23 (30) 9/9 (100) 6/7 (86) 8/8 (100) 23/24 (96) 91/96 (95) 172/189 (91) 96/97 (99) 359/382 (94) 89/96 (93) 188/189 (99) 97/97 (100) 374/382 (98) 77/96 (80) 167/180 (93) 97/97 (100) 341/373 (91) * Efficacy of MRI y mammography for Breast Cancer Screening in Women with a Familial or Genetic predisposition. NEJM 2004; vol 851, Nº 5. 213 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 211-214 láctica de los ovarios. Estudios publicados han confirmado que puede disminuir la incidencia de cáncer de mama en aproximadamente 50% en este grupo18. La menopausia prematura, sin embargo, está asociada a un incremento del riesgo de osteoporosis y enfermedad cardiovascular. Finalmente, se plantean las opciones de manejo en estas pacientes, su efecto en la reducción del riesgo y la mejor elección para cada paciente (Tabla 3). Tabla 3. Opciones de manejo en pacientes con alto riesgo de mutación genética o mutación confirmada Observación Quimioprevención Mastectomía profiláctica Ooforectomía profiláctica Autoexamen mensual, Eco cada 6 meses. Considerar RM, Mamografía anual desde los 25 años Tamoxifeno 20 mg/d por 5 años Considerar en premenopáusicas IC a psicología y oncoplástica Beneficio en portadoras de mutación No reduce el riesgo. Debido a la alta frecuencia de cánceres entre intervalos de control Reducción incierta. Debido a que portadoras de BRCA1 tienden a RE(-). Probable mayor efecto en BRCA2 Mujeres jóvenes en edad reproductiva. -Historia familiar de Ca. diagnosticados después de los 50 años Candidatas favorables Portadoras de cáncer de -Hist. con histol. o citol. mama previo con RE+. con atipias, mamas densas, extrema ansiedad y temor al cáncer. Pacientes con cáncer de mama con alto riesgo de cáncer en la mama contralateral. Reducción del riesgo Promedio 90%, tanto para recidiva como para protección de mama contralateral en cáncer de mama REFERENCIAS 1. PARKIN DM, BRAY F FERLAY. Global Cancer Statisticaas, 2002, CA Cancer J Clin 2005; 55: 74-108. 2. O PERALTA, ME BRAVO, M AMAR, F ARNELLO, C BARRIGA, P CARVALLO, ET AL. III Jornada de Consenso Nacional de Diagnóstico y Tratamiento del Cáncer de Mama. Alto Riesgo de Cáncer de Mama y Estrategias de Prevención. 2009. 3. HANKINSON SE, COLDITZ GA, WILLETT WC. Towards an integrated model for breast cancer etiology: the lifelong interplay of genes, lifestyle, and hormones. Breast Cancer Res 2004; 6: 213-8. 4. CHEN S, PARMIGIANI G. Meta-analysis of BRCA1 and BRCA2 penetrance. J Clin Oncol 2007; 25: 1329-33. 5. LEVY-LAHAD E, FRIEDMAN E. Cancer risks among BRCA1 and BRCA2 mutation carriers. Br J Cancer 2007; 96: 11-5. 6. TAI YC, DOMCHEK S, PARMIGIANI G, ET AL. Breast cancer risk among male BRCA1 and BRCA2 mutation carriers. J Natl Cancer Inst 2007; 99: 1811-4. 7. GARBER JE, OFFIT K. Hereditary cancer predisposition syndromes. J Clin Oncol 2005; 23: 276-92. 8. TAYLOR MR. Genetic testing for inherited breast and ovarian cancer syndromes: important concepts for the primary care physician. Postgrad Med J 2001; 77: 11-5. 9. ANTONIOU, SHENTON, MAHER, WATSON, WOODWARD, LALLOO, EASTON, EVANS. Parity and breast cancer risk among BRCA1 and BRCA2 mutation carriers. Breast Cancer Res 2006. 10. COLLABORATIVE GROUP ON HORMONAL FACTORS IN BREAST CANCER. Breast cancer and hormone replacement thera- 214 11. 12. 13. 14. 15. 16. 17. 18. Evaluar en premenopausia con paridad completa -Mayor beneficio para mujeres premenopausia con paridad finalizada. -Historia familiar de cáncer de mama. py: collaborative reanalysis of data from 51 epidemiological studies of 52705 women wih breast cancer and 108411 women without breast cancer. Lancet 1997; 350: 1047-59. ANDRIEU, GOLDGAR, EASTON, ROOKUS, BROHET. Pregnancies, breast-feeding, and breast cancer risk in the International BRCA 1-2. Carrier Cohort Study (IBCCS). J Natl Cancer Inst 2006. MARSHALL LM, HUNTER DJ, CONNOLLY JL, ET AL. Risk of breast cancer associated with atypical hyperplasia of lobular and ductal types. Cancer Epidemiol Biomarkers Prev 1997; 6: 297-301. MORROW M, JORDAN. Managing Breast Cancer Risk. BC Decker Inc., 2003. www.cancer.gov/bcrisktool/ TABAR L, VITAK B, CHEN HH, ET AL. Beyond randomized controlled trials: organized mammographic screening substantially reduces breast carcinoma mortality. Cancer 2001; 91: 1724-31. SHAPIRO S, STRAX P, VENET L. Periodic breast cancer screening in reducing mortality from breast cancer. Jama 1971; 215: 1777-85. KOLB TM, LICHY J, NEWHOUSE JH. Comparison of the performance of screening mammography, physical examination, and breast US and evaluation of factors that influence them: an analysis of 27,825 patient evaluations. Radiology 225: 165-75. REBBECK TR, LEVIN AM, EISEN A, ET AL. Breast cancer risk After Bilateral Prophylactic oophorectomy in BRCA 1 mutation carriers. J Nat Cancer Inst 1999; 91: 1475. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 215-218 ARTÍCULO Terapia hormonal y riesgo de cáncer de mama Paola Ruiz de Viñaspre A. INTRODUCCIÓN La mayor expectativa de vida y los mejores índices de salud, han transformado a la menopausia en un período prolongado en la vida de la mujer y se hace necesario vivirla con la mejor calidad de vida posible. Para ello, la terapia de reemplazo hormonal (TRH) se ha extendido como pilar muy importante en este período, lo que conlleva beneficios indiscutibles en muchos aspectos, pero también ha despertado inquietud y dudas por los efectos deletéreos en algunos sistemas, entre ellos, el cáncer de mama. La asociación de cáncer de mama y TRH ha sido un tema de gran discusión en el tratamiento del climaterio, y es una de las principales causas de abandono del tratamiento. Se denomina Terapia de Reemplazo Hormonal, a aquella terapia consistente en dar a la paciente dosis reducidas de estrógenos y progestinas, en distintos esquemas y distintas vías de administración, para controlar los síntomas del climaterio y para prevenir o tratar enfermedades derivadas de la ausencia prolongada de la función ovárica. Este artículo tiene como objetivo analizar las distintas evidencias en relación a este tema, y obtener, finalmente, una idea acabada de la indicación adecuada de la TRH para cada paciente. TERAPIA DE REEMPLAZO HORMONAL. EVIDENCIA CIENTÍFICA Hasta principios de la década de los 90, los principales datos provienen de metaanálisis de estudios observacionales. La gran mayoría de ellos, no demuestra una asociación entre TRH y riesgo de cáncer de mama. Uno de los primeros estudios que demuestra un mayor riesgo, fue presentado en 1995 por Colditz, señalando un mayor riesgo a mayor edad de la paciente y a mayor tiempo de uso de la TRH. En 1997, se publica en Lancet, el metaanálisis observacional de Oxford, con más de 51.000 pacientes, demostrando un leve, pero significativo aumento del riesgo de cáncer de mama a partir de los 5 años de uso de TRH (2,3% anual) y que desaparece luego de 5 años de discontinuar el tratamiento. Esto significa que el riesgo relativo de cáncer de mama aumenta 1,023 por año de uso en mujeres con TRH por 5 años o más. (2 casos más por cada 1000 mujeres a los 5 años de uso, 5 casos extras por cada 1.000 mujeres a los 10 años de uso y 12 casos extras a los 15 años de uso) (Figura 1). En 2002 se suspende el Women Health Initiative (WHI), estudio prospectivo randomizado, que compara el uso de estrógenos conjugados con acetato de medroxiprogesterona, en esquema combinado continuo, después de 8 años, debido a un aumento Médico, Especialista en Obstetricia y Ginecología, Unidad de Patología Mamaria, Servicio Obstetricia y Ginecología Hospital Dr. Luis Tisné Brousse. E mail: doctorapaolaruiz@gmail.com 215 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 215-218 Incidencia acumulativa de cáncer de mama, estimada según edad actual y años de uso de TRH 89 83 79 77 90 80 70 60 Uso por 15 años Uso por 10 años Uso por 5 años Nunca usaron 50 40 30 THR=Terapia de Reemplazo Hormonal 20 10 0 50 55 65 60 Edad (años) 70 75 Collaborative Group on Hormonal Factors in Breasat Cancer, Lancet 1997 Figura 1. Incidencia acumulada de cáncer de mama y años de uso de TRH. significativo de cáncer de mama en la rama que recibe TRH en relación al grupo placebo. Se publica en la Revista Jama, y se informa un aumento por el uso de TRH de 26%, con un riesgo relativo de 1,26 y riesgo absoluto de 0,08, es decir, 38 nuevos casos de cáncer de mama en el grupo con TRH versus 30 casos en el grupo placebo por cada 10.000 mujeres por año. El aumento de cáncer de mama con TRH se consideró leve y de presentación más precoz (a los 4 años) que en el estudio de Oxford. En 2003, se publica un estudio europeo de cohorte prospectivo no randomizado, con seguimiento de 8,9 años y distintos esquemas de TRH, principalmente transdérmicos y con uso de progesterona micronizada. El riesgo relativo de cáncer de mama fue de 0,98. Esto da cuenta que no todos los preparados hormonales tienen los mismos efectos en relación al desarrollo de cáncer de mama. En 2003, también se publica el Estudio del Millón de mujeres del Reino Unido, estudio observacional basado en encuestas que analiza el riesgo de cáncer de mama en mujeres postmenopáusicas, con distintos esquemas de TRH por 4 años. Los resultados demostraron un aumento de riesgo de cáncer de mama con todos los esquemas de TRH y con el mayor tiempo de uso. Los autores estiman una incidencia acumulada después de 10 años de uso de TRH de 5 por cada 1.000 mujeres con esquema de estrógenos solos y de 19 casos adicionales por cada 1.000 mujeres con esquema de estrógenos más progestinas. Estos resultados han sido ampliamente cuestionados, principalmente por la metodología del estudio y la veracidad de sus resultados. En 2004, se publica el estudio observacional danés en 10.874 mujeres postmenopáusicas, con distintos esquemas de TRH en 6,3 años de segui- 216 miento. Demuestra un aumento del riesgo de cáncer de mama en todos los esquemas hormonales analizados. Con estrógenos solos el riesgo relativo fue de 1,96; con estrógenos más progestinas fue de 2,7; y tibolona de 4,27. Sin embargo, este resultado no es confiable, pues se dio en un pequeño número de pacientes, principalmente en aquellas con otros factores de riesgo para esta patología. Estos tres principales estudios, influyen en forma importante en el uso de TRH en las mujeres climatéricas, con un alto abandono en el tratamiento o un gran temor de la paciente y también del médico en indicar esta terapia. En 2004, se publica la otra rama de WHI, prospectivo, randomizado y doble ciego, en mujeres postmenopáusicas histerectomizadas, a estrógenos conjugados solos 0,625 mg/día versus placebo por 6,8 años. No hubo aumento del riesgo de cáncer de mama (RR de 0,77). Los estrógenos solos no aumentaron el riesgo, sino que más bien tuvieron un efecto protector que está en el límite de la significancia estadística. Estos hallazgos sugieren que se puede haber sobreestimado el riesgo de cáncer de mama con algunos esquemas de TRH y se cuestiona el uso prolongado de algunas progestinas como factor de riesgo de cáncer de mama. PROGESTINAS Y RIESGO DE CÁNCER DE MAMA Las progestinas son productos sintéticos con actividad similar a la progesterona, cuyo objetivo es proteger el endometrio de la proliferación exagerada por el efecto estrogénico prolongado. Hay diversas progestinas en el mercado, por lo que sus efectos son variados y los riesgos en el cáncer de mama son diferentes entre ellas. TERAPIA Son innumerables los esquemas de estrógenos y progestinas, con efectos secundarios diferentes entre sí, por lo que es fundamental individualizar cada tratamiento, en relación al tipo y dosis de cada preparado. La medroxiprogesterona estimularía los genes relacionados con la angiogénesis y el crecimiento tumoral y disminuiría la expresión de genes pro apoptosis. En 2005, Fournier publicó un estudio prospectivo de cohorte (Figura 2), en que demostró que el riesgo relativo de cáncer de mama en el grupo con TRH fue de 1,2 con un muy leve aumento del riesgo. Sin embargo, en las mujeres con uso de estrógenos solos, no aumentó el riesgo (RR 1,1), como tampoco en aquéllas con terapia de estrógenos más progesterona micronizada (RR 0,95). En las con riesgo aumentado estaban aquéllas con terapia de estrógenos más progestinas sintéticas tipo medroxiprogesterona (RR de 1,4). Este estudio, junto con la segunda rama del WHI y estudios europeos, demuestran que los estrógenos solos no aumentan el riesgo de cáncer de mama y que sólo algunas progestinas junto con los estrógenos aumentan este riesgo. En conclusión, es necesario ser prudente en relación al análisis de las distintas terapias de TRH en HORMONAL Y RIESGO DE CÁNCER DE MAMA cuanto a su riesgo específico de desarrollar cáncer de mama. Además, se debe tener presente que el riesgo de cáncer de mama con el uso de TRH es mínimo o ninguno y pareciera ser que el riesgo más elevado se da en terapias combinadas con algunas progestinas en específico. TRH EN PACIENTES TRATADAS POR CÁNCER DE MAMA La TRH en pacientes con historia de cáncer de mama ha sido controversial debido al temor a que los beneficios de la TRH se vean sobrepasados por el riesgo de una recurrencia de la enfermedad. Hay numerosos estudios observacionales de baja casuística, poco rigurosos y seguimientos incompletos. Ellos demuestran que la TRH usada entre 3 a 94 meses no aumenta la tasa de recurrencia y de sobrevida. Debido a lo anteriormente expuesto, se diseñaron 3 estudios para clarificar este tema. El HABITS, el estudio de Estocolmo y el Liberate. El HABITS, es un estudio multinacional, prospectivo randomizado abierto, que estudia si la TRH afecta el riesgo de recurrencia y mejora la calidad de RIESGO DE CÁNCER DE MAMA EN DIFERENTES REGÍMENES HORMONALES (Estudio de Cohorte E3N-EPIC) N = 54.548 THR: 29.420 Control: 25.128A Edad: 52,8 años Seg. promedio: 5,8 años No de cánceres: 948 Tiempo promedio de administración: 2,8 años – – – – Cualquier THR E solos E y Prog. sintética E y Prog. micronizada RR 1,2 (0,9 – 1,6) RR 1,1 (0,8 – 1,6) RR 1,4 (1,2 – 1,7) RR 0,9 (0,7 – 1,2) Fournier A. et al. int. J. Cancer 2005. 114: 448-454 Figura 2. Riesgo de cáncer de mama en diferentes regímenes hormonales. Tabla 1. Tasa recurrencia de cáncer de mama en pacientes en TRH Estudios Habits + Estocolmo Habits N =434 Estocolmo N =378 H.R Eventos de cáncer mama CI 95% 1,79 3,29 0,82 1,03 - 3,10 1,48 - 7,35 0,35 - 1,89 217 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 215-218 vida en mujeres con historia de cáncer de mama. Se reclutaron mujeres en estadio 0, I y II, con cualquier estado de receptores hormonales, una rama con estrógenos y la otra sólo sintomática. La TRH fue principalmente estrógenos conjugados con medroxiprogesterona por 10 a 14 días. El estudio de Estocolmo es contemporáneo y muy parecido, en que la diferencia radica en la forma de administración, con siete días sin tratamiento entre cada ciclo de tratamiento. Ambos estudios se unieron en 2001 para analizar en conjunto la tasa de recurrencia de cáncer de mama y se publican en 2004, lo que se puede observar en la Tabla 1. Con estos resultados, los comités de seguridad de los estudios sugieren que la exposición a la TRH en mujeres tratadas por cáncer de mama conlleva a un riesgo inaceptable de recurrencia, a pesar de las diferencias de ambos estudios. Esto lleva a interrumpir el tratamiento hormonal, detienen la randomización y las mujeres siguen en seguimiento. El estudio Liberate compara Tibolona versus placebo en pacientes con historia de cáncer de mama y síntomas climatéricos. Aún no se han publicado los resultados finales luego de haberse cerrado el estudio antes de lo planificado. La decisión de detener el estudio antes de la fecha planeada originalmente para su término, se tomó después de que el Comité de Monitoreo y Seguridad de los Datos del estudio, DSMB (Data & Safety Monitoring Board) y el Comité Asesor del estudio (Advisory Board), advirtieran que el objetivo primario del mismo, que era mostrar el efecto equivalente entre tibolona y placebo con relación a la recurrencia de cáncer de mama, no se alcanzaría en el tiempo en el que estaba planeado el estudio. Además, el DSMB encontró una diferencia en el número de recurrencias de cáncer mamario, en el grupo LECTURAS – – – – RECOMENDADAS COLDITZ GA, HANKINSON SE, HUNTER DJ ET AL. The use of estrogens and progestinsand the risk of breast cancer in postmenopausal women. N Engl J Med 1995; 332; 1589-93. PRINCIPAL RESULTS FROM THE WOMEN‘S HEALTH INITIATIVE RANDOMIZED CONTROLLED TRIAL. Risk and Benefi ts of Estrogen Plus Progestin in Healthy Postmenopausal Women. JAMA 2002; 228, 3: 321. MILLION WOMEN STUDY COLLABORATORS. Breast Cancer and hormone-replacement therapy in the Million Women Study. The Lancet 2003; 362: 419. THE WOMEN‘S HEALTH INITIATIVE RANDOMIZED CONTROLLED TRIAL. Effects of conjugated estrogen in postmenopausal women with hysterectomy. JAMA 2004; Vol 291: 14: 1701. 218 de mujeres que recibieron tibolona, mayor a la necesaria para demostrar estadísticamente la equivalencia. Los resultados pueden concluir que la TRH no se recomienda en pacientes con cáncer de mama debido al mayor riesgo de recurrencia. ANTICONCEPTIVOS HORMONALES (ACO) Y RIESGO DE CÁNCER DE MAMA Cada día está más expandido el uso masivo de preparados hormonales orales con fines anticonceptivos, además de su uso por períodos más prolongados de tiempo. Debido a ello, se plantea el riesgo que puede provocar en la población general y en las mujeres de mayor riesgo el uso de este método anticonceptivo. El reanálisis colaborativo de 54 estudios epidemiológicos examinando el riesgo de cáncer de mama, no encontró efectos generales de los ACO en relación a la duración de uso, dosis, fórmula, edad de uso o edad al tiempo de diagnóstico del cáncer. Las mujeres con historia familiar de cáncer de mama no tienen un aumento posterior del riesgo asociado a uso de ACO. Otros hallazgos interesantes de estos estudios demostraron enfermedades más localizadas y menos riesgo de metástasis en aquellas pacientes usuarias de ACO. Tampoco se observa mayor riesgo por el uso de ACO en aquellas pacientes con alto riesgo con mutaciones del BRCA. Sin embargo, en estas pacientes con o sin mutación del gen que usaron ACO, presentaron un riesgo disminuido de cáncer de ovario de 3 a 4 veces, con un efecto protector de 10 a 20 años después de la suspensión del ACO. No hay evidencia que una historia familiar positiva pueda ser una contraindicación para el uso corriente de ACO. – – – – – FOURNIER A, BERRINO F, RIBOLI E, ET AL. Breast cancer risk in relation to different types of hormone replacement therapy in the E3N-EPIC cohort. Int J Cancer 2005; 114; 448-54. HOLMBERG L, ANDERSON H. HABITS (Hormone Replacement Therapy after Breast Cancer - is it safe?), a randomized comparison: trial stopped. Lancet 2004; 363: 453. VON SCHOULTZ E, RUTQVIST LE. Menopausal Hormone Therapy after Breast Cancer: The Stockholm Randomized Trial. J Nath Cancer Inst 2005; 97; 533-5. PERALTA O. Terapia de reemplazo hormonal en la menopausia y riesgo de cáncer de mama. Revista Médica Clínica Las Condes. 2006. GAMBACCIANI M. Pisa, Roma. Terapia hormonal y riesgo de cáncer de mama. Revista Colombiana de Menopausia. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 219-222 ARTÍCULO Biopsias percutáneas en cáncer de mama Dra. Paula Escobar O. INTRODUCCIÓN BIOPSIA CORE En el estudio de las lesiones mamarias, las biopsias percutáneas han demostrado progresivamente mayor utilidad. Permiten diagnosticar neoplasias malignas, planificar cirugías, certificar histología benigna y evitar cirugías diagnósticas. Existen distintas opciones de biopsias percutáneas que pueden ser utilizadas según las características de la lesión a estudiar, de la paciente y también de los recursos técnicos disponibles. Las biopsias percutáneas pueden realizarse bajo guía mamográfica, ecográfica o últimamente bajo resonancia magnética. En nuestro centro, sugerimos la cirugía por cáncer de mama tras la confirmación diagnóstica con biopsia percutánea. La punción con aguja fina, PAAF, si bien orienta al diagnóstico, no permite obtener material para estudio histológico por lo que no se recomienda de rutina. La biopsia incisional se reserva para casos especiales en que la paciente debe ser operada en el mismo acto quirúrgico. Es la biopsia mamaria realizada con pistola Trucut automática o aguja gruesa, que en el caso de lesiones no palpables visibles a ultrasonido, utiliza este método como guía. En lesiones palpables, se ubica una zona tumoral representativa y accesible, se toman varios fragmentos, se rotulan y envían a estudio diferido. El procedimiento es ambulatorio, requiere sólo de anestesia local y desinfección cutánea, es muy bien tolerado por los pacientes y presenta bajo porcentaje de complicaciones, siendo las más frecuentes el hematoma y la infección (Figura 1). No hay contraindicaciones absolutas para su aplicación, siendo las limitantes principales, las alteraciones severas de la coagulación y los desórdenes psiquiátricos graves. Está indicado en lesiones sospechosas o altamente sospechosas de ser malignas, principalmente nódulo y distorsiones de la arquitectura. Para que su rendimiento sea óptimo debe considerarse tomar un número adecuado de mues- Médico. Especialista en Obstetricia y Ginecología, Unidad de Patología Mamaria, Servicio Obstetricia y Ginecología, Hospital Dr. Luis Tisné Brousse. Profesor Asistente Departamento Cirugía, Facultad de Medicina, Universidad de Chile. E mail: paulaescobaro@yahoo.com 219 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 219-222 Figura 1. Nódulo sospechoso a ecografía. Biopsia core bajo ultrasonido. tras, no menor a 4 y se debe correlacionar el resultado histológico obtenido con el grado de sospecha asignado por imágenes a la lesión inicial, para establecer así la concordancia entre ambos, repitiendo la biopsia en caso de discordancia. BIOPSIA ESTEREOTÁXICA La biopsia estereotáxica utiliza mamografía digital con un sistema computarizado para calcular la ubicación de una lesión en las 3 coordenadas (ejes X, Y, Z) y un sistema de toma de muestra por vacío denominado Mammotomme. Para su realización, la paciente debe estar con la mama comprimida y fija en decúbito lateral, prono o sentada según el equipo que se utilice. Se aplica anestesia local y desinfección de superficie, introduciendo la cánula según las coordenadas previamente calculadas por el equipo y se toman muestras de tejido de la zona blanco girando la aguja en 360°, hasta obtener un mínimo de 20 cilindros. Es imprescindible realizar examen mamográfico del tejido extirpado con el propósito de verificar la presencia de las microcalcificaciones (Figura 2). La biopsia estereotáxica digital (BED), ha cobrado un especial rol en el estudio de las lesiones visualizadas exclusivamente a la mamografía, como son las microcalcificaciones. Aunque en ocasiones puede presentar impedimentos técnicos, el factor limitante más importante en el medio nacional ha sido el costo, por lo que las experiencias iniciales se realizaron en centros privados. En el Sistema de Salud Pública, la BED, ha sido recientemente implementada, en un centro especializado, el CMIM (Centro Metropolitano de Imágenes Mamarias) para ser utilizada por las pacientes derivadas de otros hospitales, incluido el nuestro. Durante 2008, se derivaron 158 pacientes de nuestra Unidad. Se realizó BED a 144 pacientes, con promedio edad de 55,8 años. En 12 pacientes se estudió más de un foco. Figura 2. Defecto mamográfico tras realización de BED y comprobación de microcalcificaciones en tejido extirpado. 220 BIOPSIAS Las causas de no realización de la BED fueron: reevaluación del caso y considerarse inoportuna la biopsia, dificultad técnica y desistimiento de la paciente. En la mamografía, 95% presentaba BIRADS 4% y 5% BIRADS 5, todos estos casos fueron evaluados previamente en Comité de Imágenes de nuestro hospital. El diagnóstico radiológico de derivación a BED se presenta en la Tabla 1. Tabla 1. Diagnósticos de derivación a BED Diagnóstico radiológico Microcalcificaciones Densidad asimétrica Nódulo 140 3 1 97% 2% 0,7% Figura 3. Resultado histológico mamografías BIRADS 4. PERCUTÁNEAS EN CÁNCER DE MAMA La histología reveló cáncer en 22% (5,4% infiltrante, 16,7% in situ), 3,5% hiperplasia ductal atípica y 74,4% lesiones benignas. La histología según el BIRADS mamográfico se presentan en las Figuras 3 y 4. En 4 casos, a pesar del resultado benigno en la BED y por discordancia imagenológica, se realizó biopsia radioquirúrgica, encontrándose en 2 de ellas cáncer ductal in situ y en 2 HDA; en otras 3 pacientes (2,08%) la BED subdiagnosticó lesiones malignas. En 4 pacientes no se encontró neoplasia residual al momento de la cirugía. En todas ellas, la zona estaba debidamente marcada con clip y la revisión patológica de la pieza identificó el sitio de la BED. A continuación se presentan las Figuras 5 y 6 que muestran algunos ejemplos de resolución de microcalcificaciones mamarias sospechosas. En nuestras pacientes con mamografías alteradas, el porcentaje de malignidad encontrado por BED es de 22%. La mayoría de las lesiones malignas encontradas fueron cánceres in situ. Se logró evitar cirugías diagnósticas en 70% de las pacientes. Figura 4. Resultado histológico mamografías BIRADS 5. Figura 5. a) Mamografía: Microcalcificaciones CSE izquierdo. b) Microcalcificaciones en muestras de tejido obtenidas por BED. c) Clip de marcación post-BED en zona de microcalcificaciones. 221 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 219-222 Figura 6. a) Marcación con aguja de clip bajo mamografía. b) Biopsia radioquirúrgica con clip en centro (mamografía de pieza operatoria). c) Histología: carcinoma ductal infiltrante. MAMMOTOMME BAJO ULTRASONIDO Este sistema de biopsia con aguja aspirativa al vacío puede utilizarse también bajo guía ecográfica. Permite muestras de relativa mejor calidad que la biopsia core, sin embargo, su beneficio es discutible frente a ésta debido a su elevado costo. Algunos centros utilizan este procedimiento para biopsiar lesiones de menor tamaño, incluso en algunos casos microcalcificaciones que se visualicen bajo ecografía. LECTURAS – – – – – RECOMENDADAS BREM RF, LECHNER MC ET AL. Lobular neoplasia at percutaneous breast biopsy: variables associated with carcinoma at surgical excision. AJR Am J Roentgenol 2008; 190(3): 637-41. BRENNER RJ, JACKMAN RJ ET AL. Percutaneous core needle biopsy of radial scars of the breast: when is excision necessary? AJR Am J Roentgenol 2002; 179(5): 1179-84. EBY PR, OCHSNER JE ET AL. Frequency and upgrade rates of atypical ductal hyperplasia diagnosed at stereotactic vacuum-assisted breast biopsy: 9-versus 11-gauge. AJR Am J Roentgenol 2009; 192(1): 229-34. ESSERMAN L, CURA M ET AL. Recognizing Pitfalls in Early and Late Migration of Clip Markers after Imagingguided Directional Vacuum-assisted Biopsy. Radiographics 2004; 24: 147-56. GONZÁLEZ P Y COLS. Biopsia estereotáxia mamaria: experiencia de dos años. Revista Chilena de Radiología 2008; 14: Nº 3, 154-7. 222 Recomendaciones Consenso Nacional de Mama 2009 • Utilizar aguja 11G o similar para la realización de biopsias con sistema de vacío, el uso de calibres mayores no mejora la subestimación, y aumenta la incidencia de hemorragia y hematomas. • En biopsia estereotáxica obtener al menos 12 o más muestras adecuadas o completas con análisis de todo el material. • En biopsia core utilizar aguja 14G, con excursión de 22 milímetros, con al menos 5 muestras. – – – – – – LIBERMAN L, GOODSTINE SL ET AL. One operation after percutaneous diagnosis of nonpalpable breast cancer: frequency and associated factors. AJR Am J Roentgenol 2002; 178(3): 673-9. LIBERMAN L, TORNOS C ET AL. Is surgical excision warranted after benign, concordant diagnosis of papilloma at percutaneous breast biopsy? AJR Am J Roentgenol 2006; 186(5): 1328-34. PFARL G, HELBICH TH ET AL. Stereotactic 11-gauge vacuum-assisted breast biopsy: a validation study. AJR Am J Roentgenol 2002; 179(6): 1503-7. POELLINGER A, DIEKMANN S ET AL. In patients with DCIS: is it sufficient to histologically examine only those tissue specimens that contain microcalcifications? Eur Radiol 2008); 18(5): 925-30. SOMERVILLE P, SEIFERT PJ ET AL. Anticoagulation and bleeding risk after core needle biopsy. AJR Am J Roentgenol 2008; 191(4): 1194-7. VALDÉS EK, TARTTER PI ET AL. Significance of papillary lesions at percutaneous breast biopsy. Ann Surg Oncol 2006; 13(4): 480-2. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 223-232 ARTÍCULO Cáncer de mama Dr. Alonso Uribe O. El cáncer de mama es la segunda causa de muerte oncológica en mujeres en Chile, después del cáncer de vía biliar. La mortalidad es del orden de 13 por 100.000 mujeres al año, y se ha mantenido así durante los últimos años. La incidencia se calcula en que 1 de cada 12 a 14 mujeres desarrollarán un cáncer de mama a lo largo de su vida. En cuanto a sexo, se diagnostica 1 cáncer de mama en hombre por cada 100 en mujeres. En Chile, no existe un programa de screening nacional para una detección precoz, lo que resulta en pacientes que consultan por síntomas y esto se traduce en una presentación en estadios más avanzados de la enfermedad. El 50% de las pacientes que fallecen están en el grupo de edad productiva (35 a 65 años) lo cual conlleva una pérdida económica agregada. Su diagnóstico precoz, en países desarrollados, ha permitido disminuir la mortalidad en 20% a 30%. Es la neoplasia más frecuente en la mujer occidental y la principal causa de muerte en mujeres en países desarrollados, y su incidencia está en aumento en países asiáticos. En EE.UU. es el cáncer más frecuente en mujeres, la segunda causa de muerte por cáncer en la mujer (después del cáncer pulmonar), y en generaciones sucesivas de inmigrantes la incidencia aumenta (medio ambiente y estilo de vida). Se sabe que 5% a 10% de todos los tipos de cáncer se asocian a factores hereditarios, transmitidos a través de alteraciones cromosómicas y el resto acontece de forma esporádica asociado a factores genéticos y ambientales. Así es como el BRCA1, que se ubica en el brazo largo del cromosoma 17, su inactivación o mutación puede aumentar la predisposición para cáncer de mama y ovario en mujeres premenopáusicas, principalmente. En cambio, el BRCA2, localizado en el cromosoma 13q, parece estar relacionado con cáncer de mama en mujeres jóvenes y cáncer de mama en hombres, y también en cáncer de ovario cuando se compara con BRCA1. De este modo, la presencia de BRCA1 mutado predispone a la aparición de cáncer de mama en 50% a los 50 años y 87% a los 70 años. Además 40%-50% de las mujeres desarrollarán un cáncer de ovario. Asociado a cáncer de mama y ovario están presentes en 45% de los casos familiares de cáncer de mama. En cuanto al BRCA2, hay probabilidad de 85% de desarrollar un cáncer de mama en la vida, y 10%-20% de cáncer de ovario. Dentro de los factores de riesgo, existen mayores y menores; entre los primeros, la edad avanzada (Tabla 1), el antecedente familiar de cáncer de mama (dependiendo del parentesco) aumenta el riesgo entre 2 y 10 veces (Tabla 2); antecedente personal de Médico. Especialista en Obstetricia y Ginecología, Unidad de Patología Mamaria. Servicio Obstetricia y Ginecología, Hospital Dr. Luis Tisné Brousse. E mail: alonsouribeo@gmail.com 223 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 223-232 Tabla 1. Riesgo según edad Edad 25 30 35 40 45 50 55 60 65 70 75 80 85 En la vida Tabla 2. Riesgo y antecedentes familiares Riesgo 1/19.608 1/2.525 1/622 1/217 1/93 1/50 1/33 1/24 1/17 1/14 1/11 1/10 1/9 1/8 Pariente y estado menopáusico Riesgo % Madre, posmenopausia Madre, premenopausia Madre y hermana, posmenopausia Hermana, premenopausia Hermana, posmenopausia 14 25 33 25 14 Tabla 3. Lesiones proliferativas y riesgo relativo Histología Riesgo relativo Hiperplasia ductal atípica sin HF Hiperplasia ductal atípica con HF Carcinoma lobulillar in situ 3-4 7-8 11 HF: historia familiar cáncer mamario, aumenta el riesgo 1,7 a 4,5 de contraer un 2° primario o uno contralateral, tomando en cuenta que en mujeres menores de 40 años este riesgo relativo puede aumentar a 8; y lesiones proliferativas, las que aumentan el riesgo entre 3 y 8 dependiendo si existen o no antecedentes familiares (Tabla 3). Los segundos, de menor importancia, son: edad de menarquia y menopausia, edad de primer embarazo y parto, paridad, lactancia, consumo de alcohol y dieta rica en grasas, falta de ejercicio, radioterapia sobre pared torácica (linfomas). La historia natural del cáncer de mama está dada por una acción hormonal sobre el epitelio mamario, que dejado a su libre evolución, va afectando a éste, pasando por procesos benignos hasta el desarrollo del cáncer y si no actuamos sobre el mismo, se desarrollarán metástasis. El estudio de un cáncer mamario comienza con la anamnesis y examen físico. El estudio de imágenes comprende la mamografía, ecotomografía y resonancia magnética. La ecotomografía es sólo complemento de la mamografía, y la resonancia tiene indicaciones puntuales, por lo que no son usados como screening. Pero el diagnóstico definitivo se hace con la histología del tumor, es decir, hacer una biopsia, la que puede ser en forma percutánea idealmente, o excisional (cirugía). Teniendo el diagnóstico histológico, se etapifica a la paciente, usando la clasificación TNM para cáncer de mama. Así, tendremos cánceres precoces que incluyen el cáncer in situ y los estadios I, IIA y IIB, y 224 los localmente avanzados, estadios IIIA y IIIB que incluye el cáncer inflamatorio. CLASIFICACIÓN TNM Tumor primario • Tx: No determinado • T0: Sin evidencia de tumor primario • Tis: Carcinoma in situ - Tis (CDIS). Carcinoma ductal in situ - Tis (CLIS). Carcinoma lobulillar in situ - Tis (Paget). E. de Paget del pezón sin tumor • T1: Tumor menor a 2 cm de diámetro - T1mic: Microinvasión menor o igual a 0,1 cm - T1a: Entre 0,1 y 0,5 cm - T1b: Entre 0,5 y 1 cm - T1c: Entre 1 y 2 cm • T2: Entre 2 y 5 cm • T3: mayor a 5 cm • T4: Cualquier tamaño: - a: Extensión directa a la pared de tórax - b: Compromiso de piel - c: a+b - d: Carcinoma inflamatorio Compromiso de linfonodos regionales (N) clínica • • • • Nx: No evaluados N0: Ausencia de adenopatías palpables N1: axilares homolaterales móviles N2: - N2a: axilares homolaterales fijas CÁNCER - N2b: en mamaria interna detectables por imagen o clínica en ausencia de adenopatías axilares • N3: - N3a: infraclaviculares homolaterales y axilares - N3b: mamaria interna homolateral y axilares - N3c: supraclaviculares homolateral DE MAMA cia de 1 ó más ganglios axilares afectados; o en más de 3 ganglios axilares y en ganglios de la mamaria interna con afectación microscópica detectada con disección del ganglio centinela, pero no clínicamente aparente. • pN3c.- Metástasis en ganglios supraclaviculares ipsilaterales. Compromiso de linfonodos regionales (pN) patológica pN0. No metástasis, histológicamente, en ganglios regionales, sin examen adicional para CTA. • pN0(i-). No metástasis, histológicamente, en ganglios regionales IHQ negativa. • pN0(i+). No metástasis, histológicamente, en ganglios regionales IHQ positiva con CTA (grupo de células neoplásicas <0,2 mm). • pN0(mol-). No metástasis, histológicamente, en ganglios regionales estudio molecular negativo. • pN0(mol+). No metástasis, histológicamente, en ganglios regionales. Estudio molecular positivo. pN1. Metástasis en 1 a 3 ganglios axilares, y/o en ganglios mamarios internos con afectación microscópica detectada por disección del ganglio centinela, pero no clínicamente aparente*. • pN1(mi). Micrometástasis (>0,2 mm / <0,2 cm). • pN1a. Metástasis en 1 a 3 ganglios axilares. • pN1b. Metástasis en ganglios mamarios internos con afectación microscópica detectada por disección del ganglio centinela, pero no clínicamente aparente*. • pN1c. Metástasis en 1 a 3 ganglios axilares, y en ganglios mamarios internos con afectación microscópica detectada por disección del ganglio centinela, pero no clínicamente aparente*. (La afectación mamaria interna asociada con más de tres ganglios axilares afectados, se clasifica pN3b). pN2. Metástasis en 4 a 9 ganglios axilares, o en ganglios mamarios internos clínicamente aparentes* en ausencia de ganglios axilares afectados. • pN2a. Metástasis en 4 a 9 ganglios axilares (al menos un depósito tumoral >0,2 cm). • pN2b. Metástasis en ganglios mamarios internos clínicamente detectables* en ausencia de ganglios axilares afectados. pN3. Metástasis en 10 ó más ganglios axilares, o en ganglios infraclaviculares, o en ganglios mamarios internos ipsilaterales clínicamente detectables* en presencia de 1 ó más ganglios axilares afectados; o en más de 3 ganglios axilares con metástasis microscópica en ganglios mamarios internos, clínicamente negativos, o en ganglios supraclaviculares ipsilaterales. • pN3a. Metástasis en 10 ó más ganglios axilares (con al menos un depósito tumoral >0,2 cm), o metástasis en ganglios infraclaviculares. • pN3b. Metástasis en ganglios mamarios internos ipsilaterales clínicamente detectables* en presen- * Clínicamente aparente, detectable: Detectado por estudios de imagen (excluyendo linfoescintigrafía) o por examen clínico. Metástasis a distancia (M) • Mx: No evaluadas • M0: sin metástasis demostrables • M1: metástasis presentes Conjugando los tamaños tumorales, el compromiso axilar y la presencia o no de metástasis, se etapifica cada paciente en distintos estadios (Tabla 4). CLASIFICACIÓN El cáncer de mama se clasifica en: in situ o intraductal e invasor o infiltrante, dependiendo de si el componente maligno atraviesa o no la membrana Tabla 4. Clasificación TNM y estadios del cáncer de mama Estadio 0 I IIA IIB IIIA IIIB IIIC IV Tis T1* T0 T1* T2 T2 T3 T0 T1* T2 T3 T3 T4 T4 T4 Cualquier T Cualquier T N0 N0 N1 N1 N0 N1 N0 N2 N2 N2 N1 N2 N0 N1 N2 N3 Cualquier N M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M1 *T1 incluye T1 mic (microinvasión (0,1 cm)). 225 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 223-232 basal de la célula. Esta diferencia es importante ya que tiene relación tanto con la sobrevida global y libre de enfermedad como con la agresividad del tratamiento a realizar. Los tipos histológicos son: ductal, lobulillar, papilar, medular, coloide, tubular, apocrino, adenoide quístico, siendo los más frecuentes los ductales y lobulillares. Carcinoma ductal in situ (CDIS) Se define como una proliferación de células epiteliales, con componentes citológicos e histológicos de malignidad en la unidad ductolobulillar confinada a la membrana basal. El diagnóstico se hace con la visualización, en una mamografía (es la forma más frecuente), de microcalcificaciones agrupadas, irregulares, pleomórficas, en número de 5 a 7 por cm cuadrado. En ausencia de nódulo palpable la ecotomografía no presta mayores beneficios. En cuanto a la RM todavía no se ha validado como útil para el diagnóstico de CDIS. La biopsia estereotáxica o radioquirúrgica serán las formas de elección para el diagnóstico definitivo. Usando estereotaxia, se debe realizar posteriormente una biopsia radioquirúrgica, asegurando la obtención de márgenes libres de tumor y con buen resultado cosmético. El tratamiento quirúrgico habitual es una mastectomía parcial, aunque si el CDIS es extenso se realiza mastectomía. El CDIS no tiene indicación de disección axilar, sin embargo, si se sospecha microinvasión, el ganglio centinela está indicado. En el caso de realizarse mastectomía parcial, ésta debe complementarse con radioterapia para lograr buen control locorregional. Está indicado el tamoxifeno, 20 mg al día por 5 años, si hay receptores hormonales (estrógeno y progesterona) positivos en el tumor lo que sucede en más del 90% de estas pacientes. Carcinoma lobulillar in situ (CLIS) El carcinoma lobulillar in situ (CLIS), en cambio, no se considera un proceso maligno, sino que un factor de riesgo junto a la hiperplasia ductal y lobulillar atípica (HDA y HLA), dado que su presencia aumenta el riesgo de cáncer mamario hasta en 8 veces. Su manejo, a diferencia del CDIS, es la extirpación de la lesión y quimioprevención con tamoxifeno durante 5 años. Hace algún tiempo, la mastectomía bilateral profiláctica está sustentada en la bilateralidad y multicentricidad del CLIS, por lo que también es una posibilidad y alternativa de prevención para no desarrollar un cáncer en el futuro. 226 Existe consenso actual que la variedad de CLIS pleomórfico, denominado LIN III tendría comportamiento biológico similar al CDIS y por lo tanto, la recomendación de tratamiento es la cirugía y radioterapia adyuvante y eventual hormonoterapia posterior. Cáncer ductal infiltrante (CDI) El carcinoma ductal infiltrante (CDI) es la forma invasora más frecuente de cáncer de mama, constituyendo 80% de todos los casos y se caracteriza por ser una masa o tumoración con límites no bien delimitados. En la mamografía aparece como una masa con bordes mal definidos con trabéculas y tejido graso con áreas de necrosis y hemorragia que pueden aparecer como calcificaciones. En el examen físico, la tumoración tiene una consistencia más rígida o firme que las lesiones benignas. Bajo el microscopio, las células cancerosas invaden y reemplazan los tejidos circundantes normales. El factor pronóstico más importante en la sobrevida por cáncer de mama es el compromiso de linfonodos axilares. La expectativa de vida de pacientes con CDI, también depende del subtipo histológico de cada caso. Los carcinomas mucinosos, papilares, cribiformes y tubulares tienen una sobrevida más extensa y las recurrencias son mucho menos frecuentes. En los casos de CDI indeterminados o no especificados, la sobrevida es intermedia. Finalmente, las formas menos frecuentes del cáncer de mama ductal, como el sarcomatoide o el metaplásico, tienen pronósticos pobres. Otros factores predisponentes sobre el pronóstico del CDI son el estadio del cáncer al momento del diagnóstico, la expresión de receptores hormonales y la presencia de oncogenes como el HER2. Cáncer lobulillar infiltrante (CLI) El cáncer lobulillar es aquel que se desarrolla a partir de los lobulillos mamarios. Se le llama invasor o infiltrante porque penetra a través del tejido normal invadiendo las áreas más allá de los lobulillos. El carcinoma lobulillar invasor es menos común que el carcinoma ductal infiltrante y comprende alrededor del 15% de todos los cánceres de la mama, se presenta en forma multicéntrica y bilateral con bastante frecuencia. El cáncer infiltrante de mama, ya sea ductal o lobulillar, una vez que invade el tejido graso mamario, puede diseminarse a otras partes del cuerpo a través de conductos linfáticos o el torrente sanguíneo y se puede localizar en los ganglios cercanos a la CÁNCER mama. Los sitios más frecuentes a donde se disemina son los pulmones, hígado y huesos. El cáncer lobulillar además produce en forma frecuente metástasis cerebral. TRATAMIENTO DEL CÁNCER INFILTRANTE El tratamiento del CDI, y del CLI, por lo general, comienza con la extirpación del tumor y estudio de los ganglios linfáticos axilares, con disección de ganglio centinela o disección axilar. Después del estudio histológico definitivo se puede determinar el estadio, pronóstico y plantear el tratamiento más adecuado. La terapia suele ser adyuvante con una combinación de quimioterapia, radioterapia y terapia hormonal como el tamoxifeno o inhibidores de aromatasa, dependiendo de los factores pronósticos del tumor y caraterísticas de la paciente. El tratamiento comprende cirugía y radioterapia para el control local y quimioterapia y hormonoterapia para el control a distancia o sistémico. La mastectomía parcial o total con la exploración axilar (ganglio centinela o disección axilar) son las cirugías más frecuentemente usadas. En el caso de la mastectomía total, ésta puede ir acompañada de reconstrucción inmediata o diferida. La hormonoterapia se usa en pacientes con receptores hormonales positivos (estrógeno y progesterona) y los agentes más usados son el tamoxifeno y los inhibidores de aromatasa (letrozole y anastrazole), estos últimos solo en pacientes posmenopáusicas. Otro medicamento utilizado como terapia adyuvante es el Trastuzumab, nombre comercial herceptina, que es un anticuerpo monoclonal de IgG humanizado obtenido de células de mamífero (ovario) que se utiliza en aquellas pacientes con sobreexpresión del Her 2-neu, indicador de mayor replicación tumoral, logrando mejorar la sobrevida libre de enfermedad en estas pacientes con su uso por un año. Ganglio centinela (GC) Se define como el primer linfonodo de una cadena linfática que drena un territorio tisular determinado, de manera que, antes de proseguir su camino por la cadena, toda la linfa proveniente de dicho territorio debe pasar primero por el GC que, en el caso de la mama, se ubica, generalmente, en la axila. Criterios para realizar GC: – Cáncer de mama invasor histológicamente comprobado T1-T2- N0 M0 (Estadios I y IIa) – Axila clínicamente negativa DE MAMA – Tumor invasor hasta 3 cm – Carcinoma intraductal extenso o con microinvasión Para efectuar el estudio del GC, se debe encontrar un trazador que, de alguna manera, simule el comportamiento que tendría una célula maligna desprendida del tumor principal. En el caso del cáncer de mama se utiliza el nanocoloide (sulfuro coloidal) marcado con 99mTc y el azul de isosulfán (Lymphazurin, de la familia del azul patente). Linfocintigrafía Detección con gammacámara preoperatoria y/o sonda manual de detección de rayos gamma pre e intraoperatoria: – Se inyectan preoperatoriamente coloides marcados con Tecnecio-99 subdérmicamente sobre el tumor. – Entre 15 minutos y 2 horas después se obtienen imágenes estáticas escintigráficas mediante gammacámara en proyecciones anterior, lateral y oblicua. – Se marca la piel que está por encima de la primera detección radiactiva. – Se aplica la sonda manual de detección de rayos gamma sobre la zona marcada para confirmarla. – Intraoperatoriamente, con esta sonda, se vuelve a localizar ese ganglio centinela. Azul patente – Se inyectan 2-5 ml. intratumoral, peritumoral o subareolar. – 5-10 min. después se realiza una incisión axilar y se localiza el ganglio o conducto linfático que lleva al ganglio que se tiñe de azul. – Extirpación y envío a anatomía patológica para confirmar intraoperatoriamente que es tejido linfoide y ver si es (+) para metástasis. Conducta según GC – En caso positivo, se realiza vaciamiento axilar convencional de niveles I y II. – En caso negativo, fin de la intervención, en espera del estudio inmunohistoquímico posterior del GC. – En caso de estar afectado por micrometástasis se realizaría posteriormente el vaciamiento axilar convencional. ALTERNATIVAS TERAPÉUTICAS Tratamiento CDI – Cirugía conservadora + radioterapia: indicado en casos en que no existe multicentricidad ni 227 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 223-232 calcificaciones difusas a la mamografía. Indicado, además, para tumores pequeños, bajo grado nuclear y ausencia de necrosis. Se sugiere un margen de al menos 2 mm para un adecuado balance entre resultado cosmético y control de enfermedad. – Mastectomía total con o sin reconstrucción inmediata: recomendada cuando la lesión es de tamaño mayor al que permitiría un resultado cosmético aceptable (dependerá del tamaño de la mama). Otra indicación es microcalcificaciones difusas, multicéntricas o cuando persisten márgenes comprometidos tras dos intentos de cirugía conservadora. No requiere radioterapia postoperatoria. Tratamiento del cáncer de mama precoz (estadios I y II) – Corresponde a las etapas I, IIA y IIB. – El tratamiento consiste de cirugía, radioterapia, hormonoterapia y eventualmente quimioterapia. Opciones quirúrgicas: • Cirugía conservadora (mastectomía parcial con ganglio centinela y/o disección axilar, más radioterapia y hormonoterapia). – Contraindicaciones: - Tumores multicéntricos o con componente intraductal extenso. - Microcalcificaciones sospechosas extensas que comprometen más de un cuadrante. - Imposibilidad de márgenes (-) con resultado cosmético aceptable. - Tu >5 cm, sin respuesta a QT. - Imposibilidad de recibir radioterapia. - Alto riesgo de recurrencia local. - Preferencia de la paciente por una mastectomía total. – No son contraindicaciones para el tratamiento conservador: - Tumores del cuadrante central, aunque la cirugía conservadora obligue a resecar la areola y el pezón. - Compromiso de linfonodos axilares. - Preexistencia de implantes mamarios. • Mastectomía total (que puede ser con GC y/o DA): – Riesgo estimado de recurrencia inaceptable con manejo conservador. – Proporción mama/tumor que devenga mal resultado cosmético. – Imposibilidad de radioterapia. – Preferencia de la paciente. 228 Tratamiento del cáncer de mama localmente avanzado (estadio III) • Estadios III A y III B (incluye Inflamatorio) • Tratamiento estándar es combinado: 1. Quimioterapia neoadyuvante 2. Cirugía conservadora o radical 3. Quimioterapia adyuvante 4. Radioterapia 5. Hormonoterapia 1. Tumor primario resecable: – Cirugía radical. – Cirugía conservadora tras QMT neoadyuvante para disminuir tamaño tumoral. – Reconstrucción mamaria: No se recomienda reconstrucción mamaria inmediata, sino diferida posterior al tratamiento de radioterapia. – Tratamiento adyuvante: - Radioterapia: Puede incluir: pared torácica o glándula mamaria y linfáticos periféricos - Tratamiento sistémico – Quimioterapia y/u hormonoterapia, dependiendo del tamaño tumoral, grado histológico, compromiso linfonodos, receptores hormonales, cerb2, edad y condiciones de la paciente. 2. No resecable – Tratamiento preoperatorio con quimioterapia neoadyuvante y/o radioterapia y/o hormonoterapia. – Sin respuesta suficiente: Terapia paliativa sintomática. – Con respuesta suficiente: mastectomía total + disección axilar y radioterapia complementaria (si no se ha usado previamente). – Evaluar para continuar con terapia sistémica. Tratamiento del cáncer de mama metastásico (estadio IV) • El cáncer de mama metastásico es incurable (nivel de evidencia II). • Se debe tener confirmación del diagnóstico con biopsia (intervalo largo a la aparición de metástasis, lesiones únicas, lesiones óseas, sin estudio de receptores hormonales en el tumor primario). • El objetivo del tratamiento sistémico es aliviar síntomas y prolongar la sobrevida. • En consecuencia, se debe elegir el tratamiento más efectivo y con menor toxicidad. • Si las condiciones lo permiten, se debe recurrir siempre al tratamiento hormonal antes que la quimioterapia. CÁNCER • Metástasis ósea → bifosfonatos y radioterapia a zonas óseas dolorosas. • Metástasis viscerales → quimioterapia. • Cirugía en presencia de hemorragia o infección; en caso de metástasis óseas en columna, con riesgo de fractura, se podrá indicar también la cirugía de estabilización. • Radioterapia está indicada en recaídas locorregionales y en caso de metástasis óseas dolorosas (como manejo paliativo antiálgico). FACTORES • Estadio 0: se cura + del 90% • Estadio I: se cura en alrededor del 80% de los casos • Estadio II: grupo heterogéneo, se curan alrededor de 50%-60% de los casos • Estadio III: grupo heterogéneo, tasa media de intervalo libre de enfermedad a largo plazo: 30%40% • Estadio IV: casi todas las pacientes con cáncer de mama diseminado mueren a los 2 años de seguimiento. PRONÓSTICOS SEGUIMIENTO El objetivo de los factores pronósticos es el de proporcionar al clínico las indicaciones sobre el riesgo vital y de recidiva local de las pacientes que presentan un carcinoma infiltrante de mama. Factores tumorales - Factores del huésped Estado de los ganglios Tamaño tumoral Grado histolológico y nuclear Permeación vascular y linfática Estadio patológico (TNM) Estado receptores hormonales (RE y RP) HER2 Contenido ADN (ploidía y fase S) Componente in situ Quimioterapia previa Radioterapia previa Componente intraductal extenso (asociado a carcinoma invasor) - Edad Estado menstrual Historia familiar Enfermedad previa neoplásica Inmunosupresión Respuesta inflamatoria Nutrición (dieta) SOBREVIDA La sobrevida varía fundamentalmente en función del estadio de la paciente (Tabla 5). Tabla 5. Relación entre estadio del cáncer de mama y pronóstico de sobrevida Estadio 0 IA - IB IC II IIIA IIIB IV DE MAMA Sobrevida 99% 90% 80% 60% 50% 30% 10% a a a a a a a 20 20 20 10 10 10 10 años años años años años años años DEL CÁNCER DE MAMA El diagnóstico precoz de la enfermedad y las mejores terapias favorecen la sobrevida y el pronóstico de la enfermedad. Si sumamos el incremento en la incidencia, y el mayor número de mujeres con sobrevida mayor, deducimos que cada vez tendremos más mujeres con cáncer de mama que controlar. El seguimiento tradicional de las pacientes que han sido operadas de un cáncer mamario ha consistido en una anamnesis prolija, examen físico y mamario (trimestral los 2 primeros años, luego semestral hasta el 5º año, y desde ahí anual), mamografía con o sin ecotomografía anual, cintigrama óseo, Rx de tórax, ecotomografía abdominal, hemograma y perfil bioquímico también anual. Esto se consideraba un estudio completo de extensión y control de estas pacientes, con el fin, probablemente de mejorar el pronóstico o asegurar un tratamiento efectivo para la enfermedad diseminada. Pero lamentablemente sabemos que no hay cura para el cáncer metastásico. En los últimos años, en base a trabajos y experiencia internacional, se ha observado que la verdadera utilidad de este tipo de seguimiento intensivo, no ofrece mayor beneficio, ya que el diagnóstico de una metástasis no mejora ni el pronóstico ni la sobrevida de la enfermedad, versus el seguimiento llamado clínico, que consiste sólo en anamnesis, examen físico y mamario y mamografía anual. Es más, en un estudio se vio que la mortalidad en pacientes con cáncer mamario, no variaba incluso en ausencia de seguimiento; 45,4% para las con seguimiento normal y 45,8% para las sin seguimiento. La diferencia en la expectativa de sobreviva en pacientes sobre 50 años tratadas con intento curativo fue de 2 meses más para las que tuvieron seguimiento. Tomamos como recomendación el empleo del seguimiento clínico versus el intensivo, al menos 229 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 223-232 para pacientes con estadios 0, I y II, y las razones estadísticas se resumen a continuación. • Ecotomografía hepática: su positividad, como único método para diagnóstico de metástasis, en estadios III es entre 1% y 3%. Tasa de falsos positivos 10% a 22%. • Radiografía de tórax: su real valor de positividad no es mayor al 1%, con 0,1% para estadio I, 0,2% para el II, y 1,7% para el III. Tasa de falsos positivos 0% a 23%. • Cintigrama óseo: su rendimiento es bajo en estadios I y II, siendo del 0% al 3%. Es cierto que en etapas más avanzadas la positividad es mayor entre 8% y 30%. Por lo tanto no se recomienda en estadios precoces, por su bajo rendimiento y el porcentaje de falsos positivos, que van del 10% al 22%, negativos del orden del 10%. • Enzimas: no son representativas, ya que pueden estar normales en una paciente metastásica y alta en una paciente sin que tenga significado tumoral. Por lo anterior, la norma es realizar estudio de diseminación, a pacientes recién diagnosticadas de cáncer, en estadios III. Después de esa contextualización, la forma en que enfrentaremos a nuestras pacientes portadoras de un cáncer mamario será la siguiente. En pacientes estadios 0, I, II, sólo anamnesis, examen físico y mamario (trimestral los 2 primeros años, luego semestral hasta el 5º año, y desde ahí anual), mamografía anual con o sin ecotomografía mamaria. La anamnesis será dirigida a la detección de síntomas sugerentes de metástasis. La tasa de recurrencia local en una mama sometida a tratamiento conservador es del 1% anual, 5% a los 5 años, y 8% a los 10 años. Los siguientes estudios no tienen mayor rendimiento, y no estarían recomendados en pacientes en LECTURAS – – – – RECOMENDADAS ANDERSON BO, MASETTI R ET AL. Oncoplastic approaches to partial mastectomy: an overview of volume-displacement techniques. Lancet Oncol 2005; 6(3): 145-57. ARRIAGADA R, LE MG ET AL. Conservative treatment versus mastectomy in early breast cancer: patterns of failure with 15 years of follow-up data. Institut Gustave-Roussy Breast Cancer Group. J Clin Oncol 1996; 14(5): 1558-64. ASGEIRSSON KS, MCCULLEY SJ ET AL. Size of invasive breast cancer and risk of local recurrence after breast-conservation therapy. Eur J Cancer 2003; 39 (17): 2462-9. BARTON A, BLITZ M ET AL. Early removal of postmastectomy drains is not beneficial: results from a halted randomized controlled trial. Am J Surg 2006; 191 (5): 652-6. 230 estadios precoces asintomáticos: hemograma, vhs, perfil bioquímico y marcadores tumorales, Rx de tórax, ecotomografía abdominal, cintigrama óseo. Si bien la quimioterapia y radioterapia pueden producir una leucemia, su frecuencia es tan baja que la obtención de un hemograma para ese fin no es útil. Las hormonas, fundamentalmente LDH y fosfatasas alcalinas, están relacionadas con metástasis óseas y hepáticas, pero son inespecíficas. En cuanto a marcadores tumorales como el CEA, CA15.3 y otros no se recomiendan para el seguimiento, dado que ni el pronóstico, ni el manejo de la enfermedad varía, aunque es cierto que los marcadores pudieran anticiparse en algunos meses a las imágenes. El cintigrama óseo no se recomienda por su bajo rendimiento y su alto número de falsos positivos. La radiografía de tórax no se recomienda ya que el diagnóstico de recurrencia de la enfermedad promedio es de 2,7%, en otros estudios es de 0,4%. Ecotomografía abdominal tampoco se recomienda ya que no hay datos que avalen su rendimiento en el seguimiento. En pacientes usuarias de tamoxifeno, medicamento usado hace varios años para el tratamiento y prevención del cáncer mamario, tienen un riesgo real de alteraciones endometriales, siendo su expresión mayor, el cáncer. Por tal motivo el control ginecológico de la paciente con cáncer mamario y en tratamiento con tamoxifeno debe ser enfocado al estudio endometrial. Así las pacientes deben estar bien informadas de que presentan un mayor riesgo de cáncer de endometrio que la población normal. Por lo tanto, deben estar atentas a cualquier sangrado vaginal para ser estudiado. Así y todo, la ecotomografía transvaginal no está indicada de rutina. – – – – – BOUGHEY JC, PEINTINGER F ET AL. Impact of preoperative versus postoperative chemotherapy on the extent and number of surgical procedures in patients treated in randomized clinical trials for breast cancer. Ann Surg 2006; 244 (3): 464-70. BREM RF, GATEWOOD OM. Preoperative Needle Localization of Nonpalpable Breast Lesions: Determination of Appropriate Needle Length. Breast J 1999; 5 (4): 235-7. BREAST CANCER DISEASE SITE GROUP (2003). Baseline Staging Tests in Primary Breast Cancer. BURAK WE JR, AGNESE DM ET AL. Radiofrequency ablation of invasive breast carcinoma followed by delayed surgical excision. Cancer 2003; 98 (7): 1369-76. CAREY LA, METZGER R ET AL. American Joint Committee on Cancer tumor-node-metastasis stage after neoad- CÁNCER – – – – – – – – – – – – – juvant chemotherapy and breast cancer outcome. J Natl Cancer 2005. CHO LC, SENZER N ET AL. Conservative surgery and radiation therapy for macroscopically multiple ipsilateral invasive breast cancers. Am J Surg 2002; 183 (6): 650-4. CLARK RM, WHELAN T ET AL. Randomized clinical trial of breast irradiation following lumpectomy and axillary dissection for node-negative breast cancer: an update. Ontario Clinical Oncology Group. J Natl Cancer Inst 1996; 88 (22): 1659-64. CLARKE M, COLLINS R ET AL. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomized trials. Lancet 2005; 366 (9503): 2087-106. CLOUGH KB, LEWIS JS ET AL. Oncoplastic techniques allow extensive resections for breast-conserving therapy of breast carcinomas. Ann Surg 2003; 237(1): 26-34. DIBIASE SJ, KOMARNICKY LT ET AL. The number of positive margins influences the outcome of women treated with breast preservation for early stage breast carcinoma. Cancer 1998; 82 (11): 2212-20. DILLON MF, HILL AD ET AL. A pathologic assessment of adequate margin status in breast-conserving therapy. Ann Surg Oncol 2006; 13 (3): 333-9. Effects of radiotherapy and surgery in early breast cancer. An overview of the randomized trials. Early Breast Cancer Trialists’ Collaborative Group. N Engl J Med 1995; 333 (22): 1444-55. Favourable and unfavourable effects on long-term survival of radiotherapy for early breast cancer: an overview of the randomized trials. Early Breast Cancer Trialists’ Collaborative Group. Lancet 2000; 355 (9217): 1757-70. FISHER B, JEONG JH ET AL. Twenty-five-year follow-up of a randomized trial comparing radical mastectomy, total mastectomy, and total mastectomy followed by irradiation. N Engl J Med 2002; 347 (8): 567-75. FISHER B, ANDERSON S ET AL. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med 2002; 347 (16): 1233-41. FITZAL F, MITTLBOECK M ET AL. Breast-conserving therapy for centrally located breast cancer. Ann Surg 2008; 247 (3): 470-6. FORREST AP, STEWART HJ ET AL. Randomized controlled trial of conservation therapy for breast cancer: 6-year analysis of the Scottish trial. Scottish Cancer Trials Breast Group. Lancet 1996; 348 (9029): 708-13. GONZÁLEZ-ANGULO AM, MCGUIRE SE ET AL. Factors predictive of distant metastases in patients with breast cancer who have a pathologic complete response after neoadjuvant chemotherapy. J Clin Oncol 2005; 23 (28): 7098-104. – – – – – – – – – – – – – – – DE MAMA GUARNERI V, FRASSOLDATI A ET AL. Primary systemic therapy for operable breast cancer: a review of clinical trials and perspectives. Cancer Lett 2007; 248 (2): 175-85. HUGHES KS, SCHNAPER LA ET AL. Lumpectomy plus tamoxifen with or without irradiation in women 70 years of age or older with early breast cancer. N Engl J Med 2004; 351 (10). JAIN PK, SOWDI R ET AL. Randomized clinical trial investigating the use of drains and fibrin sealant following surgery for breast cancer. Br J Surg 2004; 91 (1): 54-60. JATOI I, AND PROSCHAN MA. Randomized trials of breast-conserving therapy versus mastectomy for primary breast cancer: a pooled analysis of updated results. Am J Clin Oncol 2005; 28 (3): 289-94. JONES RL, AND SMITH IE. Neoadjuvant treatment for earlystage breast cancer: opportunities to assess tumour response. Lancet Oncol 2006; 7 (10): 869-74. KAPLAN J, GIRON G ET AL. Breast conservation in patients with multiple ipsilateral synchronous cancers. J Am Coll Surg 2003; 197 (5): 726-9. KAWASE K, DIMAIO DJ ET AL. Paget’s disease of the breast: there is a role for breast-conserving therapy. Ann Surg Oncol 2005; 12 (5): 391-7. KIRICUTA CI AND TAUSCH J. A mathematical model of axillary lymph node involvement based on 1446 complete axillary dissections in patients with breast carcinoma. Cancer 1992; 69 (10): 2496-501. LILJEGREN G, HOLMBERG L ET AL. 10-Year results after sector resection with or without postoperative radiotherapy for stage I breast cancer: a randomized trial. J Clin Oncol 1999; 17 (8): 2326-33. LONCASTER J AND DODWELL D. Adjuvant radiotherapy after conservative surgery for breast cancer: is it always necessary? Clin Oncol (R Coll Radiol) 2003; 15 (3): 139-43. LUINI A, ROSOSCHANSKY J ET AL. The surgical margin status after breast-conserving surgery: discussion of an open issue. Breast Cancer Res Treat 2009; 113 (2): 397-402. MCLAUGHLIN SA, OCHOA-FRONGIA LM ET AL. Influence of frozen-section analysis of sentinel lymph node and lumpectomy margin status on reoperation rates in patients undergoing breast-conservation therapy. J Am Coll Surg 2008; 206 (1): 76-82. MIEOG JS, VAN DER HAGE JA ET AL. Preoperative chemotherapy for women with operable breast cancer. Cochrane Database of Systematic Reviews (2) (2007). MIRALLES R. ¿Cirugía conservadora o radical en el cáncer de mama? Ginecología Clínica y Quirúrgica 2002; 3 (1): 38-51. MORROW M, STROM EA ET AL. Standard for breast conservation therapy in the management of invasive breast carcinoma. CA Cancer J Clin 2002; 52 (5): 277-300. 231 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 223-232 – – – – – – – – – – – – – – – MORROW M. Rational local therapy for breast cancer. N Engl J Med 2002; 347 (16): 1270-1. NATTINGER AB, HOFFMANN RG ET AL. Relation between appropriateness of primary therapy for early-stage breast carcinoma and increased use of breast-conserving surgery. Lancet 2000; 356 (9236): 1148-53. NEWMAN LA AND KUERER HM. Advances in breast conservation therapy. J Clin Oncol 2005; 23 (8): 1685-97. NUYTEN DS, KREIKE B ET AL. Predicting a local recurrence after breast-conserving therapy by gene expression profiling. Breast Cancer Res 2006; 8 (5): R62. OLSEN MA, LEFTA M ET AL. Risk factors for surgical site infection after major breast operation. J Am Coll Surg 2008; 207 (3): 326-35. POGGI MM, DANFORTH DN ET AL. Eighteen-year results in the treatment of early breast carcinoma with mastectomy versus breast conservation therapy: the National Cancer Institute Randomized Trial. Cancer 2003; 98 (4): 697-702. PUGLISI F, FOLLADOR A ET AL. Baseline staging tests after a new diagnosis of breast cancer: further evidence of their limited indications. Ann Oncol 2005; 16 (2): 263-6. PUNGLIA RS, MORROW M ET AL. Local therapy and survival in breast cancer. N Engl J Med 2007; 356 (23): 2399-405. RUBIO IT AND MARCO V. [The importance of surgical margins in conservative surgery for breast cancer]. Cir Esp 2006; 79 (1): 3-9. SAMPHAO S, EREMIN JM ET AL. Management of the axilla in women with breast cancer: current clinical practice and a new selective targeted approach. Ann Surg Oncol 2008; 15 (5): 1282-96. SINGLETARY SE. Surgical margins in patients with earlystage breast cancer treated with breast conservation therapy. Am J Surg 2002; 184 (5): 383-93. SINGLETARY SE, ALLRED C ET AL. Revision of the American Joint Committee on Cancer staging system for breast cancer. J Clin Oncol 2002; 20 (17): 3628-36. SMITH IE, DOWSETT M ET AL. Neoadjuvant treatment of postmenopausal breast cancer with anastrozole, tamoxifen, or both in combination: the Immediate Preoperative Anastrozole, Tamoxifen, or Combined with Tamoxifen (IMPACT) multicenter double-blind randomized trial. J Clin Oncol 2005; 23 (22): 5108-16. TORRISI R, DELLAPASQUA S ET AL. Preoperative concurrent chemo- and endocrine therapies for women with large operable breast cancer expressing steroid hormone receptors. Breast 2008; 17 (6): 654-60. VERONESI U, SACCOZZI R ET AL. Comparing radical mastectomy with quadrantectomy, axillary dissection, and radiotherapy in patients with small cancers of the breast. N Engl J Med 1981; 305 (1): 6-11. 232 – – – – – – – – – – – – – – VERONESI U, BANFI A ET AL. Comparison of Halsted mastectomy with quadrantectomy, axillary dissection, and radiotherapy in early breast cancer: long-term results. Eur J Cancer Clin Oncol 1986; 22 (9): 1085-9. VERONESI U, BANFI A ET AL. Breast conservation is the treatment of choice in small breast cancer: long-term results of a randomized trial. Eur J Cancer 1990; 26 (6): 668-70. VERONESI U, VOLTERRANI F ET AL. Quadrantectomy versus lumpectomy for small size breast cancer. Eur J Cancer 1990; 26 (6): 671-3. VERONESI U, LUINI A ET AL. Radiotherapy after breastpreserving surgery in women with localized cancer of the breast. N Engl J Med 1993; 328 (22): 1587-91. VERONESI U, SALVADORI B ET AL. Breast conservation is a safe method in patients with small cancer of the breast. Long-term results of three randomised trials on 1,973 patients. Eur J Cancer 1995; 31A (10): 1574-9. MARIANI L, SALVADORI B ET AL. Ten year results of a randomised trial comparing two conservative treatment strategies for small size breast cancer. Eur J Cancer 1998; 34 (8): 1156-62. VERONESI U, MARUBINI E ET AL. Radiotherapy after breast-conserving surgery in small breast carcinoma: long-term results of a randomized trial. Ann Oncol 2001; 12 (7): 997-1003. VERONESI U, CASCINELLI N ET AL. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med 2002; 347 (16): 1227-32. VINH-HUNG V AND VERSCHRAEGEN C. Breast-conserving surgery with or without radiotherapy: pooled-analysis for risks of ipsilateral breast tumor recurrence and mortality. J Natl Cancer Inst 2004; 96 (2): 115-21. VOOGD AC, NIELSEN M ET AL. Differences in risk factors for local and distant recurrence after breast-conserving therapy or mastectomy for stage I and II breast cancer: pooled results of two large European randomized trials. J Clin Oncol 2001; 19 (6): 1688-97. WHELAN T, OLIVOTTO I ET AL. Clinical practice guidelines for the care and treatment of breast cancer: breast radiotherapy after breast-conserving surgery (summary of the 2003 update). CMAJ 2003; 168 (4): 437-9. WINCHESTER DP AND COX JD. Standars for Breast conservation treatment. CA A Cancer Journal for Clinicians 1992; 42 (3). WYLD L AND REED M. The role of surgery in the management of older women with breast cancer. Eur J Cancer 2007; 43 (15): 2253-63. YANG SH, YANG KH ET AL. Breast conservation therapy for stage I or stage II breast cancer: a meta-analysis of randomized controlled trials. Ann Oncol 2008; 19 (6): 1039-44. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 233-236 ARTÍCULO Cáncer de mama y embarazo Paola Ruiz de Viñaspre A. INTRODUCCIÓN El cáncer de mama, junto con el cáncer cérvicouterino, es una de las neoplasias más comunes diagnosticadas durante el embarazo. Se define como aquel cáncer de mama que se diagnostica durante el embarazo, lactancia y hasta 12 meses posparto. El diagnóstico y las implicancias terapéuticas en esta condición son especiales, por lo que es necesario conocer todos los antecedentes para poder optar al mejor tratamiento y con el menor costo tanto para la madre como para el producto de la gestación. La mujer en esta condición generalmente se presenta con un estadio más avanzado de la enfermedad y está asociado a un peor pronóstico. EPIDEMIOLOGÍA La fecundidad en Chile está en plena etapa de transición. Si en 1960 la tasa de fecundidad era de 5,4 hijos, hoy es de 1,9. Además, la fecundidad ha disminuido en todos los grupos etarios, excepto en el grupo entre 35-39 años, en que experimenta un leve aumento. Debido a que la asociación de cáncer de mama y embarazo es escasa, debiera esperarse alrededor de 56 a 100 casos nuevos por año. La incidencia de cáncer de mama en la población general es de 12,67%. La edad promedio de diagnóstico es a los 61 años, y sólo el 12,7% se presenta en la edad fértil entre los 20 y 40 años. De estas mujeres, sólo 10% se embarazará. Esto demuestra que la relación cáncer de mama y embarazo es poco frecuente. Se estima una incidencia de 1 en 3.000 embarazos, sin embargo, como se dijo anteriormente, es la segunda neoplasia más frecuente durante la gestación. El cáncer de mama asociado al embarazo está relacionado con la edad. Aquellas mujeres que tienen un primer embarazo después de los 30 años tienen 2 a 3 veces mayor riesgo de desarrollar cáncer de mama, que aquellas que los tienen antes de los 20 años. Patología La histología más común en estas pacientes es el carcinoma ductal infiltrante. Generalmente es mayor en su tamaño de presentación. Además hay mayor frecuencia de invasión linfovascular, mayor grado nuclear, e independencia hormonal (mayor frecuencia de receptores hormonales negativos). Evaluación diagnóstica La mayoría de estas pacientes se presentan con una masa indolora en la mama. Médico. Especialista en Obstetricia y Ginecología, Unidad de Patología Mamaria, Servicio Obstetricia y Ginecología, Hospital Dr. Luis Tisné Brousse. E mail: doctorapaolaruiz@gmail.com 233 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 233-236 El diagnóstico diferencial se debe realizar con: carcinoma invasor, adenoma lactacional, fibroadenoma, enfermedad fibroquística, hiperplasia lobular, galactocele, absceso, lipoma, hamartoma, linfoma, sarcoma, neuroma, TBC. El 80% de las masas mamarias son benignas. Sin embargo, la evaluación debe comenzar con un examen clínico, cuyo inicio debe ser en la primera visita prenatal. Generalmente, el diagnóstico es clínico, difícil y tardío. Se debe principalmente a todos los cambios que se producen en la glándula mamaria durante el embarazo. Se produce edema, congestión mamaria, hipervascularización, cambios estructurales de la glándula, etc. Si a esto le sumamos la falta de rigurosidad del médico en pesquisar patologías no relacionadas al embarazo, es que diagnosticamos a estas pacientes en estadios más avanzados. Se ha visto un retraso entre 3 a 15 meses en comparación a pacientes sin embarazo. ESTUDIO IMAGENOLÓGICO Mamografía La mamografía a menudo revela mamas muy densas, por lo que no se recomienda de rutina en estas pacientes. El tamaño de la mama y la densidad del parénquima se incrementan durante el embarazo y la lactancia, por lo que la efectividad de este método disminuye. La sensibilidad es de 78% a 90%. Cabe destacar que en un tercio de las pacientes sólo se encontrarán signos secundarios de malignidad. Se debe tener en cuenta la radiación fetal, que se estima en 0,004 Gy lo que es muy poco, considerando que dosis de 100 Gy se asocian a 1% de riesgo de malformaciones fetales y problemas del sistema nervioso central. Por lo tanto, se considera un método seguro para el feto. Ecografía mamaria La ecografía mamaria ofrece una excelente ayuda en la evaluación mamaria sin riesgo fetal. Presenta una sensibilidad de 100% en la detección de masas mamarias. Además, detectan tumores adicionales en 20% y metástasis axilares en 83%. Es el método de diagnóstico de elección durante el embarazo y la lactancia. Si hay sospecha, debe ser sometida de inmediato a biopsia percutánea. Para el estudio de diseminación se pueden realizar los siguientes exámenes: • Ecografía abdominal: para evaluación hepática principalmente, es segura e inocua para el feto. • Radiografía de tórax: Se produce una exposición fetal <0,01 cGy. Debe realizarse con protección fetal. • Cintigrama ósea: Con Tc 99 como medio de contraste. Se puede utilizar para la evaluación ósea de estas pacientes. La exposición es <0,02 cGy. Se debe tener precaución y realizar sobrehidratación parenteral y cateterización vesical por al menos 8 horas. • TAC cerebro: Se debe realizar con protección fetal. Biopsia de la mama Frente a una lesión que se considere sospechosa se debe realizar una biopsia sin demora. Se recomienda el método menos invasivo y de mayor rendimiento, el que variará según los recursos disponibles y de la experiencia de cada grupo de trabajo. La biopsia mamaria, sea percutánea mediante aguja gruesa o abierta con biopsia incisional se puede realizar con anestesia local o general, respectivamente, siendo seguro, sin consecuencias para el feto. Hay que tener en cuenta, que por el aumento de la vascularización y cambios propios del embarazo, se presenta un mayor riesgo de hemorragias intraoperatorias y de hematomas posterior a la biopsia. Marcadores tumorales En estas pacientes es un poco más complejo poder medir los niveles de receptores hormonales. Método bioquímico: Se debe tener presente que la unión al ligando depende de la disponibilidad del receptor no ligado. Puede dar falsos negativos porque los sitios activos del receptor se encuentran ocupados. Hay 65% de falsos negativos. Método inmunohistoquímico: Se tiñen todos los receptores, ocupados o libres. Hay pocas publicaciones al respecto, pero en una se señala que la mayoría de los cánceres de mama durante el embarazo presentan receptores estrogénicos positivos. • HER 2/NEU: Al medir este oncogen, se encuentra en 58% de las pacientes con embarazo, v/s 16% en las mujeres controles sin embarazo. • BRCA 1- BRCA 2: La mutación de estos genes no está suficientemente estudiada. Sólo en 2 estudios de baja casuística señalan mayor frecuencia de mutaciones en mujeres con cáncer y embarazo. Resonancia mamaria TRATAMIENTO No tiene indicación para el estudio de lesiones mamarias durante el embarazo. 234 Además de tener las consideraciones propias de la enfermedad para plantear el adecuado tratamiento, CÁNCER se debe considerar el efecto de cada uno de ellos sobre el feto. Es por eso, que se hace más difícil la toma de decisiones y conlleva problemas éticos importantes en algunos casos. Debido a lo anterior, se hace fundamental conocer las alternativas de tratamiento disponible en estas pacientes, el momento adecuado de su utilización en relación al período de la gestación y los efectos finales que cada uno de ellos tiene. Cirugía La mayoría de los autores concluye que la cirugía de elección en estas pacientes es la mastectomía radical modificada. Se recomienda esperar hasta después de las 12 semanas de embarazo para evitar riesgo de abortos espontáneos. Aunque la cirugía conservadora se considera segura, requiere radioterapia complementaria, la que está contraindicada durante todo el embarazo. Se aconseja, por lo tanto, realizar esta cirugía a partir del segundo a tercer trimestre y diferir la radioterapia hasta después del parto. Se debe considerar la alternativa de la evaluación del ganglio centinela para el estudio axilar, en los casos que cumplan los criterios para su uso, aun cuando, sigue siendo controvertido. En los estudios realizados, la exposición fetal a la radiación es despreciable, pues los umbrales alcanzados se encuentran muy por debajo de los niveles para producir daño fetal. Radioterapia El riesgo fetal a la radiación es mayor en el primer trimestre e incluye teratogenicidad, aborto y neoplasia infantil con desórdenes hematológicos. Se estima que la dosis mínima para provocar daño fetal (muerte, malformaciones, deterioro intelectual y cánceres posteriores) es de 0,1 a 0,2 Gy. Con la radioterapia estándar a la pared torácica, la exposición fetal varía entre 0,05 a 2 Gy hacia el final del embarazo, pues el feto se acerca más a la zona irradiada. Hay estudios en los que se ha realizado radioterapia con protección fetal con blindaje de plomo y se han obtenido recién nacidos sanos (poca casuística). Sin embargo, Hassey Dow sostiene que la mayor exposición al feto ocurre por dispersión interna, pese a la protección fetal, alcanzando niveles inaceptables (1 a 1,5 Gy). Por todo lo anterior, la radioterapia está contraindicada en cualquier período del embarazo, pues no se puede garantizar la seguridad fetal. Sólo debe realizarse posterior al parto. Quimioterapia La quimioterapia está contraindicada en el primer trimestre del embarazo por el alto riesgo de malformaciones fetales (14% a 19%). DE MAMA Y EMBARAZO La quimioterapia en base a antraciclinas (FAC) en el segundo y tercer trimestre puede ser administrada con mínimo riesgo para el feto, teniendo presente que hay una mayor probabilidad de restricción del crecimiento intrauterino y parto prematuro. La quimioterapia no debe administrarse después de las 35 semanas de embarazo ni durante la lactancia, por riesgo de mielosupresión fetal (10% a 30%) en el recién nacido, sepsis y trombocitopenia. El metotrexato está contraindicado durante todo el embarazo por el alto riesgo de teratogenicidad. Con respecto al uso de taxanos, no existe evidencia de efecto deletéreo después del primer trimestre, aunque no hay grandes estudios con esta droga, por lo que se prefieren las antraciclinas. Por último, con respecto a Herceptina, se puede usar en casos más extremos, por ejemplo en aquellas pacientes con cáncer mamario metastásico, y con el consentimiento informado de la paciente, pues puede exponer al feto a una probabilidad importante de sufrir oligoamnios. Hormonoterapia No debe ser usado el Tamoxifeno durante el embarazo, por existir reporte de anomalías genitales fetales por el uso de este medicamento. La similitud del Tamoxifeno con el dietiletilbestrol, hacen posible que los fetos expuestos presenten a largo plazo efectos similares a los provocados por este compuesto, es decir, carcinoma cervical de células claras, incluso hasta 20 años después de su exposición. Recomendaciones de tratamiento 1. Tratamiento locorregional estadios I y II: Primera mitad del embarazo: Mastectomía radical modificada sin radioterapia complementaria. Segunda mitad del embarazo: Se agrega la opción de mastectomía parcial más vaciamiento axilar. Se espera viabilidad fetal y radioterapia posterior al parto. 2. Tratamiento sistémico estadios I y II: Si existe indicación de quimioterapia adyuvante, se recomienda a partir de las 19 semanas de gestación. El embarazo debe continuar. El riesgo de aborto es mínimo. El aborto no influye en el pronóstico, por lo que no se recomienda la interrupción del embarazo. 3. Tratamiento en estadio III: Durante el embarazo se recomienda combinar cirugía y quimioterapia. La radioterapia se debe posponer hasta después del parto. En la segunda mitad del embarazo puede considerarse quimioterapia neoadyuvante, eventual cirugía conservadora y radioterapia después del parto. 235 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 233-236 PRONÓSTICO No existe consenso sobre si el mal pronóstico observado en este grupo de mujeres depende de una mayor agresividad tumoral propia del estado embarazo-lactancia, o si este peor pronóstico es debido a un retraso en el diagnóstico y tratamiento, junto a la agresividad tumoral propia de las mujeres jóvenes. Generalmente se presentan tumores más grandes y mayor incidencia de metástasis ganglionares axilares. Hasta en el 80% de los casos, las propias pacientes se descubrieron el tumor, lo que permite deducir la falta de examen clínico mamario rutinario. La mayoría de las mujeres se diagnostican en estadio II a III (65% a 90%) comparado con 45% a 66% de las no embarazadas. El factor más decisivo en esto tiene relación en un diagnóstico más tardío de la enfermedad y no necesariamente con el hiperestrogenismo, pues no LECTURAS – – – – – – – – – – – – – – – RECOMENDADAS HARRIS JR. Diseases of the breast, 2nd Ed, Lippincott Williams and Wilkins, Philadelphia, 2000. GWYN ET AL. Breast cancer during pregnancy. Oncology 15:39-51, 2001 KOPANS D. Lipincott-Raven Publisher. Philadelphia, 1999; 445-96. BONNIER P, ROMAIN S, DILHUYDY J ET AL. Int J Cancer 1997; 72: 720-7. LANGOME G ET AL. Cancer 1993; 71: 2499-506. PETREK JA. Breast cancer during pregnancy. Cancer 1994; 74: 518-27. GWYN ET AL. Breast cancer during pregnancy. Oncology 2001; 15: 39-51. MAZZE R ET AL. Reproductive out-come after anesthesia and operation during pregnancy. AM J Obstet Gynecol 1989; 161: 1178. ZEMLICKIS D ET AL. Arch Intern Med 1992; 152: 573. EBERT U. Pharmacol Ther 1997; 74: 207-20. GIACALONE P ET AL. 1999; 86: 2266-72. BERRY D ET AL. J Clin Oncol 1999; 17: 855-61. ZEMLICKIS D, LISHNER M, DEGENDORFER P ET AL. Fetal outcome after in utero exposure to cancer chemotherapy. Arch Intern Med 1992; 152: 573. GIACALONE P, LAFFARGUE F, BENOS P. Chemotherapy for breast carcinoma during pregnancy. Cancer 1999; 86: 2266-72. BUEKERS TE, LALLAS TA. Chemotherapy in pregnancy. Obstet Gynecol Clin North Am 1998; 25: 323. 236 hay clara evidencia en que contribuya al desarrollo y rápido crecimiento del cáncer. Embarazo posterior a cáncer de mama: El 7% de las mujeres fértiles tratadas se embarazan posteriormente, y el 70% de ellas lo hacen en los 5 años siguientes al tratamiento. La mayor parte de los estudios indican que un nuevo embarazo no afecta el pronóstico. Incluso algunos demuestran un efecto protector, especialmente cuando se espera más de 24 meses. La evidencia disponible permite concluir que el embarazo posterior al diagnóstico de cáncer de mama, al menos no empeora la sobrevida. La interrupción del embarazo no mejora el pronóstico. Se recomienda esperar 2 años después del tratamiento para un nuevo embarazo. Los embarazos en mujeres tratadas previamente por cáncer de mama, se deben considerar de alto riesgo, ya que existe mayor probabilidad de complicaciones de parto, cesárea, parto pretérmino y bajo peso al nacer. – – – – – – – – – – – – – – – – – – – – – AVILEZ ET AL. Long term follow up of children born to mothers with acute leukemia during pregnancy. Med Pediatr Oncol 1988; 16: 3-6. GWYN ET AL. Breast cancer during pregnancy. Oncology 2001; 15: 39-51. NCCN Breast Practice Guidelines Panel, 1999. GWYN K, THERIAULT R. Breast Cancer During Pregnancy. Oncology 2001; Vol 15; 1: 9-24. HOLLEB ET AL. The relation of carcinoma of the breast and pregnancy in 283 patients. Surg Gynecol Obstet 1962; 115: 65-71. NUGENT ET AL. Breast cancer and pregnancy. Arch Surg 1985; 120: 1221-4. CLARK ET AL. Breast cancer and pregnancy. Clin Oncol 1989; 1: 11-8. DEEMARSKY ET AL. Breast cancer and pregnancy. Breast 1981; 7: 17-21. TRETLI ET AL. Br J Cancer 1988; 58: 382-4. HARVEY JC ET AL. Surg Gynecol Obstet 1981; 153: 723. RIBEIRO GG ET AL. Br J Surg 1986; 73: 607. MIGNOT L ET AL. Presse Med 1961; 15: 1086. ARIEL I ET AL. Int Surg 1989; 74: 185. CLARK RM ET AL. Clin Oncol 1989; 1: 11. SANKILA R ET AL. Am J Obstet Gynecol 1994; 170: 818. MALAMOS NA ET AL. Oncology 1996; 53: 471. KROMAN N ET AL. Lancet 1997; 350: 319. VELENTGAS P ET AL. Cancer 1999; 85: 2424. GELBER S ET AL. J Clin Oncol 2001; 19: 1671-5. VON SCHOULTZ ET AL. J Clin Oncoloy 1995; 13: 430. Consenso Chileno de Mastología, Coquimbo 2009. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 237-240 ARTÍCULO Reconstrucción mamaria Paula Escobar O. INTRODUCCIÓN La mastectomía altera en forma drástica la anatomía en la mujer, se pierden la capacidad de lactancia y sensibilidad cutánea, y se produce una deformidad estética que afecta en forma importante la autoimagen corporal. Este impacto sicológico, con frecuencia produce ansiedad, síntomas depresivos y en ocasiones, trastornos en la función sexual y en la relación de pareja. La reconstrucción mamaria es el proceso mediante el cual, se intenta recuperar el volumen mamario extirpado, utilizando distintas técnicas según la experiencia del cirujano, las características de la paciente, y también, de los recursos disponibles. Se ha demostrado que con ésta se logra mejorar la imagen corporal y la calidad de vida. Se discuten en este artículo, las indicaciones y distintas opciones quirúrgicas. INDICACIONES La reconstrucción mamaria, si bien tiene beneficios reconocidos, no constituye una cirugía esen- cial que impacte en la sobrevida o que tenga un carácter de urgente. Diversos trabajos han analizado la satisfacción y morbilidad de los procedimientos reconstructivos, lo que ha determinado que existe un grupo de pacientes que, ya sea, por su edad o enfermedades asociadas no serían buenas candidatas a una reconstrucción mamaria. Otro factor a considerar es el estadio del cáncer y su pronóstico, con el objeto de evitar cirugías innecesarias a pacientes en etapas muy avanzadas. A pesar que existe consenso internacional en estos aspectos, cada centro define sus criterios de selección de pacientes acorde a su propia realidad. En el Hospital Dr. Luis Tisné Brousse, además de tener algunos criterios definidos previamente, discutimos cada caso en un comité quirúrgico, en donde se evalúa a la paciente y se discute con ella el momento de la reconstrucción y tipo de procedimiento. Las pacientes fumadoras, diabéticas no controladas, obesas y con patología siquiátrica se evalúan una vez corregidas estas situaciones. Médico. Especialista en Obstetricia y Ginecología, Unidad de Patología Mamaria, Servicio Obstetricia y Ginecología, Hospital Dr. Luis Tisné Brousse. Profesor Asistente Departamento Cirugía, Facultad de Medicina, Universidad de Chile. E mail: paulaescobaro@yahoo.com 237 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 237-240 Criterios de selección para reconstrucción mamaria en Hospital Dr. Luis Tisné Brousse • Enfermedad oncológica controlada • Ausencia de metástasis • Edad menor a 60 años • Pacientes sanas con morbilidad menor Contraindicaciones absolutas de reconstrucción mamaria en Hospital Dr. Luis Tisné Brousse • Enfermedad cardiopulmonar severa • Hipertensión arterial no controlada • Diabetes Mellitus insulinodependiente • Enfermedad vascular • Obesidad mórbida OPCIONES DE RECONSTRUCCIÓN La reconstrucción mamaria habitualmente involucra dos etapas, la recuperación del volumen mamario y en segunda instancia el complejo areola pezón. Esta puede realizarse utilizando implantes o mediante el uso de tejido autólogo. La elección de la opción a utilizar depende de la forma y tamaño de la mama nativa, la ubicación y tamaño del tumor, la disponibilidad de tejidos alrededor de la mama y zonas dadoras, de la edad y riesgo quirúrgico de la paciente y del tipo de terapia adyuvante. La reconstrucción mamaria se sugiere realizar en forma inmediata a la mastectomía, y de preferencia con ahorro de piel, lo que permite mantener la forma y el surco mamario que determinan una apariencia más natural. Sin embargo, esto no siempre es posible, ya que existen situaciones en que la recomendación es realizar el tratamiento oncológico y posteriormente, en forma diferida, la reconstrucción. limitaciones. Se contraindica su uso asociado a radioterapia por la alta tasa de complicaciones como la extrusión de implantes, infecciones y alta posibilidad de producirse retracción periprotésica. La reconstrucción en dos etapas implica la expansión del tejido nativo mediante un dispositivo que se insufla con suero fisiológico en forma paulatina hasta lograr el volumen esperado, habitualmente después de 8 semanas. El uso de expansores, con distintos tipos de válvula de llenado (imantadas o remotas) se ha popularizado en nuestro medio en el último tiempo, en parte por la mayor simplicidad relativa de la técnica en relación a colgajos, y también porque la ley GES contempla y costea la reconstrucción mamaria como parte del tratamiento. El expansor se sitúa en un bolsillo retropectoral y bajo el músculo serrato anterior del mismo modo que un implante, se deja in situ por algunos meses hasta lograr una caída esperada, y se cambia por una prótesis definitiva (Figuras 2a, 2b). La asociación de prótesis a tejidos autólogos se utiliza en las pacientes que han perdido volumen mamario y además tienen la piel dañada o ausente en la zona receptora. El colgajo aporta tejido para cubrir la prótesis y el implante aporta el volumen. La asociación de tejido autólogo a la reconstrucción con implantes aumenta la magnitud del procedimiento quirúrgico, la morbilidad y las complicaciones por lo que se reserva para pacientes seleccionadas. Los implantes pueden ser de suero fisiológico o de silicona, los que pueden ser lisos o texturizados y de forma anatómica o redonda. Se prefieren los de silicona por ser más suaves, permanentes en su forma en el tiempo y consistencia más natural. RECONSTRUCCIÓN MAMARIA CON TEJIDO AUTÓLOGO El volumen mamario puede ser reconstruido utilizando tejido de la propia paciente. RECONSTRUCCIÓN MAMARIA CON IMPLANTES Las opciones de reconstrucción actual con implantes, incluyen las prótesis definitivas o ajustables, la reconstrucción en dos etapas con expansión seguido de implantes y el uso de prótesis asociado a tejidos autólogos (Figura 1). El uso de prótesis exclusivas, se prefiere en las pacientes con mamas de tamaño medio a pequeñas, sin ptosis y con zona receptora con piel y músculos de buena calidad que permitan una cobertura completa del implante. Es el procedimiento quirúrgico más abreviado, por lo que se puede utilizar en pacientes mayores, o aquellas que no deseen o toleren otras cirugías, ya que el resultado estético puede tener 238 Figura 1. Expansores anatómicos con distintos tipos de válvula e implante anatómico. RECONSTRUCCIÓN MAMARIA Figura 2a. Expansor con válvula imantada en proceso de expansión. Reemplazo de expansor por prótesis definitiva. Figura 2b. Reconstrucción bilateral con prótesis. Se ha descrito una gran variedad de sitios donantes: abdomen, dorsal, glúteos, muslos y epiplón. En todos estos casos un colgajo de tejido es transferido de la zona donante a la zona receptora, a través de un colgajo pediculado (con irrigación propia) o libre (requiere anastomosis microvascular a otros vasos). El colgajo pediculado miocutáneo más conocido es el recto abdominal transverso (TRAM), que extirpa el exceso de piel y grasa de la región infraumbilical suprayacente al recto abdominal que se irriga desde la arteria epigástrica superior. Una vez disecado se transfiere a la zona mamaria a través de un túnel subcutáneo abdominal (Figuras 3a, 3b). Es una cirugía extensa, no exenta de complicaciones principalmente en la región abdominal donde se producen debilidades de la pared que se manifiestan como hernias. El resultado cosmético de este colgajo es muy auspicioso, estable en el largo plazo y recrea una mama de aspecto y consistencia natural, principalmente cuando se ha logrado conservar la piel en la mastectomía. Requiere de cirujanos experimentados y pacientes dispuestas a una recuperación posoperatoria algo más lenta, ya que el abdomen debe ser cerrado utilizando una malla. Por esta razón no se recomienda en pacientes que deseen embarazarse tras el tratamiento. El colgajo de dorsal ancho, se extrae de la espalda de la paciente y utiliza los vasos toracodorsales para sustentar el tejido cutáneo y adiposo suprayacente al músculo dorsal ancho, el que se rota a través de un túnel subcutáneo hasta la pared anterior (Figura 4). Por la disposición del músculo y vasos y por la cantidad limitada de tejido excedente en la zona, este colgajo no permite reconstruir mamas de volumen importante y con frecuencia tiene que asociarse una prótesis. Es un colgajo con pocas complicaciones que no logra cubrir adecuada- Figura 3a. TRAM pediculado. (Gentileza Dr. Peter Cordeiro). Figura 3b. TRAM derecho más reconstrucción. Complejo aréola-pezón. 239 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 237-240 mente defectos de cuadrantes internos, pero de una complejidad quirúrgica moderada lo que permite utilizarlo en un gran número de pacientes. De los colgajos libres, se utilizan el miocutáneo transverso abdominal (TRAM libre), el perforante profunda de epigástrica inferior (DIEP), el perforante superficial de epigástrica inferior (SIEP) y el de arteria perforante superior glútea (SGAP). El concepto es realizar la disección o «cosecha» de colgajo sustentando en alguna arteria perforante con el objeto de limitar la resección muscular de la zona donante y por lo tanto de minimizar sus complicaciones y defectos. Esto implica una anastomosis microvascular en la región receptora que suele demorar varias horas, requiere cirujanos altamente adiestrados, y ante una complicación puede perderse el colgajo completo. Se realiza en centros muy especializados y en pacientes muy seleccionadas. Puntos a considerar • Cualquier procedimiento reconstructivo supone más riesgos y complicaciones que la mastectomía por sí sola, lo que debe ser aclarado a las pacientes. LECTURAS – – – – – – – – – – – • La reconstrucción mamaria no debe retrasar el tratamiento oncológico y menos interferir con éste. • Hay pacientes que por características personales o de la enfermedad no son susceptibles de ser reconstruidas. • La reconstrucción mamaria es un proceso, no una cirugía de una etapa. RECOMENDADAS SCOTT L SPEAR. Surgery of The Breast Principles and Art. Lippincott-Raven 1998. MALATA CM, MC INTOSH SA. Inmediate Breast Reconstruction after mastectomy for cancer. Br J Surg 2000; 87: 1455-72. HANDEL N. Breast reconstruction Overview, in Silverstein MJ. Ductal Carcinoma in situ of the Breast, ed. Williams and Wilkins, USA, pp. 505-519, 1997. BENK RW, GROTTING C. Conceptual considerations in breast reconstruction. Clinics in Plastic Surg 1995; 22: 141-52. KHOO A, KROLL S. A comparison of resource cost of inmediate and delayed breast reconstruction. Plastic Reconstr Surg 1998; 101: 964-8. RIVAS B, CARRILLO J, ESCOBAR G. Reconstructive Management of Breast Cancer. Ann Pl Surg 2001; 47: 3: 234-9. KELLY K, HUNT MD, BONNIE J, BALDWIN, ERIC A, STROM, ET AL. Feasibility of post mastectomy radiation therapy after TRAM flap Breast Reconstruction. Am Surg Oncol 1997; Vol 4, Nº 5. CORRAL J AND MUSTOE T. Controversy in Breast Reconstruction Surgical Clinics of North America. 1996; 76: 2. SINGLETARY E. Skin sparing mastectomy with inmediate breast reconstruction: The MD Anderson Cancer Center experience. Ann Surg Oncol 1996; 3: 411-6. KROLL S, AMES F, SINGLETARY E ET AL. The oncologic risks of skin preservation at mastectomy when combined with inmediate reconstruction of the breast. Surg Gynecol Obst 1991; 172: 17-20. JENSEN A. Glandular replacement therapy for patients 240 Figura 4. Colgajo de dorsal ancho más prótesis. (Gentileza Dr. Peter Cordeiro). – – – – – – with ductal carcinoma in situ, in Silverstein MJ. Ductal Carcinoma In Situ of the Breast. Ed. Williams A; Wilkins, USA 1997; 521-33. The effects of Radiation Treatment after TRAM flap breast reconstruction. J Williams, G Carlson, J Bostwick, III et al. Emory University,Atlanta, GA. Plastic and reconstructive surgery 1997; 100(5): 1153-60. Reconstruction and the Rt breast is there a role for implants? Evans, GRD. Schustermann MA. Kroll SS, Miller MJ. Plastic and Reconstructive Surgery 1995; 96: 1111-5. Radiation Tolerance of Transverse Rectus Abdominis Myocutaneous-Free flap used in Immediate Breast Reconstruction. Robert P. Zimmerman, et al. Scott and White Hospital and Clinic Texas, A&M University College of Medicine, Temple, TX UCLA, Good Samaritan Hospital, Los Angeles, CA. Am J Clin Oncology 1998; 21: 381-5. The Acute Effects of Postoperative Radiation Therapy on the Transverse Rectus Abdominis Myocutaneous flap used in Immediate Breast Reconstruction. S. Hanks, J. Lyons, J. Crowe, et al. Cleveland Clinic Foundation, Cleveland, OH. Int J Radiation Oncology Biol Phys 2000; 47(5): 1185-90. The Effects of Radiation Treatment after TRAM Flap Breast Reconstruction J. Williams, G. Carlson, J Bostwick, III, et al. Emory University, Atlanta, GA. Plastic and Reconstructive Surgery 1997; 100 (5): 1153-60. Postoperative Adjuvant Irradiation: Effects on Transverse Rectus Abdominis Muscle Flap Breast Reconstruction, N. Tran, G. Evans, S. Kroll, et al. MD Anderson Cancer Center. University of Texas, Houston, TX. Plastic and Reconstructive Surgery 2000; 106 (2): 313-7. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 241-244 ARTÍCULO Radioterapia en cáncer de mama Patricio Olfos G. INTRODUCCIÓN La radioterapia es un tratamiento que se utiliza desde hace un siglo, y ha evolucionado con los avances científicos de la física, de la oncología y de la computación, mejorando tanto los equipos como la precisión, calidad e indicación de los tratamientos. La radioterapia, también llamada terapia con rayos X o irradiación, es el uso de un tipo de energía llamada radiación ionizante para destruir las células neoplásicas y reducir el tamaño de los tumores. La radioterapia lesiona las células en el área que recibe tratamiento al dañar su material genético y hace imposible que crezcan y se dividan. Aunque la radiación daña las células cancerosas así como las normales, muchas células normales se recuperan de los efectos de la radiación y funcionan en forma posterior adecuadamente. El objeto de la radioterapia es destruir el mayor número posible de células cancerosas y limitar el daño que sufre el tejido sano (NCI-USA). En cáncer de mama, la radioterapia se puede administrar en varias formas diferentes, aunque la irradiación externa es la que habitualmente se usa como tratamiento, pudiéndose aplicar: • Después de una mastectomía • En combinación con quimioterapia • En forma previa a la cirugía para disminuir el volumen tumoral y convertir una paciente “inoperable” en “operable”. • En forma paliativa, para disminuir el tamaño del tumor y/o aplacar el dolor. Un radioterapeuta o radio-oncólogo, planificará el tratamiento radioactivo apoyado por todos los antecedentes médicos, examen físico e informe de la biopsia, no existiendo límite o diferencias por edad. El área a tratar puede comprender sólo la mama enferma o incluir algunas o todas las zonas de drenaje que normalmente siguen las células tumorales (axilar, supraclavicular, mamaria interna). El tratamiento suele durar entre 5 a 7 semanas, todos los días de lunes a viernes, dura unos pocos minutos, no es doloroso y la paciente no queda radioactiva, por lo que puede mantenerse al lado o dormir con cualquier persona. No se cae el pelo, se puede bañar, y normalmente no hay restricciones en la alimentación o medicación. La dosis y campos a irradiar se planifican en forma minuciosa para cada paciente. El o los campos a tratar se marcarán con una tinta que permanecerá en la piel durante todo el tratamiento, además de algunos puntos de tatuaje, para asegurar que la radiación se aplique en el área exacta que se planificó. El radioterapeuta vigilará diligentemente, la intensidad, duración y el área que se está tratando y el paciente tendrá exámenes físicos regulares durante el curso de su tratamiento. Médico, Radioterapeuta, Instituto de Radio Medicina (IRAM). E mail: olfos@iram.cl 241 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 241-244 Objetivos de la radioterapia • Prevenir que el tumor recurra localmente • Mejorar la sobrevida global • Hacer posible, en la mayoría de los casos, conservar la mama con óptimo resultado estético. La radioterapia adyuvante posmastectomía efectuada con técnicas adecuadas mejora el control local, reduciendo en 2/3 las recidivas locales en todas las pacientes, y mejora la supervivencia global y causa específica en todas las pacientes con axila positiva, sin relación con el número de linfonodos positivos. La cirugía conservadora seguida de radioterapia es equivalente a la mastectomía sola, aun en grupos de menor edad. El metaanálisis de ensayos de distribución aleatoria publicado en 2005, en que se analizan 42.000 pacientes tratados con técnicas relativamente modernas de radioterapia y un seguimiento maduro muestran que el uso de radioterapia adyuvante, ya sea posmastectomía o poscirugía conservadora se asocia no sólo a mejor control local sino que también a mejor sobrevida global y causa específica, evitando una muerte por cáncer por cada cuatro recidivas prevenidas. Este efecto es igual en todas las pacientes, independiente de la edad, características tumorales, terapias sistémicas y época del estudio. En estadios precoces de la enfermedad, un estudio mostró que el 95% de las mujeres, preferían la mastectomía parcial o tumorectomía o lumpectomía seguido de radioterapia a la extirpación completa de la glándula. La conservación de la mama, con buen resultado estético no sólo mejora la tolerancia psicológica de la paciente, sino, la aceptación de la enfermedad, capacidad de relación social y femineidad, mejorando su autoestima. LECTURAS – – RECOMENDADAS ANTONUCCI JV, M WALLACE ET AL. Differences in patterns of failure in patients treated with accelerated partial breast irradiation versus whole-breast irradiation: a matched-pair analysis with 10-year follow-up. Int J Radiat Oncol Biol Phys 2009; 74(2): 447-52. BAGLAN KL, MB SHARPE ET AL. Accelerated partial breast irradiation using 3D conformal radiation therapy (3D-CRT). Int J Radiat Oncol Biol Phys 2003; 55 (2): 302-11. 242 Indicaciones de Radioterapia, Recomendaciones Consenso Nacional de Mama 2009 • Se recomienda efectuar radioterapia después de mastectomía cuando la axila es positiva, independiente del número de linfonodos comprometidos. • Se recomienda efectuar radioterapia posoperatoria en todas las pacientes sometidas a mastectomía parcial. EFECTOS SECUNDARIOS O COMPLICACIONES Pueden ocurrir efectos secundarios tempranos o durante la irradiación e incluyen: • Cambios en la coloración de la piel en el área tratada como: enrojecimiento, aumento de la pigmentación, descamación seca o húmeda. • Molestias al tragar. • Cansancio general o fatiga hacia el final del tratamiento. En la mayoría de los casos, estos efectos son temporales y la piel bajo cuidados simples, volverá a tomar una coloración normal. Los efectos secundarios tardíos, son aquellos que suceden después de dos meses de haber finalizado el tratamiento con irradiación, son muy poco frecuentes y de más difícil resolución, e incluyen: • Fibrosis o endurecimiento de la piel en algunas zonas. • Aparición de circulación colateral llamadas telangectasias. • Hinchazón del brazo. • Disminución del tamaño de la glándula mamaria. • Edema de la mama. En general, la incidencia de estos efectos, están relacionados al grado de la enfermedad que obliga al oncólogo a usar distintas combinaciones de áreas a tratar o combinaciones de distintos tratamientos quirúrgicos y de quimioterapia. – – – BARTELINK HJ, C HORIOT ET AL. Impact of a higher radiation dose on local control and survival in breast-conserving therapy of early breast cancer: 10year results of the randomized boost versus no boost EORTC 22881-10882 trial. J Clin Oncol 2007; 25 (22): 3259-65. BARTELINK H AND R ARRIAGADA. Hypofractionation in radiotherapy for breast cancer. 2008. BELLON JR, SE COME ET AL. Sequencing of chemotherapy and radiation therapy in early-stage breast cancer: updated results of a prospective randomized trial. J Clin Oncol 2005; 23. RADIOTERAPIA – – – – – – – – – – – – – CHEN RC, NU LIN ET AL. Internal mammary nodes in breast cancer: diagnosis and implications for patient management — a systematic review. J Clin Oncol 2008; 26 (30): 4981-9. CLARKE M, R. COLLINS ET AL. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomized trials. Lancet 2005; 366 (9503): 2087-106. COULOMBE G, S TYLDESLEY ET AL. Is mastectomy superior to breast-conserving treatment for young women? Int J Radiation Oncology Biol Phys 2007; 67 (5): 1282-90. E. B. C. T. C. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and on 15-year survival: an overview of the randomised trials. EBCTCG secretariat, University of Oxford. 2005. FLOYD S, T BUCHHOLZ ET AL. Low local recurrence rate without postmastectomy radiation in node-negative breast cancer patients with tumors 5 cm and larger. Int J Radiation Oncology Biol Phys 2006; 66 (2): 358-64. FREEDMAN G, B FOWBLE ET AL. Patients with early stage invasive cancer with close or positive margins treated with conservative surgery and radiation have an increased risk of breast recurrence that is delayed by adjuvant systemic therapy. Int J Radiat Oncol Biol Phys 1999; 44 (5): 1005-15. GARG A, J OH ET AL. Effect of postmastectomy radiotherapy in patients <35 years old with stage IIIII breast cancer treated with doxorubicin-based neoadjuvant chemotherapy and mastectomy. Int J Radiation Oncology Biol Phys 2007. GOLD HT, HT DO, ET AL. Correlates and effect of suboptimal radiotherapy in women with ductal carcinoma in situ or early invasive breast cancer. Cancer 2008; 113 (11): 3108-15. HARRIS JR, P HALPIN-MURPHY ET AL. Consensus Statement on postmastectomy radiation therapy. Int J Radiat Oncol Biol Phys 1999; 44 (5): 989-90. HARRIS EE, C CORREA ET AL. Late cardiac mortality and morbidity in early-stage breast cancer patients after breast-conservation treatment. J Clin Oncol 2006; 24 (25): 4100-6. KARLSSON P, BF COLE ET AL. The role of the number of uninvolved lymph nodes in predicting locoregional recurrence in breast cancer. J Clin Oncol 2007; 25 (15): 2019-26. MARKS LB, J ZENG ET AL. One to three versus four or more positive nodes and postmastectomy radiotherapy: time to end the debate. J Clin Oncol 2008; 26 (13): 2075-7. MCCAMMON R, C FINLAYSON ET AL. Impact of postmastectomy radiotherapy in T3N0 invasive carcinoma – – – – – – – – – – – – EN CÁNCER DE MAMA of the breast: a Surveillance, Epidemiology, and End Results database analysis. Cancer 2008; 113 (4): 683-9. OFFERSEN BV, M OVERGAARD ET AL. Accelerated partial breast irradiation as part of breast conserving therapy of early breast carcinoma: a systematic review. Radiother Oncol 2009; 90 (1): 1-13. OVERGAARD M, H NIELSEN ET AL. Is the benefit of postmastectomy irradiation limited to patients with four or more positive nodes, as recommended in international consensus reports? A subgroup analysis of the DBCG 82 b&c randomized trials. Radiotherapy and Oncology 2007; 82: 247-53. OWEN JR, A ASHTON ET AL. Effect of radiotherapy fraction size on tumour control in patients with early-stage breast cancer after local tumour excision: long-term results of a randomised trial. Lancet Oncol 2006; 7 (6): 467-71. PATT DA, JS GOODWIN ET AL. Cardiac morbidity of adjuvant radiotherapy for breast cancer. J Clin Oncol 2005; 23 (30): 7475-82. RECHT A, SE COME ET AL. The sequencing of chemotherapy and radiation therapy after conservative surgery for early-stage breast cancer. N Engl J Med 1996; 334 (21): 1356-61. RECHT A, SB EDGE ET AL. Postmastectomy radiotherapy: clinical practice guidelines of the American Society of Clinical Oncology. J Clin Oncol 2001; 19 (5): 1539-69. ROWELL N. Radiotherapy to the chest wall following mastectomy for node-negative breast cancer: A systematic review. Radiotherapy and Oncology. 2008. SMITH B, B HAFFTY ET AL. Use of postmastectomy radiotherapy in older women. Int J Radiation Oncology Biol Phys 2008; 71 (1): 98-106. SMITH BD, DW ARTHUR ET AL. Accelerated partial breast irradiation consensus statement from the American Society for Radiation Oncology (ASTRO). Int J 2009. START. The UK Standardization of Breast Radiotherapy (START) Trial B of radiotherapy hypofractionation for treatment of early breast cancer: a randomized trial. Lancet Oncol 2008; 371. START. Hypofractionation in radiotherapy for breast cancer. Lancet Oncol 2008; 9: 331-241. TAGHIAN AG, JH JEONG ET AL. Low locoregional recurrence rate among node-negative breast cancer patients with tumors 5 cm or larger treated by mastectomy, with or without adjuvant systemic therapy and without radiotherapy: results from five national surgical adjuvant breast and bowel project randomized clinical trials. J Clin Oncol 2006; 24 (24): 3927-32. 243 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 241-244 – – – – – TRUONG PT, V BERNSTEIN ET AL. Radiotherapy omission after breast-conserving surgery is associated with reduced breast cancer-specific survival in elderly women with breast cancer. Am J Surg 2006; 191 (6): 749-55. TRUONG P, W WOODWARD ET AL. The ratio of positive to excised nodes identifies high-risk Subsets and reduces inter-institutional differences in Locoregional recurrence risk estimates in breast cancer Patients with 1-3 positive nodes: an analysis of prospective Data from british columbia and the m. D. Anderson Cancer center. Int J Radiation Oncology Biol Phys 2007; 68 (1): 59-65. TSOUTSOU PG, MI KOUKOURAKIS ET AL. Optimal timing for adjuvant radiation therapy in breast cancer: a comprehensive review and perspectives. Crit Rev Oncol Hematol 2009; 71 (2): 102-16. VERONESI U, P ARNONE ET AL. The value of radiotherapy on metastatic internal mammary nodes in breast cancer. Results on a large series. Ann Oncol 2008; 19 (9): 1553-60. VICINI FA, KL BAGLAN ET AL. Accelerated treatment of breast cancer. J Clin Oncol 2001; 19 (7): 1993-2001. 244 – – – – – – VICINI FA, M SHARPE ET AL. Optimizing breast cancer treatment efficacy with intensity-modulated radiotherapy. Int J Radiat Oncol Biol Phys 2002; 54 (5): 1336-44. VOORDECKERS M, V VINH-HUNG ET AL. The lymph node ratio as prognostic factor in node-positive breast cancer. Radiother Oncol 2004; 70 (3): 225-30. WHELAN T, R MACKENZIE ET AL. Randomized trial of breast irradiation schedules after lumpectomy for women with lymph node-negative breast cancer. J Natl Cancer Inst 2002; 94 (15): 1143-50. WHELAN T, J PIGNOL ET AL. Long-term Results of a Randomized Trial of Accelerated Hypofractionated Whole Breast Irradiation Following Breast Conserving Surgery in Women with Node-Negative Breast Cancer. Int J Radiation Oncology 2008; 72 (1). WILDIERS H, I KUNKLER ET AL. Management of breast cancer in elderly individuals: recommendations of the International Society of Geriatric Oncology. Lancet Oncol 2007; 8 (12): 1101-15. YARNOLD J, A ASHTON ET AL. Fractionation sensitivity and dose response of late adverse effects in the breast after radiotherapy for early breast cancer: long-term results of a randomized trial. Radiother Oncol 2005; 75 (1): 9-17. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 245-246 ARTÍCULO Manejo sistémico del cáncer de mama Claudio Salas F, Marta Palma L. El cáncer de mama es la neoplasia maligna más frecuente en las mujeres occidentales, ya que en algún momento de la vida afectará a una de cada 10 mujeres. En Chile es la segunda causa de muerte entre las mujeres, con una tasa de mortalidad de 13,2/100.000 habitantes y se calcula una incidencia de 31,7/100.000 en mujeres mayores de 15 años, según datos publicados. Los objetivos del tratamiento en etapas tempranas son la curación (adyuvancia) mientras que en etapas avanzadas son el alivio sintomático y prolongación de la sobrevida (paliación). A pesar de los avances logrados en las últimas décadas, actualmente el cáncer de mama es incurable en etapa metastásica. Sin embargo, gracias al desarrollo tanto de tratamiento sistémico como local, se ha observado una significativa prolongación de la sobrevida, que alcanza los 24 meses aproximadamente, como también una significativa mejoría en la calidad de vida, ya que se controlan los síntomas como fatiga, anorexia, disnea, dolor. En nuestro país la gran mayoría de las pacientes presentan cáncer de mama en etapa temprana, por ejemplo, los datos nacionales consolidados reportados por 23 servicios de salud del país el año 2001 mostraron que el cáncer in situ se presentó en 4%, estados I y II en 63%, estado III en 27% y estado IV en 6%. Las mujeres con cáncer temprano pueden recurrir en un porcentaje variable de 30% a 80% en un periodo de 10 años, dependiendo de la extensión de la enfermedad al momento del diagnóstico, pero también del perfil molecular de ésta. En la medida que la ciencia progresa aumenta el conocimiento del comportamiento tumoral de esta enfermedad, reconociéndose una forma más agresiva de cáncer de mama, el HER 2+. Esto significa que el 20% de las portadoras de cáncer de mama en Chile, presenta un peor pronóstico, con una alta tasa de recurrencia en los primeros años y menor sobrevida. El cáncer de mama HER 2+ es aquel que expresa en la célula tumoral una proteína de membrana que activa una vía de transducción que induce la proliferación, inhibe la apoptosis (muerte celular programada) y facilita el desarrollo de metástasis. Son estas características las que les confieren un peor pronóstico a las mujeres que lo padecen. Otro perfil molecular que ofrece un peor pronóstico es el llamado triple negativo, es decir que no expresa los receptores de estrógeno, progesterona ni HER 2. También presenta una alta tasa proliferativa, pero además ofrece una restricción en los recursos terapéuticos disponibles, ya que no es susceptible de manipulación hormonal ni con terapias específicas contra el HER 2 y las herramientas disponibles son la cirugía, radioterapia y quimioterapia solamente. Oncólogos Médicos, Sección de Oncología, Hospital del Salvador E mail: salas72gmail.com 245 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 245-246 Las pacientes con mejor comportamiento son aquellas que se presentan con tumores pequeños, bien diferenciados, sin compromiso axilar y con expresión intensa de los receptores hormonales y HER 2 negativos. El control del cáncer de mama en etapas tempranas y avanzadas se logra mediante la cirugía, la radioterapia y el tratamiento sistémico. En este último se incluyen la quimioterapia, la hormonoterapia y las terapias biológicas. Se entiende por quimioterapia al empleo de drogas citotóxicas administradas en su mayoría por vía endovenosa, pero algunas también pueden ser por vía oral. En general, ellas actúan inhibiendo por distintos mecanismos la replicación celular o la síntesis de proteínas. Las toxicidades más frecuentes incluyen la mielosupresión, náuseas y vómitos, neurotoxicidad, neuropatía y alopecia. En los últimos 20 años se han desarrollado medicamentos de soporte que permiten mejorar la tolerancia a la quimioterapia, como por ejemplo antieméticos potentes (vómitos), y factores estimulantes de colonia (mielosupresión); de este modo se mejora la calidad de vida de los pacientes. El cáncer de mama es hormonosensible cuando expresa los receptores de estrógeno y/o progesterona, lo que permite su manipulación. Existen diversas clases de hormonoterapia. El más conocido es el Tamoxifeno que se considera como modulador del receptor ya que en algunos tejidos actúa como agonista (hueso) y en otros como antagonista (cáncer de mama), útil en adyuvancia y etapa metastásica. Otro grupo de fármacos son los llamados inhibidores de aromatasa, los que actúan a nivel de la enzima aromatasa que convierte los andrógenos 246 de síntesis suprarrenal en estrógeno, siendo esta conversión periférica la principal fuente de estradiol en la mujer posmenopáusica. Por ello está indicado en esta etapa de la vida, tanto a título adyuvante como paliativo. Finalmente, los antiestrógenos puros son una nueva clase de hormonoterapia útil en etapa metastásica. Entre las terapias biológicas podemos nombrar a trastuzumab y lapatinib, ambos agentes target contra el receptor HER -2. Trastuzumab es anticuerpo monoclonal contra el dominio extracelular de la proteína HER 2 que mediante activación del sistema inmunológico induce la muerte de la célula tumoral, como también induce apoptosis, y que por otros mecanismos logra controlar mejor esta enfermedad, tanto en etapas tempranas (adyuvancia) como metastásica (paliativo). Lapatinib también actúa en la proteína HER 2 pero su mecanismo de acción es diferente ya que éste es una molécula pequeña que inhibe el dominio intracitoplasmático tirosina quinasa, inhibiendo la dimerización y posterior activación de este receptor. Los estudios publicados muestran su actividad en etapa metastásica, mientras que están en marcha los estudios de adyuvancia y neoadyuvancia. En resumen el conocimiento de la biología del cáncer ha permitido mejorar el cuidado de las mujeres portadoras de esta enfermedad, con nuevas herramientas terapéuticas pero también adaptando el tratamiento al perfil molecular y riesgo de la paciente. Esperamos que en los próximos años presenciemos el advenimiento de la medicina personalizada que consiste en adaptar las decisiones terapéuticas según un complejo análisis de la biología tumoral de la enfermedad. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 247-250 ARTÍCULO Tamoxifeno y patología ginecológica Karen Junemann U. Los moduladores selectivos de los receptores de estrógenos (SERMS) son inhibidores competitivos de los estrógenos, presentando una actividad biológica que va desde antagonista completo a agonista parcial. La acción en el receptor de estrógenos se puede resumir como unión del SERM al receptor, lo que provoca un cambio en la estructura terciaria de éste que es imperfecto, pero que igual logra una formación de un complejo que mantiene la actividad transcripcional del receptor. El Tamoxifeno (TMX) se considera como el tratamiento adyuvante estándar en cáncer de mama debido a que éste disminuye la incidencia de cáncer en la mama ipsilateral (recurrencia) en 47% y contralateral en aproximadamente 50%. Además disminuye el riesgo de muerte en 10% a 25% en las pacientes con o sin axila positiva. También se considera como agente quimiopreventivo en mujeres con predisposición genética o con biopsias previas que confirmen hiperplasia ductal o lobulillar atípica, disminuyendo la incidencia de cáncer invasor en 50%. Debido a que el cambio en la estructura terciaria es imperfecto los efectos del tamoxifeno varían según el órgano diana y la edad fisiológica de las pacientes. Es decir, en una paciente premenopáusica a nivel del hipotálamo tiene una acción antagonista de estrógenos, por lo que actuaría como inductor de la ovulación. En una paciente posmenopáusica, en cambio, a nivel del hipotálamo actuaría como agonista de estrógeno, por lo que disminuiría los síntomas vasomotores. A grandes rasgos los efectos serían agonistas en endometrio, hueso e hígado y antagonista de la mama. Debido al uso masivo de este medicamento en el tratamiento de nuestras pacientes y al alto impacto que puede provocar en el ámbito ginecológico, se hace necesario conocer los alcances y manejarlos adecuadamente. En la Figura 1 se grafican algunos de los efectos del tamoxifeno, sin duda los más temidos son los vasculares (tromboembolismo pulmonar y trombosis venosas profundas) y la neoplasia endometrial. El TMX aumenta la incidencia de patología ginecológica benigna y maligna. Con respecto a la patología benigna, el 20% desarrollará irritación vulvovaginal, sequedad vaginal y bochornos, como así también dispareunia y disminución importante de la líbido. En las pacientes premenopáusica 25% presentará amenorrea. Se observan, además, frecuentemente quistes simples ováricos, desórdenes menstruales, metrorragia, y en las usuarias de larga data, un hipoestrogenismo genital marcado que es Médico, Especialista en Obstetricia y Ginecología, Unidad de Patología Mamaria, Servicio Obstetricia y Ginecología, Hospital Dr. Luis Tisné Brousse. E mail: kjunemann@yahoo.com 247 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 247-250 Figura 1. informado en el Papanicolaou. El tamoxifeno no produce ni anticipa la menopausia. Uno de los efectos más llamativos e importantes es a nivel endometrial. Se pueden encontrar diferentes lesiones, benignas como pólipos e hiperplasia endometrial y más raramente, malignas tales como pólipos malignos y cáncer de endometrio. Estudios en que se ha evaluado el endometrio con histeroscopía e histología previo al inicio del uso de TMX y durante el tratamiento con el mismo, revelan aparición de novo de pólipos en hasta 27% de los casos. Otro hallazgo muy común, es la hiperplasia endometrial, existe una mayor tasa de hiperplasia simple y compleja (con o sin atipias) en pacientes con TMX comparado con aquellas que no lo usan. Esta hiperplasia se ve mayormente en las pacientes con TMX que sangran versus las que no sangran (p 0,0001), y en general es asociado al tiempo de uso del tamoxifeno. PÓLIPOS • Es la patología más frecuentemente asociada al uso del TMX (8%-36%). Los pólipos en estas pacientes son con mayor frecuencia múltiples y más grandes que los que se ven 248 habitualmente en pacientes no usuarias de tamoxifeno. Se asocian con sangrado endometrial fuera de ciclo o sangrado intermitente en pacientes posmenopáusicas, aunque pueden presentarse en pacientes asintomáticas. Se ha reportado transformación maligna en 3% a 11% de los pólipos biopsiados en pacientes con TMX, el 50% de ellos produce sangrado. No habría correlación entre el tamaño del pólipo y la duración del tratamiento, por lo tanto, frente a la sospecha, es necesario realizar una histeroscopía, como ideal para visualizar la lesión y extirparla en forma completa. La biopsia aspirativa por Pipelle puede no ser representativa y salir negativa. CÁNCER DE ENDOMETRIO • Existen múltiples estudios que lo asocian al uso de TMX. En 1985 Killackey reportó por primera vez, la asociación entre uso de TMX y cáncer de endometrio. La asociación descrita oscila entre 0,6% y 15,2%. Actualmente hay consenso en que el TMX aumentaría 2-3 veces el riesgo de desarrollar cáncer en las pacientes posmenopáusicas. Lo más llamativo en estas pacientes es que todas ellas son sintomáticas, es decir, presentan sangrado. TAMOXIFENO Se han descrito diversos factores relacionados: a. Duración del TMX: A mayor tiempo de uso, mayor riesgo. Jordan y Assikis vieron el doble de casos en pacientes que fueron tratadas por 2 años con TMX. En trabajos a 5 años se vio aumento del riesgo durante todo el tiempo de uso. Las diferencias entre 2 y 5 años fue significativa (p <0,01) con una mediana de 40 meses. b. Dosis acumulativa: Existe asociación entre mayor dosis y mayor riesgo, se ha descrito que 35 g sería la dosis crítica, por lo que se ha establecido una dosis terapéutica para el cáncer pero más segura para el endometrio que ha sido establecida en 20 g. c. Malignidad: Los cánceres en pacientes usuarias de TMX serían más avanzados y de peor pronóstico presentando tasas de mortalidad 33,3% vs 2,6% y una tasa de sobrevida a 5 años de 40% vs 64%. Además, las formas histológicas serían más malignas, encontrándose los tipos histológicos serosos papilares, tumores mullerianos mixtos y/o de células claras en un mayor porcentaje (21,4% vs 1,5% de los casos). EVALUACIÓN GINECOLÓGICA En el 2004, Brockbank en Londres, realizó un estudio sobre manejo ginecológico de pacientes con TMX y encontró que 94,7% de los ginecólogos y 87% de los oncólogos, no tienen un protocolo de manejo. Ninguno investiga presencia o ausencia de patología previa al uso de TMX y el 76,9% deriva a la paciente cuando es sintomática. Los métodos de evaluación de las pacientes sintomáticas difieren, siendo los métodos más usados la ecografía y la biopsia endometrial. Ecografía El TMX causa gran distorsión de la unión endometrial-miometrial. El endometrio se torna atrófico con proliferación estromal periglandular y dilatación quística, lo cual genera la visión ultrasonográfica de un endometrio engrosado. No existe consenso en cuanto al grosor endometrial normal o anormal en estas pacientes asintomáticas, sin embargo, se ve más patología a mayor grosor endometrial. Love en 1999, realizó histeroscopías en pacientes con endometrios mayores a 5 mm, en un grupo de 357 pacientes con TMX vs 130 Y PATOLOGÍA GINECOLÓGICA pacientes sin TMX, resultando en 46% de casos falsos positivos. Lahti en 1993, realizó lo mismo y concluyó que con grosores mayores a 5 mm, 51,2% de los casos no tiene patología. El mejor límite sería 15 mm, dado que presenta una sensibilidad de 37,9%, una especificidad de 87,2%, un valor predictivo positivo de 87,2% y un valor predictivo negativo de 70,2%. De esta manera hay que tener en claro que estos resultados implican que el 62,2% de las patologías endometriales quedarían subdiagnosticadas y que se realizarían 78,5% de biopsias de más. Se asume que la incidencia anual de cáncer de endometrio en mujeres con TMX es de 2 x 1.000 usuarias, y el 15% de estos cánceres mueren. Un examen de screening sería aquél que logre disminuir esta mortalidad de 0,002 x 0,15 = 0,0003 de todas las pacientes tratadas con TMX. Por lo tanto, aun con sensibilidades y especificidades apropiadas para el screening en mujeres asintomáticas, éste no se justificaría en términos de reducción de la mortalidad ni tampoco desde el punto de vista económico. Es así como el Royal Collage of Obstetricians and Gyneacologists publicó recomendaciones en base a evidencia tipo C. En aquellas mujeres con sangrado anormal, se sugirió realizar una biopsia tipo Pipelle. Si ésta es negativa, se debe realizar una histeroscopía. Esto se presenta en la Figura 2. En el año 2000, la Unidad de Patología Mamaria (en esa época operaba en Hospital del Salvador) revisó y analizó la experiencia en pacientes usuarias Pre TTO Historia Clínica PAP Ex. Pélvico Ex pélvico anual PAP anual Educación Sintomática + Pipelle - HTC Figura 2. Algoritmo de manejo según Royal Collage of Obstetricians and Gyneacologists. 249 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 247-250 de tamoxifeno y patología endometrial. Ésta, se resume a continuación. Se analizaron las fichas de las 123 pacientes con cáncer de mama notificados en el año 2000. De 50 registros completos, 35 pacientes usaban TMX. De las 35 pacientes, 11,43% tuvo sangramiento (4/35). Estas últimas, fueron todas evaluadas con Pipelle y/ o HTC. • Ninguna histología reveló cáncer y/o lesiones precursoras. • La edad promedio de sangramiento fue de 53,5 años (44-61). • El tiempo promedio de uso de TMX fue de 31,5 meses (6-48). LECTURAS Sin embargo, con mejores registros y seguimientos más prolongados, la situación actual es diferente. Existen 5 casos de cáncer de endometrio tras cáncer de mamas, en control en Unidad de Oncología desde su creación en el año 2002. En 2 pacientes, el diagnóstico de cáncer de endometrio se realizó durante el primer año de uso de TMX (2 y 10 meses, respectivamente). En suma, en la Unidad de Patología Mamaria del Servicio de Obstetricia y Ginecología del Hospital Dr. Luis Tisné Brousse, no se indica ecografía transvaginal de rutina a pacientes usuarias de tamoxifeno que estén asintomáticas. En aquellas, que evolucionan con sangrado genital, el manejo incluye siempre el estudio histológico endometrial. RECOMENDADAS – – – PRITCHARD K. Adjuvant hormonal therapy for early stage breast cancer. Uptodate 2005. BROCKBANK EC, G HAEM-M AGHAMI S, B RIDGES JE. Gynaecological management of women on Tamoxifen: a national questionnaire survey. J Obstet 250 – Gynaecol 2004; 24: 675-9. COHEN I. Endometral pathologies associated with postmenopausal tamoxifen treatment. Gynecol COL 2004; 94: 256-66. ESCOBAR P. Utero y Tamoxifeno. Rev Chil Obstet y Ginecol 2000; 5: 412-6. REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 251-253 ARTÍCULO Normativa de derivación a Unidad de Patología Mamaria Hospital Dr. Luis Tisné Brousse Miguel Celis M. Con el advenimiento de las Garantías Explícitas en Salud (GES) para cáncer de mama a partir de julio de 2005, se redefinieron las prioridades en la derivación mastológica, lo que obligó a adecuar la gestión en salud para lograr cumplir con el objetivo de dar garantía de acceso a especialistas a la paciente con sospecha de cáncer de mama. Esto se tradujo en la necesidad de hacer eficiente el uso de los recursos físicos y humanos de la Unidad de Patología Mamaria (UPM) del Servicio de Obstetricia y Ginecología del Hospital Dr. Luis Tisné Brousse, Servicio de Salud Metropolitano Oriente (SSMO), lo cual obligó a establecer y aplicar normas claras en cuanto a la derivación por patología benigna y al buen cumplimiento en la derivación por sospecha de patología maligna (derivación AUGE), para evitar la saturación inapropiada del sistema. Desde el nacimiento de la Unidad en agosto de 2002 a la fecha, el número de pacientes por cáncer ha ido incrementándose, siendo inicialmente alrededor de 110 pacientes anuales y al año 2007 con 192 casos nuevos, representando una incidencia estimada de 37,6 por 100.000 habitantes. Esto, con porcentajes de cumplimiento auge promedio cercanos a 98%, en forma importante, debido a la aplicación estricta de derivación hacia nuestra UPM en el nivel secundario y terciario. Hay que destacar que durante el año 2008 hubo 1.139 derivaciones a nuestra UPM, siendo el 48,6% por derivación AUGE lo que conlleva ocupar gran parte de nuestros recursos en el manejo de estas pacientes en los plazos establecidos, con rendimiento de alrededor 1.100 atenciones mensuales globales en la UPM. El cáncer de mama constituye una patología de alta prevalencia tanto a nivel mundial como en nuestro país. En la actualidad se estima se presentará en 1 de cada 10 mujeres. En nuestro país la mortalidad por cáncer de mama ha presentado un progresivo aumento en los últimos 20 años, constituyendo actualmente, la segunda causa de muerte por cáncer entre las mujeres con una tasa de 13,5 por 100.000 mujeres (MINSAL 2006). El 50% de las pacientes que fallecen están en el grupo de edad productiva (35 a 65 años) lo cual conlleva para el país una pérdida económica agregada. En Chile a partir de 1995 se crea el Programa Nacional de Cáncer de Mama, cuyo objetivo era Médico, Especialista en Obstetricia y Ginecología, Especialista en Ginecología Oncológica, Jefe Unidad Patología Mamaria, Servicio de Obstetricia y Ginecología, Hospital Dr. Luis Tisné Brousse. E mail: mcelis@med.uchile.cl 251 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 251-253 disminuir la mortalidad por esta patología a través de la pesquisa de cánceres en etapas I y II, realizando tratamientos adecuados y oportunos. Es un programa de prevención, pesquisa, diagnóstico, tratamiento y seguimiento del cáncer de mama. Sus actividades de pesquisa están insertas dentro de las actividades del Programa de Salud de la Mujer y del Examen de Salud del Adulto (ESPA). El programa nacional consiste en: • Examen físico de mama (EFM) protocolizado, realizado por matrona capacitada y la enseñanza del Autoexamen de Mama (AEM). • Es un examen gratuito realizado en los Consultorios del Nivel Primario de Atención de Salud (APS). • Esta intervención está focalizada en población femenina asintomática entre 35 a 64 años con una periodicidad de 3 años y si existen antecedentes de cáncer de mama familiar (madre, hermana, tías maternas), se realiza anualmente. • El examen físico de mama también se realiza en mujeres menores de 35 años y mayores de 65 años, que consultan por sintomatología de patología mamaria. • En todo caso sospechoso de probable patología maligna (PPM) se le debe solicitar mamografía bilateral en el nivel de atención primaria de salud (2001, mamografía en programa de resolución de especialidades en APS). En cuanto a las normas de derivación a la Unidad de Patología Mamaria del Nivel Secundario de Atención, en relación a patología benigna deben “definirse claramente en cada Servicio de Salud”, manteniendo las orientaciones y recomendaciones del Programa Nacional de acuerdo al Ordinario N° B 232/ 2479 del 12 julio de 2005 de la Subsecretaría de Salud Pública, y en cuanto a patología maligna cumpliendo el decreto N° 170 que aprueba garantías explícitas de la Ley AUGE N° 19.966, publicada en el Diario Oficial el 28 de enero de 2005. En el SSMO se han redefinido en relación a las necesidades ya expuestas desde el 2005, y establecidas en el Ord. 786 del 17 de abril 2006 para patología benigna, como siguen: • Mujeres con Probable Patología Benigna de la Mama (PBM). – Condición fibroquística con quistes simples mayores de 3 cm o sólido-quísticos. – Ectasia ductal complicada: absceso subareolar o fístulas mamarias. – Mastitis no puerperal o puerperal que no responden a tratamientos de primera línea. 252 – Tumores de aspecto benigno clínicos y/o imagenológicos. – Lesiones compatibles con papilomas intraquísticos por ecografía. – Ginecomastias, mamas supernumerarias u otras alteraciones congénitas y alteraciones tróficas de la mama que lo ameriten (dependiendo de la edad y alteración de calidad de vida). – Lesiones mamarias biopsiadas de alto riesgo: hiperplasias ductales o lobulillares con atipía, o CLIS. • Mujeres con Probable Patología Maligna de la Mama (PPM) derivación AUGE mamas. – Lesiones clínicas sospechosas evidentes (tumor irregular indurado, nódulo axilar sospechoso; alteraciones del pezón (derrame hemático, sospecha enfermedad de Paget), alteraciones de la piel de la mama (retracción, ulceración, sospecha cáncer inflamatorio). – Alteraciones mamográficas y/o ecotomográficas sospechosas de malignidad (BIRADS 4, 5 ó 6). – Se debe propender a que las personas que sean derivadas a la UPM sean aquellas con un informe de mamografía sospechoso de cáncer. En aquellos casos en que no se pueda disponer en forma oportuna de mamografía en el Nivel Primario de atención y que clínicamente corresponda a “Probable Patología Maligna”, según definición del Programa Nacional de Cáncer de Mama, la persona puede derivarse sin mamografía, la cual deberá ser solicitada en la UPM o Nivel de Especialidad (Decreto Supremo N° 44, de 31 de Enero de 2007 que modifica normas técnicas de la ley N° 19.966 de Garantías de Salud) (Figura 1). La Ley AUGE para cáncer de mama establece el acceso y oportunidad de atención de la paciente mayor de 15 años dentro de plazos establecidos en la siguiente distribución: Derivación a Unidad de Patología Mamaria – Dentro de 30 días desde la consulta a nivel primario la paciente accederá a evaluación con el especialista en mastología. Toda persona que, luego de una mamografía o ecografía mamaria, se sospeche tiene cáncer de mama tendrá garantizada la atención por un médico especialista dentro de 30 días desde la solicitud de interconsulta. En caso de manifestación clínica evidente de cáncer de mama, no será exigible la mamografía para la interconsulta a especialista. NORMATIVA DE DERIVACIÓN A UNIDAD DE PATOLOGÍA MAMARIA HOSPITAL DR. LUIS TISNÉ BROUSSÉ Figura 1. Flujograma de actividades Programa Cáncer de Mama. Confirmación diagnóstica y etapificación – Dentro de 45 días desde la consulta con el especialista la persona accederá a los exámenes para confirmar diagnóstico (biopsia) y para completar el estudio de avance de la enfermedad (etapificación) cuando corresponda (localmente avanzado o sospecha de metástasis). Tratamiento – Se garantiza que dentro de 30 días desde confirmado y etapificado el cáncer de mama, la persona iniciará el tratamiento indicado por el Comité Oncológico. El tratamiento puede considerar cirugía, radioterapia, quimioterapia, hormonoterapia. LECTURAS – – Seguimiento – Se garantiza que dentro de 90 días desde terminado el tratamiento la persona será evaluada por un médico especialista en le solicitará los exámenes para seguimiento del problema de salud. La eficiencia en los rendimientos en el SSMO y el cumplimiento de los plazos AUGE obedece, además de la correcta aplicación de la normativa de derivación de PBM y PMM, a la implementación en la red asistencial de la interconsulta por internet (rezebra) y al permanente perfeccionamiento a los encargados de programas en APS por parte del equipo de profesionales del Hospital Dr. Luis Tisné Brousse. RECOMENDADAS Departamento de Información y Estadísticas Ministerio de Salud. Ministerio de Salud. www.minsal.cl Epidemiología Ministerio de Salud. Estudio de AVISA: Años de Vida Potenciales Perdidos (AVPP) por – – Cáncer de Mama. http://epi.minsal.cl/html/frames/ frame6.htm. 2005. Ministerio de Salud 1995, Pauta de Evaluación para la atención de la Patología Mamaria, 1994-1995, Ministerio de Salud, Santiago. Ley AUGE 19.966 .Ministerio de Salud. www.minsal/ juridico. 253 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 254-255 ARTÍCULO Programa de tratamiento integral de pacientes con cáncer de mama en Hospital Dr. Luis Tisné Brousse y Centro de Referencia de Salud Cordillera Equipo Multidisciplinario Con el fin de implementar un programa de tratamiento del paciente con cáncer de mama desde una acción clínica integral, con atención de excelencia tanto en los aspectos técnicos, interpersonales, científicos, éticos y humanos, un equipo multidisciplinario se ha reunido a trabajar. Se analizó cada una de las etapas que viven las pacientes afectadas por esta enfermedad y fue posible comprobar que durante el diagnóstico, tratamiento y seguimiento, sufren un fuerte impacto en su calidad de vida. Todo lo anterior llevó a desarrollar el “Programa de Experiencia Integral”, cuya misión y objetivos se describen a continuación y donde la premisa es que las pacientes se den cuenta que en la Unidad de Patología Mamaria del Hospital Dr. Luis Tisné Brousse “no están solas”. OBJETIVOS ESPECÍFICOS Entregar a las pacientes y sus familias información sobre aspectos del diagnóstico, procedimientos médicos, intervenciones y manejo a largo plazo, incluyendo adherencia a los medicamentos y cambios en el estilo de vida. Promover una participación activa de la paciente y su familia, centrada en sus capacidades físicas, cognitivas, emocionales y sociales que orientan el curso y desarrollo del tratamiento. Integrar la actividad física, cuidados del brazo, y cicatriz después del tratamiento. Prevenir complicaciones posteriores como el linfedema. Desarrollar habilidades de afrontamiento para restablecer la estabilidad emocional, combatiendo sentimientos de ansiedad, miedo, fracaso, amenaza, pérdida y fragmentación de la imagen corporal. MISIÓN Brindar un cuidado integral en pacientes con cáncer de mama con el propósito de reducir el impacto en la calidad de vida (físico, psicológico y social), alcanzando una mejoría en el funcionamiento global de la paciente. OBJETIVO GENERAL Entregar cuidado integral a la paciente con cáncer de mama a través de las acciones y responsabilidades específicas de cada profesional integrante del equipo de salud. 254 ¿CÓMO SE REALIZA? La propuesta consiste en brindar una instancia de acogida y educación en momentos claves durante el proceso de la enfermedad, junto con un apoyo de rehabilitación kinésica, destinada a educar en torno a un cambio en los estilos de vida, ejercicios permitidos y prevención de enfermedades derivadas de la cirugía. En la práctica esto se traduce en lo siguiente: la paciente es derivada de atención primaria y tiene la primera consulta médica. Luego se presentan dos alternativas. PROGRAMA DE TRATAMIENTO INTEGRAL DE PACIENTES CON CÁNCER DE MAMA EN HOSPITAL DR. LUIS TISNÉ BROUSSÉ Y CENTRO DE REFERENCIA DE SALUD CORDILLERA La primera, donde la paciente es dada de alta por presentar claramente una patología benigna o se envía a realizar una biopsia percutánea (biopsia core o estereotáxica) en caso de presentar alguna lesión indeterminada o sospechosa. Si la biopsia resulta positiva para cáncer, la paciente recibe el apoyo de psicóloga hasta que es presentada a Comité Oncológico o se le realiza cirugía. La segunda, puede requerir exámenes preoperatorios y derivación a medicina física donde kinesiólogos le realizarán evaluación preoperatoria del hombro y la instruirán acerca de cuánto puede moverlo en los días posteriores a la intervención, para luego ser sometida a una cirugía que puede ser diagnóstica o de tratamiento, según la biopsia que se obtenga. Si ésta es negativa la paciente puede ser dada de alta con control en su consultorio. En caso de que la biopsia haya sido positiva comienza el proceso de apoyo, acogida y educación por parte de psicóloga y terapeuta ocupacional y se mantiene el apoyo por kinesiólogo. Luego la paciente es evaluada por el Comité de Oncología para decidir los próximos tratamientos a seguir (radioterapia, quimioterapia, Tamoxifeno, seguimiento asintomático, se- guimiento sintomático, cuidados paliativos, Zometa). Durante todo este proceso es acompañada por psicóloga. Básicamente lo que se propone es acompañar a la paciente durante todas la etapas de su enfermedad, a través del manejo por parte de la psicóloga, kinesióloga y terapeuta ocupacional, quien se encargará de realizar una acogida y en etapas posteriores, un taller para adaptar la ropa interior y ayudar con la postura de un pañuelo o turbante en caso que la paciente así lo desee. Todo este proceso se realizará en conjunto con médicos tratantes, matronas y enfermeras matronas, quienes facilitarán una comunicación constante, rápida y efectiva para hacer sentir a nuestras pacientes que: “Aquí no están solas”. El equipo multidisciplinario está constituido por: Marcela Estolaza F, Matrona Sylvia Jorquera S, Enfermera Matrona Coordinadora GES Carolina Alessandri B, Psicóloga Soledad Cornejo V, Terapeuta Ocupacional Verónica Tagle A, Kinesióloga Pamela Inda C, Enfermera Matrona 255 REV. OBSTET. GINECOL. - HOSP. SANTIAGO ORIENTE DR. LUIS TISNÉ BROUSSE. 2009; VOL 4 (3): 256 CARTA AL EDITOR Santiago, 23 de noviembre de 2009 Señor Editor Jefe Dr. Jorge Varas C. Revista de Obstetricia y Ginecología Hospital Santiago Oriente Dr. Luis Tisne B. Presente Estimado Dr. Varas: La Academia Chilena de Medicina ha estimado conveniente y oportuno hacer una declaración respecto a la Certificación de Especialistas Médicos, cuyo reglamento está siendo procesado en el Ministerio de Salud. Mucho agradeceré a usted considerar para publicación en la revista de su digna dirección el documento adjunto:” Opinión de la Academia Chilena de Medicina sobre la Certificación de Especialistas Médicos”. Saluda a usted con la mayor consideración, Dr. Alejandro Goic G. Presidente Academia Chilena de Medicina OPINIÓN DE LA ACADEMIA CHILENA DE MEDICINA SOBRE LA CERTIFICACIÓN DE ESPECIALISTAS Hace 6 años, las asociaciones médicas hicimos la declaración pública: “Una amenaza a la seriedad y prestigio de la medicina chilena”, alertando al país, gobierno y parlamentarios, sobre las disposiciones de un proyecto de ley que establecía el reconocimiento como especialistas a médicos que no tenían esa condición, por no haber cumplido los requisitos exigidos por las universidades o una certificación de la Corporación Autónoma de Certificación de Especialidades Médicas (CONACEM). No obstante, la ley fue aprobada, quedando pendiente la reglamentación complementaria. El “Reglamento de Certificación de las Especialidades y Subespecialidades de los prestadores individuales de salud y de las entidades que lo otorgan”, fue tomado de razón en octubre del año 2008, estableciendo que, hasta el año 2015, aquellos médicos que sin ser especialistas hayan ejercido como tales bajo determinadas condiciones, se les otorgará un “certificado de competencias”, lo que les habilitará para ser incorporados a la lista pública de especialistas médicos que, para conocimiento de la ciudadanía, deberá elaborar la Superintendencia de Salud. Es conveniente destacar que los programas de formación de médicos especialistas, establecidos en el país hace más de 50 años por grandes maestros de la medicina, implican un entrenamiento de 3 años de duración con dedicación completa, turnos de residencia y las correspondientes evaluaciones. En las décadas posteriores, la Academia de Medicina, la Asociación de Facultades de Medicina, las Sociedades Médicas Científicas y el Colegio Médico, impulsaron sucesivos procesos institucionalizados de certificación de la calidad de los programas y de los centros de formación de los especialistas. La reconocida idoneidad de los especialistas chilenos se explica por el rigor con que son formados y el control de calidad de los respectivos programas. Esto es un motivo de orgullo para la profesión médica y una garantía para la población. La Academia de Medicina, cuya misión es velar por el progreso y calidad de la medicina chilena, expresa su disconformidad con las disposiciones del reglamento aludido y reitera que el camino correcto para alcanzar la condición de especialista es cumplir con los programas de formación respectivos, o someterse a los exámenes de competencia que exige CONACEM. La búsqueda de caminos alternativos impropios constituye un retroceso histórico para la medicina chilena, perturba la calidad de la atención médica y confunde a la opinión pública. Santiago de Chile, noviembre de 2009 256 REVISTA DE OBSTETRICIA Y GINECOLOGÍA HOSPITAL SANTIAGO ORIENTE DR. LUIS TISNE BROUSSE INSTRUCCIONES A LOS AUTORES Los trabajos enviados a la Revista de Obstetricia y Ginecología, del Hospital Santiago Oriente Dr. Luis Tisné Brousse, deberán ajustarse a las siguientes instrucciones. 1. El trabajo debe ser escrito en papel tamaño carta, dejando un margen de al menos 3 cm. en los cuatro bordes. Todas las páginas deben ser numeradas en el ángulo superior derecho, empezando por la página del título. Debe entregarse dos ejemplares idénticos de todo el texto, acompañados por una copia idéntica para computador en CD, con espaciado a 1,5 líneas, con tamaño de letra 12 pt, tipo Times New Roman, justificada a la izquierda. Las figuras que muestren imágenes deben entregarse en copias fotográficas de excelente calidad. Al pie de la página del título, debe mostrarse un recuento computacional de palabras, contadas desde el comienzo de la Introducción hasta el término de la Discusión (se excluyen para el recuento, la página del Título, el Resumen, los Agradecimientos, las Referencias, Tablas y Figuras). Se solicita que los “Artículos de Investigación” no sobrepasen 2.500 palabras, los “Artículos de Revisión” y los “Especiales” pueden extenderse hasta 3.000 palabras. Los “Casos Clínicos” no deben exceder 1.500 palabras, pudiendo agregárseles hasta dos Tablas y Figuras y no más de 20 referencias. Las “Cartas al Editor” no deben exceder 1.000 palabras, pudiendo agregárseles hasta 6 referencias y una tabla o figura. 2. Los Artículos de Investigación deben dividirse en secciones tituladas: “Resumen”, “Introducción”, ”Material y Método”, ”Resultados” y “Discusión”. Otros tipos de artículos, tales como los “Casos Clínicos” y “Artículos de Revisión”, pueden acomodarse mejor a otros formatos pero deben ser aprobados por el Editor. 3. Artículos de Investigación. Deben ser originales e inéditos. El ordenamiento de cada trabajo será el siguiente: 3.1. Página del Título La primera página del manuscrito debe contener: 1) El título del trabajo, que debe ser conciso pero informativo sobre el contenido central de la publicación. 2) El o los autores, identificándolos con su nombre de pila, apellido paterno e inicial del materno. Al término de cada nombre debe identificarse con número en “superíndice”, el 3) Nombre de la o las Secciones, Departamentos, Servicios e Instituciones a las que perteneció dicho autor durante la ejecución del trabajo. 4) Nombre y dirección del autor con quien establecer correspondencia o solicitarle separatas. Debe incluirse su número de fax y correo electrónico. 5) Fuente de apoyo financiero si lo hubo, en forma de subsidio de investigación (grants), equipos, drogas o todos ellos. Debe aclararse toda ayuda financiera recibida, especificando si la organización que la proporcionó tuvo o no tuvo influencia en el diseño del estudio; en la recolección, análisis o interpretación de los datos; en la preparación, revisión o aprobación del manuscrito. 6) Señale con letras minúsculas en “superíndices” a los autores que no sean médicos y use dichos superíndices para identificar su título profesional o su calidad de alumno de una determinada escuela universitaria. 7) Al pie de la página del título coloque el recuento computacional de palabras. 8) Cada una de las secciones siguientes (3.2 a 3.8) debe iniciarse en nuevas páginas. 3.2 Resumen. La segunda página debe contener un resumen en español e inglés de no más de 250 palabras que describan los propósitos del estudio o investigación, el material y método empleados, los resultados principales y las conclusiones más importantes. Los autores pueden proponer 3 a 10 “palabras clave” (key words). 3.3 Introducción. Breve exposición de los objetivos de la investigación y de la literatura estrictamente atingente al estudio. Limite su extensión, en lo posible, a no más de 200 palabras. 3.4 Material y Método (o “Pacientes y Método”). Describa la selección de los pacientes, animales de experimentación o tejidos y sus respectivos controles. Señale el número de casos u observaciones, los métodos estadísticos utilizados y el nivel de significación elegido. Si el estudio se efectuó en seres humanos, explicite si la investigación fue aprobada por el Comité de Ética de la Institución. 3.5 Resultados. Presente sus resultados siguiendo una secuencia lógica y concordante, en el texto, las Tablas y las Figuras. Los datos no pueden presentarse simultáneamente en Tablas y Figuras. En el texto destaque las observaciones importantes, sin repetir todos los datos presentados en las Tablas o Figuras. No discuta los resultados en esta sección. 3.6 Discusión. Discuta los resultados obtenidos en su investigación y no una revisión del tema. No repita detalladamente datos que aparecen en “Resultados”. Explicite las concordancias o discordancias de sus resultados con otros estudios. Conecte sus conclusiones con los propósitos del estudio establecidos en la “Introducción”. Evite formular conclusiones que no estén respaldadas por sus resultados. Cuando sea apropiado proponga recomendaciones. 3.7 Agradecimientos. Exprese su agradecimiento sólo a personas que hicieron contribuciones substantivas a su trabajo. Los autores son responsables por la mención de personas e instituciones a quienes los lectores podrían atribuir un apoyo a los resultados del trabajo y sus conclusiones. 3.8 Referencias. Limite las referencias (citas bibliográficas) a las más relevantes. Numérelas en el orden según aparecen en el texto, 257 identificadas entre paréntesis por números arábigos al final de la frase o párrafo en que se las alude. Las anotaciones de cada referencia debe ser la siguiente: a) Para artículos de Revistas. Apellido e inicial del nombre del o los autores en mayúsculas. Mencione todos los autores cuando sean seis o menos; si son siete o más incluya los seis primeros y agregue “et al”. Limite la puntuación a comas que separen los autores entre sí. Sigue el título completo del artículo, en su idioma original. Luego el nombre de la revista en que apareció, abreviado según el estilo usado por el Index Medicus, año de publicación; volumen de la Revista, página inicial y final del artículo. Ejemplo: Scholl T, Hediger M, Belsky D. Prenatal care and maternal health during adolescent pregnancy:a review and meta – analysis. J Adolesc Health 1994; 15(6): 444-456. b) Para capítulos en libros. Ejemplo: 18. Croxatto H. Prostaglandinas. Funciones endocrinas del riñón. En: Pumarino H, ed. Endocrinología y Metabolismo. Santiago: Editorial Andrés Bello, 1984; 823 – 840. c) Para artículos en formato electrónico: citar autores, título del artículo y revista de origen tal como para su publicación en papel, indicando a continuación el sitio electrónico donde se obtuvo la cita y la fecha en que se hizo la consulta. Ejemplo: Rev Med Chile 2003; 131: 473–482. Disponible en www.scielo.cl (Consultado el 14 de julio de 2003). Los autores son responsables de la exactitud de sus referencias. 3.9 Tablas, Figuras e Ilustraciones. Deben ser originales y venir en hojas separadas. Presente cada tabla, separando sus celdas con doble espacio (1,5 líneas). Numérelas en orden consecutivo y asígneles un título que explique su contenido sin necesidad de buscarlo en el texto del manuscrito (Título de la Tabla). Sobre cada columna coloque un encabezamiento corto o abreviado. Separe con líneas horizontales solamente los encabezamientos de las columnas y los títulos generales. Las columnas de datos deben separarse por espacios y no por líneas verticales. Cuando se requieran notas aclaratorias, agréguelas al pie de la tabla. Use notas aclaratorias para todas las abreviaturas no estándar. Cite cada Tabla en su orden consecutivo de mención en el texto del trabajo. Denomine “Figura” a cualquier ilustración que no sea Tabla (Ejemplos: gráficos, ecografías, radiografías, electrocardiogramas, etc.). Las Figuras deben tener un título que exprese claramente el contenido. Las fotografías de pacientes deben cubrir parte(s) de su rostro para proteger su anonimato. Es deber del médico garantizar que los pacientes a que se haga referencia en publicaciones científicas, reuniones clínicas y presentaciones públicas permanezcan en el anonimato. Con todo si fuera imprescindible revelar la identidad de algún paciente, el facultativo deberá contar siempre con el consentimiento escrito de aquél. (Artículo 34, Código de Ética, Colegio Médico de Chile A. G. ) Las drogas deben designarse por su nombre genérico y no por su nombre comercial. La publicación de Figuras en colores debe ser consultada con el Editor. 3.10 Unidades de medida. Use unidades correspondientes al sistema métrico decimal. Las abreviaturas o símbolos que se emplean con mayor frecuencia, aparecen listadas en la Revista. 258 3.11 Las ideas, opiniones o conclusiones expresadas en los artículos son de la exclusiva responsabilidad de los autores. 3.12 El Comité Editorial de la Revista de Obstetricia y Ginecología del Hospital Santiago Oriente Dr. Luis Tisné Brousse, se reserva el derecho de no publicar aquellos trabajos que no cumplan con los requisitos antes señalados. 4. Toda correspondencia debe ser enviada al Editor Jefe, Dr. Jorge Varas C., a las siguientes direcciones: Revista de Obstetricia y Ginecología del Hospital Santiago Oriente Dr. Luis Tisné Brousse. Avenida Las Torres 5150, Peñalolén, Santiago. Teléfono 4725293. E mail: drjorgevaras@gmail.com Advertencia: El Director, Editor Jefe y Comité Editorial de la Revista de Obstetricia y Ginecología del Hospital Santiago Oriente Dr. Luis Tisné Brousse, no asumen ninguna responsabilidad por injurias o daños a personas o propiedades (bienes), que pudieran derivar del uso de productos, métodos, procedimientos, instrucciones o ideas contenidas en el material presentado. Debido al rápido avance de la ciencia médica, se debe, en particular, realizar siempre una verificación independiente de los diagnósticos y dosis de fármacos. ABREVIATURAS PARA UNIDADES DE MEDIDA La siguiente lista indica las abreviaturas o símbolos de uso internacional que representan a las unidades de medida empleadas con mayor frecuencia en los trabajos publicados por la Revista. Los autores deben utilizar estas abreviaturas o símbolos en el texto, Tablas y Figuras de los trabajos que envían a la Revista de Obstetricia y Ginecología del Hospital Santiago Oriente Dr. Luis Tisné Brousse para su publicación. TERMINOLOGIA ABREVIATURA O SÍMBOLO CORRECTO cuentas por minuto cuentas por segundo curie Equivalente Gramo Hora unidad internacional kilogramo litro metro minuto segundo kilo-(prefijo) deci-(prefijo) centi-(prefijo) mili-(prefijo) no significativo número de observaciones probabilidad (estadístico) cpm cps Ci Eq g h IU kg l m min s k d c m NS n P Nótese que a ninguna abreviatura o símbolo se le agrega “s” para indicar plural. Una lista más completa de abreviaturas o símbolos de uso común en biología y medicina aparece publicada en Annals of Internal Medicine 90: 98 – 99, 1979.